Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.27 no.2 Chapingo may./ago. 2021 Epub 26-Ene-2024
https://doi.org/10.5154/r.rchscfa.2020.06.045
Artículo científico
Producción, dispersión y banco de semillas en Lupinus montanus Kunth en el límite superior de su distribución altitudinal en el Nevado de Toluca
1 Colegio de Postgraduados, Postgrado en Ciencias Forestales. Carretera México-Texcoco km 36.5, Montecillo. C. P. 56230. Texcoco, Estado de México, México.
2 Universidad Autónoma del Estado de México, Instituto de Ciencias Agropecuarias y Rurales. El Cerrillo, Piedras Blancas. C. P. 50200. Toluca, Estado de México, México.
3 Colegio de Postgraduados, Postgrado en Botánica. Carretera México-Texcoco km 36.5, Montecillo. C. P. 56230. Texcoco, Estado de México, México.
Introducción:
Ante el cambio climático, las plantas pueden adaptarse, emigrar o morir; sin embargo, la migración por dispersión natural puede ser muy lenta.
Objetivo:
Determinar el potencial productivo, la distancia de dispersión y el banco de semillas de Lupinus montanus Kunth (lupino) en el límite superior (4 200 m) de su distribución natural en el Nevado de Toluca.
Materiales y métodos:
El banco de semillas se estimó en una superficie de 1.88 m2. Se establecieron tres sitios de muestreo con plantas en estado reproductivo (15 plantas) aisladas de otras plantas adultas. La producción de semillas se determinó en trampas colocadas en las cuatro orientaciones de cada planta y se determinó el patrón espacial de dispersión.
Resultados y discusión:
La densidad fue 4.26 semillas∙m2 de terreno. Lupinus montanus produjo más de 5 500 semillas por planta en un ciclo reproductivo; su potencial se asoció con la altura y número de tallos. El número de semillas capturadas varió significativamente (P < 0.0001) con respecto a la distancia de la planta madre. La curva de dispersión se ajustó (P < 0.01) a un modelo exponencial negativo (R2 = 0.849). La dispersión en las cuatro orientaciones fue simétrica; 97 % de las semillas cae a una distancia ≤2 m de la planta madre.
Conclusiones:
Solo 3.2 % de las semillas de L. montanus alcanzaron una distancia mayor de 2 m de la planta madre; no obstante, la dispersión es uniforme en todas las orientaciones, por lo que la pendiente no representa un factor limitante para el movimiento altitudinal de la especie.
Palabras clave: Fabaceae; lupino; migración altitudinal; zona alpina; pendiente
Introduction:
In response to climate change, plants can adapt, migrate or die; however, migration by natural dispersion of seed can be very slow.
Objective:
To determine productive potential, dispersal distance and seed bank of Lupinus montanus Kunth (lupine) at the upper limit (4 200 m) of its natural distribution at the Nevado de Toluca mountain.
Materials and methods:
The seed bank was estimated in an area of 1.88 m2. Three sampling sites were established with plants in reproductive stage (15 plants) isolated from other adult plants. Seed production was determined in traps placed at the four orientations of each plant and spatial pattern of dispersal was also determined.
Results and discussion:
Seedbank density was 4.26 seeds∙m-2 of soil. Lupinus montanus produced over 5 500 seeds per plant in one reproductive cycle; its seed potential was associated with plant height and number of stems. The number of seeds collected varied significantly (P < 0.0001) with respect to distance from the mother plant. The dispersion curve was adjusted (P < 0.01) to a negative exponential model (R2 = 0.849). Dispersal in the four orientations was symmetrical; 97 % of the seeds fell at a distance ≤2 m from the mother plant.
Conclusions:
Only 3.2 % of the seeds of L. montanus reached a distance greater than 2 m from the mother plant; however, dispersal is uniform in all orientations, therefore soil slope does not represent a limiting factor for the altitudinal migration of species.
Keywords: Fabaceae; lupine; altitudinal migration; alpine zone; soil slope
Ideas destacadas:
Lupinus montanus produjo más de 5 500 semillas por planta en un ciclo reproductivo.
La capacidad de producción de semillas se asoció en forma positiva con el tamaño de la planta.
La curva de dispersión de semillas se ajustó a un modelo exponencial negativo.
La dirección de la pendiente no influyó en la distancia de dispersión de las semillas.
La mayoría (97 %) de las semillas dispersadas cayó a una distancia ≤2 m de la planta madre.
Introducción
La dispersión se define como el movimiento de un organismo desde su sitio de origen hasta el lugar donde se establece (van Den et al., 2016). A diferencia de los organismos móviles, la dispersión en las plantas ocurre cuando una semilla, espora o propágulo vegetativo se desprende de su planta materna (van Den, La Rue, & Emery, 2016). Este proceso une el ciclo reproductivo de las plantas con el establecimiento de su progenie (Wang & Smith, 2002). El desplazamiento espacial de las semillas tiene la finalidad de incrementar la probabilidad de establecimiento y colonización de las especies (Tercero-Burcado & Rovere, 2010).
Las características del proceso de dispersión de semillas tienen consecuencias importantes para la evolución de los nichos ecológicos que determinan dónde puede persistir una especie (van Den et al., 2016). La dispersión facilita el escape de las semillas a los depredadores (Perea, 2012) y disminuye la competencia en áreas cercanas a la planta madre (van Den et al., 2016). Una especie con distancia de dispersión corta o pocos propágulos dispersantes puede no colonizar hábitats adecuados más allá de sus límites de distribución actual, mientras que la dispersión generalizada puede aumentar las posibilidades de colonización de hábitats que en primera instancia parecen inadecuados (van Den et al., 2016).
La distribución de las especies vegetales, especialmente en ambientes de montaña, se ha ido modificando por el cambio climático y esto ha provocado que muchas de ellas se desfasen o no tengan posibilidad de adaptación por su marcado arraigo local (Jump & Peñuelas, 2005). Ante el cambio climático, las plantas tienen las opciones de adaptarse, emigrar o morir (Aitken, Yeaman, Holliday, Wang, & Curtis-McLane, 2008). Las posibilidades de adaptación dependen del nivel de variación genética y de la plasticidad fenotípica de las poblaciones para ajustar sus procesos a las nuevas condiciones (Soto-Correa, Lindig-Cisneros, & Sáenz-Romero 2014; Tognetti, Mazia, & Ibañez, 2019). Por otro lado, la capacidad natural de migración de las plantas a través de la dispersión y su establecimiento en nuevos hábitats puede ser extremadamente lenta para la mayoría de las especies (Pearson, 2006; Soto-Correa et al., 2014).
En los ecosistemas de alta montaña, la principal opción de movimiento de las plantas es hacia sitios de mayor elevación, donde se espera que ocurran las condiciones de temperatura a las que están adaptadas (Byars, Papst, & Hoffmann, 2007); sin embargo, la tasa de movimiento altitudinal debe ser relativamente rápida, antes de que ocurran cambios fenológicos que limiten su capacidad reproductiva o que sean invadidas y desplazadas por especies de sitios más bajos (Peñuelas, Filella, & Comas, 2002). El cambio climático representa desafíos importantes para los manejadores forestales y ecólogos en cuanto a la práctica de actividades eficaces de manejo, ya sea para fines comerciales o de conservación (Sáenz-Romero et al., 2016).
Lupinus montanus Kunth es una especie de la familia Fabaceae con amplia distribución natural en las montañas de México (Dunn, 2001). La mayoría de las poblaciones naturales de esta planta se encuentran en el Cinturón Volcánico Transmexicano, en altitudes que van de 2 500 a 4 100 m, asociadas a bosques de pino (Pinus hartwegii Lindl.), encino (Quercus spp.), oyamel (Abies religiosa [Kunt.] Schltdl. & Cham.) y a las praderas alpinas y subalpinas (Acosta-Percástegui & Rodríguez-Trejo, 2005), por lo que representa un modelo biológico importante, para evaluar la capacidad de migración altitudinal en estas condiciones. Al igual que otras especies del mismo género, L. montanus presenta un mecanismo especial de dispersión de semillas (Abraham de Noir, Bravo, & Abdala, 2002). Los frutos en forma de vaina explotan y lanzan las semillas al aire en varias direcciones (Ruiz, Gómez, & Lindig, 2010); es decir, tienen una dispersión balística. Las semillas dispersadas pueden germinar inmediatamente o permanecer en el suelo formando un banco de semillas ecológico y evolutivamente importante en la dinámica poblacional de muchas especies (Ooi, 2012). Las semillas pequeñas (i. e., <5 mm), como en el caso de L. montanus, se entierran con facilidad y parece que corren menos riesgos, aunque también pueden ser presas de lombrices, hormigas y otra fauna del suelo (Thompson & Fenner, 1992). No obstante, ante el escenario del cambio climático, no existe información suficiente sobre la capacidad de dispersión de Lupinus ni de la presencia de un banco natural de semillas que permita visualizar la permanencia a largo plazo o bien su posible movimiento hacia otros espacios dentro de su condición alpina.
Este trabajo tuvo como objetivo determinar el banco de semillas de L. montanus, como resultado de su dispersión en ciclos reproductivos de años anteriores; la relación del tamaño de las plantas con el potencial de producción de semillas; y la distancia de dispersión de las semillas en el límite altitudinal superior de la distribución natural en el Nevado de Toluca. Lo anterior con el propósito de establecer el patrón espacial de dispersión y potencial de migración altitudinal de L. montanus.
Materiales y métodos
Área de estudio
El estudio se realizó en el Área de Protección de Flora y Fauna Nevado de Toluca (APFF Nevado de Toluca) que incluye el volcán del mismo nombre (Figura 1). El Nevado de Toluca ocupa el cuarto lugar entre las cumbres más altas de México, con una elevación de 4 660 m y una superficie de 53 590 ha; se localiza en la porción centro-sur del Estado de México, 23 km al suroeste de la ciudad de Toluca (SEMARNAT, 2016). El tipo de suelo predominante es el Andosol, que ocupa 90 % del Área Natural Protegida (INEGI, 2000). El clima es frío E(T)H wig y semifrío-subhúmedo C(E)wig según la clasificación de Köppen modificada por García (1973). El régimen de lluvias es de verano, aunque puede haber nevadas en invierno. La temperatura media mensual fluctúa entre 2 °C y 5 °C, mientras que la temperatura máxima extrema se eleva a 21 °C en el verano y la mínima extrema corresponde a ‑10 °C en invierno (SEMARNAT, 2016).
Determinación del banco de semillas
La determinación se realizó en el mes de agosto del 2017, previo al ciclo de dispersión de ese año, con el propósito de hacer un conteo de semillas y considerarlas como un banco o reservorio de la especie. Se seleccionaron tres sitios de muestreo y en cada sitio se delimitaron cuatro polígonos de 25 m2 (5 m x 5 m) o subpoblaciones (manchones con un mínimo de 10 plantas adultas) localizadas en el límite altitudinal superior de distribución de la especie (4 200 m), separadas entre sí por al menos 100 m (Figura 1). Los polígonos se dividieron en 25 cuadros de 1 m2 y de ellos se seleccionaron cinco al azar. En el centro de cada unidad se tomó una muestra de suelo con un cilindro de PVC de 20 cm de diámetro (314.16 cm2) y 5 cm de profundidad. Se recolectaron 60 muestras de suelo en total (1.88 m2) y se colocaron en bolsas de plástico. Las muestras se secaron a temperatura ambiente en un invernadero y se tamizaron con una malla de tamaño de poro de 1 mm2 para la separación y conteo del número de semillas de L. montanus.
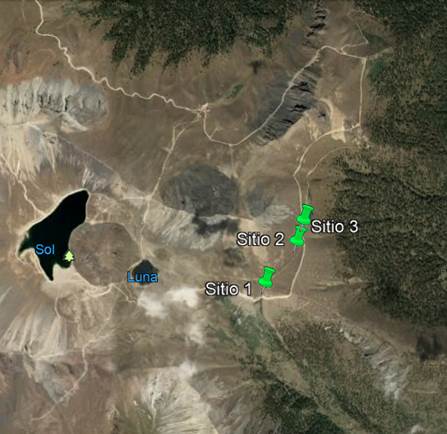
Figura 1 Localización geográfica de los sitios de estudio (sitio 1: 19° 06.33’ N - 99° 44.64’ O; sitio 2: 19° 06.60’ N - 99° 44.44’ O; sitio 3: 19° 06.83’ N - 99° 44.47’ O) en el límite altitudinal superior de Lupinus montanus (4 200 m) en el Área de Protección de Flora y Fauna Nevado de Toluca, Estado de México, México.
Evaluación de la dispersión de la semilla
En el mes de octubre de 2017 se seleccionaron tres subpoblaciones (manchones de L. montanus) en el límite altitudinal superior de su distribución, cercano a los 4 200 m. En cada subpoblación se localizaron cinco plantas en estado reproductivo (15 plantas en total), aisladas de otras plantas adultas. Se muestreó este número de plantas debido a que no fue posible encontrar un número mayor de ellas aisladas de la población. En cada uno de los individuos se colocaron trampas (coladeras de plástico) de 12 cm de diámetro (113.09 cm2) y 5 cm de alto, las cuales tuvieron una malla de plástico en el interior, para evitar el rebote de las semillas al momento de caer. Las trampas se colocaron en forma de cruz con la planta en el centro; a partir de esta, se trazaron líneas que tuvieron una distancia de 2 m en dirección paralela y perpendicular a la pendiente del terreno. En la dirección perpendicular, las trampas se colocaron cada 50 cm a partir del centro, y en la dirección paralela, se colocaron cada 25 cm; el interés principal fue detectar, con mayor precisión, la capacidad de dispersión a favor y en contra de la pendiente del terreno. En total se colocaron 24 trampas de captura de semillas alrededor de cada planta.
En cada lupino se contó el número de vainas y tallos, y se midió la altura de los tres tallos centrales más altos. Posteriormente, para estimar el potencial de producción, el número de semillas llenas (con embrión) por vaina se determinó en una muestra de 50 vainas tomadas al azar de 10 plantas cercanas. Durante el periodo de octubre 2017 a enero 2018, el número de semillas capturadas en las trampas se contó cada semana y se obtuvo el total de semillas capturadas en cada una de ellas.
Análisis estadístico
Con los datos del banco de semillas se estimó la cantidad de semillas por m2 de terreno. El potencial de producción de semillas por planta se estimó con el promedio de vainas y de semillas por vaina. La relación entre el potencial de producción de semillas y el tamaño de la planta (altura y número de tallos) se estableció mediante la correlación de Pearson. También se realizó un análisis de varianza de una vía (P = 0.05) para evaluar las diferencias en estas características de las plantas, entre las subpoblaciones.
La prueba de Kruskal-Wallis se utilizó para determinar las posibles diferencias en el número de semillas capturadas entre distancias, para cada una de las orientaciones en que se colocaron las trampas y en el promedio de todas ellas. Previo a las comparaciones entre distancias, los datos del número de semillas se transformaron con la función de raíz cuadrada.
Adicionalmente, con los datos del número de semillas capturadas por trampa se ajustó la curva de dispersión con respecto a la distancia de la planta madre, mediante el procedimiento Model de SAS versión 9.3 (Statistical Analysis System, 2013), utilizando un modelo exponencial negativo (Bustamante, 1996) de la forma:
donde,
Y j = número de semillas capturadas en la j-ésima trampa
X j = distancia (cm) de la j-ésima trampa a la planta madre
a y b = coeficientes del modelo de regresión a estimar.
El posible efecto de la orientación (a favor vs. en contra de la pendiente o en dirección paralela vs. perpendicular a la pendiente) sobre la curva de dispersión de las semillas se determinó con base en el modelo anterior, del cual se derivó la ecuación Y ij = (a + a oi )*exp [(b + boi)Xij] , donde oi es la variable indicadora de la i-ésima orientación de dispersión de la semilla.
Resultados y discusión
Banco de semillas en el suelo
En la superficie muestreada (1.88 m2) se encontró un total de ocho semillas de L. montanus, lo que representa una densidad de 4.26 semillas∙m2 de terreno. Todas las semillas fueron viables, pues se obtuvo 100 % de germinación. Al parecer, una cantidad importante queda almacenada en el suelo por algún tiempo para formar un banco de semillas persistente que puede ser a corto o largo plazo, en función de las condiciones climáticas del sitio y los mecanismos adaptativos de las semillas (Marañón, 2001). Las semillas de los lupinos poseen latencia física y la germinación inicia hasta que se presentan condiciones favorables, a través de algún mecanismo o estímulo (Pablo-Pérez, Lagunes-Espinoza, López-Upton, Ramos-Juárez, & Aranda-Ibáñez, 2013).
Los factores principales que afectan la persistencia de semillas en el suelo son la depredación y el ataque de patógenos (De Souza-Maia, Maia, & Pérez, 2006); sin embargo, en las zonas árticas y alpinas, la incidencia de estos factores es menor, lo cual favorece el mantenimiento de semillas viables en el suelo (McGraw & Vavrek, 1989). A pesar de que las semillas de L. montanus pueden ser consumidas por insectos, aves y roedores, los dos últimos grupos de animales también pueden ayudar en la dispersión, como se ha demostrado en otras especies, incluidas las fabáceas (Amico & Aizen, 2005; Pérez-Cadavid, Rojas-Soto, & Bonilla-Moheno, 2018); este proceso puede ampliar su movimiento altitudinal. El estudio de la dinámica de las semillas en el suelo es útil para comprender los procesos ecológicos involucrados en el movimiento de las poblaciones (Pérez & Santiago, 2001).
Capacidad de producción de semillas
Una planta de L. montanus tiene el potencial de producir más de 5 500 semillas por ciclo reproductivo, con un promedio de 637 vainas por planta (Cuadro 1) y nueve semillas llenas por vaina. No se encontraron diferencias significativas (P = 0.43) entre las subpoblaciones muestreadas en su capacidad productiva. En cambio, se encontraron diferencias significativas con respecto al número de tallos (P = 0.045) y su altura (P = 0.0004); además, el número de vainas se correlacionó positivamente con el número (r = 0.8602, P < 0.0001) y altura (r = 0.9539, P < 0.0001) de los tallos. En otras palabras, el potencial de producción de semillas está fuertemente relacionado con el tamaño de las plantas, medido en términos de la altura o el número de tallos. Al parecer, la estrategia reproductiva de la especie es producir la mayor cantidad posible de tallos con la mayor longitud posible para que en cada uno se produzca una inflorescencia que maximice la producción de semillas. Esta es una característica general de las Fabaceae, donde la producción de rebrotes o tallos que generen estructuras reproductivas favorece la permanencia de los individuos adultos (Barchuk, Campos, Oviedo, & Díaz, 2006).
Cuadro 1 Cantidad de vainas y potencial de producción de semillas (± error estándar) por planta (15 plantas en total) en tres subpoblaciones de Lupinus montanus en el Nevado de Toluca.
| Subpoblación | Vainas por planta | Potencial de semillas | |||
|---|---|---|---|---|---|
| Media | Valores extremos | Media | Valores extremos | ||
| 1 | 694.0 ± 50.8 | 433-1 016 | 6 246 ± 56.8 | 3 897-9 144 | |
| 2 | 595.2 ± 34.4 | 345-794 | 5 357 ± 309.5 | 3 105-7 176 | |
| 3 | 623.2 ± 12.9 | 521-699 | 5 608 ± 116.4 | 4 689-6 291 | |
El análisis de varianza no indicó diferencias significativas (P = 0.43) entre las subpoblaciones muestreadas.
Los datos muestran que esta especie tiene potencial elevado de producción de semillas por planta y que se mantienen a escasa profundidad del suelo como es característico de las fabáceas (O´Connor & Pickett, 1992); sin embargo, además del consumo de semillas por la fauna y el ataque de patógenos, el establecimiento de plántulas es un proceso difícil y hasta poco común en ambientes de alta montaña (Cabrera, 2002). Por lo anterior, la producción alta de semillas puede compensar la mortandad elevada de las plántulas, producto de factores ambientales adversos como temperaturas congelantes, inestabilidad del suelo y escasez de nutrimentos (Escudero et al., 2012).
Capacidad de dispersión de la semilla
El número de semillas capturadas varió significativamente (P < 0.0001) en las trampas entre todas las distancias de 25 cm a 100 cm. La Figura 1 muestra que la curva promedio de dispersión de las semillas con respecto a la distancia se ajustó de manera significativa (P < 0.01) a un modelo exponencial negativo con R2 = 0.849. De acuerdo con este modelo, 90 % de las semillas dispersadas por una planta cae dentro del primer metro de distancia y menos de 3.2 % se dispersa de manera natural a 2 m o más de la planta madre.
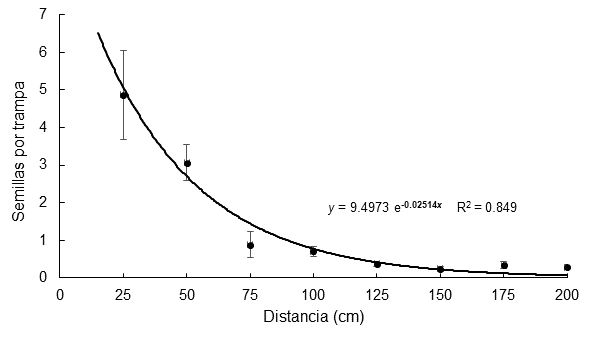
Figura 2 Patrón espacial de dispersión de semillas de Lupinus montanus (15 plantas en total) en promedio de las cuatro orientaciones de las trampas. La línea indica la distribución a la que se ajustaron los datos. Las diferencias fueron significativas (Kruskal-Wallis; P < 0.0001) entre todas las distancias de 25 cm a 100 cm.
Estos resultados de dispersión concuerdan con los datos presentados por Ruiz et al. (2010) para Lupinus elegans Kunth, pues también encontraron que la mayor cantidad de semillas se concentró cerca de la planta madre, con una distancia de dispersión limitada (i. e., <1 m). En ese estudio se capturaron más semillas en las trampas colocadas pendiente abajo de las plantas, por lo que el ascenso hacia partes más elevadas fue limitado. No obstante, el movimiento geográfico de las semillas depende no solo de la dispersión de la planta madre; factores como la velocidad y dirección del viento, ingestión y transporte por fauna o eventos de lluvia pueden ocasionar el desplazamiento de semillas a mayor distancia, en sitios alejados de la planta madre (García, 1991), lo cual puede favorecer el movimiento de la especie hacia sitios de mayor elevación.
En el presente estudio no se encontró un efecto significativo (P > 0.05) de la orientación (paralelo o perpendicular) al ajustar el modelo exponencial con variables indicadoras (oi). De acuerdo con el Cuadro 2, los parámetros estimados para la variable indicadora al comparar la orientación a favor vs. en contra de la pendiente o la dirección paralela vs. perpendicular a la pendiente, no fueron significativos. La Figura 2 muestra que las curvas ajustadas de dispersión de las semillas son similares en ambos casos.
Cuadro 2 Valor de significancia (P) de los parámetros estimados en el modelo exponencial negativo ajustado a la curva de dispersión de las semillas de Lupinus montanus (15 plantas en total) en varias direcciones con respecto a la pendiente del terreno en el Nevado de Toluca.
| Parámetro | Significado | Valor estimado | Error estándar | P |
|---|---|---|---|---|
| A favor vs. en contra de la pendiente | ||||
| a | Modelo base (contra la pendiente) | 17.3063 | 6.4033 | 0.0130 |
| b | Modelo base (contra la pendiente) | -0.0487 | 0.0129 | 0.0011 |
| ao1 | Efecto a favor de la pendiente | -8.8809 | 7.3411 | 0.2328 |
| bo1 | Efecto a favor de la pendiente | 0.0249 | 0.0154 | 0.1117 |
| Paralelo vs. perpendicular a la pendiente | ||||
| a | Modelo base (paralelo a la pendiente) | 10.8482 | 2.0550 | <0.0001 |
| b | Modelo base (paralelo a la pendiente) | -0.0332 | 0.0055 | <0.0001 |
| ao1 | Efecto perpendicular a la pendiente | 5.9361 | 7.6688 | 0.4416 |
| bo1 | Efecto perpendicular a la pendiente | 0.0035 | 0.0098 | 0.7205 |
La semilla de L. montanus se dispersó de manera simétrica en las cuatro orientaciones. La pendiente del terreno (alrededor de 30 %) no favoreció alguna orientación en particular, a favor o en contra de la pendiente. La mayoría de las especies de Lupinus tienen un mecanismo de dispersión balística (autocoria): las vainas se secan y se abren de forma explosiva, expulsando las semillas como máximo a unos pocos metros de separación de las plantas madre (Nevado, Contreras-Ortiz, Hughes, & Filatov, 2018). Lupinus texensis Hook lanza sus semillas de 0 a 4 m (Turner, Huang, Cronk, & Rieseberg, 2017).

Figura 3 Patrón espacial de dispersión de semillas de Lupinus montanus en el Nevado de Toluca: a) a favor y en contra de la pendiente; b) en dirección paralela y perpendicular a la pendiente (15 plantas en total). Las líneas muestran las curvas ajustadas a cada serie de datos. No se encontró un efecto significativo (P > 0.05) de la orientación de acuerdo al modelo de regresión ajustado para la estimación de los parámetros.
La dispersión de semillas es la fase demográfica más importante para el movimiento de las plantas en el espacio; el establecimiento o supervivencia dependerá de los mecanismos de adaptación, resistencia y establecimiento (Ooi, 2012). En este estudio se muestra que, en cada ciclo reproductivo, L. montanus libera una gran cantidad de semillas que no alcanza una distancia lejana. Esta cercanía a la planta madre también tiene consecuencias genéticas, ya que el establecimiento local de propágulos resulta en un agrupamiento de individuos genéticamente emparentados (Rovere & Premoli, 2005); sin embargo, si estos manchones persisten, se reproducen y liberan semillas, lo cual podría representar una oportunidad de avance para la especie hacia otros lugares y modificar la dinámica poblacional y comunitaria de las plantas (Wang & Smith, 2002). Con el incremento en temperatura asociado al cambio climático, el proceso de migración de especies puede provocar desplazamientos y una nueva distribución de ellas (Aitken et al., 2008). La evaluación de la dinámica de dispersión de las semillas y sus efectos demográficos en especies como los lupinos contribuye al entendimiento de los posibles impactos derivados del cambio climático en zonas de alta montaña.
El estudio de la dispersión de semillas contribuye al conocimiento de la colonización de nuevas áreas. Es importante continuar con la observación a largo plazo de la dispersión de semillas de L. montanus pues la oscilación en el tiempo también marca una dinámica particular con respecto al ascenso o retroceso de esta especie en la zona alpina. El muestreo se hizo hasta 2 m de distancia, por lo que en estudios posteriores podría determinarse el alcance de dispersión ampliando la distancia de las trampas. De acuerdo con su distancia de dispersión, existe la posibilidad de aumentar la colonización de sitios a mayor elevación; sin embargo, el cambio climático que ocurre en un lapso corto podría ser un factor determinante en el establecimiento de las poblaciones en esos sitios.
Conclusiones
Lupinus montanus produce y dispersa gran cantidad de semillas, pero la mayoría se queda cerca de la planta madre (≤2 m), lo cual limita la velocidad de expansión hacia otras áreas. No obstante, la distribución uniforme en todas las orientaciones podría ser una ventaja constante pues la pendiente del terreno no representa un factor limitante para el movimiento altitudinal de la especie. La alta capacidad reproductiva de la especie, asociada en forma positiva a la altura y el número de tallos, permite que, de no ser depredadas, las semillas se incorporen al banco en el suelo en espera de condiciones que permitan su germinación o que aprovechen la ingesta por animales para moverse hacia otras zonas y establecerse.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca de apoyo económico otorgada a Diana Córdoba-Rodríguez durante su programa de Doctorado en Ciencias en el Colegio de Postgraduados. A CEPANAF y a CONANP por permitir el acceso al APFF Nevado de Toluca para la realización del estudio.
REFERENCIAS
Abraham de Noir, F., Bravo, S., & Abdala, R. (2002). Mecanismos de dispersión de algunas especies de leñosas nativas del Chaco Occidental y Serrano. Quebracho, 9, 140‒150. Retrieved from https://www.researchgate.net/publication/237035441_Mecanismos_de_dispersion_de_algunas_especies_de_lenosas_nativas_del_Chaco_Occidental_y_Serrano [ Links ]
Acosta-Percástegui, J., & Rodríguez-Trejo, D. (2005). Factors affecting germination and pregerminative treatments of Lupinus montanus seeds. Interciencia, 30(9), 576‒579. Retrieved from https://www.redalyc.org/articulo.oa?id=339/33910811 [ Links ]
Aitken, S. N., Yeaman, S., Holliday, J. A., Wang, T., & Curtis-McLane, S. (2008). Adaptation, migration or extirpation: climate change outcomes for tree populations. Evolutionary Applications, 1(1), 95‒111. doi: 10.1111/j.1752-4571.2007.00013.x [ Links ]
Amico, G. C., & Aizen, M. A. (2005). Dispersión de semillas por aves en un bosque templado de Sudamérica austral: ¿Quién dispersa a quién? Ecología Austral, 15, 89‒100. Retrieved from https://bibliotecadigital.exactas.uba.ar/download/ecologiaaustral/ecologiaaustral_v015_n01_p089.pdf [ Links ]
Barchuk, A. H., Campos, E. B., Oviedo, C., & Díaz, M. P. (2006). Supervivencia y crecimiento de plántulas de especies leñosas del Chaco Árido sometidas a remoción de la biomasa aérea. Ecología Austral, 16(1), 47‒61. Retrieved from https://www.researchgate.net/publication/262465213_Supervivencia_y_crecimiento_de_plantulas_de_especies_lenosas_del_Chaco_Arido_sometidas_a_remocion_de_la_biomasa_aerea [ Links ]
Bustamante, R. O. (1996). Depredación de semillas en bosques templados de Chile. En J. J. Armesto, C. Villagrán, & M. T. Arroyo (Eds.), Ecología de los bosques nativos de Chile (pp. 265‒278). Santiago de Chile, Chile: Editorial Universitaria. [ Links ]
Byars, S. G., Papst, W., & Hoffmann, A. A. (2007). Local adaptations and cogradient selection in the alpine plant, Poa hiemata, along a narrow altitudinal gradient. Evolution, 61(12), 2925‒2941. doi: 10.1111/j.1558-5646.2007.00248.x [ Links ]
Cabrera, H. M. (2002). Respuestas ecofisiológicas de plantas en ecosistemas de zonas con clima mediterráneo y ambientes de alta montaña. Revista Chilena de Historia Natural, 75(3), 625‒637. doi: 10.4067/S0716-078X2002000300013 [ Links ]
De Souza-Maia, M., Maia, F. C., & Pérez, M. A. (2006). Soil seed banks. Agriscientia, 23(1), 33‒44. doi: 10.31047/1668.298x.v23.n1.2689 [ Links ]
Dunn, D. B. (2001). Lupinus. En G. Calderón, & J. Rzedowski (Eds.), Flora fanerogámica del Valle de México (2.ª ed., pp. 326‒333). Pátzcuaro, México: Instituto de Ecología. [ Links ]
Escudero, A., García-Camacho, R., García-Fernández, A., Gavilán R. G., Giménez-Benavides L., Iriondo, J., …Pescador, D. S. (2012). Vulnerabilidad al cambio global en la alta montaña mediterránea. Ecosistemas, 21(3), 1‒10 doi: 10.7818/ECOS.2012.21-3.08 [ Links ]
García, A. (1991). La dispersión de las semillas. Ciencias, 24, 3‒6. Retrieved from https://www.revistacienciasunam.com/es/172-revistas/revista-ciencias-24/1569-la-dispersi%C3%B3n-de-las-semillas.html [ Links ]
García, E. (1973). Modificaciones al sistema de clasificación de Köppen. México: Instituto de Geofísica, Universidad Nacional Autónoma de México. [ Links ]
Instituto Nacional de Estadística y Geografía (INEGI). (2000). Cartografía edafológica temática, escala 1:250,000. México: Author. [ Links ]
Jump, S. A., & Peñuelas, J. (2005). Running to stand still: adaptation and the responses of plants to rapid climate change. Ecology Letters, 8(9), 1010‒1020. doi: 10.1111/j.1461-0248.2005.00796.x [ Links ]
Marañón, T. (2001). Ecología de banco de semillas y dinámica de comunidades mediterráneas. En R. R. Zamora, & F. I. Pugnaire de Iraola (Eds.), Ecosistemas mediterráneos. Análisis funcional (pp. 153‒181). España: CSIC/AEET. [ Links ]
McGraw, J. B., & Vavrek, M. C. (1989). The role of buried viable seeds in arctic and alpine plant communities. In M. A. Leck, V. T. Parker, & R. L. Simpson (Eds.), Ecology of soils seed banks (pp. 91‒105). San Diego, USA: Academic Press. [ Links ]
Nevado, B., Contreras-Ortiz, N., Hughes, C., & Filatov, A. D. (2018). Pleistocene glacial cycles drive isolation, gene flow and speciation in the high-elevation Andes. New Phytologist, 219(2), 779‒793. doi: 10.1111/nph.15243 [ Links ]
O’Connor, T. G. O., & Pickett, G. A. (1992). The influence of grazing on seed production and seed banks of some African savanna grasslands. Journal of Applied Ecology, 29(1), 247-260. doi: 10.2307/2404367 [ Links ]
Ooi, M. K. J. (2012). Seed bank persistence and climate change. Seed Science Research, 22(S1), S53‒S60. doi: 10.1017/S0960258511000407 [ Links ]
Pablo-Pérez, M., Lagunes-Espinoza, L. C., López-Upton, J., Ramos-Juárez, J., & Aranda-Ibáñez, E. M. (2013). Morfometría, germinación y composición mineral de semillas de Lupinus silvestres. Bioagro, 25(2), 101‒108. Retrieved from http://ve.scielo.org/pdf/ba/v25n2/art03.pdf [ Links ]
Pearson, R. G. (2006). Climate change and the migration capacity of species. Trends in Ecology and Evolution, 21, 111‒113. doi: 10.1016/j.tree.2005.11.022 [ Links ]
Peñuelas, J., Filella, I., & Comas, P. (2002). Changed plant and animal life cycles from 1952 to 2000 in the Mediterranean region. Global Change Biology, 8(6), 531‒544. doi: 10.1046/j.1365-2486.2002.00489.x [ Links ]
Perea, R. (2012). Dispersión y predación de semillas por la fauna: Implicaciones en la regeneración forestal de bosques templados. Ecosistemas, 21(1-2), 224‒229. Retrieved from https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/368 [ Links ]
Pérez-Cadavid, A., Rojas-Soto, O. R., & Bonilla-Moheno, M. (2018). Effect of seed ingestion by birds on the germination of understory species in cloud forest. Revista Mexicana de Biodiversidad, 89(4), 1167‒1175. doi: 10.22201/ib.20078706e.2018.4.2612 [ Links ]
Pérez, M. E., & Santiago, T. E. (2001). Dinámica estacional del banco de semilla en una sabana en los Llanos Centro-Orientales de Venezuela. Biotropica, 33(3), 435‒446. doi: 10.1111/j.1744-7429.2001.tb00197.x [ Links ]
Rovere, E. A., & Premoli, C. A. (2005). Dispersión asimétrica de semillas de Embothrium coccineum (Proteaceae) en el bosque templado de Chiloé, Chile. Ecología Austral, 15, 1‒7. Retrieved from https://bibliotecadigital.exactas.uba.ar/download/ecologiaaustral/ecologiaaustral_v015_n01_p001.pdf [ Links ]
Ruiz, R. S., Gómez, R. M., & Lindig, C. R. (2010). Lluvia de semillas de Lupinus elegans Kunth. en un proyecto de restauración ecológica. Biológicas, 12(2), 72-74. Retrieved from https://www.biologicas.umich.mx/index.php?journal=biologicas&page=article&op=view&path%5B%5D=80 [ Links ]
Sáenz-Romero, C., Lindig-Cisneros, R. A., Joyce, D. G., Beaulieu, St,. Clair, J. B., & Jaquish, B. C. (2016). Assisted migration of forest populations for adapting trees to climate change. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 22(3), 303‒323. doi: 10.5154/r.rchscfa.2014.10.052 [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). (2016). Programa de Manejo Área de Protección de Flora y Fauna Nevado de Toluca. Retrieved from https://simec.conanp.gob.mx/pdf_libro_pm/104_libro_pm.pdf [ Links ]
Soto-Correa, J. C., Lindig-Cisneros, R., & Sáenz-Romero, C. (2014). Migración asistida de Lupinus elegans Kunth en ensayos de jardín común en campo. Revista Fitotecnia Mexicana, 37(2), 107‒116. Retrieved from http://www.scielo.org.mx/pdf/rfm/v37n2/v37n2a2.pdf [ Links ]
Statistical Analysis System (SAS). (2013). The SAS system for windows, release V. 9.3. Cary, NC, USA: Author. [ Links ]
Tercero-Burcado, N., & Rovere, A. E. (2010). Patrones de dispersión de semillas y colonización de Misodendrum punctulatum (Misodendraceae) en un matorral postfuego de Nothofagus antarctica (Nothofagaceae) del noroeste de la Patagonia. Revista Chilena de Historia Natural, 83(3), 375‒386. doi: 10.4067/S0716-078X2010000300005 [ Links ]
Thompson, K. & Fenner, M. (1992). The functional ecology of seed banks. In M. Fenner (Ed.), Seeds: the ecology of regeneration in plant communities (pp. 231-258). Wallingford, UK: CAB International. [ Links ]
Tognetti, M. P., Mazia, N., & Ibañez, G. (2019). Seed local adaptation and seedling plasticity account for Gleditsia triacanthos tree invasion across biomes. Annals of Botany 124(2), 307‒318. doi: 10.1093/aob/mcz077 [ Links ]
Turner, K. G., Huang, D. I., Cronk, Q. C. B., & Rieseberg, L. H. (2017). Homogenization of populations in the wildflower, Texas bluebonnet (Lupinus texensis). Journal of Heredity 109(2), 152-161. doi: 10.1093/jhered/esx094 [ Links ]
van Den, E. C. L., La Rue, E. A., & Emery, N. C. (2016). Oh, the places you’ll go! Understanding the evolutionary interplay between dispersal and habitat adaptation as a driver of plant distributions. American Journal of Botany, 103(12), 1-4. doi: 10.3732/ajb.1600312 [ Links ]
Wang, B. C., & Smith, T. B. (2002). Closing the seed dispersal loop. Trends in Ecology & Evolution, 17(8), 379‒385. doi: 10.1016/S0169-5347(02)02541-7 [ Links ]
Recibido: 17 de Junio de 2020; Aprobado: 10 de Febrero de 2021











 texto en
texto en 


