Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo serie ciencias forestales y del ambiente
versão On-line ISSN 2007-4018versão impressa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.27 no.2 Chapingo Mai./Ago. 2021 Epub 26-Jan-2024
https://doi.org/10.5154/r.rchscfa.2020.04.029
Artículo científico
Rizobacterias aisladas de Jatropha curcas L.: actividad antagonista de fitopatógenos y promotora del crecimiento de plantas
1 Universidad Autónoma de Guerrero. Av. Lázaro Cárdenas s/n. C. P. 39087. Chilpancingo, Guerrero, México.
2 Universidad Autónoma del Estado de Morelos. Av. Universidad núm. 1001, col. Chamilpa. C. P. 62209. Cuernavaca, Morelos, México.
3 Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos. Ctra. Yautepec-Jojutla km 6, calle CEPROBI núm. 8, col. San Isidro. C. P. 62731. Yautepec, Morelos, México.
4 Universidad Nacional Autónoma de México, Instituto de Investigaciones Biomédicas. Tercer circuito exterior s/n, Ciudad Universitaria. C. P. 04510. Coyoacán, Ciudad de México, México.
5 Universidad de la República de Uruguay, Facultad de Química. General Flores núm. 2124, Montevideo, CC 1157. Uruguay.
Introducción:
Jatropha curcas L. es una especie nativa de México que recientemente se ha considerado un cultivo importante para la producción de biocombustible.
Objetivo:
Aislar e identificar rizobacterias de J. curcas con actividad antagónica frente a hongos fitopatógenos (Curvularia lunata y Fusarium equiseti) del cultivo y evaluar la capacidad de estas para promover el crecimiento de plantas de jitomate.
Materiales y métodos:
Las cepas bacterianas se obtuvieron por dilución en serie. La actividad antagónica se evaluó mediante compuestos volátiles y difusibles en medio de cultivo PDA; además, se determinó la producción de compuestos antifúngicos y metabolitos que promueven el crecimiento de plantas. Las cepas se identificaron mediante la amplificación de los genes ARNr 16S y sodA; posteriormente, se inocularon en semillas de jitomate para evaluar la germinación de las plantas y la promoción del crecimiento.
Resultados y discusión:
Las bacterias antagonistas se identificaron como Bacillus mojavensis, Bacillus subtilis, Bacillus thuringiensis y Pseudomonas aeruginosa. El efecto antifúngico sobre el crecimiento micelial de C. lunata y F. equiseti se debió a la presencia de compuestos volátiles y difusibles con inhibición de entre 30 % y 79 %. Pseudomonas aeruginosa mostró el efecto inhibitorio más fuerte (48.7 a 79.8 %). Bacillus subtilis (A1), B. mojavensis (A4) y B. thuringiensis (A6, A8) mostraron la mayor germinación (70 % a 88 %). El crecimiento de las plantas de jitomate tratadas con cepas bacterianas fue significativamente mayor (P < 0.05) que el de las plantas testigo.
Conclusión:
Ocho aislados de rizobacterias de J. curcas mostraron actividad antagónica frente a C. lunata y F. equiseti, y demostraron su capacidad para mejorar la germinación y promover el crecimiento de las plantas de jitomate.
Palabras clave: Bacillus mojavensis; Bacillus subtilis; Bacillus thuringiensis; Pseudomonas aeruginosa; Curvularia lunata; Fusarium equiseti
Introduction:
Jatropha curcas L. is a species native to Mexico that has recently been considered an important crop to produce biofuel.
Objective:
To isolate and identify rhizobacteria from J. curcas with antagonistic activity against phytopathogenic fungi (Curvularia lunata and Fusarium equiseti) of this crop and evaluate their capacity to promote tomato plant growth.
Materials and methods:
The isolates were obtained by serial dilution and antagonistic activity was assessed by volatile and diffusible compounds on PDA medium. In addition, the production of antifungal compounds and metabolites that promote the plant growth were determined. The isolates were identified by amplifying the 16S RNA and sodA genes. Finally, the isolates were inoculated on tomato seeds to evaluated plant growth promotion and germination.
Results and discussion:
The antagonistic bacteria were identified as Bacillus mojavensis, Bacillus subtilis, Bacillus thuringiensis, and Pseudomonas aeruginosa. The antifungal effect on the mycelial growth of C. lunata and F. equiseti was due to the presence of volatile and diffusible compounds with between 30 % and 79 % inhibition. Pseudomonas aeruginosa showed the strongest inhibitory effect (48.7 to 79.8 %). Bacillus subtilis (A1), B. mojavensis (A4) and B. thuringiensis (A6, A8) showed the highest germination (70 % to 88 %). The vegetative growth of tomato plants treated with the isolates was significantly higher than the controls (P < 0.05).
Conclusion:
Eight rhizobacteria isolated from J. curcas showed antagonistic activity against C. lunata and F. equiseti and demonstrated their capacity to improve the germination and promote growth in tomato plants.
Keywords: Bacillus mojavensis; Bacillus subtilis; Bacillus thuringiensis; Pseudomonas aeruginosa; Curvularia lunata; Fusarium equiseti
Introducción
Jatropha curcas L. es una especie tropical perenne nativa de México que recientemente ha recibido mucha atención, debido a su papel en la producción de biodiesel, un combustible ecológico, biodegradable y no tóxico (Mazumdar, Singh, Babu, Siva, & Harikrishna, 2018). El aceite extraído de semillas de J. curcas es una fuente importante de ácidos grasos que se utilizan para producir biocombustible; el éxito de esta producción depende en gran medida de las propiedades fisicoquímicas y el contenido de humedad de las semillas (Keneni, Hvoslef-Eide, & Marchetti, 2019).
En estudios anteriores se ha demostrado que la calidad de las semillas de J. curcas se ve afectada por la actividad del agua, el tiempo de almacenamiento y los hongos fitopatógenos (Dharmaputra, Worang, Syarief & Miftahudin, 2009). También se ha señalado que los hongos fitopatógenos provocan cambios en el contenido de ácidos grasos, lo que podría afectar la producción de biocombustibles (Oluwatoyin & Anthony, 2019); además, se ha demostrado que diversas especies de hongos, como Aspergillus flavus, Rhizopus nigricans, Fusarium equiseti y Curvularia lunata afectan la germinación de semillas de J. curcas (Anjorin, Omolewa & Salako, 2011; Pabón-Baquero, Velázquez-del Valle, Evangelista-Lozano, León-Rodriguez, & Hernández-Lauzardo, 2015). Tradicionalmente, los hongos fitopatógenos se han controlado con fungicidas químicos; no obstante, estos productos representan un riesgo potencial para el medio ambiente y la salud humana, con el problema adicional de que los hongos generan resistencia a estos (Yang et al., 2019). Una estrategia alterna es el uso de rizobacterias antagonistas como agentes de control biológico de hongos fitopatógenos.
Existen pocos estudios sobre la diversidad microbiana de la rizosfera de J. curcas; sin embargo, se ha informado del aislamiento de rizobacterias promotoras del crecimiento de plantas (PGPR) capaces de solubilizar fosfatos y producir cianuro de hidrógeno y sideróforos (Jha & Saraf, 2012). En estudios recientes, estos metabolitos se han asociado con la protección contra enfermedades fúngicas en muchos cultivos (Abo-Elyousr, Khalil Bagy, Hashem, Alamri & Mostafa, 2019). Actualmente, hasta donde se sabe, solo existe un informe sobre el uso de rizobacterias antagonistas aisladas de J. curcas para el control de hongos fitopatógenos de este cultivo en India (Latha et al., 2011).
Además de los posibles efectos antimicóticos, un estudio ha demostrado que las bacterias aisladas de la rizosfera de J. curcas promueven el crecimiento de plantas (Jha, Patel & Saraf, 2012). Esto se trata de una posible aplicación importante, ya que el uso inadecuado o excesivo de fertilizantes químicos, para promover el crecimiento, causa daños ambientales y sanitarios, por lo que se necesita el desarrollo de un formulado a base de bacterias para ofrecer mejores alternativas y así reducir el consumo de productos químicos. Este efecto podría producirse en plantas distintas de la propia J. curcas, como el jitomate, del que México es el mayor exportador (Saavedra, Figueroa, & Cauih, 2017). Por tanto, el objetivo de este estudio fue aislar e identificar las bacterias provenientes del suelo rizosférico de J. curcas con capacidad antagónica frente a dos especies de hongos fitopatógenos (C. lunata y F. equiseti) del cultivo y evaluar la capacidad de estas para promover el crecimiento de plantas de jitomate. Las cepas bacterianas con potencial uso pueden ser utilizadas como fertilizantes y ofrecerse como una alternativa más amigable con el medio ambiente y útil para los agricultores.
Materiales y métodos
Aislamiento de rizobacterias de Jatropha curcas y fuente de hongos fitopatógenos
Las muestras se colectaron en Yautepec, Morelos, México (18º 49’ N, 99º 05’ O) a partir de suelo rizosférico de J. curcas en cinco sitios de muestreo (un punto en el centro y cuatro en los bordes de un campo de 4 000 m2). Con un equipo estéril se recogieron 100 g de suelo rizosférico de hasta 15 cm de profundidad en cada punto. A partir de muestras homogeneizadas se tomaron 10 g de suelo rizosférico, se depositó en 90 mL de agua destilada estéril y se agitó durante un minuto. Se realizaron diluciones en serie y se esparcieron 0.1 mL en agar nutritivo (AN). Después de 24 h de incubación a 28 ± 2 °C, las colonias bacterianas con apariencias morfológicas diferentes se contaron, purificaron y almacenaron a 4 °C en AN. Los hongos fitopatógenos C. lunata y F. equiseti se aislaron de las semillas de J. curcas en trabajos anteriores de Pabón-Baquero et al. (2015) y pertenecen a la colección de hongos del Laboratorio de Fitopatología, CEPROBI-IPN. Las cepas fúngicas se mantuvieron en placas de agar papa dextrosa (PDA) a 28 ± 2 °C.
Evaluación de la actividad antagónica de aislamientos bacterianos
La actividad antagónica de 70 aislados bacterianos se evaluó frente a C. lunata o F. equiseti mediante la técnica de cultivo dual en PDA. Para ello, un disco micelial de 5 mm del hongo se colocó en el centro de las placas de Petri. Cinco microlitros (3 x 108 UFC∙mL-1) de cuatro aislados bacterianos se colocaron equidistantes del centro en cuatro puntos de las placas de Petri. Las placas de PDA inoculadas solo con el patógeno se utilizaron como testigo. Las placas se incubaron a 28 ± 2 °C hasta que el micelio alcanzó los bordes de las placas testigo. Los aislados bacterianos que mostraron inhibición de crecimiento del micelio en el área del agar se seleccionaron como antagonistas potenciales (Karimi, Amini, Harighi, & Bahramnejad, 2012).
Actividad antagónica in vitro de compuestos volátiles
La metodología descrita por Karimi et al. (2012) se llevó a cabo con algunas modificaciones. Las bacterias aisladas se estriaron en placas de AN y, al mismo tiempo, el hongo (disco de 5 mm de un cultivo de 7 días) se colocó en el centro de otra placa de Petri con medio de cultivo PDA. Posteriormente, ambas medias placas se colocaron cara a cara impidiendo el contacto físico entre hongos y bacterias y se sellaron con Parafilm para evitar la pérdida de compuestos volátiles. Las placas se incubaron a 28 ± 2 °C y la zona de inhibición se midió con un calibrador vernier digital. El radio medio (mm) de crecimiento del hongo en presencia de cada cepa bacteriana se comparó con el de los cultivos testigo (que contenían solo un disco de cada especie fúngica) para determinar el porcentaje de inhibición de crecimiento del micelio, mediante la fórmula (C-T)/C * 100 %, donde C = testigo y T = tratamiento.
Actividad antagónica in vitro por compuestos difusibles
La actividad antagónica de los aislados bacterianos se evaluó frente a C. lunata y F. equiseti mediante la técnica de cultivo dual en PDA. Un disco micelial de 5 mm se colocó en el centro de las placas de Petri. Cinco microlitros (3 x 108 UFC∙mL-1) del aislado bacteriano se colocaron en cuatro puntos equidistantes del centro de las placas de Petri. Las placas de PDA inoculadas solo con el patógeno se utilizaron como testigos. Las placas se incubaron a 28 ± 2 °C hasta que las placas testigo mostraron crecimiento completo. El porcentaje de inhibición de crecimiento del micelio se determinó como se describió anteriormente (Karimi et al., 2012).
Identificación morfológica y molecular de las bacterias antagonistas
Los aislados bacterianos que mostraron actividad antagónica hacia los hongos fitopatógenos examinados se seleccionaron mediante procedimientos morfológicos y moleculares para su identificación. El ADN genómico se extrajo y purificó utilizando el kit MiniPrepTM de ADN bacteriano y fúngico ZR. Las secuencias del gen ARNr 16S de los aislados antagonistas se amplificaron según lo descrito por Weisburg, Barns, Pelletier, y Lane (1991); además, con base en Gatson et al. (2006), se logró la amplificación por PCR de la porción interna de las secuencias del gen sodA en algunas cepas. Para identificar la cepa Bacillus thuringiensis, que alberga cualquiera de los genes cry1, cry2 y cry7, se hizo un análisis PCR con cebadores específicos (Ben-Dov et al., 1997; Ceron, Ortíz, Quintero, Güereca, & Bravo, 1995; Sauka, Cozzi, & Benintende, 2005). Las secuencias de nucleótidos del ARNr 16S y sodA se compararon con las secuencias de la base de datos del NCBI (National Center for Biotechnology Information, 2020) utilizando la herramienta BLAST. La alineación de las secuencias múltiples y el análisis filogenético de máxima probabilidad se realizaron con el programa MEGA 5 (Tamura et al., 2011). La fiabilidad del árbol filogenético se evaluó utilizando una prueba de bootstrap con 1 000 réplicas.
Producción de compuestos antimicóticos por bacterias antagonistas
Cada aislado bacteriano antagonista se probó directamente para la producción de cianuro de hidrógeno (HCN), sideróforos, proteasas y quitinasas de la manera siguiente. La producción de HCN se evaluó en un medio de cultivo AN, donde el cultivo bacteriano se esparció en la superficie; posteriormente, los filtros esterilizados se empaparon en 2.0 % de Na2CO3 en ácido pícrico al 5.0 % (p/v) y se colocaron en la cubierta de la placa de Petri. Las placas de Petri se sellaron con Parafilm y se incubaron a 30 °C durante 4 días. El cambio de color del filtro de amarillo a café rojizo fue positivo para la actividad cianogénica (Karimi et al., 2012). La producción de sideróforos se determinó con un ensayo en placa de agar cromo azurol sulfonato (CAS), utilizando como base el medio Grimm Allen (Baakza, Vala, Dave, & Dube, 2004; Schwyn & Neilands, 1987). La actividad de proteasas se determinó a partir de la presencia de halos claros en agar de leche desnatada (SMA), según Chantawannakul, Oncharoen, Klanbut, Chukeatirote, y Lumyong (2002). La actividad de quitinasas se determinó inoculando cada cepa en un medio de cultivo con 6.7 g∙L--1 de base de nitrógeno de levadura, 5 g∙L-1 de quitina coloidal y 15 g∙L-1 de agar. La producción de quitinasas se evaluó mediante el examen visual de zonas claras alrededor de las colonias incubadas a 28 ± 2 °C durante 72 h.
Análisis de actividades promotoras del crecimiento de plantas por rizobacterias
Solubilización de fosfatos y cuantificación del ácido indol-3-acético (IAA)
La solubilización de fosfatos se determinó a partir de zonas claras en medio de cultivo. Los cultivos bacterianos se esparcieron en superficie de agar fosfato inorgánico (10 g∙L-1 glucosa, 0.5 g∙L-1 (NH4)2SO4, 0.3 g∙L-1 NaCl, 0.3 g∙L-1 KCl, 0.03 g∙L-1 FeSO4, 0.03 g∙L-1 MnSO4, 0.3 g∙L-1 MgSO4 y pH 7.2) con fosfato de calcio (1 g∙L-1 Ca3(PO4)2) como única fuente de P (Qian et al., 2010). Las placas de Petri se incubaron durante 3 a 7 días (28 ± 2 °C).
La producción de IAA se determinó según lo descrito por Karimi et al. (2012). En resumen, se inocularon cepas bacterianas en caldo de cultivo (5 g∙L-1 de peptona de caseína, 1.5 g∙L-1 de extracto de levadura, 1.5 g∙L-1 de extracto de carne y 5 g∙L-1 de NaCl) con o sin triptófano (500 µg∙mL-1) y se incubaron a 30 °C durante 3 días. Un cultivo de 5 mL se extrajo de cada tubo y se centrifugó a 12 000 x g durante 15 min. Una alícuota de 2 mL de sobrenadante se transfirió a un tubo nuevo al que se añadieron 100 µL de ácido ortofosfórico de 10 mM y 4 mL de reactivo (1 mL de 0.5 M FeCl3 en 50 mL de HClO4 al 35 %). La mezcla se incubó a temperatura ambiente durante 30 min y la absorbancia se leyó a 530 nm.
Germinación y promoción de crecimiento
Las semillas de jitomate (Solanum lycopersicum L. “Bola”) se desinfectaron con etanol e hipoclorito de sodio. En resumen, las semillas se seleccionaron por el método de flotación y luego se desinfectaron durante 1 min en hipoclorito de sodio comercial al 5 %; posteriormente, se sumergieron en etanol al 70 % por 1 min y, por último, se lavaron tres veces con agua destilada estéril.
Las cepas bacterianas A1, A2, A3, A4, A5, A6 y A8 se inocularon en agar Luria-Bertani (agar LB: 10 g∙L-1 de peptona de caseína, 5 g∙L-1 de extracto de levadura, 10 g∙L-1 de NaCl, 15 g∙L-1 de agar y pH 7.2 ajustado y esterilizado) y se incubaron durante 24 h a 30 °C. Según la escala de Mcfarland de 0.5 (1.5 x 108 UFC∙mL-1), se preparó una suspensión bacteriana en solución salina al 0.9 % como inóculo para los ensayos de germinación y promoción de crecimiento. La bacteria P. aeruginosa no se probó en bioensayos in vivo para evitar contaminar el medio ambiente con este patógeno oportunista para los humanos.
Para el bioensayo de germinación se utilizaron 20 semillas por cepa. Las semillas se sumergieron en la suspensión bacteriana con agitación durante 2 h a 180 rpm. Las semillas testigo negativas se sumergieron en una solución salina al 0.9 % con las mismas condiciones descritas anteriormente. Las semillas se sembraron en un almácigo con sustrato de tierra esterilizado y se registró el porcentaje de germinación durante los siguientes 15 días.
Para evaluar la promoción de crecimiento, las semillas germinadas se colocaron en una taza con sustrato de tierra esterilizada en un invernadero a 30 ± 2 °C y 70 ± 5 % de humedad relativa con un fotoperíodo de 10 h de luz/14 h de oscuridad. La fertilización y la inoculación de la suspensión bacteriana se realizaron de la manera siguiente: después de trasplantar las plántulas, los testigos positivos se fertilizaron con 5 mL de Nitrofoska Blaukorn® classic (3 g∙L-1; 18 % de N, 8 % de P, 16 % de K y otros nutrientes); los tratamientos consistieron en 5 mL de la escala de Mcfarland 0.5 de suspensión bacteriana de cada cepa, y el control negativo fue agua destilada esterilizada. Después de seis semanas del bioensayo, se registraron el diámetro del tallo, la longitud de la planta, el número de hojas, el peso fresco de la planta y el peso fresco de la raíz.
Los experimentos se llevaron a cabo en un diseño completamente aleatorio; se tuvieron tres réplicas con cuatro repeticiones cada una. Los datos se analizaron con un ANOVA y las medias se compararon con la prueba de Tukey (P < 0.05) utilizando SigmaPlot versión 10.0 (Systat Software, Inc., 2007).
Resultados
Aislamiento y actividad antagónica de rizobacterias de Jatropha curcas
Se obtuvo un total de 124 cepas bacterianas en medio de cultivo AN, provenientes del suelo rizosférico de J. curcas. Solo 70 aislamientos crecieron en medio de cultivo PDA. La apariencia de la colonia varió coincidiendo con morfotipos bacterianos comunes. En las pruebas de antagonismo, de las 70 cepas bacterianas analizadas, ocho cepas inhibieron el crecimiento del micelio de C. lunata y F. equiseti, las cuales se seleccionaron por su actividad antagónica (Cuadro 1) y se designaron con la nomenclatura de A1 a A8.
Efecto de los compuestos bacterianos volátiles y difusibles en el crecimiento de micelios fúngicos
Los resultados del efecto antagónico de los compuestos volátiles y difusibles en el crecimiento del micelio de F. equiseti y C. lunata se muestran en el Cuadro 1. En general, todas las cepas inhibieron significativamente el crecimiento de los micelios fúngicos; sin embargo, el porcentaje de inhibición varió según la especie del hongo y el tipo de compuesto evaluado. El aislado A7 mostró el efecto inhibitorio más fuerte (48.7 a 79.8 %) en ambas especies de hongos y para ambos tipos de compuestos, seguido de las cepas A5, A4 y A3 que mostraron una inhibición de crecimiento de micelio de entre 30 % y 57 % (Cuadro 1).
Cuadro 1 Inhibición de crecimiento micelial de Curvularia lunata y Fusarium equiseti por compuestos volátiles y difusibles (experimentos incubados a 28 °C) de aislados bacterianos antagonistas obtenidos del suelo rizosférico de Jatropha curcas.
| Cepas bacterianas | Inhibición del crecimiento del micelio (%) | |||
|---|---|---|---|---|
| Componentes volátiles | Componentes difusibles | |||
| C. lunata | F. equiseti | C. lunata | F. equiseti | |
| Testigo | 0 a | 0 a | 0 a | 0 a |
| A1 | 32.8 b | 31.3 b | 51.9 d | 40.9 c |
| A2 | 29.1 b | 32.1 b | 51.6 d | 41.4 c |
| A3 | 27.0 b | 21.5 b | 57.0 e | 48.4 c |
| A4 | 43.0 bc | 25.6 b | 54.7 e | 49.5 c |
| A5 | 35.0 b | 31.2 b | 55.3 e | 45.8 c |
| A6 | 31.3 b | 23.1 b | 33.7 c | 22.8 b |
| A7 | 66.6 c | 48.7 c | 76.3 f | 79.8 d |
| A8 | 31.0 b | 24.8 b | 20.9 b | 27.2 b |
Letras diferentes dentro de las columnas indican diferencias significativas según la prueba de Tukey (P < 0.05).
Características morfológicas e identificación molecular de rizobacterias antagonistas
Las características morfológicas y la identificación molecular de las rizobacterias antagonistas se muestran en el Cuadro 2. Las ocho bacterias antagonistas consistieron en siete bacilos Gram-positivo (A1-A6 y A8) y un bacilo Gram-negativo (A7). La identificación molecular fue consistente con las características morfológicas de todas las cepas. Las secuencias del gen ARNr 16S se depositaron en el GenBank y se compararon con las ya encontradas en la base de datos del NCBI. Los resultados mostraron cuatro especies de rizobacterias antagonistas (Bacillus subtilis, Bacillus mojavensis, Bacillus thuringiensis y Pseudomonas aeruginosa).
La búsqueda de BLAST reveló que la secuencia del gen ARNr 16S de las cepas A1 y A2 fue 100 % idéntica a la de la cepa B. subtilis JX123316. Las secuencias ARNr 16S de las cepas A3, A4 y A5 mostraron identidad del 100 % con las cepas B. mojavensis KC519442 (A3 y A4) y JX126863 (A5). A6 y A8 se identificaron como dos cepas distintas de B. thuringiensis (100 % de identidad con B. thuringiensis KC683724 y KC692184, respectivamente); además, el análisis de PCR demostró que ambas cepas de B. thuringiensis contenían genes cry. La identificación taxonómica de la cepa A7 se confirmó con una identidad del 100 % con la secuencia ARNr 16S de la cepa P. aeruginosa KC787580. Asimismo, las secuencias de nucleótidos sodA de A1 y A2 resultaron ser 99 % idénticas al gen sodA de las cepas B. subtilis CP002468 y CP003329, respectivamente. Las cepas A3, A4 y A5 fueron 99 % idénticas al gen sodA de la cepa B. mojavensis AY197618. Los números de acceso obtenidos en este estudio a partir de las secuencias de nucleótidos de los genes ARNr 16S y sodA se muestran en el Cuadro 2.
Cuadro 2 Identificación morfológica y molecular de los aislados bacterianos antagonistas obtenidos del suelo rizosférico de Jatropha curcas.
| Cepas | Características morfológicas | Identificación molecular | ||||||
|---|---|---|---|---|---|---|---|---|
| 16S del ARNr | sodA | |||||||
| Tinción de Gram | Forma de la célula | GenBank (número de acceso) | Identidad (%) | Identificación (número de acceso al GenBank) | GenBank(número de acceso) | Identidad (%) | Identificación (número de acceso al GenBank) | |
| A1 | + | barra | JX123316 | 100 | Bacillus subtilis | CP002468 | 99 | Bacillus subtilis |
| KF255983 | KF313554 | |||||||
| A2 | + | barra | JX123316 | 100 | Bacillus subtilis | CP003329 | 99 | Bacillus subtilis |
| KF255984 | KF313555 | |||||||
| A3 | + | barra | KC519442 | 100 | Bacillus mojavensis | AY197618 | 99 | Bacillus mojavensis |
| KF255985 | KF313556 | |||||||
| A4 | + | barra | KC519442 | 100 | Bacillus mojavensis | AY197618 | 99 | Bacillus mojavensis |
| KF255986 | KF313557 | |||||||
| A5 | + | barra | JX126863 | 100 | Bacillus mojavensis | AY197618 | 99 | Bacillus mojavensis |
| KF255987 | KF313558 | |||||||
| A6 | + | barra | KC683724 | 100 | Bacillus thuringiensis | - - | - - | - - |
| KF255988 | ||||||||
| A7 | - | barra | KC787580 | 100 | Pseudomonas aeruginosa | - - | - - | - - |
| KF255989 | ||||||||
| A8 | + | barra | KC692184 | 100 | Bacillus thuringiensis | - - | - - | - - |
| KF255990 | ||||||||
Reacción positiva (+) y reacción negativa (-). Muestras no analizadas (- -)
Análisis filogenético
Los árboles filogenéticos construidos a partir de las secuencias ARNr 16S y sodA se muestran en las Figuras 1 y 2, respectivamente. El árbol ARNr 16S mostró tres grupos distintos: grupo 1 con cepas de B. mojavensis y B. subtilis, grupo 2 con B. thuringiensis y grupo 3 con P. aeruginosa (Figura 1). Para separar y corroborar la identificación de las dos especies de Bacillus en el grupo 1, se realizaron análisis de las secuencias de sodA en las cepas A1-A5. El árbol sodA definió claramente dos grupos: grupo 1 con A1 y A2 (B. subtilis) y grupo 2 con A3, A4 y A5 (B. mojavensis) (Figura 2).

Figura 1 Árbol filogenético que utiliza las secuencias de nucleótidos del gen ARNr 16S de ocho cepas bacterianas (letras en negrita: Bacillus mojavensis, B. subtilis, B. thuringiensis y Pseudomonas aeruginosa) provenientes del suelo rizosférico de Jatropha curcas. *Borrelia burgdorferi (L40596) se incluyó como grupo externo. El árbol se construyó utilizando el método Neighbor-Joining con 1 000 réplicas de bootstrap. La barra de la escala indica el número de sustituciones por posición de nucleótidos.
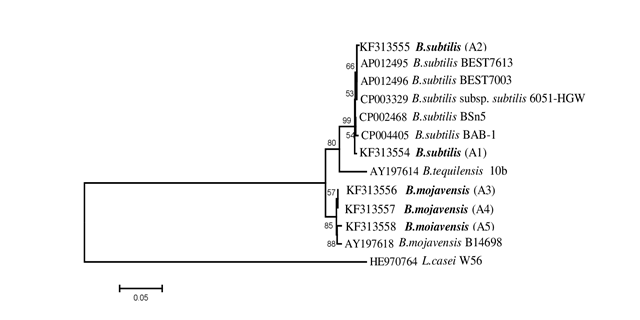
Figura 2 Árbol filogenético basado en secuencias del gen sodA de cinco cepas bacterianas (tipo negrita: Bacillus mojavensis y B. subtilis) del suelo rizosférico de Jatropha curcas. *Lactobacillus casei (HE970764) se incluyó como grupo externo. El árbol se construyó usando el método Neighbor-Joining con 1 000 réplicas de bootstrap. La barra de la escala indica el número de sustituciones por posición de nucleótidos.
Compuestos antimicóticos producidos por cepas bacterianas
Las ocho cepas se examinaron para determinar su actividad de biocontrol (Cuadro 3). Los resultados demostraron que cada especie bacteriana tuvo comportamiento diferente y algún grado de efecto antagónico en el crecimiento del micelio de C. lunata y F. equiseti. Todas las cepas de Bacillus spp. produjeron enzimas hidrolíticas. Se detectó actividad de proteasas en B. subtilis, B. mojavensis y B. thuringiensis, mientras que la actividad de quitinasas solo se observó en B. thuringensis (A6 y A8). A excepción de B. thuringiensis, todas las cepas produjeron sideróforos y solo P. aeruginosa produjo HCN (Cuadro 3).
Cuadro 3 Cepas bacterianas provenientes de suelo rizosférico de Jatropha curcas: caracterización de compuestos con potencial en control biológico y promoción de crecimiento de plantas.
| Cepas | Control biológico | Promoción de crecimiento de plantas | ||||
|---|---|---|---|---|---|---|
| Proteasas | Quitinasas | Sideróforos | HCN | Solubilización de fosfatos | IAA (µg∙mL-1) | |
| Bacillus subtilis (A1) | + | - | + | - | - | 4.85 ± 0.004 c |
| Bacillus subtilis (A2) | + | - | + | - | - | 5.06 ± 0.006 c |
| Bacillus mojavensis (A3) | + | - | + | - | - | 4.30 ± 0.003 c |
| Bacillus mojavensis (A4) | + | - | + | - | - | 4.35 ± 0.010 c |
| Bacillus mojavensis (A5) | + | - | + | - | - | 4.55 ± 0.006 c |
| Bacillus thuringiensis (A6) | + | + | - | - | - | 15.31 ± 0.054 b |
| Pseudomonas aeruginosa (A7) | - | - | + | + | + | 18.73 ± 0.001 a |
| Bacillus thuringiensis (A8) | + | + | - | - | - | 10.56 ± 0.068 c |
La presencia (+) o ausencia (-) del compuesto está indicada para todas las sustancias excepto en el ácido indol-3-acético (IAA), donde se muestra la media ± desviación estándar de la concentración. HCN: cianuro de hidrógeno. Letras diferentes dentro de las columnas indican diferencias significativas según la prueba de Tukey (P < 0.05).
Solubilización de fosfatos y cuantificación del ácido indol-3-acético en cepas bacterianas
La capacidad de solubilización de fosfatos y de producción de IAA de las cepas bacterianas se muestra en el Cuadro 3. De las ocho cepas evaluadas, solo P. aeruginosa mostró actividad de solubilización de fosfatos, pero todas las cepas analizadas produjeron IAA. Mientras que la mayoría de las cepas produjeron niveles similares de IAA, P. aeruginosa (A8, 18.73 µg∙mL-1) y B. thuringiensis (A6, 15.31 µg∙mL-1) tuvieron una producción de IAA significativamente mayor que las demás cepas.
Evaluación de la germinación y actividad promotora del crecimiento de las plantas
El porcentaje de germinación se registró 15 días después de la siembra. El testigo negativo mostró el menor porcentaje, seguido por las cepas B. mojavensis (A5, A3) y B. subtilis (A2) con alrededor de 50 a 60 % de germinación. Por su parte, las cepas B. subtilis (A1), B. mojavensis (A4) y B. thuringiensis (A6) mostraron el mayor porcentaje de germinación que se registró entre 80 y 88 % (Cuadro 4).
La promoción de crecimiento por las cepas aisladas se evaluó utilizando diferentes variables de tamaño, las cuales difirieron ligeramente en sus resultados. En la variable de longitud de planta, las cepas B. mojavensis (A4), B. subtilis (A1) y B. thuringiensis (A6) mostraron diferencias estadísticamente significativas (P < 0.05) con entre 15.4 y 19.8 cm, seguidas por B. mojavensis (A3, A5), B. subtilis (A2) y B. thuringiensis (A8) con 14.0 a 15.3 cm. Estas últimas cepas no presentaron diferencia estadística significativa (P > 0.05) con respecto al testigo positivo (tratamiento fertilizado) según la prueba de Tukey (Cuadro 4). En el diámetro del tallo, las cepas B. subtilis (A1) y B. thuringiensis (A6) tuvieron los tallos más grandes, con 5 y 4.98 mm, respectivamente. Aunque las otras cepas también tuvieron diámetros de tallo más grandes que el testigo positivo, la prueba de Tukey no mostró diferencias significativas (P > 0.05) (Cuadro 4). En cuanto al número de hojas, los tratamientos con las bacterias B. subtilis (A1), B. mojavensis (A3, A4, A5) y B. thuringiensis (A8) tuvieron hasta dos hojas más que el testigo positivo (Cuadro 4). En cuanto al peso fresco de la planta, B. mojavensis (A4), B. thuringiensis (A6) y B. subtilis (A1) obtuvieron los mejores resultados. Por último, según la prueba de Tukey, el peso fresco de raíz no presentó diferencia estadísticamente significativa (P > 0.05) entre tratamientos y testigo positivo. En todas las pruebas, los tamaños y pesos más pequeños se produjeron en las plantas del grupo del testigo negativo (sin tratamiento) (Cuadro 4).
Cuadro 4 Tratamientos con cepas de Bacillus inoculados en semillas de jitomate para evaluar la germinación y promoción del crecimiento en plantas.
| Cepa | Germinación (%) | Longitud de planta (cm) | Diámetro de tallo (mm) | Número de hojas | Peso fresco de planta (g) | Peso fresco de raíz (g) |
|---|---|---|---|---|---|---|
| A1 | 86.67 ± 2.89 a | 16.94 ± 0.71 ab | 5.00 ± 0.51 a | 7.00 ± 0.57 a | 6.29 ± 1.41 ab | 1.05 ± 0.46 a |
| A2 | 61.67 ± 2.89 dc | 15.34 ± 0.69 bc | 4.15 ± 0.33 ab | 6.42 ± 0.97 ab | 4.27 ± 1.50 bc | 0.77 ± 0.47 a |
| A3 | 58.33 ± 7.64 dc | 15.18 ± 1.55 bc | 4.52 ± 0.48 ab | 6.85 ± 0.90 a | 4.95 ± 1.43 ac | 0.76 ± 0.23 a |
| A4 | 81.67 ± 2.89 ab | 19.81 ± 2.10 a | 4.77 ± 0.61 ab | 7.42 ± 0.78 a | 7.93 ± 1.21 a | 1.21 ± 0.21 a |
| A5 | 53.33 ± 5.77 d | 15.35 ± 2.86 bc | 4.58 ± 0.50 ab | 6.85 ± 0.69 a | 5.77 ± 2.08 ac | 0.87 ± 0.40 a |
| A6 | 88.33 ± 2.89 a | 15.44 ± 1.41 b | 4.98 ± 0.59 a | 6.42 ± 0.53 ab | 6.55 ± 2.41 ab | 1.02 ± 0.61 a |
| A8 | 70.00 ± 5.00 bc | 14.07 ± 1.73 bc | 4.34 ± 0.68 ab | 6.85 ± 0.37 a | 5.20 ± 1.53 ac | 0.86 ± 0.27 a |
| NTF | NA | 12.14 ± 2.73 c | 3.76 ± 1.08 b | 5.57 ± 0.78 bc | 3.51 ± 1.90 c | 0.61 ± 0.34 ab |
| TN | 50 ± 5.00 d | 8.37 ± 2.07 d | 2.58 ± 0.43 c | 5.00 ± 0.57 c | 1.39 ± 0.74 d | 0.24 ± 0.13 b |
*NTF = fertilizante nitrofoska; TN = testigo negativo; NA = no aplica. Letras diferentes dentro de las columnas indican diferencias significativas según la prueba de Tukey (P < 0.05).
Discusión
Existen pocos reportes científicos sobre el aislamiento, identificación y caracterización de las comunidades microbianas de J. curcas. Un reporte anterior reveló que la rizosfera de este cultivo perenne contiene gran biodiversidad microbiana y demostró la importancia de obtener aislamientos de PGPR para comprender su impacto ecológico y social (Jha, Patel, Rajendran, & Saraf, 2010). Por tanto, es esencial evaluar el potencial funcional de las cepas obtenidas de los cultivos de J. curcas. En este estudio, ocho cepas de rizobacterias mostraron actividad antagónica frente a C. lunata y F. equiseti, hongos fitopatógenos de semillas de J. curcas. Este efecto antifúngico en el crecimiento de micelios de dos especies de hongos quedó demostrado por la presencia de compuestos volátiles y difusibles producidos por los aislamientos bacterianos.
La identificación morfológica y molecular demostró que estas bacterias antagonistas pertenecen a los géneros Bacillus y Pseudomonas. Los árboles filogenéticos mostraron distintos grupos que contienen especies de Bacillus (B. mojavensis, B. subtilis y B. thuringiensis) y una cepa de P. aeruginosa. En los estudios de Wong-Villarreal et al. (2019) se reportaron varias cepas de P. aeruginosa, bacterias con potencial biotecnológico aisladas de la rizosfera de J. curcas. En ese estudio, las cepas de P. aeruginosa fueron capaces de degradar hidrocarburos aromáticos y promover el crecimiento en Zea mays L. Aunque el centro de origen y domesticación de J. curcas es México (Mazumdar et al., 2018), el potencial de sus bacterias rizosféricas es poco conocido. Teniendo en cuenta la incidencia de plagas y enfermedades reportadas en J. curcas (Góngora-Canul et al., 2018; Saragih, Fajri, Mahmudy, Abadi, & Anggodo, 2018), es importante evaluar el potencial de control biológico y promoción del crecimiento de plantas por cepas de rizobacterias.
En este estudio, las rizobacterias antagonistas demostraron su capacidad para producir metabolitos antifúngicos. Las cepas B. subtilis produjeron proteasas y sideróforos, y tuvieron una actividad antagónica sustancial frente al crecimiento micelial de C. lunata y F. equiseti. Los resultados son consistentes con los reportados en estudios realizados con B. subtilis, aislado de J. curcas en India y México (Hernández-Guerra et al., 2016; Latha et al., 2011), que produjeron sideróforos e inhibieron el crecimiento micelial de los hongos fitopatógenos Lasiodiplodia theobromae y Fusarium verticillioides. Las cepas B. mojavensis aisladas en el presente trabajo también produjeron proteasas y sideróforos e inhibieron el crecimiento micelial de las dos especies de hongos analizadas. En estudios anteriores, B. mojavensis inhibió el crecimiento micelial de tres hongos fitopatógenos importantes: Ceratocystis fimbriata, Pestalotiopsis microspora y F. verticilloides (Hernández-Guerra et al., 2016; Mohamad et al., 2018). Otra especie bacteriana importante aislada en este estudio fue B. thuringiensis. Esta cepa produjo enzimas hidrolíticas como proteasas y quitinasas y presentó genes cry, esenciales para el biocontrol de plagas de insectos. La actividad quitinasa de B. thuringiensis y su efecto antifúngico frente a hongos fitopatógenos ha sido demostrado previamente (Martínez-Zavala, Barboza-Pérez, Hernández-Guzmán, Bideshi, & Barboza-Corona, 2020). Finalmente, se aisló una cepa de P. aeruginosa, que fue la de mayor efecto antagónico sobre el crecimiento micelial de las dos especies fúngicas analizadas. Esta cepa (junto con otras de este estudio) produjo sideróforos y fue la única rizobacteria que produjo HCN. El HCN es un metabolito secundario que actúa como inhibidor de la enzima citocromo c oxidasa, y P. aeruginosa contribuye a la supresión de enfermedades de plantas mediante la producción de HCN (Abo-Elyousr et al., 2019).
Actualmente, se sabe que las rizobacterias son biofertilizantes eficaces en varios cultivos, proporcionando fitohormonas como la auxina, citoquinina, giberelina y ACC desaminasa; además, aportan nutrientes mediante la fijación de nitrógeno, solubilización del fósforo y secuestro del hierro mediante la producción de sideróforos. Por otro lado, las raíces de las plantas proporcionan moléculas esenciales para el metabolismo de las bacterias, como azúcares, ácidos orgánicos y aminoácidos (Olanrewaju, Glick, & Babalola, 2017). Todas las cepas analizadas en este estudio pueden producir IAA. Muchos estudios señalan que la producción de IAA se relaciona con la estimulación del crecimiento en plantas por Bacillus sp. y Pseudomonas sp., entre otros microorganismos (Jha & Saraf, 2012; Uzair et al., 2018). Otros estudios indican que Bacillus spp. y Enterobacter cancerogenus pueden potenciar el crecimiento de J. curcas (Desai et al., 2007; Jha et al., 2012). En este caso, solo P. aeruginosa mostró actividad de solubilización de fosfatos y exhibió el mayor potencial beneficioso. Se ha reportado que P. aeruginosa solubiliza los fosfatos de forma significativa y produce IAA, sideróforos y HCN y que puede utilizarse como bioinoculante para aumentar la productividad de legumbres (Ahemad & Khan, 2012). Actualmente, existen pocos estudios sobre las bacterias B. subtilis, B. thuringiensis y B. mojavensis como promotoras del crecimiento en plantas de jitomate e inductoras de la germinación. El estudio de Cabra-Cendales, Rodríguez-González, Villota-Cuasquer, Tapasco-Alzate, y Hernández-Rodríguez (2017) demostró que una cepa de B. subtilis indujo la germinación de alrededor de 86.7 % de semillas de jitomate; sin embargo, no incluyó comparaciones estadísticas con semillas no inoculadas. En el presente estudio, el porcentaje de germinación de todas las cepas mostró diferencias estadísticamente significativas en comparación con el testigo negativo (las semillas no inoculadas tuvieron 50 % de germinación). El estudio de Cabra-Cendales et al. (2017) coincide con nuestros resultados; en ambos estudios, las bacterias aumentaron las medidas del tallo, así como la masa fresca. Qi, Aiuchi, Tani, Asano, y Koike (2016) evaluaron la actividad promotora del crecimiento de B. thuringiensis en plantas de jitomate y la germinación de semillas, y encontraron mayor longitud del tallo y peso fresco de la planta en comparación con un testigo no tratado; así también, las cepas promovieron la germinación de semillas de jitomate. Por otro lado, B. mojavensis no cuenta con reportes anteriores sobre los efectos de promoción de crecimiento en plantas de jitomate. No obstante, el estudio de Pyo, Shrestha, Park, y Kang (2014) demostró la potencial actividad promotora de crecimiento de una cepa de B. mojavensis mediante la pulverización de la suspensión bacteriana en hojas de rábano altari y lechuga; los tratamientos foliares aumentaron la cantidad, la longitud y el peso de las hojas y raíces de dichos cultivos.
En la actualidad se conoce la contaminación causada por el uso excesivo de productos sintéticos en la actividad agrícola, los cuales disminuyen la calidad del agua y suelo; además, afectan la salud humana, por lo que la aplicación de plaguicidas en relación con sus efectos nocivos es un tema preocupante a nivel mundial (Leong et al., 2020). En este sentido, México es el mayor productor de jitomate del mundo y el posible uso de PGPR puede ser una opción para disminuir el consumo de productos químicos. Los estudios que emplean PGPR han demostrado ser una alternativa como biofertilizantes y supresores de enfermedades, que pueden ser más amigables con el medio ambiente que los productos químicos. En general, en este estudio se demostró que varias de las rizobacterias de J. curcas producen compuestos de importancia potencial para el control biológico de plagas y enfermedades y la mejora del crecimiento de las plantas.
Conclusiones
Ocho aislados de rizobacterias provenientes del suelo rizosférico de Jatropha curcas mostraron actividad antagónica frente a Curvularia lunata y Fusarium equiseti por los efectos de compuestos volátiles y difusibles. Las rizobacterias Bacillus mojavensis, B. thuringiensis y Pseudomonas aeruginosa pueden suprimir el crecimiento de los micelios mediante la producción de compuestos antimicóticos, lo que indica su potencial en el control biológico contra enfermedades de J. curcas. Al respecto, hasta donde se sabe, este es el primer reporte de rizobacterias aisladas de J. curcas que demostraron capacidad para mejorar la germinación de semillas y promover el crecimiento de las plantas de jitomate.
Agradecimientos
Los autores agradecen al Instituto Politécnico Nacional (IPN) por su apoyo financiero. Erubiel Toledo-Hernández agradece al Dr. Miguel Gerardo Velázquez-del Valle y a la Dra. Ana Niurka Hernández-Lauzardo por su apoyo para publicar este artículo.
REFERENCIAS
Abo-Elyousr, K. A. M., Khalil Bagy, H. M. M., Hashem, M., Alamri, S. A. M., & Mostafa, Y. S. (2019). Biological control of the tomato wilt caused by Clavibacter michiganensis subsp. michiganensis using formulated plant growth-promoting bacteria. Egyptian Journal of Biological Pest Control, 29, 54. doi: 10.1186/s41938-019-0152-6 [ Links ]
Ahemad, M., & Khan, M. S. (2012). Alleviation of fungicide-induced phytotoxicity in greengram [Vigna radiata (L.) Wilczek] using fungicide-tolerant and plant growth promoting Pseudomonas strain. Saudi Journal of Biological Sciences, 19(4), 451‒459. doi: 10.1016/j.sjbs.2012.06.003 [ Links ]
Anjorin, S. T., Omolewa, O. R., & Salako, E. A. (2011). Germinability and seedling vigour of physic nut (Jatropha curcas L.) seeds inoculated with seed-borne fungi. African Journal of Agricultural Research, 6(12), 2655‒2659. doi: 08.5897/AJAR09.480 [ Links ]
Baakza, A., Vala, A. K., Dave, B. P., & Dube, H. C. (2004). A comparative study of siderophore production by fungi from marine and terrestrial habitats. Journal of Experimental Marine Biology and Ecology, 311(1), 1‒9. doi: 10.1016/j.jembe.2003.12.028 [ Links ]
Ben-Dov, E., Zaritsky, A., Dahan, E., Barak, Z., Sinai, R., Manasherob, R., … Margalith, Y. (1997). Extended screening by PCR for seven cry-group genes from field-collected strains of Bacillus thuringiensis. Applied and Environmental Microbiology, 63(12), 4883‒4890. doi: 10.1128/aem.63.12.4883-4890.1997 [ Links ]
Cabra-Cendales, T., Rodríguez-González, C. A., Villota-Cuásquer, C. P., Tapasco-Alzate, O. A., & Hernández-Rodríguez, A. (2017). Bacillus effect on the germination and growth of tomato seedlings (Solanum lycopersicum L.). Acta Biológica Colombiana, 22(1), 37‒44. doi: 10.15446/abc.v22n1.57375 [ Links ]
Cerón, J., Ortíz, A., Quintero, R., Guereca, L., & Bravo, A. (1995). Specific PCR primers directed to identify cryI and cryIII genes within a Bacillus thuringiensis strain collection. Applied and Environmental Microbiology, 61(11), 3826‒3831. doi: 10.1128/aem.61.11.3826-3831.1995 [ Links ]
Chantawannakul, P., Oncharoen, A., Klanbut, K., Chukeatirote, E., & Lumyong, S. (2002). Characterization of proteases of Bacillus subtilis strain 38 isolated from traditionally fermented soybean in Northern Thailand. ScienceAsia, 28, 241‒245. doi: 10.2306/scienceasia1513-1874.2002.28.241 [ Links ]
Desai, S., Narayanaiah, C., Kumari, C. K., Reddy, M. S., Gnanamanickam, S. S., Rao, G. R., & Venkateswarlu, B. (2007). Seed inoculation with Bacillus spp. improves seedling vigour in oil-seed plant Jatropha curcas L. Biology and Fertility of Soils, 44, 229‒234. doi: 10.1007/s00374-007-0209-7 [ Links ]
Dharmaputra, O. S., Worang, R. L., Syarief, R., & Miftahudin. (2009). The quality of physic nut (Jatropha curcas) seeds affected by water activity and duration of storage. Microbiology Indonesia, 3(3), 139‒145. doi: 10.5454/mi.3.3.6 [ Links ]
Gatson, J. W., Benz, B. F., Chandrasekaran, C., Satomi, M., Venkateswaran, K., & Hart, M. E. (2006). Bacillus tequilensis sp. nov., isolated from a 2000-year-old Mexican shaft-tomb, is closely related to Bacillus subtilis. International Journal of Systematic and Evolutionary Microbiology, 56(7), 1475‒1484. doi: 10.1099/ijs.0.63946-0 [ Links ]
Góngora-Canul, C. C., Martínez-Sebastián, G., Aguilera-Cauich, E. A., Uc-Varguez, A., López-Puc, G., & Pérez-Hernández, O. (2018). Spatio-temporal dynamics of mealybug (Hemiptera: Pseudococcidae) populations in plantations of Jatropha curcas L. in Yucatan, Mexico. Industrial Crops and Products, 117, 110‒117. doi: 10.1016/j.indcrop.2017.12.070 [ Links ]
Hernández-Guerra, H., Castrejón-Gómez, V. R., Velázquez-del Valle, M. G., Figueroa-Brito, R., Castrejón-Ayala, F., & Hernández-Lauzardo, A. N. (2016). Activity of rhizobacteria of Jatropha curcas against Fusarium verticillioides and Leptoglossus zonatus.Revista Chapingo Serie Ciencias Forestales y del Ambiente, 22(3), 255‒268. doi: 10.5154/r.rchscfa.2015.05.024 [ Links ]
Jha, C. K., Patel, D., Rajendran, N., & Saraf, M. (2010). Combinatorial assessment on dominance and informative diversity of PGPR from rhizosphere of Jatropha curcas L. Journal of Basic Microbiology, 50(3), 211‒217. doi: 10.1002/jobm.200900272 [ Links ]
Jha, C. K., Patel, B., & Saraf, M. (2012). Stimulation of the growth of Jatropha curcas by the plant growth promoting bacterium Enterobacter cancerogenus MSA2. World Journal of Microbiology and Biotechnology, 28, 891‒899. doi: 10.1007/s11274-011-0886-0 [ Links ]
Jha, C. K., & Saraf, M. (2012). Evaluation of multispecies plant-growth-promoting consortia for the growth promotion of Jatropha curcas L. Journal of Plant Growth Regulation, 31, 588‒598. doi: 10.1007/s00344-012-9269-5 [ Links ]
Karimi, K., Amini, J., Harighi, B., & Bahramnejad, B. (2012). Evaluation of biocontrol potential of Pseudomonas and Bacillus spp. against Fusarium wilt of chickpea. Australian Journal of Crop Science, 6(4), 695‒703. Retrieved from https://www.cabi.org/isc/FullTextPDF/2012/20123167040.pdf [ Links ]
Keneni, Y. G., Hvoslef-Eide, A. K., & Marchetti, J. M. (2019). Mathematical modelling of the drying kinetics of Jatropha curcas L. seeds. Industrial Crops and Products, 132, 12‒20. doi: 10.1016/j.indcrop.2019.02.012 [ Links ]
Latha, P., Anand, T., Prakasam, V., Jonathan, E. I., Paramathma, M., & Samiyappan, R. (2011). Combining Pseudomonas, Bacillus and Trichoderma strains with organic amendments and micronutrient to enhance suppression of collar and root rot disease in physic nut. Applied Soil Ecology, 49, 215‒223. doi: 10.1016/j.apsoil.2011.05.003 [ Links ]
Leong, W. H., Teh, S. Y., Hossain, M. M., Nadarajaw, T., Zabidi-Hussin, Z., Chin, S. Y.,... Lim, S. H. E. (2020). Application, monitoring and adverse effects in pesticide use: the importance of reinforcement of good agricultural practices (GAPs). Journal of Environmental Management, 260, 109987. doi: 10.1016/j.jenvman.2019.109987 [ Links ]
Martínez-Zavala, S. A., Barboza-Pérez, U. E., Hernández-Guzmán, G., Bideshi, D. K., & Barboza-Corona, J. E. (2020). Chitinases of Bacillus thuringiensis: phylogeny, modular structure, and applied potentials. Frontiers in Microbiology, 10, 3032. doi: 10.3389/fmicb.2019.03032 [ Links ]
Mazumdar, P., Singh, P., Babu, S., Siva, R., & Harikrishna, J. A. (2018). An update on biological advancement of Jatropha curcas L.: New insight and challenges. Renewable and Sustainable Energy Reviews, 91, 903‒917. doi: 10.1016/j.rser.2018.04.082 [ Links ]
Mohamad, O. A. A., Li, L., Ma, J. B., Hatab, S., Xu, L., Guo, J. W., … Li, W. J. (2018). Evaluation of the antimicrobial activity of endophytic bacterial populations from Chinese traditional medicinal plant licorice and characterization of the bioactive secondary metabolites produced by Bacillus atrophaeus against Verticillium dahliae. Frontiers in Microbiology, 9, 924. doi: 10.3389/fmicb.2018.00924 [ Links ]
National Center for Biotechnology Information (NCBI). (2020). BLAST: Basic Local Alignment Search Tool. Bethesda, MD, USA: National Library of Medicine (US), National Center for Biotechnology Information. Retrieved from https://blast.ncbi.nlm.nih.gov/Blast.cgi [ Links ]
Olanrewaju, O. S., Glick, B. R., & Babalola, O. O. (2017). Mechanisms of action of plant growth promoting bacteria. World Journal of Microbiology and Biotechnology, 33(11), 197. doi: 10.1007/s11274-017-2364-9 [ Links ]
Oluwatoyin, F. I., & Anthony, E. A. (2019). The effect of Fusarium oxysporum and Macrophomina phaseolina on the proximate composition of Jatropha curcas seed a biofuel plant. Journal of Biotechnology and Biomedicine, 2, 001-008. doi: 10.26502/jbb.2642-9128004 [ Links ]
Pabón-Baquero, D., Velázquez-del Valle, M. G., Evangelista-Lozano, S., León-Rodriguez, R., & Hernández-Lauzardo, A. N. (2015). Chitosan effects on phytopathogenic fungi and seed germination of Jatropha curcas L.Revista Chapingo Serie Ciencias Forestales y del Ambiente, 21(3), 241‒253. doi: 10.5154/r.rchscfa.2014.10.051 [ Links ]
Pyo, J. S., Shrestha, S. A., Park, S. H., & Kang, J. S. (2014). Biological control of plant growth using the plant growth-promoting rhizobacterium Bacillus mojavensis KJS-3. Journal of Life Science, 24(12), 1308‒1315. doi: 10.5352/jls.2014.24.12.1308 [ Links ]
Qi, J., Aiuchi, D., Tani, M., Asano, S.I., & Koike, M. (2016). Potential of entomopathogenic Bacillus thuringiensis as plant growth promoting rhizobacteria and biological control agents for tomato Fusarium Wilt. International Journal of Environmental & Agriculture Research, 2(6), 55‒63. Retrieved from https://ijoear.com/Paper-June-2016/IJOEAR-JUN-2016-4.pdf [ Links ]
Qian, Y., Shi, J., Chen, Y., Lou, L., Cui, X., Cao, R., …Tang, J. (2010). Characterization of phosphate solubilizing bacteria in sediments from a shallow eutrophic lake and a wetland: Isolation, molecular identification and phosphorus release ability determination. Molecules, 15(11), 8518‒8533. doi: 10.3390/molecules15118518 [ Links ]
Saavedra, T. M., Figueroa, G. A., & Cauih, J. G. D. (2017). Origin and evolution of tomato production Lycopersicon esculentum in México. Ciência Rural, 47(3), e20160526. doi: 10.1590/0103-8478cr20160526 [ Links ]
Saragih, T. H., Fajri, D. M. N., Mahmudy, W. F., Abadi, A. L., & Anggodo, Y. P. (2018). Jatropha curcas disease identification with extreme learning machine. Indonesian Journal of Electrical Engineering and Computer Science, 12(2), 883‒888. doi: 10.11591/ijeecs.v12.i2.pp883-888 [ Links ]
Sauka, D. H., Cozzi, J. G., & Benintende, G. B. (2005). Screening of cry2 genes in Bacillus thuringiensis isolates from Argentina. Antonie van Leeuwenhoek, International Journal of General and Molecular Microbiology, 88(2), 163‒165. doi: 10.1007/s10482-005-3368-2 [ Links ]
Schwyn, B., & Neilands, J. B. (1987). Universal chemical assay for the detection and determination of siderophores. Analytical Biochemistry, 160(1), 47‒56. doi: 10.1016/0003-2697(87)90612-9 [ Links ]
Systat Software, Inc. (2007). SigmaPlot version 10.0. San Jose California, USA: Author. Retrieved from https://systatsoftware.com/products/sigmaplot/sigmaplot-product-updates/ [ Links ]
Tamura, K., Peterson, D., Peterson, N., Stecher, G., Nei, M., & Kumar, S. (2011). MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 28(10), 2731‒2739. doi: 10.1093/molbev/msr121 [ Links ]
Uzair, B., Kausar, R., Bano, S. A., Fatima, S., Badshah, M., Habiba, U., & Fasim, F. (2018). Isolation and molecular characterization of a model antagonistic Pseudomonas aeruginosa divulging in vitro plant growth promoting characteristics. BioMed Research International, Article ID 6147380. doi: 10.1155/2018/6147380 [ Links ]
Weisburg, W. G., Barns, S. M., Pelletier, D. A., & Lane, D. J. (1991). 16S ribosomal DNA amplification for phylogenetic study. Journal of Bacteriology, 173(2), 697‒703. doi: 10.1128/jb.173.2.697-703.1991 [ Links ]
Wong-Villarreal, A., Yañez-Ocampo, G., Hernández-Nuñez, E., Corzo-González, H., Giácoman-Vallejos, G., González-Sánchez, A., …Espinosa-Zaragoza, S. (2019). Bacteria from Jatropha curcas rhizosphere, degrades aromatic hydrocarbons and promotes growth in Zea mays. Open Agriculture, 4(1), 641‒649. doi: 10.1515/opag-2019-0066 [ Links ]
Yang, L. N., He, M. H., Ouyang, H. B., Zhu, W., Pan, Z. C., Sui, Q. J., … Zhan, J. (2019). Cross-resistance of the pathogenic fungus Alternaria alternata to fungicides with different modes of action. BMC Microbiology, 19(1), 205. doi: 10.1186/s12866-019-1574-8 [ Links ]
Recibido: 14 de Abril de 2020; Aprobado: 15 de Enero de 2021











 texto em
texto em 


