Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.26 no.3 Chapingo sep./dic. 2020 Epub 25-Jun-2021
https://doi.org/10.5154/r.rchscfa.2019.12.096
Artículo científico
Poblaciones de Pinus radiata D. Don difieren en la tolerancia a bajas temperaturas y en la tasa de crecimiento
1Colegio de Postgraduados, Postgrado en Ciencias Forestales. Carretera México-Texcoco km 36.5, Montecillo. C. P. 56230. Texcoco, Estado de México, México.
2Colegio de Postgraduados, Postgrado en Recursos Genéticos y Productividad-Fisiología Vegetal. Carretera México-Texcoco km 36.5, Montecillo. C. P. 56230. Texcoco, Estado de México, México.
Introducción :
En Pinus radiata D. Don, uno de los pinos más plantados globalmente, las heladas dañan a las plantaciones en etapa de plántula.
Objetivo:
Determinar las diferencias en crecimiento y tolerancia a bajas temperaturas de poblaciones nativas (islas Guadalupe y Cedros) de P. radiata en condiciones de invernadero e intemperie, bajo niveles distintos de humedad.
Materiales y métodos:
La tolerancia a bajas temperaturas se determinó mediante el índice de daño (ID) en pruebas de congelamiento a -12 °C durante 4 h. En cada ambiente (invernadero e intemperie) se definieron dos tratamientos de humedad (riego y sequía). El ID se evaluó con el método de conductividad eléctrica en hojas primarias durante el invierno y primavera. La tasa absoluta de crecimiento (TAC) del brote terminal se obtuvo a través de la medición de altura total de las plantas.
Resultados y discusión:
En invierno y primavera se obtuvo ID promedio de 50 y 64 %, respectivamente. En invernadero, el ID fue diferente (P ≤ 0.05) entre las poblaciones, siendo mayor en Guadalupe (>59 %) que en Cedros (<42 %), tanto en invierno como en primavera. En intemperie, Cedros (64.1 %) tuvo mayor ID que Guadalupe (36.5 %) solo durante el invierno. El ID fue similar tanto en el tratamiento de humedad favorable como en la sequía. La población de Guadalupe presentó TAC mayor en ambos ambientes y condiciones de humedad.
Conclusión:
La población de Guadalupe es más sensible a las bajas temperaturas con mayor variación en el ID, debido a su dinámica de crecimiento. Las diferencias entre poblaciones son útiles en el mejoramiento genético de la especie.
Palabras clave: Índice de daño; estrés hídrico; isla Cedros; isla Guadalupe; tasa absoluta de crecimiento
Introduction:
In Pinus radiata D. Don, one of the most widely planted pines globally, frost damages plantations at the seedling stage.
Objective:
To determine differences in growth and tolerance to low temperatures of native populations (Guadalupe and Cedros islands) of P. radiata in greenhouse and outdoors conditions, under different levels of soil moisture.
Materials and methods:
Low-temperature tolerance was determined through the damage index (DI) in freezing tests at -12 °C during 4 h. In each environment (greenhouse and outdoors) two soil moisture treatments were defined (irrigation and drought). The DI was evaluated with the method of electrical conductivity in primary needles during winter and spring. The absolute growth rate (AGR) of the terminal shoot was obtained by measuring the total height of the seedlings.
Results and discussion:
Average DI of 50 and 64 % were obtained in winter and spring, respectively. In greenhouse, DI was different (P ≤ 0.05) between populations, being higher in Guadalupe (>59 %) than in Cedros (<42 %), both in winter and spring. Outdoors, Cedros (64.1 %) had a higher DI than Guadalupe (36.5 %) only during winter. DI was similar in both favorable soil moisture and drought conditions. The Guadalupe population presented higher AGRs in both environments and moisture conditions.
Conclusion:
The population of Guadalupe is more sensitive to low temperatures with greater variation in DI, due to its growth dynamics. Differences between populations are useful in the genetic improvement of the species.
Keywords: Damage index; water stress; Cedros Island; Guadalupe Island; absolute growth rate
Introducción
Pinus radiata D. Don tiene gran importancia económica global, ya que es uno de los pinos más plantados (4.1 millones de ha aproximadamente), principalmente en el hemisferio sur (Nueva Zelanda, Chile, Australia, Argentina y Sudáfrica) (Rogers, Matheson, Vargas-Hernández, & Guerra-Santos, 2006). La especie se localiza en un área geográfica reducida, con clima influenciado por las corrientes frías del océano Pacífico (McDonald & Laacke, 1990). Pinus radiata tiene cinco poblaciones nativas; tres de ellas están en la costa oeste de California (Hoeksema, Vargas-Hernandez, Rogers, Luna-Mendoza, & Thompson, 2012) y las otras dos en las islas mexicanas Guadalupe y Cedros del estado de Baja California (Rogers, 2002). Estas dos poblaciones son de clima mediterráneo, con temperaturas extremas por su altitud superior a los 290 m (Rogers, Vargas-Hernández, Matheson, & Guerra, 2005), aunque su origen es drásticamente diferente; isla Cedros tiene origen continental, geológicamente similar a la sierra Vizcaíno (Rogers et al., 2005), y la isla Guadalupe es parte de un archipiélago de origen volcánico, formado hace siete millones de años, el cual nunca ha tenido contacto con el continente (Ledig, Vargas-Hernández, & Johnsen, 1998). Esto hace que las poblaciones difieran entre sí en varias características adaptativas (Millar, 1999) como la tasa de crecimiento y la tolerancia a la salinidad (Burdon, 2001), pero se desconoce su nivel de tolerancia al frío (Mead, 2013).
Las bajas temperaturas y la sequía representan las restricciones ambientales más importantes en la distribución de las plantas (Harrison et al., 2010) y su productividad (Anjum et al., 2011). Ambas variables ambientales cambian con la altitud (Viveros-Viveros et al., 2009), latitud, longitud (Robson, Rasztovits, Aphalo, Alia, & Aranda, 2013) y con la época del año (Charra-Vaskou, Charrier, Wortemann, & Beikircher, 2012). Los efectos negativos que tienen dichos factores sobre el crecimiento, productividad y supervivencia de los individuos promueven la adaptación evolutiva y la diferenciación de poblaciones (Blödner, Skroppa, Johnsen, & Polle, 2005; Larcher, 2005; Palacio, Milla, & Montserrat-Martí, 2005).
En P. radiata, las heladas tempranas (en otoño) y tardías (en primavera) dañan los tejidos meristemáticos y el follaje juvenil de las plántulas (Greer, Robinson, Hall, Klages, & Donnison, 1998). En estos periodos, la resistencia a bajas temperaturas varía ampliamente, debido a las diferencias fenológicas en el crecimiento del brote (Neuner, 2014). Bachofen, Wohlgemuth, Ghazoul, y Moser (2016) encontraron que la resistencia al frío no difirió entre poblaciones de P. sylvestris L., P. nigra Arnold y P. halepensis Mill., pero sí disminuyó de invierno a primavera (febrero a mayo); además, las poblaciones de P. sylvestris y P. nigra, adaptadas a la sequía, resistieron a las heladas durante la fase más sensible (primavera).
A pesar del aumento de temperatura previsto en las próximas décadas (Intergovernmental Panel on Climate Change [IPCC], 2013), los modelos climáticos revelan la persistencia de fríos extremos irregulares en invierno (Kodra, Steinhaeuser, & Ganguly, 2011). Estos cambios bruscos en temperatura con frecuencia rebasan el umbral de tolerancia, induciendo daños a corto y largo plazo (Man, Lu, & Dang, 2017a; Williams, Henry, & Sinclair, 2015). Las plantas son más propensas a sufrir daños por congelamiento con estas fluctuaciones inesperadas (Kalcsits, Silim, & Tanino, 2009; Matusick, Ruthrof, Brouwers, & Hardy, 2014), debido a la asincronía fenológica con el ambiente (Ensminger, Hüner, & Busch, 2009; Man, Lu, & Dang, 2017b). Las fluctuaciones inusuales en temperatura y humedad pueden generar condiciones severas de estrés, a las que no están adaptadas las poblaciones naturales, ocasionando efectos negativos en el crecimiento y supervivencia. En este sentido, el objetivo del presente estudio fue determinar las diferencias en crecimiento y tolerancia a bajas temperaturas en hojas primarias de plantas de P. radiata de las islas Cedros y Guadalupe, creciendo en dos ambientes (invernadero e intemperie) y condiciones distintas de humedad.
Materiales y métodos
Selección del germoplasma
Se utilizó germoplasma de P. radiata de dos poblaciones nativas en isla Cedros e isla Guadalupe, ambas del estado de Baja California, México. De cada población se incluyeron dos subpoblaciones separadas espacialmente por latitud y altitud (Cuadro 1).
La semilla se sembró en contenedores de 200 mL, en un sustrato de corteza, perlita y tepezil (50:30:10) y 5 g·L-1 de fertilizante de liberación controlada (Multicote®) con riego a capacidad de campo. A los seis meses se seleccionaron plantas de tamaño homogéneo de cada una de las subpoblaciones para el experimento: 29.8 ± 2.3 cm de altura en plantas de la población Guadalupe, y 22.4 ± 2.1 cm de altura en Cedros.
Cuadro 1 Ubicación geográfica de las fuentes de semilla de Pinus radiata y condiciones de temperatura (TMA) y precipitación (PMA) media anual en las islas.
| Población | TMA1 (°C) | PMA1 (mm) | Subpoblación | Latitud (N) | Longitud (O) | Altitud (m) |
|---|---|---|---|---|---|---|
| Isla Cedros (C) | 19.9 | 85 | C1 | 28° 10.741' | 115° 12.570' | 519 |
| C2 | 28° 15.314 | 115° 12.883' | 496 | |||
| Isla Guadalupe (G) | 17.7 | 130 | G1 | 29° 09.357' | 118° 18.387' | 988 |
| G2 | 29° 09.600' | 118° 17.527' | 710 |
Establecimiento del experimento
El experimento se estableció en el vivero del Postgrado en Ciencias Forestales del Colegio de Postgraduados, campus Montecillo, en dos ambientes de crecimiento: contenedores individuales (invernadero) y camas de crecimiento (intemperie). Durante el periodo diciembre 2018 a marzo del 2019, la temperatura promedio fue 4.7 °C mayor y con menor fluctuación diurna en el invernadero (14.8 °C con mínima promedio de 6.3 °C y máxima promedio de 24.4 °C) con respecto a la intemperie (10.1 °C con mínima promedio de 0.4 °C y máxima promedio de 22.8 °C). La humedad relativa promedio en el invernadero fue de 63.3 % con variación diurna promedio de 28.8 a 98.3 %, y a la intemperie fue de 57.3 % con variación promedio de 24.6 a 93.1 %. En el invernadero, el 26 octubre de 2018, 96 plantas de cada subpoblación se trasplantaron a tubos de PVC de 10 cm de diámetro y 100 cm de longitud que contenían un sustrato de suelo agrícola local, arena y tepezil en proporción 50:30:20. En intemperie, el 22 noviembre de 2018, 80 plantas de cada subpoblación se trasplantaron a 20 cm x 15 cm entre hileras y plantas en camas de crecimiento con suelo agrícola local. En cada ambiente se definieron dos tratamientos de humedad (S0 y S1) con base en la curva de retención de los sustratos. En el nivel S0, el contenido de humedad se mantuvo entre 76 y 100 % de su humedad aprovechable (40 a 47 % de humedad en contenedores y 26 a 30 % de humedad en camas de crecimiento), mientras que en el nivel S1, el contenido de humedad en los contenedores se mantuvo entre 10 y 25 % de la humedad aprovechable, y sin riego en las camas de crecimiento, evitando el ingreso de agua durante la temporada de lluvias. En cada ambiente se utilizó un diseño en parcelas divididas con arreglo factorial 2 x 4. En las parcelas grandes se establecieron los tratamientos de humedad (S0 y S1), y en las pequeñas, las subpoblaciones con cuatro repeticiones. Cada unidad experimental estuvo representada por 12 plantas en invernadero y 10 plantas en las camas de crecimiento.
Evaluación del daño por temperatura
Con base en pruebas preliminares (enero 2019) para determinar el tipo de hoja y su posición en el tallo, se decidió utilizar tres hojas primarias cercanas al ápice por planta, en una muestra de seis plantas elegidas al azar por unidad experimental. En todas las pruebas se utilizaron las mismas plantas. Las acículas se lavaron con agua destilada y se cortaron en secciones de 10 mm, descartando la punta y la base. Cada muestra se separó en dos partes con un peso fresco similar, medido en una balanza analítica (Chyo Balance Corp, precisión 0.1 mg), y se colocaron en tubos de ensayo; una parte se sometió a congelamiento (Ft) y otra parte se utilizó como referencia o control (Fc).
La primera prueba de exposición al frío se hizo durante el invierno (6 de febrero del 2019) y la segunda se realizó en primavera (24 de abril del 2019). En cada ocasión, los tubos con la fracción Ft se colocaron en gradillas dentro de una cámara de congelamiento (modelo M1212, Manufacturas Ind. Universo, México), con control automático de temperatura, y los tubos con la fracción Fc se mantuvieron a temperatura ambiente (22 a 23 °C). Las fracciones Ft se sometieron a una rutina de descenso gradual de temperatura en la cámara, iniciando con una estabilización a 4 °C durante una hora y después un descenso de 2 °C por hora, durante 8 h, hasta alcanzar -12 °C. Las muestras se mantuvieron a esta temperatura por 4 h y, posteriormente, se dejaron reposar hasta alcanzar nuevamente 4 °C, para iniciar la evaluación.
El daño ocasionado en las hojas se determinó con la conductividad eléctrica que mide la concentración de electrolitos liberados por los tejidos vegetales después de exponerse a temperaturas de congelamiento (Climent, Costa e Silva, Chambel, Pardos, & Almeida, 2009). Después de someter la fracción Ft al congelamiento, se agregaron 10 mL de agua desionizada a las dos fracciones (Ft y Fc) y se dejaron reposar durante 24 h a temperatura ambiente. La conductividad eléctrica (C1) se midió con un conductímetro LAQUAtwin modelo EC-33. Después, las muestras se esterilizaron en autoclave a 120 °C durante 15 min, para matar el tejido y medir la conductividad eléctrica total (C2) 12 h después. A cada muestra se realizaron tres lecturas de conductividad cada 20 min y se utilizó el promedio de estas en los cálculos del daño ocasionado. Con los datos de conductividad eléctrica estandarizados a una masa de 100 mg de tejido, se calculó la conductividad relativa (R = 100*C1/C2) de cada fracción (Rt y Rc). El índice de daño celular (ID) para cada muestra se calculó como ID = 100 * (Rt - Rc)/(100 - Rc).
Evaluación del crecimiento del brote terminal
La tasa absoluta de crecimiento (TAC, mm·d-1) del brote terminal se obtuvo a través de la medición de altura total de las plantas cada dos semanas, a partir del 26 de octubre en el invernadero y del 22 de noviembre en las camas de crecimiento (intemperie), hasta el 8 de mayo en ambas condiciones. La TAC para cada planta (Arias et al., 2019) se calculó con la fórmula TAC = (A2 - A1)/(T2 - T1), donde A1 y A2 son la altura inicial y final de la planta (mm), respectivamente, al tiempo inicial (T1) y final (T2) de cada periodo de medición.
Análisis estadístico
Los datos se sometieron a un análisis de varianza con el procedimiento MIXED en SAS 9.0 (SAS Institute, 2003), para evaluar los efectos del tratamiento de humedad y de las poblaciones y subpoblaciones en cada ambiente por separado, con el modelo estadístico:
donde,
Yijkl |
valor de la ijkl -ésima observación |
µ |
media general |
Bi |
efecto del bloque |
Sj |
efecto del tratamiento de humedad |
Bi*Sj |
efecto de la interacción bloque x tratamiento de humedad |
Pk |
efecto de población |
Sj*Pk |
efecto de la interacción tratamiento de humedad x población |
Subl(Pk) |
efecto de subpoblación dentro de población |
Sj*Subl(Pk) |
efecto de la interacción tratamiento de humedad x subpoblación dentro de población |
Eiikl |
error experimental |
La correlación de Pearson entre ID y TAC se estimó con los valores promedio de ID por subpoblación en cada tratamiento de humedad (n = 8) y periodo por cada ambiente, y los datos promedio de TAC durante los periodos de medición. Asimismo, para cada tratamiento de humedad (n = 16), se hizo un análisis de correlación entre ID y TAC con los valores promedio por subpoblación, incluyendo los dos ambientes de crecimiento y los dos periodos de evaluación.
Resultados y discusión
Daño por bajas temperaturas
En invierno se obtuvo un ID promedio de 50 %, mientras que en primavera fue 64 %. El ID ocasionado por las bajas temperaturas en los tejidos fue similar tanto en el tratamiento de humedad favorable como en la sequía; sin embargo, entre poblaciones sí se encontraron diferencias significativas (P < 0.05), excepto en primavera para las plantas con crecimiento en intemperie. A nivel de subpoblaciones, solo las plantas en intemperie, durante el invierno, mostraron diferencias significativas (P < 0.01). De la misma manera, la interacción tratamiento de humedad*población fue significativa solo en primavera dentro del invernadero (P = 0.02).
En condiciones naturales, las poblaciones de P. radiata están expuestas a temperaturas mínimas extremas de -5 °C con 300 días sin heladas al año (McDonald & Laacke, 1990); sin embargo, en estudios realizados fuera de su ambiente natural, el follaje de plántulas menores de dos años sufre deterioro al exponerse a temperaturas entre -3 y -6 °C en verano y entre -12 y -14 °C en invierno (Burdon, 2001). En este estudio, el ID en hojas primarias de plantas de 10 y 12 meses de edad fue de 50 y 64 %, durante el invierno y primavera, respectivamente, con una temperatura letal (TL50) cercana a -12 °C. Climent et al. (2009) señalan una TL50 entre -9 y -12 °C en plantas de 18 meses de la misma especie.
Diferencias entre poblaciones y subpoblaciones
La Figura 1 muestra el ID en las poblaciones y subpoblaciones evaluadas de P. radiata. En el invernadero, la población de isla Guadalupe presentó mayor ID en invierno (59.9 %) y primavera (75.0 %) que la isla Cedros (41.4 y 37.5 % en invierno y primavera, respectivamente); sin embargo, a la intemperie se encontró mayor ID en Cedros (64.1 %) que en Guadalupe (36.5 %) en invierno, mientras que en primavera presentaron ID similar. En las dos condiciones (dentro y fuera del invernadero), el ID cambió más de invierno a primavera en isla Guadalupe, lo cual implica que esta población tiene mayor sensibilidad estacional o fenológica a las bajas temperaturas que la de Cedros.
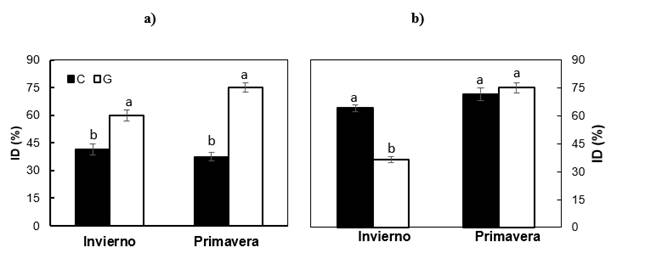
Figura 1 Índice de daño (ID; media ± error estándar) ocasionado por bajas temperaturas (-12 °C, 4 h) en hojas primarias de plantas de Pinus radiata de las islas Cedros (C) y Guadalupe (G) creciendo en invernadero (a) y a la intemperie (b). Pares de barras con letras distintas indican ID estadísticamente diferente entre poblaciones (P = 0.05).
Larcher (2005) señala que las diferencias de ID entre ecotipos y entre periodos de evaluación se deben a diferencias en la capacidad fisiológica de aclimatación al frío; es decir, a diferencias en el metabolismo de los carbohidratos, las características de las membranas y las proteínas asociadas al proceso de congelamiento (Pearce, 2001; Roden, Canny, Huang, & Ball, 2009). Entre estas se incluyen proteínas específicas que inhiben la formación de hielo (proteínas anticongelantes), reducen la velocidad de congelamiento o protegen al protoplasma celular de los efectos del descenso de temperatura y la deshidratación, como las deshidrinas (Ambroise et al., 2020; Larcher, 2005; Sharma & Deswal, 2014). Se ha demostrado que el origen geográfico influye en la fenología, afectando la condición fisiológica de las plantas (Aldrete, Mexal, & Burr, 2008) y la síntesis de dichas moléculas (Kreyling et al., 2012; Larcher, 2005). Varios estudios muestran que las dos islas difieren en condiciones ecológicas, por lo que se consideran dos ecorregiones (González-Abraham et al., 2010). En general, el ambiente en isla Guadalupe es más favorable en humedad relativa por la abundancia de niebla (Oberbauer, 2006; Perry, 2009), nivel de aridez y frecuencia de temperaturas extremas (Hoeksema et al., 2012). Estas condiciones, además del aislamiento geográfico, han diferenciado las poblaciones, al grado de considerarse variedades distintas (Ledig et al., 1998; Rogers et al., 2006). En ensayos de campo, la población de Guadalupe presenta mayor crecimiento y productividad que la de Cedros (Burdon, Bannister, & Low, 1992).
De acuerdo con el Cuadro 2, las subpoblaciones mostraron un comportamiento similar en cada población, con excepción de G2 fuera del invernadero, la cual presentó menor ID que G1 en invierno. En general, no hay evidencias de una diferenciación adaptativa entre las subpoblaciones muestreadas en cada isla, a pesar de las diferencias en elevación, debido probablemente a que todavía existe suficiente flujo genético entre ellas (Rogers, 2004). Estos resultados contrastan con los descritos por Viveros-Viveros et al. (2009) en P. hartwegii Lindl. y Sáenz-Romero y Tapia-Olivares (2008) en P. devoniana Lindl., quienes encontraron diferencias en ID asociadas a la elevación del sitio de origen.
Cuadro 2 Índice de daño ocasionado por baja temperatura (-12 °C, 4 h) en hojas primarias de plantas de dos subpoblaciones de Pinus radiata de las islas Cedros y Guadalupe.
| Población | Subpoblación | Invernadero | Intemperie | ||
|---|---|---|---|---|---|
| Invierno | Primavera | Invierno | Primavera | ||
| Isla Cedros | C1 | 37.3 ± 8.5a | 30.6 ± 5.2 a | 64.8 ± 4.7a | 70.0 ± 9.7a |
| C2 | 45.6 ± 8.7a | 44.7 ± 4.2a | 63.5 ± 4.8a | 73.3 ± 8.8a | |
| Isla Guadalupe | G1 | 57.5 ± 8.6a | 80.6 ± 6.8a | 49.8 ± 5.0a | 78.3 ± 9.6a |
| G2 | 62.3 ± 9.0a | 68.9 ± 7.6a | 24.3 ± 4.3b | 71.9 ± 10.3a | |
Media ± error estándar. Letras iguales indican que no existen diferencias significativas entre subpoblaciones (P = 0.05).
Efecto de la humedad del suelo
La Figura 2 muestra que el tratamiento de humedad del suelo afectó de manera diferente a las poblaciones en la tolerancia al daño por bajas temperaturas. En invernadero, durante la primavera, las diferencias de daño entre poblaciones fueron más evidentes en sequía que en condiciones favorables de humedad; la restricción de humedad aumentó ligeramente el ID en Guadalupe, pero lo redujo en Cedros. En el invierno, las diferencias del ID entre las poblaciones fueron similares en los dos tratamientos de humedad. En las plantas expuestas a la intemperie durante el invierno y primavera, las diferencias del ID entre poblaciones no fueron significativas, independientemente del tratamiento de humedad.

Figura 2 Humedad del suelo (S0 = riego; S1 = sequía) e índice de daño (ID) promedio de las poblaciones de Pinus radiata en invierno (──) y primavera (- - -) en plantas de las islas Cedros (() y Guadalupe (○), creciendo en invernadero (a) y a la intemperie (b).
La tolerancia a las heladas y a la sequía tienen mucho en común; en ambas, la base de la tolerancia radica en la capacidad del protoplasma para resistir el efecto deshidratante de la privación directa o indirecta de agua (Larcher, 2000). Uno de los procesos metabólicos involucrados incluye la síntesis o acumulación de moléculas en el ajuste osmótico, como azúcares solubles, prolina y betaínas (Ambroise et al., 2020; Arias, Bucci, Scholz, & Goldstein, 2015; Larcher, 2005). Es concebible que dichos mecanismos se activen por la exposición a sequías severas de corta duración; por lo tanto, una sequía previa a la temporada de heladas podría desencadenar los mecanismos de adaptación a bajas temperaturas, con un menor daño (Kreyling et al., 2012; Walter, Jentsch, Beierkuhnlein, & Kreyling, 2013). En el invernadero, dicho efecto se registró en las dos poblaciones durante el invierno y en la población de Cedros en la primavera; mientras que a la intemperie solo sucedió en Guadalupe, independientemente del periodo evaluado. Estudios en Quercus robur L. (Čehulić et al., 2019; Thomas & Ahlers, 1999) y en Q. petraea (Matt.) Liebl. (Thomas & Ahlers, 1999) señalan que la sequía puede aumentar la susceptibilidad a heladas al modificar la dinámica de crecimiento.
Tasa absoluta de crecimiento
En la mayoría de los intervalos de medición, las diferencias en la TAC fueron significativas (P ≤ 0.05) entre tratamientos, entre poblaciones y en la interacción de estos factores en las dos condiciones ambientales (Cuadro 3). Entre subpoblaciones también se encontraron diferencias durante algunos periodos de crecimiento en invernadero, pero no en intemperie.
Cuadro 3 Nivel de significancia en cada intervalo de medición (In) de la tasa absoluta de crecimiento (mm·d-1) en longitud del tallo de dos poblaciones de Pinus radiata. Las plantas fueron sometidas a dos tratamientos de humedad en invernadero y a la intemperie.
| Ambiente | Factor | GL | DF | I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 | I9 | I10 | I11 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Invernadero | T | 1 | 3 | * | ** | ns | ns | * | ** | ** | * | ns | * | * |
| P | 1 | 18 | ** | ** | ** | ** | ** | ** | * | * | ** | * | * | |
| TxP | 1 | 18 | * | * | * | ns | ** | * | * | * | ns | ** | * | |
| SP | 2 | 18 | ns | ns | ns | * | * | ns | * | * | ns | ns | * | |
| TxSP | 2 | 18 | ns | ns | ns | ns | ns | ns | ns | ns | ns | * | ns | |
| Intemperie | T | 1 | 3 | - | - | * | * | * | ** | ** | ** | ** | ** | * |
| P | 1 | 18 | - | - | ** | * | * | ** | ** | ** | * | * | * | |
| TxP | 1 | 18 | - | - | ns | ns | * | * | * | * | * | * | * | |
| SP | 2 | 18 | - | - | ns | ns | ns | * | ns | ns | ns | ns | ns | |
| TxSP | 2 | 18 | - | - | ns | ns | ns | ns | ns | ns | * | ns | ns |
T = tratamiento de humedad, P = población, SP = subpoblación dentro de población; GL = grados de libertad del numerador (factor); DF = grados de libertad del denominador (error); In = intervalo de dos semanas a partir del 26 de octubre del 2018 al 08 de mayo del 2019. *significativo con P = 0.05 **significativo con P = 0.01; ns = no significativo.
Las plantas en S0 (riego) mantuvieron una TAC mayor que en S1 (sequía) dentro y fuera del invernadero, pero la dinámica de crecimiento fue distinta en ambas condiciones, tal como se observa en la Figura 3. En el invernadero se presentaron varios ciclos de crecimiento; a partir del día 82 después del trasplante (DDT) se notó el efecto de la humedad con un crecimiento acelerado en S0, mientras que en S1, el crecimiento se reactivó hasta después de 112 DDT, luego a los 142 DDT alcanzó una TAC similar a la de S0 (2.5 mm·d-1) y, nuevamente, descendió a valores de 0.5 mm·d-1 a los 164 DDT. A la intemperie, las plantas en S1 mantuvieron una fase de crecimiento lento (TAC < 1.0 mm·d-1) durante todo el experimento, mientras que en S0 presentaron una TAC baja solo la primera parte del invierno, ya que a los 89 DDT reactivaron el crecimiento hasta alcanzar una TAC máxima de 2.5 mm·d-1 a los 133 DDT.
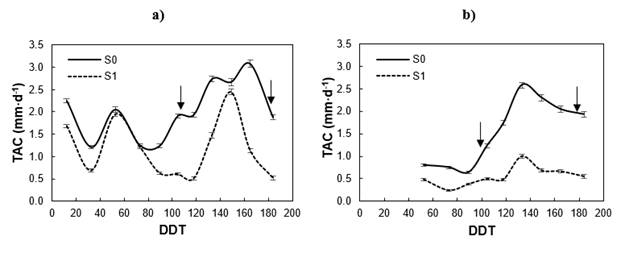
Figura 3 Tasa absoluta de crecimiento (TAC) de la longitud del tallo en invernadero (a) y a la intemperie (b) por tratamiento de humedad (S0 = riego; S1 = sequía). DDT: Días después del trasplante en invernadero; (↓) fechas en que se determinó el índice de daño.
P. radiata es una especie policíclica que ha evolucionado en un clima mediterráneo con influencia de la humedad costera; en la etapa juvenil, la especie está adaptada para crecer todo el año cuando el clima es adecuado (Mead, 2013), pero su dinámica de crecimiento es muy sensible a los cambios en humedad del suelo (Figura 3) y temperatura del aire. En invernadero, el crecimiento del brote nunca cesó y no se observó la formación de una yema terminal, como ocurre en la mayoría de las especies de pino de clima templado-frío (Jansons, Matisons, Libiete-Zālīte, Baders, & Rieksts-Riekstiņš, 2013; Mead, 2013).
La diferente dinámica de crecimiento del brote en las plantas dentro y fuera del invernadero muestra sensibilidad al cambio de las condiciones ambientales. Las plantas a la intemperie estuvieron más expuestas a bajas temperaturas durante el invierno (mínima promedio de 0.4 °C). Esta variabilidad fenológica en el patrón de crecimiento del brote, ante los cambios en humedad y temperatura, muestran la complejidad de P. radiata en la tolerancia al frío, en comparación con otros pinos de crecimiento monocíclico como P. pseudostrobus Lindl., P. montezumae Lamb. y P. hartwegii (Viveros-Viveros, Sáenz-Romero, López-Upton, & Vargas-Hernández, 2007). Climent et al. (2009) y Bachofen et al. (2016) mencionan que es más complejo interpretar el daño por heladas en pinos de clima mediterráneo costero, con múltiples ciclos de crecimiento y más sensibles a las fluctuaciones de humedad y temperatura, como P. radiata, que en especies de origen continental alpino.
La población de Guadalupe presentó una TAC mayor que la de Cedros en los dos ambientes, pero las diferencias y los picos máximos (2.6 mm·d-1 en intemperie y 3.2 mm·d-1 en invernadero) fueron mayores en invernadero (Figuras 4a y 4b). Solo en las subpoblaciones de Cedros se encontraron diferencias en TAC, especialmente en invernadero (Figuras 4c y 4d), ya que en las de Guadalupe, la TAC fue similar entre ellas, en los dos ambientes (Figuras 4e y 4f). Las diferencias en TAC entre poblaciones pueden atribuirse a diferencias genéticas asociadas a las condiciones ecológicas de las islas. Burdon et al. (1992) señalan que, a los 12 años, la población de Cedros presentó menor tasa de crecimiento en altura que la de Guadalupe.

Figura 4 Tasa absoluta de crecimiento (TAC; mm·d-1) de la longitud del tallo de Pinus radiata de las poblaciones (a, b) y subpoblaciones (c, d, e, f) nativas de las islas Cedros (C) y Guadalupe (G) en condiciones de invernadero (a, c, e) e intemperie (b, d, f). DDT: Días después del trasplante en invernadero; (↓) fechas en que se determinó el índice de daño.
Relación entre ID y TAC
Acorde con la Figura 5, la correlación de ID con TAC fue positiva, pero relativamente baja (r < 0.50). Las correlaciones más altas se obtuvieron en invierno (r ≥ 0.46), independientemente del ambiente de crecimiento; en cambio en primavera, la correlación fue más baja (0.25 ≤ r ≤ 0.28). A pesar de que la TAC no tuvo relación clara con el ID, el signo positivo de la correlación indica que las plantas con mayor actividad meristemática son más susceptibles a daños por bajas temperaturas, tal como se ha demostrado en otras coníferas (Fløistad & Granhus, 2010; Sogaard, Granhus, & Johnsen, 2009). La relación positiva entre ID y TAC fue más evidente en condiciones favorables de humedad que en condiciones de sequía.

Figura 5 Correlación entre el índice de daño (ID) en hojas primarias y la tasa absoluta de crecimiento (TAC) en invierno (a y b) y primavera (c y d) en plantas de Pinus radiata de las islas Cedros (triángulos) y Guadalupe (círculos) con humedad del suelo favorable (negro) y sequía (blanco), en condiciones de invernadero (a y c) y a la intemperie (b y d).
Cuando el análisis de correlación se hizo por cada tratamiento de humedad (n = 16), la correlación fue mayor en S0 que en S1 (Figura 6). La correlación aumenta (r = 0.77) si se consideran solo los datos de las subpoblaciones de Guadalupe (n = 8) o si se excluyen los datos de las dos subpoblaciones de Cedros en invierno (n = 14), debido a que sus plantas prácticamente no crecieron en este periodo. La sequía redujo drásticamente la TAC y alteró la relación entre ID y TAC. Esto explica, en parte, las diferencias observadas en ID entre las poblaciones con respecto a la tasa y dinámica estacional de crecimiento del brote dentro y fuera del invernadero. La población Cedros tiene una TAC intrínseca menor que Guadalupe y también muestra una mayor tolerancia a daños por heladas, resultados que coinciden con información previa (Mead, 2013). La mayor sensibilidad de la población Guadalupe al efecto de la humedad del suelo en ID (Figura 2) y en la dinámica de crecimiento del brote (Figura 5) implica que hay diferencias importantes entre poblaciones en los mecanismos de respuesta y adaptación al estrés hídrico, como resultado de los procesos de adaptación local en las islas donde han evolucionado.
Conclusiones
Las poblaciones de Pinus radiata en isla Cedros e isla Guadalupe difieren notoriamente en la tolerancia a bajas temperaturas y en la tasa y dinámica de crecimiento del brote dentro y fuera del invernadero. La población de isla Guadalupe es más sensible en el índice de daño (ID) en función del ambiente, debido a los cambios en su dinámica de crecimiento cuando las condiciones se modifican. La población de isla Cedros tuvo menor tasa de crecimiento y menor ID, debido a su adaptación al ambiente más adverso en que ha evolucionado. Existe relación positiva entre ID y la tasa absoluta de crecimiento, especialmente en condiciones favorables de humedad. Las diferencias en productividad y tolerancia a bajas temperaturas de estas poblaciones son de gran utilidad en la domesticación de P. radiata en el contexto actual de cambio climático, por lo que los esfuerzos de conservación in situ de estos recursos genéticos adquieren mayor relevancia.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca de apoyo económico otorgado a Gardenia de Jesús-Reyes durante su programa de Maestría en Ciencias en el Colegio de Postgraduados.
REFERENCIAS
Aldrete, A., Mexal, J. G., & Burr, K. E. (2008). Seedling cold hardiness, bud set, and bud break in nine provenances of Pinus greggii Engelm. Forest Ecology and Management, 255(11), 3672-3676. doi: 10.1016/j.foreco.2008.02.054 [ Links ]
Ambroise, V., Legay, S., Guerriero, G., Hausman, J.-F., Cuypers, A., & Sergeant, K. (2020). The roots of plant frost hardiness and tolerance. Plant Cell Physiology, 61(1), 3-20. doi: 10.1093/pcp/pcz196 [ Links ]
Anjum, S. A., Xie, X. Y., Wang, L. C., Saleem, M. F., Man, C., & Lei, W. (2011). Morphological, physiological, and biochemical responses of plants to drought stress. African Journal of Agricultural Research, 6(9), 2026-2032. doi: 10.5897/AJAR10.027 [ Links ]
Arias, N. S., Bucci, S. J., Scholz, F. G., & Goldstein, G. (2015). Freezing avoidance by supercooling in Olea europaea cultivars: the role of apoplastic water, solute content and cell wall rigidity. Plant, Cell and Environment, 38(10), 2061-2070. doi: 10.1111/pce.12529 [ Links ]
Arias, R. C., Reyes, J. J., Ray, J. V., Benítez, D. G., Hernández, L. G., & Ledea, J. L. (2019). Indicadores morfométricos en nuevas variedades megatérmicas de Cenchrus purpureus tolerantes al estrés hídrico. Tropical and Subtropical Agroecosystems, 22(1), 115-125. Retrieved from http://www.revista.ccba.uady.mx/ojs/index.php/TSA/article/view/ 2784/ 1223 [ Links ]
Bachofen, C., Wohlgemuth, T., Ghazoul, J., & Moser, B. (2016). Cold temperature extremes during spring do not limit the range shift of Mediterranean pines into regions with intermittent frost. Functional Ecology, 30(6), 856-865. doi: 10.1111/1365-2435.12581 [ Links ]
Blödner, C., Skroppa, T., Johnsen, O., & Polle, A. (2005). Freezing tolerance in two Norway spruce (Picea abies [L.] Karst.) progenies is physiologically correlated with drought tolerance. Journal of Plant Physiology, 162(5), 549-558. doi: 10.1016/j.jplph.2004.09.005 [ Links ]
Burdon, R. D. (2001). Pinus radiata. In F. T. Last. (Ed.), Ecosystems of the world. Tree crop ecosystems (vol. 19, pp. 99-161). Amsterdam, The Netherlands: Elsevier. [ Links ]
Burdon, R. D., Bannister, M. H., & Low, C. B. (1992). Genetic survey of Pinus radiata. 2: Population comparisons for growth rate, disease resistance, and morphology.New Zealand Journal of Forestry Science , 22(2/3), 138-159. Retrieved from https://www.researchgate.net/publication/288957107_Genetic_survey_of_Pinus_radiata_2_Population_comparisons_for_growth_rate_disease_resistance_and_morphology [ Links ]
Čehulić, I., Sever, K., Bogdan, I., Jazbec, A., Škvorc, Ž., & Bogdan, S. (2019). Drought impact on leaf phenology and spring frost susceptibility in a Quercus robur L. provenance trial. Forests, 10(1), 50. doi: 10.3390/f10010050 [ Links ]
Charra-Vaskou, K., Charrier, G., Wortemann, R., & Beikircher, B. (2012). Drought and frost resistance of trees: A comparison of four species at different sites and altitudes. Annals of Forest Science, 69(3), 325-333. doi: 10.1007/s13595-011-0160-5 [ Links ]
Climent, J., Costa e Silva, F., Chambel, M. R., Pardos, M., & Almeida, M. H. (2009). Freezing injury in primary and secondary needles of Mediterranean pine species of contrasting ecological niches. Annals of Forest Science, 66(4), 407-407. doi: 10.1051/forest/2009016 [ Links ]
Ensminger, I., Hüner, N. P. A., & Busch, F. (2009). Conifer cold hardiness, climate change and the likely effects of warmer temperatures on photosynthesis. In L. V. Gusta, M. E. Wisniewski, & K. K. Tanino (Eds.), Plant cold hardiness. From the laboratory to the field (pp. 249-261). London, UK: CAB International. [ Links ]
Fløistad, I. S., & Granhus, A. (2010). Bud break and spring frost hardiness in Picea abies seedlings in response to photoperiod and temperature treatments. Canadian Journal of Forest Research, 40(5), 968-976. doi: 10.1139/X10-050 [ Links ]
González-Abraham, C. E., Garcillán, P. P., & Ezcurra, E. (2010). Ecorregiones de la península de Baja California: una síntesis. Boletín de la Sociedad Botánica de México, 87, 69-82. doi: 10.17129/botsci.302 [ Links ]
Greer, D. H., Robinson, L. A., Hall, A. J., Klages, K., & Donnison, H. (1998). Frost hardening of Pinus radiata seedlings: effects of temperature on relative growth rate, carbon balance and carbohydrate concentration. Tree Physiology, 20(2), 107-114. doi: 10.1093/treephys/20.2.107 [ Links ]
Harrison, S. P., Prentice, I. C., Barboni, D., Kohfeld, K. E., Ni, J., & Sutra, J.-P. (2010). Ecophysiological and bioclimatic foundations for a global plant functional classification. Journal of Vegetation Science, 21(2), 300-317. doi: 10.1111/j.1654-1103.2009.01144.x [ Links ]
Hoeksema, J. D., Vargas-Hernández, J. J., Rogers, D. L., Luna-Mendoza, L., & Thompson, J. N. (2012). Geographic divergence in a species‐rich symbiosis: interactions between Monterey pines and ectomycorrhizal fungi. Ecology, 93(10), 2274-2285. Retrieved from https://www.researchgate.net/publication/233786825_Geographic_divergence_in_a_species-rich_symbiosis_Interactions_between_Monterey_pines_and_ectomycorrhizal_fungi [ Links ]
Intergovernmental Panel on Climate Change (IPCC). (2013). Climate Change 2013: The physical science basis. Working group I contribution to the fifth assessment report of the Intergovernmental Panel on Climate Change. In T. F. Stocker, D. Qin, G.-K. Plattner, M. Tignor, S. K. Allen, J. Boschung, A. Nauels, …P. M. Midgley (Eds.). Cambridge, UK and New York, USA: Cambridge University Press. [ Links ]
Jansons, A., Matisons, R., Libiete-Zālīte, Z., Baders, E., & Rieksts-Riekstiņš, J. (2013). Relationships of height growth of Lodgepole pine (Pinus contorta var. latifolia) and Scots pine (Pinus sylvestris) with climatic factors in Zvirgzde, Latvia. Baltic Forestry, 19(2), 236-244. Retrieved from https://www.researchgate.net/publication/286021721_Relationships_of_Height_Growth_of_Lodgepole_Pine_Pinus_contorta_var_latifolia_and_Scots_Pine_Pinus_sylvestris_with_Climatic_Factors_in_Zvirgzde_Laivia [ Links ]
Kalcsits, L., Silim, S., & Tanino, K. (2009). The influence of temperature on dormancy induction and plant survival in woody plants In L. V. Gusta, M. E. Wisniewski, & K. K. Tanino (Eds.), Plant cold hardiness. From the laboratory to the field (pp. 249-261). London, UK: CAB International. [ Links ]
Kodra, E., Steinhaeuser, K., & Ganguly, A. R. (2011). Persisting cold extremes under 21st‐century warming scenarios. Geophysical Research Letters, 38(8), 1-5. doi: 10.1029/2011GL047103 [ Links ]
Kreyling, J., Wiesenberg, G. L. B., Thiel, D., Wohlfart, C., Huber, G., Walter, J., & Beierkuhnleina, C. (2012). Cold hardiness of Pinus nigra Arnold as influenced by geographic origin, warming, and extreme summer drought. Environmental and Experimental Botany, 78, 99-108. doi: 10.1016/j.envexpbot.2011.12.026 [ Links ]
Larcher, W. (2000). Temperature stress and survival ability of Mediterranean sclerophyllous plants. Plant Biosystems, 134(3), 279-295. doi: 10.1080/11263500012331350455 [ Links ]
Larcher, W. (2005). Climatic constraints drive the evolution of low temperature resistance in woody plants. Journal of Agricultural Meteorology, 61(4), 189-202. doi: 10.2480/agrmet.61.189 [ Links ]
Ledig, T., Vargas-Hernández, J. J., & Johnsen, K. H. (1998). The conservation of forest genetic resources: case histories from Canada, Mexico, and the United States. Journal of Forestry, 96(1), 32-41. doi: 10.1093/jof/96.1.32 [ Links ]
Man, R., Lu, P., & Dang, Q-L. (2017a). Cold hardiness of white spruce, black spruce, jack pine, and lodgepole pine needles during dehardening. Canadian Journal of Forest Research, 47(8), 1116-1122. doi: 10.1139/cjfr-2017-0119 [ Links ]
Man, R., Lu, P., & Dang, Q-L. (2017b). Insufficient chilling effects vary among boreal tree species and chilling duration. Frontiers in Plant Science, 8, 1354. doi: 10.3389/fpls.2017.01354 [ Links ]
Matusick, G., Ruthrof, K. X., Brouwers, N. C., & Hardy, G. St. J. (2014). Topography influences the distribution of autumn frost damage on trees in a Mediterranean-type Eucalyptus forest. Trees, 28, 1449-1462. doi: 10.1007/s00468-014-1048-4 [ Links ]
McDonald, P. M., & Laacke, R. J. (1990). Pinus radiata D. Don Monterey Pine. In R. M. Burns & B. H. Honkala (Eds.), The silvics of North America. Conifers (vol. 1, pp. 433-441). Washington, DC, USA: US Forest Service. [ Links ]
Mead, D. J. (2013). Sustainable management of Pinus radiata plantations. Rome: FAO. doi: 10.13140/2.1.5173.0885 [ Links ]
Millar, C. I. (1999). Evolution and biogeography of Pinus radiata, with a proposed revision of its Quaternary history.New Zealand Journal of Forestry Science, 29(3), 335-365. Retrieved from https://www.fs.fed.us/psw/publications/millar/captured/psw_1999_millar011.pdf [ Links ]
Neuner, G. (2014). Frost resistance in alpine woody plants. Frontiers in Plant Science, 5, 1-13. doi: 10.3389/fpls.2014.00654 [ Links ]
Oberbauer, T. A. (2006). La vegetación de Isla Guadalupe, entonces y ahora. Gaceta Ecológica, 81, 47-58. Retrieved from https://www.redalyc.org/pdf/539/53908104.pdf [ Links ]
Palacio, S., Milla, R., & Montserrat-Martí, G. (2005). A phenological hypothesis on the thermophilous distribution of Pistacia lentiscus L. Flora - Morphology, Distribution, Functional Ecology of Plants, 200(6), 527-534. doi: 10.1016/j.flora.2005.06.004 [ Links ]
Pearce, R. (2001). Plant freezing and damage. Annals of Botany, 87(4), 417-424. doi: 10.1006/anbo.2000.1352 [ Links ]
Perry, J. P. (2009). The pines of México and Central America. Portland, Oregon: Timber Press. [ Links ]
Robson, T. M., Rasztovits, E., Aphalo, P. J., Alia, R., & Aranda, I. (2013). Flushing phenology and fitness of European beech (Fagus sylvatica L.) provenances from a trial in La Rioja, Spain, segregate according to their climate of origin. Agricultural and Forest Meteorology, 180, 76-85. doi: 10.1016/j.agrformet.2013.05.008 [ Links ]
Roden, J. S., Canny, M. J., Huang, C. X., & Ball, M. C. (2009). Frost tolerance and ice formation in Pinus radiata needles: ice management by the endodermis and transfusion tissues. Functional Plant Biology, 36(2), 180-189. doi:10.1071/fp08247 [ Links ]
Rogers, D. L. (2002). In situ genetic conservation of Monterey pine (Pinus radiata D. Don): Information and recommendations. USA: Division of Agriculture and Natural Resources, Genetic Resources Conservation Program. [ Links ]
Rogers, D. L. (2004). In situ genetic conservation of a naturally restricted and commercially widespread species, Pinus radiata. Forest Ecology and Management, 197(1-3), 311-322. doi: 10.1016/j.foreco.2004.05.022 [ Links ]
Rogers, D. L., Matheson, A. C., Vargas-Hernández, J. J., & Guerra-Santos, J. J. (2006). Genetic conservation of insular populations of Monterey pine (Pinus radiata D. Don). Biodiversity & Conservation, 15(2), 779-798. doi: 10.1007/s10531-004-1066-4 [ Links ]
Rogers, D. L., Vargas-Hernández, J. J., Matheson, A. C., & Guerra, S. J. J. (2005). Conserving the pines of Guadalupe and Cedros Islands, Mexico: an international collaboration. In A. Romero & S. E. West (Eds.), Environmental issues in Latin America and the Caribbean (pp. 31-54). Dordrecht, The Netherlands: Springer. doi: 10.1007/1-4020-3774-0_2 [ Links ]
Sáenz-Romero, C., & Tapia-Olivares, B. L. (2008). Genetic variation in frost damage and seed zone delineation within an altitudinal transect of Pinus devoniana (P. michoacana) in Mexico. Silvae Genetica, 57(1-6), 165-170. doi: 10.1515/sg-2008-0025 [ Links ]
SAS Institute. (2003). The SAS System for Windows 9.0. Cary, NC, USA: Author. [ Links ]
Sharma, B., & Deswal, R. (2014). Antifreeze proteins in plants: an overview with an insight into the detection techniques including nanobiotechnology. Journal of Proteins and Proteomics, 5(2), 89-107. Retrieved from https://www.researchgate.net/publication/268742011_Antifreeze_Proteins_in_Plants_An_overview_with_an_insight_into_the_detection_techniques_including_nanobiotechnology [ Links ]
Sogaard, G., Granhus, A., & Johnsen, O. (2009). Effect of frost nights and day and night temperature during dormancy induction on frost hardiness, tolerance to cold storage and bud burst in seedlings of Norway spruce. Trees, 23, 1295-1307. doi: 10.1007/s00468-009-0371-7 [ Links ]
Thomas, F. M., & Ahlers, U. (1999). Effects of excess nitrogen on frost hardiness and freezing injury of above-ground tissue in young oaks (Quercus petraea and Q. robur). New Phytologist, 144(1), 73-83. doi: 10.1046/j.1469-8137.1999.00501.x [ Links ]
Viveros-Viveros, H., Sáenz-Romero, C., López-Upton, J., & Vargas-Hernández, J. J. (2007). Growth and frost damage variation among Pinus pseudostrobus, P. montezumae and P. hartwegii tested in Michoacán, México. Forest Ecology and Management, 253(1), 81-88. doi: 10.1016/j.foreco.2007.07.005 [ Links ]
Viveros-Viveros, H., Sáenz-Romero, C., Vargas-Hernández, J. J., López-Upton, J., Ramírez-Valverde, G., & Santacruz-Varela, A. (2009). Altitudinal genetic variation in Pinus hartwegii Lindl. I: Height growth, shoot phenology, and frost damage in seedlings.Forest Ecology and Management,257(3), 836-842. doi: 10.1016/j.foreco.2008.10.021 [ Links ]
Walter, J., Jentsch, A., Beierkuhnlein, C., & Kreyling, J. (2013). Ecological stress memory and cross stress tolerance in plants in the face of climate extremes. Environmental and Experimental Botany, 94, 3-8. doi: 10.1016/j.envexpbot.2012.02.009 [ Links ]
Williams, C. M., Henry, H. A., & Sinclair, B. J. (2015). Cold truths: how winter drives responses of terrestrial organisms to climate change.Biological Reviews,90(1), 214-235. doi: 10.1111/brv.12105 [ Links ]
Recibido: 30 de Diciembre de 2019; Aprobado: 14 de Julio de 2020











 texto en
texto en 



