Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.26 no.3 Chapingo sep./dic. 2020 Epub 25-Jun-2021
https://doi.org/10.5154/r.rchscfa.2019.11.080
Artículo científico
Micorrizas y fertilización: efecto en la producción de Pinus engelmannii Carr. en vivero
1Universidad Juárez del Estado de Durango, Programa Institucional de Doctorado en Ciencias Agropecuarias y Forestales. Av. Río Papaloapan y bulevar Durango s/n, col. Valle del Sur. C. P. 34120, Durango, Durango, México.
2Universidad Juárez del Estado de Durango, Facultad de Ciencias Forestales. Av. Río Papaloapan y bulevar Durango s/n, Col. Valle del Sur. C. P. 34120. Durango, Durango, México.
3Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Centro de Investigación Norte-Centro (CIRNOC), Campo Experimental Valle del Guadiana (CEVAG). km 4.5 carretera Durango-El Mezquital. C. P. 34170, Durango, Durango., México.
4Secretaría de Recursos Naturales y Medio Ambiente del estado de Durango, vivero forestal Praxedis Guerrero. Av. Ferrocarril 109. C. P. 34070. Durango, Durango, México.
5Universidad Juárez del Estado de Durango, Instituto de Silvicultura e Industria de la Madera. Bulevar Guadiana núm. 501, Cd. Universitaria. C. P. 34120. Durango, Durango, México.
Introducción:
En el vivero, la fertilización de liberación controlada y la inoculación con hongos micorrícicos favorecen la calidad del material vegetal reproducido en contenedores.
Objetivo:
Evaluar el efecto de dos inoculantes micorrícicos comerciales y un fertilizante de liberación controlada sobre el desarrollo de Pinus engelmannii Carr. en vivero.
Materiales y métodos:
Se evaluaron dos inoculantes comerciales (hongos nativos de México [1 mL·planta-1 con 1.05 x 107 esporas·mL-1] y exóticos [1.5 mL·planta-1 con 6.5 x 106 esporas·mL-1]), dos dosis de un fertilizante de liberación controlada (11-28-11 de NPK [3 y 6 g·L-1]) y un testigo; en total, se tuvieron nueve tratamientos. Las variables analizadas fueron: supervivencia, altura del tallo, diámetro al cuello de la raíz, biomasa húmeda y seca, relación biomasa seca de la parte aérea/biomasa seca de la parte radical, índice de lignificación, índice de calidad de Dickson y colonización micorrícica.
Resultados y discusión:
La supervivencia (80 a 96 %) fue similar entre tratamientos. A los ocho meses de la siembra, las plantas mostraron diferencias significativas (P ≤ 0.05) en las variables morfológicas; los tratamientos combinados dieron mejores resultados. Las plantas con inoculante comercial de hongos nativos (1 mL·planta-1 [Amanita rubescens Pers., Amanita sp., Lactarius indigo [Schwein] Fr., Ramaria sp. y Boletus sp.]) y fertilización de 3 g·L-1 tuvieron mayor índice de calidad de Dickson. Se observó que a mayor dosis de fertilización existió menor porcentaje de colonización micorrícica.
Conclusión:
La combinación de inoculante ectomicorrícico de hongos nativos y fertilización en dosis baja demostró que ambos componentes son complementarios en el desarrollo de planta de P. engelmannii.
Palabras clave: hongos nativos; ectomicorriza; fertilizante de liberación controlada; colonización micorrícica; calidad de planta
Introduction:
In the nursery, controlled-release fertilization and inoculation with mycorrhizal fungi promote the quality of plant material reproduced in containers.
Objective:
To evaluate the effect of two commercial mycorrhizal inoculants and one controlled-release fertilizer on the development of Pinus engelmannii Carr. in nursery.
Materials and methods:
Two commercial inoculants (fungi native to Mexico [1 mL·plant-1 with 1.05 x 107 spores·mL-1] and exotics [1.5 mL·plant-1 with 6.5 x 106 spores·mL-1]), two doses of a controlled-release fertilizer (11-28-11 NPK [3 and 6 g·L-1]) and a control were evaluated; in total, nine treatments were used. The variables analyzed were: survival, stem height, root collar diameter, wet and dry biomass, ratio of dry biomass of the aerial part/dry biomass of the root part, lignification index, Dickson's quality index and mycorrhizal colonization.
Results and discussion:
Survival (80 to 96 %) was similar between treatments. Eight months after sowing, seedlings showed significant differences (P ≤ 0.05) in morphological variables; combined treatments gave better results. Plants with commercial inoculum of native fungi (1 mL·plant-1 [Amanita rubescens Pers., Amanita sp., Lactarius indigo [Schwein] Fr., Ramaria sp. and Boletus sp.]) and fertilization of 3 g·L-1 had higher Dickson quality index. It was observed that the higher the fertilization dose, the lower the percentage of mycorrhizal colonization.
Conclusion:
The combination of ectomycorrhizal inoculum of native fungi and low-dose fertilization showed that both components are complementary in the plant development of P. engelmannii.
Keywords: native fungi; ectomycorrhiza; controlled-release fertilizer; mycorrhizal colonization; plant quality
Introducción
El término micorriza se refiere a la asociación simbiótica entre raíces de plantas y el micelio de hongos del suelo (Honrubia, 2009). Se estima que 90 % de las plantas forman simbiosis micorrícica; el desarrollo de este tipo de simbiosis inició hace aproximadamente 400 millones de años (Sosa, Sánchez, Morales, & Cruz, 2006). Las micorrizas favorecen la solubilidad y movilidad de nutrimentos del suelo a la planta, confiriendo mayor resistencia al estrés hídrico y a daños por enfermedades (Carrasco-Hernández et al., 2010; Pera & Parladé, 2005). Asimismo, las micorrizas mejoran la estructura del suelo y la interacción con microorganismos benéficos, por lo que coadyuvan en el desarrollo y crecimiento de las plantas (Gómez-Romero, Villegas, Sáenz-Romero, & Lindig-Cisneros, 2013; Osorio, 2012).
Entre los tipos de micorrizas se encuentran las endomicorrizas y las ectomicorrizas; estas últimas se caracterizan por formar micelio externo y una red de Hartig entre las células de la raíz sin penetrar la pared celular. La ectomicorriza se establece en más de 5 000 especies de hongos, en su mayoría de la clase Basidiomycetes, y en alrededor de 3 000 especies de angiospermas y gimnospermas. Las ectomicorrizas se asocian a especies forestales y son relevantes en la producción de planta del género Pinus en vivero. Este género es simbionte obligado, de modo que la ausencia de las micorrizas afecta la supervivencia y el desarrollo de las plantas (García, Sarmiento, Sierra, & Mejía, 2012). De ahí la importancia de considerar la presencia de ectomicorrizas como un parámetro que evalúa la calidad de la planta forestal producida en vivero (Martínez, Sarmiento, Sígala, Rosales, & Montoya, 2016; Secretaría de Economía, 2016).
En la etapa de vivero, la producción de planta forestal en contenedor requiere de insumos y procesos para favorecer la calidad del material vegetal. Algunos de estos son el medio de crecimiento, el tipo de contenedor, la incorporación de fertilizantes, la inoculación con hongos micorrícicos, el riego y el control de los factores ambientales (Baltasar, Barroetaveña, & Rajchenberg, 2007; Castro-Garibay, Aldrete, López-Upton, & Ordáz-Chaparro, 2018). La adición de nutrimentos se hace mediante la incorporación de fertilizantes de liberación controlada en el sustrato y de soluciones nutritivas en el agua de riego, de acuerdo con las necesidades de la planta durante el proceso de producción o bien se utilizan ambas opciones (Dumroese, Landis, & Wilkinson, 2012). Con respecto a los hongos ectomicorrícicos, la forma más sencilla y común de inocular esporas en las plantas es a través del agua durante el riego (Baltasar et al., 2007).
Dentro del ciclo de producción de planta forestal en vivero, lo más común es que se apliquen inoculantes comerciales que contienen mezclas de esporas de varias especies de hongos nativos o exóticos, como es el caso de Pisolithus tinctorius (Pers.) Coker et Couch y Scleroderma citrinum Pers. (García et al., 2012). Al respecto, Prieto, García, Mejía, Huchín, y Aguilar (2009) encontraron que de 10 viveros forestales en el estado de Durango solo uno consideraba la micorrización como práctica de cultivo, utilizando inoculantes comerciales con las esporas de los hongos exóticos antes mencionados.
Con respecto a la micorrización y fertilización se han reportado tres tendencias. La primera refiere una relación adversa, donde a mayor fertilización hay menor grado de micorrización (Baltasar et al., 2007; Salgado, Rajchenberg, & Barroetaveña, 2009). La segunda reporta que la micorrización no es afectada por la fertilización (Khasa et al., 2001) y la última sostiene una respuesta diferenciada que depende de la especie del hongo ectomicorrícico; es decir, una especie puede ser más susceptible a la fertilización que otra (Brundett, Bougher, Dell, Grove, & Malajczuk, 1996; Trappe, 1977).
En México, Escobar-Alonso y Rodríguez (2019), en su revisión del estado del arte sobre calidad de planta en Pinus, indican la escasez de estudios relacionados con especies micorrícicas, niveles de micorrización y su efecto en la calidad de planta, por lo que recomiendan el incremento de este tipo de ensayos. En este sentido, el objetivo del presente trabajo fue evaluar el efecto de dos inoculantes micorrícicos comerciales y de un fertilizante de liberación controlada sobre el desarrollo de Pinus engelmannii Carr. en vivero. Un inoculante comercial contenía una mezcla de esporas de hongos nativos de México (Amanita rubescens Pers., Amanita sp., Lactarius indigo [Schwein] Fr., Ramaria sp. y Boletus sp.), mientras que el otro incluía una mezcla de esporas de hongos exóticos (P. tinctorius y S. citrinum). Se parte de la hipótesis de que al menos una combinación de tipo de inoculante y dosis de fertilización favorece la calidad de planta de P. engelmannii en mayor medida.
Materiales y métodos
Localización del área de estudio
El experimento se realizó en el vivero forestal Praxedis Guerrero de la Secretaría de Recursos Naturales y Medio Ambiente del estado de Durango, México. El vivero se localiza en el kilómetro 12.5 de la carretera Durango-El Mezquital, al sureste de la ciudad de Durango, Dgo. en las coordenadas 23° 56' 58.3" LN y 104° 34' 07.4" LO a 1 890 m.
Condiciones de producción
De acuerdo con su fase de desarrollo, la planta creció en diferentes áreas del vivero. En la etapa de establecimiento, del 11 de octubre al 21 de noviembre de 2018, la planta estuvo en un invernadero de estructura metálica protegida con película de polietileno blanco calibre 720 µm, cubierta a su vez por malla sombra al 50 % y con cortinas laterales. A partir del 22 de noviembre de 2018 y hasta el 31 de enero de 2019, la planta continuó su crecimiento en un invernadero tipo túnel con polietileno verde calibre 720 µm y malla sombra de 50 %. Los promedios de temperatura y humedad relativa fueron 20 °C y 66 %, respectivamente.
A los tres meses y medio después de la siembra (del 1 de febrero al 11 de mayo del 2019), correspondiente a la etapa de crecimiento rápido, el material vegetativo se cambió a otra área de producción con malla sombra al 50 %, donde la temperatura promedio fue de 18.5 °C y la humedad relativa de 48 %. Por último, en la etapa de preacondicionamiento, a los siete meses después de la siembra (del 12 de mayo al 12 de junio de 2019), la planta se expuso a condiciones de intemperie con temperatura promedio de 23 °C y humedad relativa de 42 %.
Producción de la planta
Previo a la siembra, como tratamiento pregerminativo, la semilla se remojó en agua a temperatura ambiente durante 24 h y al término se aplicó fungicida. La siembra se realizó el 11 de octubre de 2018. Como sustrato se empleó una mezcla a base de turba (57 %), vermiculita (23 %) y agrolita (20 %). La porosidad total del sustrato fue de 68.1 % y la porosidad de aireación de 31.5 % con capacidad de retención de agua de 36.6 %, valores normales de acuerdo con la norma NMX-AA-170-SCFI-2016 (Secretaría de Economía, 2016). Se utilizaron envases negros (165 mL de volumen) de polietileno rígido con guías de raíces internas. Durante la preparación del sustrato, la nutrición de la planta se hizo mediante la adición de fertilizante granulado de liberación controlada (ocho a nueve meses de duración) con la composición 11-28-11 de N-P-K, respectivamente.
Previo a la inoculación, las concentraciones de esporas en cada inoculante se verificaron con la cámara Neubauer o hematocitómetro para fijar las dosis empleadas en cada tratamiento propuesto. Los inoculantes con esporas de hongos nativos y exóticos tuvieron una concentración de 1.05 x 107 esporas·mL-1 y 6.5 x 106 esporas·mL-1, respectivamente. La inoculación se realizó cuatro meses después de la siembra cuando las plántulas presentaron raíces secundarias (Figura 1a). El procedimiento consistió en inyectar la solución de esporas directamente en el sustrato de cultivo, aproximadamente en un ángulo de 45° con respecto a la raíz principal de la planta a una profundidad de 5 cm, procurando que la solución tuviera el mayor contacto posible con el sistema radical (Figura 1b).
Tratamientos evaluados y diseño experimental
Los tratamientos se distribuyeron en un diseño experimental de bloques completos al azar. Se evaluaron nueve tratamientos considerando la inoculación controlada derivada de dos productos comerciales más una condición sin inoculación, combinados con dos dosis de fertilizante de liberación controlada, así como un testigo sin fertilizante (Cuadro 1). Se utilizó un inoculante comercial compuesto por una mezcla de esporas de hongos nativos de México: A. rubescens, Amanita sp., L. indigo, Ramaria sp. y Boletus sp.; el otro inoculante comercial incluía una mezcla de esporas de hongos exóticos: P. tinctorius y S. citrinum. Cada tratamiento estuvo compuesto de cuatro repeticiones con 49 plantas cada una.
Cuadro 1 Tratamientos aplicados con inoculantes micorrícicos comerciales y fertilizante de liberación controlada en el desarrollo de Pinus engelmannii en vivero.
| Tratamientos | Descripción | |
|---|---|---|
| 1 | (Testigo) | Sin fertilizante de liberación controlada y sin inoculante |
| 2 | (FB) | Fertilización baja (3 g·L-1) |
| 3 | (FA) | Fertilización alta (6 g·L-1) |
| 4 | (ICHN) | Inoculante comercial con esporas de hongos nativos (1 mL·planta-1 [1.05 x 107 esporas·mL-1]) |
| 5 | (ICHE) | Inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1 [6.5 x 106 esporas·mL-1]) |
| 6 | (ICHN+FB) | Inoculante comercial con esporas de hongos nativos más fertilización baja |
| 7 | (ICHN+FA) | Inoculante comercial con esporas de hongos nativos más fertilización alta |
| 8 | (ICHE+FB) | Inoculante comercial con esporas de hongos exóticos más fertilización baja |
| 9 | (ICHE+FA) | Inoculante comercial con esporas de hongos exóticos más fertilización alta |
Variables evaluadas
A los ocho meses de la siembra y a los cuatro meses de la inoculación, se determinó la supervivencia del lote bajo estudio y se evaluaron la altura del tallo, diámetro al cuello de la raíz, biomasa húmeda y seca de la parte aérea, radical y total de 10 plantas por unidad experimental, extraídas en forma aleatoria. Para estimar la biomasa seca, las plantas se deshidrataron a 65 °C en horno de ventilación forzada durante 72 h. También se determinaron tres índices de calidad de planta que, a través de una evaluación de variables morfológicas, permiten predecir la oportunidad de adaptación de una planta cuando se traslada a campo (Prieto et al., 2009). Estos índices fueron: relación biomasa seca de la parte aérea/biomasa seca de la parte radical, índice de lignificación (IL) e índice de calidad de Dickson (ICD) (Dickson, Leaf, & Hosner, 1960). Los dos últimos se obtuvieron mediante las expresiones siguientes:
El porcentaje de colonización micorrícica (PCM) se evaluó en el sistema de raíces de tres plantas de cada unidad experimental tomadas al azar. El sustrato adherido al sistema radical de las plantas se eliminó con agua corriente; posteriormente, se seleccionaron al azar 100 cm de raíces secundarias por planta, las cuales se conservaron en una solución de formaldehído, alcohol (96°), ácido acético glacial y agua destilada en proporción 10:50:5:35. El número de ápices micorrizados y no micorrizados se determinó con un microscopio estereoscópico (Leica® EZ4 HD, Suiza). El PCM se calculó con la ecuación utilizada por García (2018):
Los valores porcentuales de colonización micorrícica y los de supervivencia se transformaron con la función arcoseno y raíz cuadrada. Los datos se sometieron a un análisis de varianza; en los casos donde existieron diferencias significativas se hizo una prueba de separación de medias de Tukey, utilizando el programa estadístico SAS® versión 9.2 (Statistical Analysis System, 2009).
Resultados y discusión
Variables morfológicas
El valor promedio del diámetro del cuello de la raíz presentó diferencias estadísticas (P ≤ 0.05) entre los tratamientos. La diferencia entre los valores extremos (2.60 a 5.11 mm) fue del 100 %; de acuerdo con la Figura 2, el inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1) más fertilización baja (3 g·planta-1) (tratamiento 8 = ICHE + FB) generó los valores más altos. La NMX-AA-170-SCFI-2016 estipula que la planta de P. engelmannii requiere un diámetro mínimo de 5 mm para considerar que es de calidad y que pueda ser plantada en campo (Secretaría de Economía, 2016).
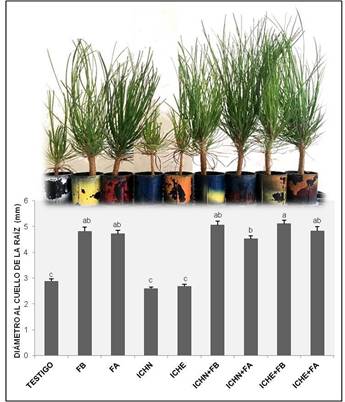
Figura 2 Diámetros de Pinus engelmannii obtenidos en los tratamientos con inoculantes micorrícicos comerciales y fertilizante de liberación controlada en vivero. FB = fertilización baja (3 g·L-1), FA = fertilización alta (6 g·L-1), ICHN = inoculante comercial con esporas de hongos nativos (1 mL·planta-1 [1.05 x 107 esporas·mL-1]), ICHE = inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1 [6.5 x 106 esporas·mL-1]).
Aunque los tratamientos 2 (FB), 3 (FA) y 9 (ICHE + FA) fueron estadísticamente iguales (P ≤ 0.05) al tratamiento 6 (ICHN + FB), solo este último logró cumplir con el diámetro mínimo que establece la NMX-AA-170-SCFI-2016; mientras que las plantas del tratamiento testigo y de los tratamientos sin fertilizar, independientemente del tipo de inoculante, tuvieron la respuesta más baja (Figura 2).
La Figura 3 muestra el efecto de los tratamientos sobre la biomasa seca de las plantas. Los tratamientos con mayor biomasa seca total fueron el 6 (ICHN + FB) y el 8 (ICHE + FB) con diferencias significativas (P ≤ 0.05) respecto al resto de los tratamientos. La biomasa seca de la parte aérea varió de 0.36 a 1.67 g, sobresaliendo nuevamente el tratamiento 8 (ICHE + FB). Los tratamientos con fertilizante y los que combinaron inoculante y fertilizante produjeron mayor biomasa aérea que los únicamente inoculados y que el testigo. Respecto a la biomasa seca de la parte radical, el rango fue de 0.44 a 1.12 g, donde sobresalió el tratamiento del inoculante comercial con esporas de hongos nativos (1 mL·planta-1) más fertilización baja (3 g·planta-1) (tratamiento 6 = ICHN + FB); los valores más bajos ocurrieron en los tratamientos sin fertilizar.

Figura 3 Biomasa seca de Pinus engelmannii en vivero, bajo los tratamientos con inoculantes micorrícicos comerciales y fertilizante de liberación controlada. FB = fertilización baja (3 g·L-1), FA = fertilización alta (6 g·L-1), ICHN = inoculante comercial con esporas de hongos nativos (1 mL·planta-1 [1.05 x 107 esporas·mL-1]), ICHE = inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1 [6.5 x 106 esporas·mL-1]).
Rentería-Chávez, Pérez-Moreno, Cetina-Alcalá, Ferrera-Cerrato, y Xoconostle-Cázares (2017) determinaron que las plantas de Pinus greggii Engelm. inoculadas con hongos ectomicorrícicos comestibles desarrollaron mayor cantidad de biomasa total con respecto a aquellas sin inocular. No obstante, en el presente estudio, los tratamientos con los resultados más bajos no fueron los no inoculados, sino los que carecieron de fertilizante. Esto concuerda con lo reportado por Vázquez-Cisneros et al. (2018), quienes encontraron que la incorporación de fertilizante de liberación lenta influyó positivamente en el crecimiento de especies del género Pinus en comparación con la planta sin fertilizar.
Índices de calidad de planta
Los valores medios de la relación biomasa seca de la parte aérea/biomasa seca de la parte radical variaron de 0.86 a 1.94. Los tratamientos 3 (FA), 7 (ICHN + FA), 8 (ICHE + FB) y 9 (ICHE + FA) estuvieron dentro del rango de 1.5 a 2.5, el cual representa un balance apropiado entre las áreas de transpiración y de absorción de agua (Sáenz, Muñoz, Pérez, Rueda, & Hernández, 2014). Los tratamientos 1 (Testigo), 4 (ICHN) y 5 (ICHE), caracterizados por no tener fertilizante, obtuvieron valores menores (Cuadro 2), lo que significa que la biomasa radical es mayor que la aérea; por tanto, hay desproporcionalidad en la planta (Rodríguez, 2008).
Cuadro 2 Valores medios de los índices de calidad de planta de Pinus engelmannii a los ocho meses después de la siembra, bajo tratamientos de inoculación micorrícica y fertilización de liberación controlada.
| Tratamientos | Relación biomasa seca aérea/radical | Índice de lignificación (%) | Índice de calidad de Dickson | |
|---|---|---|---|---|
| 1 | Testigo | 0.86 ± 0.04 | 25.76 ± 1.04 bc | 0.36 ± 0.02 d |
| 2 | FB | 1.41 ± 0.07 | 25.11 ± 0.49 bc | 0.85 ± 0.04 abc |
| 3 | FA | 1.76 ± 0.09 | 22.84 ± 0.60 c | 0.70 ± 0.05 c |
| 4 | ICHN | 0.87 ± 0.04 | 27.85 ± 0.81 ab | 0.30 ± 0.02 d |
| 5 | ICHE | 0.89 ± 0.06 | 30.56 ± 0.87 a | 0.36 ± 0.02 d |
| 6 | ICHN+FB | 1.38 ± 0.06 | 24.89 ± 0.41 bc | 0.98 ± 0.05 a |
| 7 | ICHN+FA | 1.89 ± 0.09 | 23.91 ± 0.68 c | 0.76 ± 0.04 bc |
| 8 | ICHE+FB | 1.63 ± 0.07 | 25.10 ± 0.47 bc | 0.90 ± 0.04 ab |
| 9 | ICHE+FA | 1.94 ± 0.10 | 22.99 ± 0.54 c | 0.76 ± 0.04 bc |
Medias con letra diferente en la misma columna indican diferencia significativa entre tratamientos de acuerdo con Tukey (P ≤ 0.05). ± Error estándar de la media. FB = fertilización baja (3 g·L-1), FA = fertilización alta (6 g·L-1), ICHN = inoculante comercial con esporas de hongos nativos (1 mL·planta-1 [1.05 x 107 esporas·mL-1]), ICHE = inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1 [6.5 x 106 esporas·mL-1]).
Prieto et al. (2009) refieren que el índice de lignificación expresa el nivel de preacondicionamiento de las plantas; cuando son de calidad presentan valores de 25 a 30 %. Esto se relaciona con la fase de intemperización donde los individuos sufren estrés debido al cambio drástico en las condiciones de luz, de malla sombra a intemperie y de mayor a menor disponibilidad de humedad. En el presente estudio, los tratamientos que carecían de fertilizante alcanzaron valores óptimos (P ≤ 0.05).
El índice de calidad de Dickson es una medida integrada de rasgos morfológicos, donde los valores altos expresan mejor calidad de planta (García, 2018; Prieto et al., 2009). Este índice se ha utilizado para la selección de plantas mejor proporcionadas, así como para predecir su respuesta una vez plantadas en campo (Sáenz et al., 2014). Los resultados variaron de 0.30 a 0.98, posicionando al tratamiento del inoculante comercial con esporas de hongos nativos (1 mL·planta-1) más fertilización baja (3 g·planta-1) (tratamiento 6 = ICHN + FB) como el mejor, con diferencias significativas (P ≤ 0.05) respecto al resto de los tratamientos. Esto concuerda con lo que reportan Martínez et al. (2016), quienes obtuvieron un índice de 1.08 como efecto de la inoculación inducida con Russula delica Fr. en P. engelmannii, manteniendo un régimen de fertilización acorde con las etapas de desarrollo de la planta. De acuerdo con este parámetro, en el presente estudio, las plantas de los tratamientos sin fertilización fueron las de menor calidad (Cuadro 2).
Supervivencia
Acorde con la Figura 4, la supervivencia varió de 80 a 96 %, sin que existieran diferencias significativas (P ≤ 0.05) entre tratamientos. La literatura reporta efectos negativos en las plantas al utilizar dosis altas de fertilización (Marschner, 2012), favoreciendo la susceptibilidad de la planta a plagas y enfermedades que conducen a la muerte. Esto puede explicar la mortalidad causada por un brote de damping off más severo en los tratamientos 3 (FA), 7 (ICHN + FA) y 9 (ICHE + FA), caracterizados por tener dosis alta de fertilización. Esta enfermedad se presenta en viveros forestales y es causada por un complejo de hongos de los géneros Phytopthora, Pythium, Fusarium y Rhizoctonia; su característica principal es el necrosamiento del tejido de conducción a nivel del cuello de la raíz de la plántula que ocasiona su muerte (Cibrián, Alvarado, & García, 2007).

Figura 4 Supervivencia de las plantas de Pinus engelmannii en los tratamientos con inoculantes micorrícicos comerciales y fertilizante de liberación controlada, después de ocho meses de la siembra. FB = fertilización baja (3 g·L-1), FA = fertilización alta (6 g·L-1), ICHN = inoculante comercial con esporas de hongos nativos (1 mL·planta-1 [1.05 x 107 esporas·mL-1]), ICHE = inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1 [6.5 x 106 esporas·mL-1]).
Porcentaje de colonización micorrícica
La Figura 5 muestra que el PCM varió de 15 a 71 % y mostró tendencia inversa a la dosis de fertilización empleada. Los tratamientos 3 (FA), 7(ICHN + FA) y 9 (ICHE + FA), caracterizados por tener dosis de 6 g·L-1 de fertilizante de liberación controlada, tuvieron baja micorrización independientemente del tipo de inoculante, lo cual concuerda con lo reportado por Baltasar et al. (2007) y Salgado et al. (2009). Los tratamientos con mayor PCM fueron el 1 (testigo), 4 (ICHN), 5 (ICHE) y 6 (ICHN + FB), destacando el tratamiento 4, aunque sin diferencias estadísticas entre sí, lo que indica que la simbiosis se estableció con más abundancia en un ambiente limitado en nutrientes, funcionando como mecanismo de nutrición auxiliar. Esto concuerda con lo observado por Bücking, Liepold, y Ambilwade (2012), quienes reconocen la existencia de dos vías para la absorción de nutrimentos en las plantas; la directa que involucra la epidermis y los pelos absorbentes de la raíz, y la segunda a través de las ectomicorrizas. En esta última, el micelio externo favorece una mayor exploración en el suelo. Con respecto a los tratamientos sin inocular, debido a que el ensayo se realizó bajo condiciones normales de producción en vivero, las plantas desarrollaron colonización ectomicorrícica indeseable.
Si bien existió la tendencia negativa respecto al porcentaje de micorrización y la fertilización empleada, los resultados mostraron que el tratamiento 6 (ICHN + FB) tuvo un balance entre las dos variables; esto repercutió favorablemente en la calidad de planta producida en ese tratamiento, confirmando la hipótesis planteada. De manera general, la asociación hongo-raíz tuvo una respuesta diferenciada en función de la cantidad de fertilizante empleado, lo cual coincide con lo planteado por Trappe (1977). Al respecto, Brundett et al. (1996) realizaron un estudio sobre fertilización y hongos micorrícicos asociados a Eucalyptus diversicolor F. Muell. y encontraron que el aumento en la dosis de fertilización mineral repercutió en la disminución en la colonización micorrícica; sin embargo, dicho efecto fue diferencial encontrando que el género Scleroderma es menos susceptible a la fertilización que P. tinctorius.

Figura 5 Colonización micorrícica (PCM) en plantas de Pinus engelmannii bajo tratamientos de micorrización y fertilizantes de liberación controlada, después de ocho meses de la siembra. FB = fertilización baja (3 g·L-1), FA = fertilización alta (6 g·L-1), ICHN = inoculante comercial con esporas de hongos nativos (1 mL·planta-1 [1.05 x 107 esporas·mL-1]), ICHE = inoculante comercial con esporas de hongos exóticos (1.5 mL·planta-1 [6.5 x 106 esporas·mL-1]).
Caracterización de ectomicorrizas
En el presente estudio se encontraron tres morfotipos de ectomicorrizas: uno del inoculante comercial con esporas de hongos nativos y dos del inoculante comercial con esporas de hongos exóticos. Del primer inoculante que contenía esporas de A. rubescens, Amanita sp., L. indigo, Ramaria sp. y Boletus sp., solo se identificó un morfotipo afín al género Amanita spp. que presentó ramificación dicotómica sin rizomorfos, con terminaciones no ramificadas rectas de forma cilíndrica no inflamada y terminación ligeramente afilada, de colores ocre, ocre-amarillento o blanco con presencia de manto (Figura 6a) (Determination of ectomycorrhizae [DEEMY], 2019). El resto de las especies contenidas en el inoculante (L. indigo, Ramaria sp. y Boletus sp.) no formaron ectomicorrizas. Al respecto, Ishida, Nara, Tanaka, Kinoshita, y Hogetsu (2008)) y Nara (2009) mencionan que algunas especies de hongos ectomicorrícicos son pioneros, por lo que sus esporas responden rápido a la germinación ante la presencia de raíces de las plantas hospederas; en contraste, otras especies (donde se incluyen especies del género Lactarius) requieren estímulos adicionales que se obtienen conforme el hábitat se desarrolla, por lo que la inoculación con esporas puede no ser exitosa.
Del inoculante con esporas de hongos exóticos, se identificaron dos morfotipos; el primero afín a S. citrinum, que en estructuras con desarrollo inicial se caracterizó por ectomicorrizas estipitadas con ramificación dicotómica, de color blanco y sin presencia de rizomorfos. Los sistemas de micorrizas en estadios maduros presentaron ramificación principalmente coraloide estipitadas de color blanco amarillento, con terminaciones rectas no ramificadas y presencia de rizomorfos (Figura 6b). El segundo morfotipo tuvo estructuras coraloides estipitadas con ramificaciones dicotómicas color marrón, ápices rectos no ramificados y rizomorfos de conexión restringida a la parte lateral de los ápices. Esta descripción corresponde a la realizada por Valdés, Ambriz, Camacho, y Fierros (2010), quienes probaron el mismo producto utilizado en el presente trabajo y que de igual forma contenía esporas de P. tinctorius, solo que en raíces de Pinus devoniana Lindl. (Figura 6c).
En los tratamientos sin inoculante (testigo, FB y FA) se observó colonización micorrícica en estadios iniciales, condición que no permitió la identificación de especies. De manera general, se observó que los sistemas de micorrizas en los tratamientos con solo inoculante (ICHN y ICHE), así como aquellos con inoculante y fertilización baja (ICHN + FB y ICHE + FB) presentaron ectomicorrizas en estadio maduro; en contraste, los tratamientos con inoculante y fertilización alta (ICHN + FA y ICHE + FA) mostraron estructuras micorrícicas en estadios de desarrollo inicial (Figuras 6d y 6e). Esto podría indicar que el nivel de micorrización, hasta el momento de la evaluación, fue afectado en función de la dosis de fertilización, retrasando el desarrollo de las ectomicorrizas, tal como lo observó Marx (1980).

Figura 6 Morfotipos de ectomicorrizas en Pinus engelmannii: (a) morfotipo afín a Amanita spp.; (b) morfotipo afín a Scleroderma citrinum; (c) morfotipo afín a cepa comercial de Pisolithus tinctorius descrita por Valdés et al. (2010); (d) ectomicorriza en desarrollo inicial; (e) ectomicorriza afín a Scleroderma citrinum en estadio maduro.
Conclusiones
La combinación de inoculante comercial con esporas de hongos nativos (1 mL·planta1) y fertilización de 3 g·L-1 propició mejor calidad de la planta respecto al inóculo comercial con esporas de hongos exóticos (1.5 mL·planta1), demostrando que ambos componentes favorecen la calidad de Pinus engelmannii en vivero. La incorporación de la dosis alta de fertilizante de liberación controlada propició una tendencia negativa en el porcentaje de micorrización. La diversidad de esporas de hongos ectomicorrícicos contenidos en los inoculantes comerciales no resulta en una diversidad de formación de micorrizas, como ocurre con el inoculante comercial de hongos nativos. Los resultados representan un aporte al conocimiento técnico para la producción de planta de calidad de P. engelmannii en vivero, lo cual repercute en la supervivencia de la especie en campo.
Agradecimientos
Al CONACYT, por el financiamiento otorgado a la Dra. Silvia Salcido Ruiz dentro del marco de una estancia posdoctoral en el Programa Institucional de Doctorado en Ciencias Agropecuarias y Forestales de la Universidad Juárez del Estado de Durango. A la Secretaría de Recursos Naturales y Medio Ambiente del gobierno del estado de Durango, por el apoyo para este trabajo con infraestructura y materiales en el vivero forestal “Praxedis Guerrero”.
REFERENCIAS
Baltasar, M. D., Barroetaveña, C., & Rajchenberg, M. (2007). Influencia del régimen de fertilización y del momento de inoculación en la micorrización de Pinus ponderosa en la etapa de vivero. Bosque, 28(3), 226‒233. doi: 10.4067/S0717-92002007000300007 [ Links ]
Brundett, M., Bougher, N., Dell, B., Grove, T., & Malajczuk, N. (1996). Working with mycorrhizas in forestry and agriculture. Canberra, Australia: Australian Center for International Agricultural Research. doi: 10.13140/2.1.4880.5444 [ Links ]
Bücking, H., Liepold, E., & Ambilwade, P. (2012). The role of the mycorrhizal symbiosis in nutrient uptake of plants and the regulatory mechanisms underlying these transport processes. In N. Kumar, & S. Charan (Eds.), Plant science (pp. 107‒138). doi: 10.5772/52570 [ Links ]
Carrasco-Hernández, V., Pérez-Moreno, J., Espinosa-Hernández, V., Almaraz-Suárez, J. J., Quintero-Lizaola, R., & Torres-Aquino, M. (2010). Caracterización de micorrizas establecidas entre dos hongos comestibles silvestres y pinos nativos de México. Revista Mexicana de Ciencias Agrícolas, 1(4), 567‒577. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342010000400009&lng=es&tlng=es [ Links ]
Castro-Garibay, S. L., Aldrete, A., López-Upton, J., & Ordáz-Chaparro, V. M. (2018). Efecto del envase, sustrato y fertilización en el crecimiento de Pinus greggii var. australis en vivero. Agrociencia, 52(1), 115‒127. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952018000100115&lng=es&tlng=es [ Links ]
Cibrián, T. D., Alvarado, R. D., & García, D. S. E. (2007). Enfermedades forestales en México. México: Universidad Autónoma Chapingo. [ Links ]
Determination of ectomycorrhizae (DEEMY). (2019). An information system for characterization and determination of ectomycorrhizae. Retrieved August 1, 2019 from http://www.deemy.de/ [ Links ]
Dickson, A., Leaf, A. L., & Hosner, J. F. (1960). Quality appraisal of white pine seedling stock in nurseries. The Forestry Chronicle, 36(1), 10‒13. doi: 10.5558/tfc36010-1 [ Links ]
Dumroese, R. K., Landis, T. D., & Wilkinson, K. M. (2012). Riego y fertirriego. In M. G. Buamscha, L. T. Contardi, R. K. Dumroese, J. A. Enricci, R. R. Escobar, H. E. Gonda, …Wilkinson, K. M. (Eds.), Producción de plantas en viveros forestales (pp. 115‒125). Buenos Aires, Argentina: Consejo Federal de Inversiones, Centro de Investigación y Extensión Forestal Andino Patagónico, Universidad Nacional de la Patagonia San Juan Bosco. [ Links ]
Escobar-Alonso, S., & Rodríguez, T. D. A. (2019). Estado del arte en la investigación sobre calidad de planta del género Pinus en México. Revista Mexicana de Ciencias Forestales, 10(55), 1‒38. doi: 10.29298/rmcf.v10i55.558 [ Links ]
García, R. J. L. (2018). Micorrización controlada de plantas del género Pinus en vivero y su incidencia sobre atributos del material y del comportamiento. Tesis doctoral, Universidad de Concepción, Concepción, Chile . [ Links ]
García, R. J. L., Sarmiento, L. H., Sierra, A. D., & Mejía, B. J. M. (2012). Hongos silvestres ectomicorrízicos de bosques templados de los municipios de Pueblo Nuevo, San Dimas y Durango, Durango. México: Campo Experimental Valle del Guadiana, INIFAP-SAGARPA. Retrieved from http://biblioteca.inifap.gob.mx:8080/jspui/handle/123456789/3539 [ Links ]
Gómez-Romero, M., Villegas, J., Sáenz-Romero, C., & Lindig-Cisneros, R. (2013). Efecto de la micorrización en el establecimiento de Pinus pseudostrobus en cárcavas. Revista Madera y Bosques, 19(3), 51‒63. doi: 10.21829/myb.2013.193327 [ Links ]
Honrubia, M. (2009). Las micorrizas: Una relación planta-hongo que dura más de 400 millones de años. Anales del Jardín Botánico de Madrid, 66(S1), 133‒144. doi: 10.3989/ajbm.2226 [ Links ]
Ishida, T. A., Nara, K., Tanaka, M., Kinoshita, A., & Hogetsu, T. (2008). Germination and infectivity of ectomycorrhizal fungal spores in relation to their ecological traits during primary succession. New Phytologist, 180(2), 491‒500. doi: 10.1111/j.1469-8137.2008.02572.x [ Links ]
Khasa, P. D., Sigler, L., Chakravarty, P., Dancik, B. P., Erickson, L., & Mc Curdy, D. (2001). Effect of fertilization on growth and ectomycorrhizal development of container-grown and bare-root nursery conifer seedling. New Forests, 22(3), 179‒197. doi: 10.1023/A:1015674921878 [ Links ]
Marschner, P. (2012). Marschner's mineral nutrition of higher plants (3rd. ed.). USA: Elsevier/Academic Press. [ Links ]
Martínez, N. L. E., Sarmiento, L. H., Sígala, R. J. A., Rosales, M. S., & Montoya, A. J. B. (2016). Respuesta a la inoculación inducida de Russula delica Fr. en plantas de Pinus engelmannii Carr. en vivero. Revista Mexicana de Ciencias Forestales, 7(33), 108‒117. doi: 10.29298/rmcf.v7i33.93 [ Links ]
Marx, D. H. (1980). Ectomycorrhizal fungus inoculations: A tool for improving forestations practices. In P. Mykola (Ed.), Tropical mycorrhiza research (pp. 13‒71). USA: Oxford University Press. [ Links ]
Nara, K. (2009). Spores of ectomycorrhizal fungi: ecological strategies for germination and dormancy. New Phytologist, 181(2), 245-248. doi: 10.1111/j.1469-8137.2008.02691.x [ Links ]
Osorio, N. W. (2012). Uso de hongos formadores de micorriza como alternativa biotecnológica para promover la nutrición y el crecimiento de plántulas. Revista Manejo Integral del Suelo y Nutrición Vegetal, 1(2), 1‒4. Retrieved from https://www.bioedafologia.com/sites/default/files/documentos/pdf/Hongos-formadores-de-micorrizas.pdf [ Links ]
Pera, J., & Parladé, J. (2005). Inoculación controlada con hongos ectomicorrícicos en la producción de planta destinada a repoblaciones forestales: estado actual en España. Investigación Agraria: Sistemas y Recursos Forestales, 14(3), 419‒433. Retrieved from https://recyt.fecyt.es/index.php/IA/article/view/2340/1736 [ Links ]
Prieto, R. J. A., García, R. J. L., Mejía, B. J. M., Huchín, A. S., & Aguilar, V. J. L. (2009). Producción de planta del género Pinus en vivero en clima templado frío. (1.a ed.). Durango, México: Campo Experimental Valle del Guadiana INIFAP. [ Links ]
Rentería-Chávez, M. C., Pérez-Moreno, J., Cetina-Alcalá, V. M., Ferrera-Cerrato, R., & Xoconostle-Cázares, B. (2017). Transferencia de nutrientes y crecimiento de Pinus greggii Engelm. inoculado con hongos comestibles ectomicorrícicos en dos sustratos. Revista Argentina de Microbiología, 49(1), 93‒104. doi: 10.1016/j.ram.2016.06.004 [ Links ]
Rodríguez, T. D. A. (2008). Indicadores de calidad de planta forestal. México: Mundi Prensa. [ Links ]
Sáenz, R. J. T., Muñoz, F. H. J., Pérez, D. C. M. A., Rueda, S. A., & Hernández, J. (2014). Calidad de planta de tres especies de pino en el vivero “Morelia”, estado de Michoacán. Revista Mexicana de Ciencias Forestales, 5(26), 98‒111. doi: 10.29298/rmcf.v5i26.293 [ Links ]
Salgado, S. M. E., Rajchenberg, M., & Barroetaveña, C. (2009). Evaluación del estado micorrícico de plántulas de Pinus ponderosa producidas bajo fertirriego, sin manejo de la micorrización. Bosque, 30(3), 127‒134. doi: 10.4067/S0717-92002009000300002 [ Links ]
Secretaría de Economía. (2016). Norma Mexicana NMX-AA-170-SCFI-2014: Certificación de operación de viveros forestales. Retrieved March 9, 2019 from http://dof.gob.mx/nota_detalle_popup.php?codigo=5464460 [ Links ]
Sosa, R. T., Sánchez, N. J., Morales, G. E., & Cruz, C. F. (2006). Interacción micorrizas arbusculares-Trichoderma harzianum (Moniliaceae) y efectos sobre el crecimiento de Brachiaria decumbens (Poaceae). Acta Biológica Colombiana, 11(1), 43‒54. Retrieved from http://www.scielo.org.co/pdf/abc/v11n1/v11n1a04.pdf [ Links ]
Statistical Analysis System (SAS Institute Inc.). (2009). SAS ver. 9.2. Cary, NC, USA: Author. [ Links ]
Trappe, J. M. (1977). Selection of fungi for ectomycorrhizal inoculation in nurseries. Annual Review of Phytopathology, 15, 203‒222. doi: 10.1146/annurev.py.15.090177.001223 [ Links ]
Valdés, R. M., Ambriz, P. E., Camacho, V. A., & Fierros, G. A. M. (2010). Inoculación de plántulas de pinos con diferentes hongos e identificación visual de la ectomicorriza. Revista Mexicana de Ciencias Forestales, 1(2), 53‒64. doi: 10.29298/rmcf.v1i2.637 [ Links ]
Vázquez-Cisneros, I., Prieto-Ruíz, J. A., López-López, M. A., Wehenkel, C., Domínguez-Calleros, P. A., & Muñoz-Sáez, F. E. (2018). Growth and survival of plantation of Pinus greggii Engelm. ex Parl. var. greggii under different fertilization treatments. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 24(2), 251‒264. doi: 10.5154/r.rchscfa.2017.05.036 [ Links ]
Recibido: 07 de Noviembre de 2019; Aprobado: 06 de Mayo de 2020











 texto en
texto en 



