Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo serie ciencias forestales y del ambiente
versão On-line ISSN 2007-4018versão impressa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.25 no.3 Chapingo Set./Dez. 2019 Epub 19-Fev-2021
https://doi.org/10.5154/r.rchscfa.2018.12.090
Artículo científico
Efecto de la luz y la humedad del suelo sobre variables fisiológicas en seis especies forestales mediterráneas plantadas bajo dosel de pinar
1Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Biología. Edificio R Ciudad Universitaria. C. P. 58030. Morelia, Michoacán, México.
2Universidad Laica Eloy Alfaro de Manabí, Facultad de Ciencias Agropecuarias. Av. Circunvalación Vía San Mateo, Ciudadela Universitaria. Manta 130802, Ecuador.
3ONGD Bosque y Comunidad, Campus Universitario de Rabanales, Edificio Leonardo da Vinci, Dpto. de Ingeniería Forestal. Carretera N-IV, km 396. C. P. 14071. Córdoba, España.
4Centro de Estudios Ambientales del Mediterráneo. C/ Charles R. Darwin, 14, Parque Tecnológico. 46980 - Paterna, Valencia, España.
Introducción:
Las especies rebrotadoras, por la rapidez de su regeneración, pueden mantener el balance óptimo de carbono y mejorar la resiliencia de los ecosistemas perturbados o que tienen alto riesgo de incendios.
Objetivo:
Evaluar el efecto de la disponibilidad de luz y la humedad del suelo sobre las variables ecofisiológicas de seis especies rebrotadoras plantadas bajo cubierta de Pinus halepensis Mill.
Materiales y métodos:
Arbutus unedo L., Rhamnus alaternus L., Quercus ilex L., Quercus faginea Lam., Fraxinus ornus L. y Acer granatense Boiss. se plantaron en parcelas con tres densidades de pinos por hectárea: DA = 800 a 1 100, DM = 300 a 600 y DB = 100 a 250. En vivero, las especies también se cultivaron tratando de mantener las mismas condiciones de radiación solar. Se midieron la fotosíntesis (A), la conductancia estomática (Gs), la eficiencia máxima del fotosistema II (Fv/Fm) y la eficiencia en el uso del agua (IWUE).
Resultados y discusión:
Las especies esclerófilas perennifolias (A. unedo, R. alaternus y Q. ilex) mostraron tendencias de mayor capacidad fotosintética, menor fotoinhibición y menor IWUE que las caducifolias. En DA, las plantas mostraron menor capacidad fotosintética (P < 0.01) y mayor fotoprotección (P < 0.001). La IWUE fue similar bajo las tres densidades de pinar. En vivero, la A fue alta en condiciones de 100 % y 50 % de luz; Gs fue mayor en condiciones de 20 %; y la IWUE fue alta bajo 100 % de luz.
Conclusión:
Las variables fisiológicas de las especies estuvieron condicionadas por el sombreo y cambios en la demanda hídrica producidos por la cubierta arbórea.
Palabras clave: eficiencia en el uso del agua; fotoprotección; fotosíntesis; conductancia estomática; densidad de pinos
Introduction:
Resprouter species, by regenerating rapidly, can maintain an optimal carbon balance and improve the resilience of ecosystems that have been disturbed or are at high risk of fire.
Objective:
To assess the effect of light availability and soil moisture on the ecophysiological variables of six resprouter species planted under cover of Pinus halepensis Mill.
Materials and methods:
Arbutus unedo L., Rhamnus alaternus L., Quercus ilex L., Quercus faginea Lam., Fraxinus ornus L. and Acer granatense Boiss. were planted in plots with three pine densities per hectare: HD = 800 to 1 100, MD = 300 to 600 and LD = 100 to 250. The species were also grown in the nursery, trying to maintain the same solar radiation conditions. Photosynthesis (A), stomatal conductance (Gs), photosystem II maximum efficiency (Fv/Fm) and water use efficiency (IWUE) were measured.
Results and discussion:
Evergreen sclerophyll species (A. unedo, R. alaternus and Q. ilex) showed higher photosynthetic capacity, lower photoinhibition and lower IWUE than deciduous species. In HD, plants showed lower photosynthetic capacity (P < 0.01) and higher photoprotection (P < 0.001). The IWUE was similar under the three pine forest densities. In the nursery, A was high under 100 % and 50 % light conditions; Gs was higher under 20 % conditions; and IWUE was high under 100 % light.
Conclusion:
The physiological variables of the species were conditioned by shading and changes in water demand produced by tree cover.
Keywords: water use efficiency; photoprotection; photosynthesis; stomatal conductance; pine density
Introducción
En regiones de clima mediterráneo del sureste español, el incremento en la temperatura y la disminución de la precipitación se han agudizado desde los años 70, particularmente durante la primavera y verano, lo que se ha asociado con el cambio climático (Bladé & Castro-Díez, 2010; Intergovernmental Panel on Climate Change [IPCC], 2014). El desarrollo de las plantas en áreas de clima fuertemente estacional se confina a los periodos de condiciones favorables, por lo que la distribución, adaptación, crecimiento y supervivencia dependerán de los atributos ecofisiológicos, morfológicos y reproductivos. No obstante, la variación e interacción simultánea de luz y agua condicionan la respuesta de las plantas a la luz y su tolerancia a la sombra, especialmente limitadas por la condición hídrica (Valladares, Aranda, & Sánchez-Gómez, 2004; Vilagrosa et al., 2003).
Las plantas mediterráneas han desarrollado mecanismos para afrontar condiciones de estrés hídrico, existiendo un rango de variación para evitar o tolerar la sequía (McDowell et al., 2013). Las especies que evitan la sequía son capaces de cerrar los estomas para mantener la hidratación de sus tejidos y así evitar la tensión excesiva del xilema (Pausas et al., 2016); sin embargo, esto limita la asimilación del carbono y aumenta la posibilidad de inanición (Galiano, Martínez-Vilalta, & Lloret, 2011). Por otra parte, las especies tolerantes a la sequía admiten que cierto grado de estrés afecte sus tejidos al mantener los estomas abiertos con potenciales hídricos muy bajos, lo que favorece un balance de carbono positivo; sin embargo, arriesgan el funcionamiento del sistema hidráulico (Pausas et al., 2016; Urli et al., 2013) y aumentan la cavitación (McDowell, 2011). El efecto podría ser crítico en años de mayor sequía, ocasionando la competencia por agua entre las plantas del sotobosque y los árboles que componen el dosel (Valladares et al., 2004).
En este sentido, la determinación de la eficiencia en el uso del agua, a través de la proporción de CO2 asimilado durante la fotosíntesis y la cantidad de agua perdida por transpiración, es fundamental para comprender la interacción entre las plantas y los ecosistemas que se encuentran bajo estrés hídrico. El establecimiento de especies rebrotadoras de grupos perennifolios y caducifolios en estos ecosistemas, induciría el desarrollo de masas mixtas a largo plazo, para favorecer la resiliencia de estos sistemas forestales frente a fuegos recurrentes o perturbaciones futuras (García de la Serrana, Vilagrosa, & Alloza, 2015; Gavinet et al., 2015; Granados, Vilagrosa, Chirino, & Vallejo, 2016; Rodríguez-Rodríguez, Jordano, & Valido, 2015).
Las especies rebrotadoras, por la rapidez de su regeneración, representan una opción para mantener el balance óptimo de carbono y mejorar la resistencia y resiliencia de los ecosistemas que han sido perturbados o con alto riesgo de incendios (Pausas & Keeley, 2017). En tal contexto, el objetivo de este estudio fue evaluar el efecto de la disponibilidad de luz y la humedad del suelo, sobre variables del intercambio de gases y la eficiencia máxima del fotosistema II (PSII) de seis especies forestales establecidas en bosques de pino carrasco (Pinus halepensis Mill.).
Materiales y métodos
Área de estudio
La investigación se realizó en la localidad La Hunde (39° 7’ LN y 1° 13’ LO; Ayora, Valencia, España) en clima mesomediterráneo seco, a una altitud de 600 m y en relieve relativamente llano. La precipitación media anual es de 480 mm, temperatura media anual de 14 °C, evapotranspiración de referencia (Eto) de 749 mm y evapotranspiración real (Eta) de 453 mm (Pérez-Cueva, 1994). Los suelos derivan de un sustrato margo-calizo, son poco profundos, ricos en carbonatos y con pH ligeramente básico. La vegetación dominante corresponde a repoblaciones antiguas de pino carrasco (P. halepensis) plantadas hace 50 a 60 años. En el área de estudio, el Servicio Forestal del Gobierno Regional (Generalitat Valenciana) realizó labores de aclareo del pinar con varias intensidades entre los años 2003 y 2005, lo que permitió el establecimiento de otras especies herbáceas y arbustivas en las áreas donde el aclareo fue más intenso.
Diseño experimental en campo
Se definieron tres tratamientos experimentales en función de la densidad de masa forestal: alta (DA, 800 a 1 100 árboles·ha-1), media (DM, 300 a 600 árboles·ha-1) y baja densidad (DB, 100 a 250 árboles·ha-1). En cada tratamiento se establecieron tres parcelas experimentales de 900 m2 (30 x 30 m) localizadas en tres sitios: El Aljibe (39° 09’ LN; 1° 18’ LO), El Lobo (39° 12’ LN; 1° 23’ LO) y El Mojón (39° 12’ LN; 1° 22’ LO). En cada parcela se plantaron 15 individuos de un año correspondientes a seis especies nativas rebrotadoras: Arbutus unedo L., Rhamnus alaternus L., Quercus ilex L. subsp. ballota (Desf.) Samp, Quercus faginea Lam. subsp. faginea, Fraxinus ornus L. y Acer granatense Boiss. Estas especies presentan características morfofuncionales contrastadas y diferente grado de tolerancia a la sombra y a la sequía (Cuadro 1). La plantación se hizo en febrero del 2011 en hoyos de 40 x 40 x 40 cm, hechos con retroexcavadora. La capacidad de campo se determinó (FC) mediante el método descrito por Walker (1989). En cada parcela experimental, el contenido de agua en el suelo (SWC) se monitoreó durante el periodo marzo del 2011 a octubre del 2013, utilizando una sonda TDR 100 (Campbell Scientific, Inc., Logan, Utah, USA) a una profundidad de 0 a 20 cm en siete hoyos de plantación elegidos al azar. Simultáneamente, el SWC se monitoreó en tres hoyos de plantación, elegidos al azar, a una profundidad de 30 a 40 cm con una sonda HS10 (ProCheck Decagon Devices Inc., Pullman, USA). La disponibilidad hídrica se determinó mediante el cociente SWC/FC. Una descripción más detallada de las parcelas, así como de las condiciones edafoclimáticas de los tratamientos (precipitación, dinámica temporal del contenido de agua en el suelo, temperatura ambiental, evapotranspiración y densidad del flujo de fotones fotosintéticos), se puede obtener en Gavinet et al. (2015) y Granados et al. (2016). Un resumen de dichas condiciones se presenta en el Cuadro 2.
Cuadro 1 Rasgos ecológicos distintivos de seis especies nativas rebrotadoras establecidas en las parcelas experimentales.
| Especies | Forma de vida | Hábitos de hoja | Tolerancia a la sequía* | Tolerancia a la sombra** |
|---|---|---|---|---|
| Arbutus unedo | Arbusto | Perennifolia | Alta | Baja |
| Rhamnus alaternus | Arbusto | Perennifolia | Alta | Baja |
| Quercus ilex | Árbol | Perennifolia | Media | Media |
| Quercus faginea | Árbol | Semicaducifolia | Media | Media |
| Fraxinus ornus | Árbol | Caducifolia | Baja | Alta |
| Acer granatense | Árbol | Caducifolia | Baja | Alta |
*Determinada a partir de la resistencia a la cavitación del xilema (Gortan, Nardini, Gasco, & Salleo, 2009; Martínez-Vilalta, Prat, Oliveras, & Piñol, 2002). ** Determinado a partir del ambiente o del ecosistema en el que habitan de forma natural (Rivas-Martínez, 1987).
Cuadro 2 Condiciones ambientales en las parcelas por densidad de pino evaluada (DA = 800 a 1 100 árboles·ha-1; DM = 300 a 600 árboles·ha-1 y DB = 100 a 250 árboles·ha-1) en la localidad La Hunde, Valencia, España.
| Factor ambiental | Tratamientos experimentales | Valor F* | ||
|---|---|---|---|---|
| DA | DM | DB | ||
| Densidad de árboles (1) | 1 067 ± 14 a | 344 ± 19 b | 165 ± 25 b | 32.687*** |
| Translocación acumulada (L·m-2) (1) | 859 ± 24 b | 915 ± 33 ab | 993 ± 27 a | 5.298 ** |
| Proporción SWC:FC (1) | 0.53 ± 0.1 c | 0.55 ± 0.0 b | 0.63 ± 0.0 a | 0.017 *** |
| PPFD (µmol·m-2·s-1) (1) | 135.4 ± 9.4 c | 300.3 ± 17.4 b | 547.5 ± 26.7 a | 463.2 *** |
| Tª máxima diaria en verano (°C) (2) | 34.0 ± 0.2 b | 35.8 ± 0.5 a | 36.0 ± 0.1 a | P = 0.05 |
| VPD máximo diario en verano (kPa) (2) | 4.3 ± 0.1 b | 4.8 ± 0.2 a | 4.9 ± 0.1 a | P = 0.05 |
Valores y resultados tomados de Granados et al. (2016)(1) y Gavinet et al. (2015)(2). SWC = contenido de agua en el suelo; FC = capacidad de campo, PPFD = densidad de flujo de fotones fotosintéticos; Tª = temperatura del aire; VPD = déficit de presión de vapor. ± Error estándar de la media. **P < 0.01, ***P < 0.001
Variables fisiológicas en condiciones de campo
En campo se midieron variables relacionadas con el intercambio de gases y la eficiencia máxima del fotosistema II. En seis individuos de cada especie por tratamiento (dos individuos por tres parcelas), seleccionados aleatoriamente, se midió fotosíntesis (A, µmol CO2·m-2·s-1) y conductancia estomática (Gs, mol H2O·m-2·s-1) con un analizador de gases infrarrojo (IRGA, LiCor 6400 XT, Inc., Lincoln, NE, USA), entre las 8:00 y 10:00 h del día de medición en los meses de mayo, julio y noviembre del 2011 y junio del 2012. La eficiencia en el uso del agua (IWUE) se calculó como la relación A/Gs (µmol CO2·m-2·s-1/ mol H2O·m-2·s-1). Las condiciones en el interior de la cámara del IRGA fueron similares para todos los tratamientos (flujo de aire de 380 µmol·s-1, concentración de CO2 de 390 ppm y temperatura 25 °C), excepto en la densidad de flujo de fotones fotosintéticos (PPFD), la cual se ajustó al valor promedio que dicha variable registraba bajo el dosel de cada parcela al momento de hacer las mediciones, utilizando un ceptómetro (Sunfleck Ceptometer, Decagon Devices, USA).
La eficiencia máxima del fotosistema II (Krause & Weis, 1984) se midió al alba, a través de la fluorescencia de la clorofila (fluorescencia variable [Fv]/ fluorescencia máxima [Fm]) en los mismos individuos y en los meses de mayo, julio, agosto y noviembre del 2011 y junio del 2012. La medición se hizo con un fluorómetro portátil de pulso de amplitud modulada (PAM 2100, Heinz Walz Gm BHEffeltrich, Alemania), en condiciones de oscuridad; la pinza se colocó en cada hoja durante 30 min.
Diseño experimental en condiciones de vivero
Para comparar cualitativamente la respuesta de las especies y entender los procesos que operan en el intercambio de gases en condiciones lumínicas e hídricas diferentes, se determinaron las mismas variables fisiológicas de las plantas (A, Gs e IWUE) en condiciones óptimas de humedad del sustrato, simulando niveles similares de radiación solar que en campo. En condiciones controladas se realizó un experimento en el vivero de la Unidad Experimental Vegetal de la Universidad de Alicante (San Vicente del Raspeig, España). Para simular las condiciones de luz solar en campo, se establecieron tres tratamientos de luz: 1) tratamiento control (TC), plantas en condiciones de máxima disponibilidad de luz (100 % de luz solar); 2) media disponibilidad de luz (MDL), plantas bajo una malla de sombreo de color negro (transmisión: 50 % de la luz solar); y 3) escasa disponibilidad de luz (EDL), plantas bajo una doble malla de sombreo (transmisión: 20 % de luz solar). La transmisión se calculó como el cociente entre los valores de PPFD bajo la malla de sombreo y en un sitio abierto con máxima disponibilidad de luz solar. La PPFD se midió un día desde las 6:00 horas hasta las 16:00 horas (hora solar) en cada tratamiento, con un ceptómetro (Sunfleck ceptometer, Decagon Devices, USA). Se trasplantaron ocho individuos de cada especie por tratamiento a contenedores de 1.5 L de capacidad, utilizando una mezcla de turba rubia y fibra de coco al 50 % (v/v) como sustrato. Cada tratamiento y especie se replicó dos veces. Las plantas se cultivaron en condiciones de humedad óptima durante dos meses para favorecer su aclimatación. La humedad del sustrato en el contenedor se midió mediante la sonda EC-5 Pro-Check (Decagon Devices, Pullman, USA). Las plantas se regaron con 25 L·m-2 cada cuatro días en el TC y cada seis días dentro del sombreado para mantener humedad completa del sustrato.
Variables fisiológicas en condiciones de vivero
En seis individuos de cada especie por tratamiento de sombreo, seleccionados al azar, se midieron las mismas variables que en condiciones de campo (A, Gs e IWUE) con excepción de Fv/Fm, utilizando el mismo sistema (IRGA LiCor 6400 XT, Inc., Lincoln, NE, USA). Las mediciones se hicieron un día entre las 8:00 y las 12:00 hora solar. Las condiciones en el interior de la cámara del IRGA fueron similares para todos los tratamientos (flujo de aire de 380 µmol·s-1, concentración de CO2 de 390 ppm y temperatura 25 °C), excepto la PPFD que se ajustó a la radiación solar de cada tratamiento: 1 000 μmol·m-2·s-1para TC, 600 μmol·m-2·s-1 para MDL y 90 μmol·m-2·s-1 para EDL. El día anterior a la medición, todas las plantas se regaron hasta capacidad de campo para evitar la influencia de grados distintos de hidratación.
Análisis estadístico
El análisis se hizo bajo un diseño factorial con dos factores fijos: el factor tratamiento experimental (tres densidades) y el factor especie (seis especies), con el modelo y ijk = μ + T i + E j + ε ijk , donde y ij = variable respuesta, μ = media general, T i = efecto del tratamiento i, E j = efecto de la especie y ε ijk = error. En el experimento en campo, las variables A, Gs, IWUE y Fv/Fm se compararon mediante un ANOVA de dos factores fijos. Un análisis similar se realizó para evaluar la respuesta de las especies en las fechas de muestreo (campaña de medición). En vivero, las variables A, Gs y IWUE se compararon mediante un ANOVA de dos factores: nivel de luz y especie. Cuando el análisis mostró interacción entre los factores, se realizó un ANOVA de un factor con nivel de significación P < 0.05. Las medias se compararon con la prueba de Tukey (DHS de Tukey). Los datos se transformaron en aquellos casos en los que no se cumplieron los supuestos del ANOVA; posteriormente, el cumplimiento de estos se verificó. Los análisis se realizaron mediante el paquete estadístico STATISTICA 12 (StatSoft Inc., 2012).
Resultados y discusión
Intercambio de gases y eficiencia del PSII en condiciones de campo
En la zona de estudio, Granados et al. (2016) observaron que las condiciones edáficas y climáticas en cada parcela estuvieron determinadas por la densidad de pinos (Cuadro 2), afectando la supervivencia y el crecimiento de las especies. En estos ecosistemas, las temperaturas altas, radiación solar alta y precipitación baja durante el periodo estival generan un marcado déficit hídrico que ha incrementado en las últimas décadas a través de sequías recurrentes (Sánchez-Salguero, Navarro-Cerrillo, Camarero, & Fernández-Cancio, 2012).
El Cuadro 3 presenta los resultados de las variables fisiológicas medidas en las seis especies rebrotadoras y en tres densidades de pinar evaluadas. Las condiciones de mayor disponibilidad de luz (PPFD), junto con una mayor disponibilidad hídrica en los tratamientos DB y DM (Granados et al., 2016), favorecieron valores de fotosíntesis (A; P < 0.01) y conductancia estomática (Gs; P < 0.05) más altos en esas densidades de pinar con respecto a AD. Se ha reportado que en climas secos y semiáridos pueden coexistir especies con diferentes estrategias y grados de vulnerabilidad a la sequía; las especies tolerantes pueden mantener los estomas abiertos en tal condición (Forner, Aranda, Granier, & Valladares, 2014; Vilagrosa, Hernández, Luis, Cochard, & Pausas, 2014). En este trabajo, R. alaternus mostró valores mayores de A (P < 0.01) y Q. ilex tuvo los valores más altos de Gs (P < 0.01). En general, las hojas formadas en ambientes con intensidad lumínica alta tienen capacidad fotosintética superior a la de las plantas sombreadas (Larcher, 1980); sin embargo, en condiciones de sequía más intensa, puede existir una regulación de la conductancia estomática a la baja, con una reducción consecuente de la tasa fotosintética (Rodríguez-Calcerrada et al., 2016). En este estudio, los resultados indican que la disponibilidad lumínica fue el factor que reguló el intercambio de gases, lo que concuerda con Gómez-Aparicio, Valladares, y Zamora (2006), quienes encontraron que la intensidad lumínica limitó el establecimiento de las especies.
En cuanto a la eficiencia en el uso del agua (IWUE), de acuerdo con el Cuadro 3, no se encontraron diferencias significativas entre tratamientos (P = 0.0930), pero se observó cierta tendencia a que los plantones bajo cubierta de DB presentaran mayor IWUE respecto a DM y DA. Con respecto a las especies, F. ornus, A. unedo y A. granatense presentaron mayor IWUE (P < 0.05); la especie con menor valor fue Q. ilex. Las diferencias observadas entre especies pueden relacionarse con algunas estrategias para hacer frente al déficit hídrico mediante mecanismos de ahorro de agua. Por ejemplo, Q. ilex es una especie con capacidad para mantener bajos potenciales hídricos mediante ajuste osmótico (Vilagrosa et al., 2003, 2014), adoptando una estrategia de tolerancia al estrés hídrico en condiciones de sequía extrema.
Por otra parte, en el Cuadro 3 se observa que la eficiencia máxima del fotosistema II (Fv/Fm) fue 0.79, valor moderadamente inferior al óptimo (0.83) que caracteriza a las plantas no estresadas (Björkman & Demmig, 1987). Estos datos podrían indicar procesos de fotoinhibición de larga duración, debido a condiciones estresantes para los plantones (Long, Humphries, & Falkowski, 1994). La Fv/Fm fue mayor en el tratamiento de DA (P < 0.01), lo cual está relacionado con valores de PPFD inferiores y, por lo tanto, menos estresantes para todas las especies (Granados et al., 2016); entre DM y DB no se observaron diferencias. En las especies, la Fv/Fm fue mayor en A. unedo, seguido de Q. ilex y R. alaternus, reflejando una mejor capacidad para adaptarse y vivir en estos ambientes (P < 0.001); Q. faginea presentó valores intermedios, mientras que F. ornus y A. granatense tuvieron los valores menores, manifestando mayor fotoinhibición y menor adaptación al ambiente lumínico en estas parcelas.
Cuadro 3 ANOVA bifactorial de las variables fisiológicas medidas en seis especies nativas rebrotadoras y en tres densidades de pino evaluadas en campo en la localidad La Hunde, Valencia, España
| Factores e interacción | Intercambio de gases | Fv/Fm | ||
|---|---|---|---|---|
| A (µmol CO2·m2·s1) | Gs (mol H2O ·m2·s-1) | IWUE (A/Gs) | ||
| Especie | ||||
| Arbutus unedo | 5.2 ± 0.4 ab | 0.08 ± 0.01 abc | 75.1 ± 4.4 a | 0.79 ± 0.00 a |
| Rhamnus alaternus | 6.8 ± 0.7 a | 0.10 ± 0.01 ab | 70.4 ± 5.6 ab | 0.76 ± 0.01 ab |
| Quercus ilex | 5.1 ± 0.5 ab | 0.11 ± 0.01 a | 57.1 ± 4.0 b | 0.77 ± 0.00 ab |
| Quercus faginea | 4.2 ± 0.4 b | 0.06 ± 0.01 c | 68.9 ± 5.3 ab | 0.75 ± 0.01 b |
| Fraxinus ornus | 4.7 ± 0.4 b | 0.08 ± 0.01 abc | 81.2 ± 5.3 a | 0.68 ± 0.02 c |
| Acer granatense | 4.8 ± 0.4 b | 0.07 ± 0.01 bc | 73.9 ± 4.9 a | 0.70 ± 0.02c |
| Valor F | 3.918** | 4.153** | 3.614** | 14.32*** |
| Tratamiento | ||||
| DA | 4.0 ± 0.3 b | 0.07 ± 0.00 b | 65.2 ± 3.1 a | 0.77 ± 0.01 a |
| DM | 5.2 ± 0.3 a | 0.09 ± 0.01 a | 72.6 ± 3.6 a | 0.74 ± 0.01 b |
| DB | 6.1 ± 0.3 a | 0.09 ± 0.01 a | 75.7 ± 3.8 a | 0.73 ± 0.01 b |
| Valor F | 10.569** | 2.241* | 3.254 (1) | 5.93** |
| Especie x tratamiento | ||||
| Valor F | 0.500 | 0.205 | 0.545 | 0.79 |
Gs = conductancia de estomas; A = fotosíntesis; IWUE = eficiencia en el uso del agua; Fv/Fm = eficiencia fotosintética; DA = densidad alta (800 a 1 100 árboles·ha-1); DM = densidad media (300 a 600 árboles·ha-1) y DB = densidad baja (100 a 250 árboles·ha-1). Valores seguidos de la misma letra, entre especies y entre tratamientos, indican que no existen diferencias significativas de acuerdo con la prueba de Tukey (DHS de Tukey, *P < 0.05, **P < 0.01, ***P < 0.001; n = 6). (1)Tendencia (P < 0.1). ± error estándar de la media.
El Cuadro 4 muestra las variables fisiológicas analizadas por periodo de medición. La respuesta de las especies, a lo largo del año, indicó diferencias entre tratamientos solo en junio del 2012, donde los plantones en DB presentaron mayores valores en Gs (P < 0.01) y A (P < 0.001) que los plantones en DM y DA. En este mismo mes, los plantones en las parcelas DB y DM no mostraron diferencias en IWUE y fueron estadísticamente mayores que DA (P < 0.05).
Cuadro 4 ANOVA bifactorial de las variables conductancia estomática (Gs), fotosíntesis (A) y eficiencia en el uso del agua (IWUE) de seis especies rebrotadoras y de tres densidades de pinar (DA = 800 a 1 100 árboles·ha-1, DM = 300 a 600 árboles·ha-1 y DB = 100 a 250 árboles·ha-1) evaluadas en cada campaña de medición en las parcelas experimentales en campo.
| Variable fisiológica | Factor | Periodo | |||
|---|---|---|---|---|---|
| mayo 2011 | julio 2011 | noviembre 2011 | junio 2012 | ||
| Gs (mol H2O·m-2·s-1) | Especie | ||||
| Arbutus unedo | 0.10 ± 0.01 a | 0.07 ± 0.01 a | 0.15 ± 0.03 ab | 0.03 ± 0.00 b | |
| Rhamnus alaternus | 0.08 ± 0.02 a | 0.08 ± 0.01 a | 0.22 ± 0.04 a | 0.04 ± 0.00 ab | |
| Quercus ilex | 0.08 ± 0.02 a | 0.08 ± 0.01 a | 0.15 ± 0.02 ab | 0.05 ± 0.00 a | |
| Quercus faginea | 0.05 ± 0.01 a | 0.07 ± 0.01 a | 0.13 ± 0.02 ab | 0.04 ± 0.00 ab | |
| Fraxinus ornus | 0.14 ± 0.02 a | 0.06 ± 0.01 a | 0.10 ± 0.02 b | 0.03 ± 0.00 b | |
| Acer granatense | 0.10 ± 0.01 a | 0.08 ± 0.01 a | 0.10 ± 0.02 b | 0.03 ± 0.00 b | |
| Valor F | 1.8942 | 1.0464 | 2.5788* | 3.5248** | |
| Valor P | 0.1018 | 0.3947 | 0.0309 | 0.0055 | |
| Tratamiento | |||||
| DA | 0.07 ± 0.01 a | 0.07 ± 0.00 a | 0.11 ± 0.02 a | 0.03 ± 0.00 b | |
| DM | 0.09 ± 0.02 a | 0.08 ± 0.00 a | 0.17 ± 0.02 a | 0.03 ± 0.00 b | |
| DB | 0.11 ± 0.02 a | 0.07 ± 0.00 a | 0.14 ± 0.02 a | 0.05 ± 0.00 a | |
| Valor F | 1.9992 | 0.5130 | 0.07196 | 6.1390** | |
| Valor P | 0.1406 | 0.6001 | 2.7014 | 0.0030 | |
| Tratamiento x especie | |||||
| Valor F | 0.5036 | 0.7552 | 0.6953 | 0.42615 | |
| Valor P | 0.8833 | 0.6709 | 0.7262 | 0.1288 | |
| A (µmol CO2·m-2·s-) | Especie | ||||
| Arbutus unedo | 4.84 ± 1.15 a | 5.24 ± 0.57 a | 6.56 ± 1.17 b | 3.50 ± 0.55 a | |
| Rhamnus alaternus | 4.27 ± 1.18 a | 6.41 ± 1.38 a | 10.18 ± 1.20 a | 4.25 ± 0.57 a | |
| Quercus ilex | 3.63 ± 1.15 a | 4.19 ± 0.43 a | 7.82 ± 1.17 ab | 4.85 ± 0.55 a | |
| Quercus faginea | 2.72 ± 1.15 a | 3.77 ± 0.57 a | 6.11 ± 1.17 b | 3.72 ± 0.55 a | |
| Fraxinus ornus | 6.44 ± 1.15 a | 4.84 ± 0.57 a | 5.44 ± 1.20 b | 3.91 ± 0.55 a | |
| Acer granatense | 6.84 ± 1.15 a | 5.37 ± 0.67 a | 5.28 ± 1.24 b | 3.49 ± 0.55 a | |
| Valor F | 1.9376 | 1.5347 | 2.3515* | 0.50698 | |
| Valor P | 0.0946 | 0.1857 | 0.0465 | 0.8657 | |
| Tratamiento | |||||
| AD | 3.62 ± 0.08 a | 4.67 ± 0.45 a | 5.30 ± 0.83 a | 3.01 ± 0.36 b | |
| MD | 5.00 ± 0.08 a | 5.28 ± 0.67 a | 7.65 ± 0.83 a | 3.67 ± 0.36 b | |
| BD | 5.84 ± 0.08 a | 4.92 ± 0.48 a | 7.90 ± 0.88 a | 5.22 ± 0.37 a | |
| Valor F | 1.8319 | 0.72564 | 2.8642 | 9.4263*** | |
| Valor P | 0.1652 | 0.321 | 0.0616 | 0.0001 | |
| Tratamiento x especie | |||||
| Valor F | 0.2298 | 0.5180 | 1.0116 | 0.55319 | |
| Valor P | 0.9926 | 0.8733 | 0.4405 | 0.8818 | |
| IWUE (A/Gs) | Especie | ||||
| Arbutus unedo | 46.76 ± 5.63 ab | 84.65 ± 7.48 a | 57.32 ± 9.85 a | 111.06 ± 9.09 a | |
| Rhamnus alaternus | 33.59 ± 5.79 b | 80.50 ± 7.69 a | 54.09 ± 10.14 a | 111.36 ± 9.36 a | |
| Quercus ilex | 34.20 ± 5.63 b | 61.34 ± 7.48 a | 56.45 ± 9.85 a | 86.16 ± 9.09 a | |
| Quercus faginea | 28.28 ± 5.63 b | 64.06 ± 7.48 a | 64.16 ± 9.85 a | 93.13 ± 9.09 a | |
| Fraxinus ornus | 49.26 ± 5.63 ab | 90.90 ± 7.48 a | 72.24 ± 10.14 a | 117.66 ± 9.09 a | |
| Acer granatense | 61.73 ± 5.63 a | 72.21 ± 7.48 a | 60.16 ± 10.45 a | 106.56 ± 9.09 a | |
| Valor F | 4.9141*** | 2.4561 | 0.4300 | 1.7643 | |
| Valor P | 0.0004 | 0.0382 | 0.8267 | 0.1269 | |
| Tratamiento | |||||
| AD | 38.48 ± 4.33 a | 76.43 ± 5.51 a | 55.20 ± 6.90 a | 90.95 ± 6.41 b | |
| MD | 46.81 ± 4.33 a | 75.21 ± 5.51 a | 61.36 ± 6.90 a | 109.94 ± 6.41 a | |
| BD | 41.85 ± 4.40 a | 75.05 ± 5.59 a | 66.14 ± 7.31 a | 112.10 ± 6.50 a | |
| Valor F | 0.9324 | 0.0185 | 0.5973 | 3.2728* | |
| Valor P | 0.3968 | 0.9816 | 0.5522 | 0.0418 | |
| Tratamiento x especie | |||||
| Valor F | 0.6765 | 0.7089 | 0.7726 | 0.2359 | |
| Valor P | 0.7433 | 0.7139 | 0.6545 | 0.9918 | |
Valor seguido de la misma letra indica que no existen diferencias significativas entre especies y entre tratamientos, por periodo de medición, de acuerdo con la prueba de Tukey (DHS de Tukey, *P < 0.05, **P < 0.01, ***P < 0.001; n = 6). ± error estándar de la media.
Con respecto a las especies, en el mes de mayo de 2011 se encontraron diferencias solo en IWUE; A. granatense tuvo la eficiencia más alta (P < 0.001). En noviembre del 2011, R. alaternus presentó los valores más altos de A y Gs (P < 0.05), mientras que en junio del 2012, solo Gs fue diferente entre las especies, siendo Q. ilex la que obtuvo el valor más alto (P < 0.01). La medición de julio del 2011 no arrojó diferencias significativas de las variables fisiológicas entre especies (P > 0.05). Estos resultados pueden estar asociados a una mayor disponibilidad hídrica en los meses de mayo y noviembre del 2011 y junio del 2012 (Granados et al., 2016). Estudios previos han reportado que las especies caducifolias son las que tienen mayor eficiencia en el uso de agua debido a que son capaces de aprovechar con intensidad los pocos pulsos predecibles y tienen mayores tasas fotosintéticas (Hasselquist, Allen, & Santiago, 2010), sobre todo en primavera (Valladares et al., 2004).
El Cuadro 5 muestra que la dinámica anual de Fv/Fm tuvo periodos específicos (mayo, agosto y noviembre del 2011) donde los plantones marcaron diferencias entre especies. Las especies perennifolias R. alaternus, A. unedo y Q. ilex mostraron mayor Fv/Fm, lo que indicó menor fotoinhibición y, posiblemente, menos daño en el sistema fotosintético (Morales, Abadía, & Abadía, 2006; Vilagrosa et al., 2010). Con respecto a las densidades de pinar, solo se observaron diferencias en los meses de mayo y agosto del 2011, siendo la DA la que obtuvo el valor más alto de Fv/Fm.
Cuadro 5 ANOVA bifactorial de fluorescencia al alba (Fv/Fm) de seis especies rebrotadoras y de tres densidades de pinar (DA = 800 a 1 100 árboles·ha-1, DM = 300 a 600 árboles·ha-1 y DB = 100 a 250 árboles·ha-1) evaluadas en cada campaña de medición en las parcelas experimentales en campo.
| Factor | Periodo de medición de Fv/Fm | ||||
|---|---|---|---|---|---|
| mayo 2011 | julio 2011 | agosto 2011 | noviembre 2011 | junio 2012 | |
| Especie | |||||
| Arbutus unedo | 0.76 ± 0.01 a | 0.76 ± 0.00 a | 0.79 ± 0.01 a | 0.74 ± 0.04 a | 0.80 ± 0.00 a |
| Rhamnus alaternus | 0.73 ± 0.01 a | 0.75 ± 0.00 a | 0.79 ± 0.01 a | 0.75 ± 0.04 a | 0.80 ± 0.00 a |
| Quercus ilex | 0.76 ± 0.01 a | 0.76 ± 0.00 a | 0.78 ± 0.01 a | 0.75 ± 0.04 a | 0.80 ± 0.00 a |
| Quercus faginea | 0.68 ± 0.01 b | 0.75 ± 0.00 a | 0.78 ± 0.01 ab | 0.67 ± 0.04 ab | 0.82 ± 0.00 a |
| Fraxinus ornus | 0.67 ± 0.01 b | 0.76 ± 0.00 a | 0.72 ± 0.01 b | 0.57 ± 0.04 ab | 0.80 ± 0.00 a |
| Acer granatense | 0.73 ± 0.01 a | 0.74 ± 0.00 a | 0.72 ± 0.01 b | 0.53 ± 0.04 b | 0.79 ± 0.00 a |
| Valor F | 9.2786*** | 0.8422 | 2.7618* | 4.5018*** | 1.5881 |
| Valor P | 0.0000 | 0.5228 | 0.0221 | 0.0009 | 0.1702 |
| Tratamiento | |||||
| DA | 0.75 ± 0.01 a | 0.76 ± 0.00 a | 0.80 ± 0.01 a | 0.70 ± 0.03 a | 0.81 ± 0.00 a |
| DM | 0.72 ± 0.01 ab | 0.75 ± 0.00 a | 0.74 ± 0.01 b | 0.66 ± 0.03 a | 0.80 ± 0.00 a |
| DB | 0.70 ± 0.01 b | 0.75 ± 0.00 a | 0.75 ± 0.01 b | 0.65 ± 0.03 a | 0.80 ± 0.00 a |
| Valor F | 4.7811* | 1.6550 | 4.8166** | 0.5380 | 2.9471 |
| Valor P | 0.0103 | 0.1960 | 0.0099 | 0.5855 | 0.0568 |
| Tratamiento x especie | |||||
| Valor F | 1.27 | 1.7460 | 0.3651 | 1.1553 | 0.6194 |
| Valor P | 0.1269 | 0.0826 | 0.9584 | 0.3319 | 0.7936 |
Valor seguido de la misma letra indica que no existen diferencias significativas entre especies y entre tratamientos, por periodo de medición, de acuerdo con la prueba de Tukey (DHS de Tukey, *P < 0.05, **P < 0.01, *P < 0.001; n = 6). ± error estándar de la media.
Intercambio de gases en el experimento en condiciones de vivero
El Cuadro 6 indica que, en condiciones de vivero, los valores más altos de Gs se observaron en condiciones de escasa disponibilidad de luz (EDL), mientras que los menores se registraron en condiciones de alta disponibilidad (TC) (P < 0.05). Por el contrario, la tasa fotosintética A mostró valores significativamente mayores en el TC y MDL (P < 0.001). Los valores más altos de Gs se observaron en EDL (P < 0.05), probablemente porque a plena luz (TC) y, a pesar del riego, el déficit de presión de vapor (VPD) pudo provocar regulación estomática de la pérdida de agua; en contraste, los valores más altos en campo se obtuvieron en condiciones de mayor disponibilidad de luz (DB y DM; P < 0.05; Cuadro 3). En A sí se observó un patrón similar al registrado en campo; los plantones en DB (P < 0.001; Cuadro 3) y TC (P < 0.001) alcanzaron los mayores valores.
Cuadro 6 ANOVA bifactorial de las variables fisiológicas medidas en seis especies nativas rebrotadoras y en tres disponibilidades de luz en vivero.
| Factores e interacción | Intercambio de gases | ||
|---|---|---|---|
| A (µmol CO2·m-2·s-1) | Gs (mol H2O ·m2·s-1) | IWUE (A/Gs) | |
| Especie | |||
| Arbutus unedo | 5.4 ± 0.7 ab | 0.15 ± 0.03 ab | 49.5 ± 7.3 ab |
| Rhamnus alaternus | 7.0 ± 1.3 a | 0.22 ± 0.04 a | 37.9 ± 6.1 b |
| Quecus ilex | 7.7 ± 1.0 a | 0.17 ± 0.00 ab | 46.1 ± 6.0 ab |
| Quercus faginea | 3.6 ± 0.9 b | 0.12 ± 0.01 b | 33.8 ± 10.4 b |
| Fraxinus ornus | 6.1 ± 0.8 ab | 0.12 ± 0.01 b | 51.8 ± 5.9 ab |
| Acer granatense | 6.5 ± 0.8 a | 0.12 ± 0.01 b | 59.5 ± 8.2 a |
| Valor F | 4.878 *** | 3.411 ** | 3.408 * |
| Tratamiento | |||
| TC | 8.2 ± 0.7 a | 0.12 ± 0.01 b | 76.6 ± 4.8 a |
| MDL | 7.5 ± 0.6 a | 0.16 ± 0.02 ab | 46.0 ± 3.3 b |
| EDL | 2.6 ± 0.3 b | 0.17 ± 0.01 a | 17.1 ± 1.9 c |
| Valor F | 40.454 *** | 3.615 * | 75.517 *** |
| Tratamiento x especie | |||
| Valor F | 2.362* | 0.841 | 0.633 |
Gs = Conductancia de estomas; A = fotosíntesis; IWUE = eficiencia en el uso del agua; TC = tratamiento control (100 % de luz); MDL = media disponibilidad de luz (50 %); EDL = escasa disponibilidad de luz (20 %). Valor seguido de la misma letra indica que no existen diferencias significativas entre especies y entre tratamientos (DHS de Tukey, *P < 0.05, **P < 0.01, ***P < 0.001; n = 6). ± error estándar de la media.
Con relación al IWUE, los plantones en TC también mostraron valores más altos, encontrando los más bajos en EDL (P < 0.001); en condiciones de campo, la tendencia fue similar, ya que, aunque las diferencias no fueron significativas entre las densidades de árboles (P > 0.05), el valor de IWUE también fue más bajo cuando hubo menor entrada de luz (densidad alta). Las especies mediterráneas han desarrollado mecanismos para afrontar tanto condiciones de estrés hídrico como de alta iluminación (Gómez-Aparicio et al., 2006; McDowell et al., 2013). En condiciones de campo, debido a la alta radiación, las plantas probablemente ajustaron su rehidratación mediante el agua disponible durante la noche (Valladares & Pearcy, 2002), para mantener el alto intercambio de gases observado y, por consiguiente, un valor alto de IWUE; en vivero, la humedad del suelo no fue el factor limitante. En este caso, los resultados podrían indicar que los factores que definieron la respuesta en el intercambio de gases en campo fueron la cantidad de luz, el VPD asociado a la temperatura y la disponibilidad hídrica (contenido de agua en el suelo:capacidad de campo).
De acuerdo con el Cuadro 6, las especies caducifolias F. ornus y A. granatense y la especie semicaducifolia Q. faginea mostraron tasas de Gs inferiores a la especie perennifolia R. alaternus; A. unedo y Q. ilex mostraron valores intermedios (P < 0.01). Respecto a la fotosíntesis, las tasas más altas se encontraron en Q. ilex, R. alaternus y A. granatense (P < 0.001). Se ha reportado que los individuos adultos de las especies caducifolias, en condiciones naturales, presentan mayores tasas de intercambio de gases (Mediavilla & Escudero, 2003) y son capaces de aprovechar con intensidad los pocos pulsos predecibles de agua, manifestando mayores tasas fotosintéticas (Hasselquist et al., 2010).
La Figura 1 ilustra el análisis de la respuesta de las especies por tratamiento de disponibilidad de luz en vivero. El análisis solo reveló diferencias en Gs en dos especies; A. unedo presentó mayor Gs en EDL, mientras que F. ornus mostró mayores valores de Gs en MDL (P < 0.05). La mayoría de las especies (R. alaternus, Q. ilex, F. ornus y A. granatense) registraron menores valores de A en el tratamiento con menor disponibilidad de luz (EDL; P < 0.05), no observándose diferencias entre MDL y TC. En contraste, los mayores valores en IWUE se reportaron en la mayoría de las especies del tratamiento de máxima disponibilidad de luz (TC) y los menores valores en EDL (P < 0.05). Estos resultados podrían indicar que intensidades lumínicas muy bajas podrían ser perjudiciales para cualquier especie, debido a que la fijación de carbono estaría comprometida.
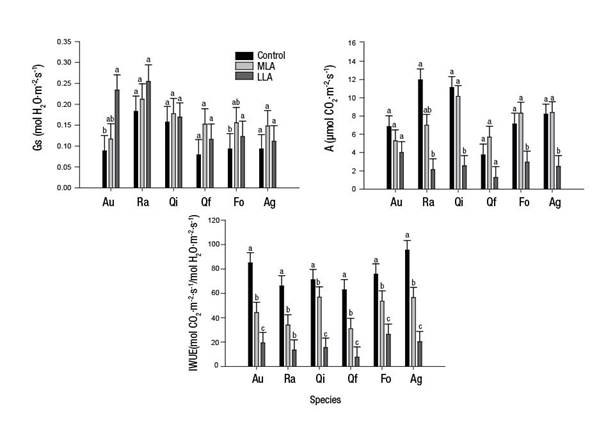
Figura 1 ANOVA de un factor para las variables de intercambio de gases en condiciones de invernadero. Conductancia de estomas (Gs), fotosíntesis (A) y eficiencia en el uso del agua (IWUE) de seis especies rebrotadoras (Au = Arbutus unedo, Ra = Rhamnus alaternus, Qi = Quercus ilex, Qf = Quercus faginea, Fo= Fraxinus ornus, Ag = Acer granatense) bajo diferentes tratamientos de disponibilidad de luz: control (TC = 100 %), media disponibilidad de luz (MDL = 50 %) y escasa disponibilidad de luz (EDL = 20 %). Letras distintas indican diferencias estadísticas entre tratamientos (DHS de Tukey, P < 0.05; n = 6). Las barras indican el error estándar de la media.
Conclusiones
La respuesta de las especies estudiadas en las condiciones de campo reflejó la interacción existente entre humedad del suelo y luz para las plantas, condicionada por la densidad del pinar. En campo, las especies esclerófilas perennifolias como Arbutus unedo, Rhamnus alaternus o Quercus ilex tuvieron mayor capacidad de aclimatación a las condiciones ambientales que las especies caducifolias. Las condiciones abióticas, debidas a la cubierta arbórea, pueden ser determinantes en la respuesta de las especies estudiadas, de acuerdo con su estrategia funcional (perennifolias y caducifolias). En condiciones óptimas de vivero, las especies se comportaron con patrones estándar de respuesta al factor disponibilidad de luz.
Agradecimientos
Este trabajo ha sido financiado por el Ministerio de Economía y Competitividad español, a través del proyecto Survive-2 (CGL2015-69773-C2-2-P MINECO/FEDER), y la Unión Europea, proyecto FUME (EU FP7-Environment, GA. 243888). CEAM recibió el apoyo y la financiación de la Generalitat Valenciana.
REFERENCIAS
Björkman, O., & Demmig, B. (1987). Photon yield of O2 evolution and chlorophyll fluorescence at 77k among vascular plants of diverse origins. Planta, 170(4), 489‒504. doi: 10.1007/BF00402983 [ Links ]
Bladé, I., & Castro-Díez, Y. (2010). Atmospheric trends in the Iberian Peninsula during the instrumental period in the context of natural variability. In F. F. Pérez, & R. Boscolo (Eds.), Climate in Spain: Past, present and future (pp. 25‒41). España: CLIVAR. Retrieved from https://digital.csic.es/handle/10261/33470 [ Links ]
Forner, S. A., Aranda, I., Granier, A., & Valladares, F. (2014). Differential impact of the most extreme drought event the last half century on growth and sap flow in two coexisting Mediterranean trees. Plant Ecology, 215(7), 703‒719. doi: 10.1007/s11258-014-0351-x [ Links ]
Galiano, L., Martínez-Vilalta, J., & Lloret, F. (2011). Carbon reserves and canopy defoliation determine the recovery of Scots pine 4 yr after a drought episode. New Phytologyst, 190(3), 750‒759. doi: 10.1111/j.1469-8137.2010.03628.x [ Links ]
García de la Serrana, R., Vilagrosa, A., & Alloza, J. A. (2015). Pine mortality in southeast Spain after an extreme dry and warm year: Interactions among drought stress, carbohydrates and bark beetle attack. Trees, 29(6), 1791-1804. doi: 10.1007/s00468-015-1261-9 [ Links ]
Gavinet, J., Vilagrosa, A., Chirino, E., Granados, M. E., Vallejo, V. R., & Prévosto, B. (2015). Hardwood seedling establishment below Aleppo pine depends on thinning intensity in two Mediterranean sites. Annals of Forest Science, 72(8), 999‒1008. doi: 10.1007/s13595-015-0495-4 [ Links ]
Gómez-Aparicio, L., Valladares, F., & Zamora, R. (2006). Differential light responses of Mediterranean tree saplings: linking ecophysiology with regeneration niche in four co-occurring species. Tree Physiology, 26(7), 947‒958. doi: 10.1093/treephys/26.7.947 [ Links ]
Gortan, E., Nardini, A., Gascó, A., & Salleo, S. (2009). The hydraulic conductance of Fraxinus ornus leaves is constrained by soil water availability and coordinated with gas exchange rates. Tree Physiology, 29(4), 529‒539. doi: 10.1093/treephys/tpn053 [ Links ]
Granados, M. E., Vilagrosa, A., Chirino, E., & Vallejo, V. R. (2016). Reforestation with resprouter species to increase diversity and resilience in Mediterranean pine forests. Forest Ecology and Management, 362, 231‒240. doi: 10.1016/j.foreco.2015.12.020 [ Links ]
Hasselquist, N. J., Allen, M. F., & Santiago, L. S. (2010). Water relations of evergreen and drought-deciduous trees along a seasonally dry tropical forest chronosequence. Oecologia, 164(4), 881‒890. doi: 10.1007/s00442-010-1725-y [ Links ]
Intergovernmental Panel on Climate Change (IPCC). (2014). Climate Change 2014: Synthesis report. Contribution of working groups I, II and III to the fifth assessment report of the Intergovernmental Panel on Climate. Geneva, Switzerland: Author. Retrieved from https://www.ipcc.ch/site/assets/uploads/2018/05/SYR_AR5_FINAL_full_wcover.pdf [ Links ]
Krause, G., & Weis, E. (1984). Chlorophyll fluorescence as a tool in plant physiology. II. Interpretation of fluorescence signals. Photosynthesis Research, 5(2), 139‒157. doi: 10.1007/BF00028527 [ Links ]
Larcher, W. (1980). Physiological plant ecology. Germany: Springer-Verlag. [ Links ]
Long, S., Humphries, S., & Falkowski, P. (1994). Photoinhibition of photosynthesis in nature. Annual Review of Plant Physiology and Plant Molecular Biology, 45, 633‒662. doi: 10.1146/annurev.pp.45.060194.003221 [ Links ]
Martínez-Vilalta, J., Prat, E., Oliveras, I., & Piñol, J. (2002). Xylem hydraulic properties of roots and stems of nine Mediterranean woody species. Oecologia, 133(1), 19‒29. doi: 10.1007/s00442-002-1009-2 [ Links ]
McDowell, N. G. (2011). Mechanisms linking drought, hydraulics, carbon metabolism, and vegetation mortality. Plant Physiology, 155(3), 1051-1059. doi: 10.1104/pp.110.170704 [ Links ]
McDowell, N. G., Fisher, R. A., Xu, C., Domec, J. C., Hölttä, T., Mackay, D. S., …Pockman, W. T. (2013). Evaluating theories of drought-induced vegetation mortality using a multimodel-experiment framework. New Phytologist, 200(2), 304‒321. doi: 10.1111/nph.12465 [ Links ]
Mediavilla, S., & Escudero, A. (2003). Stomatal responses to drought of mature trees and seedlings of two co-occurring Mediterranean oaks. Forest Ecology and Management, 187(2-3), 281‒294. doi: 10.1016/j.foreco.2003.07.006 [ Links ]
Morales, F., Abadía, A., & Abadía, J. (2006). Photoinhibition and photoprotection under nutrient deficiency, drought, and salinity. In B. Demmig-Adams, W. W. Adams III, & A. K. Mattoo (Eds.), Photoprotection, photoinhibition, gene regulation and environment (pp. 65‒85). The Netherlands: Springer. Retrieved from https://www.springer.com/la/book/9781402035647 [ Links ]
Pausas, J. G., Pratt, B., Keeley, J. E., Jacobsen, A. L., Ramirez, A. R., Vilagrosa, A., …Davis, S. D. (2016). Towards understanding resprouting at the global scale. New Phytologist, 209(3), 945-954. doi: 10.1111/nph.13644 [ Links ]
Pausas, J. G., & Keeley, J. E. (2017). Epicormic resprouting in fire-prone ecosystems. Trends in Plant Science, 22(12), 1008-1015. doi: 10.1016/j.tplants.2017.08.010 [ Links ]
Pérez-Cueva, A. (1994). Atlas climático de la comunidad Valenciana. Valencia, España: Generalitat Valenciana. Retrieved from https://www.llig.gva.es/es/383-9788448203108.html [ Links ]
Rivas-Martínez, S. (1987). Memoria del mapa de series de vegetación de España. Madrid, España: Ministerio de Agricultura, Pesca y Alimentación. Retrieved from https://floramontiberica.files.wordpress.com/2012/09/mapa_series_vegetacion_1987.pdf [ Links ]
Rodríguez-Calcerrada, J., Li, M., López, R., Cano, F. J., Oleksyn, J., Atkin, O. K, …Gil, L. (2016). Drought-induced shoot dieback starts with massive root xylem embolism and variable depletion of nonstructural carbohydrates in seedlings of two tree species. New Phytologist, 213(2), 597-610 doi: 10.1111/nph.14150 [ Links ]
Rodríguez-Rodríguez, M. C., Jordano, P., & Valido, A. (2015). Hotspots of damage by antagonists shape the spatial structure of plant-pollinator interactions. Ecology, 96(8), 2181-2191. doi: 10.6084/m9.figshare.c.3307887.v1 [ Links ]
Sánchez-Salguero, R., Navarro-Cerrillo, R. M., Camarero, J. J., & Fernández-Cancio, A. (2012). Selective drought-induced decline of pine species in southeastern Spain. Climatic Change, 113(3-4), 767-785. doi: 10.1007/s10584-011-0372-6 [ Links ]
StatSoft Inc. (2012). STATISTICA 12. Tulsa, OK, USA: Author. [ Links ]
Urli, M., Porté, A. J., Cochard, H., Guengant, Y., Burlett, R., & Delzon, S. (2013). Xylem embolism threshold for catastrophic hydraulic failure in angiosperm trees. Tree Physiology, 33(7), 672-683. doi: 10.1093/treephys/tpt030 [ Links ]
Valladares, F., Aranda, I., & Sánchez-Gómez, D. (2004). La luz como factor ecológico y evolutivo para las plantas y su interacción con el agua. Ecología del bosque mediterráneo en un mundo cambiante (pp. 335-369). Madrid, España: Ministerio del Medio Ambiente EGRAF. [ Links ]
Valladares, F., & Pearcy, E. F. (2002). Drought can be more critical in the shade than in the sun: a field study of carbon gain and photo-inhibition in a Californian shrub during a dry El Niño year. Plant Cell and Environmental, 25(6), 749-759. doi: 10.1046/j.1365-3040.2002.00856.x [ Links ]
Vilagrosa, A., Bellot, J., Vallejo, V. R., & Gil-Pelegrin, E. (2003). Cavitation, stomatal conductance, and leaf dieback in seedlings of two co-occurring Mediterranean shrubs during an intense drought. Journal of Experimental Botany, 54(390), 2015-2024. doi: 10.1093/jxb/erg221 [ Links ]
Vilagrosa, A., Hernández, E. I., Luis, V. C., Cochard, H., & Pausas, J. G. (2014). Physiological differences explain the co-existence of different regeneration strategies in Mediterranean ecosystems. New Phytologist, 201(4), 1277-1288. doi: 10.1111/nph.12584 [ Links ]
Vilagrosa, A., Morales, F., Abadia, A., Bellot, J., Cochard, H., & Gil-Pelegrin, E. (2010). Are symplast tolerance to intense drought conditions and xylem vulnerability to cavitation coordinated. An integrated analysis of photosynthetic, hydraulic and leaf level processes in two Mediterranean drought resistant species. Environmental and Experimental Botany, 69(3), 232-242. doi: 10.1016/j.envexpbot.2010.04.013 [ Links ]
Walker, W. R. (1989). Guidelines for designing and evaluating surface irrigation system. Rome, Italy: Food and Agriculture Organization of the United Nations (FAO). Retrieved from http://www.fao.org/3/T0231E/T0231E00.htm [ Links ]
Recibido: 07 de Diciembre de 2018; Aprobado: 23 de Julio de 2019











 texto em
texto em 


