Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo serie ciencias forestales y del ambiente
versão On-line ISSN 2007-4018versão impressa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.25 no.3 Chapingo Set./Dez. 2019 Epub 19-Fev-2021
https://doi.org/10.5154/r.rchscfa.2018.12.088
Artículo científico
Biocontrol de Trichoderma harzianum Rifai sobre Fusarium circinatum Nirenberg & O´Donnell en plántulas de Pinus greggii Engelm. ex Parl. en tres sustratos
1Universidad Autónoma Chapingo, División de Ciencias Forestales. km 38.5 carretera México-Texcoco. C. P. 56230. Texcoco, Estado de México, México.
2Colegio de Postgraduados, Campus Montecillo, Postgrado en Ciencias Forestales. C. P. 56230. Montecillo, Texcoco, Estado de México, México.
3Colegio de Postgraduados, Campus Montecillo, Postgrado en Fitosanidad-Fitopatología. C. P. 56230. Montecillo, Texcoco, Estado de México, México.
Introducción:
El damping-off, secadera o chupadera, es una enfermedad frecuente en los viveros forestales que ocasiona pérdidas económicas significativas a nivel mundial.
Objetivo:
Evaluar la patogenicidad e incidencia de Fusarium circinatum Nirenberg & O´Donnell en plántulas de Pinus greggii Engelm. ex Parl., y el uso de Trichoderma harzianum Rifai como biocontrol en tres sustratos.
Materiales y métodos:
El hongo fitopatógeno F. circinatum (cepa SF5) y el antagonista T. harzianum (cepa comercial T-22 KRL-AG2) se inocularon en P. greggii. Se utilizaron tres sustratos a base de turba de musgo, aserrín y corteza de pino. Se evaluaron la incidencia de la enfermedad y los índices morfológicos de la planta (diámetro del tallo, altura, relación peso seco aéreo/peso seco radical, índice de esbeltez e índice de calidad de Dickson). Los datos se sometieron a un análisis de varianza (procedimiento GLM de SAS versión 9.0) y comparación de medias de Tukey (P ≤ 0.05).
Resultados y discusión:
La patogenicidad se comprobó mediante los postulados de Koch. La incidencia de la enfermedad fue alta (> 93 %) en los sustratos a base de turba de musgo y corteza de pino, y fue menor en el sustrato a base de aserrín (78 %). Trichoderma harzianum y el sustrato a base de aserrín redujeron la incidencia a 66 %. La calidad de la planta, con base en los índices morfológicos, fue mayor en el sustrato de turba de musgo.
Conclusión:
Fusarium circinatum es patogénico en P. greggii; el sustrato a base de aserrín y T. harzianum redujeron la incidencia de la enfermedad en las plántulas.
Palabras clave: Damping-off; secadera; antagonista; turba de musgo; aserrín; corteza de pino
Introduction:
Damping-off is a common disease in forest nurseries that causes significant economic losses worldwide.
Objective:
To evaluate the pathogenicity and incidence of Fusarium circinatum Nirenberg & O´Donnell in seedlings of Pinus greggii Engelm. ex Parl., and the use of Trichoderma harzianum Rifai as a biocontrol in three substrates.
Materials and methods:
The phytopathogenic fungus F. circinatum (strain SF5) and the antagonist T. harzianum (commercial strain T-22 KRL-AG2) were inoculated into P. greggii. Three substrates based on peat moss, pine sawdust and pine bark were used. The incidence of the disease and the morphological indices of the plant (stem diameter, height, aerial dry weight/root dry weight ratio, slenderness index and Dickson quality index) were evaluated. The data were subjected to an analysis of variance (GLM procedure of SAS version 9.0) and Tukey's multiple comparison test (P ≤ 0.05).
Results and discussion:
Pathogenicity was tested using Koch's postulates. The incidence of the disease was high (> 93 %) in substrates based on peat moss and pine bark, and was lower in the sawdust-based substrate (78 %). Trichoderma harzianum and the sawdust-based substrate reduced the incidence to 66 %. Plant quality, based on the morphological indices, was highest in the peat moss substrate.
Conclusion:
Fusarium circinatum is pathogenic in P. greggii; the sawdust-based substrate and T. harzianum reduced the incidence of the disease in the seedlings.
Keywords: Damping-off; antagonist; peat moss; sawdust; pine bark
Introducción
En los viveros forestales de México se ha utilizado un sustrato llamado “mezcla base” compuesto por turba de musgo, vermiculita y perlita en proporción 3:1:1. Esta mezcla es muy utilizada por ser un sustrato con características físicas y químicas idóneas para la producción de planta; sin embargo, los componentes principales se importan a costos altos, lo que impacta de manera directa en el costo de producción. Actualmente existen sustratos alternativos preparados a partir de materiales como corteza y aserrín de pino, fibra de coco o cascarilla de arroz que pueden sustituir la mezcla base para la producción de planta y reducir su costo unitario en los viveros forestales (Aguilera-Rodríguez, Aldrete, Martínez-Trinidad, & Ordaz-Chaparro, 2016).
La calidad de la planta está determinada por características genéticas, morfológicas, fisiológicas y sanitarias; en esta última, los agentes fitopatógenos pueden tener impacto económico (Villar, 2003). Fusarium circinatum Nirenberg & O´Donnell (teleomorfo = Gibberella circinata) se presenta en plantaciones de pino y es el agente causal del cancro resinoso. En los viveros, este hongo causa damping-off, pudrición de raíz antes y después de la emergencia, marchitamientos y pudrición del cuello y tallo en plántulas de pino (García-Díaz et al., 2017; Herron et al., 2015). El control de este patógeno es complicado y costoso ya que se usan tratamientos químicos principalmente que, además de poner en peligro el equilibrio natural y la salud humana (Cubillos, Páez, & Mejía, 2011; Solano-Bonilla, & Brenes-Chacón, 2012), causan fitotoxicidad y resistencia, ocasionando el incremento de dosis y número de aplicaciones (Reglinski & Dick, 2005; Romero, Crosara, & Baraibar, 2008).
Una alternativa para controlar F. circinatum es el uso de agentes de control biológico como el hongo Trichoderma (Okorski, Oszako, Nowakowska, & Pszczólkowska, 2014). Las especies más empleadas en el biocontrol son T. virens Mater., T. viride Pers. y T. harzianum Rifai, siendo este último, el hongo antagonista de mayor uso comercial y el más investigado para su aplicación en el control biológico (Benítez, Rincón, Limón, & Codón, 2004; Harman, Björkman, Ondik, & Shoresh, 2008). En Nueva Zelanda, Cummings et al. (2016) realizaron un estudio a nivel de viveros y plantaciones en el cual analizaron charolas, sustratos y suelos; los investigadores aislaron e identificaron, por morfología y análisis filogenético, 16 especies nativas de Trichoderma con posibilidad de control para fitopatógenos.
Los mecanismos de acción de Trichoderma sobre los hongos fitopatógenos son, principalmente, la competencia por nutrientes y la producción de antibióticos, tales como trichodermina, suzukacilina, alameticina, dermadina, trichotecenos y trichorzianina, cuya función es inhibir la germinación de esporas (Infante, Martínez, González, & Reyes, 2009). El antagonista incrementa su velocidad de desarrollo cubriendo la superficie y evitando el establecimiento del patógeno por inducción de resistencia en las plantas (Desender, Andrivon, & Val, 2007). En la interacción con las raíces, Trichoderma spp. confiere beneficios como la promoción del crecimiento y el aumento de la resistencia sistémica, teniendo efectos en el desarrollo y productividad de la planta (Benítez, Rincón, Limón, & Codón, 2004; Dumroese, Kim, & James, 2012).
En México, la aplicación de T. harzianum como antagonista de Fusarium es común en los viveros forestales; sin embargo, se conoce poco sobre el efecto y la eficacia del antagonista al incorporarse en diferentes sustratos. Por lo anterior, el objetivo de este estudio fue evaluar la patogenicidad e incidencia de F. circinatum en plántulas de P. greggii sembradas en tres sustratos y el uso de T. harzianum como mecanismo de biocontrol contra el patógeno.
Materiales y métodos
Sustratos y semilla
El experimento se llevó a cabo en los invernaderos (19˚ 29´ 34” N y 98˚ 53´ 38” O, altitud de 2 240 m) de la División de Ciencias Forestales (DiCiFo) de la Universidad Autónoma Chapingo en Texcoco, México.
Los sustratos evaluados fueron los siguientes: S1 = turba de musgo (PROMIX®), agrolita y vermiculita; S2 = aserrín de pino, corteza de pino y turba de musgo; y S3 = corteza de pino, aserrín de pino y turba de musgo; todos en proporción 60:20:20 (Hernández-Zarate, Aldrete, Ordaz-Chaparro, López-Upton, & López-López, 2014). El aserrín se obtuvo de un aserradero local con material fresco (no mayor de 15 días de aserrado) de Pinus patula Schltdl. & Cham. La corteza en compost de Pinus douglasiana Martínez se obtuvo de la empresa MASVI en la región sur de Jalisco. A las mezclas de cada sustrato se agregó fertilizante de liberación controlada Osmocote Plus® 15-9-12 en dosis de 7 g·L-1, con tiempo de liberación de ocho a nueve meses.
Se utilizaron mesas portatubetes con 42 cavidades y tubetes de 170 mL. La semilla de P. greggii se obtuvo de un banco de germoplasma localizado en la comunidad de Pueblo Nuevo, municipio de Chignahuapan, Puebla (19° 52´ 60" N y 98° 06´ 36" O y altitud de 2 450 m). Después de llenar los tubetes con cada tipo de sustrato, la siembra se hizo en forma directa colocando dos semillas por cavidad. Un mes después se hizo un raleo para dejar una sola plántula por cavidad y, a finales de mayo, cuando las plantas tenían 45 días de edad (25 de mayo de 2015), se realizó la inoculación con F. circinatum y la primera aplicación de T. harzianum al sustrato. El riego se aplicó diariamente en forma superficial durante la germinación y emergencia de las plantas; posteriormente, cada tercer día. El experimento tuvo una duración de 13 semanas (junio a septiembre).
Plantas de Pinus greggii inoculadas con Fusarium circinatum
Las plantas de P. greggii se inocularon con la cepa SF5 aislada del Vivero Forestal Militar de Atlangatepec, Tlaxcala, y obtenida del cepario del laboratorio de Parasitología Forestal de la DiCiFo. La cepa está identificada, morfológicamente y con tres marcadores moleculares, como F. circinatum; sus números de accesión depositados en el banco de genes (GenBank) son ITS (KX276596), TEF (KZ337005) e IGS (KX306890). Para la inoculación de F. circinatum (Fc) se tomaron cepas puras con ocho días de crecimiento en medio de cultivo PDA con desarrollo de micelio y esporulación del hongo. El fitopatógeno se aplicó mediante inyección de 20 mL de una suspensión de 7.9 x 104 esporas·mL-1 (García-Díaz et al., 2017) al sustrato (S) de cada tubete. Los tratamientos inoculados con F. circinatum fueron T2 (S1+Fc), T6 (S2+Fc) y T10 (S3+Fc) (Cuadro 1).
Cuadro 1 Tratamientos utilizados en la producción de Pinus greggii en tubetes individuales de 170 mL.
| Número de tratamiento | Tratamientos |
|---|---|
| T1 | S1 + Fusarium circinatum (Fc) + Trichoderma harzianum (Th) |
| T2 | S1 + Fc |
| T3 | S1 + Th |
| T4 | S1-Te (sin inocular) |
| T5 | S2 + Fc + Th |
| T6 | S2 + Fc |
| T7 | S2 + Th |
| T8 | S2-Te |
| T9 | S3 + Fc + Th |
| T10 | S3 + Fc |
| T11 | S3 + Th |
| T12 | S3-Te |
S1: turba de musgo, perlita y vermiculita; S2: aserrín, corteza de pino y turba de musgo; S3: corteza de pino, aserrín de pino y turba de musgo. La proporción de materiales en las tres mezclas fue 60:20:20.
Plantas de Pinus greggii inoculadas con Trichoderma harzianum
Se utilizó la cepa comercial T-22 KRL-AG2 de T. harzianum (Th) de PHC® en dosis de 3.4 g·L-1 de agua, con una dilución de 107 esporas·g-1 de peso seco. La inoculación se realizó aplicando 20 mL por tubete, mediante inyección al sustrato, en tres aplicaciones. La primera aplicación de Th se realizó el 25 de mayo al momento de establecer el experimento. Las otras dos aplicaciones se realizaron con intervalo mensual (25 de junio y 25 de julio de 2015). Los tratamientos inoculados con T. harzianum fueron T3 (S1+Th), T7 (S2+Th) y T11 (S3+Th) (Cuadro 1).
Plantas de Pinus greggii inoculadas con Fusarium circinatum y Trichoderma harzianum
En la primera aplicación, se utilizó una mezcla de 10 mL de F. circinatum y 10 mL de T. harzianum (Fc+Th) con las mismas concentraciones y dosis empleadas en los tratamientos individuales. Posteriormente, se realizaron otras dos aplicaciones (una cada mes) con solo T. harzianum. La mezcla se inyectó en los tubetes correspondientes de cada sustrato. Los tratamientos inoculados con la mezcla fueron T1 (S1+Fc+Th), T5 (S2+Fc+Th) y T9 (S3+Fc+Th) (Cuadro 1). En cada sustrato, el tratamiento sin aplicación de hongos se usó como testigo: T4 (S1-Te), T8 (S2-Te) y T12 (S3-Te) (Cuadro 1).
Variables evaluadas
Patogenicidad e incidencia de Fusarium circinatum
La patogenicidad de la cepa F. circinatum se determinó por su capacidad para causar enfermedad, mediante el registro semanal de los síntomas típicos de la secadera y pudrición de la raíz. Al final del experimento, algunas porciones de raíz de las plántulas enfermas se sembraron en medio de cultivo PDA con sulfato de estreptomicina (0.05 mg·L-1), para el reaislamiento del patógeno y corroboración de los postulados de Koch. La incidencia de F. circinatum se evaluó semanalmente y se obtuvo el porcentaje acumulado de plantas enfermas. La incidencia y patogenicidad se evaluaron durante 13 semanas desde mediados de junio hasta finales de septiembre de 2015.
El efecto del hongo antagonista sobre la incidencia y patogenicidad se evaluó con la mezcla de F. circinatum más T. harzianum (Fc+Th) en los tres sustratos.
Índices morfológicos
Los índices morfológicos se evaluaron en los tratamientos inoculados con T. harzianum (T3: S1+Th, T7: S2+Th y T11: S3+Th) y sin inocular (T4: S1-Te, T8: S2-Te y T12: S3-Te). La evaluación se realizó a finales de octubre de 2015, seis meses después de la siembra. Las variables de estudio fueron: diámetro del tallo (D), medido en la sección donde se diferencia de la raíz principal; altura de la parte aérea (A), obtenida desde el punto donde se midió el diámetro del tallo hasta el ápice de la yema terminal; peso seco de la raíz (PSR) y peso seco de la parte aérea (PSA), determinados con una balanza analítica (OHAUS, modelo Galaxy 200), después de la deshidratación de las plantas en horno de secado (FELISA, FE-143) a 70 °C durante 72 h. También se evaluó la relación peso seco de la parte aérea sobre el peso seco de la raíz (PSA/PSR); índice de esbeltez (IE), obtenido al dividir la altura de la planta (cm) entre el valor del diámetro (mm); e índice de calidad de Dickson (ICD) obtenido con la ecuación ICD = PST/(A/D) + (PSA/PSR), donde PST es el peso seco total de la planta (Dickson, Leaf, & Hosner, 1960).
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar, el cual fue representado por el modelo siguiente:
Yij = µ + Ti + eij
donde,
Yij |
variable respuesta en la j-ésima repetición del i-ésimo tratamiento |
µ |
efecto total de la media |
Ti |
efecto atribuido al i-ésimo tratamiento |
Eij |
error del componente aleatorio |
Se utilizaron tres sustratos (S1, S2 y S3) con y sin F. circinatum (Fc), con y sin T. harzianum (Th), para un total de 12 tratamientos con cuatro repeticiones (Cuadro 1). Cada repetición fue una mesa portatubetes de 42 cavidades; la unidad experimental estuvo constituida por las 20 plantas del centro (80 plántulas de P. gregii por tratamiento, dando un total de 960 plántulas evaluadas). Los estándares morfológicos se midieron en las plantas con y sin Th en los tres sustratos; la unidad experimental se conformó de 15 plantas al azar de la parte central de cada mesa portatubetes (60 plántulas de P. gregii por seis tratamientos = 360 plantas). Los datos se sometieron a un análisis de varianza mediante el procedimiento GLM de SAS, versión 9.0 (Statistical Analysis System [SAS Institute], 2002) y comparación de medias de Tukey (P ≤ 0.05).
Resultados y discusión
Patogenicidad de Fusarium circinatum en plántulas de Pinus greggii
La patogenicidad se determinó con base en la capacidad del hongo F. circinatum cepa SF5 para causar enfermedad, la cual se manifestó a los 20 días después de la inoculación (ddi). Robles, Gómez, Macas, Sánchez, y Torres-Gutiérrez (2014) inocularon plantas de babaco (Vasconcellea × heilbornii [V. M. Badillo] V. M. Badillo) con F. oxysporum Schltdl. mediante heridas en las raíces y observaron síntomas a los 15 días, mientras que cuando inyectaron el inóculo al sustrato, los síntomas tardaron hasta un mes en manifestarse.
La primera manifestación de síntomas de la enfermedad en las plántulas de P. greggii se registró en el sustrato hecho a base de corteza de pino (S3) (Figura 1A); sin embargo, se apreció de manera similar en los tres sustratos durante la primera semana. Las plántulas mostraron estrangulamiento del tallo y marchitamiento del brote principal (Figura 1B); posteriormente, las acículas se tornaron amarillentas y de color rojizo. Esto mismo lo manifiestan Soria, Alonso, y Bettucci (2012), al mencionar que, los síntomas aéreos en las plántulas de Pinus taeda L. no se manifiestan hasta que el patógeno alcanza la zona del cuello, lo que se traduce en marchitamiento, pérdida de color (enrojecimiento) y secado de las acículas hasta la muerte. Al extraer plántulas enfermas se observó pudrición de la raíz principal y secundarias; las raíces manifestaron color café claro. En las raíces de P. greggii inoculadas con F. circinatum no se realizaron heridas y aun así se presentó la enfermedad; esto coincide con Peterson (2008), quien señala que Fusarium spp. es capaz de infectar directamente en el tejido, pero difiere con Soria et al. (2012), quienes mencionan que la infección está asociada a lesiones o heridas en la corteza u otros tejidos en los árboles, debido a que este hongo es incapaz de penetrar directamente en el tejido.

Figura 1 Patogenicidad y efecto de Fusarium circinatum en plántulas de Pinus greggii sembradas en tres sustratos. A) Plántulas de tres y cinco meses de edad con el sustrato de corteza de pino, aserrín de pino y turba de musgo (S3) en proporción 60:20:20. B) Síntomas con doblamiento del brote principal y decaimiento. C) Plántulas con acículas amarillentas y de color rojizo. D) Tallo de la planta con micelio y esporodoquios de F. circinatum. E y F) Cepas de los reaislamientos de F. circinatum.
Los síntomas fueron más evidentes cuando la planta tenía de cuatro a seis meses de edad, ya que manifestó doblamiento del brote principal, decaimiento, marchitamiento con cambios paulatinos de color marrón hasta quedar completamente rojizos, lo cual se considera un síntoma de muerte (Figura 1C). Esto coincide con los síntomas descritos por Herron et al. (2015), quienes señalan que las plántulas de un año presentan caída del brote terminal y decoloración de acículas.
Por otra parte, la pudrición de raíces fue evidente, ya que fueron muy quebradizas; esto se apreció en las plantas inoculadas del S1 y S3 cuando se extrajeron del tubete. Cuando la infección fue severa, se observó micelio abundante en el cuello de la raíz y tallo, y formación de esporodoquios color blanco a naranja (Figura 1D). De un total de 480 plantas inoculadas con F. circinatum, se realizaron 424 aislamientos de los hongos asociados, dando 88 % de reaislamientos positivos del patógeno (Figuras 1E y 1F); con esta identificación se comprobaron los postulados de Koch.
El efecto de F. circinatum en P. greggii mostró un porcentaje alto de mortalidad, coincidiendo con lo argumentado por García-Díaz et al. (2017) y Coutinho, Steenkamp, Mongwaketsi, Wilmont, y Wingfield (2007) al mencionar que F. circinatum es el patógeno más importante en plántulas de pino en diferentes partes del mundo. También Gordon, Swett, y Wingfield (2015) reportan especies de Fusarium causando daños significativos en plántulas de coníferas y señalan a F. oxysporum como la más importante causando pudrición del hipocótilo en plántulas de vivero.
Incidencia de Fusarium circinatum en plántulas de Pinus greggii
Los resultados de este bioensayo indican que la mezcla y la proporción en la que se prepararon los sustratos tuvieron efecto en la incidencia de la enfermedad ocasionada por F. circinatum. La importancia de este patógeno se muestra en la Figura 2, donde se observa que hubo un efecto directo en las plántulas de P. greggii en las primeras cuatro semanas después de la inoculación del sustrato en vivero.
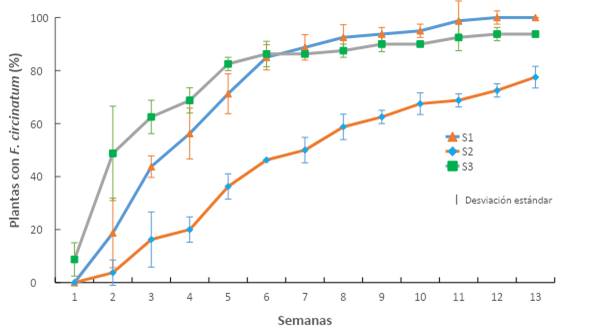
Figura 2 Incidencia acumulada de Fusarium circinatum inoculado en plantas de Pinus greggii creciendo en tres sustratos: S1 = turba de musgo, perlita y vermiculita; S2 = aserrín, corteza de pino y turba de musgo; S3 = corteza de pino, aserrín y turba de musgo. Todos los sustratos se formularon en proporción 60:20:20.
Las plántulas desarrolladas en el S2 a base de aserrín presentaron menor incidencia de F. circinatum que las desarrolladas en los S1 (a base de turba de musgo) y S3 (a base de corteza de pino), sobre todo en las primeras cuatro semanas de crecimiento. En las siguientes nueve semanas, el porcentaje incrementó en forma paulatina hasta alcanzar una incidencia de 94 % en el S3 y 99 % en el S1, mientras que en el S2 fue de 78 %. Los resultados en el S1 son similares a los reportados por Swett y Gordon (2015), quienes registraron una incidencia del 97 %, al inocular F. circinatum, aislado de pino, en plantas de maíz con sustrato a base de turba de musgo.
El S2 alcanzó una incidencia de 78 %; esto indica que el sustrato a base de aserrín puede ser una alternativa para atenuar la incidencia de la enfermedad por F. circinatum en la producción de planta en los viveros. Adicionalmente, se podrían reducir costos tal como lo señalan Aguilera et al. (2016), quienes afirman que los sustratos mezclados con aserrín y corteza de pino se usan con éxito desde 2003 en algunos viveros del centro de México.
Trichoderma harzianum como biocontrol de Fusarium circinatum
El Cuadro 2 muestra los resultados del efecto de T. harzianum sobre F. circinatum en plantas de P. greggii. En general, en cada sustrato, se encontró que los tratamientos que contenían T. harzianum (T1, T5 y T9) tuvieron niveles menores de incidencia de plantas enfermas en comparación con los tratamientos donde solo se aplicó F. circinatum (T2, T6 y T10); sin embargo, a nivel estadístico, la incidencia fue significativamente similar (P > 0.05). De acuerdo con el Cuadro 2, de todos los tratamientos, el T5 (S2+Fc+Th) a base de aserrín e inoculado con T. harzianum obtuvo la incidencia más baja (66 %), mientras que en el T2 (S1+Fc) sin T. harzianum se registró la mayor incidencia de la enfermedad (99 %). Al parecer el uso del S2 contribuyó a reducir la incidencia de la enfermedad.
Cuadro 2 Efecto de Trichodema harzianum (Th) como biocontrol de Fusarium circinatum (Fc) a los 30, 60 y 90 días después de la inoculación (ddi) en plantas de Pinus greggii creciendo en tres sustratos.
| Núm. de tratamiento | Tratamiento | Incidencia de plantas enfermas (%) | ||
|---|---|---|---|---|
| 30 ddi | 60 ddi | 90 ddi | ||
| T1 | S1+Fc+Th | 21 ab | 69 ab | 86 a |
| T2 | S1+Fc | 56 bc | 88 ab | 99 a |
| T5 | S2+Fc+Th | 15 a | 43 a | 66 a |
| T6 | S2+Fc | 20 ab | 61 ab | 75 a |
| T9 | S3+Fc+Th | 11 a | 64 a | 86 a |
| T10 | S3+Fc | 69 c | 91 b | 93 a |
S1: turba de musgo, perlita y vermiculita; S2: aserrín de pino, corteza de pino y turba de musgo; S3: corteza de pino, aserrín de pino y turba de musgo; la proporción de materiales en las tres mezclas fue 60:20:20. Valores promedio con distinta letra en una columna son estadísticamente diferentes de acuerdo con la prueba de Tukey (P ≤ 0.05). Los tratamientos T3, T4, T7, T8, T11 y T12 no se muestran en el cuadro, debido a que no fueron inoculadas con F. circinatum y no mostraron incidencia.
Cabe señalar que solo se realizaron tres aplicaciones de T. harzianum, por lo que se sugiere aumentar el número tal como lo recomiendan Mitchell, Zwolinski, Jones, y Coutinho (2004), quienes mencionan que las aplicaciones con T. harzianum deben continuar durante 180 días una vez que la plántula emerge. También sería importante determinar si T. harzianum es capaz de sobrevivir y mantenerse viable en los sustratos para ejercer su antagonismo; en este sentido, Romero et al. (2008) estudiaron el comportamiento de una cepa de T. harzianum en dos sustratos de uso comercial y encontraron que el sustrato a base de corteza en compost presentó mayor número de esporas por gramo de sustrato.
Cubillos et al. (2011) evaluaron seis cepas del hongo F. solani (Mart.) Sacc. en el cultivo de maracuyá (Passiflora edulis fo. flavicarpa O. Deg.) y señalaron que cuando primero se aplica T. harzianum existe mejor respuesta de biocontrol (86 a 100 % de plantas sanas) que preinfectando las plántulas con el patógeno; sin embargo, también indicaron un efecto positivo cuando aplicaron primero F. solani (13 a 80 %).
Reglinski y Dick (2005) señalan que la supresión de la enfermedad del damping-off fue más eficaz cuando se añadió Trichoderma al medio de crecimiento cuatro días antes de la inoculación del patógeno y que fue ineficaz cuando se añadió cuatro días después de la inoculación.
Mousseaux, Dumroese, James, Wenny, y Knudsen (1998) probaron el uso de T. harzianum para control del patógeno F. oxysporum en plántulas de Pseudotsuga menziesii (Mirb.) Franco y obtuvieron mortalidades acumuladas de 6 % en los tratamientos con T. harzianum, 70 % con F. oxysporum, 80 % en la mezcla de ambos hongos y 5 % en el testigo. Lo anterior difiere con la presente investigación, ya que los tratamientos inoculados con T. harzianum y el testigo no presentaron mortalidad. Por otra parte, Martínez-Álvarez, Alves-Santos, y Diez (2012) señalan que T. harzianum, en diluciones de 107, 106 y 105, tuvo efecto significativo de control contra F. circinatum a nivel in vitro, pero en las plántulas de P. radiata en vivero no obtuvieron resultados satisfactorios.
Índices morfológicos de plántulas de Pinus greggii inoculadas con Trichoderma harzianum en tres sustratos
El Cuadro 3 presenta las características morfológicas e índices de calidad de planta de P. greggii a los seis meses de edad. De acuerdo con la información, las plántulas con mayor diámetro en el cuello de la raíz se obtuvieron en los tratamientos con S1 y S3 (T3, T4, T11 y T12) con valores de 3.03 mm a 3.17 mm, por lo cual se considerarían plántulas de calidad media; para obtener una calidad alta, el diámetro de la planta debió ser mayor de 4.00 mm (Prieto & Sáenz, 2011). Los valores más bajos en calidad de diámetro (P ≤ 0.05) se presentaron en el T7 (S2+Th = 2.67 mm) y T8 (S2-Te = 2.61 mm) que contenían sustrato a base de aserrín de pino.
Cuadro 3 Características morfológicas e índices de calidad de planta de Pinus greggii a los seis meses de edad, sembradas en tres sustratos (S) inoculados con Trichoderma harzianum (Th).
| Tratamiento | D (mm) | A (cm) | PSA (g) | PSR (g) | RPA/R | IESB | ICD |
|---|---|---|---|---|---|---|---|
| T3 (S1+Th) | 3.11 a | 27.46 a | 1.35 a | 0.37 ab | 3.75 a | 8.90 a | 0.13 bc |
| T4 (S1+Te) | 3.17 a | 28.14 a | 1.42 a | 0.43 a | 3.65 a | 8.95 a | 0.14 ab |
| T7 (S2+Th) | 2.67 b | 20.71 b | 0.96 c | 0.42 a | 2.35 c | 7.84 b | 0.13 bc |
| T8 (S2+Te) | 2.61 b | 17.70 c | 0.78 d | 0.34 b | 2.33 c | 6.84 c | 0.12 c |
| T11 (S3+Th) | 3.03 a | 22.05 b | 1.07 bc | 0.42 a | 2.60 bc | 7.37 bc | 0.15 ab |
| T12 (S3+Te) | 3.04 a | 21.39 b | 1.14 b | 0.43 a | 2.71 bc | 7.11 c | 0.16 a |
Valores promedio en una columna con diferente letra son estadísticamente diferentes de acuerdo con la prueba de Tukey (P ≤ 0.05). S1: turba de musgo, perlita y vermiculita; S2: aserrín de pino, corteza de pino y turba de musgo; S3: corteza de pino, aserrín de pino y turba de musgo; la proporción de materiales fue 60:20:20. Te = sin inocular, D = diámetro del tallo; A = altura de la planta; PSA = peso seco de la parte aérea; PSR = peso seco de la raíz; RPA/R = relación aérea/raíz (peso seco aéreo/peso seco radical); IESB = índice de esbeltez; ICD = índice de calidad de Dickson. Los tratamientos T1, T2, T5, T6, T9, y T10 no se muestran debido a la mortandad de la planta por el patógeno.
Los tratamientos con el S1 (T3 = 27.46 cm y T4 = 28.14 cm), a base de turba de musgo, permitieron mayor altura en las plántulas; de hecho, la altura fue mayor que el intervalo de 15 a 25 cm manejado por Sáenz, Villaseñor, Muñoz, Rueda, y Prieto (2010), para considerar a una planta de alta calidad. El T8 que corresponde al sustrato a base de aserrín de pino sin inocular (S2-Te) produjo el valor más bajo en altura (17.70 cm). Los resultados coinciden con Castro-Garibay, Aldrete, López-Upton, y Ordaz-Chaparro (2018), quienes encontraron que el sustrato a base de turba de musgo mostró los mejores crecimientos en altura y diámetro de P. greggii var. australis Donahue, Jeffrey K. & López, A. R.
Los valores de altura (a excepción de los obtenidos con el S1) y diámetro estuvieron por debajo de los mínimos establecidos (altura de 25 a 30 cm y diámetro ≥4 mm) en los criterios de la Norma Mexicana para la Certificación de la Operación de Viveros Forestales NMX-AA-170-SCFI-2016 (Secretaría de Economía [SE], 2016) para P. greggii, probablemente debido al efecto sombra del invernadero y a que las plántulas requerían más tiempo en el vivero. Villar (2003) menciona que la altura de la parte aérea y el diámetro en el cuello de la raíz, junto con las características cualitativas, son atributos considerados en la calidad de planta. Prieto y Sáenz (2011) manejan el diámetro del tallo ≥4 mm y una altura de 15 a 25 cm para especies de pinos nativos de la Sierra Madre Occidental.
El peso seco aéreo también fue estadísticamente mayor (P ≤ 0.05) en los tratamientos del S1 (T3 = 1.35 g y T4 =1.42 g), mientras que el más bajo se registró en las plántulas sembradas en el S2 sin inocular (T8 = 0.78 g). En este mismo tratamiento (T8) también se registró el menor peso seco de la raíz (0.34 g). La relación parte aérea/raíz más alta se obtuvo en los tratamientos con el S1 (T3 = 3.75 g y T4 = 3.65 g). La biomasa aérea fue mayor que la biomasa subterránea, lo que ocurre comúnmente en varias especies forestales.
Los tratamientos del S1 presentaron índices de esbeltez más altos (T3 = 8.90 y T4 = 8.95) que el resto de los tratamientos, lo cual no es deseable, ya que representan un desbalance en las plantas. Lo anterior influyó en el índice de calidad de Dickson que fue menor de 0.2 en todos los tratamientos tal como se muestra en el Cuadro 3.
En general, los estándares morfológicos no tuvieron diferencias significativas (P > 0.05) en los tratamientos donde se aplicó T. harzianum con respecto a los tratamientos donde no se aplicó, lo cual coincide con Donoso et al. (2008). En cambio, Romero et al. (2008) encontraron un efecto positivo en altura, diámetro, peso radicular y de la parte aérea cuando inocularon con T. harzianum. En cuanto a los sustratos, la mezcla a base de turba de musgo como componente principal (S1) presentó los mejores valores para todas las variables evaluadas, excepto para el índice de esbeltez (Cuadro 3). Lo anterior coincide con lo encontrado por Castro-Garibay et al. (2018) para la misma especie. Los resultados reflejan que es necesario realizar más investigación en nuestro país en el área forestal, ya que el efecto de este antagonista ha sido más estudiado en el área agrícola (Dumroese et al., 2012).
Conclusiones
Fusarium circinatum mostró ser patogénico en plántulas de Pinus greggii en los tres sustratos evaluados. El sustrato a base de aserrín redujo la incidencia de F. circinatum en la producción de plántulas de P. greggii en vivero, principalmente en las cuatro primeras semanas después de la inoculación, a diferencia del sustrato a base de turba de musgo y corteza de pino que mostraron incidencia alta en este periodo. Después de 13 semanas, la aplicación de T. harzianum y el sustrato a base de aserrín permitieron reducir los porcentajes de incidencia de F. circinatum a 66 %; sin embargo, la incidencia fue similar cuando el antagonista no se inoculó. Fusarium circinatum es un patógeno de importancia económica en viveros forestales y la combinación del sustrato de aserrín y la aplicación preventiva del hongo antagonista T. harzianum resulta ser una opción para su manejo.
Agradecimientos
Este trabajo se realizó en el Colegio de Postgraduados, gracias a la concesión de una beca de formación de doctorado por CONACyT y del Fideicomiso 167304, modalidad 3, de financiamiento a Proyectos de Investigación 2013.
REFERENCIAS
Aguilera-Rodríguez, M., Aldrete, A., Martínez-Trinidad, T., & Ordaz-Chaparro, V. M. (2016). Producción de Pinus montezumae Lamb. con diferentes sustratos y fertilizantes de liberación controlada. Agrociencia, 50(1), 107-118. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952016000100107&lng=es&tlng=es [ Links ]
Benítez, T., Rincón, A. M., Limón, M. C., & Codón, A. C. (2004). Biocontrol mechanisms of Trichoderma strains. International Microbiology, 7(4), 249-260. Retrieved from http://revistes.iec.cat/index.php/IM/article/viewFile/9480/9476 [ Links ]
Castro-Garibay, S. L., Aldrete, A., López-Upton, J., Ordaz-Chaparro, V. M. (2018). Efecto del envase, sustrato y fertilización en el crecimiento de Pinus greggii var. australis en vivero. Agrociencia, 52(1), 115-127. Retrieved from http://www.colpos.mx/agrocien/Bimestral/2018/ene-feb/art-9.pdf [ Links ]
Coutinho, T. A., Steenkamp, E. T., Mongwaketsi, K., Wilmont, M., & Wingfield, M. J. (2007). First outbreak of pitch canker in a South African pine plantation. Australasian Plant Pathology, 36(3), 256-261. doi: 10.1071/AP07017 [ Links ]
Cubillos, H. J. G., Páez, R. A., & Mejía, D. L. (2011). Evaluación de la capacidad biocontroladora de Trichoderma harzianum Rifai contra Fusarium solani (Mart.) Sacc. asociado al complejo “Secadera” en maracuyá, bajo condiciones de invernadero. Revista Facultad Nacional de Agronomía Medellín, 64(1), 5821-5830. Retrieved from http://www.scielo.org.co/pdf/rfnam/v64n1/a08v64n01.pdf [ Links ]
Cummings, N. J., Ambrose, A., Braithwaite, M., Bissett, J., Roslan, H. A., Abdullah, J., …Hill, R. A. (2016). Diversity of root-endophytic Trichoderma from Malaysian Borneo. Mycological Progress, 15(5), 50. doi: 10.1007/s11557-016-1192-x [ Links ]
Desender, S., Andrivon, D., & Val, F. (2007). Activation of defense reactions in Solanaceae: where is the specificity. Cellular Microbiology, 9(1), 21-30. doi: 10.1111/j.1462-5822.2006.00831.x [ Links ]
Dickson, A., Leaf, A. L., & Hosner, J. F. (1960). Quality appraisal of white spruce and white pine seedlings stock in nurseries. The Forestry Chronicle, 36(1), 10-13. doi: 10.5558/tfc36010-1 [ Links ]
Donoso, E., Lobos, G. A., & Rojas, N. (2008). Efecto de Trichoderma harzianum y compost sobre el crecimiento de plántulas de Pinus radiata en vivero. Bosque (Valdivia), 29(1), 52-57. doi: 10.4067/S0717-92002008000100006 [ Links ]
Dumroese, R. K., Kim, M. S., & James, R. L. (2012). Fusarium oxysporum protects Douglas-fir (Pseudotsuga menziesii) seedlings from root disease caused by Fusarium commune. Plant Pathology Journal, 28(3), 311-316. doi: 10.5423/PPJ.NT.08.2011.0155 [ Links ]
García-Díaz, S. E., Aldrete, A., Alvarado-Rosales, D., Cibrián-Tovar, D., Méndez-Montiel, J. T., Valdovinos-Ponce, G., & Equíhua-Martínez, A. (2017). Efecto de Fusarium circinatum en la germinación y crecimiento de plántulas de Pinus greggii en tres sustratos. Agrociencia, 51(8), 895-908. Retrieved from http://www.scielo.org.mx/pdf/agro/v51n8/1405-3195-agro-51-08-895-en.pdf [ Links ]
Gordon, T. R., Swett, C. L., & Wingfield, M. J. (2015). Management of Fusarium diseases affecting conifer. Crop Protection, 73, 28-39. doi: 10.1016/j.cropro.2015.02.018 [ Links ]
Harman, G. E., Björkman, T., Ondik, K., & Shoresh, M. (2008). Changing paradigms on the mode of action and uses of Trichoderma spp. for biocontrol. Outlooks on pest management,19(1), 24-29. doi: 10.1564/19feb08 [ Links ]
Hernández-Zarate, L., Aldrete, A., Ordaz-Chaparro, V. M., López-Upton, J., & López-López, M. A. (2014). Crecimiento de Pinus montezumae Lamb. en vivero influenciado por diferentes mezclas de sustratos. Agrociencia, 48(6), 627-637. Retrieved from https://www.colpos.mx/agrocien/Bimestral/2014/ago-sep/art-5.pdf [ Links ]
Herron, D. A., Wingfield, M. J., Wingfield, B. D., Rodas, C. A., Marincowitz, S., & Steenkamp, E. T. (2015). Novel taxa in the Fusarium fujikuroi species complex from Pinus spp. Studies in Mycology, 80, 131-150. doi: 10.1016/j.simyco.2014.12.001 [ Links ]
Infante, D., Martínez, B., González, N., & Reyes, Y. (2009). Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Revista de Protección Vegetal, 24(1), 14-21. Retrieved from http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1010-27522009000100002&lng=es&tlng=es [ Links ]
Martínez-Álvarez, P., Alves-Santos, F. M., & Diez, J. J. (2012). In vitro and in vivo interactions between Trichoderma viride and Fusarium circinatum. Silva Fennica, 46(3), 303-316. Retrieved from https://www.researchgate.net/publication/258875067_ [ Links ]
Mitchell, R. G., Zwolinski, J., Jones, N., & Coutinho, T. (2004). The effect of applying prophylactic measures on the post-planting survival of Pinus patula in South Africa. The Southern African Forestry Journal, 200(1), 51-58. doi: 10.1080/20702620.2004.10431760 [ Links ]
Mousseaux, M. R., Dumroese, R. K., James, R. L., Wenny, D. L., & Knudsen, G. R. (1998). Efficacy of Trichoderma harzianum as a biological control of Fusarium oxysporum in container-grown Douglas-fir seedlings. New Forests, 15(1), 11-21. doi: 10.1023/A:1006512519895 [ Links ]
Okorski, A., Oszako, T., Nowakowska, J. A., & Pszczólkowska, A. (2014). The possibilities of biologically protecting plants against diseases in nurseries, with special consideration of Oomycetes and Fusarium fungi. Forest Research Papers, 75(3), 301-321. doi: 10.2478/frp-2014-0029 [ Links ]
Peterson, M. (2008). Fusarium species-a British Columbia perspective in forest seedling production. Retrieved from https://www.fs.fed.us/rm/pubs/rmrs_p057/rmrs_p057_109_125.pdf [ Links ]
Prieto, R. J. A., & Sáenz, J. T. (2011). Indicadores de calidad de planta en viveros forestales de la Sierra Madre Occidental. Durango, México: INIFAP. [ Links ]
Reglinski, T., & Dick, M. (2005). Biocontrol of forest nursery pathogens. New Zealand Journal of Forestry, 50(3), 19-26. Retrieved from http://www.nzjf.org.nz/free_issues/NZJF50_3_2005/CD6F47DA-12F9-4F5A-9914-BEABE49C0054.pdf [ Links ]
Robles, C. A., Gómez, C. R., Macas, R. F., Sánchez, R. A., & Torres-Gutiérrez, R. (2014). Estudio de la patogenicidad de aislados de Fusarium spp., asociados a la marchitez vascular del babaco en Loja-Ecuador. Centro de Biotecnología, 3(2), 61-71. Retrieved from https://www.researchgate.net/publication/279941150_ [ Links ]
Romero, G., Crosara, A., & Baraibar, A. (2008). Trichoderma harzianum un biocontrol y biopromotor en vivero de especies forestales. Ciencia e Investigación Forestal, 14(2), 335-345. Retrieved from http://biblioteca.infor.cl/DataFiles/26538.pdf [ Links ]
Sáenz, R. J. T., Villaseñor, R. F. J., Muñoz, F. H. J., Rueda, S. A., & Prieto, R. J. A. (2010). Calidad de planta en viveros forestales de clima templado en Michoacán. Uruapan, Michoacán, México: SAGARPA-INIFAP-CIRPAC-Campo Experimental Uruapan. Retrieved from http://biblioteca.inifap.gob.mx:8080/jspui/handle/123456789/1289 [ Links ]
Secretaría de Economía. (2016). Norma Mexicana NMX-AA-170-SCFI-2016. Certificación de la operación de viveros forestales. México: Diario Oficial de la Federación. Retrieved from http://www.dof.gob.mx/nota_detalle.php?codigo=5464460&fecha=07/12/2016 [ Links ]
Soria, S., Alonso, R., & Bettucci, L. (2012). Endophytic bacteria from Pinus taeda L. as biocontrol agents of Fusarium circinatum Nirenberg & O´Donnell. Chilean Journal of Agricultural Research, 72(2), 281-284. Retrieved from http://www.bioline.org.br/pdf?cj12044 [ Links ]
Solano-Bonilla, M., & Brenes-Chacón, D. (2012). Evaluación de métodos de curación de sustratos para la prevención del mal de talluelo. Revista Forestal Mesoamericana Kurú, 9(2), 63-65. doi: 10.18845/rfmk.v9i22.365 [ Links ]
Statistical Analysis System (SAS Institute). (2002). The SAS system for windows. Release 9.0. Cary NC, USA: Author. [ Links ]
Swett, C. L., & Gordon, T. R. (2015). Endophytic association of the pine pathogen Fusarium circinatum with corn (Zea mays). Fungal Ecology, 13, 120-129. doi: 10.1016/j.funeco.2014.09.003 [ Links ]
Villar, P. S. (2003). Importancia de la calidad de planta en los proyectos de revegetación. In J. M. Rey-Benayas, T. Espigares, & J. M. Nicolau (Eds.), Restauración de ecosistemas mediterráneos (pp. 65-86). España: Universidad de Alcalá-Asociación Española de Ecología Terrestre. Retrieved from http://www3.uah.es/pedrovillar/PDF/Texto%20publicado.pdf [ Links ]
Recibido: 07 de Diciembre de 2018; Aprobado: 12 de Junio de 2019











 texto em
texto em 


