Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo serie ciencias forestales y del ambiente
versão On-line ISSN 2007-4018versão impressa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.25 no.2 Chapingo Mai./Ago. 2019 Epub 19-Fev-2021
https://doi.org/10.5154/r.rchscfa.2018.08.062
Nota científica
Actividad proteolítica de frutos silvestres de Bromelia karatas L. de Yucatán, México
1Universidad Autónoma de Yucatán, Centro de Investigaciones Regionales “Dr. Hideyo Noguchi”, Biomedicina de Enfermedades Infecciosas y Parasitarias, Laboratorio de Biología Celular. Av. Itzáes, núm. 490 x calle 59, col. Centro. C. P. 97000. Mérida, Yucatán, México.
2Instituto Tecnológico de Mérida. Av. Tecnológico km 4.5 s/n. C. P. 97118. Mérida, Yucatán, México.
3Instituto Tecnológico Superior del Sur del Estado de Yucatán. Carretera Muna-Felipe Carrillo Puerto Tramo Oxkutzcab-Akil km 41+400. C. P. 97880. Oxkutzcab, Yucatán, México.
Objetivos:
Evaluar la actividad proteolítica de frutos silvestres de Bromelia karatas L. bajo distintas condiciones de temperatura, pH y NaCl, y estimar la estabilidad térmica de las proteasas.
Materiales y métodos:
Se comparó el efecto del pH (6, 7, 8, 9, 10 y 12), temperaturas de incubación (30, 40, 50, 60 y 70 °C) y concentraciones de NaCl (5, 10 y 20 %) sobre la actividad proteolítica de los frutos. La estabilidad térmica de las proteasas se evaluó a 30, 50 y 70 °C durante 240 minutos. Los pesos moleculares y los puntos isoeléctricos de las proteasas se estimaron por zimografía bidimensional no reductora. Los datos se analizaron mediante un ANOVA de un factor y la prueba de comparaciones múltiples de medias de Tukey (α = 0.05).
Resultados y discusión:
La actividad proteolítica del extracto de frutos de B. karatas (8.59 U·mg-1) fue mayor que la de Ananas comosus (L.) Merr. variedad comosus (3.42 U·mg-1). La actividad fue mayor en valores de pH 6 y 7 y en concentraciones menores de 5 % de NaCl. Las proteasas se mantuvieron estables a 30 y 50 °C durante 210 minutos. El zimograma bidimensional, bajo condiciones no reductoras, mostró por lo menos 40 zonas claras con pesos moleculares aparentes entre 27.3 y 290 kDa, que representan potencialmente proteasas.
Palabras clave: Bromeliaceae; proteasas; karatasina; zimografía 2D
Objectives:
To evaluate the proteolytic activity of wild fruits of Bromelia karatas L. under different temperature, pH and NaCl conditions, and to estimate the thermal stability of their proteases.
Materials and methods:
The effect of pH (6, 7, 8, 9, 10 and 12), incubation temperatures (30, 40, 50, 60 and 70 °C) and NaCl concentrations (5, 10 and 20 %) on the proteolytic activity of the fruits was compared. The thermal stability of the proteases was assessed at 30, 50 and 70 °C for 240 minutes. The molecular weights and isoelectric points of the proteases were estimated by non-reducing two-dimensional zymography. The data were analyzed using a one-factor ANOVA and Tukey's test (α = 0.05).
Results and discussion:
The proteolytic activity of B. karatas fruit extract (8.59 U·mg-1) was greater than that of Ananas comosus (L.) Merr. variety comosus (3.42 U·mg-1). The activity was higher at pH 6 and 7 and in concentrations lower than 5 % NaCl. Proteases were stable at 30 and 50 °C for 210 minutes. The two-dimensional zymogram, under non-reducing conditions, showed at least 40 light zones with apparent molecular weights between 27.3 and 290 kDa, potentially representing proteases.
Keywords: Bromeliaceae; proteases; karatasin; 2D zymography
Introducción
Los avances biotecnológicos han contribuido a la diversificación de uso de las proteasas y a favorecer su demanda (Ramli, Aznan, & Illias, 2017), lo que ha generado la necesidad de explorar nuevas fuentes. Las proteasas de origen vegetal, como la papaína y la bromelina, tienen amplia aceptación en la industria cosmética, alimentaria, farmacéutica y de bebidas alcohólicas (Arshad et al., 2014; de Lencastre et al., 2016). No obstante, en la actualidad existen proteasas aún no estudiadas a profundidad, pero con posibles aplicaciones biotecnológicas, como las contenidas en especies de la familia Bromeliaceae (Natalucci et al., 2009), específicamente en Bromelia karatas L. (sinónimo: Bromelia plumieri [E. Morren] L. B. Smith) (Espejo-Serna, López-Ferrari, & Ramírez-Morillo, 2005).
Bromelia karatas se distribuye en el neotrópico desde las islas del Caribe hasta Ecuador y Brasil, incluso Centroamérica. La distribución en México abarca 12 de los 32 estados, entre ellos Yucatán (Espejo-Serna & López-Ferrari, 2010). Las plantas de B. karatas crecen en los tipos de selva descritos para la península de Yucatán (Miranda, 1958) e incluso en franjas de vegetación secundaria próximas a los caminos, donde los suelos son someros. Esta especie presenta adaptaciones anatómicas y morfológicas que le permiten tolerar periodos de sequía (González-Salvatierra, Andrade, Orellana, Peña-Rodríguez, & Reyes-García, 2013). El fruto es una baya agridulce y jugosa con cáscara fibrosa, de colores blanco amarillento, rosado o café oscuro; la producción promedio es de 77 frutos por planta, los cuales representan un peso total de aproximadamente 1.4 kg (Montes, Terán, Zúñiga, & Caldón, 2014).
En el estado de Yucatán, los frutos de B. karatas se consumen, usualmente, acompañados con sal y chile y previamente hervidos; esto último con la finalidad de evitar úlceras en la boca, causadas por la cisteína proteasa. Esta proteasa ha sido nombrada y descrita como karatasina (Montes, Amador, Cuevas, & Córdoba, 1990), la cual tiene características cinéticas equivalentes a las contenidas en Bromelia pinguin L. (Meza-Espinoza et al., 2017), y es análoga a la bromelina y la papaína (Montes et al., 1990); sin embargo, aún se desconoce si existen más proteasas que contribuyan a la actividad proteolítica. Tampoco se cuenta con registros de accesiones de B. karatas, lo que sería de utilidad para su cultivo y explotación como fuente de proteasas. Por ello, es importante la identificación de plantas productoras de frutos con altos contenidos proteolíticos, para trabajos en fitomejoramiento.
En este estudio se evaluó el efecto de la temperatura, pH y NaCl sobre la actividad proteolítica de frutos silvestres de B. karatas, se determinó la estabilidad térmica de las proteasas y se estimaron sus pesos moleculares y puntos isoeléctricos mediante zimografía bidimensional, con la finalidad de generar información para procesos biotecnológicos.
Materiales y métodos
Muestreo de material vegetal
En diciembre de 2017 y enero de 2018 se colectaron frutos de B. karatas en tres localidades del estado de Yucatán, México: Oxkutzcab (colecta 1), Espita (colecta 2) y Mérida (colecta 3). En cada localidad se obtuvieron 10 frutos de cada una de siete plantas; los frutos contenían 12 °Brix al momento del corte. Como testigo se empleó piña miel (Ananas comosus [L.] Merr. variedad comosus), adquirida en un supermercado local.
Evaluación de la actividad proteolítica
De los 70 frutos colectados por localidad, se seleccionaron 10 frutos al azar para hacer una pulpa homogénea en un procesador de alimentos; posteriormente, la pulpa se centrifugó a 14 000 g por 15 min a 4 °C. La concentración de proteína se determinó por el método de Bradford usando el estuche comercial Quick StarTM Bradford Protein Assay de la casa comercial BIO-RAD, de acuerdo con las instrucciones del fabricante. El jugo del fruto fue congelado a -80 °C hasta su utilización.
La actividad proteolítica se cuantificó siguiendo la metodología propuesta por Natalucci, Brullo, López, Hilal, y Caffini (1996). La mezcla de reacción consistió en 1.1 mL de una solución de caseína al 1 % (p/v) en amortiguador de fosfatos 0.1 M a pH 7, 5 mM de cisteína y 0.1 mL de jugo de fruta. Esta mezcla se incubó a 37 °C por 20 min y se agregó 1.8 mL de ácido tricloroacético (ATA) al 5 % para detener la reacción; posteriormente, se centrifugó a 7 000 g por 20 min y la absorbancia del sobrenadante se midió a 280 nm. Como blanco se empleó una mezcla de reacción sin incubar más 1.8 mL de ATA al 5 %. Una unidad enzimática (U) se definió como un milimol de tirosina por minuto bajo las condiciones del ensayo descrito.
Las evaluaciones del efecto del pH, temperatura de incubación, estabilidad térmica y concentración de NaCl sobre la actividad proteolítica, así como la estimación de los pesos moleculares y los puntos isoeléctricos de las proteasas, se realizaron únicamente para la colecta con mayor actividad.
Efecto de la temperatura de incubación, pH y NaCl sobre la actividad proteolítica
Se comparó el efecto de la temperatura de incubación (30, 40, 50, 60 y 70 °C) a un pH constante de 7 y el efecto del pH (6, 7, 8, 9, 10 y 12) a una temperatura constante de 37 °C. Para determinar el efecto del pH se utilizaron los siguientes amortiguadores: ácido 2-morfolinoetanosulfónico (MES) 0.1 M para el pH 6; fosfatos 0.1 M para los valores de pH 7 y 12; y Tris-HCl 0.1 M para los valores de pH 8, 9 y 10. La actividad proteolítica se midió de acuerdo con la metodología de Natalucci et al. (1996). El efecto del NaCl se evaluó a 5, 10 y 20 % (p/v). El resultado se expresó como el porcentaje relativo a la actividad proteolítica observada en ausencia del NaCl (Moreno-Hernández et al., 2017).
Estabilidad térmica de las proteasas
La estabilidad térmica de las proteasas del jugo del fruto de B. karatas se evaluó a 30, 50 y 70 °C; la actividad proteolítica residual en condiciones estándares (Natalucci et al., 1996) se determinó a 0, 30, 60, 120, 180 y 240 min, y se expresó como el porcentaje relativo a la actividad proteolítica sin incubación previa.
Análisis estadístico
En la comparación de las tres colectas, la variable de respuesta actividad proteolítica se midió como unidades enzimáticas por mL de jugo y unidades enzimáticas por mg de proteína, expresadas como el promedio ± desviación estándar. La actividad proteolítica se evaluó a cinco temperaturas, seis niveles de pH y tres concentraciones de NaCl. La estabilidad térmica se analizó gráficamente. Los datos experimentales se compararon con el análisis de varianza de un factor (n = 4 y α = 0.05); posteriormente, se hizo la prueba de comparaciones múltiples de medias de Tukey (α = 0.05) (Zar, 1999). El análisis de datos se hizo con el programa R (R Core Team, 2017).
Zimografía bidimensional con caseína
Las proteasas en el extracto de B. karatas se detectaron mediante zimografía bidimensional con caseína, bajo condiciones no reductoras. La concentración de la proteína se determinó de acuerdo con el método de Bradford (1976), empleando albúmina de suero bovino como proteína estándar.
El isoelectroenfoque (IEF) se realizó con tiras prefabricadas con anfolinas (Inmobiline Dry-Strips, GE Healthcare) de 7 cm con un gradiente de pH 3 a 10. Las tiras se rehidrataron durante 16 h con la solución DeStreak (GE Healthcare) con 0.5 % de acarreador de anfolinas (IPG buffer, GE Healthcare) más 100 µg de proteínas del fruto, en un volumen final de 150 µL. El IEF se llevó a cabo en el equipo Ettan IPGphor 3 (GE Healthcare, EUA) bajo las condiciones indicadas en el Cuadro 1. Después del IEF, las tiras fueron equilibradas por 15 minutos en 10 mL de amortiguador de equilibrio (urea 6 M, tris-HCl 75 mM, glicerol 29.3 %, SDS [dodecilsulfato sódico] 2 %, azul de bromofenol 0.002 %) con 100 mg de DTT (ditiotreitol), seguido por una segunda incubación de 15 minutos en 10 mL de amortiguador de equilibrio con 250 mg de iodoacetamida.
Cuadro 1 Secuencia y condiciones para realizar el isoelectroenfoque en proteínas de frutos de Bromelia karatas.
| Voltaje (V) | Duración (min) | Voltaje (V·h-1) | |
|---|---|---|---|
| 1 | 400 | 90 | 300 |
| 2 | 1 000 | 60 | 300 |
| 3 | 5 000 | 60 | 4 000 |
| 4 | 5 000 | 30 | 3 000 |
En la segunda dimensión, las proteínas se separaron en gel de poliacrilamida al 12 % copolimerizado con 0.1 % (p/v) de caseína; la corrida se llevó a cabo en una cámara de electroforesis vertical (BIO-RAD) a 130 V. Como marcador de peso molecular se utilizó Precision Plus Protein 161-0373 (BIO-RAD). Después de la electroforesis, el gel de poliacrilamida se lavó con una solución de tritón X-100 al 2.5 % durante 1 h, seguido de tres lavados con agua destilada. Posteriormente, el gel se incubó durante 1 h a 37 °C en amortiguador de desarrollo (1 % [p/v] de tritón X-100, amortiguador de fosfatos 100 mM, pH 7.0, DTT 4 mM y cisteína 10 mM). El gel fue teñido con azul de Coomasie (0.75 g·L-1 de Coomassie R-250, 0.5 g·L-1 de Coomassie G-250, 10 % de ácido acético, 20 % de metanol y 10 % de etanol) durante 1 h, luego se destiñó en metanol (45 %) con ácido acético (10 %) y agua. La actividad proteolítica se detectó como zonas claras no teñidas en fondo azul. Finalmente, el gel se escaneó en el equipo GS-900 Calibrated Densitometer (BIO-RAD) y el análisis de la imagen para la estimación de su peso molecular y punto isoeléctrico se hizo mediante el software 2D PDQuest Advanced (BIO-RAD).
Resultados y discusión
Bromelia karatas es una planta silvestre con diversidad de forma y color en sus frutos (Montes et al., 2014), que fue tipificada recientemente por Monteiro y Forzza (2016). La Figura 1 muestra algunos frutos de B. karatas colectados en el estado de Yucatán, que pertenecen a tres grupos de plantas seleccionadas según el color del fruto.

Figura 1 Frutos de Bromelia karatas colectados en el estado de Yucatán. A) Colecta 1 (Oxkutzcab): fruto de color hueso y café, B) colecta 2 (Espita): fruto de color rojizo, C) colecta 3 (Mérida): fruto de color rosa claro a rosa más fuerte.
El Cuadro 2 contiene los resultados de la actividad proteolítica de las colectas de B. karatas. La colecta 2 (Espita) tuvo mayor actividad (8.59 U·mg-1) que las colectas 1 (6.84 U·mg-1) y 3 (7.2 U·mg-1) de Oxkutzcab y Mérida, respectivamente. El mismo patrón de diferencias se observó en la actividad proteolítica por mL de jugo, donde la colecta 2 fue aproximadamente 50 % mayor que las otras. En contraste, el contenido de proteína fue similar en los tres casos, por lo que se descarta que el nivel de madurez sea el determinante de la variación en la actividad proteolítica (Moyano et al., 2012). La actividad proteolítica en B. karatas siempre fue mayor que la de A. comosus var. comosus. En este sentido, es pertinente considerar a B. karatas como fuente de proteasas para la industria alimentaria (Arshad et al., 2014; de Lencastre et al., 2016). Con base en los resultados, las evaluaciones posteriores se realizaron únicamente para la colecta 2 (Espita), la cual tuvo mayor actividad proteolítica.
Cuadro 2 Actividad proteolítica del extracto de frutos de Bromelia karatas colectados en el estado de Yucatán, México.
| Actividad proteolítica | Colecta 1 (Oxkutzcab) | Colecta 2 (Espita) | Colecta 3 (Mérida) | Control |
|---|---|---|---|---|
| Proteína (mg·mL-1) | 1.49 ± 0.41 b | 1.45 ± 0.16 b | 1.50 ± 0.57 b | 0.35 ± 0.02 a |
| Actividad específica (U·mL-1) | 10.02 ± 0.47 b | 15.20 ± 1.04 c | 10.08 ± 0.49 b | 1.20 ± 0.44 a |
| Actividad específica (U·mg-1de proteína) | 6.84 ± 0.31 b | 8.59 ± 0.72 c | 7.20 ± 0.32 b | 3.42 ± 1.26 a |
Media ± desviación estándar. Control = Ananas comosus var. comosus. Letras diferentes representan diferencias significativas entre colectas, de acuerdo con la prueba de Tukey (α = 0.05, n = 4).
La Figura 2 representa el efecto del pH sobre la actividad proteolítica de B. karatas, la cual fue mayor con valores de pH 6 y 7, disminuyó ligeramente con pH 8, 9 y 10, y fue nula con pH 12. De esta manera, se puede considerar el intervalo de pH 6-10 como el propicio para la actividad proteolítica. Este patrón coincide con el intervalo de pH de 6 a 8 para B. karatas y B. pinguin de Meza-Espinoza et al. (2017), quienes indican que la actividad proteolítica para ambas especies disminuye cuando el pH es mayor de 8.5.

Figura 2 Efecto del pH sobre la actividad proteolítica de los frutos de Bromelia karatas colectados en el estado de Yucatán. Letras diferentes indican diferencias estadísticamente significativas de acuerdo con la prueba de Tukey (α = 0.05). Las barras representan la desviación estándar de la media.
En la Figura 3 se muestra que la actividad proteolítica aumenta conforme la temperatura de la reacción enzimática incrementa de 30 a 70 °C. Este intervalo de temperatura permitiría que las enzimas se adecuen a los requerimientos de los procesos de alimentos donde se emplean (Guadix, Guadix, Paéz-Dueñas, González-Tello, & Camacho, 2000; Li, Yu, Goktepe, & Ahmedna, 2016); sin embargo, al incrementar la temperatura de incubación, la vida útil de una enzima disminuye presumiblemente por la desnaturalización de las proteasas (Daniel, Dines, & Petach, 1996).

Figura 3 Efecto de la temperatura de incubación sobre la actividad proteolítica de los frutos de B. karatas. Letras diferentes indican diferencias estadísticamente significativas de acuerdo con la prueba de Tukey (α = 0.05). Las barras representan la desviación estándar de la media.
La actividad proteolítica del jugo de B. karatas se redujo bajo la exposición a varias temperaturas y periodos (Figura 4); después de 210 min de incubación a 30 y 50 °C, la actividad residual fue alrededor de 90 %, mientras que, a 70 °C, la actividad residual fue de aproximadamente 40 %. El tiempo en que la actividad proteolítica se mantiene a estas temperaturas es suficiente para los procesos de hidrólisis proteica (Guadix et al., 2000; Li et al., 2016). Meza-Espinoza et al. (2017) reportaron una estabilidad térmica menor; después de una incubación de 37 a 60 °C por 60 minutos, la actividad proteolítica aumentó de 68 a 95 %, pero disminuyó gradualmente después de 120 min. Las diferencias pueden deberse a que en el trabajo citado se emplearon proteínas purificadas parcialmente por precipitación, mientras que en el presente trabajo se utilizó el jugo directo.
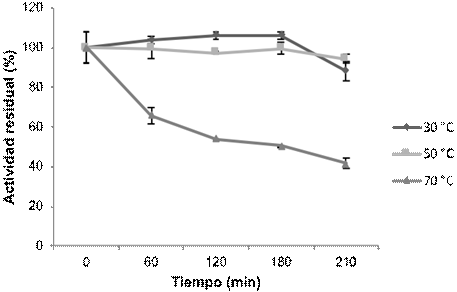
Figura 4 Evaluación de la estabilidad térmica de las proteasas de los frutos de Bromelia karatas a 30, 50 y 70 °C.
Por otra parte, la actividad proteolítica del jugo es afectada por el NaCl cuando la concentración es mayor de 10 % (Figura 5). La actividad residual disminuye a medida que el porcentaje de NaCl aumenta, debido posiblemente a la interacción de los iones de la sal con el agua, que inducen una pérdida de la solubilidad de las proteasas (Moreno-Hernández et al., 2017). No obstante, en concentraciones de 5 a 10 % de NaCl, la actividad proteolítica del jugo de B. karatas es alta (80 a 96 %), por lo que su uso es posible en productos como suavizadores de carnes, donde el marinado se realiza con menos de 5 % de concentración de NaCl (Peña, Duran, & Baleta, 2015).
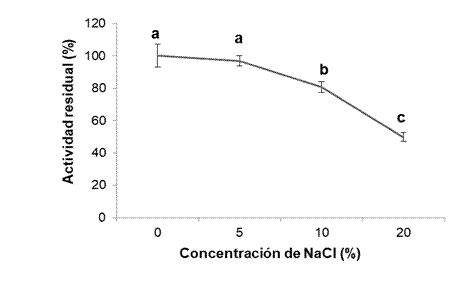
Figura 5 Efecto del NaCl sobre la actividad proteolítica de los frutos de Bromelia karatas. Letras diferentes indican diferencias estadísticamente significativas de acuerdo con la prueba de Tukey (α = 0.05). Las barras representan la desviación estándar de la media.
La Figura 6 muestra el zimograma obtenido para la detección de actividad proteolítica en B. karatas. El zimograma bidimensional del fruto de B. karatas, bajo condiciones no reductoras, mostró por lo menos 40 zonas claras con pesos moleculares aparentes comprendidos entre 27.3 y 290 kDa, con puntos isoeléctricos entre 4.6 y 9.7 (Cuadro 3). Las 40 zonas claras detectadas representan potencialmente proteasas que incluyen la karatasina (Montes et al., 1990) y la mayoría de las proteasas (entre 21 y 97 kDa en condiciones no reductoras) reportadas por Meza-Espinoza et al. (2017). Esta variedad de pesos moleculares puede deberse en parte a la asociación de varias unidades de la karatasina entre sus residuos de cisteína (Meza-Espinoza, 2017; Montes et al., 1990).
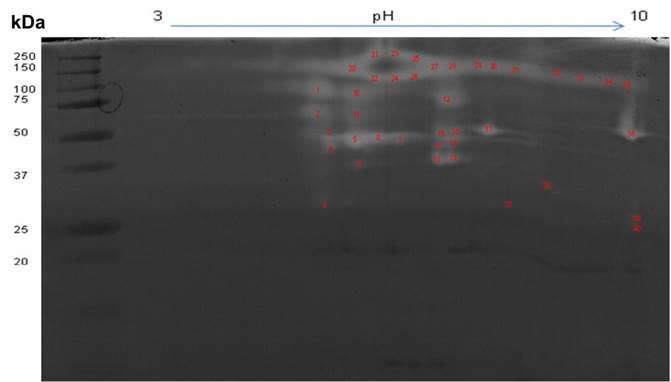
Figura 6 Zimograma bidimensional con caseína y tinción con azul de Coomasie para la detección de actividad proteolítica del jugo de Bromelia karatas bajo condiciones no reductoras. Las zonas claras indican la presencia de actividad proteolítica.
Cuadro 3 Relación de los pesos moleculares (PM) y los puntos isoeléctricos (PI) de las proteasas detectadas por zimografía bidimensional en jugo de Bromelia karatas bajo condiciones no reductoras.
| Zona clara | PM | PI | Zona clara | PM | PI | Zona clara | PM | PI |
|---|---|---|---|---|---|---|---|---|
| 1 | 102.5 | 4.7 | 15 | 52.6 | 6.5 | 29 | 169.6 | 7.3 |
| 2 | 68.9 | 4.6 | 16 | 56.1 | 6.8 | 30 | 184.7 | 7.6 |
| 3 | 50.0 | 4.9 | 17 | 46.5 | 6.5 | 31 | 170.4 | 7.9 |
| 4 | 46.3 | 4.9 | 18 | 41.1 | 6.6 | 32 | 141.1 | 8.5 |
| 5 | 48.9 | 5.2 | 19 | 41.0 | 6.8 | 33 | 130.1 | 8.9 |
| 6 | 50.4 | 5.6 | 20 | 187.0 | 5.2 | 34 | 114.9 | 9.3 |
| 7 | 49.6 | 6.0 | 21 | 290.5 | 5.6 | 35 | 105.9 | 9.6 |
| 8 | 38.9 | 5.3 | 22 | 141.1 | 5.6 | 36 | 52.9 | 9.6 |
| 9 | 29.8 | 4.8 | 23 | 282.5 | 5.9 | 37 | 29.6 | 7.7 |
| 10 | 93.1 | 5.2 | 24 | 142.0 | 5.9 | 38 | 34.0 | 8.2 |
| 11 | 68.4 | 5.2 | 25 | 250.7 | 6.2 | 39 | 29.6 | 9.7 |
| 12 | 81.7 | 6.7 | 26 | 142.9 | 6.1 | 40 | 27.3 | 9.7 |
| 13 | 55.6 | 7.4 | 27 | 196.4 | 6.5 | |||
| 14 | 49.1 | 6.7 | 28 | 195.1 | 6.9 |
La zimografía 2-D puede ofrecer un mapa completo de las proteasas presentes, permite su identificación, incluyendo los isotipos, y proporciona información para su aislamiento (Larocca, Rossano, Santamaria, & Riccio, 2010). Para el caso de B. karatas, no se cuenta con estudios previos de zimogramas 2-D; sin embargo, en otras especies de Bromelia, los puntos isoléctricos oscilan entre 3.1 y 8.9 (Bruno, Pardo, Caffini, & López, 2002), lo cual es similar a lo encontrado en este trabajo. Las variaciones de los puntos isoeléctricos pueden atribuirse a las modificaciones postraduccionales (Kozlowski, 2016) o a los cambios de algunos aminoácidos, que se reflejan en la actividad enzimática, como ocurre en las proteasas de B. pinguin (Payrol, Obregón, Trejo, & Caffini, 2008).
Los resultados muestran el potencial de B. karatas como fuente alternativa de proteasas. No obstante, la caracterización de las proteasas de esta especie, mediante la secuenciación de las proteínas con mayor actividad proteolítica, es importante para determinar la diversidad, el peso molecular y los puntos isoléctricos con exactitud.
Conclusiones
La actividad proteolítica de los frutos silvestres de Bromelia karatas del estado de Yucatán es mayor que la de Ananas comosus var. comosus. Dicha actividad se debe al efecto de una mezcla de proteasas con pesos moleculares variables en condiciones no reductoras. Las proteasas de B. karatas son estables de 30 a 50 °C hasta por lo menos tres horas; el intervalo de pH óptimo de trabajo es de 6 a 10; y la actividad enzimática se mantiene alta (80 %) en concentración de 10 % de NaCl. Dadas las características indicadas, B. karatas puede considerarse como fuente alternativa de proteasas para la industria alimentaria.
References
Arshad, Z. I. M., Amid, A., Yusof, F., Jaswir, I., Ahmad, K., & Loke, S. P. (2014). Bromelain: overview of industrial application and purification strategies. Applied Microbiology and Biotechnology, 98(17), 7283-7297. doi: 10.1007/s00253-014-5889-y [ Links ]
Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72, 248-254. Retrieved from http://hoffman.cm.utexas.edu/courses/bradford_assay.pdf [ Links ]
Bruno, M. A., Pardo, M. F., Caffini, N. O., & López, L. M. I. (2002). Purification of a new endopeptidase isolated from fruits of Bromelia hieronymi Mez (Bromeliaceae). Acta Farmaceutica Bonaerense, 21(1), 51-56. Retrieved from https://www.researchgate.net/publication/267974610_Purification_of_a_New_Endopeptidase_Isolated_from_Fruits_of_Bromelia_hieronymi_Mez_Bromeliaceae [ Links ]
Daniel, R. M., Dines, M., & Petach, H. H. (1996). The denaturation and degradation of stable enzymes at high temperatures. Biochemical Journal, 317, 1-11. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1217448/pdf/8694749.pdf [ Links ]
de Lencastre, N. L. C., Jozala, A. F., Lopes, A. M., Santos-Ebinuma, C. V, Mazzola, P. G., & Pessoa, J. A. (2016). Stability, purification, and applications of bromelain: A review. Biotechnology Progress, 32(1), 5-13. doi: 10.1002/btpr.2190 [ Links ]
Espejo-Serna, A., & López-Ferrari, A. R. (2010). Flora del Bajío y de regiones adyacentes: Bromeliaceae. Retrieved from http://www1.inecol.edu.mx/publicaciones/resumeness/FLOBA/Bromeliacaeae165(1).pdf [ Links ]
Espejo-Serna, A., López-Ferrari, A. R., & Ramírez-Morillo, I. (2005). Bromeliaceae. Flora de Veracruz, 136, 1-103. Retrieved from http://www1.inecol.edu.mx/publicaciones/resumeness/FLOVER/136-Espejo_I.pdf [ Links ]
González-Salvatierra, C., Andrade, J. L., Orellana, R., Peña-Rodríguez, L. M., & Reyes-García, C. (2013). Microambiente lumínico y morfología y fisiología foliar de Bromelia karatas (Bromeliaceae) en una selva baja caducifolia de Yucatán, México. Botanical Sciences, 91(1), 75-84. Retrieved from http://www.scielo.org.mx/scielo.php?pid=S2007-42982013000100006&script=sci_arttext [ Links ]
Guadix, A., Guadix, E. M., Paéz-Dueñas, M. P., González-Tello, P., & Camacho, F. (2000). Procesos tecnológicos y métodos de control en la hidrólisis de proteínas. Ars Pharmaceutica, 41(1), 79-89. Retrieved from http://revistaseug.ugr.es/index.php/ars/article/view/5735 [ Links ]
Kozlowski, L. P. (2016). IPC - Isoelectric point calculator. Biology Direct, 11, 55. doi: 10.1186/s13062-016-0159-9 [ Links ]
Larocca, M., Rossano, R., Santamaria, M., & Riccio, P. (2010). Analysis of pineapple [Ananas comosus (L.) Merr.] fruit proteinases by 2-D zymography and direct identification of the major zymographic spots by mass spectrometry. Food Chemistry, 123(4), 1334-1342. doi: 10.1016/j.foodchem.2010.06.016 [ Links ]
Li, Y., Yu, J., Goktepe, I., & Ahmedna, M. (2016). The potential of papain and alcalase enzymes and process optimizations to reduce allergenic gliadins in wheat flour. Food Chemistry, 196(1), 1338-1345. doi: 10.1016/j.foodchem.2015.10.089 [ Links ]
Meza-Espinoza, L., Vivar-Vera, M. A., García-Magaña, M. L., Sáyago-Ayerdi, S., Chacón-López, A., Becerraea-Verdín, E., & Montalvo-González, E. (2017). Enzyme activity and partial characterization of proteases obtained from Bromelia karatas fruit and compared with Bromelia pinguin proteases. Food Science and Biotechnology, 27(2), 509-517. doi: 10.1007/s10068-017-0244-6 [ Links ]
Miranda, F. (1958). Estudios acerca de la vegetación. In E. Beltrán (Ed.), Los recursos naturales del sureste y su aprovechamiento (pp. 215-271). México: Instituto Mexicano de Recursos Naturales Renovables, A. C. [ Links ]
Monteiro, R. F., & Forzza, R. C. (2016). Typification of Bromelia karatas, the type of the genus Bromelia (Bromeliaceae). Taxon, 65(5), 1101-1106. doi: 10.12705/655.12 [ Links ]
Montes, C., Amador, M., Cuevas, D., & Córdoba, F. (1990). Subunit structure of karatasin, the proteinase isolated from Bromelia plumieri (karatas). Agricultural and Biological Chemistry, 54(1), 17-24. Retrieved from https://www.jstage.jst.go.jp/article/bbb1961/54/1/54_1_17/_pdf [ Links ]
Montes, R. C., Terán, G. V. F., Zuñiga, B. R. A., & Caldón, Y. E. (2014). Descripción morfológica de Bromelia karatas, recurso genético promisorio. Biotecnología en el Sector Agropecuario y Agroindustrial, 12(1), 62-70. Retrieved from http://www.scielo.org.co/pdf/bsaa/v12n1/v12n1a08.pdf [ Links ]
Moreno-Hernández, J. M., Hernández-Mancillas, X. D., Navarrete, E. L. C., Mazorra-Manzano, M. A., Osuna-Ruiz, I., Rodríguez-Tirado, V. A., & Salazar-Leyva, J. A. (2017). Partial characterization of the proteolytic properties of an enzymatic extract from “Aguama” Bromelia pinguin L. fruit grown in Mexico. Applied Biochemistry and Biotechnology, 182(1), 181-196. doi: 10.1007/s12010-016-2319-x [ Links ]
Moyano, D. D., Osorio, R. M., Murillo, P. E., Murillo, A. W., Solanilla, D. J., Méndez, A. J., & Aristizabal, S. J. (2012). Evaluación de parámetros bromatológicos, fitoquímicos y funcionalidad antioxidante de frutos de Bromelia karatas (Bromeliaceae). Vitae, 19(1), S439-S441. Retrieved from http://www.redalyc.org/pdf/1698/169823914138.pdf [ Links ]
Natalucci, C. L., Brullo, A., López, L. M. I., Hilal, R. M., & Caffini, N. O. (1996). Macrodontin, a new protease isolated from fruits of Pseudananas macrodontes (Morr) Harms (Bromeliaceae). Journal of Food Biochemistry, 19(6), 443-454. doi: 10.1111/j.1745-4514.1995.tb00547.x [ Links ]
Natalucci, C. L., Payrol, J. A., Bruno, M. A., Martin, M. I., Pardo, M. F., Pérez, A. T., …Caffini, N. O. (2009). Fuentes naturales de fitoproteasas: proteasas de Bromeliaceae. In Ciencia y Tecnología para el Desarrollo - CYTED (Ed.), Enzimas proteolíticas de vegetales superiores. Aplicaciones industriales (pp. 41-50). Buenos Aires, Argentina: Mariscal & Asociados. [ Links ]
Payrol, J. A., Obregón, W. D., Trejo, S. A., & Caffini, N. O. (2008). Purification and characterization of four new cysteine endopeptidases from fruits of Bromelia pinguin L. grown in Cuba. The Protein Journal, 27(2), 88-96. doi: 10.1007/s10930-007-9111-2 [ Links ]
Peña, F. R., Duran, O. D. S., & Baleta, M. L. C. (2015). Efecto del marinado con NaCl y tripolifosfato-sódico sobre las propiedades bromatológicas en carne de cabra. Biotecnología en el Sector Agropecuario y Agroindustrial, 13(1), 64-72. Retrieved from http://www.scielo.org.co/pdf/bsaa/v13n1/v13n1a08.pdf [ Links ]
R Core Team (2017). R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing. [ Links ]
Ramli, A. N., Aznan, T. N., & Illias, R. M. (2017). Bromelain: from production to commercialization. Journal of the Science of Food Agricultural, 97(5), 1386-1395. doi: 10.1002/jsfa.8122 [ Links ]
Zar, J. H. (1999). Biostatistical analysis (4th ed.). New Jersey: Prentice Hall. [ Links ]
Recibido: 16 de Agosto de 2018; Aprobado: 25 de Enero de 2019











 texto em
texto em 


