Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.25 no.1 Chapingo ene./abr. 2019 Epub 15-Feb-2021
https://doi.org/10.5154/r.rchscfa.2018.06.053
Artículo científico
Optimización de un sistema de cultivo in vitro basado en cotiledones maduros para la inducción de callos embriogénicos en algarrobo (Ceratonia siliqua L.)
1Institut Agronomique et Vétérinaire Hassan II, Département Production, Protection et Biotechnologies Végétales, Laboratoire de la culture des tissues des végétaux. Rabat, Instituts-6654, Morocco.
2Institut National de la Recherche Agronomique, Centre Régional de la Recherche Agronomique, Unité de la Biotechnologie. Rabat- 415, Morocco.
Introducción:
El algarrobo (Ceratonia siliqua L.) es una de las especies cultivadas más importantes en el área mediterránea. La especie tiene alta demanda en el mercado, pero los métodos tradicionales de propagación no han logrado satisfacerla; por tanto, el uso de técnicas in vitro parece apropiado para el establecimiento de huertos a gran escala.
Objetivos:
Evaluar los efectos de cinco genotipos de algarrobo en la inducción de callos embrionarios y optimizar la composición del medio de cultivo para un mejor crecimiento.
Materiales y métodos:
Las semillas maduras de C. siliqua de la variedad “Dkar”, que crecen en cinco regiones de Marruecos, se utilizaron como fuentes de explantes de cotiledones. Se evaluaron cinco genotipos (‘GH’, ‘GO’, ‘GM’, ‘GA’, y ‘GB’) y cuatro medios de cultivo (MS, B5, WPM y DKW) suplementados con tres concentraciones de auxina 2,4-D (2.5, 5 y 10 µM). La sacarosa y el manitol se analizaron en concentraciones de 0, 45, 90, 135 y 180 µM.
Resultados y discusión:
Los genotipos mostraron niveles altos de inducción de callo (75 a 100 %). El medio Gamborg (B5) suplementado con 2.5 µM 2,4-D produjo el mayor peso seco (32.5 g) de callos con coloración blanco cremoso. La mayor cantidad de callos friables de color blanco cremoso se obtuvo en el medio suplementado con 90 mM de sacarosa. El análisis histológico mostró la presencia de centros meristemáticos que se convirtieron en masas embriogénicas y proembriones globulares.
Conclusión:
Los cotiledones maduros de C. siliqua tienen potencial para la inducción y proliferación de callos embrionarios. Este estudio pretende contribuir al desarrollo de un protocolo apropiado para la propagación masiva de algarrobo.
Palabras clave: Fabaceae; genotipo; nutrientes minerales; sacarosa; estudio histológico
Introduction:
The carob tree (Ceratonia siliqua L.) is one of the most important plant species cultivated in the Mediterranean area. The species is in high market demand, but traditional propagation methods have not been able to satisfy it. Therefore, the use of in vitro techniques seems appropriate for the establishment of large-scale carob orchards.
Objectives:
To assess the effects of five carob genotypes on embryogenic-calli induction and to optimize culture medium composition for better growth.
Materials and methods:
The mature seeds of C. siliqua of the variety "Dkar", which grow in five regions of Morocco, were used as sources of explants of cotyledons. Five genotypes (‘GH’, ‘GO’, ‘GM’, ‘GA’, and ‘GB’) and four culture media (MS, B5, WPM and DKW) supplemented with three 2,4-D concentrations (2.5, 5 and 10 µM) were evaluated in this study. Sucrose and mannitol were also tested at different concentrations (0, 45, 90, 135 and 180 µM).
Results and discussion:
All the tested genotypes showed high callus induction levels (75 to 100 %). The Gamborg medium (B5) supplemented with 2.5 µM 2,4-D produced the highest dry weight (32.5 g) of creamy white calli. The highest amount of friable creamy-white calli was obtained in the medium supplemented with 90 mM of sucrose. Histological analysis showed the presence of meristematic centers that became embryogenic masses and globular proembryos.
Conclusion:
Mature cotyledons of C. siliqua have potential for induction and proliferation of embryonic callus. This study aims to contribute to developing an appropriate protocol for mass propagation of carob.
Keywords: Fabaceae; genotype; mineral nutrients; sucrose; histological study
Introducción
El árbol de algarrobo (Ceratonia siliqua L., Fabaceae) es una de las especies más importantes de la región mediterránea y destaca por su alta capacidad de adaptación a condiciones de estrés por sequía. La importancia económica de esta especie proviene del uso industrial de la goma extraída de sus semillas, que se usa ampliamente como aditivo natural (E-410) en la industria alimentaria como estabilizador, espesante y saborizante (El Bouzdoudi et al., 2017; Fadel et al., 2011). La producción mundial de algarrobo es de aproximadamente 156 800 t·año-1. Los principales productores son Portugal (25.46 %), Italia (18.24 %), España (16.51 %) Marruecos (13.89 %) y Turquía (8.45 %) (FAO, 2016). También se introdujo con éxito en otras regiones mediterráneas como en el sur de Estados Unidos, México, Chile, Argentina y el sur de Australia (Benković et al., 2016).
Los métodos tradicionales de propagación de algarrobo no han logrado satisfacer la demanda del mercado, por ello, el uso de técnicas in vitro para satisfacer la demanda alta de material vegetal parece adecuado (Shahzad, Akhtar, Bukhari, & Perveen, 2017). Uno de los métodos para desarrollar un sistema reproducible para la regeneración de plántulas es mediante el callo, que también se considera el material más adecuado para embriogénesis somática, transformación genética y producción de metabolitos secundarios (Azeez et al., 2017; Mujib, Ali, Tonk, & Zafar, 2017; Reyes-Díaz, Arzate-Fernández, Piña-Escutia, & Vázquez-García, 2017). La eficiencia de la inducción de callos está relacionada con material vegetal (explantes y genotipos) y la composición del medio de cultivo (composición de sal, reguladores de crecimiento de las plantas y carbohidratos). En C. siliqua como en otras especies, los explantes más utilizados para la inducción de callos son los embriones y cotiledones inmaduros (Canhoto, Rama, & Cruz, 2006; Custodio & Romano, 2006); sin embargo, la obtención de este material es laboriosa y solo está disponible durante un periodo muy corto del ciclo de crecimiento de la planta. Por otra parte, la inducción de callos a partir de cotiledones de semillas maduras se ha logrado con éxito en experimentos anteriores (Lozzi, Abousalim, & Abdelwahd, 2015). Este material tiene la ventaja de extraerse fácilmente y estar disponible durante todo el año. Además, los callos derivados de cotiledones provenientes de semillas maduras se consideran un material inicial adecuado de células no diferenciadas para la regeneración in vitro de plantas fértiles (Din et al., 2016).
Al igual que otras plantas leñosas, el algarrobo es difícil de propagar en condiciones in vitro y hasta ahora solo se ha logrado cierto éxito. Aunque existen algunos reportes sobre la inducción de callos embrionarios en C. siliqua (Canhoto et al., 2006; Custodio & Romano, 2006; Ksia et al., 2008; Lozzi et al., 2015), los estudios se han concentrado en la influencia de reguladores de crecimiento y se sabe poco sobre el efecto del genotipo, nutrientes minerales y carbohidratos en la inducción de callos en esta planta. La composición mineral del medio de cultivo es uno de los factores más importantes que rigen el crecimiento de las plantas y la morfogénesis (George & De Klerk, 2008; Kim, Gopal, & Sivanesan, 2017). El medio Murashige y Skoog (MS) (Murashige & Skoog, 1962), desarrollado para el crecimiento óptimo del callo del tabaco, es el más utilizado en el algarrobo y en otras plantas (Canhoto et al., 2006; George & de Klerk, 2008); sin embargo, no es el óptimo para todos los tejidos vegetales (Varshney & Anis, 2014). Los carbohidratos son otro componente importante para los medios de cultivo de tejidos (Khorsha, Alizadeh, & Mashayekhi, 2016); la sacarosa es la fuente de carbono más utilizada, debido a su efecto altamente favorable en el crecimiento y su costo relativamente bajo (Sumaryono, Wirdhatul, & Ratnadewi, 2012). Todos los estudios en algarrobo han usado sacarosa como fuente de carbono en una concentración de 81 mM; sin embargo, la concentración óptima difiere entre las especies de plantas (Thorpe et al., 2008). El manitol es un alcohol de azúcar de seis carbonos de origen natural que se usa ampliamente en el cultivo de tejidos vegetales como agente osmótico, para modificar el potencial hídrico de un medio de cultivo (Tholakalabavi, Zwiazek & Thorpe, 1994). Este carbohidrato se ha aplicado exitosamente en varias especies de plantas como Cucumis sativus L. (Lou & Kako, 1995), Cucumis melo L. (Nakagawa et al., 2001), Phoenix dactylifera L. (Shibli, Subaih, & Abdelrahman, 2005) y Olea europaea L., para aumentar la eficacia de la inducción de callos y la embriogénesis somática (Brhadda, Walali, & Abousalim, 2008).
En tal contexto, el objetivo de este estudio fue evaluar los efectos de cinco genotipos de C. siliqua en la inducción de callos y optimizar la composición del medio de cultivo para un mejor crecimiento del callo embrionario. Esto con el fin de proporcionar información de referencia para el desarrollo de un protocolo apropiado de propagación masiva de algarrobos por embriogénesis somática. En este estudio también se consideró el análisis histológico de callos inducidos y las estructuras diferenciadas.
Materiales y métodos
Material vegetal
Las semillas maduras de los árboles seleccionados de C. siliqua de la variedad productiva “Dkar”, que crecen en cinco regiones de Marruecos, se utilizaron como fuentes de explantes de cotiledones (Cuadro 1).
Cuadro 1 Origen geográfico de los árboles de algarroba marroquí (Ceratonia siliqua) utilizados en este estudio.
| Regiones | Código | Región geográfica | Latitud | Longitud | Altura (m) |
| El Hoceima | GH | Costa norte | 35° 11’ | 3° 57’ | 50-250 |
| Ouazzane | GO | Montaña Rif | 34° 58’ | 5° 29’ | 170-230 |
| Marrakech | GM | Alto atlas | 31° 37’ | 7° 00’ | 700-1 000 |
| Azilal | GA | Atlas medio | 32° 12’ | 6° 28’ | 400-700 |
| Bni Mellal | GB | Atlas medio | 32° 30’ | 6° 03’ | 500-800 |
Preparación de explantes
Las accesiones se almacenaron a 5 °C durante el periodo experimental. Las semillas se trataron con ácido sulfúrico concentrado (98 %) durante 60 min, se lavaron con agua estéril tres a cuatro veces y, posteriormente, se sumergieron en agua destilada estéril durante 24 h. Los cotiledones se extirparon asépticamente. Se quitó el endospermo y el eje del embrión, y cada cotiledón se segmentó transversalmente en cuatro porciones de 4 a 6 mm de longitud. Los explantes se colocaron con la superficie abaxial en contacto con el medio de cultivo.
Medio de iniciación del callo y condiciones del cultivo
Para la iniciación del callo, los explantes se cultivaron en placas de Petri de 90 mm de diámetro, las cuales contenían 20 mL de medio MS suplementado con 90 mM de sacarosa y ácido 2,4-diclorofenoxiacético (2,4-D) a la concentración óptima reportada en nuestro estudio anterior (10 µM) (Lozzi et al., 2015). El medio se solidificó con agar a 0.7 % (SIGMA) y el pH se ajustó a 5.8 con 1 M de NaOH antes de su esterilización en autoclave a 121 °C durante 20 min.
Los explantes de los cinco genotipos de algarrobo se cultivaron en un medio de iniciación de callos para analizar sus capacidades de callogénesis. Los genotipos que mostraron la mejor respuesta de callogénesis se cultivaron en cuatro medios de cultivo: MS, Gamborg (B5) (Gamborg, Miller & Ojima, 1968), Woody Plant Medium (WPM) (Lloyd & McCown, 1980) y Driver y Kuniyuki (DKW) (Driver & Kuniyuki, 1984), suplementados con tres dosis de 2,4-D (2.5, 5 y 10 µM). También se compararon combinaciones de sacarosa y manitol (0, 45, 90, 120 y 180 mM)
Los cultivos se mantuvieron completamente en la oscuridad en el cuarto de cultivo a 25 ± 2 °C durante cinco semanas. Las muestras de callos de masa fresca conocida se secaron hasta peso constante en un horno a 60 °C durante 24 h. La morfología se observó utilizando un estereomicroscopio (SZ2-ILST, Olympus, Japón).
Análisis histológico
Para el examen histológico, el callo se fijó durante al menos 24 horas en una mezcla de formaldehído-ácido acético-etanol (5:5:90/v:v:v) y se deshidrató en series de etanol-butanol; posteriormente, se incluyó en cera de parafina como lo describe Cob-Uicab et al. (2011). Las secciones (7 µm) se cortaron utilizando un microtomo rotatorio (Leica) y se tiñeron con 0.05 % de azul de toluidina O, después se secaron y se observaron bajo un estereomicroscopio Euromex ZE-1657.
Análisis estadístico
En este estudio se utilizó un diseño completamente al azar con arreglo factorial. Los resultados se expresaron como medias ± desviación estándar, calculadas a partir de tres experimentos independientes, cada uno con al menos 16 explantes. Los datos se analizaron estadísticamente mediante un análisis de varianza (ANOVA) para las tres medidas repetidas utilizando el software SPSS, V. 21 (SPSS, 2012) y las diferencias entre las medias se evaluaron mediante la prueba de rangos múltiples de Duncan (P = 0.05). Los datos porcentuales se transformaron con la función arcoseno antes del análisis.
Resultados
Los cotiledones maduros comenzaron a hincharse después de una semana en el medio de inducción de callos. Durante la segunda semana de cultivo, los callos comenzaron a surgir principalmente de los extremos cortados de los explantes que no estuvieron en contacto con el medio (Figura 1). Acorde con el Cuadro 2, los cinco genotipos produjeron una tasa alta de callos (75 a 100 %) y se observaron diferencias genotípicas en peso seco; los valores más altos se registraron en los callos ‘GH’, ‘GM’ y ‘GB’. Con respecto al color del callo, 'GB' produjo una mayor biomasa de color blanco cremoso (27.3 mg), mientras que los otros genotipos produjeron principalmente callos de color café cremoso. En consecuencia, el genotipo ‘GB’ fue utilizado en los experimentos posteriores. Algunos explantes de los genotipos 'GH', 'GM' y 'GB' mostraron iniciación de raíz (2 a 6.7 %), a partir de callos inducidos.
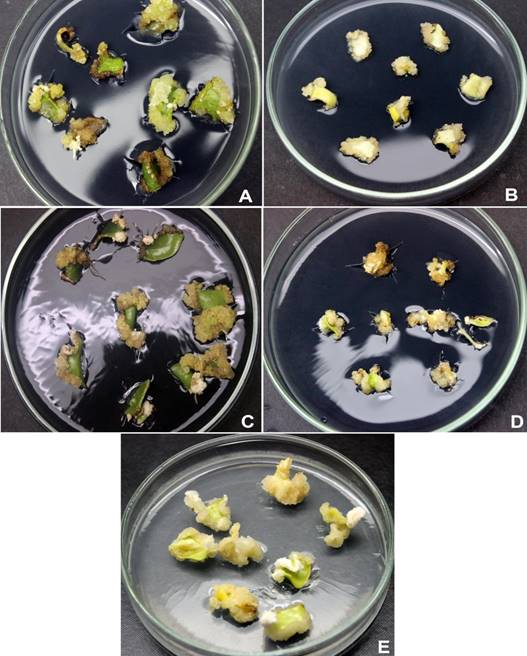
Figura 1 Inducción de callos a partir de cotiledones maduros de cinco genotipos (A = El Hoceima, B = Ouazzane, C = Merrakech, D = Azilal, E = Elksiba) de Ceratonia siliqua después de cinco semanas en medio Murashige y Skoog suplementado con 10 µM de auxina 2,4-D.
Cuadro 2 Inducción de callos a partir de cotiledones maduros de cinco genotipos de Ceratonia siliqua después de cinco semanas en medio Murashige y Skoog suplementado con 10 µM de 2,4-D.
| Genotipo | Inducción de callo (%) | Peso seco del callo (mg) | Color del callo | Morfología | Inducción de la raíz (%) |
|---|---|---|---|---|---|
| GH | 100 ± 0 | 26.5 ± 3.0 a | Café cremoso | Compacto | 6.7 ± 4.4 |
| GO | 100 ± 0 | 16.5 ± 1.1 bc | Blanco cremoso | Compacto | 0.0 |
| GM | 75 ± 6.9 | 24.9 ± 3.5 a | Café cremoso | Compacto | 4.2 ± 6.3 |
| GA | 87.5 ± 4.2 | 21.6 ± 3.5 ab | Café cremoso | Compacto | 0.0 |
| GB | 100 ± 0 | 27.3 ± 5.3 a | Blanco cremoso | Compacto | 2.0 ± 2.2 |
GH = El Hoceima, GO = Ouazzane, GM = Merrakech, GA = Azilal, GB = Elksiba. Los valores medios seguidos por las mismas letras no son significativamente diferentes entre sí de acuerdo con la prueba de rango múltiple de Duncan (P = 0.05).
De acuerdo con el Cuadro 3, el experimento diseñado para la comparación de medios basales mostró que los explantes fueron capaces de inducir callos en todas las composiciones de sal analizadas. Cabe destacar que solo los medios B5 y WPM permitieron el desarrollo de callos friables, pero WPM obtuvo los pesos secos más bajos para todas las concentraciones de auxina analizadas. El aumento máximo en peso seco (39.1 mg) se registró cuando se utilizó el medio B5 suplementado con 10 µM de 2,4-D, mientras que no hubo diferencias significativas con las concentraciones más bajas. Con el mismo medio, se obtuvieron callos de color blanco cremoso con 2.5 µM de 2,4-D y se observó que las concentraciones más altas de 2,4-D cambiaron el color a café. Con respecto a la inducción de la raíz, hubo interacción significativa (P ≤ 0.001) entre los medios salinos y la concentración 2,4-D. El medio MS con 2.5 µM de 2,4-D mostró la tasa más alta de inducción de la raíz (40 %), la cual disminuyó significativamente con el aumento de la concentración de 2,4-D. No se desarrollaron raíces con el medio B5.
Cuadro 3 Efecto del medio de cultivo y la concentración 2,4-D en la formación de callos de Ceratonia siliqua después de cinco semanas en el medio de inducción.
| Medios de cultivo | 2,4-D (µmol) | Inducción de callo (%) | Peso seco de callo (mg) | Color | Morfología | Inducción de raíz (%) |
|---|---|---|---|---|---|---|
| MS | 2.5 | 100 | 15.5 ± 2.2 ef | Blanco cremoso | Compacto | 40.0 ± 2.32 a |
| MS | 5 | 100 | 16.2 ± 8.9 ef | Blanco cremoso | Compacto | 11.1 ± 0.32 b |
| MS | 10 | 100 | 24 ± 3.4 cde | Blanco cremoso | Compacto | 0.0 b |
| WPM | 2.5 | 100 | 9.8 ± 5.1 f | Blanco cremoso | Friable | 2.3 ± 1.6 b |
| WPM | 5 | 100 | 14.2 ± 5.0 ef | Café cremoso | Friable | 4.2 ± 0.48 b |
| WPM | 10 | 100 | 15.6 ± 1.9 ef | Café cremoso | Friable | 0.0 b |
| DKW | 2.5 | 100 | 22.2 ± 5.3 de | Blanco cremoso | Compacto | 0.0 b |
| DKW | 5 | 100 | 24.3 ± 5.8 cde | Blanco cremoso | Compacto | 5.6 ± 0.32 b |
| DKW | 10 | 100 | 27.8 ± 6.1 bcd | Blanco cremoso | Compacto | 0.0 b |
| B5 | 2.5 | 100 | 32.5 ± 5.3 abc | Blanco cremoso | Friable | 0.0 b |
| B5 | 5 | 100 | 34.2 ± 6.9 ab | Café cremoso | Friable | 0.0 b |
| B5 | 10 | 100 | 39.1 ± 4.5 a | Café | Friable | 0.0 b |
| Significancia de diferencias en ANOVA de dos vías | ||||||
| Medio | NS | P ≤ 0.0001 | P ≤ 0.0001 | |||
| 2,4-D | NS | P ≤ 0.05 | P ≤ 0.001 | |||
| Medio ×2,4-D | NS | NS | P ≤ 0.0001 | |||
Medias seguidas por las mismas letras no son significativamente diferentes entre sí, según la prueba de rango múltiple de Duncan (P = 0.05). Medios de cultivo: Murashige y Skoog (MS), Gamborg (B5), Woody Plant Medium (WPM) y Driver y Kuniyuki (DKW). Auxina 2,4-D (ácido 2,4-diclorofenoxiacético).
En el experimento de combinación de carbohidratos, todos los explantes produjeron callos cuando el medio B5 se complementó con varias concentraciones de sacarosa, independientemente de la presencia de manitol (Figura 2). En contraste, no hubo inducción de callo cuando únicamente se utilizó manitol, incluso después de cinco semanas. En general, los callos formados fueron friables y de color blanco cremoso. La concentración de sacarosa afectó significativamente (P ≤ 0.05) el peso seco del callo, con el resultado más alto (38.4 mg) en presencia de 90 mM de sacarosa y en ausencia de manitol; en consecuencia, los pesos más bajos se registraron en todos los medios suplementados con manitol.

Figura 2 Efecto de las combinaciones de sacarosa y manitol en la inducción del callo de Ceratonia siliqua después de cinco semanas en medio Gamborg (B5) suplementado con 2.5 µM de auxina 2,4-D.
Las observaciones histológicas de los callos friables de color blanco cremoso mostraron la formación de centros meristemáticos con células isodiamétricas más pequeñas que las células circundantes, con núcleo y citoplasma densamente teñido, y con división anticlinal y periclinal (Figura 3a). Después de cuatro semanas de cultivo, se observaron pequeñas masas embriogénicas y proembriones globulares en la superficie de los callos (Figura 3b). Los exámenes histológicos también mostraron el desarrollo de raíces con haces vasculares en algunos callos inducidos.
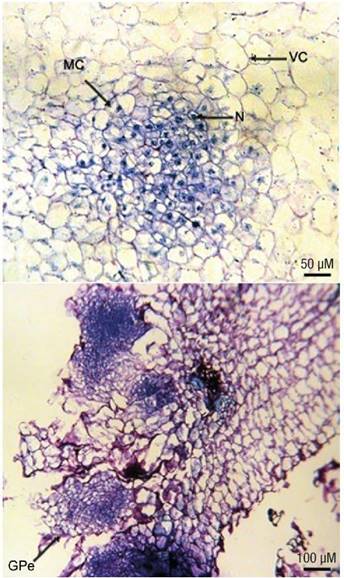
Figura 3 Observaciones microscópicas de los callos inducidos a partir de cotiledones maduros de Ceratonia siliqua. Iniciación del centro meristemático (MC) con células en división activa que tienen núcleo (N) y citoplasma densamente teñido rodeados por células altamente vacuoladas (VC). Detalle de las células en estructuras globulares (GPe) de la superficie de los callos desarrollados en los extremos cortados de los explantes.
Discusión
Este estudio evaluó el efecto de cinco genotipos de explantes y composición del medio de cultivo (nutrientes minerales, concentraciones de 2,4-D y carbohidratos) sobre la inducción y proliferación de callos, a partir de cotiledones maduros de C. siliqua. Este material vegetal tiene la ventaja de ser fácilmente extirpado y estar disponible durante todo el año.
Los estudios informan que la proliferación de callos es genotipo dependiente. Esta dependencia se observó en Castanea sativa Mill. (Hoque, Biswas, & Alam, 2007), Vigna subterranea (L.) Verdc. (Konaté, Koné, Kouakou, Kouadio, & Zouzou, 2013) y Theobroma cacao L. (Ramírez, Vasquez, Osorio, Garcés, & Trujillo, 2018). El efecto del genotipo también puede provocar cambios en el color, textura y potencial morfogenético de los callos, y esto podría ocurrir incluso entre variedades relacionadas de la misma especie (Saeed & Shahzad, 2015; Schween & Schwenkel, 2003; Shahnewaz, Bari, Siddique, & Rahman, 2004). En los últimos años, los estudios fenotípicos y genéticos han revelado un grado alto de diversidad de vainas de algarroba y semillas recolectadas en varias áreas de Marruecos (El Kahkahi, Zouhair, Ait Chitt, & Errakhi, 2014; Konaté, Filali-Maltouf, & Berraho, 2007; Sidina et al., 2009). En este estudio, se utilizaron cinco regiones de Marruecos como fuentes de explantes cotiledonares. Todos los genotipos comparados mostraron niveles altos de inducción de callo (75 a 100 %); sin embargo, la morfología varió ampliamente. La divergencia podría atribuirse a la diferencia en la concentración de hormonas endógenas en los genotipos (Han, Jin, Wu, & Zhang, 2011; Salehi & Khosh-Khui, 2005).
La composición de sal del medio de cultivo es otro factor importante que influye en la inducción y proliferación de callos (George & de Klerk, 2008). En este estudio, todos los medios basales pudieron producir callos a partir de explantes de cotiledones maduros de algarroba. El peso seco de los callos presentó diferencias significativas, obteniendo los resultados más altos con el medio B5. El medio WPM, que produjo la menor cantidad de callos, tiene una composición escasa de sal con un contenido más bajo de nitrógeno, potasio y cloruro; también tiene una cantidad iónica total más baja en comparación con los otros medios. En particular, los callos friables se obtuvieron solo con B5 y WPM. El desarrollo de esta morfología del callo podría deberse a la baja concentración de nitrógeno en dichos medios. Al igual que en el presente trabajo, los callos de Barringtonia racemosa (L.) Spreng. fueron friables en WPM y B5, y compactos en el medio MS (Behbahani, Shanehsazzadeh, & Hessami, 2011). En el medio B5, el aumento de la concentración de auxina 2,4-D (2.5 a 10 µM) mejoró el peso seco del callo. Cabe destacar que los callos de color blanco cremoso se obtuvieron en la concentración más baja, mientras que los ligeramente cafés se observaron en la concentración más alta. La interacción entre los medios salinos y la concentración 2,4-D fue significativa en el caso de la inducción de raíz. El medio basal MS complementado con 2.5 µM de 2,4-D mostró la tasa más alta. El porcentaje de raíces inducidas disminuyó a medida que la concentración de la auxina aumentaba. Una concentración alta de 2,4-D (10 µM) inhibió el crecimiento de las raíces en todos los medios evaluados. Esto podría explicarse por el hecho de que la auxina sintética a alta concentración puede producir efectos herbicidas que podrían bloquear el inicio adventicio de la raíz (Evans, Coleman, & Kearns, 2003).
En el presente estudio, el crecimiento de los callos también se vio afectado por las concentraciones de sacarosa y manitol. El medio B5 suplementado con 90 mM de sacarosa produjo la mayor cantidad de callos. Las concentraciones más altas de sacarosa parecen reducir la proliferación de callos, lo que puede explicarse por una disminución en el potencial osmótico del medio (Lipavská & Vreugdenhil, 1996). En un estudio similar realizado en O. europaea, la inducción del callo incrementó cuando la concentración de sacarosa aumentó de 54 a 243 mM (Brhadda et al., 2008). En contraste, la sacarosa a 43.8 mM produjo la mayor cantidad de callos en Aquilaria malaccensis Lam., mientras que un nivel más alto de sacarosa generó resultados más bajos (Jayaraman, Daud, Halis, & Mohamed, 2014). La adición de manitol al medio que contenía sacarosa redujo el peso seco del callo, mientras que no hubo inducción de callo en la sola presencia de manitol. Esta disminución podría ser causada por una contribución osmótica excesiva (Thorpe et al., 2008). En los experimentos desarrollados en este estudio, el uso de manitol con sacarosa arrojó resultados bajos en comparación con el uso de sacarosa sola en el medio de cultivo. Se obtuvieron resultados similares con el callo de Vitis vinifera L. (Yancheva & Roichev, 2005); sin embargo, cuando el manitol se usó como única fuente de hidratos de carbono no hubo inducción, lo que indica que la sacarosa es esencial para la inducción del callo en C. siliqua. La incapacidad de los cultivos de algarroba para usar este alcohol de azúcar podría atribuirse a la inhibición de la absorción de estos carbohidratos o a la ausencia de genes que codifican enzimas involucradas en el catabolismo del poliol en C. siliqua (Steinitz, 1999).
Los callos inducidos en B5, evaluados mediante el análisis histológico, mostraron centros activos con características embriogénicas. A diferencia de las células no embriogénicas que son grandes, alargadas y vacuoladas, las células embriogénicas son generalmente pequeñas, isodiamétricas y densamente llenas de citoplasma (Brhadda, Walali & Abousalim, 2007; Kumar, Suri, Sonie, & Ramawat, 2003). Después de cuatro semanas, estas células meristemáticas se transformaron en masas embriogénicas y proembriones globulares.
Conclusiones
Este estudio confirma el alto potencial de los cotiledones maduros de Ceratonia siliqua para la inducción y proliferación de callos embrionarios. La expresión del potencial está influenciada por el genotipo, la concentración 2,4-D, la composición de sal del medio basal y los carbohidratos. El callo obtenido mostró color y textura variada. La investigación histológica de los callos inducidos mostró centros activos con características embriogénicas. Este estudio es el primer paso hacia el establecimiento de un protocolo eficiente para la propagación de algarrobo en masa, mediante embriogénesis somática y formación de brotes, a partir de cotiledones maduros. Se están considerando estudios adicionales que incluyan factores críticos para mejorar la transición de proembriones a embriones somáticos y la posterior regeneración de la planta.
References
Azeez, H., Ibrahim, K., Pop, R., Pamfil, D., Hârta, M., & Bobis, O. (2017). Changes induced by gamma ray irradiation on biomass production and secondary metabolites accumulation in Hypericum triquetrifolium Turra callus cultures. Industrial Crops and Products, 108, 183-189. doi: 10.1016/j.indcrop.2017.06.040 [ Links ]
Behbahani, M., Shanehsazzadeh, M., & Hessami, M. J. (2011). Optimization of callus and cell suspension cultures of Barringtonia racemosa (Lecythidaceae family) for lycopene production. Scientia Agricola, 68(1), 69-76. doi: 10.1590/s0103-90162011000100011 [ Links ]
Benković, M., Srečec, S., Bauman, I., Ježek, D., Karlović, S., Kremer, D., …Erhatić, R. (2016). Assessment of drying characteristics and texture in relation with micromorphological traits of carob (Ceratonia silliqua L.) pods and seeds. Food Technology and Biotechnology, 54(4), 432-440. doi: 10.17113/ftb.54.04.16.4475 [ Links ]
Brhadda, N., Walali, D. E. L., & Abousalim, A. (2007). Etude histologique de l’embryogenèse somatique de l’olivier Olea europaea cv. Picholine marocaine. Fruits, 62(2), 115-124. doi: 10.1051/fruits:2003005 [ Links ]
Brhadda, N., Walali, D. E. L.,& Abousalim, A. (2008). Effet du sucre sur l’embryogenèse somatique de l’olivier (Olea europaea L.) cv . “Picholine marocaine”. Biotechnologie, Agronomie, Société et Environnement, 12(3), 245-250. Retrieved from https://popups.uliege.be/1780-4507/index.php?id=2521 [ Links ]
Canhoto, J. M., Rama, S. C., & Cruz, G. S. (2006). Somatic embryogenesis and plant regeneration in carob (Ceratonia siliqua L.). In Vitro Cellular & Developmental Biology - Plant, 42(6), 514-519. doi: 10.1079/ivp2006819 [ Links ]
Cob-Uicab, J. V., Sabja, A. M., Ríos-Leal, D., Lara-Aguilar, A., Donoso, P. J., González, M. E., & Escobar, B. (2011). Potencial de la organogénesis como estrategia para la masificación in vitro de Fitzroya cupressoides en Sudamérica Austral. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 17(3), 423-433. doi: 10.5154/r.rchscfa.2010.11.118 [ Links ]
Custodio, L., & Romano, A. (2006). In Vitromorphogenesis in zygotic embryo cultures of carob tree (Ceratonia siliqua L.). Acta Horticulturae, 725, 477-482. doi: 10.17660/actahortic.2006.725.68 [ Links ]
Din, A. R. J. M., Ahmad, F. I., Wagiran, A., Samad, A. A., Rahmat, Z., & Sarmidi, M. R. (2016). Improvement of efficient in vitro regeneration potential of mature callus induced from Malaysian upland rice seed (Oryza sativa cv. Panderas). Saudi Journal of Biological Sciences, 23(1), S69-S77. doi: 10.1016/j.sjbs.2015.10.022 [ Links ]
Driver, J. A., & Kuniyuki, A. H. (1984). In vitro propagation of Paradox walnut rootstock. HortScience, 19(4), 507-509. Retrieved from https://www.researchgate.net/publication/235909861_In_vitro_propagation_of_Paradox_Walnut_root_stock [ Links ]
El Bouzdoudi, B., Saïdi, R., Khalid, E., El Mzibri, M., Nejjar, A. Z., El Kbiach, M. L., …Lamarti, A. (2017). Mineral composition of mature carob (Ceratonia siliqua L.) Pod: A Study. International Journal of Food Science and Nutrition Engineering, 7(4), 91-103. doi: 10.5923/j.food.20170704.04 [ Links ]
El Kahkahi, R., Zouhair, R., Ait Chitt, M., & Errakhi, R. (2014). Morocco carob (Ceratonia siliqua L.) populations: Morphological variability of Pods and Kernel. International Journal of Pure & Applied Bioscience, 2(4), 38-47. Retrieved from http://www.ijpab.com/form/2014Volume2,issue4/IJPAB-2014-2-4-38-47.pdf [ Links ]
Evans, D. E., Coleman, J. O. D., & Kearns, A. (2003). Plant cell culture. London and New York: BIOS Scientific Publisher. [ Links ]
Fadel, F., Fattouch, S., Tahrouch, S., Lahmar, R., Benddou, A., & Hatimi, A. (2011). The phenolic compounds of Ceratonia siliqua pulps and seeds. Journal of Materials and Environmental Science, 2(3), 285-292. Retrieved from https://www.jmaterenvironsci.com/Document/vol2/vol2_N3/23-JMES-78-2011-Fadel.pdf [ Links ]
FAO (2016). Food and Agriculture Organization of the United Nations website. Retrieved April 25, 2018, from http://www.fao.org/faostat/en/#data/QC [ Links ]
Gamborg, O. L., Miller, R., & Ojima, K. (1968). Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research, 50(1), 151-158. doi: 10.1016/0014-4827(68)90403-5 [ Links ]
George, E. F., & de Klerk, G.J. (2008). The components of plant tissue culture media I: macro-and micro-nutrients. In E. F. George, M. A. Hall, & G.J. de Klerk (Eds.), Plant propagation by tissue culture (3rd ed., pp. 65-114). Netherlands: Springer. doi: 10.1007/978-1-4020-5005-3_3 [ Links ]
Han, Y., Jin, X., Wu, F., & Zhang, G. (2011).Genotypic differences in callus induction and plant regeneration from mature embryos of barley (Hordeum vulgare L.). Journal of Zhejiang University-Science B, 12(5), 399-407. doi: 10.1631/jzus.b1000219 [ Links ]
Hoque, A., Biswas, M. K., & Alam, S. (2007). Variation of callus induction through anther culture in water chestnut (Trapa sp.). Turkish Journal of Biology, 31(1), 41-45. Retrieved from http://journals.tubitak.gov.tr/biology/issues/biy-07-31-1/biy-31-1-7-0606-7.pdf [ Links ]
Jayaraman, S., Daud, N. H., Halis, R., & Mohamed, R. (2014). Effects of plant growth regulators, carbon sources and pH values on callus induction in Aquilaria malaccensis leaf explants and characteristics of the resultant calli. Journal of Forestry Research, 25(3), 535-540. doi: 10.1007/s11676-014-0492-8 [ Links ]
Khorsha, S., Alizadeh, M., & Mashayekhi, K. (2016). The usefulness of apricot gum as an organic additive in grapevine tissue culture media. Advances in Horticultural Science, 30(2), 111-118. doi: 10.13128/ahs-19137 [ Links ]
Kim, D. H., Gopal, J., & Sivanesan, I. (2017). Nanomaterials in plant tissue culture: The disclosed and undisclosed. RSC Advances, 7(58), 36492-36505. doi: 10.1039/c7ra07025j [ Links ]
Konaté, I., Filali-Maltouf, A., & Berraho, E. B. (2007). Diversity analysis of Moroccan carob (Ceratonia siliqua L.) accessions using phenotypic traits and RAPD markers. Acta Botanica Malacitana, 32, 79-90. Retrieved from http://www.biolveg.uma.es/abm/volumenes/vol32/32.ceratonia.pdf [ Links ]
Konaté, S., Koné, M., Kouakou, H. T., Kouadio, J. Y., & Zouzou, M. (2013). Callus induction and proliferation from cotyledon explants in Bambara groundnut. African Crop Science Journal, 21(3), 255-263. Retrieved from https://www.ajol.info/index.php/acsj/article/view/91326 [ Links ]
Ksia, E., Harzallah-Skhiri, F., Verdeil, J. L., Gouta, H., Alemanno, L., & Bouzid, S. (2008). Somatic embryo production from immature seeds of carob (Ceratonia siliqua L.).Journal of Horticultural Science and Biotechnology, 83(4), 401-406. doi: 10.1080/14620316.2008.11512398 [ Links ]
Kumar, S., Suri, S. S., Sonie, K. C., & Ramawat, K. G. (2003). Establishment of embryonic cultures and somatic embryogenesis in callus culture of guggul-Commiphora wightii (Arnott.) Bhandari. Indian Journal of Experimental Biology, 41(1), 69-77. Retrieved from https://www.researchgate.net/publication/8442728_Establishment_of_embryonic_cultures_and_somatic_embryogenesis_in_callus_culture_of_guggul-Commiphora_wightii_Arnott_Bhandari [ Links ]
Lipavská, H., & Vreugdenhil, D. (1996). Uptake of mannitol from the media by in vitro grown plants. Plant Cell, Tissue and Organ Culture, 45(2), 103-107. doi: 10.1007/bf00048751 [ Links ]
Lloyd, G., & McCown, B. (1980). Commercially-feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot-tip culture. Proceedings of the International Plant Propagators’ Society,30, 421-427. Retrieved from https://www.pubhort.org/ipps/30/99.htm [ Links ]
Lou, H., & Kako, S. (1995). Role of high sugar concentrations in inducing somatic embryogenesis from cucumber cotyledons. Scientia Horticulturae, 64(1-2), 11-20. doi: 10.1016/0304-4238(95)00833-8 [ Links ]
Lozzi, A., Abousalim, A., & Abdelwahd, R. (2015). Effet de 2, 4-D sur l’induction de l’embryogenèse somatique à partir de cotylédons matures de caroubier (Ceratonia siliqua L.). Revue Marocaine Des Sciences Agronomiques et Vétérinaires, 3, 24-29. Retrieved from http://www.agrimaroc.org/index.php/Actes_IAVH2/article/download/394/341 [ Links ]
Mujib, A., Ali, M., Tonk, D., & Zafar, N. (2017). Nuclear 2C DNA and genome size analysis in somatic embryo regenerated gladiolus plants using flow cytometry. Advances in Horticultural Science, 31(3), 165-174. doi: 10.13128/ahs-21956 [ Links ]
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum, 15(3), 473-497. doi: 10.1111/j.1399-3054.1962.tb08052.x [ Links ]
Nakagawa, H., Saijyo, T., Yamauchi, N., Shigyo, M., Kako, S., & Ito, A. (2001). Effects of sugars and abscisic acid on somatic embryogenesis from melon (Cucumis melo L.) expanded cotyledon. Scientia Horticulturae, 90(1-2), 85-92. doi: 10.1016/s0304-4238(00)00259-4 [ Links ]
Ramírez, A. M. H., Vasquez, T., Osorio, T. M. O., Garcés, L. A., & Trujillo, A. I. U. (2018). Evaluation of the potential of regeneration of different Colombian and commercial genotypes of cocoa (Theobroma cacao L.) via somatic embryogenesis. Scientia Horticulturae, 229, 148-156. doi: 10.1016/j.scienta.2017.10.040 [ Links ]
Reyes-Díaz, J. I., Arzate-Fernández, A. M., Piña-Escutia, J. L., & Vázquez-García, L. M. (2017). Media culture factors affecting somatic embryogenesis in Agave angustifolia Haw. Industrial Crops and Products, 108, 81-85. doi: 10.1016/j.indcrop.2017.06.021 [ Links ]
Saeed, T., & Shahzad, A. (2015). High frequency plant regeneration in Indian Sirisvia cyclic somatic embryogenesis with biochemical, histological and SEM investigations. Industrial Crops and Products, 76, 623-637. doi: 10.1016/j.indcrop.2015.07.060 [ Links ]
Salehi, H., & Khosh-Khui, M. (2005). Effects of genotype and plant growth regulator on callus induction and plant regeneration in four important turfgrass genera: a comparative study. In Vitro Cellular and Developmental Biology-Plant, 41(2), 157-161. doi: 10.1079/ivp2004614 [ Links ]
Schween, G., & Schwenkel, H.G. (2003). Effect of genotype on callus induction, shoot regeneration, and phenotypic stability of regenerated plants in the greenhouse of Primula ssp. Plant Cell, Tissue and Organ Culture, 72(1), 53-61. doi: 10.1023/A:1021227414880 [ Links ]
Shahnewaz, S., Bari, M. A., Siddique, N. A., & Rahman, M. H. (2004). Effects of genotype on induction of callus and plant regeneration potential in vitro anther culture of rice (Oryza sativa L.). Pakistan Journal of Biological Sciences, 7(2), 235-237. doi: 10.3923/pjbs.2004.235.237 [ Links ]
Shahzad, A., Akhtar, R., Bukhari, N. A., & Perveen, K. (2017). High incidence regeneration system in Ceratonia siliqua L. articulated with SEM and biochemical analysis during developmental stages. Trees, 31(4), 1149-1163. doi: 10.1007/s00468-017-1534-6 [ Links ]
Shibli, R. A., Subaih, W. S., & Abdelrahman, N. (2005). Effect of different carbohydrates on in vitro maintenance of date palm embryogenic callus. Advances in Horticultural Science, 19(3),172-175. Retrieved from http://www.jstor.org/stable/42882411 [ Links ]
Sidina, M. M., El Hansali, M., Wahid, N., Ouatmane, A., Boulli, A., & Haddioui, A. (2009). Fruit and seed diversity of domesticated carob (Ceratonia siliqua L.) in Morocco. Scientia Horticulturae, 123(1), 110-116. doi: 10.1016/j.scienta.2009.07.009 [ Links ]
SPSS, Corp. (2012). IBM SPSS Statistics for Windows, Version 21.0. Armonk, NY: IBM Corp. [ Links ]
Steinitz, B. (1999). Sugar alcohols display nonosmotic roles in regulating morphogenesis and metabolism in plants that do not produce polyols as primary photosynthetic products. Journal of Plant Physiology, 155(1), 1-8. doi: 10.1016/s0176-1617(99)80133-3 [ Links ]
Sumaryono, Wirdhatul, M., & Ratnadewi, D. (2012). Effect of carbohydrate source on growth and performance of In Vitro sago palm (Metroxylon sagu Rottb.) plantlets. HAYATI Journal of Biosciences, 19(2), 88-92. doi: 10.4308/hjb.19.2.88 [ Links ]
Tholakalabavi, A., Zwiazek, J. J., & Thorpe, T. A. (1994). Effect of mannitol and glucose-induced osmotic stress on growth, water relations, and solute composition of cell suspension cultures of poplar (Populus deltoides var. occidentalis) in relation to anthocyanin accumulation. In Vitro Cellular & Developmental Biology-Plant, 30(3), 164-170. doi: 10.1007/bf02632208 [ Links ]
Thorpe,T., Stasolla, C., Yeung, E.C., de Klerk, G-J., Roberts, A., George, E. F. (2008). The components of plant tissue culture media II: organic additions, osmotic and pH effects, and support systems. In E. F. George, M. A. Hall, & G.-J. de Klerk (Eds.), Plant propagation by tissue culture (pp. 115-173). Netherlands: Springer . doi: 10.1007/978-1-4020-5005-3_3 [ Links ]
Varshney, A., & Anis, M. (2014). Trees: Propagation and Conservation. New Delhi, India: Springer. doi: 10.1007/978-81-322-1701-5 [ Links ]
Yancheva, S. D., & Roichev, V. (2005). Carbohydrate source can influence the efficiency of somatic embryogenesis in seedless grapes (Vitis vinifera L.). Biotechnology & Biotechnological Equipment, 19(2), 62-66. doi: 10.1080/13102818.2005.10817192 [ Links ]
Recibido: 27 de Junio de 2018; Aprobado: 30 de Noviembre de 2018











 texto en
texto en 


