Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.24 n.3 Chapingo Sep./Dec. 2018 Epub Feb 19, 2021
https://doi.org/10.5154/r.rchscfa.2018.02.020
Artículo científico
Biomasa aérea y captura de carbono en manglares de la zona árida del noroeste de México: Bahía del Tóbari y estero El Sargento, Sonora
1Universidad de Sonora, Departamento de Agricultura y Ganadería. Carretera Bahía de Kino km 21. A. P. 305. Hermosillo, Sonora, México.
2Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Zaragoza. Batalla 5 de mayo s/n esquina Fuerte de Loreto, col. Ejército de Oriente. C. P. 09230. Iztapalapa, Ciudad de México, México.
3Universidad de Sonora, Departamento de Investigaciones Científicas y Tecnológicas. Rosales y bulevar Luis Donaldo Colosio M., col. Centro. C. P. 83000. Hermosillo, Sonora, México.
Introducción:
Los manglares son los mayores sumideros de carbono y contribuyen a mitigar los efectos del cambio climático global.
Objetivo:
Estimar la biomasa aérea (BA) del estero El Sargento y de la Bahía del Tóbari, para comparar los almacenes de carbono entre ambos lugares.
Materiales y métodos:
Las mediciones se realizaron en mayo de 2014 a noviembre de 2015. Las especies se identificaron, y el diámetro de árboles, altura y cobertura del dosel se midieron en 16 parcelas de 10 x 10 m. La BA se estimó con ecuaciones alométricas y se relacionó con el contenido de carbono mediante el factor 0.5. Las diferencias estadísticamente significativas entre los contenidos de carbono de ambos sitios de estudio se detectaron con la prueba t para muestras independientes.
Resultados y discusión:
La BA en el estero El Sargento se estimó entre 108.1 y 316.78 Mg∙ha-1 con predominancia de Laguncularia racemosa (L.) Gaertn (60 %); en Bahía del Tóbari, la BA varió entre 72.12 y 130 Mg∙ha-1, prevaleciendo Avicennia germinans (L.) L (83.4 %). En los dos sitios se encontró Rhizophora mangle L. de manera marginal. El almacén total de carbono fue mayor en El Sargento (con un rango de 54.1 a 158.4 Mg C∙ha-1) que en Bahía del Tóbari (36.1 a 65.5 Mg C∙ha-1); la diferencia fue estadísticamente significativa (F = 0.01; P = 0.02).
Conclusión:
La diferencia en las reservas de carbono de los lugares de estudio se relaciona con el buen desarrollo y diversidad de especies de un medio ambiente prístino (El Sargento), en comparación con otro severamente impactado (Bahía del Tóbari).
Palabras clave: Avicennia germinans; Laguncularia racemosa; Rhizophora mangle; gases de efecto invernadero; sumidero de carbono
Introduction:
Mangroves are the largest carbon sinks and contribute to mitigate the effects of global climate change.
Objective:
To estimate the above-ground biomass (AB) of El Sargento estuary and Bahía del Tóbari, to compare the carbon stocks between both places.
Materials and methods:
Measurements were taken from May 2014 to November 2015. The species were identified, and tree diameter, height and canopy cover were measured in 16 plots of 10 x 10 m. The AB was estimated with allometric equations and was related to the carbon content by the factor 0.5. The statistically significant differences between the carbon contents of both study sites were detected with the t test for independent samples.
Results and discussion:
The AB in El Sargento estuary was estimated between 108.1 and 316.78 Mg∙ha-1 with predominance of Laguncularia racemosa (L.) Gaertn (60 %); in Bahía del Tóbari, the AB varied between 72.12 and 130 Mg∙ha-1, prevailing Avicennia germinans (L.) L. (83.4 %). In both sites Rhizophora mangle L. was found marginally. Total carbon storage was greater in El Sargento (with a range of 54.1 to 158.4 Mg C∙ha-1) compared to Bahía del Tóbari (36.1 to 65.5 Mg C∙ha-1); the difference was statistically significant (F = 0.01; P = 0.02).
Conclusion:
The difference in the carbon reserves of the study sites is related to the good species development and diversity of a pristine environment (El Sargento), compared to another severely impacted environment (Bahía del Tóbari).
Keywords: Avicennia germinans; Laguncularia racemosa; Rhizophora mangle; greenhouse gases; carbon sink
Introducción
Las actividades humanas emiten cantidades importantes de dióxido de carbono (CO2), metano (CH4) y óxido nitroso (N2O) a la atmósfera, contribuyendo al incremento en la concentración de los gases de efecto invernadero (GEI) con repercusiones en el cambio climático global (Intergovernmental Panel on Climate Change [IPCC], 2013). Esta situación preocupa a los científicos y a la sociedad en general, ya que los GEI aumentaron desde que la era industrial inició en 1750: el CO2 incrementó 30 %; el CH4, 100 %; y el N2O, 15 % (Olivo & Soto-Olivo, 2010). El uso de los recursos naturales ha elevado las concentraciones de CO2 en la atmósfera. En el año 2000 se estimaron 23.5 Gt a escala mundial; 60 % proveniente de fuentes estacionarias (Organización Meteorológica Mundial-Programa de las Naciones Unidas para el Medio Ambiente [OMM-PNUMA], 2005). En el 2004, las emisiones se atribuyeron a los sectores energético (25.9 %), industrial (19.4 %), silvícola (17.4 %) y agrícola (13.5 %) (IPCC, 2007).
Los humedales almacenan 40 % del carbono generado en el planeta (Moya, Hernández, & Borrell, 2005). Los más representativos son los manglares, los pastos sumergidos, las llanuras de inundación deltaicas, los estuarios, lagos y selvas bajas inundables (Yáñez-Arancibia & Day, 2010); en conjunto, ocupan entre 4 y 6 % del territorio mundial (Mistch & Gosselink, 2000). A escala global existen 13.8 millones de ha de manglar distribuidas en Asia (34 a 42 %), Indonesia (23 %), África (20 %), Norte y Centroamérica (15 %), Oceanía (12 %), Sudamérica (11 %) y Australia (7 %) (Kauffman, Heider, Norfolk, & Payton, 2014). De acuerdo con Kauffman et al. (2013), 64 % de los manglares se concentra en 10 países: 42 % en Indonesia, Brasil, Australia y México; los más diversos se encuentran en Asia. Indonesia ocupa el primer lugar con 2 986 496 ha y México ocupa el quinto con 964 438 ha (Hutchison, Manica, Swetnam, Balmford, & Spalding, 2014). En 2015, la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) reportó 775 555 ha.
En comparación con otros ecosistemas, los manglares tienen un impacto potencial en el flujo global de carbono (Dittmar, Hertkorn, Kattner, & Lara, 2006), ya que presentan la mayor tasa de captura (Brevik & Homburg, 2004): hasta 1.023 Mg∙ha-1 en suelo (Donato et al., 2011) y 7.4 Mg∙ha-1 en biomasa (Lema & Polanía, 2006). En México, la reserva de carbono en los humedales se ha estimado en 282 Mg∙ha-1, de los cuales, 223 Mg∙ha-1 corresponden a la biomasa y 105 Mg∙ha-1 se encuentran en el suelo, árboles muertos y ramas caídas, mientras que el resto forma parte de la materia en descomposición, productos forestales y combustibles fósiles (Masera, Cerón, & Ordóñez, 2001). Recientemente, en México, la reserva forestal total de carbono orgánico en el suelo se ha estimado en 2.21 Pg (Cartus et al., 2014), cantidad 30 % mayor con respecto a los 1.69 Pg reportados por la FAO (Food and Agriculture Organization) en 2010.
La cobertura de manglar en México disminuyó 10 % en los 25 años previos a 2014 (Valderrama et al., 2014) con una tasa de deforestación anual de 2.5 % (Instituto Nacional de Ecología [INE], 2005). El deterioro de los manglares en el último medio siglo (30 a 50 %) permitió estimar la pérdida de su funcionalidad en solo 100 años (Duke et al., 2007), ya que, al intervenir en ellos, se tornan vulnerables a la metanogénesis (producción de CH4 por microorganismos) (Purvaja & Ramesh, 2001); debido a que la tala disminuye la biomasa y libera CO2 y CH4, los manglares revierten su capacidad de captura de carbono y se transforman en emisores de GEI (Troxler et al., 2015).
En México, poco se ha estudiado sobre la dinámica de intercambio de CO2 y CH4, y la acumulación de carbono en suelos de humedales (Hernández, 2009), por lo que se requieren investigaciones para determinar los flujos globales con precisión (Betancourt-Portela, Parra, & Villamil, 2013). Por lo anterior, los objetivos de este trabajo fueron: i) estimar la biomasa aérea y el contenido de carbono en árboles vivos de El Sargento y de la Bahía del Tóbari en Sonora, mediante ecuaciones alométricas, y ii) comparar las reservas de carbono de ambos manglares. La hipótesis establece que el almacén de carbono en el componente aéreo es mayor en El Sargento, por presentar condiciones naturales que favorecen el desarrollo de la biomasa y de la captura de carbono.
Materiales y métodos
Área de estudio
La investigación se realizó en el estero El Sargento y en la Bahía del Tóbari en Sonora, en la zona árida del norte de México. Las áreas tienen grado distinto de presión antropogénica, pero condiciones atmosféricas similares: clima muy seco y cálido, temperatura media anual mayor de 22 °C, verano cálido y régimen de lluvias intermedio entre verano e invierno (BW[h’]hw) (García & CONABIO, 1998).
El Sargento se ubica entre las coordenadas 29° 19´- 29° 34´´ LN y 112.3°-112° 22´ LO (Figura 1), abarca 717 ha y 7 km de longitud (Rodríguez-Zúñiga et al., 2013). El estero representa una zona prístina del golfo de California (López-Medellín, Acosta-Velázquez, & Vázquez-Lule, 2009), donde albergan especies de mangle blanco (Laguncularia racemosa [L.] Gaertn), negro (Avicennia germinans [L.] L.) y rojo (Rhizophora mangle L.), consideradas bajo amenaza en la NOM-059-SEMARNAT-2010 (Secretaría del Medio Ambiente y Recursos Naturales [SEMARNAT], 2010).
La Bahía del Tóbari se localiza entre las coordenadas 27° 01´- 27° 07´ LN y 109° 54´-110° 03´ 18´´ LO (Figura 1), ocupa 16 700 ha y forma parte del Área de Protección de Flora y Fauna “Islas del Golfo de California” (Carmona et al., 2015). El cuerpo de agua se ha deteriorado a causa de la construcción del camino a la Isla Huivulai, la contaminación y el azolvamiento, que en conjunto modifican la circulación hidrodinámica natural e interrumpen las corrientes marinas naturales de limpieza y desfogue (Domínguez, 2010).
Trabajo de campo
Las mediciones se realizaron de mayo de 2014 a noviembre de 2015. En ambos sitios de estudio se trazó un arreglo de 16 parcelas de 10 x 10 m y en cada una se establecieron dos subparcelas de 4 x 4 m (Figura 2). En las parcelas de 100 m2 se identificaron las especies de mangle; se contaron los árboles vivos; los árboles con diámetro a la altura del pecho (DAP; 1.3 m) mayor de 5 cm se midieron con una cinta métrica; y la altura y ancho del dosel se obtuvieron con la técnica de Kauffman et al. (2013). En R. mangle, el DAP se midió teniendo como base la raíz más alta. En las subparcelas de 16 m2, los árboles de DAP < 5 cm se midieron con la misma técnica.
Biomasa aérea viva y contenido de carbono
La BA se determinó con ecuaciones alométricas (Cuadro 1) y se relacionó con el cálculo del contenido de carbono mediante el factor 0.5 que el IPCC (2013) recomienda. La biomasa aérea total (BAT) se estimó mediante la suma de valores medios de BA en correspondencia con el porcentaje de las especies.
Cuadro 1 Ecuaciones alométricas para determinar la biomasa aérea total en especies de manglar del estero El Sargento y Bahía del Tóbari en Sonora.
| Fuente | Especie de mangle | Ecuación alométrica |
|---|---|---|
| Day, Conner, Ley-Lou, Day, y Navarro (1987) | Lr | BA = Exp [2.192 * (LN(DAP)) - 1.591] |
| Ag | BA = Exp [2.302 * (LN(DAP)) - 1.585] | |
| Rm | BA = Exp [2.507 * (LN(DR)) - 1.560] | |
| Smith y Whelan (2006) | Lr | BA = 10^[1.930 * (LOG10(DAP)) - 0.441] |
| Ag | BA = 10^[1.934 * (LOG10(DAP)) - 0.395] | |
| Rm | BA = 10^[1.731 * (LOG10(DAP)) - 0.112] | |
| Fromard et al. (1998) | Lr | BA = 0.1023 * (DAP^2.50) |
| Ag | BA = 0.14 * (DAP^2.40) | |
| Rm | BA = 0.1282 * (DAP^2.6) | |
| Imbert y Roller (1989) | Lr | BA = 0.209 * (DAP^2.24) |
| Ag | BA = 0.0942 * (DAP^2.54) | |
| Rm | BA = 0.178 * (DAP^2.47) | |
| Chave et al. (2005) | Ecuación común | BA = 0.168 * ρ * (D^2.47) |
| Komiyama, Poungparn, y Kato (2005) | Ecuación común | BA = 0.251 * ρ * (D^2.46) |
Ag = Avicennia germinans; Lr = Laguncularia racemosa; Rm = Rhizophora mangle. BA: biomasa aérea, LN: logaritmo natural, DAP: diámetro a la altura del pecho (cm), ρ: densidad de la madera (Ag = 0.759, Lr = 0.762 [Ministerio del Ambiente y los Recursos Naturales, 1994]; Rm = 0.80 [Richter & Dallwitz, 2000]).
Análisis estadístico
Las diferencias estadísticamente significativas entre las medias de los contenidos de carbono de ambos sitios de estudio, con respecto a cada especie de mangle y a los almacenes globales, se detectaron con la prueba t para muestras independientes. La homocedasticidad de los datos se determinó mediante la prueba F con nivel de significancia de 0.05. Los análisis se realizaron en el programa Excel de Windows 10.
Resultados y discusión
El Cuadro 2 muestra las características de las especies que conforman los manglares en el estero El Sargento y Bahía del Tóbari en Sonora. Con base en el número total de árboles muestreados, en El Sargento se estimó una densidad de 4 406 árboles∙ha-1. La especie más abundante fue L. racemosa, seguida por A. germinans y R. mangle. La especie R. mangle mostró el menor desarrollo: DAP de 1.3 cm, altura del tronco (AT) de 1 m, y ancho de dosel de 0.4 m.
Cuadro 2 Características de las especies bajo estudio en los manglares del estero El Sargento y Bahía del Tóbari en Sonora.
| Especie | DAP (cm) | Altura de tronco (m) | Ancho dosel (m) | Altura dosel (m) | Densidad (árbol∙ha-1) | Composición (%) |
|---|---|---|---|---|---|---|
| El Sargento | ||||||
| Lr | 8.3 ± 1.3 | 2.3 ± 0.2 | 1.1 ± 0.1 | 1.5 ± 0.1 | 2 650 | 60.14 |
| Ag | 7.0 ± 1.4 | 2.1 ± 0.2 | 1.3 ± 0.3 | 1.5 ± 0.2 | 1 500 | 34.04 |
| Rm | 1.3 ± 0.3 | 1.1 ± 0.3 | 0.6 ± 0.1 | 0.4 ± 0.1 | 256 | 5.82 |
| Densidad total (árboles∙ha-1) | 4 406 | 100 | ||||
| Bahía del Tóbari | ||||||
| Ag | 4.8 ± 0.5 | 1.6 ± 0.2 | 0.9 ± 0.4 | 1.0 ± 0.4 | 2 637 | 83.4 |
| Rm | 8.24 ± 1.5 | 1.8 ± 0.8 | 0.8 ± 0.3 | 0.7 ± 0.3 | 525 | 16.6 |
| Densidad total (árboles∙ha-1) | 3 162 | 100 | ||||
Ag = Avicennia germinans; Lr = Laguncularia racemosa; Rm = Rhizophora mangle. DAP: diámetro a la altura del pecho. ± Error estándar de la media con intervalo de confianza de 95 %.
En la Bahía del Tóbari, la densidad fue de 3 162 árboles∙ha-1; A. germinans predominó sobre R. mangle (Cuadro 2). Esta última exhibió mayor desarrollo y composición en Bahía del Tóbari (DAP = 8.24 cm; 16.6 %) que en El Sargento (DAP = 1.3 cm; 5.82 %), lo que sugiere la adaptabilidad de la especie a las modificaciones antrópicas del sitio.
Determinación de biomasa aérea del manglar
La Figura 3 ilustra, gráficamente, la estimación de BA de las especies que conforman el manglar del estero El Sargento, mediante diferentes ecuaciones alométricas. En El Sargento, la BA de L. racemosa varió entre 81.5 (ecuación de Smith & Whelan, 2006) y 268.8 Mg∙ha-1 (ecuación de Komiyama et al., 2005); en A. germinans, entre 26.6 (ecuación de Smith & Whelan, 2006) y 47.9 Mg∙ha-1 (ecuación de Komiyama et al., 2005); y en R. mangle, entre 0.0064 (ecuación de Chave et al., 2005) y 0.038 Mg∙ha-1 (ecuación Smith & Whelan, 2006). El resto de las ecuaciones produjeron valores intermedios de dichos intervalos.
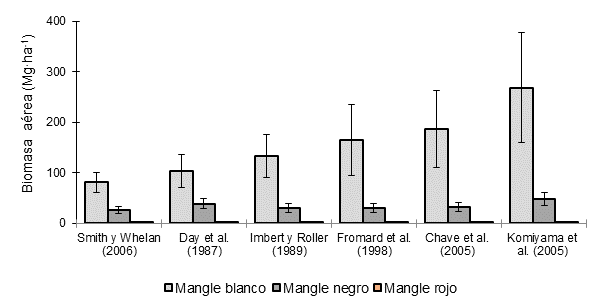
Figura 3 Biomasa aérea del manglar El Sargento, Sonora, estimada con diferentes ecuaciones alométricas. La biomasa de mangle rojo (Rhizophora mangle) es menor en comparación con el mangle blanco (Laguncularia racemosa) y negro (Avicennia germinans). Sobre las barras se representa el error estándar de la media con intervalo de confianza de 95 %.
En Bahía del Tóbari, la BA de A. germinans varió entre 60 (ecuación Smith & Whelan, 2006) y 104.4 Mg∙ha-1 (ecuación Komiyama et al., 2005), mientras que en R. mangle varió entre 12.1 (ecuación Smith & Whelan, 2006) y 32.3 Mg∙ha-1 (ecuación Chave et al., 2005). Las otras ecuaciones proporcionaron valores intermedios (Figura 4).

Figura 4 Biomasa aérea del mangle negro (Avicennia germinans) y rojo (Rhizophora mangle) en Bahía del Tóbari, Sonora, estimada con diferentes ecuaciones alométricas. Sobre las barras se representa el error estándar de la media con intervalo de confianza de 95 %.
En la península de Atasta en Campeche, Guerra-Santos et al. (2014) reportaron BA de 206.07 Mg∙ha−1 para L. racemosa, 161.93 Mg∙ha−1 para A. germinans y 181.70 Mg∙ha-1 en R. mangle. En la península de Yucatán, Adame et al. (2013) reportaron 5.3 Mg∙ha-1 para R. mangle enano. Por otra parte, en Guyana Francesa, Fromard et al. (1998) estimaron 31.5 Mg∙ha-1 para L. racemosa de dos a tres años de edad, y 315 Mg∙ha-1 para A. germinans y R. mangle de 60 a 70 años; mientras que en África, Fatoyinbo y Simard (2013) encontraron 76 (en Benín) y 178 Mg·ha-1 (en Congo) como promedio de la biomasa de diversas especies, entre ellas A. germinans, L. racemosa y R. mangle. Las diferencias de estos valores con respecto a los obtenidos en el presente estudio se justifican por las condiciones ambientales típicas de las ecorregiones, las características particulares de las especies y el distinto grado de deterioro por las actividades humanas.
La Figura 5 muestra las estimaciones de la BAT en los manglares de El Sargento y Bahía del Tóbari. En El Sargento, la BAT varió entre 108.1 y 316.78 Mg∙ha-1, mientras que en Bahía del Tóbari, la BAT se estimó entre 72.12 y 130 Mg∙ha-1. En ambos sitios, las estimaciones mayores derivaron de la ecuación de Komiyama et al. (2005), y las menores, de Smith y Whelan (2006). En El Sargento, los valores estimados con la ecuación de Komiyama et al. (2005) equivalen a 2.93 veces los calculados con la ecuación de Smith y Whelan (2006); lo mismo se observó en Bahía del Tóbari, cuya relación fue 1.81 veces mayor. La ecuación de Chave et al. (2005) generó valores menores con respecto a la de Komiyama et al. (2005), pero superiores al resto; esto también lo reportaron Komiyama, Ong, y Poungparn (2008), al emplear el mismo valor de densidad leñosa en ambas ecuaciones.
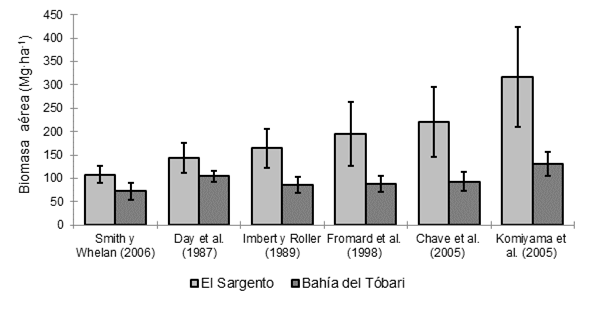
Figura 5 Estimaciones de biomasa aérea total en los manglares de El Sargento y Bahía del Tóbari, Sonora, mediante diferentes ecuaciones alométricas. Sobre las barras se representa el error estándar de la media con intervalo de confianza de 95 %.
Las diferencias entre las BA calculadas se atribuyeron a la especificidad o generalidad de las ecuaciones utilizadas, ya que los valores más altos corresponden a las de uso común en el área forestal (ecuaciones de Komiyama et al., 2005 y Chave et al., 2005); y los menores, a las de uso particular de cada especie. Para algunos científicos, aún es controversial declarar si la alometría de una especie de manglar es específica para un lugar en particular (Komiyama et al., 2008); sin embargo, otros determinaron ecuaciones similares para la misma especie en diferentes sitios, tal es el caso de Rhizophora apiculata Blume (Ong, Gong, & Wong, 2004). Komiyama et al. (2008) compararon la BA de especies de Rhizophora y encontraron que la ecuación de Komiyama et al. (2005) tuvo un error relativo de -5.81 a -4.94 % en la estimación con respecto a la de Imbert y Rollet (1989), y de -8.44 a 6.79 % respecto a la de Fromard et al. (1998); en Avicennia, el error relativo fue -4.05 a -10.8 % para la ecuación de Imbert y Rollet (1989), y de -11.7 a 3.99 para la de Fromard et al. (1998). Esto indicó que la estimación de BA con la ecuación de uso común de Komiyama et al. (2005) tiene un error relativo menor de 10 %, lo cual sugiere que las relaciones alométricas de una misma especie de manglar no difieren entre sitios, y que la densidad de la madera puede ser el factor determinante (Komiyama et al., 2008).
El Sargento tuvo mayor BAT (entre 108.1 y 316 Mg∙ha-1) que Bahía del Tóbari (72.1 y 130 Mg∙ha-1) (Figura 5). En ese intervalo se encontraron valores de BA reportados por Hutchison et al. (2014) para el Norte, Centroamérica y el Caribe (145.3 Mg∙ha-1), quienes también señalaron que los promedios más altos a escala mundial proceden de las islas del Pacífico (233.3 Mg∙ha-1) y del sureste asiático (230.9 Mg∙ha-1), mientras que los menores son del este de Asia (107.2 Mg∙ha-1).
Biomasa aérea total y su reserva de carbono
Existe diferencia estadísticamente significativa en los valores promedio del contenido de carbono de A. germinans (F = 0.12; P = 0.0004), R. mangle (F = 1.95-13; P = 0.0003) y el global (F = 0.01; P = 0.02) entre ambos sitios de estudio. Laguncularia racemosa se excluyó del análisis por encontrarse solo en El Sargento.
El Cuadro 3 indica la reserva de carbono en la biomasa aérea de los manglares de El Sargento y de la Bahía del Tóbari. En El Sargento, las estimaciones de carbono en la BA de L. racemosa fluctuaron entre 40.7 y 134.44 Mg C∙ha-1; en A. germinans, de 13.3 a 24 Mg C∙ha-1; y en R. mangle, de 0.003 a 0.019 Mg C∙ha-1. En Bahía del Tóbari, la reserva de carbono BA de A. germinans varió entre 30 y 52.2 Mg C∙ha-1; y en R. mangle, de 6 a 16.2 Mg C∙ha-1. El almacén de carbono total en la BA de El Sargento se estimó entre 54.1 y 158.4 Mg C∙ha-1, mientras que en Bahía del Tóbari varió de 36.1 a 65.5 Mg C∙ha-1.
Cuadro 3 Reserva de carbono en la biomasa aérea de los manglares de El Sargento y de la Bahía del Tóbari en Sonora.
| Carbono en biomasa aérea (Mg C∙ha-1) | Ecuación de estimación | |||
|---|---|---|---|---|
| Laguncularia racemosa | Avicennia germinans | Rhizophora mangle | Total | |
| El Sargento | ||||
| 40.7 ± 9.8 | 13.3 ± 3.5 | 0.019 ± 0.014 | 54.1 ± 9.3 | Smith y Whelan (2006) |
| 52.1 ± 16.1 | 19.6 ± 5.1 | 0.011 ± 0.009 | 71.7 ± 16.0 | Day et al. (1987) |
| 66.7 ± 21.3 | 15.5 ± 4.2 | 0.006 ± 0.005 | 82.2 ± 21.0 | Imbert y Roller (1989) |
| 82.7 ± 34.8 | 15.1 ± 4.1 | 0.005 ± 0.004 | 97.8 ± 34.2 | Fromard et al. (1998) |
| 93.3 ± 37.9 | 16.5 ± 4.5 | 0.003 ± 0.002 | 109.8 ± 37.4 | Chave et al. (2005) |
| 134.4 ± 54.1 | 24.0 ± 6.6 | 0.005 ± 0.004 | 158.4 ± 53.3 | Komiyama et al. (2005) |
| Bahía del Tóbari | ||||
| 30.0 ± 3.9 | 6.0 ± 2.2 | 36.1 ± 5.6 | Smith y Whelan (2006) | |
| 31.3 ± 5.2 | 11.7 ± 4.4 | 42.9 ± 8.2 | Imbert y Roller (1989) | |
| 32.1 ± 4.9 | 11.8 ± 4.5 | 43.9 ± 8.1 | Fromard et al. (1998) | |
| 34.9 ± 4.9 | 11.6 ± 6.0 | 46.5 ± 10.0 | Chave et al. (2005) | |
| 35.9 ± 5.1 | 16.2 ± 6.1 | 52.0 ± 9.5 | Day et al. (1987) | |
| 52.2 ± 7.9 | 13.3 ± 5.6 | 65.5 ± 12.8 | Komiyama et al. (2005) | |
± error estándar de la media con intervalo de confianza de 95 %.
La investigación en México sobre BA de manglar y su contenido de carbono es escasa; no obstante, se han hecho estimaciones para algunas regiones, las cuales se indican en el Cuadro 4. En el golfo de México y Pacífico centro se registran 137.32 y 101.75 Mg C∙ha-1, respectivamente (Herrera et al., 2016); en la península de Yucatán, el contenido de carbono varía entre 2.5 y 84.6 Mg C∙ha-1 (Adame et al., 2013); el Pacífico norte, donde se ubican los sitios de estudio, posee en promedio 42 Mg C∙ha-1, donde la Laguna Agua Brava de Nayarit (162.41 Mg C ha-1) y Bahía del Tóbari (3.4 Mg C∙ha-1) presentan los valores extremos (Herrera et al., 2016). Al comparar los datos anteriores con los de este estudio, los almacenes menores de El Sargento (54.1 Mg C∙ha-1) y de la Bahía del Tóbari (36.1 Mg C∙ha-1) se aproximan a las estimaciones de la región Pacífico norte (42 Mg C∙ha-1), aunque hay contraste con respecto a Bahía del Tóbari, donde la comparación se dificulta por la falta de información.
Cuadro 4 Biomasa aérea y carbono orgánico en distintos bosques de manglar.
| Sitio de estudio | Especie dominante | Características del manglar | Biomasa aérea (Mg∙ha-1) | Carbono (Mg∙ha-1) | Fuente | |
|---|---|---|---|---|---|---|
| Altura (m) | DAP (cm) | |||||
| México | ||||||
| El Sargento, Sonora | Ag y Lr | 108.1-316 | 54.1-158.4 | Este estudio | ||
| Bahía del Tóbari, Sonora | Ag y Rm | 72.12-130 | 36.1-65.5 | |||
| Sian Ka'an, Yucatán | Lr | 176.2 | 84.6 | Adame et al. (2013) | ||
| Rm | > 5 | 144.9 | 69.6 | |||
| Rm | 3-5 | 114.2 | 54.8 | |||
| Rm | <1.5 | 5.3 | 2.5 | |||
| Reserva de la Biósfera La Encrucijada, Chiapas | Ag, Lr y Rm | 20-40 | 8-11 | 421.1 | 215 | Adame et al. (2015) |
| Pacífico norte | 42.09 | Herrera et al. (2016) | ||||
| Pacífico centro | 101.75 | |||||
| Golfo de México | 137.32 | |||||
| Pacífico sur | 139.65 | |||||
| Guyana Francesa | Lr (Edad = 2-3 años) | 31.5 | Fromard et al. (1998) | |||
| Ag (edad = 50 años) | 180 | |||||
| Ag y Rm (edad = 60-70 años) | 315 | |||||
| República Dominicana | Rm | <3 | 11.9 | 10 | Kauffman et al. (2014) | |
| Lr y Rm | 3-10 | 54.2 | 47 | |||
| Rm | >10 | 240.7 | 161 | |||
| Colombia | ||||||
| Bahía de Cispatá | Rm | 129.69 | 64.85 | Yepes et al. (2016) | ||
| Delta del Río Atrato | Rm | >15 | 165.9 | 82.9 | Blanco-Libreros, Ortiz-Acevedo, y Urrego (2015) | |
| Ensenada de Rionegro | Rm | <2 | 115.6 | 57.8 | ||
| Puerto César-Punta | Ag, Lr y Rm | 5-16.5 | 85.4 | 42.7 | ||
| Turbo | Ag, Lr y Rm | < 5 | 75.8 | 37.9 | ||
| EUA (Costa oriente de Florida) | Ag, Lr y Rm | > 2 | 114 | 55 | Doughty et al. (2016) | |
Ag = Avicennia germinans, Lr = Laguncularia racemosa, Rm = Rhizophora mangle. DAP: Diámetro a la altura del pecho (1.3 m).
A pesar de las diferencias ambientales entre ecorregiones, la península de Yucatán (Sian Ka'an) registra BA (176.2 Mg∙ha-1) y almacenes de carbono (84.6 Mg C∙ha-1) intermedios (Adame et al., 2013), con respecto al intervalo calculado en El Sargento (BA = 108.1-316 Mg∙ha-1 y C = 54.1-158.4 Mg∙ha-1) (Cuadro 4). En diversos sitios de la península de Atasta se reportaron reservas de 36.8 a 235.77 Mg C∙ha−1 en R. mangle, y en la Bahía de Cispatá (Colombia), de 64.85 Mg C∙ha-1 (Yepes et al., 2016). Las aproximaciones de las cantidades previamente reportadas con respecto a El Sargento se atribuyeron a que L. racemosa es la especie dominante en Sian Ka'an, aunque de presencia moderada en Atasta.
Las diferencias o similitudes de las BA entre los sitios de estudio se justifican por la diversidad y abundancia de las especies. Los componentes ambientales, las prácticas de manejo y disturbios en los regímenes hidrológicos también influyen en el desarrollo de la BA. La altura decrece conforme la latitud aumenta, un patrón que produce pequeñas cantidades de BA y disminuye la captura de carbono (Morrisey et al., 2010). En contraste, los manglares primarios o maduros tienen mayor BA (menor en zonas templadas) en latitudes bajas, lo que se asocia con las condiciones climáticas (temperatura, radiación solar, precipitación y frecuencia de tormentas) (Komiyama et al., 2008).
Las características estructurales de la vegetación prevén cierta tolerancia de las especies a los efectos del cambio climático global (Doughty et al., 2016). Las propiedades y el estado nutrimental del suelo inciden en la tasa de crecimiento de biomasa y en la capacidad de secuestro de carbono (Komiyama et al., 2008). Esto se correlaciona con la talla de los árboles y el potencial secuestro de carbono en R. mangle: Adame et al., (2013) indicaron que los árboles menores de 1.5 m almacenan 2.5 Mg C∙ha-1 y mayores de 5 m almacenan 69.6 Mg C∙ha-1. Kauffman et al. (2014) coinciden con lo anterior: árboles menores de 3 m capturan 10 Mg C∙ha-1 y mayores de 10 m capturan hasta 161 Mg C∙ha-1.
Conclusiones
El Sargento es un medio ambiente prístino que registró mayores cantidades de biomasa aérea y reservas de carbono que Bahía del Tóbari, cuyo manglar presenta impactos antrópicos. El almacenamiento de carbono en los hábitats naturales es elemental para mitigar los efectos del cambio climático global. Se requieren políticas de conservación y manejo de manglares a nivel nacional, para favorecer su protección y mantener sus funciones ecológicas y ambientales.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el financiamiento otorgado al primer autor, a través del proyecto "Comportamiento de los gases de efecto invernadero (GEI) en los manglares estero El Sargento y Bahía el Tóbari, en Sonora y su relación con la hidroclimatología". A la Universidad de Sonora, por las facilidades brindadas para los recorridos de campo; a los pobladores de las comunidades del Sargento y del Tóbari, por permitir el acceso a los sitios de estudio; y a Jorge Luis Rodríguez Ibarra, por su apoyo en la etapa de campo.
REFERENCIAS
Adame, M. F., Kauffman, J. B., Medina, I., Gamboa, J. N., Torres, O., Caamal, J. P., …Herrera-Silveira, J. A. (2013). Carbon stocks of tropical coastal wetlands within the karstic landscape of the Mexican Caribbean. PLOS ONE, 8(2), e56569. doi: 10.1371/journal.pone.0056569 [ Links ]
Adame, M. F., Santini, N. S., Tovilla, C., Vázquez-Lule, A., Castro, L., & Guevara, M. (2015). Carbon stocks and soil sequestration rates of tropical riverine wetlands. Biogeosciences, 12, 3805-3818. doi: 10.5194/bg-12-3805-2015 [ Links ]
Betancourt-Portela, J. M., Parra, J. P., & Villamil, C. (2013). Emisión de metano y óxido nitroso de los sedimentos de manglar de la Ciénaga Grande de Santa Marta, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 42(1), 131-152. Retrieved from http://www.scielo.org.co/scielo.php?script=sci_abstract&pid=S0122-97612013000100008 [ Links ]
Blanco-Libreros, J. F., Ortiz-Acevedo, L. F., & Urrego, L. E. (2015). Reservorios de biomasa aérea y de carbono en los manglares del golfo de Urabá (Caribe colombiano). Actualidades Biológicas, 37(103), 131-141. doi: 10.17533/udea.acbi.v37n103a02 [ Links ]
Brevik, E. C., & Homburg, J. A. (2004). A 5000 years record of carbon sequestration from a coastal lagoon and wetland complex, Southern California, USA. CATENA, 57(3), 221-232. doi: 10.1016/j.catena.2003.12.001 [ Links ]
Carmona, R., Arce, N., Ayala, P., V., Mendoza, L. F. Hernández, A., & Cruz, M. A. (2015). Importancia del noroeste de México para la migración e invernación de las aves playeras. Biodiversitas, 121, 6-11. Retrieved from http://bioteca.biodiversidad.gob.mx/janium/Documentos/7539.pdf [ Links ]
Cartus, O., Kellndorfer, J., Walker, W., Franco, C., Bishop, J., Santos, L., & Michel, F. J. M. (2014). A national, detailed map of forest aboveground carbon stocks in Mexico. Remote Sensing, 6(6), 5559-5588. doi: 10.3390/rs6065559 [ Links ]
Chave, J., Andalo, C., Brown, S., Cairns, M. A., Chambers, J. Q., Eamus, D., …Yamakura, T. (2005). Tree allometry and improved estimation of carbon stocks and balance in tropical forests. Oecologia, 145(1), 87-99. doi: 10.1007/s00442-005-0100-x [ Links ]
Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO). (2010). Biodiversidad mexicana. Retrieved October 8, 2017, from http://www.biodiversidad.gob.mx/ecosistemas/manglares2013/manglares.html [ Links ]
Day, J. W., Conner, W. H., Ley-Lou, F., Day, R. H., & Navarro, A. M. (1987). The productivity and composition of mangrove forests, Laguna de Términos, Mexico, Aquatic Botany, 27(3), 267-284. doi: 10.1016/0304-3770(87)90046-5 [ Links ]
Dittmar, T., Hertkorn, N., Kattner, G., & Lara, R. J. (2006). Mangroves, a major source of dissolved organic carbon to the oceans. Global Biogeochemical Cycles, 20(1), GB1012. doi: 10.1029/2005GB002570 [ Links ]
Domínguez, S. L. (2010). Descripción del sistema ambiental y señalamiento de la problemática ambiental, detectada en el área de influencia del campo pesquero el paredón colorado y el paredoncio, Bahía del Tóbari, municipio de Benito Juárez, Sonora, para el establecimiento de infraestructura pesquera. Revista Sistemas Ambientales, 3(2), 18-61. [ Links ]
Donato, D. C., Kauffman, J. B., Murdiyarso, D., Kurnianto, S., Stidham, M., & Kanninen, M. (2011). Mangroves among the most carbon-rich forests in the tropics. Nature Geoscience, 4, 293-297. doi: 10.1038/ngeo1123 [ Links ]
Doughty, C. L., Langley, J.A., Walker, W. S., Feller, I. C., Schaub, R., & Chapman, S. K. (2016). Mangrove range expansion rapidly increases coastal wetland carbon storage. Estuaries and Coasts , 39(2), 385-396. doi: 10.1007/s12237-015-9993-8 [ Links ]
Duke, N. C., Meynecke, J. O., Dittmann, S., Ellison, A. M., Anger, K., Berger, U., …Dahdouh-Guebas, F. (2007). A world without mangroves? Science, 317(5834), 41-42. doi: 10.1126/science.317.5834.41b [ Links ]
Fatoyinbo, T. E., & Simard, M. (2013). Height and biomass of mangroves in Africa from ICESat/GLAS and SRTM. International Journal of Remote Sensing, 34(2), 668-681. doi: 10.1080/01431161.2012.712224 [ Links ]
Food and Agriculture Organization (FAO). (2010). Evaluación de los recursos forestales mundiales 2010-Informe nacional México. Roma, Italia: Autor. Retrieved from http://www.sidalc.net/cgi-bin/wxis.exe/?IsisScript=sibe01.xis&method=post&formato=2&cantidad=1&expresion=mfn=028592 [ Links ]
Fromard, F., Puig, H., Mougin, E., Marty, G., Betoulle, J. L., & Cadamuro, L. (1998). Structure, above groundbiomass and dynamics of mangrove ecosystems: New data from French Guiana. Oecologia, 115(1), 39-53. doi: 10.1007/s004420050489 [ Links ]
García, E., & Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO). (1998). Climas Escala 1:1 000 000. México: CONABIO. [ Links ]
Guerra-Santos, J. J., Cerón-Bretón, R. M., Cerón-Bretón, J. G., Damián-Hernández, D. L., Sánchez-Junco, R. C., & Guevara, C. (2014). Estimation of the carbon pool in soil and above-ground biomass within mangrove forests in Southeast Mexico using allometric equations. Journal of Forestry Research, 25(1), 129-134. doi: 10.1007/s11676-014-0437-2 [ Links ]
Hernández, E. (2009). Suelos de humedales como sumideros de carbono y fuentes de metano. Terra Latinoamericana, 28(2), 139-147. Retrieved from http://www.scielo.org.mx/scielo.php?pid=S0187-57792010000200005&script=sci_arttext [ Links ]
Herrera, S. J. A., Camacho, R. A., Pech, E., Pech, M., Ramírez, R. J., & Teutli, H. C. (2016). Dinámica del carbono (almacenes y flujos) en manglares de México. Terra Latinoamericana, 34(1), 61-72. Retrieved from http://www.redalyc.org/html/573/57344471004/ [ Links ]
Hutchison, J., Manica, A., Swetnam, R., Balmford, A., & Spalding, M. (2014). Predicting global patterns in mangrove forest biomass. Wiley Periodicals, 7(3), 233-240. doi: 10.1111/conl.12060 [ Links ]
Imbert, D., & Rollet, B. (1989). Phytmassaerienne et production primaire dans la mangrove du Grand Cul-de-sac Marine (Guadeloupe, Antilles francaises). Bulletin d´écologie, 20, 27-39. [ Links ]
Instituto Nacional de Ecología (INE). (2005). Evaluación preliminar de las tasas de pérdida de superficie de manglar en México. México: Dirección General de Investigación de Ordenamiento Ecológico y Conservación de los Ecosistemas. Retrieved from http://www.inecc.gob.mx/descargas/con_eco/informe_manglar.pdf [ Links ]
Intergovernmental Panel on Climate Change (IPCC). (2007). Climate change 2007: Synthesis report. Geneva, Switzerland: Author. Retrieved from https://www.ipcc.ch/pdf/assessment-report/ar4/syr/ar4_syr_full_report.pdf [ Links ]
Intergovernmental Panel on Climate Change (IPCC). (2013). Resumen para responsables de políticas. In T. F. Stocker, D. Qin, G. K. Plattner, M. Tignor, S. K. Allen, J. Boschung, … P. M. Midgley (Eds.), Cambio Climático 2013: Bases físicas. Contribución del grupo de trabajo I al quinto informe de evaluación del grupo intergubernamental de expertos sobre el cambio climático. UK & USA: Cambridge University Press. Retrieved from https://www.ipcc.ch/pdf/assessment-report/ar5/wg1/WG1AR5_SPM_brochure_es.pdf [ Links ]
Kauffman, J. B., Donato, D. C., & Adame, M. F. (2013). Protocolo para la medición, monitoreo y reporte de la estructura, biomasa y reservas de carbono de los manglares. Bogor, Indonesia: Center for International Forestry Research (CIFOR). Retrieved from http://webdoc.sub.gwdg.de/ebook/serien/yo/CIFOR_WP/117.pdf [ Links ]
Kauffman, J. B., Heider, C., Norfolk, J., & Payton, F. (2014). Carbon stocks of intact mangroves and carbon emissions arising from their conversion in the Dominican Republic. Ecological Applications, 24(3), 518-527. doi: 10.1890/13-0640.1 [ Links ]
Komiyama, A., Ong, J. E., & Poungparn, S. (2008). Allometry, biomass, and productivity of mangrove forests: A review. Aquatic Botany, 89(2), 128-137. doi: 10.1016/j.aquabot.2007.12.006 [ Links ]
Komiyama, A., Poungparn, S., & Kato, S. (2005). Common allometric equations for estimating the tree weight of mangroves. Journal of Tropical Ecology, 21(4), 471-477. doi: 10.1017/S0266467405002476 [ Links ]
Lema, V., & Polanía, J. (2006). Estructura y dinámica del manglar del delta del río Ranchería, Caribe colombiano. Revista de Biología Tropical, 55(1), 11-21. Retrieved from http://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S0034-77442007000100003 [ Links ]
López-Medellín, X. J., Acosta-Velázquez, J., & Vázquez-Lule, A. D. (2009). Caracterización del sitio de manglar estero El Sargento-Isla Tiburón. Sitios de manglar con relevancia biológica y con necesidades de rehabilitación ecológica. México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO). Retrieved from http://www.conabio.gob.mx/conocimiento/manglares/doctos/caracterizacion/PN04_Estero_El_Sargento_Isla_Tiburon_caracterizacion.pdf [ Links ]
Masera, O. R., Cerón, A. D., & Ordóñez, A. (2001). Forestry mitigation options for Mexico: Finding synergies between national sustainable development priorities and global concerns. Mitigation and Adaptation Strategies for Global Change, 6(3-4), 291-312. doi: 10.1023/A:1013327019175 [ Links ]
Ministerio del Ambiente y los Recursos Naturales. (1994). Plan de manejo de la cooperativa Pedro Joaquín Chamorro Cardenal. Proyecto de protección del bosque. Managua, Nicaragua: Proyecto Nandarola/ MARENA-DED. [ Links ]
Mitsch, W. J., & Gosselink, J. G. (2000). Wetlands (3rd. edition). New York, USA: John Wiley & Sons. doi: 10.1002/rrr.637 [ Links ]
Morrisey, D. J., Swales, A., Dittmann, S., Morrison, M. A., Lovelock, C. E., & Beard, C. M. (2010). The ecology and management of temperate mangroves. Oceanography and Marine Biology: An Annual Review, 48, 43-160. doi: 10.1201/EBK1439821169-c2 [ Links ]
Moya, B. V., Hernández, A. E., & Borrell, H. E. (2005). Los humedales ante el cambio climático. Investigaciones Geográficas, 37, 127-132. Retrieved from http://www.redalyc.org/articulo.oa?id=17612746005 [ Links ]
Olivo, M. D. L., & Soto-Olivo, A. (2010). Comportamiento de los gases de efecto invernadero y las temperaturas atmosféricas con sus escenarios de incremento potencial. Universidad, Ciencia y Tecnología, 14(57), 221-230. Retrieved from http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S1316-48212010000400002 [ Links ]
Ong, J. E., Gong, W. K., & Wong, C. H. (2004). Allometry and partitioning of the mangrove, Rhizophora apiculata. Forest Ecology and Management, 188(1-3), 395-408. doi: 10.1016/j.foreco.2003.08.002 [ Links ]
Organización Meteorológica Mundial & Programa de las Naciones Unidas para el Medio Ambiente (OMM & PNUMA). (2005). La captación y el almacenamiento de dióxido de carbono. Génova, Suiza: Intergovernmental Panel on Climate Change. Retrieved from https://www.ipcc.ch/pdf/special-reports/srccs/srccs_spm_ts_sp.pdf [ Links ]
Purvaja, R., & Ramesh, R. (2001). Natural and anthropogenic methane emission from coastal wetlands of South India. Environmental Management, 27(4), 547-557. doi: 10.1007/s002670010169 [ Links ]
Richter, H. G., & Dallwitz, M. J. (2000). Commercial timbers: Descriptions, illustrations, identification and information retrieval. Retrieved July 25, 2017 from http://www1.biologie.uni-hamburg.de/b-online/wood/english/intro.htm [ Links ]
Rodríguez-Zúñiga, M. T., Troche-Souza, C., Vázquez-Lule, A. D., Márquez-Mendoza, J. D., Vázquez- Balderas, B., Valderrama-Landeros, L., …Galindo-Leal, C. (2013). Manglares de México. Extensión, distribución y monitoreo. México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Retrieved from http://www.biodiversidad.gob.mx/ecosistemas/manglares2013/pdf/manglares_de_mexico_1.pdf [ Links ]
Secretaría del Medio Ambiente y Recursos Naturales (SEMARNAT). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Nación. México: Autor. Retrieved from http://www.profepa.gob.mx/innovaportal/file/435/1/NOM_059_SEMARNAT_2010.pdf [ Links ]
Smith, T. J., & Whelan, K. R. T. (2006). Development of allometric relations for three mangrove species in South Florida for use in the Greater Everglades Ecosystem restoration. Wetlands Ecology and Management, 14(5), 409-419. doi: 10.1007/s11273-005-6243-z [ Links ]
Troxler, T. G., Barr, J. G., Fuentes, J. D., Engel, V., Anderson, G., Sanchez, C., …Davis, S. E. (2015). Component-specif ic dynamics of riverine mangrove CO2 efflux in the Florida coastal Everglades. Agricultural and Forest Meteorology, 213, 273-282. doi: 10.1016/j.agrformet.2014.12.012 [ Links ]
Valderrama, L., Troche, C., Rodríguez, M. T., Márquez, D., Vázquez, B., Velázquez, S., …Ressl, R. (2014). Evaluation of mangrove cover changes in Mexico during the 1970-2005 period. Wetlands, 34(4), 747-758. doi: 10.1007/s13157-014-0539-9 [ Links ]
Yáñez-Arancibia, A., & Day, J. W. (2010). La zona costera frente al cambio climático: vulnerabilidad de un sistema biocomplejo e implicaciones en el manejo costero. In E. Rivera-Arriaga, I. Azuz-Adeath, L. Alpuche, & G. J. Villalobo-Zapata (Eds.), Cambio climático en México un enfoque costero-marino (pp. 3-22). Campeche, México: Universidad Autónoma de Campeche CETYS-Universidad, Gobierno del Estado de Campeche. Retrieved from http://etzna.uacam.mx/epomex/publicaciones/Cambio_Climatico/CCMexico1B.pdf [ Links ]
Yepes, A., Zapata, M., Bolivar, J., Monsalve, A., Espinosa, S. M., Sierra-Correa, P. C., & Sierra, A. (2016). Ecuaciones alométricas de biomasa aérea para la estimación de los contenidos de carbono en manglares del Caribe Colombiano. Revista Biología Tropical, 64(2), 913-926. doi: 10.15517/rbt.v64i2.18141 [ Links ]
Recibido: 27 de Febrero de 2018; Aprobado: 26 de Julio de 2018











 text in
text in 




