Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo serie ciencias forestales y del ambiente
versão On-line ISSN 2007-4018versão impressa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.24 no.2 Chapingo Mai./Ago. 2018
https://doi.org/10.5154/r.rchscfa.2017.02.014
Artículo científico
Descripción anatómica de la colonización de hongos micorrízicos arbusculares en dos leguminosas arbóreas
1Universidad Centroccidental “Lisandro Alvarado”, Decanato de Agronomía, Posgrado de Agronomía. Calle 1 entre Av. General Patiño y Redoma de Agua Viva. Cabudare, Lara, Venezuela.
Introducción:
La asociación micorrízica arbuscular es la simbiosis entre un hongo y las raíces de las plantas, la cual contribuye a mantener los ecosistemas de manera sostenible.
Objetivos:
Describir la colonización de tres hongos micorrízicos arbusculares (HMA) inoculados en dos leguminosas arbóreas y determinar el tipo morfológico de la asociación simbiótica.
Materiales y métodos:
Las semillas de Pithecellobium dulce (Roxb.) Benth. y Platymiscium diadelphum S. F. Blake se inocularon con tres cepas puras de HMA: Rhizophagus manihotis (R. H. Howeler, Sieverd. & N. C. Schenck) C. Walker & A. Schüßler, Funneliformis mosseae (T. H. Nicolson & Gerd.) C. Walker & A. Schüßler y Scutellospora heterogama (T. H. Nicolson & Gerd.) C. Walker & F. E. Sanders. A los 105 días, las raíces secundarias se muestrearon, clarificaron y tiñeron con fucsina ácida y azul de tripán. Las estructuras fúngicas se observaron en microscopio óptico y se determinó el porcentaje de colonización.
Resultados y discusión:
La colonización de los HMA fue mayor de 60 %. Se observaron hifas delgadas, transparentes y cenocíticas, así como hifopodios y arbúsculos. En P. dulce, S. heterogama tiende a producir mayor cantidad de arbúsculos. En P. diadelphum, los porcentajes de colonización y estructuras fúngicas de los HMA fueron similares. La asociación morfológica en las dos especies arbóreas fue principalmente de tipo Paris, con presencia ocasional del tipo Arum.
Conclusión:
Los inóculos de los HMA establecieron alta asociación simbiótica con las leguminosas estudiadas. Las técnicas aplicadas evidenciaron las estructuras de los HMA en el interior de la raíz y permitieron identificar la asociación morfológica de los simbiontes.
Palabras clave: Pithecellobium dulce; Platymiscium diadelphum; Rhizophagus manihotis; Funneliformis mosseae; Scutellospora heterogama; simbiosis
Introduction:
The arbuscular mycorrhizal association is the symbiosis between fungi and the roots of plants, which contributes to maintaining ecosystems in a sustainable manner.
Objectives:
To describe the colonization of three arbuscular mycorrhizal fungi (AMF) inoculated in two tree legumes and to determine the morphological type of the symbiotic association.
Materials and methods:
The seeds of Pithecellobium dulce (Roxb.) Benth. and Platymiscium diadelphum S. F. Blake were inoculated with three pure strains of AMF: Rhizophagus manihotis (R. H. Howeler, Sieverd. & N. C. Schenck) C. Walker & A. Schüßler, Funneliformis mosseae (T. H. Nicolson & Gerd.) C. Walker & A. Schüßler y Scutellospora heterogama (T. H. Nicolson & Gerd.) C. Walker & F. E. Sanders. At 105 days, the secondary roots were sampled, clarified and stained with acid fuchsin and trypan blue. The fungal structures were observed under an optical microscope and the colonization percentage was determined.
Results and discussion:
The colonization of the AMF was greater than 60 %. Thin, transparent and cenocitic hyphae, as well as hylopodia and arbuscules, were observed. In P. dulce, S. heterogama tends to produce more arbuscules. In P. diadelphum, the percentages of colonization and fungal structures of the AMF were similar. The morphological association in the two arboreal species was mainly from the Paris type, with occasional presence of the type Arum.
Conclusion:
The inocula of the AMF established high symbiotic association with the legumes studied. The applied techniques evidenced the structures of the AMF inside the root and allowed to identify the morphological association of the symbionts.
Keywords: Pithecellobium dulce; Platymiscium diadelphum; Rhizophagus manihotis; Funneliformis mosseae; Scutellospora heterogama; symbiosis
Introducción
La asociación micorrízica arbuscular es una simbiosis entre un hongo y el sistema de raíces de las plantas. Es una interacción biotrófica, armoniosa y no patogénica, que contribuye a mantener los ecosistemas de manera sostenible (Bonfante & Genre, 2012; Scheublin & van der Heijden, 2006). La simbiosis descrita es mutualista, donde ambos organismos se benefician de un intercambio recíproco de minerales y recursos orgánicos (Cuenca, Cáceres, Oirdobro, Hasmy, & Urdaneta, 2007) para mejorar el estatus nutricional de las partes involucradas.
Los hongos micorrízicos facilitan la absorción de nutrientes que se encuentran difícilmente disponibles para las plantas (Ortas, 2009; van der Heijden & Scheublin, 2007); además, favorecen el ajuste osmótico durante periodos de estrés por escasez de humedad en el suelo (Augé et al., 2004). En contraparte, el hongo requiere a la planta hospedante para completar el ciclo de vida. Es así como la planta controla la colonización y formación de arbúsculos de acuerdo con sus necesidades, regula sus mecanismos de defensa e inicia un proceso de comunicación preparando a las células de la corteza de la raíz para recibir al simbionte (Schmitz & Harrison, 2014). A medida que la colonización avanza a través de la raíz, las estructuras fúngicas se desarrollan en dos tipos de asociación denominadas Arum y Paris. En la primera, la hifa crece intercelularmente en la corteza, en sentido longitudinal a este tejido y penetra con cortas ramificaciones en las células formando arbúsculos en su interior. En el tipo Paris, la hifa intracelular se enrolla formando espirales; no siempre origina arbúsculos capaces de interactuar con el citoesqueleto. De esta manera, la hifa permanece separada del citoplasma de la célula del hospedante por una matriz en la interfase formada en el compartimiento apoplástico, similar al tipo Arum (Kubota, McGonigle, & Hyakumachi, 2005).
Smith y Smith (1997) determinaron el tipo de asociación entre los hongos micorrízicos arbusculares (HMA) y las plantas, evidenciando que prevaleció el tipo Paris en 41 familias botánicas, mientras que en otras 30 estuvo presente el tipo Arum; además, encontraron tipos intermedios en 21 familias, entre estas, las fabáceas. Se ha reportado que los individuos de esta familia botánica son capaces de establecer relaciones simbióticas con diversos organismos, tanto con los HMA como con las bacterias encargadas de fijar nitrógeno (Zhu, Riely, Burns, & Ané, 2006). La triple relación simbiótica planta-hongo-bacteria garantiza mayor eficiencia a las leguminosas, incrementando su importancia biológica (Scotti & Corrêa, 2004).
Las especies arbóreas Pithecellobium dulce (Roxb.) Benth. y Platymiscium diadelphum S. F. Blake son plantas autóctonas capaces de soportar las condiciones adversas que caracterizan a la zona semiárida del estado Lara, Venezuela. Las semillas frescas de P. dulce y P. diadelphum alcanzan valores de emergencia de 91 y 78 %, respectivamente, lo que amplía su potencial para incluirlos en el paisajismo urbano y con beneficios ecológicos y económicos, tal como la producción de madera de excelente calidad en el caso del roble (Parra, Sanabria, & Maciel, 2011). Una estrategia que garantiza la sobrevivencia de las especies arbóreas, ante las condiciones de estrés del trasplante y establecimiento en el arbolado urbano, es la inoculación con HMA en fases iniciales en vivero.
Los objetivos del presente trabajo fueron describir la colonización de los HMA Rhizophagus manihotis (R. H. Howeler, Sieverd. & N. C. Schenck) C. Walker & A. Schüßler, Funneliformis mosseae (T. H. Nicolson & Gerd.) C. Walker & A. Schüßler y Scutellospora heterogama (T. H. Nicolson & Gerd.) C. Walker & F. E. Sanders, inoculados en plantas de yacure (P. dulce) y roble (P. diadelphum), árboles adaptados a condiciones del semiárido; y determinar el tipo morfológico de la asociación simbiótica.
Materiales y métodos
Los experimentos se llevaron a cabo en las instalaciones del Posgrado del Decanato de Agronomía de la Universidad Centroccidental “Lisandro Alvarado” (10º 01’ 30’’ LN, 69º 16’ 30’’ LO y 500 m de altitud) ubicado en Cabudare, en el municipio Palavecino del estado Lara, Venezuela. La precipitación anual del lugar es 662 mm con temperatura media anual de 24.9 °C.
Los frutos maduros de P. dulce y P. diadelphum se colectaron de árboles adultos de 12 y 25 años, respectivamente, los cuales están ubicados en las instalaciones de la institución. Los frutos se procesaron para seleccionar semillas con base en el tamaño, grado de formación, coloración, ausencia de malformaciones y síntomas aparentes de enfermedades. En tubetes diseñados para producir árboles forestales se agregó sustrato, producto de la mezcla de aserrín de coco, cáscara de arroz y suelo franco arenoso (1:1:1) pasteurizado. El sustrato se colocó hasta completar 70 % del volumen disponible de la celda; en cada una se adicionaron 30 g de inóculo granulado de HMA conformando los siguientes tratamientos: R. manihotis (T1), F. mosseae (T2) y S. heterogama (T3). Una semilla se sembró en cada tubete. Las cepas puras de HMA fueron proporcionadas por la Unidad Micoven del Instituto Venezolano de Investigaciones Científicas (IVIC).
El diseño de experimentos fue completamente al azar; cada tratamiento estuvo conformado por 40 unidades experimentales. A los 105 días después de la siembra (dds), las raíces secundarias de 20 plantas, seleccionadas al azar, se sometieron al proceso de clarificación con la metodología de Phillips y Hayman (1970). Las raíces se dividieron en dos grupos y se tiñeron con fucsina ácida y azul de tripán.
El porcentaje de colonización en las raíces se determinó con la metodología propuesta por McGonigle, Hiller, Evans, Fairchild, y Swan (1990); se eligieron las más delgadas (<1 mm) y se separaron en secciones de 1 cm de largo. Las raíces se colocaron sobre la lámina portaobjeto en posición vertical. La colonización se describió a través de observaciones con un microscopio óptico (Olympus CX21, China) de 400x y 1000x de aumento. Las estructuras micorrízicas (hifas, arbúsculos y vesículas) se cuantificaron mediante las siguientes fórmulas:
Colonización (%): [segmentos colonizado (cm) / (segmento no colonizado (cm) + segmento colonizado (cm)] * 100
Colonización por hifas (%): (número de segmentos con hifas / número de segmentos totales) * 100
Colonización por arbúsculos (%): (número de segmentos con arbúsculos / número de segmentos totales) * 100
Colonización por vesículas (%): (número de segmentos con vesículas / número de segmentos totales) * 100
Las raíces teñidas se seccionaron transversalmente a mano alzada. En cada segmento y sección se describieron las estructuras de los hongos. La información fue necesaria para definir el tipo morfológico de la asociación.
Análisis estadístico
Los datos de porcentaje de colonización se analizaron mediante análisis de varianza después de comprobar los supuestos estadísticos del diseño completamente al azar, en el programa Statistix versión 8.0. (Analytical Software, 2003). Posteriormente se hizo una comparación de medias con la prueba de Dunnet (P ≤ 0.05).
Resultados y discusión
Pithecellobium dulce
Colonización de los hongos micorrízicos arbusculares a los 105 días después de la siembra
El Cuadro 1 muestra los resultados de colonización y desarrollo de estructuras de los HMA en P. dulce. A los 105 dds, R. manihotis colonizó 80.36 % de las raíces y desarrolló 79.40 % de hifas y 47.60 % de arbúsculos; F. mosseae colonizó 61.38 % y generó 61.05 % de hifas y 31.57 % de arbúsculos; mientras que S. heterogama tuvo aproximadamente el mismo porcentaje de colonización, hifas y arbúsculos (59 %). El análisis de varianza detectó diferencias significativas (P < 0.05) entre al menos un par de medias de los tratamientos inoculados al estimar las variables mencionadas anteriormente, siendo R. manihotis (T1) quien produjo mayor porcentaje de colonización e hifas. La producción de arbúsculos y vesículas fue estadísticamente similar (P > 0.05) en R. manihotis y S. heterogama. Rhizophagus manihotis y F. mosseae tuvieron 18.91 y 15.95 % de vesículas intrarradicales, respectivamente. Cabe destacar que S. heterogama no las produce (González & Cuenca, 2008). Las vesículas son indicativos de la finalización del desarrollo del hongo micorrízico al colonizar las raíces (Bonfante & Genre, 2012), de manera que se infiere que R. manihotis y F. mosseae se mantuvieron creciendo activamente.
Cuadro 1 Colonización y estructuras de hongos micorrízicos arbusculares inoculados en Pithecellobium dulce. Las estructuras fúngicas se cuantificaron en segmentos de raíces a los 105 días después de la siembra.
| Tratamientos | Colonización (%) | Hifas (%) | Arbúsculos (%) | Vesículas (%) |
|---|---|---|---|---|
| Rhizopagus manihotis | 80.36 ± 2.62 a | 79.40 ± 2.85 a | 47.60 ± 3.67 a | 18.91 ± 2.25 a |
| Funneliformis mosseae | 61.38 ± 2.91 b | 61.05 ± 3.01 b | 31.57 ± 1.88 b | 15.95 ± 2.67 a |
| Scutellospora heterogama | 59.98 ± 3.81 b | 59.38 ± 3.90 b | 59.38 ± 2.33 a | 0 a |
| Coeficiente de variación (%) | 12.26 | 12.74 | 17.08 | 19.03 |
Medias con diferente letra en cada columna difieren significativamente según la prueba de Dunnet (P ≤ 0.05).
El mayor porcentaje de colonización correspondió al tratamiento donde se inoculó R. manihotis (80.36 %). En el caso de F. mosseae y S. heterogama, aunque fueron inferiores a los de T1 (61.38 y 59.58 %, respectivamente), superaron el valor señalado por Habte, Fox, Aziz, y El-Swaify (1988) para L. leucochepala ‘K8’, inoculada con Glomus agregatum N. C. Schenck & G. S. Sm. (30 % de colonización). Lo planteado permite inferir que las esporas utilizadas en los ensayos tuvieron condiciones adecuadas para la germinación y, tal cual lo señalaron dichos autores, los hongos se comportaron como buenos colonizadores. Los resultados demostraron la afinidad entre los HMA y P. dulce, especie perteneciente a las fabáceas, lo cual coincidió con los resultados obtenidos por Patreze y Cordeiro (2005), quienes indicaron 24.72, 42.25 y 15.35 % de colonización de hongos micorrízicos nativos en Enterolobium contortisiliquum (Vell.) Morong, Inga laurina (Sw.) Willd. y Platypodium elegans Vogel, respectivamente. Los valores superiores a 50 % de colonización, en relaciones micorrízicas, favorecen la sucesión ecológica y nivel de sobrevivencia, tal cual lo señalan Kumar, Raghuwanshi, y Upadhyay (2003) en Acacia auriculiformis A. Cunn. ex Benth., A. catechu (Willd.) Wight & Arn., A. procera (Roxb.) Willd., A. nilotica (L.) Delile, Albizia lebbeck (L.) Benth., Prosopis juliflora (SW) DC., Pongamia pinnata (L.) Pierre, Dalbergia sissoo Roxb. ex DC. y Tamarindus indica (L.), especies de la familia Fabaceae.
Con respecto al porcentaje de arbúsculos, la fluctuación entre los tratamientos con R. manihotis, F. mosseae y S. heterogama en P. dulce se justifica, ya que estas estructuras son de vida corta, con ocurrencia estacional y de formación sensible a la variación de los factores ambientales y metabolismo fisiológico de la planta hospedante (Alexander, Meier, Toth, & Weber, 1988).
Por otra parte, el bajo porcentaje de vesículas determinado en este estudio (18.95 y 15.95 % para R. manihotis y F. mosseae, respectivamente) se explica por el hecho de que la formación de estas estructuras de almacenamiento depende del tipo de hongo micorrízico, de su desarrollo dentro de la raíz y de los factores ambientales (Hawley & Dames, 2004; Kumar et al., 2003).
Anatomía de la colonización de los hongos micorrízicos arbusculares
La Figura 1 ilustra la colonización de los hongos micorrízicos arbusculares R. manihotis (A y E), S. heterogama (B y G) y F. mosseae (C, D y F). La colonización en P. dulce se evidenció en las raíces terminales, manteniéndose la integridad de las células corticales. Las hifas formaron hifopodios engrosados, los cuales fueron el medio de penetración a través o entre las células rizodérmicas (Figura 1B). Estas observaciones coincidieron con las descritas por Garriock, Petersonm, y Ackerley (1989), quienes consideraron que dichas estructuras son similares a las de los hongos patogénicos. Las hifas inter e intracelulares se desarrollaron desde los puntos de penetración (Figuras 1B y 1D) en sentidos de dirección circunferencial y longitudinal, recorriendo el parénquima cortical, sin llegar al cilindro vascular (Figuras 1F y 1G).

Figura 1 Colonización de los hongos micorrízicos arbusculares Rhizopagus manihotis (A y E), Scutellospora heterogama (B y G) y Funneliformis mosseae (C, D y F) en aclarados (A, B, C, D y E) y secciones transversales (F y G) de raíces de Pithecellobium dulce; donde se pueden observar rizodermis (ri), corteza (c), cilindro vascular (cv), hifa extrarradical (he), hifopodio (ap), hifa intrarradical (hi), rulo intracelular (r), exodermis (ex), endodermis (en), arbúsculo (a) y tronco o base del arbúsculo (ta).
De acuerdo con el desarrollo del micelio intrarradical, el comportamiento morfológico observado en P. dulce fue intermedio entre el tipo Arum (Figuras 1A, 1B y 1F) y Paris (Figuras 1C y 1D). Durante la primera fase de colonización, el segundo tipo morfológico fue predominante en sentido circunferencial, ya que el simbionte fúngico se propagó en el parénquima cortical por medio de hifas intracelulares de grosor considerable (Figura 1F); posteriormente, se formaron arbúsculos como estructuras terminales dentro de las células, además de espirales o rulos intercelulares (Figura 1C). Las interfases arbusculares en los tipos Arum y Paris fueron similares. En los arbúsculos se pudo distinguir el tronco o base, mientras que las terminaciones de los extremos se dividieron dicotómicamente (Figura 1E). Estos resultados coincidieron con los reportados por Shi, Chen, Feng, Liu, y Christie (2006) en especies de Meliaceae, y con los de Armstrong y Peterson (2002) en Panax quinquefolius L. Aunque la función de las hifas enrolladas en el tipo morfológico Paris aún es incierta, Cavagnaro, Smith, Ayling, y Smith (2003) afirmaron que estas proveen un área interfacial tan amplia como los arbúsculos, lo cual podría estar relacionado con la transferencia de nutrientes en especies vegetales tolerantes a estrés ambiental y de crecimiento lento. Por su parte, Hawley y Dames (2004) consideraron que el hospedante podría determinar el tipo morfológico dominante, indicando que las diferentes estructuras no son más que adaptaciones para la sobrevivencia del hongo.
Platymiscium diadelphum
Colonización de los hongos micorrízicos arbusculares a los 105 días después de la siembra
El Cuadro 2 presenta los resultados de la colonización de R. manihotis, F. mosseae y S. heterogama en P. diadelphum a los 105 dds. La colonización de los tres HMA fue mayor de 90 %, siendo estadísticamente similar (P > 0.05). El porcentaje de hifas, arbúsculos y vesículas también fue similar en los tres tratamientos.
La interacción e intercambio bidireccional entre la planta y el hongo micorrízico se evidenciaron con un porcentaje de arbúsculos satisfactorio en cada tratamiento. El valor más bajo fue de 69.7 % en F. mosseae, mientras que el máximo correspondió a R. manihotis (85.7 %); los tres tratamientos fueron estadísticamente similares (P > 0.05). La importancia de la presencia de arbúsculos radica en que estas estructuras participan directamente en el transporte de compuestos necesarios para el desarrollo de la planta y el hongo (Ortas, 2009).
Los porcentajes de vesículas intrarradicales fueron 85.7 y 12.2 para R. manihotis y F. mosseae, respectivamente. Estos valores permitieron inferir que la interacción entre P. diadelphum y los inóculos utilizados si se llevó a cabo, ya que la colonización fue mayor de 90 %. A pesar de los márgenes de diferencia de los valores, el análisis de varianza (P < 0.05) no detectó diferencias significativas entre las variables evaluadas. Los valores bajos se deben a que las vesículas se forman con la finalidad de almacenar sustancias de reservas, por lo que son menos percibidas hasta que el hongo se encuentra totalmente establecido.
Cuadro 2 Colonización y estructuras de hongos micorrízicos arbusculares inoculados en Platymiscium diadelphum. Las estructuras fúngicas se cuantificaron en segmentos de raíces a los 105 días después de la siembra.
| Tratamientos | Colonización (%) | Hifas (%) | Arbúsculos (%) | Vesículas (%) |
|---|---|---|---|---|
| Rhizopagus manihotis | 98.50 ± 2.75 | 93.50 ± 2.99 | 85.70 ± 3.24 | 85.70 ± 2.47 |
| Funneliformis mosseae | 92.40 ± 2.95 | 91.10 ± 3.07 | 69.70 ± 3.88 | 12.20 ± 3.35 |
| Scutellospora heterogama | 91.30 ± 2.37 | 88.10 ± 3.65 | 72.20 ± 3.83 | 0.0 |
| Coeficiente de variación (%) | 17.22 | 6.97 | 12.42 | 18.03 |
De acuerdo con la prueba de Dunnet, no hubo diferencia significativa (P > 0.05) en el efecto de los hongos micorrízicos arbusculares (tratamientos).
Los resultados demostraron que el nivel de asociación de P. diadelphum con R. manihotis, F. mosseae y S. heterogama es alto, considerando las categorías de clasificación propuestas por Kumar et al. (2003).
La relación micorrízica de P. diadelphum concuerda con lo expresado por Saslis-Lagoudakis, Chase, Robinson, Russell, y Klitgaard (2008), quienes determinaron que el éxito en el establecimiento de Platymiscium se debe al desarrollo de estrategias para optimizar su desarrollo y adaptación en biomas secos, a su vez Smith y Smith (1997) indicaron la existencia de una simbiosis micorrízica en las leguminosas de la subfamilia Papilionoideae.
Para los individuos de la familia Fabaceae se han reportado porcentajes altos de colonización por hongos micorrízicos. En este mismo sentido, en un estudio realizado en seis familias de angiospermas, Fabaceae ocupó el tercer lugar en colonización con valores superiores de 50 % (Ali, Mubassara, Rahman, Alam, & Khan, 2008). Del mismo modo, Rey, Chamorro, y Ramírez (2005) determinaron colonización superior de 60 % cuando emplearon la doble inoculación con cepas de rizobios en Leucaena leucocephala (Lam.) de Wit, mientras que Ingleby, Wilson, y Munro (2007) señalaron que las fabáceas de porte arbóreo Senna siamea (Lam.) H. S. Irwin & Barneby, Gliricidia sepium (Jacq.) Kunth ex Walp. y Calliandra calothyrsus Meisn. son altamente dependientes de las micorrizas y, por consiguiente, responden satisfactoriamente a la inoculación. Por su parte, Sylvia, Alagely, Kent, y Mecklenburg (1998) determinaron que las plantas que crecen en contenedores presentan mayor porcentaje de colonización que aquellas que crecen en espacios abiertos, tal como lo observaron en Acacia farnesiana (L.) Willd.
Los porcentajes de arbúsculos en P. diadelphum fueron elevados, correspondiendo con las categorías de moderada a muy altas de acuerdo con Kumar et al. (2003), a pesar de que estas estructuras son consideradas de corta vida (Alexander et al., 1988). Caso contrario ocurrió con las vesículas; la ausencia de estas se atribuyó a que el hongo se encuentra en una fase activa de desarrollo (Hawley & Dames, 2004).
La inoculación con HMA causó resultados satisfactorios; sin embargo, no hubo prevalencia constante de un hongo micorrízico sobre otro, aunque los porcentajes de colonización hayan sido elevados. Este resultado permite inferir que una planta hospedante puede interrelacionarse con diversos HMA, respuesta que puede medirse a través de los efectos en la sobrevivencia y diversidad de especies vegetales en un ecosistema (Scotti & Corrêa, 2004). Es necesario considerar los factores extrínsecos de la planta (Jansa, Smith, & Smith, 2008), ya que la cuantificación de estructuras del hongo dentro de la raíz es variable.
Cada especie fúngica tiene características potenciales para establecer las simbiosis, tal es el caso de las especies de Gigasporaceae que son lentas para colonizar, pero sus hifas alcanzan mayor extensión en el suelo durante la germinación de la espora y posterior a este periodo (Matekwor, Andoh, & Nonaka, 2007). La dinámica de crecimiento y desarrollo de la planta hospedante y del hongo micorrízico regula simultáneamente el intercambio bidireccional; por tanto, la sincronización depende de diversos factores que definen la complejidad de la relación (van del Heijden & Scheublin, 2007).
Anatomía de la colonización
La Figura 2 ilustra la colonización de los hongos micorrízicos arbusculares S. heterogama (A y C), R. manihotis (B y H) y F. mosseae (D, E, F y G). En las secciones longitudinales y transversales de raíces de P. diadelphum se observó un gran volumen de hifas delgadas, transparentes y cenocíticas, rodeando las raíces terminales (Figura 2A).
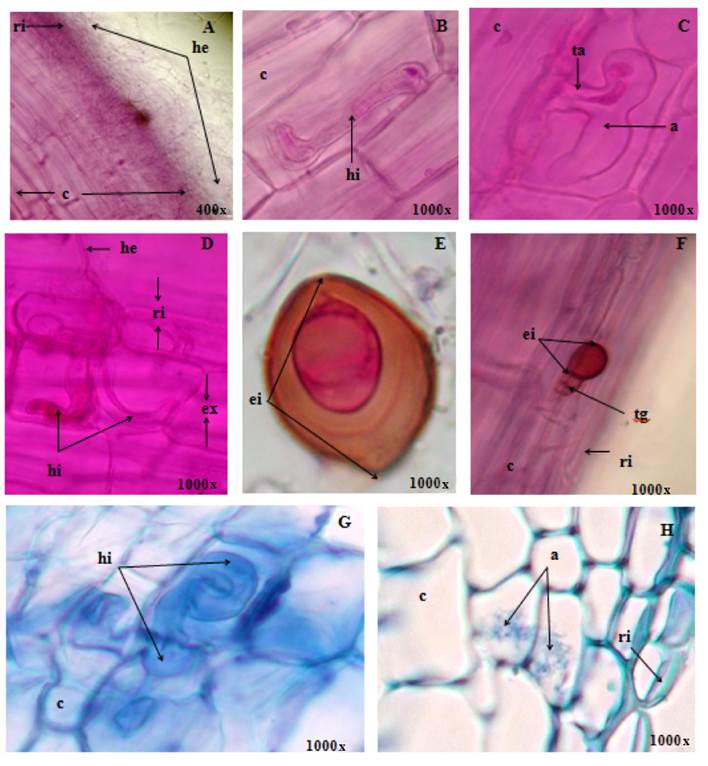
Figura 2 Colonización de los hongos micorrízicos arbusculares Scutellospora heterogama (A y C), Rhizopagus manihotis (B y H) y Funneliformis mosseae (D, E, F y G) en aclarado (A, B, C, D, E y F) y secciones transversales (G y H) de raíces de Platymiscium diadelphum; donde se pueden observar rizodermis (ri), exodermis (ex), corteza (c), hifa extrarradical (he), hifa intrarradical (hi), arbúsculo (a), espora intrarradical (ei) y tubo germinativo (tg) y tronco o base del arbúsculo (ta).
En las raíces se evidenció la presencia de esporas e hifopodios en la rizodermis, los cuales iniciaron la colonización intrarradical (Figuras 2C, 2E y 2F); posteriormente, las hifas se ramificaron extendiéndose desde la exodermis hasta la región del cilindro central (Figura 2H). Sbrana y Giovannetti (2005) y Zhu et al. (2006) afirmaron que la germinación de la espora y la formación de hifopodios representan el principal evento morfogenético específico, cuya diferenciación es mediada por señales desconocidas, lo que probablemente incluya las químicas y mecánicas sensitivas, propias del tipo de hifa.
Durante la colonización intrarradical en P. diadelphum, las hifas de los HMA presentaron patrones de desarrollo correspondientes a tipos intermedios entre el Paris (Figuras 2D y 2G) y Arum (Figura 2H). La colonización se extendió de una célula a otra y se formaron espirales para originar rulos intercelulares (Figuras 2D y 2G); estas características correspondieron al tipo Paris. El desarrollo de las hifas se extendió en sentido longitudinal intercelularmente y a nivel de la corteza. Las hifas formaron, en ciertos intervalos, ramificaciones laterales que penetraron la pared celular; se ramificaron dicotómicamente originando arbúsculos (Figura 2C); y, a pesar del ciclo de vida tan efímero, siguieron el patrón establecido para el tipo morfológico Arum. La interfase arbuscular fue similar en los tipos morfológicos Arum y Paris.
A juicio de Armstrong y Peterson (2002), las hifas enrolladas del tipo Paris interactúan con el citoesqueleto y están separadas del citoplasma de las células del hospedante por una matriz interfacial, formada en el compartimiento apoplástico, mostrando esta similaridad con la micorriza tipo Arum. Cabe destacar que la interfase de las hifas intercelulares contribuye de forma significativa en la liberación de fósforo a las células hospedantes.
Al parecer, la expresión de uno u otro desarrollo morfológico del HMA está fuertemente controlado por la planta hospedante (Matekwor et al., 2007). Urcelay, Tecco, y Chiarini (2005) afirmaron que los tipos intermedios entre Arum y Paris presentan características formadas por las mismas especies de HMA y que la formación de estructuras micorrízicas en las raíces está determinada por la interacción de las especies de plantas y hongos involucrados. El tipo intermedio de desarrollo morfológico del HMA observado en P. diadelphum coincidió con lo reportado por Smith y Smith (1997) para Fabaceae. Por su parte, Cavagnaro et al. (2003) consideraron que este es el comportamiento morfológico más común.
La asociación tipo Paris ha sido determinada con mayor frecuencia en árboles y plantas de ecosistemas semiáridos (Yamato & Iwasaki, 2002), característica presente en P. diadelphum.
Conclusiones
Los hongos micorrízicos arbusculares (HMA) Rhizopagus manihotis, Funneliformis mosseae y Scutellospora heterogama establecieron alta asociación simbiótica con las especies arbóreas Pithecellobium dulce y Platymiscium diadelphum, por lo cual se recomienda la inoculación de estos en la fase de vivero. La asociación morfológica en P. dulce y P. diadelphum inoculados con HMA fue de tipo Paris, principalmente, con presencia ocasional del tipo Arum. En P. dulce, S. heterogama tuvo la tendencia de producir mayor cantidad de arbúsculos; estructuras que permiten el intercambio bidireccional entre el hongo micorrízico arbuscular y la planta hospedante. En el caso de P. diadelphum, la colonización de los tres hongos inoculados y el desarrollo de estructuras fúngicas fueron similares.
Agradecimientos
Al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT), de la Universidad Centroccidental Lisandro Alvarado, por la subvención parcial a esta investigación a través del proyecto 020-AG-2013."
REFERENCIAS
Alexander, T., Meier, R., Toth, R., & Weber, H. (1988). Dynamics of arbuscule development and degeneration in mycorrhizas of Triticum aestivum L. and Avena sativa L. with reference to Zea mays L. New Phytologyst, 110(3), 363-370. doi: 10.1111/j.1469-8137.1988.tb00273.x [ Links ]
Ali, M., Mubassara, S., Rahman, M., Alam, S., & Khan, Z. (2008). Status of vesicular-arbuscular (VA) mycorrhizae in vegetable crop plants of Bangladesh. World Journal of Agricultural Sciences, 4(6), 704-708. Retrieved from https://www.researchgate.net/publication/242322942_Status_of_Vesicular-arbuscular_VA_Mycorrhizae_in_Vegetable_Crop_Plants_of_Bangladesh [ Links ]
Analytical Software (2003). Statistix for Windows Manual. Copyright© 1985-2003. Version 8.0. USA: Author. [ Links ]
Armstrong, L., & Peterson, L. (2002). The interfase between the arbuscular mycorrhizal fungus Glomus intraradices and root cells of Panax quinquefolius: a Paris-type mycorrhizal association. Mycologia, 94(4), 587-595. Retrieved from http://www.mycologia.org/content/94/4/587.full.pdf+html [ Links ]
Augé, R., Sylvia, D., Park, S., Buttery, B., Saxton, A., Moore, J., & Cho, K. (2004). Partitioning mycorrhizal influence on water relations of Phaseolus vulgaris into soil and plant components. Canadian Journal of Botany, 82(4), 503-514. doi: 10.1139/b04-020 [ Links ]
Bonfante, P., & Genre, A. (2012). Mechanisms underlying beneficial plant-fungus interactions in mycorrhizal symbiosis. Nature communications, 1(48). doi: 10.1038/ncomms1046 [ Links ]
Cavagnaro, T., Smith, F., Ayling, S., & Smith, S. (2003). Growth and phosporus nutrition of a Paris-type arbuscular mycorrhizal symbioses. New Phytologist, 157(1), 127-134. doi: 10.1046/j.1469-8137.2003.00654.x [ Links ]
Cuenca, G., Cáceres, A., Oirdobro, G., Hasmy, Z., & Urdaneta, C. (2007). Las micorrizas arbusculares como alternativas para una agricultura sustentable en áreas tropicales. Interciencia, 32(1), 23-29. Retrieved from http://www.redalyc.org/articulo.oa?id=33932104 [ Links ]
Garriock, B., Petersonm, R., & Ackerley, C. (1989). Early stages in colonization of Allium porrum (leek) roots by the vesicular-arbuscular mycorrhizal fungus, Glomus versiforme. New Phytologyst, 112(1), 85-92. doi: 10.1111/j.1469-8137.1989.tb00312.x [ Links ]
González, M., & Cuenca, G. (2008). Respuesta de plantas de plátano (Musa AAB cv. Hartón) a la inoculación con hongos micorrízicos arbusculares nativos e introducidos, bajo condiciones de campo. Revista de la Facultad de Agronomía (LUZ), 25, 470-495. Retrieved from http://revfacagronluz.org.ve/PDF/julio_septiembre2008/v25n3a20085.pdf [ Links ]
Habte, M., Fox, R., Aziz, T., & El-Swaify, S. (1988). Interaction of vesicular-arbuscular mycorrhizal fungi with erosion in an oxisol. Applied and Environmental Microbiology, 54(4), 945-950. Retrieved from http://aem.asm.org/content/54/4/945.long [ Links ]
Hawley, G., & Dames, J. (2004). Mycorrhizal status of indigenous tree species in a forest biome of the Eastern Cape, South Africa. South African Journal of Science, 100, 633-637. Retrieved from https://www.academia.edu/18501488/Mycorrhizal_status_of_indigenous_tree_species_in_a_forest_biome_of_the_Eastern_Cape_South_Africa [ Links ]
Ingleby, K., Wilson, J., & Munro, R. (2007). Mycorrhizas in agroforestry: spread and sharing of arbuscular mycorrhizal fungi between trees and crops complementary use of molecular and microscopic approaches. Plant Soil, 294, 125-136. doi: 10.1007/s11104-007-9239-z [ Links ]
Jansa, J., Smith, F., & Smith, S. (2008). Are there benefits of simultaneous root colonization by different arbuscular mycorrhizal fungi? New Phytologist, 177(3), 779-789. doi: 10.1111/j.1469-8137.2007.02294.x [ Links ]
Kubota, M., McGonigle, T., & Hyakumachi, M. (2005). Co-occurrence of Arum- and Paris-type morphologies of arbuscular mycorrhizae in cucumber and tomato. Mycorrhiza, 15(2), 73-77. doi: 10.1007/s00572-004-0299-0 [ Links ]
Kumar, A., Raghuwanshi, R., & Upadhyay, R. (2003). Vesicular-arbuscular mycorrhizal association in naturally revegetated coal mine spoil. Tropical Ecology, 44(2), 253-256. Retrieved from http://tropecol.com/pdf/open/PDF_44_2/44213.pdf [ Links ]
McGonigle, T., Hiller, M., Evans, D., Fairchild, G., & Swan, J. (1990). A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New Phytologyst, 115(3), 495-501. doi: 10.1111/j.1469-8137.1990.tb00476.x [ Links ]
Matekwor, E., Andoh, H., & Nonaka, M. (2007) Host-related variability in arbuscular mycorrhizal fungal structures in roots of Hedera rhombea, Rubus parvifolius y Rosa multiflora under controlled conditions. Mycorrhiza, 17(2), 93-101. doi: 10.1007/s00572-006-0080-7 [ Links ]
Ortas, I. (2009). Mycorrhizae applications in horticultural production on plant growth. Retrieved from https://cloudfront.escholarship.org/dist/prd/content/qt16t0m0hx/qt16t0m0hx.pdf?t=kro69w [ Links ]
Parra, S., Sanabria, M. E., & Maciel, N. (2011). Aspectos descriptivos de la semilla, emergencia y crecimiento de plántulas de Yacure (Pithecellobium dulce) y Roble (Platymiscium diadelphum). Revista de la Facultad de Agronomía (LUZ), 28(1), 576-585. Retrieved from http://produccioncientificaluz.org/index.php/agronomia/article/view/12528/12515 [ Links ]
Patreze, C., & Cordeiro, L. (2005). Nodulation, arbuscular mycorrhizal colonization and growth of some legumes native from Brazil. Acta Botanica Brasilica, 19(3), 527-537 doi: 10.1590/S0102-33062005000300014 [ Links ]
Phillips, J. M., & Hayman, D. S. (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal for rapid assessment of infection. Transactions of the British Mycological Society, 55(1), 158-161. doi: 10.1016/S0007-1536(70)80110-3 [ Links ]
Rey, A., Chamorro, D., & Ramírez, M. (2005). Efecto de la doble inoculación de rizobios y micorrizas sobre la producción y calidad de forraje de Leucaena leucocephala. Revista Corpoica, 6(2), 52-59. Retrieved from https://dialnet.unirioja.es/servlet/articulo?codigo=5624616 [ Links ]
Saslis-Lagoudakis, C., Chase, M., Robinson, D., Russell, S., & Klitgaard, B. (2008). Phylogenetics of neotropical Platymiscium (Leguminosae: Dalbergieae): sistematics, divergence times, and biogeopraphy inferred from nuclear ribosomal and plastid DNA sequence data. American Journal of Botany, 95(10), 1270-1286. doi: 10.3732/ajb.0800101 [ Links ]
Sbrana, C., & Giovannetti, M. (2005). Chemotropism in the arbuscular mycorrhizal fungus Funneliformis mosseae. Mycorrhiza, 15(7), 539-545. doi: 10.1007/s00572-005-0362-5 [ Links ]
Scheublin, T., & van der Heijden, M. (2006). Arbuscular mycorrhizal fungi colonize non fixing root nodules of several legume species. New Phytologist, 172(4), 732-738. doi: 10.1111/j.1469-8137.2006.01858.x [ Links ]
Schmitz, A. M., & Harrison, M. (2014). Signaling events during initiation of arbuscular mycorrhizal symbiosis. Journal of Integrative Plant Biology, 56(3), 250-261. doi: 10.1111/jipb.12155 [ Links ]
Scotti, M., & Corrêa, E. (2004). Growth and litter descomposition of woody species inoculated with rhizobia and arbuscular mycorrhizal fungi in semiarid Brazil. Annals of Forest Science, 61(1), 87-95. doi: 10.1051/forest:2003088 [ Links ]
Shi, Z., Chen, L., Feng, G., Liu, R., & Christie, P. (2006). Arbuscular mycorrhizal fungi associated with the Meliaceae on Hainan island, China. Mycorrhiza, 16(2), 81-87. doi: 10.1007/s00572-005-0017-6 [ Links ]
Smith, F., & Smith, S. (1997). Tansley review No. 96: Structural diversity in (vesicular)-arbuscular mycorrhizal symbiosis. New Phytologyst, 137(3), 373-388. doi: 10.1046/j.1469-8137.1997.00848.x [ Links ]
Sylvia, D., Alagely, A., Kent, D., & Mecklenburg, R. (1998). Mycorrhizae of landscape trees produced in raised beds and containers. Journal of Arboriculture, 24(6), 308-315. [ Links ]
Urcelay, C., Tecco, P., & Chiarini, F. (2005). Micorrizas arbusculares del tipo 'Arum' y 'Paris' y endófitos radicales septados oscuros en Miconia ioneura y Tibouchina paratropica (Melastomataceae). Boletín de la Sociedad Argentina de Botánica, 40(3-4), 151-155. Retrieved from http://www.scielo.org.ar/scielo.php?pid=S1851-23722005000200002&script=sci_abstract [ Links ]
van der Heijden, M. G., & Scheublin, T. R. (2007). Functional traits in mycorrhizal ecology: their use for predicting the impact of arbuscular mycorrhizal fungal communities on plant growth and ecosystem functioning. New Phytologist, 174(2), 224-250. doi: 10.1111/j.1469-8137.2007.02041.x [ Links ]
Yamato, M., & Iwasaki, M. (2002). Morphological types of arbuscular mycorrhizal fungi in roots of understory plants in Japanese deciduous broad leaved forest. Mycorrhiza, 12(6), 291-296. doi: 10.1007/s00572-002-0187-4 [ Links ]
Zhu, H., Riely, B., Burns, N., & Ané, J. (2006). Tracing nonlegume orthologs of legume genes required for nodulation and arbuscular mycorrhizal symbioses. Genetics, 172(4), 2491-2499. doi: 10.1534/genetics.105.051185 [ Links ]
Recibido: 14 de Febrero de 2017; Aprobado: 02 de Marzo de 2018











 texto em
texto em 


