Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.24 n.1 Chapingo Jan./Apr. 2018
https://doi.org/10.5154/r.rchscfa.2017.03.024
Artículo científico
Morfoanatomía de embriones de Acrocomia aculeata (Jacq.) Lodd. ex Mart. (Arecaceae)
1Universidad Nacional de Asunción, Facultad de Ciencias Agrarias, Ingeniería Forestal, Campus de San Lorenzo. Ruta Mariscal López km 10.5. San Lorenzo, Paraguay.
2Universidad de Córdoba, Escuela Técnica Superior de Ingenieros Agrónomos y de Montes, Campus de Rabanales. Edificio Leonardo Da Vinci. Córdoba, España.
Introducción:
El estudio morfoanatómico de las semillas y sus embriones sirve para obtener información sobre la germinación, almacenamiento y viabilidad.
Objetivo:
Describir la morfoanatomía del embrión de la palma Acrocomia aculeata (Jacq.) Lodd. ex Mart., a nivel celular.
Materiales y métodos:
Los embriones se obtuvieron de frutos maduros de A. aculeata, recolectados en individuos de una población nativa, próxima a la ciudad de San Lorenzo, Departamento Central, Paraguay. El estudio morfoanatómico se hizo mediante la fijación, deshidratación e inclusión de los embriones en bloques de resina y análisis cualitativo mediante microscopía.
Resultados y discusión:
El embrión es pequeño de color amarillo verdoso y de forma lanceolada. En el extremo proximal se localiza el cotiledón, y en el distal, el limbo o haustorio. El embrión presenta una hendidura longitudinal o ventana cotiledonar que permitirá la emergencia de la plántula (radícula y plúmula). La plúmula, bien diferenciada, está situada en ángulo con respecto al eje longitudinal del embrión; en forma opuesta se encuentra la zona meristemática, donde se desarrollará la radícula. La plúmula consta de dos primordios foliares y un ápice, con el esbozo de un tercer primordio.
Conclusión:
En general, el embrión de A. aculeata es semejante al de otras palmas del mismo grupo, en cuanto a forma e inclusión en el endosperma.
Palabras clave: Palma; ventana cotiledonar; haustorio; plúmula; germinación
Introduction:
The morpho-anatomical study of seeds and their embryos serves to obtain information on germination, storage and viability.
Objective:
To describe the morphoanatomy of the embryo of the palm species Acrocomia aculeata (Jacq.) Lodd. ex Mart., at the cellular level.
Materials and methods:
The embryos were obtained from mature fruits of A. aculeata, collected in individuals of a native population near the city of San Lorenzo, Central Department, Paraguay. The morpho-anatomical study was done by means of the fixation, dehydration and inclusion of the embryos in resin blocks and qualitative analysis by means of microscopy.
Results and discussion:
The embryo is small, greenish yellow and lanceolate. The cotyledon is located at the proximal end, and the limbus or haustorium in the distal. The embryo has a longitudinal slit or cotyledon window that allows the emergence of the seedling (radicle and plumule). The well-differentiated plumule is positioned at an angle with respect to the longitudinal axis of the embryo, opposite to which is the meristematic zone, where the radicle will develop. The plumule consists of two leaf primordia and one apex, with the outline of a third primordium.
Conclusion:
In general, the A. aculeata embryo is similar to that of other palms of the same group, in terms of shape and inclusion in the endosperm.
Keywords: Palm; cotyledon window; haustorium; plumule; germination
Introducción
Acrocomia aculeata (Jacq.) Lodd. ex Mart., conocida en Paraguay como mbokaja, pertenece a la familia Arecaceae y es nativa de los bosques tropicales (Bandeira, 2008). Esta especie se distribuye ampliamente a lo largo de América tropical y subtropical, desde el sur de México y las Antillas, hasta la región sur, incluyendo Brasil, Argentina y Paraguay (Sorol, Haupenthal, & Reckziegel, 2012). En Paraguay, A. aculeata es abundante de forma natural en la Región Oriental y en algunas zonas del Chaco.
La especie A. aculeata es una palma heliófila que habita en áreas abiertas con irradiación solar alta, se adapta a suelos arenosos (60 a 75 % arena) con bajo nivel de agua, aunque prefiere los profundos y bien drenados; también puede encontrarse en suelos derivados de areniscas y basaltos. La palma no crece en suelos bajos y de naturaleza hidromórfica que sean pesados y mal drenados (Lorenzi, 2006).
Acrocomia aculeata posee un estípite que puede oscilar entre 10 y 15 m de altura y entre 20 y 30 cm de diámetro. Dicho tallo presenta una cobertura de espinas de color oscuro, de cerca de 10 cm de largo (Lorenzi, 2008). Las hojas son verdes, pinnadas y alternas, de 4 a 5 m de longitud y se encuentran ordenadas en diferentes planos, dando a la copa un aspecto de corona de plumas. Las hojas tienen aproximadamente 130 foliolos de 30 a 60 cm de largo y 1 a 2 cm de ancho de color verde lustroso en cada lado. El envés es verde claro y presenta espinas en la región central (Lorenzi, 2006).
Las inflorescencias aparecen entre las hojas; tienen forma de espádice, miden de 80 a 130 cm de longitud, son decurrentes y están recubiertas por una bráctea. Cuando la inflorescencia alcanza la madurez se vuelve túrgida, con ubicación perpendicular al tallo. Henderson, Galeano, y Bernal (1995) indican que las flores son unisexuales, apareciendo las flores femeninas en la base de la inflorescencia y las masculinas en la parte superior.
Respecto a la fructificación, Lorenzi (2008) refiere que ocurre todo el año y que los frutos maduran entre septiembre a junio. El fruto es una drupa globosa con diámetro entre 2.5 a 5 cm, constituida por un pericarpio quebradizo en la madurez y un mesocarpio fibroso, mucilaginoso, azucarado y rico en glicéridos de coloración amarillo-naranja. El endocarpio está fuertemente adherido al mesocarpio; posee una estructura ósea, es de coloración oscura, tiene un espesor de aproximadamente 3 mm y contiene la almendra oleaginosa comestible (Bandeira, 2008).
Las semillas de A. aculeata son ortodoxas, de germinación lenta y poseen latencia; están conformadas por un endosperma donde el embrión se encuentra inmerso, por lo general, en un extremo. El embrión, cónico y pequeño, es rico en material nutritivo y está envuelto por una masa de tejido córneo o albumen. El conocimiento de la morfología de la semilla es esencial para el análisis del ciclo vegetativo y el estudio de regeneración de la especie. A partir del estudio morfoanatómico de las semillas y sus embriones también se puede obtener información sobre la germinación, almacenamiento y viabilidad (Moura et al., 2008).
De los frutos se obtiene aceite y se produce biodiesel, tanto de la drupa como de la nuez interna. El aceite es consumido por las poblaciones locales, debido al valor alimenticio alto. En Paraguay se están implementando cultivos intensivos de A. aculeata, dirigidos a cubrir la demanda de aceite obtenido de sus frutos (Instituto Interamericano de Cooperación para la Agricultura [IICA], 2007). De acuerdo con IICA (2007), la producción de aceite alcanza hasta 4 000 L·ha-1, con rendimiento mayor que otros cultivos aceiteros como el aguacate (Persea americana Mill.), ricino (Ricinus communis L.), colza (Brassica napus L.), maní (Arachis hipogeae L.), girasol (Helianthus annuus L.), tung (Aleurites fordii Hemsl.) y soja (Glicine max L.). Se estima que en Paraguay existen alrededor de 6 millones de plantas de mbokaja, lo que sugeriría una producción anual de 170 000 t de frutos, aproximadamente (Souto, 2008). Según Silva (2006), A. aculeata puede convertirse en uno de los aceites de palma más importante comercialmente, dada la variedad de productos derivados de los frutos (20 a 30 % de aceite, 5 % de harina comestible, 35 % de forraje y 35 % de combustible de alto valor calorífico).
En ese sentido, este trabajo tiene como objetivo describir la morfoanatomía del embrión de A. aculeata, a nivel celular.
Materiales y métodos
Material vegetal
Los embriones se obtuvieron de frutos maduros de A. aculeata, cosechados entre los meses de febrero y marzo del 2014. Los frutos se recolectaron en 10 individuos de una población nativa, próxima a la ciudad de San Lorenzo, Departamento Central (25° 21' 54.80" S y 57° 30' 8.77" O) en Paraguay. De cada planta madre se colectaron 20 frutos por racimo haciendo un total de 100 frutos por individuo.
Las semillas se mezclaron y se secaron a temperatura ambiente durante 20 días, facilitando la eliminación del pericarpio. Una vez eliminado, se procedió a la ruptura del endocarpio con la ayuda de una prensa manual y se obtuvieron las almendras (semillas) que contienen los embriones cigóticos. Las almendras con síntomas de infecciones fúngicas, bacterianas o con ataques de insectos se eliminaron.
Estudio morfoanatómico
Fijación, deshidratación e inclusión de los embriones en bloques de resina
Los embriones se extrajeron cuidadosamente de las semillas con un bisturí, para el proceso de inclusión en bloques de resina. Previo a este proceso, las muestras fueron fijadas durante 24 h con una solución de Karnovsky (glutaraldehído al 5 % y paraformaldehído al 4 % en cacodilato 0.2 M) y conservadas con cacodilato 0.025 M. Para ello, las muestras se depositaron en tubos de microcentrífuga de 2 mL conteniendo 1 mL de solución de Karnovsky. Posteriormente, el soporte con los tubos abiertos se colocó en una campana de vacío durante periodos de 1 min, para facilitar la penetración del fijador. Finalmente, los tubos se enfriaron a 4 °C durante 4 h y se conservaron a 4 °C en condiciones de oscuridad (Pérez‐de‐Luque et al., 2006).
Las muestras se deshidrataron mediante una serie de etanol/agua: 50, 80 y 95 %, durante 12 h; posteriormente, se conservaron a 4 °C en condiciones de oscuridad. Los moldes de historresina se rellenaron con solución de infiltración (dimetil sulfóxido), endurecedor (derivado de ácido barbitúrico) y parafina; las muestras se colocaron en la posición de interés. Los bloques de resina se extrajeron de los moldes y se dejaron secar a temperatura ambiente. En cada bloque se colocaron dos muestras, una en posición transversal y otra en posición longitudinal, con el objetivo de tener cortes de secciones de ambos tipos.
Una vez extraídos los bloques de los moldes, se procedió al desbastado (trimming) con una cuchilla. Posteriormente, se obtuvieron cortes con un grosor de 2 µm en la sección de interés; estos se realizaron con un micrótomo LEICA RM2245 (Leica Mycrosistems GmbH, Wetzlar, Germany) con cuchillas de carbono-tungsteno Spikker Specials.
Microscopía
Los portaobjetos se introdujeron en una solución TBO (Toluidine Blue‐O) al 0.1 %, durante 12 h. Las secciones de 2 µm de espesor se depositaron sobre portaobjetos de vidrio que se extendieron sobre un portaobjetos con recubrimiento de polisina (Thermo Scientific, Gerhard Menzel GmbH, Braunschweig, Germany) para una mejor fijación del material vegetal a la superficie. Cada una de las secciones se rehidrataron con agua desionizada.
Las secciones se desparafinaron con xileno (Pérez‐de‐Luque et al., 2006) y se tiñeron con una solución de TBO (Cahill, Benett, & McComb, 1992) al 0.05 % en tampón citrato a pH 5 (Ruzin, 1999). Las muestras, secadas completamente, se colocaron sobre portaobjetos con resina sintética para montaje rápido (Entellan®, Merck KGaA, Darmstadt, Germany).
Las secciones se analizaron cualitativamente a través de un microscopio óptico NIKON Eclipse 50i (Nikon Instruments Inc., Melville‐NY, USA), con objetivos intercambiables (10x, 20x, 40x, 100x) que proporcionaron hasta 1 000 aumentos. Se obtuvieron imágenes de 2 560 x 1 920 píxeles, tomadas con lentes de la serie Plan Fluor de Nikon Instruments Inc., a través de un dispositivo óptico digital Nikon DS‐Fi1 (Nikon Instruments Inc., Melville‐NY, USA) acoplado al microscopio y conectado a un ordenador mediante la unidad de control Nikon DS‐U2 (Nikon Instruments Inc., Melville‐NY, USA).
Resultados y discusión
Caracterización morfoanatómica del embrión de A. aculeata
El embrión de A. aculeata es pequeño de color amarillo verdoso con forma lanceolada. Presenta una región proximal, situada de forma periférica respecto a la semilla, que corresponde al peciolo del cotiledón; y una región distal, en forma de protuberancia, en el limbo o haustorio cotiledonar. La estructura del embrión tiene el patrón general observado en otras especies de palmas, con una protuberancia y las invaginaciones pronunciadas del haustorio. La Figura 1 muestra el corte longitudinal del embrión de A. aculeata, en el cual se distinguen tres regiones: limbo cotiledonar, constricción y peciolo cotiledonar.

Figura 1 Corte longitudinal del embrión de Acrocomia aculeata. Se observan el limbo cotiledonar (lc), la zona de constricción (c) y el peciolo cotiledonar (pc).
El peciolo cotiledonar tiene longitud promedio de 4.5 mm y diámetro de 1.5 mm; está formado por una protodermis externa, un meristema fundamental y haces procambiales. El eje embrionario se inserta en una cavidad en el tercio proximal del peciolo cotiledonar y está alineado de forma oblicua respecto al resto del embrión. En la Figura 2 se observan los tejidos meristemático primario, meristemo fundamental y procambium.

Figura 2 Tejidos meristemático primario (MP), meristemo fundamental (MF) y procambium (Prc) en el corte longitudinal del embrión de Acrocomia aculeata.
En los cortes transversales y longitudinales de los embriones se observó la plúmula bien diferenciada, situada en ángulo con respecto al eje longitudinal del embrión. En forma opuesta se encuentra la zona meristemática, donde se desarrollará la radícula. La plúmula consta de dos primordios foliares y un ápice, con el esbozo de un tercer primordio (Figura 3). Todas estas estructuras están encerradas por el coleóptilo.
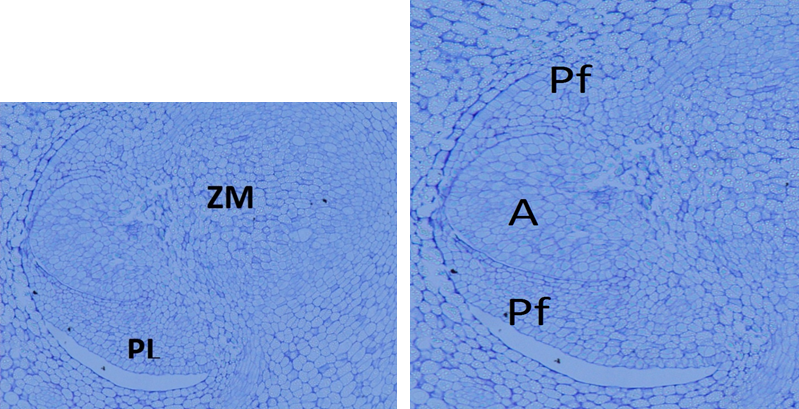
Figura 3 Corte longitudinal de un embrión de Acrocomia aculeata, donde se observan la plúmula (PL) y zona meristemática radical (ZM). Dentro de la plúmula se encuentran el ápice (A) y los primordios foliares (Pf).
Externamente, el embrión presenta una hendidura longitudinal o ventana cotiledonar, al nivel de la plántula; la capa de células protodérmicas que recubre dicha ventana continúa con la del coleóptilo. En la Figura 4 se observa el corte transversal de un embrión, mostrando la ventana cotiledonar que permitirá la emergencia de la plántula (radícula y plúmula).

Figura 4 Corte transversal de embrión de Acrocomia aculeata, al nivel del peciolo cotiledonario, mostrando la ventana cotiledonar (vc) que permitirá la emergencia de la plántula (PL).
Según Cabello (2008), la fase de plántula inicia con la reactivación del embrión y su emergencia de la semilla, mediante la emisión de la radícula y de la plúmula. Cuando la germinación se produce, el embrión se elonga desprendiendo el opérculo, del cual emerge al exterior la vaina cotiledonaria o lígula, a través del poro germinativo. Posteriormente, la lígula se engloba, se hiende y surgen la radícula y la plúmula. A partir del limbo cotiledonar del embrión se desarrolla el haustorio, que ocupará la cavidad interna de la semilla. El haustorio presenta una superficie invaginada, con una epidermis formada por células rectangulares en sentido radial, con citoplasma muy denso y núcleos prominentes. La capa subepidérmica, monoestratificada, presenta células de forma y tamaño regulares. Hacia el interior, las células parenquimáticas son irregulares y aumentan gradualmente de tamaño, dejando grandes espacios intercelulares.
En las palmas, según Tomlinson (1990), el embrión es siempre diminuto en relación con el tamaño total de la semilla y del endosperma. El embrión de A. aculeata no es la excepción y las observaciones realizadas en este trabajo confirman las afirmaciones de Cabello (2008), quien indica que el embrión de las palmas está desarrollado incompletamente. Esto concuerda con lo afirmado por Nikolaeva (1969), quien señala que los individuos del grupo Arecaceae presentan latencia endógena morfológica, ya que poseen un embrión que no ha alcanzado su desarrollo morfológico en el tiempo de maduración de la semilla.
En general, el embrión de A. aculeata es semejante al de otras palmas del mismo grupo, en cuanto a forma e inclusión en el endosperma. La disposición del endosperma de Cocos nucifera L. y Jubebaea chilensis (Molina) es similar, al igual que la ubicación del embrión bajo el poro germinativo (Heathcock & Chapman, 1983; Sugimura & Murakami, 1990) en su forma cilíndrica. La mayor parte del tejido del embrión corresponde al cotiledón con la presencia de una pequeña constricción que lo divide en dos partes. Lo mismo ocurre con el embrión de Elaeis guineensis fo. dura Becc., que también es cilíndrico-cónico (Quero, 1992). El embrión de Acrocomia mexicana Karwinky ex Mart. es opuesto a uno de los polos, en tanto que Bactris mexicana Martius, otra especie del grupo de las Arecaceae, puede ser basal o dorsal (Quero, 1992).
Los embriones de A. aculeata constan de protoderma, plúmula y hebras procambiales bien definidas (Moura et al., 2008). El protoderma presenta invaginaciones y, por debajo, células del meristema fundamental. Los granos de almidón se acumulan en las células del meristema fundamental bajo intensa división (Moura et al., 2008), especialmente en las que tienen menos citoplasma denso. En el caso de A. aculeata, una ventana cotiledonar aparece ubicada en sentido longitudinal del embrión, la cual simula un ojal en corte tangencial, similar a la de E. guineensis (Vallade, 1966a). Acrocomia aculeata, al igual que E. guineensis fo. dura y J. chilensis, presenta la plúmula del embrión en posición lateral y se encuentra bien diferenciada en dos hojas y un ápice, que porta sobre sus flancos el esbozo de la tercera hoja. Esta plúmula se encuentra encerrada completamente en un repliegue del cotiledón, cuyos labios son completamente visibles al nivel de la abertura cotiledonar. La raíz no se encuentra individualizada; en el parénquima fundamental, existe una región de aptitud radicular que participará en la formación de la raíz, al momento de la germinación (Vallade, 1966a).
La epidermis de las estructuras anatómicas de A. aculeata presenta una capa compuesta de células cúbicas alargadas con paredes delgadas, presentando células meristemáticas de apariencia globosa en la región externa del mesófilo, intercaladas con haces de pilas alargadas radialmente. La región media del mesófilo se compone predominantemente de células parenquimatosas (Reis, Mercadante-Simões, & Ribeiro, 2012).
Algunas células de la parte interior de los embriones de A. aculeata son más grandes que las células de la periferia con citoplasma denso, por lo general, las divisiones celulares se producen en la región distal tanto en la periferia como en el interior. Esas divisiones celulares se producen principalmente en el meristemo fundamental, cerca de las hebras procambiales. En estos tejidos se concentran grupos de células que presentan pared con engrosamiento aparente y aspecto mucilaginoso. El engrosamiento aparente puede ser el resultado de la pared celular desintegrada, almacenamiento de pectina y formación de mucílago (Moura et al., 2008).
Conclusiones
En general, el embrión de Acrocomia aculeata es semejante al de otras palmas del mismo grupo, en cuanto a forma e inclusión en el endosperma. Los estudios morfoanatómicos pueden ayudar a mejorar la descripción de procesos que conducen a que un tejido readquiera su potencialidad embriogénica, lo cual puede ser aplicado a la embriogénesis de A. aculeata. El estudio morfoanatómico podría servir también para encarar los ensayos de germinación desde una nueva perspectiva, con el fin de encontrar tratamientos que superen la latencia en las semillas de esta palma.
Agradecimientos
Al Programa de Vinculación de Científicos y Tecnólogos del Consejo Nacional de Ciencia y Tecnología (CONACYT) de Paraguay, por la beca otorgada para llevar a cabo esta investigación. Se agradece también la colaboración del Instituto de Investigación y Formación Agraria y Pesquera (IFAPA) de la Consejería de Agricultura, Pesca y Desarrollo Rural de la Junta de Andalucía, España.
REFERENCIAS
Bandeira, F. S. (2008). Cultivo in vitro e embriogenese somática de embriöes zigóticos de macuaba (Acrocomia aculeata (Jacq.) Loddiges). Tese de doutorado, Universidade Federal de Viçosa, Minas Gerais, Brasil. Retrieved from http://locus.ufv.br/bitstream/handle/123456789/518/texto%20completo.pdf?sequence=1&isAllowed=y [ Links ]
Cabello, A. (2008). Técnicas de propagación de palma chilena (Jubaea chilensis (Mol.) Baillon). Tesis doctoral, Universidad de Córdoba, Córdoba, España. [ Links ]
Cahill, D. M., Benett, I. J., & McComb, A. J. (1992). Resistance of micropropagated Eucalyptus marginata to Phytophthora cinnamomi. Plant Disease Journal, 76, 630-632. Retrieved from https://www.apsnet.org/publications/PlantDisease/BackIssues/Documents/1992Articles/PlantDisease76n06_630.PDF [ Links ]
Henderson, A., Galeano, G., & Bernal, R. (1995). Field guide to the palms of the Americas. New Jersey, USA: Princeton University Press. [ Links ]
Heathcock, J. F., & Chapman, J. A. (1983). The structure of fresh and desiccated coconut. Food Microstructure, 2, 81-90. Retrieved from https://digitalcommons.usu.edu/cgi/viewcontent.cgi?article=1052&context=foodmicrostructure [ Links ]
Instituto Interamericano de Cooperación para la Agricultura (IICA). (2007). El estado del arte de los biocombustibles en el Paraguay. Asunción-Paraguay: Autor. Retrieved from http://repiica.iica.int/docs/B0389e/B0389e.pdf [ Links ]
Lorenzi, G. M. C. (2006). Acrocomia aculeata (Jacq.) Lodd. ex Mart.-Arecaceae: bases para o extrativismo sustentável. Tese de doutorado, Universidade Federal do Paraná, Curitiba, Brasil. Retrieved from http://dspace.c3sl.ufpr.br/dspace/bitstream/1884/5279/1/Acrocomia%20aculeata.pdf [ Links ]
Lorenzi, H. (2008). Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas do Brasil (5ª ed.). Nova Odessa, Brasil: Instituto Plantarum. [ Links ]
Moura, M. F., Ventrella, M. S, Motoike, S. Y., Sá, A. Q. J, Carvalho, M., & Manfio, C. E. (2008). Histological study of somatic embryogenesis induction on zygotic embryos of macaw palm (Acrocomia aculeata(Jacq.) Lodd. ex Martius). Plant Cell, Tissue and Organ Culture, 95(2), 175-184. doi: 10.1007/s11240-008-9430-9 [ Links ]
Nikolaeva, M. G. (1969). Physiology of deep dormancy in seeds. Washington, D. C. USA: Kohn and Wills. [ Links ]
Pérez-de-Luque, A., Lozano, M. D., Maldonado, A. M., Jorrín, J. V., Dita, M. A., Die, J., …Rubiales, D. (2006). Medicago truncatula as a model for studying interactions between root parasitic plants and legumes. Retrieved from https://www.researchgate.net/publication/237117955_Medicago_truncatula_AS_A_MODEL_FOR_STUDYING_INTERACTIONS_BETWEEN_ROOT_PARASITIC_PLANTS_AND_LEGUMES [ Links ]
Quero, H. (1992). Las palmas silvestres de la península de Yucatán. México: Instituto de Biología UNAM. [ Links ]
Reis, S. M., Mercadante-Simões, M. O., & Ribeiro, L. M. (2012). Pericarp development in the macaw palm Acrocomia aculeata (Arecaceae). Rodriguésia 63(3), 541-549. Retrieved from http://www.scielo.br/pdf/rod/v63n3/a05v63n3.pdf [ Links ]
Ruzin, S. E. (1999). Plant microtechnique and microscopy. USA: Oxford University Press. [ Links ]
Silva, V. (2006). Morfologia e avaliacao do crecimiento inicial de plántulas de Bactris gasipaes Kunth. (Areacaceae) em substratos. Revista Brasileira de Fruticultura, 28(3), 477-480. [ Links ]
Sorol, C. B., Haupenthal, D. I., Reckziegel, M. E. (2012). Caracterización de la germinación, la plántula y el crecimiento de Acrocomia aculeata (Jacq.) Lodd ex. Mart. Rojasiana, 11(1-2), 21-30. Retrieved from http://www.qui.una.py/files/publicaciones/rojasiana/Vol%2011%20(1-2)%202012/3_Caracterizacion%20de%20la%20germinaci%C3%B3n_la%20plantula.pdf [ Links ]
Souto, G. (2008). Paraguay explora su potencial en biocombustible. Comuniica (IICA) , 4(2), 44-52. Retrieved from http://webiica.iica.ac.cr/bibliotecas/repiica/B0719E/B0719E.pdf [ Links ]
Sugimura, Y., & Murakami, T. (1990). Structure and function of the haustorium in germinating coconut palm seed.Japan Agricultural Research Quarterly, 24, 1-14. Retrieved from http://www.jircas.affrc.go.jp/english/publication/jarq/24-1/24-1-001-014.pdf [ Links ]
Tomlinson, P. B. (1990). The structural biology of palms. Oxford: Claredon Press. [ Links ]
Vallade, J. (1966a). Aspect morphologique et cytologique de l’embryon quiescent d’ Elaeis guineensis Jacq. Comptes Rendus de l'Académie des Sciences. Série D: Sciences Naturelles, 262(8), 856-859. Retrieved from http://horizon.documentation.ird.fr/exl-doc/pleins_textes/pleins_textes_5/b_fdi_08-09/10545.pdf [ Links ]
Recibido: 23 de Marzo de 2017; Aprobado: 22 de Noviembre de 2017











 text in
text in 


