Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.24 no.1 Chapingo ene./abr. 2018
https://doi.org/10.5154/r.rchscfa.2017.07.043
Nota científica
Crecimiento de Leucaena leucocephala (Lam.) de Wit biofertilizada con hongos micorrízicos arbusculares en vivero
1Universidad Autónoma de Chiapas, Facultad de Ciencias Agrícolas, Campus IV. Entronque Carretera Costera y Estación Huehuetán km 1. C. P. 30660. Huehuetán, Chiapas, México.
Introducción:
Leucaena leucocephala (Lam.) de Wit es nativa de América tropical. El sistema radical de la especie se asocia a microorganismos que mejoran la nutrición y el crecimiento.
Objetivo:
Evaluar el efecto de recolectas de hongos micorrízicos arbusculares (HMA) sobre el contenido de fósforo (P) y crecimiento de L. leucocephala en vivero.
Materiales y métodos:
Las semillas se sembraron y se aplicaron seis tratamientos: Rhizophagus intraradices (Schenck & Sm.) Walker & Schüßler (1), las recolectas “Caracoles” (2), “Rosario Izapa” (3), “Té limón” (4) y “San Rafael” (5), fertilización 15N-15P-15K (6) y un testigo. Las variables morfológicas y fisiológicas, colonización radical y contenido de P se registraron a los 120 días. Los datos se sometieron a un análisis de varianza y comparación de medias (Tukey, P ≤ 0.05).
Resultados y discusión:
Los HMA mejoraron las características de la planta en comparación con el testigo y la fertilización. Rhizophagus intraradices causó los valores más altos de crecimiento en la parte aérea, colonización micorrízica y contenido de P, y el menor crecimiento en el sistema radical. Los aislamientos “Caracoles” y “Rosario Izapa” promovieron altura, biomasa de la raíz y contenido de P más altos que “Té limón” y “San Rafael”.
Conclusión:
Los HMA permiten disminuir la fertilización química sin detrimento del crecimiento de L. leucocephala.
Palabras clave: Micorrizas arbusculares; biofertilización; fósforo; Rhizophagus intraradices
Introduction:
Leucaena leucocephala (Lam.) de Wit is native to tropical America. The root system of the species is associated with microorganisms that improve nutrition and growth.
Objective:
To evaluate the effect of arbuscular mycorrhizal fungi (AMF) collections on the phosphorus (P) content and growth of L. leucocephala in the nursery.
Materials and methods:
The seeds were sown and six treatments were applied: Rhizophagus intraradices (Schenck & Sm.) Walker & Schüßler (1), the collections “Caracoles” (2), “Rosario Izapa” (3), “Té limón” (4) and “San Rafael” (5), fertilization 15N-15P-15K (6) and a control. Morphological and physiological variables, root colonization and P content were recorded at 120 days. Data were subjected to an analysis of variance and Tukey’s range test (P ≤ 0.05).
Results and discussion:
AMF improved plant characteristics in comparison with the control and fertilization. Rhizophagus intraradices caused the highest growth values in the aerial part, mycorrhizal colonization and P content, and the lowest growth in the root system. The "Caracoles" and "Rosario Izapa" isolates promoted height, root biomass and P content higher than “Té limón” and “San Rafael”.
Conclusion:
AMF allow decreasing chemical fertilization without detriment to the growth of L. leucocephala.
Keywords: Arbuscular mycorrhizae; biofertilization; phosphorus; Rhizophagus intraradices
Introducción
Leucaena leucocephala (Lam.) de Wit se distribuye en el trópico y subtrópico (Yeung, Wong, & Wong, 2002) y tiene amplia diversidad biológica en México (Grether, Martínez-Bernal, Luckow, & Zárate, 2006). La planta es de crecimiento rápido (Tewari, Katiyar, Ram, & Misra, 2004); se utiliza en la reforestación de zonas erosionadas y con otros fines en diversos sistemas de producción (Wencomo & Lugo, 2013).
La especie L. leucocephala se adapta fácilmente a diferentes ambientes, debido probablemente a la capacidad del sistema radical para establecer simbiosis con diversos microorganismos, si se toma en cuenta que la vegetación puede vincularse con el desarrollo de la comunidad subterránea (Sanon et al., 2009). Entre ellos se encuentran los hongos micorrízicos arbusculares (HMA), los cuales influyen en el crecimiento de las plantas a través del transporte de nutrientes, especialmente fósforo; además, promueven la absorción de elementos menores (Smith, Anderson, & Smith, 2015), activan mecanismos de defensa contra patógenos (Jaizme-Vega & Rodríguez-Romero, 2008) y mejoran la tolerancia a condiciones ambientales adversas (Doubková, Vlasáková, & Sudová, 2013). En todos los ecosistemas terrestres pueden encontrarse HMA; su universalidad implica vasta diversidad taxonómica (Jaizme-Vega, 2009). Las poblaciones nativas de HMA han favorecido la sostenibilidad de los sistemas agrícolas, mientras que otros HMA introducidos pueden no adaptarse al ambiente y presentar especificidad ecológica (Serralde & Ramírez 2004) o preferencia por el hospedero (Daniell, Husband, Fitter, & Young, 2001). En la rizósfera, además de los microorganismos, hay abundantes exudados de las raíces que tienen efecto selectivo sobre la microbiota del suelo (Offre et al., 2007).
El objetivo del presente trabajo fue evaluar el efecto de diferentes recolectas de hongos micorrízicos arbusculares del sureste de México en el crecimiento y contenido de fósforo (P) de L. leucocephala.
Materiales y métodos
La investigación se desarrolló en condiciones de vivero durante la primavera de 2015 en el Campo Experimental de la Facultad de Ciencias Agrícolas C-IV en Huehuetán, Chiapas. El vivero se localiza en las coordenadas 15° 00´ LN y 94° 30´ LO a 44 m de altitud. El tipo climático, según García (1973), es Am(w’’)ig. La precipitación media anual es de 2 326 mm y la temperatura media anual de 25.4 °C.
La semilla de L. leucocephala cv. Perú se cosechó de una plantación de 10 años de establecimiento en la colonia Miguel Alemán, municipio de Pijijiapan, Chiapas (15° 19’ LN - 92° 33’ LO). Cuatro aislamientos de HMA se recolectaron en tres regiones tropicales de México. Dos de ellos, “Caracoles” (Tenampulco, Puebla: 20° 08´ 30´´ LN y 97° 30´ 00´´ LO a 350 m de altitud, 2 100 mm de precipitación y suelos Regosoles) y “San Rafael” (San Rafael, Veracruz: 20° 08´ 20´´ LN y 97° 02´ 57´´ LO a 20 m, 1 600 mm de precipitación y suelos Cambisoles) se obtuvieron de suelo cultivado con Vanilla planifolia Andrews. Los otros dos, “Rosario Izapa”, asociado a Theobroma cacao L., y “Té limón” a Coffea arabica L. se obtuvieron en la región del Soconusco, Chiapas (Tuxtla Chico, Chiapas: 14° 30´ LN y 92° 00´ LO a 425 m, 4 252 mm de precipitación y suelos Luvisoles). Estos aislamientos se evaluaron debido a que se ha observado su capacidad inicial para inducir mayor crecimiento de la planta hospedante durante la etapa de multiplicación. Además de los anteriores, Rhizophagus intraradices (Schenck & Sm.) Walker & Schüßler se evaluó, como hongo de referencia, a una concentración de 40 esporas·g-1 de suelo y 95 % de colonización de la raíz en la planta hospedante Brachiaria brizantha (Hochst. ex. A. Rich.) Stapf (datos contenidos en el producto Micorriza INIFAP®). Este HMA se ha utilizado en el programa de inducción de los biofertilizantes en diversos cultivos anuales y perennes en México (Aguirre-Medina, 2006).
En las raíces recolectadas se verificó la presencia de HMA mediante tinción y aclareo (Phillips & Hayman, 1970). En cada muestra de suelo, las esporas se separaron en grupos, mediante tamizado húmedo y decantación, con el fin de multiplicar los hongos similares (Gerdemann & Nicolson, 1963), de acuerdo con el color, forma y tamaño observados en un estereomicroscopio. Las esporas con características similares se propagaron durante 90 días en un sustrato de arena de río esterilizado (en contenedores de 1 L), utilizando sorgo como planta hospedante. En la cosecha se lograron al menos 100 esporas·g-1 de suelo con 93 % de colonización radical.
El sustrato utilizado en la investigación se obtuvo en los terrenos del mismo campo experimental, a una profundidad de 0 a 30 cm en suelos del grupo Fluvisol eútrico (Instituto Nacional de Estadística, Geografía e Informática [INEGI], 2005). El sustrato se mezcló con arena de río lavada previamente y tamizada en proporción 1:1 (v/v). El sustrato final tuvo los siguientes componentes y características: arena (82.7 %), limo (14.3 %), arcilla (4.16 %), textura arena migajonosa, materia orgánica (2.8 %), pH 5.5, N (0.12 %), P (5.0 ppm), capacidad de intercambio catiónico (CIC: 4.12 mg·100 g-1) y conductividad eléctrica (CE: 0.12 dS·m-1). Utilizando este sustrato, se llenaron bolsas con capacidad de 5 kg, se perforaron en la parte inferior para favorecer el drenaje y se colocaron sobre bancales de fierro. El riego se realizó cada tercer día.
Los HMA fueron adheridos a las semillas de L. leucocephala con carboximetilcelulosa; el inóculo representó 6 % del peso de la semilla. Estas se sembraron en macetas, a 3 cm de profundidad, de acuerdo con los siguientes tratamientos: R. intraradices, “Caracoles”, “Rosario Izapa”, “Té limón”, “San Rafael”, fertilización con 15N-15P-15K y un testigo. Los tratamientos se distribuyeron en un diseño completamente al azar con cuatro repeticiones.
Las variables morfológicas (altura de planta, diámetro del tallo, número de hojas y colonización radical) y fisiológicas (biomasa seca de la raíz, tallo y hoja) se registraron a los 120 días después de la siembra (dds). La altura se obtuvo con cinta métrica, a partir de la corona radical hasta la yema apical, y el diámetro del tallo se midió con vernier digital (AutoTECTM, China), a 5 cm de distancia de la corona radical hacia el ápice. La colonización micorrízica (%) se determinó en 100 segmentos de raíz, de cada tratamiento, con longitud de 1.5 a 1.6 cm; se prepararon mediante la técnica de tinción y clareo de Phillips y Hayman (1970) y se observaron al microscopio con objetivo de inmersión (100x). Por otra parte, la materia seca de la parte aérea y radical se determinó en estufa de aire forzado a temperaturas de 75 a 80 °C por 72 h; posteriormente, se pesó cada componente (Ohaus, Adventurer Pro, USA). Con estas variables se determinó el índice de calidad propuesto por Dickson, Leaf, y Hosner (1960). Finalmente, el contenido de P se cuantificó en un espectrofotómetro (Thermo Fisher Scientific Modelo 400 ¼, USA).
Los efectos entre tratamientos se determinaron a través de un análisis de varianza para cada variable con el procedimiento PROC ANOVA. Posteriormente se hizo una comparación de medias (Tukey, P ≤ 0.05) utilizando el programa computacional SAS versión 8.1 (Statistical Analysis System [SAS], 1999-2000).
Resultados y discusión
El Cuadro 1 muestra las variables de crecimiento de las plantas de L. leucocephala con los tratamientos aplicados. La altura de la planta fue estadísticamente diferente entre estos (P ≤ 0.05); la máxima fue de 128 cm con la recolecta “Caracoles” y los incrementos fueron de 15 % (19 cm) con relación al testigo y 8.6 % (16 cm) en comparación con el tratamiento fertilizado. Los aislamientos “Caracoles”, “Rosario Izapa” y “Té limón” fueron estadísticamente similares con R. intraradices, con un promedio de altura de 124 ± 1.9 cm. En otras especies perennes como T. cacao, Aguirre-Medina, Mendoza-López, Cadena-Iñiguez, y Avendaño-Arrazate (2007) reportan 9 cm más de altura en las plantas inoculadas con R. intraradices en comparación con el testigo a los 120 dds.
Cuadro 1 Componentes morfológicos y fisiológicos de Leucaena leucocephala inoculada con diferentes hongos micorrízicos arbusculares en vivero. Resultados a los 120 días después de la siembra.
| Tratamiento | Altura (cm) | Diámetro (mm) | Número de hojas | Peso seco (g·planta-1) | ICD | ||
|---|---|---|---|---|---|---|---|
| Hojas | Tallo | Raíz | |||||
| Rhizophagus intraradices | 123 ± 1.3 ab | 9.1 ± 0.0 a | 37 ± 0.8 a | 16.08 ± 0.5 a | 15.76 ± 0.5 a | 10.49 ± 0.5 c | 2.27 |
| Caracoles | 128 ± 2.7 a | 7.3 ± 0.4 b | 24 ± 0.9 b | 10.19 ± 0.3 b | 12.42 ± 0.6 b | 13.95 ± 0.7 ab | 1.80 |
| Rosario Izapa | 126 ± 3.2 ab | 7.3 ± 0.2 b | 21 ± 0.8 bc | 14.17 ± 0.4 a | 11.32 ± 0.6 bc | 14.64 ± 0.6 a | 1.87 |
| Té limón | 119 ± 3.3 abc | 7.0 ± 0.1 b | 18 ± 0.4 c | 9.05 ± 0.7 bc | 9.86 ± 0.1 bcd | 11.87 ± 0.2 bc | 1.68 |
| San Rafael | 86 ± 2.2 d | 7.0 ± 0.2 b | 24 ± 1.4 b | 8.00 ± 0.3 bc | 7.89 ± 0.9 d | 9.99 ± 0.5 c | 2.08 |
| 15N-15P-15K | 112 ± 4.3 bc | 6.7 ± 0.1 b | 19 ± 1.1 c | 8.56 ± 0.6 bc | 8.98 ± 0.3 cd | 12.60 ± 0.9 abc | 1.57 |
| Testigo | 109 ± 3.6 c | 6.8 ± 0.1 b | 19 ± 0.5 c | 7.80 ± 0.3 c | 8.48 ± 0.4 d | 12.31 ± 0.3 abc | 1.56 |
| CV (%) | 5.4 | 7.5 | 8.0 | 9.6 | 9.3 | 9.7 | |
CV: coeficiente de variación. ICD: índice de calidad de Dickson. Valores con la misma letra dentro de cada columna son iguales de acuerdo con la prueba de Tukey (P ≤ 0.05).
En el caso del diámetro del tallo, las plantas inoculadas con R. intraradices fueron 25 % mayores (P ≤ 0.05) que las del testigo y el tratamiento fertilizado, y 21 % mayores que las inoculadas con los HMA recolectados. En otras plantas inoculadas con R. intraradices como Cedrela odorata L. y Coffea canephora (Pierre) ex Froehner, el incremento fue 8 y 20 %, respectivamente, con respecto al testigo (Aguirre-Medina, Mina-Briones, Cadena-Iñiguez, Dardón-Zunun, & Hernández-Sedas, 2014; Ibarra-Puón, Aguirre-Medina, Ley-De Coss, Cadena-Iñiguez, & Zavala-Mata, 2014). Con otros HMA como Glomus fasciculatum (Thaxter) Gerdemann & Trappe inoculado en Tectona grandis L. F. y Astronium graveolens Jacq., el incremento del diámetro del tallo fue 11.8 % en comparación con el testigo (Hernández & Salas, 2009).
Con relación al número de hojas, R. intraradices indujo 18 hojas más en comparación con el testigo y el tratamiento fertilizado, y 14 más que los HMA recolectados (P ≤ 0.05). En promedio, los aislamientos indujeron dos hojas más que el testigo y el tratamiento con fertilización química. En T. cacao inoculado con R. intraradices, las plantas tuvieron cuatro hojas más en comparación con el testigo (Aguirre-Medina et al., 2007), y las plantas de C. canephora tuvieron dos hojas más con el mismo hongo endomicorrízico en suelo-arena como sustrato (Ibarra-Puón et al., 2014). El número de hojas incrementó en las plantas micorrizadas, con excepción de “Té limón”, debido posiblemente a la mayor capacidad de absorción de nutrientes (Leigh, Hodge, & Fitter, 2009), lo cual induce aumento de la actividad fotosintética después de la colonización, como en el caso del fríjol (Aguirre-Medina, Kohashi-Shibata, Trejo-López, Acosta Gallegos, & Cadena-Iñiguez, 2005).
La producción de biomasa de la hoja presentó diferencia estadística (P ≤ 0.05) entre los tratamientos y el mayor incremento se registró con la inoculación del HMA de referencia R. intraradices. Entre los hongos recolectados, “Rosario Izapa” disminuyó 11 % la asignación de materia seca a las hojas en comparación con R. intraradices, aunque estadísticamente fueron similares; sin embargo, la disminución fue mayor en los otros aislamientos, del orden de 36 y 46 % para “Caracoles” y “Té limón”, respectivamente, y 46 % para “San Rafael” y el testigo fertilizado. Los resultados indican que la acumulación de materia seca en la biomasa de la hoja varía según el aislamiento aplicado. Moora, Öpik, Sen, y Zobel (2004) señalan variaciones en la micorrización, la captación de nutrientes y la productividad vegetal en función de la interacción entre especies de plantas y los HMA.
El peso seco del tallo también incrementó con R. intraradices y fue estadísticamente superior (P ≤ 0.05) al resto de los tratamientos. Entre los aislamientos recolectados se presentó respuesta diferencial. “Caracoles” y “Rosario Izapa” asignaron 24 % menos biomasa al tallo en comparación con R. intraradices, mientras que en “Té limón”, “San Rafael”, el testigo y el tratamiento fertilizado, la disminución fue de 43 %. Doubková et al. (2013) demostraron que la inoculación con HMA, en especies de interés agrícola, incrementa la nutrición y el crecimiento de la planta, y permite superar situaciones de estrés biótico y abiótico. Estos antecedentes sugieren la funcionalidad contrastante de los microorganismos en interacción con las plantas (Jäderlund, Arthurson, Granhall, & Jansson, 2008), como la respuesta encontrada con L. leucocephala.
Con respecto a la biomasa de la raíz hubo respuesta diferencial entre los aislamientos; el mayor incremento se registró en “Caracoles” y “Rosario Izapa”. Con relación a estos dos tratamientos, la biomasa disminuyó 28 % en R. intraradices y “San Rafael”, y 15 % en los tratamientos testigo y fertilizado. En C. arabica, R. intraradices indujo menor biomasa radical comparado con el testigo (Aguirre-Medina et al., 2011), pero en C. odorata incrementó (Aguirre-Medina et al., 2014). La disminución de la biomasa radical parece que es sustituida por la hifa del hongo (Azcón & Barea, 1980); de lo contrario, se esperaría que los tratamientos con mayor sistema radical, como los inoculados con las colectas nativas y el testigo, tuvieran mayor absorción de nutrientes del suelo, pero en este caso sucedió lo contrario con el P, tal como se observa en la Figura 1.
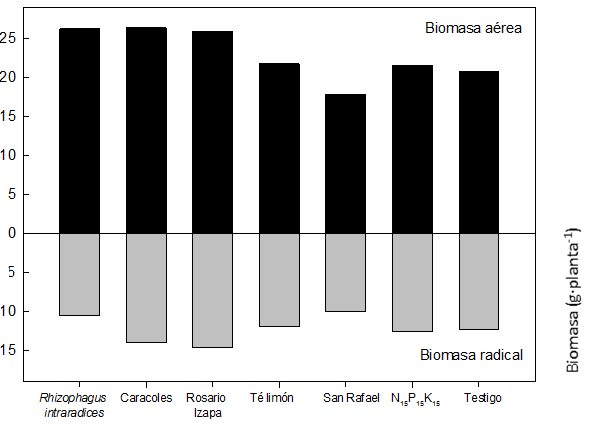
Figura 1 Relación biomasa aérea/radical de Leucaena leucocephala inoculada con hongos micorrízicos arbusculares. Los valores son promedios de cuatro repeticiones por tratamiento.
La relación raíz-vástago de L. leucocephala se modificó con la biofertilización de algunos HMA en condiciones de vivero (Figura 1). El sistema radical de L. leucocephala inoculado con R. intraradices representó 28.4 % del total de la biomasa, siendo el menor porcentaje en comparación con el resto de los tratamientos (entre 35 y 37 %). En cambio, en el caso de la biomasa aérea, R. intraradices representó 71.6 %. En el resto de los tratamientos, el valor fluctuó de 63 a 65 %. El efecto anterior influye en la determinación del índice de calidad de planta propuesto por Dickson et al. (1960).
Kanno et al. (2006) evaluaron aislamientos nativos de hongos endomicorrízicos en Brasil y encontraron incrementos en biomasa aérea y radical en Brachiaria decumbens Stapf, B. brizantha y Panicum maximun Jacq. pero no en B. humidicola (Rendle) Schweick.
Con respecto a la colonización radical, el valor más alto se obtuvo con R. intraradices (78 %), mientras que el menor (61 %) se encontró en el testigo. Lo anterior confirma la presencia de otros hongos micorrízicos en el sustrato utilizado, pero con menor capacidad de estimular el crecimiento de Leucaena. Estos resultados confirman la capacidad de colonización de R. intraradices, como ha sucedido también en otros cultivos anuales y perennes (Aguirre-Medina, Aguirre-Cadena, Cadena-Iñiguez, & Avendaño-Arrazate, 2012). En cuanto a las recolectas, la colonización promedio fue: Caracoles (68 %), Rozario Izapa (72 %), Té limón (77 %) y San Rafael (63 %). Estos hongos, al introducirse adheridos a la semilla, tienen mayor oportunidad de colonización cuando la radícula emerge, a diferencia de los hongos que están presentes en el sustrato pero que pueden no estar en la misma cercanía. Es probable que la colonización por hongos nativos suceda, pero su efecto se asume en la capacidad para influir en el crecimiento de la planta hospedante y el transporte de P.
En la Figura 2 se observa que el contenido de P en L. leucocephala fue estadísticamente mayor (P ≤ 0.05) en el tratamiento con R. intraradices. Las plantas en simbiosis con hongos micorrízicos absorben P del suelo de manera más eficiente que las plantas no colonizadas (Aguirre-Medina et al., 2011; Kanno et al., 2006). De acuerdo con los resultados obtenidos, los HMA inoculados en L. leucocephala permiten disminuir la fertilización química en vivero, sin detrimento del crecimiento de la planta.
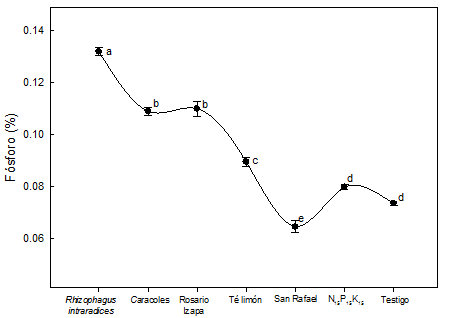
Figura 2 Variación del contenido de fósforo en el tejido vegetal de Leucaena leucocephala inoculada con hongos micorrízicos arbusculares. Resultados a los 120 días después de la siembra. Letras distintas indican diferencias estadísticamente significativas de acuerdo con la prueba de Tukey (P ≤ 0.05). Las barras verticales indican el error estándar de la media (n = 4). Coeficiente de variación = 3.7 %.
Conclusiones
Los componentes morfológicos y fisiológicos del rendimiento en Leucaena leucocephala se modificaron en interacción con los aislamientos recolectados, pero mantuvieron proporción semejante en la relación vástago-raíz. La biofertilización con Rhizophagus intraradices promovió mayor crecimiento vegetal de L. leucocephala en la parte aérea, menor en el sistema radical y mayor contenido de fósforo. Con respecto a los hongos endomicorrízicos, “Caracoles”, “Rosario Izapa” y “Té limón” incrementaron el contenido de P en el tejido vegetal en comparación con el testigo y el tratamiento fertilizado. Las recolectas “Caracoles” y “Rosario Izapa” son buenos candidatos como biofertilizantes en las especies perennes. De acuerdo con los resultados obtenidos, los HMA en L. leucocephala permiten disminuir la fertilización química en vivero, sin detrimento del crecimiento de la planta.
References
Aguirre-Medina, J. F. (2006). Biofertilizantes microbianos: Experiencias agronómicas del programa nacional del INIFAP en México. México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias - Centro de Investigaciones Regionales Pacífico Sur - Campo Experimental Rosario Izapa. Retrieved from http://biblioteca.inifap.gob.mx:8080/jspui/handle/123456789/3633 [ Links ]
Aguirre-Medina, J. F., Aguirre-Cadena, J. F., Cadena-Iñiguez, J., & Avendaño-Arrazate, C. H. (2012). Biofertilización en plantas de la selva húmeda tropical (1.a ed.). México: Colegio de Postgraduados. [ Links ]
Aguirre-Medina, J. F., Kohashi-Shibata, J., Trejo-López, C., Acosta Gallegos, J. A., & Cadena-Iñiguez, J. (2005). Inoculación de Phaseolus vulgaris L. con tres microorganismos y su efecto en tolerancia a sequía. Agricultura Técnica en México, 31, 125-137. Retrieved from http://www.redalyc.org/toc.oa?id=608&numero=10078 [ Links ]
Aguirre-Medina, J. F., Mendoza-López, A., Cadena-Iñiguez, J., & Avendaño-Arrazate, C. H. (2007). La biofertilización del cacao (Theobroma cacao L.) en vivero con Azospirillum brasilense Tarrand, Krieg et Döbereiner y Glomus intraradices Schenk et Smith. Interciencia, 32(8), 1-6. Retrieved from http://www.redalyc.org/articulo.oa?id=33932808 [ Links ]
Aguirre-Medina, J. F., Mina-Briones, F., Cadena-Iñiguez, O. J., Dardón-Zunun, J. D., & Hernández-Sedas, D. A. (2014). Crecimiento de Cedrela odorata L. biofertilizada con Rhizophagus intraradices y Azospirillum brasilense en vivero. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 20(3), 177-186. doi: 10.5154/r.rchscfa.2014.01.001 [ Links ]
Aguirre-Medina, J. F., Moroyoqui-Ovilla, D. M., Mendoza-López, A., Cadena-Iñiguez, J., Avendaño-Arrazate, C. H., & Aguirre-Cadena, J. F. (2011). Aplicación de A. brasilense y G. intraradices a Coffea arabica en vivero. Agronomía Mesoamericana, 22(1), 1-10. Retrieved from http://www.mag.go.cr/rev_meso/v22n01_071.pdf [ Links ]
Azcón, G. C., & Barea, J. M. (1980). Micorrizas. Investigación y Ciencia, 47, 8-16. [ Links ]
Daniell, T., Husband, J. R., Fitter, A. H., & Young, J. P. W. (2001). Molecular diversity of arbuscular mycorrhizal fungi colonizing arable crops. FEMS Microbiology Ecology 36(2-3), 203-209. doi: 10.1111/j.1574-6941.2001.tb00841.x [ Links ]
Dickson, A., Leaf, A. L., & Hosner, J. F. (1960). Quality appraisal of white spruce and white pine seedling stock in nurseries. Forestry Chronicle, 36, 10-13. Retrieved from http://pubs.cif-ifc.org/doi/pdf/10.5558/tfc36010-1 [ Links ]
Doubková, P., Vlasáková, E., & Sudová, R. (2013). Arbuscular mycorrhizal symbiosis alleviates drought stress imposed on Knautia arvensis plants in serpentine soil. Plant Soil, 370, 149-161. doi: 10.1007/s11104-013-1610-7 [ Links ]
García, A. E. (1973). Modificaciones al sistema de clasificación climática de Köppen para adaptarlas a las condiciones de la república mexicana (3a ed.). México. Universidad Nacional Autónoma de México. [ Links ]
Gerdemann, J. W., & Nicolson, T. H. (1963). Spores of mycorrhizal Endogone species extracted from the soil by wet sieving and decanting. Transactions of the British Mycological Society, 46(2), 235-244. doi: 10.1016/S0007-1536(63)80079-0 [ Links ]
Grether, R., Martínez-Bernal, A., Luckow, M., & Zárate, S. (2006). Fascículo 44, Mimosaceae. In A. Novelo-Retana, R. Medina-Lemos, H. Ochoterena-Booth, G. A. Salazar-Chávez, & L. O. Alvarado-Cárdenas (Eds.), Flora del Valle de Tehuacán-Cuicatlán (1.a ed., pp. 1-108). México: UNAM. Retrieved from http://www.conabio.gob.mx/malezasdemexico/mimosaceae/leucaena-leucocephala/fichas/ficha.htm [ Links ]
Hernández, W., & Salas, E. (2009). La inoculación con Glomus fasciculatum en el crecimiento de cuatro especies forestales en vivero y campo. Agronomía Costarricense, 33(1), 17-30. Retrieved from https://revistas.ucr.ac.cr/index.php/agrocost/article/view/6732 [ Links ]
Ibarra-Puón, J. C., Aguirre-Medina, J. F., Ley-De Coss, A., Cadena-Iñiguez, J., & Zavala-Mata, A. (2014). Inoculación de Coffea canephora (Pierre) ex Froehner con Rhizophagus intraradices (Schenck et Sm.) Walker et Schuessler y Azospirillum brasilense Tarrand, Krieg et Döbereiner en vivero. Revista Chapingo Serie Horticultura, 20(2), 201-213. doi: 10.5154/r.rchsh.2013.09.027 [ Links ]
Instituto Nacional de Estadística, Geografía e Informática (INEGI). (2005). Marco geoestadístico municipal, versión 3.1. Prontuario de información geográfica municipal de los Estados Unidos Mexicanos. Retrieved from http://www3.inegi.org.mx/sistemas/mexicocifras/datos-geograficos/21/21158.pdf [ Links ]
Jäderlund, L., Arthurson, V., Granhall, U., & Jansson, J. K. (2008). Specific interactions between arbuscular mycorrhizal fungi and plant growth-promoting bacteria: as revealed by different combinations. FEMS Microbiol Letters, 287(2),174-180. doi: 10.1111/j.1574-6968.2008.01318.x [ Links ]
Jaizme-Vega, M. C. (2009). Las micorrizas. Una simbiosis de interés para la agricultura. Revista Vida Rural, 288, 40-52. Retrieved from http://www.mapama.gob.es/ministerio/pags/Biblioteca/Revistas/pdf_Vrural%2FVrural_2009_288_48_52.pdf [ Links ]
Jaizme-Vega, M. C., & Rodríguez-Romero, A. S. (2008). Integración de microorganismos benéficos (Hongos micorrícicos y bacterias rizosféricas) en agrosistemas de las Islas Canarias. Agroecología, 3, 33-39. Retrieved from http://revistas.um.es/agroecologia/article/view/95491/91801 [ Links ]
Kanno, T., Saito, M., Ando, Y., Macedo, M. C. M., Nakamura, T., & Miranda, C. H. B. (2006). Importance of indigenous arbuscular mycorrhiza for growth and phosphorus uptake in tropical forage grasses growing on an acid, infertile soil from the Brazilian savannas. Tropical Grasslands, 40, 94-101. Retrieved from http://www.tropicalgrasslands.info/public/journals/4/Historic/Tropical%20Grasslands%20Journal%20archive/PDFs/Vol_40_2006/Vol_40_02_20 [ Links ]
Leigh, J., Hodge, A., & Fitter, A. H. (2009). Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material. New Phytologist, 181, 199-207. doi: 10.1111/j.1469-8137.2008.02630.x [ Links ]
Moora, M., Öpik, M., Sen, R., & Zobel, M. (2004). Native arbuscular mycorrhizal fungal communities differentially influence the seedling performance of rare and common Pulsatilla species. Functional Ecology, 18(4), 554-562. doi: 10.1111/j.0269-8463.2004.00876.x [ Links ]
Offre, P., Pivato, B., Siblot, S., Gamalero, E., Corberand, T., Lemanceau, P., & Mougel, C. (2007). Identification of bacterial groups preferentially associated with mycorrhizal roots of Medicago truncatula. Applied and Environmental Microbiology, 73, 913-921. doi: 10.1128/AEM.02042-06 [ Links ]
Phillips, J. M., & Hayman, D. J. (1970). Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 55, 158-161. [ Links ]
Sanon, A., Andrianjaka, Z. N., Prin, Y., Bally, R., Thioulouse, J., Comte, G., & Duponnois, R. (2009). Rhizosphere microbiota interfere with plant-plant interactions. Plant Soil, 321, 259-278. doi: 10.1007/s11104-009-0010-5 [ Links ]
Serralde, O. A. M., & Ramírez, G. M. M. (2004). Análisis de poblaciones de micorrizas en maíz Zea mays cultivado en suelos ácidos bajo diferentes tratamientos agronómicos. Revista Corpoica, 5(1), 31-40. Retrieved from http://corpomail.corpoica.org.co/BACFILES/BACDIGITAL/48629/48629.pdf [ Links ]
Smith, S., Anderson, I., & Smith, F. (2015). Mycorrhizal associations and phosphorus acquisition: From cells to ecosystems. In W. C. Plaxton, & H. Lambers (Eds.), Annual plant reviews volume 48: Phosphorus metabolism in plants (pp. 409-440). USA: John Wiley & Sons. doi: 10.1002/9781118958841.ch14 [ Links ]
Statistical Analysis System (SAS). (1999-2000). SAS/STAT user´s Guide: version 8.1. Cary NC, USA: Author. [ Links ]
Tewari, S. K., Katiyar, R. S., Ram, B., & Misra, P. N. (2004). Effect of age and season of harvesting on the growth, coppicing characteristics and biomass productivity of Leucaena leucocephala and Vitex negundo. Biomass and Bioenergy, 26, 229-234. doi: 10.1016/S0961-9534(03)00118-1 [ Links ]
Wencomo, H. B., & Lugo, J. (2013). Rendimiento de materia seca y otros componentes en Leucaena leucocephala cv. Cunningham con el uso del Liplant. Pastos y Forrajes, 36(1), 43-49. Retrieved from http://www.redalyc.org/articulo.oa?id=269127587004 [ Links ]
Yeung, P. K. K., Wong, F. T. W., & Wong, J. T. Y. (2002). Mimosine the allelochemical from the leguminous tree L. leucocephala, selectively enhances cell proliferation in dinoflagellates. Applied and Environmental Microbiology, 68, 5160-5163. doi: 10.1128/AEM.68.10.5160-5163.2002 [ Links ]
Recibido: 12 de Julio de 2017; Aprobado: 03 de Noviembre de 2017











 texto en
texto en 


