Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.23 no.3 Chapingo sep./dic. 2017
https://doi.org/10.5154/r.rchscfa.2016.12.067
Artículo original
Crecimiento miceliar in vitro de hongos comestibles silvestres de alta montaña en el centro de México
1Universidad Autónoma del Estado de México, Centro de Investigación de Recursos Bióticos. Carretera Toluca-Ixtlahuaca km 14.5, San Cayetano. C. P. 50295. Toluca, Estado de México, México.
2Instituto de Ecología , A. C. Carretera antigua a Coatepec 351, El Haya. C. P. 91070. Xalapa, Veracruz, México.
Introducción:
Los hongos comestibles silvestres se consideran alimentos funcionales de alto valor culinario; su demanda ha aumentado en los últimos años.
Objetivo:
Se evaluó el crecimiento miceliar de Bovista aestivalis, Infundibulicybe squamulosa, I. gibba, Gymnopus dryophilus y Lycoperdon perlatum, para identificar especies susceptibles al cultivo.
Materiales y métodos:
La tasa de crecimiento miceliar (TC) y la biomasa se determinaron a 18 y 25 °C en medios de cultivo sólido, cultivo líquido y en semilla suplementada con acículas de Pinus patula. La actividad metabólica (Am) se cuantificó en la semilla suplementada, mediante la técnica del diacetato de fluoresceína (FDA).
Resultados y discusión:
Gymnopus dryophilus y L. perlatum presentaron mejor desarrollo miceliar. En medio sólido, el tratamiento óptimo para ambas especies fue agar maíz a 18 °C. La TC de G. dryophilus fue 2.2 mm·d-1 con biomasa de 70 mg; la TC de L. perlatum fue 2.0 mm·d-1 con biomasa de 30 mg. En cultivo líquido, la TC de G. dryophilus fue 0.11 g·d-1 y para L. perlatum fue 0.12 g·d-1 . En sorgo suplementado, G. dryophilus tuvo Am de 61.5 µg de FDA·g-1 de sustrato y TC de 1.18 mm·d-1; L. perlatum registró 23.6 µg de FDA·g-1 y TC de 0.68 mm·d-1.
Palabras clave: Sorgo; Gymnopus dryophilus; Lycoperdon perlatum; agar-maíz; agar-acículas de pino
Introduction:
Wild edible mushrooms are considered functional foods of high culinary value; their demand has increased in recent years.
Objective:
The mycelial growth of Bovista aestivalis, Infundibulicybe squamulosa, I. gibba, Gymnopus dryophilus and Lycoperdon perlatum was evaluated to identify species susceptible to culture.
Materials and methods:
Mycelial growth rate (GR) and biomass were determined at 18 and 25 °C in solid and liquid culture media and in seed supplemented with Pinus patula needles. Metabolic activity (Ma) was quantified in the supplemented seed using the fluorescein diacetate (FDA) technique.
Results and discussion:
Gymnopus dryophilus and L. perlatum showed better mycelial development. In solid medium, the optimal treatment for both species was maize agar at 18 ° C. The G. dryophilus GR was 2.2 mm·d-1 with 70 mg biomass; the L. perlatum GR was 2.0 mm·d-1 with 30 mg biomass. In liquid culture, the G. dryophilus GR was 0.11 g·d-1 and for L. perlatum it was 0.12 g·d-1 . In supplemented sorghum, G. dryophilus had Ma of 61.5 µg of FDA·g-1 of substrate and a GR of 1.18 mm·d-1; L. perlatum recorded 23.6 µg of FDA·g-1 and a GR of 0.68 mm·d-1.
Keywords: Sorghum; Gymnopus dryophilus; Lycoperdon perlatum; maize agar; pine needle agar
Introducción
La demanda de los hongos comestibles silvestres ha aumentado considerablemente ya que representan una nueva tendencia alimenticia (Martínez-Carrera, Morales, Sobal, Bonilla, & Martínez, 2007). Los hongos tienen alto valor nutrimental y energético y brindan propiedades benéficas para la salud, por lo que se consideran alimentos funcionales de alto valor culinario (Trigos & Suárez-Medellín, 2010).
México es uno de los países con mayor diversidad de hongos comestibles silvestres; se consumen alrededor de 371 especies (Garibay-Orijel & Ruan Soto, 2014). Debido a esta gran diversidad fúngica es fundamental estudiar las especies silvestres nativas, fortalecer su conservación y buscar alternativas para su aprovechamiento (Gaitán-Hernández & Salmones, 2015). El estudio de los hongos comestibles silvestres puede generar grandes beneficios económicos, sociales, tecnológicos y científicos. Los hongos representan una alternativa para la seguridad alimentaria (Mayett & Martínez-Carrera, 2010; Organización de las Naciones Unidas para la Alimentación y la Agricultura [FAO], Fondo Internacional de Desarrollo Agrícola [FIDA], & Programa Mundial de Alimentos [PMA], 2006); sus cepas pueden ser susceptibles al cultivo (Carreño-Ruiz, Capello-García, Gaitán-Hernández, Cifuentes-Blanco, & Rosique-Gil, 2014), impulsan la producción rural de pequeños productores y la dependencia de cepas extranjeras puede disminuir (Morales et al., 2010). El germoplasma de hongos podría presentar una mejor resistencia al ataque de plagas y enfermedades comunes en la producción industrial (Salmones, Ballesteros, Zulueta, & Mata, 2012) y generar mayor competencia en el mercado durante todo el año. Tal recurso no se ha utilizado en todo su potencial (Garibay-Orijel et al., 2009) y se puede hacer uso del conocimiento tradicional y ecológico que existe al respecto, para identificar las especies más valoradas y con mayor demanda, que eventualmente pueden ser aprovechadas (Burrola-Aguilar, Montiel, Garibay-Orijel, & Zizumbo-Villarreal, 2012).
En el Área de Protección de Flora y Fauna Nevado de Toluca, en el Estado de México, se han registrado 77 especies de hongos comestibles (Franco-Maass, Burrola-Aguilar, & Arana-Gabriel, 2012), algunas consideradas con alto potencial de cultivo por ser saprobias (Arana-Gabriel, Burrola-Aguilar, Garibay-Orijel, & Franco-Maass, 2014). Entre las especies que destacan en la región, y son valoradas alimenticia y culturalmente, se encuentran Gymnopus dryophilus (Bull.) Murrill 1916, conocida popularmente como “clavitos de llano”, y Lycoperdon perlatum Pers. 1796 o “terneritas” (Franco-Maass et al., 2012). Este último tiene gran potencial medicinal debido a sus propiedades como cicatrizante, antioxidante y antimicrobiano (Alvarado-Castillo, Mata, & Benítez-Badillo, 2015).
En los últimos años se han realizado investigaciones enfocadas al desarrollo biotecnológico de hongos silvestres a nivel de cepas e inóculo (Martínez-Carrera et al., 2007), como el crecimiento miceliar en medios de cultivo sólidos enriquecidos (Gaitán-Hernández, 2000; Gaitán-Hernández & Báez-Rodríguez, 2008; León-Avendaño, Martínez-García, Caballero, & Martínez-Carrera, 2013); la influencia de los nutrientes del inóculo en medio líquido sobre la producción de biomasa y otros metabolitos (Chegwin & Nieto 2013; Lin & Chen, 2007; Torres- López, Quinter, & Tehortua, 2011), el crecimiento del micelio sobre diferentes semillas (Arana-Gabriel et al., 2014; Carreño-Ruiz et al., 2014; Villegas, 2007), semillas suplementadas utilizadas como inóculo (Gaitán-Hernández, Cortés, & Mata, 2014; Gaitán-Hernández & Salmones, 2015; Mata, Savoie, Delpech, & Olivier, 1998) y cuantificación de biomasa presente en inóculo preparado con semilla, mediante técnicas indirectas como la estimación de diacetato de fluoresceína (FDA) (Mata, Ortega, & Pérez-Merlo, 2011). Estos estudios permiten conocer los requerimientos nutricionales y ambientales de las especies, estableciendo los parámetros para su cultivo (Arana-Gabriel et al., 2014).
Con base en lo anterior, el objetivo de este trabajo fue evaluar y caracterizar el crecimiento miceliar de algunas cepas de hongos comestibles silvestres saprobios de alta montaña, para establecer las condiciones óptimas de cultivo de micelio in vitro e identificar cuáles pueden ser susceptibles de cultivo.
Materiales y métodos
Zona de muestreo
El Parque Ecológico Ejidal de Cacalomacán (PEEC) se localiza en el Área de Protección de Flora y Fauna Nevado de Toluca en el Estado de México. El PEEC tiene una superficie total de 244 ha en el gradiente altitudinal 2 800 a 3 247 m. El clima predominante es templado semifrío con lluvias en verano. La temperatura media anual oscila entre 12 y 18 °C y la precipitación media anual es de 1 200 a 1 800 mm. El tipo de vegetación sobresaliente corresponde a un bosque secundario de coníferas Cupressus lindleyi Klotzsch ex Endl., Eucalyptus globulus Labill., Pinus ayacahuite C. Ehrenb. ex Schltdl., P. patula Schltdl. & Cham. y P. montezumae D. Don in Lamb. (Sánchez-Jasso, Aguilar-Miguel, Medina-Castro, & Sierra-Domínguez, 2013).
Obtención de cepas
Mediante un muestreo preferencial, a partir de recorridos en todo el PEEC, se recolectaron esporomas de hongos saprobios de importancia cultural, alimenticia y económica en el centro de México. Los ejemplares se caracterizaron macroscópicamente de acuerdo con Delgado, Villegas, y Cifuentes (2005) y microscópicamente de acuerdo con Franco-Maass et al. (2012) para su posterior identificación taxonómica. Los ejemplares vouchers se depositaron en la Colección de Hongos (XAL) del Instituto de Ecología, A. C.
Aislamiento vegetativo y caracterización de las cepas
Los cultivos puros se obtuvieron de esporomas en tres medios de cultivo sólido comercial (agar papa dextrosa [PDA] pH 5.6, agar extracto de malta [EMA] pH 4.7, agar Sabouraud dextrosa [AS] pH 5.6) y dos medios no convencionales: agar maíz (AM: 15 g·L-1 de harina de maíz, 15 g·L-1 de agar agar, 2 g·L-1 de extracto de levadura y 1 g·L-1 de peptona de gelatina, pH 6.3) y agar acículas de pino (AA: 15 g·L-1 de una infusión acuosa de acículas de pino [Pinus patula] secas y molidas, 15 g·L-1 de agar agar, 2 g·L-1 de extracto de levadura y 1 g·L-1 de peptona de gelatina, pH 5.8). Los medios fueron previamente esterilizados a 120 °C y 15 psi durante 15 min. Las cepas se caracterizaron macroscópicamente y microscópicamente de acuerdo con Cruz-Ulloa (1995).
Evaluación del crecimiento miceliar en medio sólido
Tasa de crecimiento miceliar
Con un horadador de 0.5 cm de diámetro se tomó micelio de los medios de cultivo en los que cada cepa presentó mejor desarrollo miceliar y se colocó en el centro de una caja Petri de 9 cm de diámetro. Las cajas se incubaron en oscuridad a 18 y 25 °C. Para cada cepa se evaluaron cuatro medios de cultivo a dos temperaturas, con ocho repeticiones. El crecimiento del micelio se midió cada tercer día durante 28 días. Las mediciones de cada repetición se graficaron respecto al tiempo de incubación y la curva de crecimiento se linealizó para obtener la ecuación de una recta (Gaitán-Hernández & Báez-Rodríguez, 2008):
Cuantificación de biomasa
El micelio se colocó en agua a 90 °C aproximadamente y se enjuagó hasta dejarlo libre de agar. Posteriormente, la muestra se colocó en un horno a 80 °C por 24 h y se pesó la biomasa seca (Santiago-Martínez, Estrada-Torres, Varela, & Herrera, 2003).
Evaluación del crecimiento miceliar en los tratamientos de semillas utilizadas como fuente de inóculo
Invasión y densidad miceliar
Las cepas G. dryophilus y L. perlatum se inocularon en cuatro tratamientos: trigo (T1), sorgo (T2), trigo suplementado con acículas de pino al 10 % (T3) y sorgo suplementado con acículas de pino al 10 % (T4). Los granos se limpiaron e hidrataron y se agregaron las acículas de pino previamente hidratadas. Se colocaron 200 g de sustrato en frascos de cristal de 400 mL, con ocho repeticiones por tratamiento. Los frascos se esterilizaron y se incubaron en oscuridad a 18 °C durante 28 días. Posteriormente, el porcentaje de grano invadido por el hongo y la densidad del micelio se obtuvieron mediante el análisis cualitativo propuesto por Villegas (2007) y modificado por Arana-Gabriel et al. (2014).
Tasa de crecimiento miceliar en semilla
Se identificó el tratamiento con mejor porcentaje de invasión y densidad de micelio y se tomaron 24 g en fresco para llenar cada caja Petri de 9 cm de diámetro, con 10 repeticiones. Las cajas se inocularon con un trozo de 0.7 cm de micelio en medio sólido y se incubaron en oscuridad durante 21 días a 20 °C. Posteriormente, la TC se calculó con la función de crecimiento lineal descrita anteriormente (Gaitán-Hernández & Salmones, 2015).
Actividad metabólica (Am) del micelio en semilla
Cuarenta gramos de semilla del tratamiento óptimo de cada cepa se incubaron por separado en frascos de cristal de 100 mL en oscuridad a 20 °C. Posteriormente, la Am se estimó mediante cuatro mediciones semanales de la hidrólisis de FDA de acuerdo con el método de Swisher y Carrol (1980) modificado por Mata y Savoie (1998).
Tasa de crecimiento miceliar y cuantificación de biomasa a partir de cultivo líquido
El medio de cultivo líquido se elaboró con 15 g de harina de maíz en un matraz aforado a 1 L con agua destilada. Posteriormente, el medio se centrifugó en tubos de 50 mL a 8 500 rpm durante 10 min para obtener un medio libre de precipitado. Finalmente se agregaron 2 g·L-1 de extracto de levadura y 1 g·L-1 de peptona de soya. Se adicionaron 100 mL de medio en matraces Erlenmeyer de 150 mL y se esterilizaron (Chegwin & Nieto 2013). Los matraces se inocularon con un trozo de 0.7 cm de micelio en medio sólido, se taparon con papel aluminio y se colocaron en un agitador orbital a 80 rpm, durante 21 días a 20 °C. La biomasa se cuantificó mediante peso seco cada semana con tres repeticiones por medición. La TC se obtuvo de la ecuación de Monod en función de la biomasa (Sánchez & Royse 2002):
Análisis estadístico
La interacción entre la temperatura y los medios de cultivo sólidos sobre la tasa de crecimiento miceliar y la biomasa se determinó con un análisis estadístico multifactorial (MANOVA) con 95 % de confianza (P ≤ 0.05). Se realizó una prueba de rangos múltiples de Tukey con el programa STATGRAPHICS Centurión XVI (Statpoint Technologies, Inc., 2009), para conocer las diferencias estadísticamente significativas en los valores promedio.
Resultados y discusión
Obtención y caracterización macroscópica y microscópica de las cepas
Cinco cepas de hongos comestibles silvestres se aislaron en cultivo puro in vitro: Bovista aestivalis (Bonord.) Demoulin 1979 (pedo de burro), Infundibulicybe squamulosa (Pers.) Harmaja 2003 (tejamanilero o copa), I. gibba (Pers.) Harmaja 2003 (tejamanil), G. dryophilus (clavitos de llano) y L. perlatum (terneritas). Las cepas se resguardaron en el cepario de hongos del Instituto de Ecología, A. C. bajo los números: IE 991 (B. aestivalis), IE 988 (G. dryophilus), IE 989 (I. gibba), IE 990 (I. squamulosa) e IE 987 (L. perlatum).
El hongo B. aestivalis logró desarrollarse en todos los medios con una TC de 1.2 mm·d-1, aunque el crecimiento en AS y EMA, a 18 y 25 °C, fue lento y poco denso. La forma del micelio es circular irregular con margen fimbrado, textura aterciopelada con superficie plana y crecimiento postrado-sumergido de color blanco (Figura 1A). Las hifas son hialinas de 1.1 (0.7-2.4) mm de ancho y sinuosas con terminación redondeada.
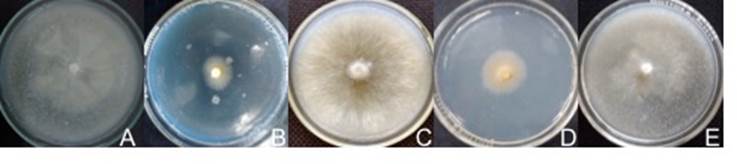
Figura 1 Micelio de las cepas obtenidas. A) Bovista aestivalis en agar maíz (AM) a 18 °C, B) Infundibulicybe gibba en PDA a 25 °C, C) Gymnopus dryophilus en agar acículas de pino a 18 °C, D) Infundibulicybe squamulosa en AM a 18 °C y E) Lycoperdon perlatum en AM a 18 °C.
Infundibulicybe gibba creció en todos los medios y a ambas temperaturas con una TC de 1.0 mm·d-1; sin embargo, en AA presentó el crecimiento y densidad más bajo. La forma del micelio es circular con margen liso-fimbrado, textura aterciopelada, superficie plana y crecimiento sumergido (Figura 1B). Las hifas midieron 2.2 (1.5-2.8) mm de ancho, son hialinas con fíbulas y prolongaciones parietales, y lisas con terminación redondeada-globosa.
Gymnopus dryophilus tuvo una TC de 2.2 mm·d-1 y densidad
miceliar alta en todos los medios bajo las dos temperaturas de evaluación, a
excepción de AS a 18 y 25 °C donde el crecimiento fue muy lento. La forma
del micelio es circular con margen fimbrado, textura algodonosa y superficie
plana; el crecimiento es aéreo y de color blanco, al envejecer cambia a una
tonalidad crema-café (Figura 1C). Las
hifas son lisas con terminaciones redondeadas, hialinas y septadas; presenta
abundantes fíbulas y prolongaciones parentales. Las hifas midieron 3.1
Infundibulicybe squamulosa se desarrolló en todos los medios a las dos temperaturas; sin embargo, su TC fue de 0.9 mm·d-1 y su densidad miceliar fue muy baja. El crecimiento del micelio es sumergido de color amarillo, de forma irregular con margen liso-fimbrado, textura aterciopelada y superficie plana (Figura 1D). El hongo desarrolló hifas de 2.6 (2.2-3.3) mm de ancho, ramificadas, septadas y con fíbulas frecuentes.
Lycoperdon perlatum creció a una TC de 1.6 mm·d-1. En EMA a 18 y 25 °C el crecimiento fue casi nulo. La forma del micelio es circular con margen fimbrado, textura algodonosa y superficie plana; el crecimiento es sumergido-aéreo de color blanco-crema (Figura 1E). Las hifas son lisas-sinuosas con terminaciones redondeadas-globosas, hialinas con prolongaciones parietales y escasas fíbulas. Las hifas midieron 3.3 mm de ancho en AM, 3.7 mm en AA, 2.8 mm en AS y 2.5 mm en PDA a 18 °C; y 3.1 mm en AM, 3.4 mm en AA, 2.7 mm en AS y 2.9 mm en PDA a 25 °C.
Bovista aestivalis, I. gibba e I. squamulosa tuvieron crecimiento lento, por tal motivo solamente se seleccionaron G. dryophilus en AA, AM, PDA y EMA a 18 y 25 °C, y L. perlatum en AA, AM, PDA y AS a 18 y 25 °C, para evaluar el crecimiento miceliar en medio sólido y en semilla utilizada como inoculante.
Evaluación del crecimiento miceliar en medio sólido
Tasa de crecimiento miceliar y cuantificación de la biomasa
El Cuadro 1 reporta la TC y biomasa de Gymnopus dryophilus y Lycoperdon perlatum en los medios de cultivo y temperaturas de evaluación. En dicho cuadro se observa que no existieron diferencias estadísticamente significativas entre los tratamientos (P > 0.05) ni hubo interacción entre los medios de cultivo y la temperatura sobre la TC de Gymnopus dryophilus. Respecto a la biomasa, existen diferencias estadísticas entre los tratamientos y hay interacción entre los medios de cultivo y la temperatura (P < 0.05) sobre dicha variable. Los tratamientos óptimos fueron AA y AM, ambos a 18 y 25 °C. En el caso de L. perlatum, existen diferencias estadísticamente significativas entre los tratamientos e interacción entre los medios de cultivo y la temperatura (P < 0.05) sobre la TC. Los valores más altos de TC se obtuvieron en los tratamientos AA a 18 y 25 °C y AM a 18 °C. Respecto a la biomasa, hay diferencias estadísticas entre los tratamientos e interacción entre los medios de cultivo y la temperatura (P > 0.05). Los medios AM a 18 °C y AA a 25 °C fueron los tratamientos con mayor producción de biomasa.
Cuadro 1 Tasa de crecimiento miceliar (TC) y producción de biomasa de Gymnopus dryophilus y Lycoperdon perlatum.
| Temperatura (°C) | Medio de cultivo | Gymnopus dryophilus | Lycoperdon perlatum | ||
|---|---|---|---|---|---|
| TC (mm·d-1) | Biomasa (mg) | TC (mm·d-1) | Biomasa (mg) | ||
| 18 | AS | NE | NE | 1.6 cd | 10 cd |
| AM | 2.2 a | 70 abc | 2.0 a | 30 a | |
| AA | 2.3 a | 110 a | 1.9 a | 10 bc | |
| PDA | 2.4 a | 30 c | 1.0 e | 6 e | |
| EMA | 2.2 a | 40 bc | NE | NE | |
| 25 | AS | NE | NE | 1.6 c | 10 c |
| AM | 2.2 a | 60 abc | 1.7 b | 10 b | |
| AA | 2.2 a | 90 ab | 2.0 a | 20 a | |
| PDA | 2.2 a | 30 c | 1.1 d | 7 d | |
| EMA | 2.3 a | 0.04 bc | NE | NE | |
AS: agar Sabouraud dextrosa, AM: agar maíz, AA: agar acículas de pino, PDA: papa dextrosa agar y EMA: agar extracto de malta. NE: medio no evaluado. Las letras en cada columna representan diferencias significativas entre tratamientos (Tukey, P < 0.05).
Gymnopus dryophilus y L. perlatum no presentaron diferencias en las características macroscópicas entre los tratamientos evaluados, probablemente debido a los caracteres fenotípicos de cada cepa como lo señala León-Avendaño et al. (2013). En el caso de G. dryophilus podría deberse a que todos los medios de cultivo cuentan con los nutrientes necesarios, por lo que no existen interacciones entre temperatura y los medios de cultivo sobre la TC. No obstante, la biomasa sí se ve afectada por la interacción entre la temperatura y los medios de cultivo (P < 0.05, Cuadro 1). En PDA y EMA a 18 y 25 °C, la densidad del micelio fue más baja, reflejándose en una menor producción de biomasa, en contraste con el medio AM en el que desarrolló micelio aéreo muy abundante. Para L. perlatum, la densidad y velocidad de crecimiento miceliar se ven afectados por los tratamientos (P < 0.05, Cuadro 1). En este caso, el medio AA a 18 y 25 °C produjo mayor crecimiento miceliar y densidad seguido por AM a 18 °C (micelio aéreo en ambos medios), mientras que en PDA a 18 y 25 °C se obtuvieron los valores más bajos de crecimiento.
Los valores más altos de TC y biomasa en ambas especies se obtuvieron con los medios AA y AM, lo cual se atribuye a que el medio AA está elaborado a base de acículas de pino, brindando al micelio las condiciones de su medio natural. Esto concuerda con lo reportado por Gaitán-Hernández (2000), quien demuestra que el mayor crecimiento miceliar de Neolentinus suffrutescens (Brot.) T. W. May & A. E. Wood fue obtenido en medios adicionados con extracto de madera de pino (medio natural del hongo).
El uso del medio AM se recomienda debido a la facilidad para adquirir harina de maíz. Lin y Chen (2007) y Chegwin y Nieto (2013) reportaron que los medios elaborados con harinas disponen de una relación C/N ideal para la producción de biomasa y otros metabolitos, parámetros indispensables para que una cepa sea susceptible a cultivo.
Por otra parte, en ambas cepas existen diferencias en el ancho de las hifas de acuerdo con el medio de cultivo. Las hifas más anchas de G. dryophilus corresponden a los medios AA a 18 °C (3.9 mm), AA a 25 °C (3.7 mm), AM a 18 °C (3.1 mm) y AM a 25 °C (3.4 mm), donde la TC y biomasa fueron superior en comparación con PDA a 18 °C (2.9 mm) y 25 °C (2.7 mm) y EMA a 18 °C (3.0 mm) y 25 °C (2.7 mm), donde el crecimiento miceliar fue más bajo e incluso hubo mayor cantidad de prolongaciones parietales. De acuerdo con Harris (2008), la formación de prolongaciones se debe a que el micelio busca nutrientes en el medio viéndose obligado a generar más hifas, pero de menor grosor; esto no se reflejó en la tasa de crecimiento miceliar, pero sí en la producción de biomasa. Asimismo, las hifas de L. perlatum fueron más gruesas en AA a 18 °C (3.7 mm), AA a 25 °C (3.4 mm), AM a 18 °C (3.3 mm) y AM a 25 °C (3.1 mm), correspondientes a los tratamientos donde la TC y biomasa fueron mayores. En AS a 18 °C (2.8 mm) y 25 °C (2.7 mm), y PDA a 18 °C (2.5 mm) y 25 °C (2.9 mm), las hifas de L. perlatum fueron más delgadas y con más prolongaciones parietales, extendiéndose apicalmente para conseguir los nutrientes necesarios (Sánchez & Royse, 2002).
Otro factor de suma importancia es el pH de los medios. El hongo G. dryophilus mostró TC y biomasa menor en los tratamientos con pH más bajo (EMA = 4.7 y PDA = 5.6) en comparación con AM = 6.3 y AA = 5.8, lo que sugiere que el pH óptimo se encuentra en este intervalo. De la misma forma, L. perlatum tuvo mejor desarrollo miceliar en AM = 6.3 y AA = 5.8, y los valores más bajos se obtuvieron en PDA = 5.6, AS = 5.6 e incluso EMA = 4.7, donde el crecimiento fue casi nulo. Lo anterior indica que el pH óptimo para esta especie también se encuentra más cercano al pH neutro.
Evaluación del crecimiento miceliar en semilla utilizada como fuente de inóculo
Invasión y densidad miceliar en semilla
La densidad del micelio de G. dryophilus incubado a 18 °C en trigo (T1, 30 % de humedad y pH 7.0) fue de 3.4 con 90 % de invasión, y en sorgo (T2, 20 % de humedad y pH 7.3), la densidad del micelio fue de 3.2 con 90 % de invasión (Figura 2A); en ambos casos, el micelio fue medianamente denso. En el trigo suplementado con acículas de pino (T3, 40 % de humedad y pH 6.6) y en sorgo suplementado con acículas de pino (T4, 37 % de humedad y pH 6.9), los valores aumentaron considerablemente, obteniendo densidad de 4.2 y 100 % de invasión en T3 y densidad de 4.5 y 100 % de invasión del grano en T4 (Figura 2B), en ambos casos con micelio medianamente denso.

Figura 2 Micelio de Gymnopus dryophilus: A) semilla de sorgo, B) semilla de sorgo suplementada con acículas de pino. Micelio de Lycoperdon perlatum en: C) semilla de sorgo, D) semilla de sorgo suplementada con acículas de pino.
En L. perlatum, la densidad del micelio incubado a 18 °C en el trigo (T1) y sorgo (T2, Figura 2C) fue muy baja con un porcentaje de invasión casi nulo, correspondiente a un micelio poco denso. En contraste, en trigo suplementado (T3) y sorgo suplementado (T4), la densidad del micelio fue de 4.5 y 100 % de invasión del micelio para T3, y una densidad de 4.8 y 100 % de invasión del grano para T4 (Figura 2D), ambos casos con micelio medianamente denso.
Respecto al porcentaje de invasión y densidad miceliar en semilla como fuente de inóculo, tanto para G. dryophilus como para L. perlatum, el tratamiento T4 a 18 °C fue el óptimo. Esto puede deberse a que las acículas de pino le proporcionan mayor porcentaje de humedad a los tratamientos T3 y T4, de esta forma hay mayor disponibilidad de agua para el micelio, además de que el grano suplementado presenta pH (6.9) próximo al óptimo para el desarrollo de micelio en medio sólido.
Actividad metabólica y tasa de crecimiento miceliar en semilla
Debido a que G. dryophilus y L. perlatum presentaron mejor desarrollo miceliar en sorgo suplementado, los tratamientos de sorgo (T2) y sorgo suplementado con acículas (T4) a 18 °C se utilizaron para estimar la actividad metabólica (Am) de las cepas y contrastar el desarrollo miceliar en un sustrato suplementado y sin suplementar.
El micelio de Gymnopus dryophilus presentó una fase de latencia de aproximadamente 21 días en el T2 (Figura 3A). Después de este periodo, la fase exponencial alcanzó valores de 71.07 (g de FDA hidrolizados·g-1 de sustrato seco. En contraste, G. dryophilus presentó actividad metabólica desde la primera semana en T4, manteniendo su crecimiento hasta la tercera semana con Am de 61 (g de FDA hidrolizados·g-1 de sustrato seco y TC de 1.18 mm·d-1.
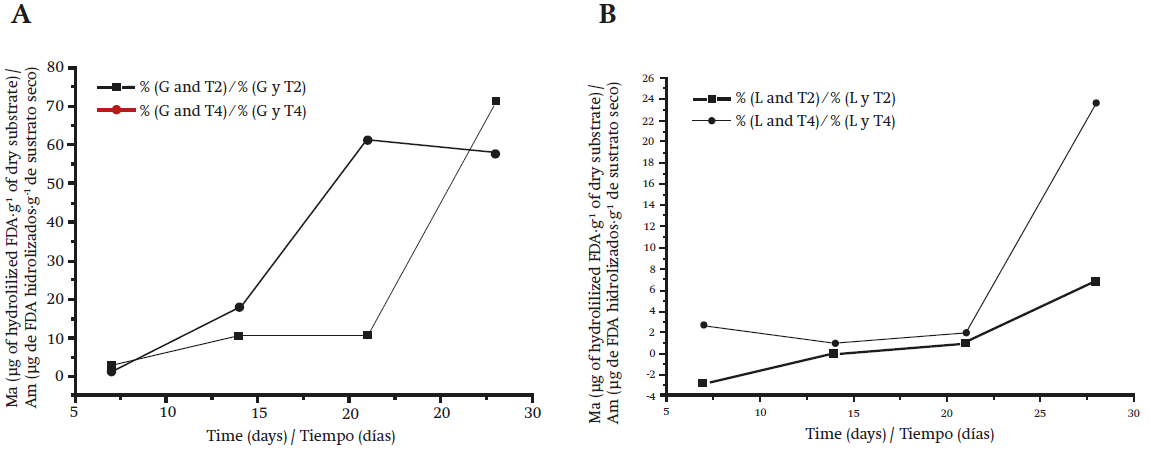
Figura 3 Actividad metabólica (Am) determinada por la hidrólisis del diacetato de fluoresceína (FDA): A) Gymnopus dryophilus en sorgo (T2) y sorgo suplementado con acículas de pino (T4); B) Lycoperdon perlatum en sorgo (T2) y sorgo suplementado con acículas de pino (T4).
Lycoperdon perlatum presentó Am baja de 6.9 (g de FDA hidrolizados·g-1 de sustrato seco en T2 (Figura 3B) y, por consiguiente, una producción de biomasa muy baja. En T4, L. perlatum presentó mayor actividad metabólica de 23.6 (g de FDA hidrolizados·g-1 de sustrato seco, debido a que el sustrato suplementado le proporcionó mejores condiciones para el desarrollo del micelio (37 % de humedad y pH 6.9), aunque la fase exponencial del micelio comenzó después de los 21 días de incubación. La TC en T4 fue 0.68 mm·d-1.
En la Figura 3A se puede notar que hay un declive de la Am de G. dryophilus a partir de los 21 días en el T4. Esto no representa una fase de muerte celular sino más bien denota que su gasto energético se enfocó en funciones metabólicas diferentes a la producción de biomasa, como podría ser la preparación del micelio para su fructificación, tal como lo mencionan Mata et al. (2011). El hongo G. dryophilus segrega exudados debido a la adición de acículas; Gaitán-Hernández et al. (2014) lo atribuyen a que el micelio se encuentra en un estado maduro y listo para la fructificación en comparación con el T2, donde después de los 21 días de incubación comienza la producción exponencial de biomasa. Por lo anterior, se considera que el sorgo suplementado (T4) a 18 °C es el tratamiento óptimo, para la producción de inóculo de G. dryophilus.
Lycoperdon perlatum presentó Am muy baja en ambos tratamientos. En el T2 se debe posiblemente a que las condiciones de humedad (20 %) son muy bajas, además de que el pH (7.3) está por encima del óptimo (6.3) para el desarrollo de la cepa, inhibiendo el desarrollo del micelio. El hongo L. perlatum podría alcanzar valores más altos de Am en T4 en un periodo de incubación mayor; sin embargo, los valores de biomasa y TC son bajos para considerar dicho tratamiento como una opción para la producción de inóculo.
De acuerdo con Villegas (2007), las semillas proporcionan alto contenido de carbohidratos y proteínas que permiten un buen desarrollo del micelio; sin embargo, el crecimiento miceliar y producción de biomasa de G. dryophilus y L. perlatum fue mayor en las semillas suplementadas con acículas de pino. Esto se atribuye a que las acículas son el medio natural de los hongos, por lo que están adaptados a crecer en él. Mata et al. (2011) indican que el micelio podría producir enzimas lignocelulolíticas que le brindan la capacidad de explotar adecuadamente los nutrientes del sustrato, facilitando así su crecimiento; Gaitán-Hernández y Salmones (2015) también reportan la presencia de elementos químicos que favorecen una mayor actividad enzimática del hongo. La rápida invasión del micelio sobre el grano es de suma importancia para la optimización de los procesos de cultivo (Gaitán-Hernández & Salmones, 2015), por lo que se recomienda utilizar el inóculo en semilla suplementada con acículas de pino. Además, al suplementar la semilla con compuestos de estructuras orgánicas complejas, la contaminación por otros hongos disminuye significativamente (Mata et al., 1998).
Tasa de crecimiento miceliar en cultivo líquido
El medio utilizado presentó pH 7.27. El hongo G. dryophilus tuvo una TC de 0.11 g de biomasa seca·d-1, alcanzando 7.3 g de biomasa fresca centrifugada. Lycoperdon perlatum presentó una TC de 0.12 g de biomasa seca·d-1 y 2.4 g de biomasa fresca centrifugada.
La cantidad de biomasa de G. dryophilus en cultivo líquido es considerable debido a que el mayor efecto lo ejerce la fuente de carbono disponible en la harina de maíz (Torres-López et al., 2011). A pesar de ello, se recomienda utilizar semilla como fuente de inoculación, ya que es más accesible, no se necesitan equipos especializados para la elaboración y es más económico (Sánchez & Royse, 2002), además de que tiene la capacidad de inocular mayor cantidad de sustrato. En contraste, para el caso de L. perlatum se recomienda utilizar cultivo líquido para su producción, ya que la biomasa y TC obtenidas con la semilla son muy bajas y no es viable elaborar inóculo a una escala mayor.
Conclusiones
El crecimiento miceliar de Bovista aestivalis, Infundibulicybe squamulosa, I. gibba, Gymnopus dryophilus y Lycoperdon perlatum, en medio sólido, fue mayor en los medios no convencionales como agar maíz y agar acículas de pino a 18 °C. Gymnopus dryophilus y L. perlatum mostraron valores más altos de invasión, densidad, tasa de crecimiento y producción de biomasa miceliar en semillas de sorgo suplementadas con acículas de pino al 10 %, utilizadas como fuente de inoculación, que en los granos sin suplemento; además, el tiempo de incubación fue menor. En el caso de L. perlatum es posible utilizar cultivo líquido para su producción, ya que la biomasa y tasa de crecimiento en sorgo fueron muy bajas y no es viable elaborar inóculo a una escala mayor. La cepa de G. dryophilus es susceptible al cultivo; las condiciones óptimas se encuentran en medios sólidos a base de harina y en sorgo suplementado con acículas de pino, aproximadamente a 18 °C y pH cercano al neutro. De acuerdo con la evaluación del crecimiento miceliar y a que no se cuenta con trabajos similares, los resultados fungen como base para estudios posteriores sobre el cultivo in vitro de las cinco especies de alta montaña del centro de México.
Agradecimientos
Al CONACYT por la beca otorgada al primer autor y a la SyEA de la Universidad Autónoma del Estado de México por el financiamiento del proyecto (3687/2014/CIA).
REFERENCIAS
Alvarado-Castillo, G., Mata, G., & Benítez-Badillo, G. (2015). Importancia de la domesticación en la conservación de los hongos silvestres comestibles en México. Bosque, 36(2), 151-161. doi: 10.4067/S0717-92002015000200001 [ Links ]
Arana-Gabriel, Y., Burrola-Aguilar, C., Garibay-Orijel, R., & Franco-Maass, S. (2014). Obtención de cepas y producción de inóculo de cinco especies de hongos silvestres comestibles de alta montaña en el centro de México. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 20(3), 213-226. doi: 10.5154/r.rchscfa.2014.04.017 [ Links ]
Burrola-Aguilar, C., Montiel, O., Garibay-Orijel, R., & Zizumbo-Villarreal, L. (2012). Conocimiento tradicional y aprovechamiento de los hongos comestibles silvestres en la region de Amanalco, Estado de México. Revista Mexicana de Micología, 35, 1-16. Retrieved from http://www.redalyc.org/pdf/883/88325120004.pdf [ Links ]
Carreño-Ruiz, S. D., Capello-García, S., Gaitán-Hernández, R., Cifuentes-Blanco, J., & Rosique-Gil, E. (2014). Crecimiento de tres hongos comestibles tropicales en medios de cultivo y residuos agrícolas. Revista Mexicana de Ciencias Agrícolas, 5(8), 1447-1458. Retrieved from http://www.scielo.org.mx/pdf/remexca/v5n8/v5n8a9.pdf [ Links ]
Cruz-Ulloa, B. S. (1995). Micorrizas un caso de simbiosis entre plantas y hongos. México: Colegio de Ciencias y Humanidades, UNAM. [ Links ]
Chegwin, C., & Nieto, I. J. (2013). Influencia del medio de cultivo en la producción de metabolitos secundarios del hongo comestible Pleurotus ostreatus cultivados por fermentación en estado líquido empleando harinas de cereal como fuente de carbono. Revista Mexicana de Micología, 37, 1-9. Retrieved from http://revistamexicanademicologia.org/wp-content/uploads/2013/06/RMM-Tr-256-version-paginada-1-9.pdf [ Links ]
Delgado, A., Villegas, M., & Cifuentes, J. (2005). Glosario ilustrado de los caracteres macroscópicos en Basidiomycetes con himenio laminar. México: UNAM. [ Links ]
Franco-Maass, S., Burrola-Aguilar, C., & Arana-Gabriel, Y. (2012). Hongos silvestres comestibles: un recurso forestal no maderable del Nevado de Toluca. México: EON. [ Links ]
Gaitán-Hernández, R. (2000). Obtención de cepas de Neolentinus suffrutescens por entrecruzamiento, su caracterización in vitro y producción de cuerpos fructíferos a nivel de planta piloto. Revista Iberoamericana de Micología, 17, 20-24. Retrieved from http://www.reviberoammicol.com/2000-17/020024.pdf [ Links ]
Gaitán-Hernández, R., & Báez-Rodríguez, I. (2008). Crecimiento micelial de cepas silvestres nativas de Lepista nuda, en medios de cultivo con diferentes suplementos orgánicos. Revista Mexicana de Micología, 26, 41-49. Retrieved from http://www.scielo.org.mx/pdf/rmm/v26/v26a7.pdf [ Links ]
Gaitán-Hernández, R., Cortés, N., & Mata, G. (2014). Improvement of yield of the edible and medicinal mushroom Lentinula edodes on wheat straw by use of supplemented spawn. Brazilian Journal of Microbiology, 45(2), 467-474. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4166270/ [ Links ]
Gaitán-Hernández, R., & Salmones, D. (2015). Uso de residuos lignocelulósicos para optimizar la producción de inóculo y la formación de carpóforos del hongo comestible Lentinula boryana. Revista Mexicana de Ciencias Agrícolas, 6(7), 1639-1652. Retrieved from http://www.scielo.org.mx/pdf/remexca/v6n7/v6n7a17.pdf [ Links ]
Garibay-Orijel, R., Cordova, J., Cifuentes, J., Valenzuela, R., Estrada-Torres, A., & Kong, A. (2009). Integrating wild mushrooms use into a model of sustainable management for indigenous community forests. Forest Ecology and Management, 258(2), 122-131. doi: 10.1016/j.foreco.2009.03.051 [ Links ]
Garibay-Orijel, R., & Ruan-Soto, F. (2014). Listado de los hongos silvestres consumidos como alimento tradicional en México. In A. Moreno-Fuentes, & R. Garibay-Orijel (Eds.), La etnomicología en México, estado del arte. México: CONACYT-UAEH-UNAM. [ Links ]
Harris, S. (2008). Branching of fungal hyphae: regulation, mechanisms and comparison with other branching systems. Mycologia, 100(6), 823-832. doi: 10.3852/08-177 [ Links ]
León-Avendaño, H., Martínez-García, R., Caballero, P., & Martínez-Carrera, D. (2013). Caracterización de dos cepas de Pleurotus djamor nativas de Oaxaca, México. Revista Mexicana de Ciencias Agrícolas, 6, 1285-1291. Retrieved from http://www.redalyc.org/pdf/2631/263128353019.pdf [ Links ]
Lin, E. S., & Chen, Y. H. (2007). Factors afecting mycelial biomass and exopolysaccharide production in submerged cultivation of Antrodia cinnamomea using complex media. Bioresource Technology, 98, 2511-2517. doi: 10.1016/j.biortech.2006.09.008 [ Links ]
Martínez-Carrera, D., Morales, P., Sobal, M., Bonilla, M., & Martínez, W. (2007). México ante la globalización en el siglo XXI: el sistema de producción consumo de los hongos comestibles. En J. E. Sánchez, D. Martínez-Carrera, G. Mata, & H. Leal (Eds.), El cultivo de setas Pleurotus spp. en México. México: ECOSUR-CONACYT. [ Links ]
Mata, G., Ortega, C., & Pérez-Merlo, R. (2011). Inóculo suplementado: evaluación de un método para optimizar la producción de inóculo para el cultivo de Pleurotus en pulpa de café. Revista Mexicana de Micología , 34, 53-61. Retrieved from http://www.scielo.org.mx/pdf/rmm/v34/v34a8.pdf [ Links ]
Mata, G., & Savoie, J. M. (1998). Extracellular enzyme activities in six Lentinula edodes strains during cultivation in wheat straw. World Journal of Microbiology & Biotecnology, 14, 513-519. doi: 10.1023/A:1008886521091 [ Links ]
Mata, G., Savoie, J. M., Delpech, P., & Olivier, J. M. (1998). Reductions of the incidence of Trichoderma spp. using substrate supplementation with peat and an alternative spawn during cultivation of Lentinula edodes on pasteurised wheat straw. Agronomie: Agriculture and Environment, 18(8-9), 515-520. Retrieved from https://hal.inria.fr/file/index/docid/885900/filename/hal-00885900.pdf [ Links ]
Mayett, Y., & Martínez-Carrera, D. (2010). El consumo de hongos comestibles y su relevancia en la seguridad alimentaria de México. In D. Martínez-Carrera, N. Curvett, M. Sobal, P. Morales, & V. M. Mora (Eds.), Hacia un desarrollo sostenible del sistema de producción-consumo de los hongos comestibles y medicinales en Latinoamérica: avances y perspectivas en el siglo XXI. Puebla, México: Red Latinoamericana de Hongos Comestibles y Medicinales-COLPOS-UNS-CONACYT-AMC, UAEM, UPAEP, IMINAP. [ Links ]
Morales, P., Sobal, M., Bonilla, M., Martínez, W., Ramírez-Carrasco, P., Tello, I., …Martínez-Carrera, D. (2010). Hongos comestibles y medicinales en México: recursos genéticos, biotecnología y desarrollo del sistema de producción-consumo. En D. Martínez-Carrera, N. Curvetto, M. Sobal, P. Morales, & V. M. Mora (Eds.), Hacia un desarrollo sostenible del sistema de producción-consumo de los hongos comestibles y medicinales en Latinoamérica: avances y perspectivas en el siglo XXI. Puebla, México: Red Latinoamericana de Hongos Comestibles y Medicinales-COLPOS-UNS-CONACYT-AMC, UAEM, UPAEP, IMINAP . [ Links ]
Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), Fondo Internacional de Desarrollo Agrícola (FIDA), & Programa Mundial de Alimentos (PMA). (2006). El estado de la inseguridad alimentaria en el mundo. Cumplimiento de los objetivos internacionales para 2015 en relación con el hambre: balance de los desiguales progresos. Roma, Italia: Autor. Retrieved from http://www.fao.org/3/a-i4646s.pdf [ Links ]
Salmones, D., Ballesteros, H., Zulueta, R., & Mata, G. (2012). Determinación de las características productivas de cepas mexicanas silvestres de Agaricus bisporus, para su potencial uso comercial. Revista Mexicana de Micología , 36, 9-15. Retrieved from http://www.scielo.org.mx/pdf/rmm/v36/v36a3.pdf [ Links ]
Sánchez-Jasso, J. M., Aguilar-Miguel, X., Medina-Castro, J. P., & Sierra-Domínguez, G. (2013). Riqueza específica de vertebrados en un bosque reforestado del Parque Nacional Nevado de Toluca, México. Revista Mexicana de Biodiversidad, 84, 360-373. doi: 10.7550/rmb.29473 [ Links ]
Sánchez, J. E., & Royse, D. (2002). La biología y el cultivo de Pleurotus spp. México: LIMUSA. [ Links ]
Santiago-Martínez, G., Estrada-Torres, A., Varela, L., & Herrera, T. (2003). Crecimiento en siete medios nutritivos y síntesis in vitro de una cepa de Laccaria bicolor. Agrociencia, 37(6), 575-584. Retrieved from http://www.colpos.mx/agrocien/Bimestral/2003/nov-dic/art-3.pdf [ Links ]
Statpoint Technologies, Inc. (2009). Statgraphics Centurion XVI. Warrenton, Virginia, USA: Author. [ Links ]
Swisher, R., & Carrol, G. C. (1980). Fluorescein diacetate hydrolysis as an estimator of microbial biomass on coniferous needle surfaces. Microbiology and Ecology, 6, 217-226. doi: 10.1007/BF02010387 [ Links ]
Torres-López, A., Quinter, J. C., & Tehortua, A. L. (2011). Efecto de nutrientes sobre la producción de biomasa del hongo medicinal Ganoderma lucidum. Revista Colombiana de Biotecnología, 13(1), 103-109. Retrieved from http://www.bdigital.unal.edu.co/25538/2/22949-79510-1-PB.pdf [ Links ]
Trigos, A., & Suárez-Medellín, J. (2010). Los hongos como alimentos funcionales y complementos alimenticios. En D. Martínez-Carrera , N. Curvetto , M. Sobal , P. Morales , & V. M. Mora (Eds.), Hacia un desarrollo sostenible del sistema de producción-consumo de los hongos comestibles y medicinales en latinoamérica: avances y perspectivas en el siglo XXI. Puebla, México: Red Latinoamericana de Hongos Comestibles y Medicinales-COLPOS-UNS-CONACYT-AMC, UAEM, UPAEP, IMINAP . [ Links ]
Villegas, E. V. (2007). Evaluación del crecimiento de Lentinula edodes en medios de cultivo sólido para la producción de micelio como inóculo. Revista Colombiana de Biotecnología , 9(2), 56-63. Retrieved from http://www.redalyc.org/pdf/776/77690206.pdf [ Links ]
Recibido: 18 de Diciembre de 2016; Aprobado: 14 de Julio de 2017











 texto en
texto en 


