Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.23 no.1 Chapingo ene./abr. 2017
https://doi.org/10.5154/r.rchscfa.2015.11.051
Artículos
Producción de plántula de orégano (Lippia graveolens Kunth) por semilla en vivero para trasplante
1Universidad Autónoma Agraria Antonio Narro, Unidad Laguna. Periférico Raúl López Sánchez s/n, Valle Verde. C. P. 27059. Torreón, Coahuila, México.
2Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Centro Nacional de Investigación Disciplinaria en Relación Agua, Suelo, Planta, Atmósfera (CENID RASPA). km 6.5 Margen Derecha Canal Sacramento. C. P. 35140. Gómez Palacio, Durango, México.
La producción de orégano en vivero es una opción para la obtención de plantas de buena calidad para trasplante. El propósito del presente estudio fue evaluar el efecto de cinco sustratos y cinco contenedores en el crecimiento y calidad de la planta de orégano. Los sustratos fueron: mezcla comercial BM2 (turba, perlita y vermiculita, 80:10:10), BM2 + arena de río (1:1), BM2 + arena de río (1.5:1), BM2 + perlita + vermiculita (1:1:1) y mezcla de composta + arena de río (1.5:1). Los contenedores incluyeron charolas de poliestireno expandido (PE) de 200, 128 y 76 cavidades, vaso de PE de 250 cm3 y bolsa de plástico negro de 712 cm3 (calibre 150 μm). Se usó un diseño experimental de bloques al azar con arreglo factorial, con cuatro repeticiones por tratamiento. Los sustratos y el tipo de contenedor afectaron el crecimiento y calidad de la planta. Se observó mayor crecimiento de la planta y mayor área foliar en la combinación bolsa y sustrato BM2. Este mismo sustrato y el contenedor bolsa promovieron el índice de calidad de Dickson más alto. La relación peso seco del vástago y peso seco de la raíz fue mayor en los contenedores de mayor volumen.
Palabras clave: Sustrato; contenedor; peso seco de vástago y raíz.
The production of oregano plants in nursery is an option for the production of high quality transplanting plants. The purpose of this study was to evaluate the effect of five growing media mixtures and five types of containers on the growth and quality of oregano plants. The growing media mixtures consisted of the commercial mixture BM2 (peat moss, perlite and vermiculite 80:10:10), BM2 with river sand (1:1), BM2 with river sand (1.5:1), BM2 with perlite and vermiculite (1:1:1) and a mixture of compost with river sand (1.5:1). The containers included expanded polystyrene trays of 200, 128 and 76 cavities, 250-mL polystyrene pots and 712-mL black plastic bags (caliber 150 μm). A randomized complete block design with factorial arrangement of treatment with four replications per treatment was used. The growing media and the type of container affected the growth and quality of the plant. Higher plant growth and higher leaf area was observed in the combination of bag and growing medium BM2, which led to the highest Dickson quality index. Shoot and root dry weight ratio was higher in larger volume containers.
Keywords: Growing media; container; dry weight of stem and root.
Introducción
El orégano (Lippia graveolens Kunth) es una especie nativa de las zonas áridas de México, donde se recolecta y se comercializa para generar ingresos a las familias de esas zonas; es una especie aromática con gran potencial económico, ya que tiene demanda a nivel internacional por sus usos en la industria farmacéutica y cosmética (Pascual, Slowing, Carretero, Sánchez, & Villar, 2001; Silva, 2003). El orégano se ha estudiado y probado como conservador de alimentos, anticancerígeno, plaguicida y antimicrobiano (Machado et al., 2010; Martínez-Rocha, Puga, Hernández-Sandoval, Loarca- Piña, & Mendoza, 2008; Zheng & Wang, 2001). También se ha estudiado la composición química del tallo por su contenido importante de flavonoides que pueden contribuir al desarrollo de nuevos compuestos con aplicaciones en la agronomía y medicina (González-Güereca, Soto, Kite, & Martínez, 2007), lo cual le da aún más importancia a la planta.
México es uno de los países con mayor producción de orégano seco en el mundo; en Huerta, 1997, reportó que la producción era de 4,000 t∙año-1 y que el país era uno de los mayores exportadores, superado sólo por Turquía. Debido a que la especie se recolecta en áreas naturales, no se lleva un control en las estadísticas de la producción y no se cuenta con datos más recientes. No obstante, el orégano mexicano es considerado el de más alta calidad, debido a la composición química de sus aceites esenciales, lo cual ha impulsado la comercialización en los últimos años (Comisión Nacional Forestal [CONAFOR], 2007). La mayor parte de la producción de orégano en México proviene de poblaciones silvestres ubicadas en zonas con precipitación baja y temperaturas altas. Esto aunado a que la recolección se hace durante la época de floración hace que la tasa de regeneración natural de la planta sea lenta. Por esto, se requiere de programas de reforestación que garanticen la permanencia del orégano en su hábitat natural.
El orégano puede ser un cultivo alternativo en las regiones con baja disponibilidad de agua para riego. Por ser una especie nativa de las regiones áridas, los requerimientos hídricos son bajos (Villa-Castorena, Catalán-Valencia, Arreola-Ávila, Inzunza-Ibarra, & Román-Lopez, 2011); sin embargo, la siembra de orégano en campo de forma directa tiene baja probabilidad de éxito, debido principalmente a que la semilla es muy pequeña, tiene bajo porcentaje de germinación y la plántula en sus etapas tempranas es muy frágil, para soportar las prácticas de cultivo. Esto trae como consecuencia una baja densidad de población, lo cual se refleja en una cosecha reducida. La producción de plántula de orégano en forma masiva en vivero es una opción para obtener plantas de buena calidad con un sistema radicular bien desarrollado y tallos fuertes.
Esto permite que la planta tenga una buena adaptación y establecimiento en campo cuando sea trasplantada.
El sustrato y el tipo de contenedor son dos factores muy importantes en la producción de plántulas en vivero. Estos definen el crecimiento y desarrollo tanto de la raíz como de la parte aérea. Al seleccionar un sustrato debe tenerse en cuenta sus propiedades físicas y químicas, las cuales determinan la disponibilidad de agua y oxígeno, la movilidad del agua, la facilidad de penetración de la raíz y la absorción de nutrientes (Abad, Martínez, & Martínez, 1993; Cremades, 2005). Un sustrato debe propiciar un buen crecimiento de las plántulas dentro del espacio limitado del contenedor. Es por esto que los estudios referentes a la respuesta del crecimiento de las plántulas de orégano para trasplante a diferentes tipos de sustrato y contenedor son relevantes; además, el conocimiento de estos factores ayuda a realizar una mejor planeación del vivero, ya que se puede determinar el espacio necesario para la producción de plántulas, así como los costos necesarios para esta actividad. Tomando en cuenta lo anterior, en el presente trabajo se evaluó el efecto del tipo de sustrato y contenedor en el crecimiento y calidad de plántulas de orégano, cultivadas bajo condiciones de vivero.
Materiales y métodos
El trabajo se desarrolló en un invernadero con cubierta de policarbonato en sus lados lateral y frontal y polietileno en el techo, así como extractores para ventilación. El invernadero está ubicado a 25° 30’ LN - 103° 42’ LO y a una altura de 1,135 m, en el campo experimental del CENID RASPA INIFAP en Gómez Palacio, Durango. La temperatura máxima y mínima dentro del invernadero variaron desde 28.3 a 39.3 °C y 15.6 a 22.5 °C, respectivamente, mientras que la humedad relativa osciló entre 32 y 85 %.
Se evaluaron cinco sustratos y cinco contenedores para la producción de orégano en vivero. Los sustratos fueron: S1 = mezcla comercial BM2 (turba + perlita + vermiculita, 80:10:10), S2 = mezcla BM2 + arena de río (1:1), S3 = mezcla de BM2 + arena de río (1.5:1), S4 = mezcla de BM2 + vermiculita + perlita (1:1:1) y S5 = mezcla de composta + arena (1.5:1); las proporciones se hicieron con base en el volumen. La densidad aparente y la capacidad de retención de humedad de cada sustrato se presentan en el Cuadro 1. Los contenedores evaluados fueron: charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro (PN) calibre 150 μm de 10 x 15 cm y volumen de 712 cm3.
Cuadro 1 Propiedades físicas de los sustratos evaluados para la producción de orégano (Lippia graveolens) en vivero.
| Sustrato | Densidad aparente (g∙cm-3) | Capacidad de retención de humedad (cm3∙cm-3) |
| Mezcla BM2 | 0.08 | 0.75 |
| Mezcla BM2 + arena (1:1) | 0.80 | 0.43 |
| Mezcla BM2 + arena (1.5:1) | 0.60 | 0.49 |
| Mezcla BM2 + perlita + vermiculita (1:1:1) | 0.16 | 0.46 |
| Composta + arena (1.5:1) | 1.03 | 0.40 |
BM2: Turba + perlita + vermiculita (80:10:10).
Se usó un diseño experimental de bloques al azar con arreglo factorial 5 x 5, con cuatro repeticiones por tratamiento. El factor A comprendió a los tipos de sustratos mientras que el factor B incluyó al tipo de contenedor. La combinación de ambos factores dio un total de 25 tratamientos (Cuadro 2). La parcela experimental consistió en dos charolas de cada tipo (200, 128 y 72 cavidades), 10 vasos y 10 bolsas.
Cuadro 2 Tratamientos resultantes de la combinación tipo de sustrato y tipo de contenedor, para la producción de orégano (Lippia graveolens) en vivero.
| Tratamiento | Sustrato | Contenedor |
| T1 | Mezcla BM2 (S1) | CH200 (C1) |
| T2 | Mezcla BM2 (S1) | CH128 (C2) |
| T3 | Mezcla BM2 (S1) | CH72 (C3) |
| T4 | Mezcla BM2 (S1) | VASO (C4) |
| T5 | Mezcla BM2 (S1) | BOLSA (C5) |
| T6 | Mezcla BM2 + Arena 1:1 (S2) | CH200 (C1) |
| T7 | Mezcla BM2 + Arena 1:1 (S2) | CH128 (C2) |
| T8 | Mezcla BM2 + Arena 1:1 (S2) | CH72 (C3) |
| T9 | Mezcla BM2 + Arena 1:1 (S2) | VASO (C4) |
| T10 | Mezcla BM2 + Arena 1:1 (S2) | BOLSA (C5) |
| T11 | Mezcla BM2 + Arena 1.5:1 (S3) | CH200 (C1) |
| T12 | Mezcla BM2 + Arena 1.5:1 (S3) | CH128 (C2) |
| T13 | Mezcla BM2 + Arena 1.5:1 (S3) | CH72 (C3) |
| T14 | Mezcla BM2 + Arena 1.5:1 (S3) | VASO (C4) |
| T15 | Mezcla BM2 + Arena 1.5:1 (S3) | BOLSA (C5) |
| T16 | Mezcla BM2 + perlita + vermiculita 1:1:1 (S4) | CH200 (C1) |
| T17 | Mezcla BM2 + perlita + vermiculita 1:1:1 (S4) | CH128 (C2) |
| T18 | Mezcla BM2 + perlita + vermiculita 1:1:1 (S4) | CH72 (C3) |
| T19 | Mezcla BM2 + perlita + vermiculita 1:1:1 (S4) | VASO (C4) |
| T20 | Mezcla BM2 + perlita + vermiculita 1:1:1 (S4) | BOLSA (C5) |
| T21 | Composta + Arena 1.5:1 (S5) | CH200 (C1) |
| T22 | Composta + Arena 1.5:1 (S5) | CH128 (C2) |
| T23 | Composta + Arena 1.5:1 (S5) | CH72 (C3) |
| T24 | Composta + Arena 1.5:1 (S5) | VASO (C4) |
| T25 | Composta + Arena 1.5:1 (S5) | BOLSA (C5) |
BM2: Turba + perlita + vermiculita (80:10:10). Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro, calibre 150 μm de 10 x 15 cm y volumen de 712 cm3
Las semillas se desinfectaron con una solución clorada al 5 % por 60 s, se enjuagaron con agua destilada y después se trataron con una solución de ácido giberélico a una concentración de 250 mg∙L-1 de agua y un tiempo de inmersión de 12 h. Previo a la siembra, los sustratos se prepararon en las proporciones correspondientes a cada tratamiento, se mezclaron con una pala y se humedecieron. Posteriormente, los contenedores se llenaron y se sembraron tres semillas en cada cavidad; después de la emergencia, las plántulas se desahijaron dejando sólo una.
Las plántulas se regaron con agua hasta la aparición de las primeras hojas verdaderas. Desde ese momento y hasta los 45 días después de la emergencia (dde), las plántulas se regaron con una solución nutrimental a una concentración de 20-40-30 mg∙L-1 de N, P y K, respectivamente. Después de los 45 y hasta los 90 dde, la concentración de la solución se cambió a 60- 80-90. Esta solución se preparó con agua de pozo y fertilizantes solubles. La aportación de nutrientes del agua de riego se consideró en la formulación de la solución nutrimental. La solución nutrimental se preparó con los fertilizantes comerciales monofosfato de potasio, nitrato de potasio y nitrato de amonio. También se usó ácido fosfórico para regular el pH de la solución a 6.5. Los riegos se hicieron cada dos o tres días según la edad de la planta y las condiciones de humedad en las charolas, lo cual estuvo influenciado por la temperatura y humedad en el invernadero; los riegos se aplicaron con un sistema de microaspersión tipo nebulizador.
A los 110 días después de la siembra (dds), cinco plantas se seleccionaron en cada tratamiento y repetición, para medir la altura de la planta, el área foliar y el diámetro del tallo. La altura se midió desde la base del tallo hasta el punto de crecimiento de la planta con una regla graduada, y el diámetro se registró en la base del tallo con un vernier digital (Auto Tec, Charlottre, NC, USA). Todas las hojas de cada planta (sin pecíolo) se cortaron y se midieron con un integrador de área foliar (LI-COR 3500, Lincoln, Nebraska, USA). Además de lo anterior, el peso seco de la parte aérea (vástago) y peso seco de la raíz se obtuvieron mediante el secado de las hojas (incluyendo el pecíolo), tallo y raíz en estufa de aire forzado a 68 °C por 48 h. La suma del peso seco de las hojas y del tallo dio como resultado el peso seco del vástago. Los índices morfológicos relación entre el peso seco de la parte aérea y peso seco de raíces, y el índice de calidad de Dickson (ICD) también se calcularon (Olivo & Buduba, 2006). Este último se estimó mediante la siguiente relación:
donde:
PT |
Peso total de la planta (g) |
AP |
Altura de la planta (cm) |
PSV |
Peso seco del vástago (g) |
PSR |
Peso seco de la raíz (g) |
D |
Diámetro del cuello de la raíz (mm) |
Los datos se analizaron mediante un análisis de varianza acorde con el diseño experimental usado. Cuando los factores estudiados y la interacción de ellos fueron significativos (P ≤ 0.05), se hizo la comparación de medias mediante la prueba de Tukey (P = 0.05). Los análisis se hicieron con el paquete estadístico SAS versión 9.0 (Statistical Analysis System [SAS Institute], 2002).
Resultados y discusión
Altura de la planta Lippia graveolens
El análisis de varianza de la altura de la planta (AP) indicó que los efectos del tipo de contenedor, sustrato y la interacción de ambos factores fueron significativos (P ≤ 0.01). La Figura 1 muestra la comparación gráfica en la altura de la planta, como resultado de la interacción sustrato-contenedor. Las plantas más altas, en cada sustrato estudiado, se produjeron en el contenedor en bolsa, excepto en el S5. Las combinaciones bolsa con S1 y S2 tuvieron un efecto estadísticamente similar en la AP; en promedio, las plantas midieron 23.4 cm y fueron superiores al resto de las combinaciones. El contenedor CH128 en combinación con todos los sustratos, excepto con el S1, produjo las plantas más pequeñas con sólo 25 % de la AP de las mejores combinaciones.
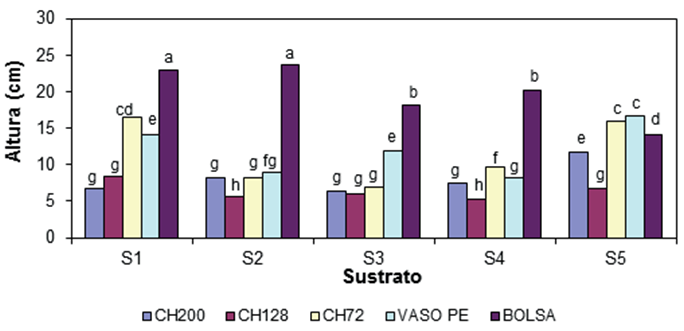
Figura 1 Interacción del sustrato y tipo de contenedor en la altura de la planta de orégano (Lippia graveolens) a los 110 días después de la siembra. S1 = Mezcla BM2 (turba+ perlita + vermiculita [80:10:10]), S2 = BM2 + arena (1:1), S3 = BM2 + arena (1.5:1), S4 = BM2 + perlita + vermiculita (1:1:1) y S5 = Mezcla de composta + arena (1.5:1). Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro, calibre 150 μm de 10 x 15 cm y volumen de 712 cm3. Barras con letra distinta indican diferencia estadística entre medias de acuerdo con la prueba de Tukey (P = 0.05).
Área foliar de Lippia graveolens
El área foliar (AF) del orégano fue afectado significativamente (P ≤ 0.01) por el sustrato, tipo de contenedor e interacción de ambos factores. La Figura 2 muestra que la bolsa mostró mayor AF que los demás Bar-Yosef, & Kafkafi, 1990), tomate (Kemble, Davis, Gardner, & Sanders, 1994) y sandía (Liu & Latimer, 1995). Las plantas con valores altos de diámetro del tallo son mejores que aquéllas que tienen tallos menos gruesos, ya que un diámetro mayor reduce daños de acame por efecto del viento y, en consecuencia, tienen mayor adaptación al momento del trasplante.
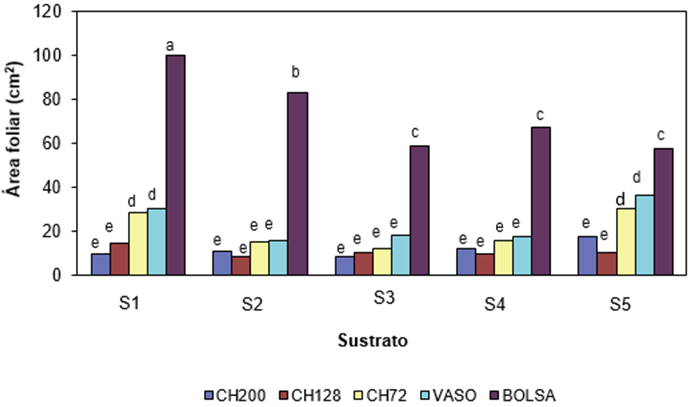
Figure 2 Interacción del sustrato y tipo de contenedor en el área foliar de orégano (Lippia graveolens) a los 110 días después de la siembra. S1 = Mezcla BM2 (turba + perlita + vermiculita [80:10:10]), S2 = BM2 + arena (1:1), S3 = BM2 + arena (1.5:1), S4 = BM2 + perlita + vermiculita (1:1:1) y S5 = Mezcla de composta + arena (1.5:1). Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro de 10 x 15 cm y volumen de 712 cm3. Barras con letra distinta indican diferencia estadística entre medias de acuerdo con la prueba de Tukey (P = 0.05).
Los sustratos S1 y S5, los cuales tuvieron mayor cantidad de materia orgánica, produjeron un diámetro de tallo promedio de 1.5 mm, 19 % superior al promedio observado en los sustratos S2 y S4, y 30 % superior al sustrato S3 (Cuadro 3).
Cuadro 3 Diámetro del tallo de orégano (Lippia graveolens) en cada sustrato y contenedor evaluado a los 110 días después de la siembra.
| Sustrato | Diámetro de tallo (mm) | Contenedor | Diámetro del tallo (mm) |
| Mezcla BM2 (S1) | 1.55 a | CH200 | 0.96 d |
| Mezcla BM2 + Arena 1:1(S2) | 1.27 bc | CH128 | 1.00 d |
| Mezcla BM2 + Arena 1.5:1(S3) | 1.15 c | CH72 | 1.21 c |
| Mezcla BM2 + vermiculita + perlita 1:1:1 (S4) | 1.25 bc | VASO | 1.42 b |
| Composta + Arena 1.5:1(S5) | 1.45 ab | BOLSA | 2.08 a |
BM2: Turba + perlita + vermiculita (80:10:10). Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro, calibre 150 μm de 10 x 15 cm y volumen de 712 cm3. Medias seguidas con la misma letra dentro de columnas no son estadísticamente diferentes de acuerdo con la prueba de Tukey (P = 0.05).
Peso seco del vástago de Lippia graveolens
Los efectos del tipo de contenedor, sustrato y la interacción entre ambos factores en el peso seco del vástago (PSV) fueron significativos (P ≤ 0.01). En cada sustrato, el mayor PSV se registró en el contenedor en bolsa, excepto en el S5 (Cuadro 4). Las combinaciones bolsa con sustrato S1 y S2 promovieron el valor más alto de PSV con un promedio entre ellas de 1.30 g. Esas combinaciones fueron superiores en 51 % a las de bolsa con S3 y S4, las cuales no fueron estadísticamente diferentes entre sí (P > 0.05) y en 223 % a la bolsa con S5. Los tratamientos S1 con CH72 y con el vaso, y el S5 con CH72, vaso y bolsa no fueron estadísticamente diferentes entre ellos (P = 0.05), presentaron sólo 37 % del PSV registrado en los mejores tratamientos. El resto de las combinaciones tuvo un promedio de 0.16 g de PSV que representa sólo 13 % del observado en los mejores tratamientos (Cuadro 4).
Cuadro 4 Peso seco del vástago (PSV) y de la raíz (PSR) de orégano (Lippia graveolens) a los 110 días después de la siembra.
| Sustrato | Contenedor | PSV | PSR |
| Mezcla BM2 (S1) | CH200 | 0.125 d | 0.055 d |
| Mezcla BM2 (S1) | CH128 | 0.224 d | 0.099 d |
| Mezcla BM2 (S1) | CH72 | 0.404 c | 0.178 cd |
| Mezcla BM2 (S1) | POT / VASO | 0.479 c | 0.227 c |
| Mezcla BM2 (S1) | BAG / BOLSA | 1.428 a | 0.657 a |
| BM2 + Arena 1:1 (S2) | CH200 | 0.143 d | 0.075 d |
| BM2 + Arena 1:1 (S2) | CH128 | 0.116 d | 0.057 d |
| BM2 + Arena 1:1 (S2) | CH72 | 0.193 d | 0.087 d |
| BM2 + Arena 1:1 (S2) | VASO | 0.258 d | 0.141 d |
| BM2 + Arena 1:1 (S2) | BOLSA | 1.184 a | 0.582 a |
| BM2 + Arena 1.5:1 (S3) | CH200 | 0.100 d | 0.053 d |
| BM2 + Arena 1.5:1 (S3) | CH128 | 0.108 d | 0.066 d |
| BM2 + Arena 1.5:1 (S3) | CH72 | 0.164 d | 0.071 d |
| BM2 + Arena 1.5:1 (S3) | VASO | 0.215 d | 0.109 d |
| BM2 + Arena 1.5:1 (S3) | BOLSA | 0.795 b | 0.418 b |
| BM2 + perlita + vermiculita 1:1:1 (S4) | CH200 | 0.150 d | 0.070 d |
| BM2 + perlita + vermiculita 1:1:1 (S4) | CH128 | 0.103 d | 0.060 d |
| BM2 + perlita + vermiculita 1:1:1 (S4) | CH72 | 0.230 d | 0.100 d |
| BM2 + perlita + vermiculita 1:1:1 (S4) | VASO | 0.230 d | 0.114 d |
| BM2 + perlita + vermiculita 1:1:1 (S4) | BOLSA | 0.931 b | 0.506 b |
| Composta + Arena 1.5:1 (S5) | CH200 | 0.247 d | 0.088 d |
| Composta + Arena 1.5:1 (S5) | CH128 | 0.184 d | 0.098 d |
| Composta + Arena 1.5:1 (S5) | CH72 | 0.439 c | 0.218 c |
| Composta + Arena 1.5:1 (S5) | VASO | 0.529 c | 0.292 c |
| Composta + Arena 1.5:1 (S5) | BOLSA | 0.581 c | 0.289 c |
BM2: Turba + perlita + vermiculita (80:10:10). Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro, calibre 150 μm de 10 x 15 cm y volumen de 712 cm3. Medias seguidas con la misma letra dentro de columnas no son estadísticamente diferentes de acuerdo con la prueba de Tukey (P = 0.05).
Peso seco de la raíz de Lippia graveolens
El peso seco de la raíz (PSR) fue afectado en forma significativa (P ≤ 0.01) por el sustrato, tipo de contenedor y la interacción de ambos factores. En cada sustrato, la bolsa promovió un mayor PSR con respecto a los demás contenedores, excepto en el sustrato S5, donde la bolsa, el vaso y la CH72 mostraron una biomasa de raíces similar (Cuadro 4). Las combinaciones bolsa con sustratos S1 y S2, las cuales mostraron un PSR similar (P > 0.05), produjeron el valor más alto con un promedio de 0.62 g; las bolsas con S3 y con S4 tuvieron, en promedio, 33 % menos de PSR. Las combinaciones S1 con vaso, y el S5 con CH72, vaso y bolsa tuvieron 59 % menos de PSR, mientras que el resto de las combinaciones tuvieron PSR inferior en 86 %.
Los resultados anteriores muestran que el mayor volumen de sustrato que se tuvo en la bolsa afectó de manera positiva el crecimiento de la raíz, lo cual puede deberse a que en ese contenedor se tiene una mayor reserva de agua y nutrientes. Al respecto, Van Iersel (1997) reportó que el peso seco de la raíz de salvia incrementó en forma lineal con el volumen del contenedor. También los resultados indican que las mezclas de sustratos interfirieron de manera diferente en el crecimiento de la raíz. Esto se debe a que cada uno de ellos proporciona diferentes condiciones de aireación y almacenamiento de humedad y, por consiguiente, diferente almacenamiento de nutrientes, a causa de la aplicación de la solución nutrimental, lo cual influye en el desarrollo de la raíz.
Relación entre el peso seco del vástago y peso seco de la raíz (PSV ⁄PSR)
Uno de los indicadores de la calidad de plántula para trasplante producida en vivero es el cociente del peso seco de la parte aérea (PSV) entre el peso seco de raíz (PSR). Esta relación fue afectada en forma significativa (P < 0.01) por el contenedor, pero no por el sustrato ni la interacción entre contenedores y sustratos. De acuerdo con el Cuadro 5, el valor más alto se registró en CH200, lo cual indica que el contenedor de menor volumen afectó más el crecimiento de la raíz que el de la parte aérea. Por otra parte, el valor más pequeño de PSV/PSR se registró en los contenedores de vaso, CH128 y bolsa.
Cuadro 5 Relación entre el peso seco del vástago (PSV) y peso seco de la raíz (PSR) de orégano (Lippia graveolens) a los 110 días después de la siembra.
| Contenedor | PSV / PSR |
| CH200 | 2.66 a |
| CH128 | 1.53 c |
| CH72 | 2.16 b |
| VASO | 1.20 c |
| BOLSA | 1.71 c |
Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro, calibre 150 μm de 10 x 15 cm y volumen de 712 cm3. Medias seguidas con la misma letra dentro de columnas no son estadísticamente diferentes de acuerdo con la prueba de Tukey (P = 0.05).
De manera general, a menor relación PSV⁄PSR se tiene una mejor calidad en la planta. Cuando el PSR es elevado, la supervivencia en campo al momento del trasplante es más alta, ya que la mayor cantidad de raíces garantiza mejor absorción de agua y nutrientes que favorecen el crecimiento de la planta. También las plantas con menor PSV⁄PSR pueden mantener un mejor estado hídrico con un consumo más moderado de agua en situaciones de deficiencia hídrica (Leiva & Fernández- Alés, 1998; Stewart & Bernier, 1995). Las plantas con valores de PSV/PSR arriba de 2.5, como es el caso de las desarrolladas en el contenedor CH200, deberían de establecerse en condiciones ambientales favorables o donde exista la posibilidad de aplicar riegos durante la fase de establecimiento (Haase & Rose, 1993).
Índice de calidad de Dickson de Lippia graveolens
Con respecto al ICD existe diferencia estadística significativa (P < 0.01) entre los sustratos y contenedores, pero no hubo interacción de ambos factores (P > 0.05). El sustrato S1 produjo plantas con el valor más alto de ICD, mientras que la bolsa lo hizo dentro de los contenedores (Cuadro 6). A mayor valor del ICD resulta una mejor calidad de planta (Sáenz, Villaseñor, Muñoz, Rueda, & Prieto, 2010); esto implica que el desarrollo es grande y que, al mismo tiempo, las fracciones de la parte aérea y radical están equilibradas y, por tanto, las plantas tendrán mayor probabilidad de éxito en el campo.
Cuadro 6 Índice de calidad de Dickson (ICD) de orégano (Lippia graveolens) a los 110 días después de la siembra.
| Sustrato | ICD | Contenedor | ICD |
| Mezcla BM2 (S1) | 0.067 a | CH200 | 0.020 c |
| Mezcla BM2 + Arena 1:1 (S2) | 0.047 c | CH128 | 0.026 c |
| Mezcla BM2 + Arena 1.5:1 (S3) | 0.040 c | CH72 | 0.035 bc |
| Mezcla BM2 + vermiculita + perlita 1:1:1 (S4) | 0.045 c | Pot | 0.048 b |
| Composta + Arena 1.5:1 (S5) | 0.053 b | Bag | 0.124 a |
BM2: Turba + perlita + vermiculita (80:10:10). Contenedores: Charolas de poliestireno expandido (PE) de 200 (CH200), 128 (CH128) y 72 (CH72) cavidades, con volumen de 16, 28 y 74 cm3, respectivamente; vaso de PE de 250 cm3; y bolsa de plástico negro, calibre 150 μm de 10 x 15 cm y volumen de 712 cm3. Medias seguidas con la misma letra dentro de columnas no son estadísticamente diferentes de acuerdo con la prueba de Tukey (P = 0.05).
Conclusiones
Los sustratos y tipos de contenedores evaluados afectaron de manera definitiva el crecimiento y calidad de la planta de orégano. La combinación bolsa y sustrato S1 (BM2 = Turba, perlita y vermiculita [80:10:10]) produjo plantas de mayor altura, área foliar, peso seco del vástago y peso seco de raíz. Los sustratos S1 y S5 (mezcla de composta con arena, 1.5:1) promovieron tallos más gruesos, al igual que el contenedor bolsa de plástico negro (calibre 150 μm de 10 x 15 cm). También el sustrato S1 y el contenedor bolsa produjeron el índice de calidad de Dickson más alto. Por otra parte, los contenedores de mayor volumen (CH128, vaso y bolsa) mostraron la mayor relación del peso seco del vástago y peso seco de la raíz. Con la información generada y el conocimiento de la cantidad de plantas requeridas es posible definir las dimensiones del vivero, así como las prácticas de manejo para la producción masiva de plantas, ya sea para reforestar áreas naturales o para el establecimiento como cultivo.
References
Abad, M., Martínez, G. P. F., & Martínez, H. M. D. (1993). Evaluación agronómica de los sustratos de cultivo. Actas de Horticultura, 11, 141-154. [ Links ]
Bar-Tal, A., Bar-Yosef, B., & Kafkafi, U. (1990). Pepper transplant response to root volume and nutrition in the nursery. Agronomy Journal, 82, 989-995. doi: 10.2134/agronj1990.00021962008200050030x [ Links ]
Comisión Nacional Forestal (CONAFOR). (2007). Orégano mexicano, oro verde del desierto. Revista electrónica de la Comisión Nacional Forestal, 54, 1. Retrieved from http://www.mexicoforestal.gob.mx/nuestros_arboles.php?id=29 [ Links ]
Cremades, M. M. (2005). Factores implicados en el desarrollo de la plántula: Sustratos. En G. I. M Cuadrado, G. M. del C. García, & F. Ma. M. Fernández (Eds.), Dirección técnica de semilleros hortícolas. Curso de especialización (pp. 91-113). Almería, España: Fundación para la Investigación Agraria en la Provincia de Almería. [ Links ]
González-Güereca, M. C., Soto, H. M., Kite, G., & Martínez, V. M. (2007). Actividad antioxidante de flavonoides del tallo de orégano mexicano (Lippia graveolens H.B.K. var. berlandieri Schauer.) en el estado de Durango. Revista Fitotecnia Mexicana, 30, 43-49. Retrieved from http://www.redalyc.org/pdf/610/61030106.pdf [ Links ]
Haase, L. D., & Rose, R. (1993). Soil moisture stress induces transplant shock in stored and unstored 2+0 Douglas fir seedlings of varying root volumes. Forest Science, 39, 275-294. Retrieved from http://www.researchgate.net/publication/233558668 [ Links ]
Huerta, C. (1997). Orégano mexicano: Oro vegetal. Biodiversitas, 15, 8-13. Retrieved from http://www.biodiversidad.gob.mx/Biodiversitas/Articulos/biodiv15art2.pdf [ Links ]
Kemble, J. M., Davis, J. M., Gardner, R. G., & Sanders, D. C. (1994). Root cell volume affects growth of compact-growth-habit tomato transplants. HortScience, 29, 261-262. Retrieved from http://hortsci.ashspublications.org/content/29/4/261.full.pdf+html [ Links ]
Kramer, P. J., & Boyer, J. S. (1995). Water relations of plant and soils. New York, USA: Academic Press. Retrieved from http://udspace.udel.edu/handle/19716/2830 [ Links ]
Leiva, M. J., & Fernández-Alés, R. (1998). Variability in seedling water status during drought within a Quercus ilex subsp. ballota population, and its relation to seedling morphology. Forest Ecology and Management, 111, 147- 156. doi: 10.1016/S0378-1127(98)00320-X [ Links ]
Liu, A., & Latimer, J. G. (1995). Root cell volume in the planter flat affects watermelon seedling development and fruit yield. HortScience, 30, 242-246. Retrieved from http://www.researchgate.net/publication/277738624 [ Links ]
Machado, M., Dinis, A. M., Salguerio, L., Cavaleiro, C., Custódio, J. B. A., & Sousa, M. D. C. (2010). Anti-Giardia activity of phenolic-rich essential oils: Effects of Thymbra capitata, Origanum virens, Thymus zygis subsp. sylvestris, and Lippia graveolens on trophozoites growth, viability, adherence, and ultrastructure. Parasitology Resources, 106, 1205-1215. doi: 10.1007/s00436-010-1800-7 [ Links ]
Martínez-Rocha, A., Puga, R., Hernández-Sandoval, L., Loarca-Piña, G., & Mendoza, S. (2008). Antioxidant and antimutagenic activities of Mexican oregano (Lippia graveolens Kunth). Plant Foods for Human Nutrition, 63, 1-5. doi: 10.1007/s11130-007-0061-9 [ Links ]
Olivo, B. V., & Buduba, G. C. (2006). Influencia de seis sustratos en el crecimiento de Pinus ponderosa producido en contenedores bajo condiciones de invernáculo. Bosque, 27, 267-271. Retrieved from http://mingaonline.uach.cl/scielo.php?pid=S0717-92002006000300007&script=sci_arttext [ Links ]
Pascual, M. E., Slowing, K., Carretero, E., Sánchez-Mata, D., & Villar, A. (2001). Lippia: Traditional uses, chemistry and pharmacology: a review. Journal of Ethnopharmacology, 76, 201-214. doi: 10.1016/S0378-8741(01)00234-3 [ Links ]
Romano, D., Paratore, A., & Rosi, A. L. (2003). Plant density and container cell volume on Solanaceus seedling growth. Acta Horticulturae, 614, 247-253. doi: 10.17660/ActaHortic.2003.614.36 [ Links ]
Sáenz, R. J. T., Villaseñor, R. F. J., Muñoz, F. H. J., Rueda, S. A., & Prieto, R. J. A. (2010). Calidad de planta en viveros forestales de clima templado en Michoacán. Michoacán, México: SAGARPA-INIFAP-CIRPAC-Campo Experimental Uruapan. [ Links ]
Silva, V. S. (2003). El orégano (Los nuevos caminos de la agricultura). Chihuahua, México: CONAZA-CIRENA. [ Links ]
Statistical Analysis System, Institute Inc. (SAS). (2002). Statistical Analysis System, v.9. Cary, N. C. USA: Author. [ Links ]
Steudle, E. (2000). Water uptake by roots: Effects of water deficit. Journal of Experimental Botany, 51, 1531-1542. doi: 10.1093/jexbot/51.350.1531 [ Links ]
Stewart, J. D., & Bernier, P. Y. (1995). Gas exchange and water relations of three sizes of containerized Picea mariana seedlings subjected to atmospheric and edaphic water stress under controlled conditions. Annales des Sciences Forestières, 52, 1-9. Retrieved from https://hal.archives-ouvertes.fr/hal-00882975/document [ Links ]
Van Iersel, M. (1997). Root restriction effects on growth and development of salvia (Salvia splendens). HortScience, 32, 1186-1190. Retrieved from http://hortsci.ashspublications.org/content/32/7/1186.full.pdf+html [ Links ]
Villa-Castorena, M., Catalán-Valencia, E. A., Arreola-Ávila, J. G., Inzunza-Ibarra, M. A., & Román-López, A. (2011). Influencia de la frecuencia del riego en el crecimiento de orégano (Lippia graveolens HKB). Revista Chapingo Serie Ciencias Forestales y del Ambiente, 17, 183-193. doi: 10.5154/r.rchscfa.2010.10.088 [ Links ]
Zheng, W., & Wang, S. J. (2001). Antioxidant activity and phenolic compounds in selected herbs. Journal of Agricultural and Food Chemistry, 49, 5165-5170. Retrieved from http://tilia.zf.mendelu.cz/ustavy/553/dzi/www/data/10_antio.pdf [ Links ]
Recibido: 16 de Noviembre de 2015; Aprobado: 18 de Octubre de 2016











 texto en
texto en 


