Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.22 no.3 Chapingo sep./dic. 2016
https://doi.org/10.5154/r.rchscfa.2015.05.024
Articulo Cientifico
Actividad de rizobacterias de Jatropha curcas contra Fusarium verticillioides y Leptoglossus zonatus
1Instituto Politécnico Nacional, Departamento de Interacciones Planta-Insecto, Centro de Desarrollo de Productos Bióticos. Carretera Yautepec-Jojutla km 6, calle CEPROBI núm. 8, col. San Isidro. C. P. 62731, Apartado Postal 24. Yautepec, Morelos, México.
El centro de origen y domesticación de Jatropha curcas L. es México. Este cultivo puede ser afectado por diversos hongos fitopatógenos y plagas insectiles que disminuyen la calidad de las semillas. El objetivo de este estudio fue evaluar la actividad antagonista y entomopatógena de bacterias rizosféricas (Bacillus subtilis, B. mojavensis, B. thuringiensis y Lysinibacillus sphaericus) contra Fusarium verticillioides y Leptoglossus zonatus. La actividad antagonista de las rizobacterias se evaluó contra F. verticillioides mediante la técnica de cultivo dual en papa dextrosa agar. Además, se evaluó el efecto de B. thuringiensis y L.sphaericus en la mortalidad y desarrollo de L. zonatus. Los resultados demostraron que las rizobacterias inhibieron el crecimiento micelial (26 a 55 %) y afectaron la morfología hifal de F. verticillioides con independencia del medio y tiempo de cultivo probados. Los mayores porcentajes de inhibición lo causaron B. mojavensis (40.4 a 54 %), L. sphaericus (39.6 a 55 %) y B. subtilis (38.5 a 50 %). Por otra parte, B. thuringiensis y L. sphaericus no mostraron actividad entomopatógena, pues no afectaron la mortalidad ni el desarrollo de L. zonatus.
Palabras clave: Actividad; antagonista; actividad; entomopatógena; Bacillus subtilis; Bacillus mojavensis; Bacillus thuringiensis; Lysinibacillus sphaericus
The center of origin and domestication of Jatropha curcas L. is Mexico. This crop can be affected by several phytopathogenic fungi and insect pests that diminish the Tquality of the seeds. The aim of this study was to evaluate the antagonistic and enthomopathogenic activity of rhizospheric bacteria (B. subtilis, B. mojavensis, B. thuringiensis and Lysinibacillus sphaericus) against Fusarium verticillioides and Leptoglossus zonatus. The antagonistic activity of rhizobacteria was evaluated against F. verticillioides by dual culture technique on potato dextrose agar. Moreover, the effect of B. thuringiensis and L. sphaericus was evaluated on the mortality and development of L. zonatus. The results demonstrated that rhizobacteria inhibited the mycelial growth (26 to 55 %) and affected the hyphal morphology of F. verticillioides regardless of the culture medium and cultivation time tested. B. mojavensis(40.4 to 54 %), L. sphaericus (39.6 to 55 %) and B. subtilis (38.5 to 50%) caused the highest percentages of inhibition. On the other hand, B. thuringiensis and L. sphaericus showed no enthomopathogenic activity because they did not affect the mortality or development of L. zonatus.
Keywords: Antagonistic activity; entomopathogenic activity; Bacillus subtilis; Bacillus mojavensis; Bacillus thuringiensis; Lysinibacillus sphaericus.
Introducción
Jatropha curcas L. es una planta de la familia Euphorbiaceae; el centro de origen y domesticación es México (Dias, Missio, & Dias, 2012). Las plantaciones de J. curcas se distribuyen en las regiones tropicales de América, África y Asia. En los últimos años, la especie ha tenido mayor atención debido a su potencial para la producción de biodiesel (Basili & Fontini, 2012); reforestación de suelos tropicales poco fértiles (Fresnedo-Ramírez & Orozco-Ramírez, 2013); establecimiento de plantaciones extensas en zonas costeras cálidas, secas y marginales, para la captura de CO2 atmosférico y mitigación del cambio climático (Becker, Wulfmeyer, Berger, Gebel, & Münch, 2013); y recuperación de suelos degradados (Van Rooijen, 2014; Wani et al., 2012).
Terren et al. (2012) evidenciaron que las raíces, tallos, ramas, hojas, flores, frutos y semillas de J. curcas son afectados por insectos y hongos que causan problemas fitosanitarios. Diversas especies de insectos pertenecientes a la orden Hemiptera causan afectaciones en J. curcas. En particular, L. zonatus (Dallas) es una de las más dañinas pues provoca aborto de los frutos; reduce el tamaño, peso y contenido de aceite en semillas; y conlleva a la formación de granos vacíos (Grimm & Somarriba, 1999, Terren et al., 2012). L. zonatus se ha encontrado en plantaciones del estado de Morelos como un agente potencial de daño para el cultivo de J. curcas, porque además de causar efectos perjudiciales a los frutos, también forma heridas que facilitan la entrada de hongos fitopatógenos (Tepole-García, Pineda-Guillermo, Martínez-Herrera, & Castrejón-Gómez, 2012). Estos hongos alteran la viabilidad y calidad de semillas de J. curcas, en específico, F. verticillioides (Saccardo) Nirenberg afecta la semilla de J. curcas disminuyendo la cantidad de lípidos, contenido de ácidos grasos libres y la viabilidad de las semillas (Dharmaputra, Worang, Syarief, & Tahudin, 2009), por lo que es necesario atender las afectaciones fitosanitarias teniendo en cuenta la importancia del cultivo. Una alternativa ecológica es el uso de bacterias antagonistas provenientes de la rizósfera con potencial de control biológico de plagas y enfermedades.
Las bacterias rizosféricas producen cristales proteicos que afectan a diferentes insectos y metabolitos, enzimas líticas que inhiben el desarrollo de hongos fitopatógenos. A pesar de ello, la rizósfera de J. curcas ha sido poco estudiada, pues son escasos los trabajos que abordan el uso de bacterias antagonistas obtenidas para controlar hongos fitopatógenos (Latha et al., 2011) y no hay reportes previos del uso contra insectos plaga del cultivo. En este contexto, el objetivo del presente trabajo fue evaluar la actividad antagonista y entomopatógena de bacterias rizosféricas de J. curcas contra F. verticilloides y L. zonatus.
Materiales y métodos
Material biológico
Cepas microbianas. Las cepas empleadas en este estudio pertenecen al Laboratorio de Fitopatología del Centro de Desarrollo de Productos Bióticos del Instituto Politécnico Nacional (CEPROBI-IPN). B. subtilis (Ehrenberg) Cohn, B. mojavensis Roberts, Nakamura & Cohan, B. thuringiensis Berliner y L. sphaericus comb. nov. se aislaron de suelo rizosférico de J. curcas, y F. verticillioides, de semillas del cultivo. Las bacterias se resembraron en agar nutritivo y se conservaron a 4 °C, y el hongo en papa dextrosa agar a 28 °C.
Insectos. Las ninfas de L. zonatus se obtuvieron de una colonia mantenida a 25 °C con 60 % de humedad relativa y fotoperiodo de 12:12 en el Laboratorio de Ecología Química del CEPROBI-IPN. Los progenitores se colectaron en 2012 en un cultivo de sorgo ubicado en la colonia Diego Ruíz, municipio de Yautepec, Morelos (18° 49’ 22.85” N y 99° 06’ 13.68” O) y en una plantación experimental de J. curcas ubicada en el CEPROBI-IPN. Los insectos se identificaron con base en las claves de McPherson, Packauskas, Taylor, y O´Brien (1990).
Establecimiento de la cría de L. zonatus
Las ninfas y adultos de L. zonatus se colocaron en jaulas de acrílico (27 x 23 cm) y se llevaron al Laboratorio de Ecología Química del CEPROBI-IPN. Las ninfas y adultos se alimentaron con vainas tiernas de ejote y elote, y se les suministró agua con miel al 10 % en tubos Eppendorf (1.5 mL) perforados en la base; el alimento se cambió cada tercer día. Posterior al apareamiento, los insectos se aislaron para la obtención de los huevecillos, los cuales se contaron y separaron hasta la emergencia de las ninfas. Éstas se seleccionaron en el cuarto y quinto estado ninfal para los bioensayos posteriores.
Cinéticas de crecimiento bacteriano
El inóculo bacteriano (B. subtilis, B. mojavensis, B. thuringiensis y L. sphaericus) se obtuvo mediante una asada de la cepa que se colocó en 50 mL de caldo nutritivo y se incubó en agitación (150 rpm) a 28 °C durante 12 h.
Cinética en medio caldo nutritivo. Una alícuota de 0.5 mL de inóculo de cada cepa bacteriana se añadió en matraces que contenían 50 mL de caldo nutritivo. Los cultivos se incubaron en agitación (150 rpm) a 28 °C durante 36 h. Cada 4 h se tomaron muestras de 1 mL del cultivo bacteriano y se midió la absorbancia a una densidad óptica de 590 nm en un espectrofotómetro (Shimadzu UV-160, Japón). Con los datos obtenidos se elaboraron las gráficas de cinética de crecimiento en SigmaPlot versión 11.0 (Systat Software Inc., 2008).
Cinéticas en medio caldo nutritivo suplementado con extracto de levadura y sales (CNS). Las bacterias B. thuringiensis y L. sphaericus se cultivaron en medio CNS (caldo nutritivo más extracto de levadura al 0.05 % y solución de sales) (Dussán, Andrade, Lozano, & Vanegas, 2002). Las muestras se tomaron y procesaron como se explicó anteriormente para determinar las fases de crecimiento.
Bioensayos de antagonismo in vitro
Actividad antagonista de bacterias rizosféricas mediante cultivo dual. Las pruebas de antagonismo se realizaron utilizando el método de cultivo dual en cajas Petri con agar nutritivo. Se emplearon las bacterias rizosféricas B. subtilis, B. mojavensis, B. thuringiensis y L. sphaericus, y el hongo fitopatógeno F. verticillioides. Una asada de cultivo bacteriano (24 h) se inoculó en cuatro puntos equidistantes (1 cm2) de la caja Petri y en el centro se colocó un disco de micelio (5 mm) de F. verticillioides. El testigo constó solo de un disco de 5 mm del hongo en medio agar nutritivo. Los tratamientos se incubaron a 28 °C hasta que el micelio de F. verticillioides (testigo) llenó completamente la caja Petri. Posteriormente, el diámetro del crecimiento micelial se midió con un vernier digital para el cálculo del porcentaje de inhibición mediante la ecuación de Guo et al. (2006):
Inhibición micelial (%) = [1 - (Da /Db)] * 100 donde:
Da = Diámetro de la zona de crecimiento micelial de los tratamientos (mm)
Db = Diámetro de la zona de crecimiento micelial del testigo (mm)
Actividad antagonista de bacterias rizosféricas crecidas en caldo nutritivo. A partir de las cinéticas de crecimiento bacteriano desarrolladas en caldo nutritivo, se tomaron 5 µL de cada cepa bacteriana cultivada durante 12 y 24 h y se inoculó mediante la técnica de cultivo dual en cuatro puntos equidistantes de las cajas Petri con agar nutritivo. Los cultivos se incubaron a 28 °C hasta que el micelio del testigo llenó la caja Petri. Los datos del crecimiento micelial y porcentaje de inhibición se obtuvieron de la forma mencionada en el punto anterior.
Efecto de bacterias rizosféricas en la morfología hifal de F. verticillioides
Un disco de 5 mm de la zona de crecimiento micelial (F. verticillioides) inhibido por B. subtilis, B. mojavensis, B. thuringiensis y L. sphaericus se cortó y se colocó en un portaobjetos. El antagonismo de las rizobacterias en cultivo dual en cajas Petri con agar nutritivo se determinó mediante una tinción con azul de algodón (0.5 g•100 mL-1 de lactofenol). El micelio del tratamiento testigo se procesó de la misma forma. Las muestras se cubrieron con cubreobjetos y se observaron en un microscopio óptico (Nikon Eclipse 80i, Japón) con aumentos de 20X y 40X. La morfología del micelio fúngico se describió con base en lo observado.
Mortalidad y reducción del peso del insecto L. zonatus por efecto de las rizobacterias B. thuringiensis y L. sphaericus
Previo a los bioensayos, las ninfas del cuarto estadio se colocaron individualmente en vasos de plástico (número 4) sin alimento por 4 h. Posteriormente, un tubo Eppendorf perforado en la base se colocó dentro de cada vaso para la alimentación de las ninfas. En el tubo se depositó 1 mL de la bacteria correspondiente (B. thuringiensis o L. sphaericus), crecida en medio CNS durante 16 h; adicionalmente, se colocaron dos granos tiernos de elote que se cambiaron cada dos días. En las ninfas testigo se colocó 1 mL de caldo nutritivo sin la bacteria. Cada tratamiento se integró con 30 ninfas. Cabe mencionar que las bacterias B. thuringiensis y L. sphaericus se evaluaron con base en la actividad insecticida demostrada en trabajos previos (Baum et al., 2012; Berry et al., 2012). La evaluación de la mortalidad se realizó cada 24 h durante los cinco días posteriores del inicio del experimento. Las observaciones preliminares permitieron determinar que la duración del cuarto estado ninfal fue de cinco días. Los insectos muertos fueron removidos en cada observación y al final del experimento la tasa de mortalidad se calculó de acuerdo con la fórmula de Abbott (1925):
Mortalidad (%) = 100 [muertos tratados (%) - muertos control (%)] / [100 - muertos control (%)]
Por otra parte, se tomaron datos de peso del cuarto y quinto estado ninfal de L. zonatus; además, se observó si ocurrió algún cambio morfológico o retraso en el ciclo biológico.
Análisis de datos
Los experimentos se realizaron por triplicado mediante un diseño completamente al azar con arreglo simple. Los datos del antagonismo in vitro y del peso ninfal se procesaron mediante análisis de varianza de una vía y las medias se compararon por el método Holm-Sidak (P = 0.05). El efecto de B. thuringiensis y L. sphaericus sobre la mortalidad de L. zonatus se analizó usando la prueba Chi-cuadrada (Ӽ2) con el programa estadístico SigmaPlot versión 11.0 (Systat Software Inc., 2008).
Resultados y discusión
Cinéticas de crecimiento bacteriano en dos medios de cultivo
Las cinéticas de crecimiento de las rizobacterias B. subtilis, B. mojavensis, B. thuringiensis y L. sphaericus en medio caldo nutritivo y CNS se muestran en la Figura 1.Todas las bacterias presentaron las cuatro fases de crecimiento bacteriano típicas en un máximo de 36 h: adaptación (0-6 h), exponencial (6-12 h), estacionaria (12-24 h) y declinación (de 24 h en adelante). Las fases se reflejaron por igual en medio caldo nutritivo y CNS. La producción de metabolitos asociados o no al crecimiento bacteriano desempeña un papel fundamental en la actividad antagonista. Por otra parte, el uso de un medio suplementado podría facilitar la formación de toxinas con actividad entomopatógena (Dussán et al., 2002). Mediante tinciones realizadas con cristal violeta se observó gran cantidad de cristales proteicos en las cepas de B. thuringiensis y L. sphaericus. Estos resultados coinciden con los reportados por Poopathi et al. (2014), quienes encontraron actividad entomopatógena de Bacillus cereus Frankland & Frankland contra mosquitos, Con una producción elevada de proteínas a partir de las 12 h de cultivo en medio Luria Bertani.
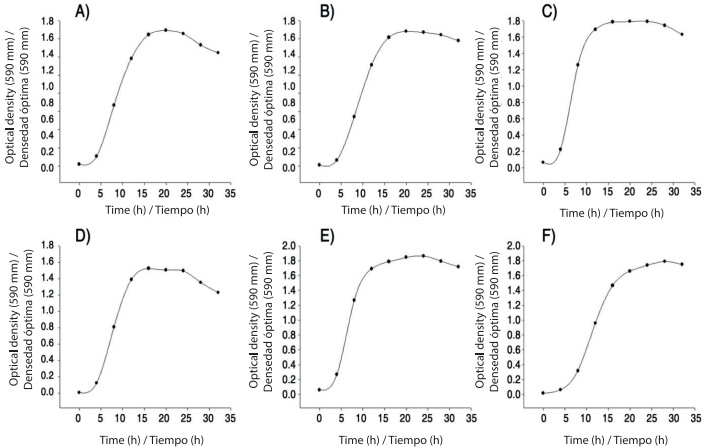
Figura 1 Cinética de crecimiento de las bacterias rizosféricas en caldo nutritivo (CN) y caldo nutritivo suplementado (CNS) a 28 °C en agitación (150 rpm) durante 36 h. A) B. subtilis (CN), B) B. mojavensis (CN), C) B. thuringiensis (CN), D) L. sphaericus (CN), E) B. thuringiensis (CNS), F) L. sphaericus (CNS).
Actividad antagonista in vitro de las rizobacterias sobre F. verticillioides
La actividad antagonista de B. subtilis, B. mojavensis, B. thuringiensis y L. sphaericus ante el crecimiento micelial de F. verticillioides se reporta en el Cuadro 1. Todas las rizobacterias inhibieron el crecimiento micelial de F. verticillioides en medio agar nutritivo con independencia del método de cultivo utilizado para su multiplicación y de los metabolitos antagonistas liberados en medio líquido durante 12 y 24 h. Los mayores porcentajes de inhibición lo causaron B. subtilis (38.5 a 50 %), B. mojavensis (40.4 a 54 %) y L. sphaericus (39.6 a 55 %); se observaron diferencias estadísticas significativas (P = 0.05) entre el crecimiento micelial del testigo y el obtenido con las bacterias rizosféricas.
Cuadro 1 Efecto antifúngico in vitro de las bacterias rizosféricas de Jatropha curcas sobre el crecimiento micelial de Fusarium verticillioides, a 28 °C
| Tratamientos | Agar nutritivo (7 días) | Caldo nutritivo (12 h) | Caldo nutritivo (24 h) | |||
|---|---|---|---|---|---|---|
| CM (mm) | ICM (%) | CM (mm) | ICM (%) | CM (mm) | ICM (%) | |
| Testigo | 85.31 ± 0.54 a | 0 | 85.43 ± 0.74 a | 0 | 85.43 ± 0.74 a | 0 |
| Bacillus subtilis | 43.04 ± 3.46 c | 50.0 | 52.57 ± 2.46 c | 38.5 | 47.68 ± 3.57 c | 44.2 |
| Bacillus mojavensis | 39.89 ± 1.74 c | 54.0 | 50.92 ± 2.48 c | 40.4 | 48.78 ± 4.58 c | 43.0 |
| Bacillus thuringiensis | 63.98 ± 3.71 b | 26.0 | 62.03 ± 7.04 b | 27.4 | 61.18 ± 3.15 b | 28.4 |
| Lysinibacillus sphaericus | 38.79 ± 4.68 c | 55.0 | 51.67 ± 4.11 c | 39.6 | 50.08 ± 2.90 c | 41.4 |
CM: Crecimiento micelial. ICM: Inhibición del crecimiento micelial. ANOVA de una vía. Letras iguales en la misma columna indican que no hay diferencias estadísticas significativas de acuerdo con el método Holm-Sidak (P = 0.05).
La morfología colonial de F. verticillioides se observa en la Figura 2. El testigo presentó crecimiento micelial en forma radial de color blanquecino, textura algodonosa y bordes regulares (Figura 2A). La presencia de B. subtilis provocó que F. verticillioides presentara crecimiento micelial retardado y en forma cuadrada (Figuras 2B, 2C y 2D). Latha et al. (2011) aislaron B. subtilis de la rizósfera de J. curcas y demostraron que la bacteria inhibió al hongo fitopatógeno Lasiodiplodia theobromae (Patouillard) Griffon & Maublanc en condiciones de campo.
En este trabajo, los tratamientos con B. mojavensis provocaron las mayores afectaciones morfológicas en el micelio de F. verticillioides; adicionalmente, la bacteria indujo colonias fúngicas con la parte central más blanca y algodonosa (Figura 2E). Otros cambios morfológicos se destacan en el desarrollo de colonias fúngicas cuadradas irregulares (Figura 2F, 2G). Se ha reportado que B. mojavensis produce proteasas, sideróforos y compuestos volátiles que inhiben el crecimiento micelial de F. verticillioides (Bacon & Hinton, 2002; Bacon, Hinton, Mitchell, Snook, & Olubajo, 2012). La rizobacteria B. mojavensis posee un mecanismo antagonista complejo aún no conocido por completo, donde además de producir los compuestos mencionados se relaciona también la producción de surfactinas con la actividad antifúngica (Bacon et al., 2012). Los tratamientos con B. thuringiensis indujeron menores cambios en el color y aspecto del micelio de F. verticillioides, pero el crecimiento micelial del hongo fue también de forma cuadrada (Figuras 2H, 2I y 2J). Recientemente, Rocha etal. (2014) demostraron en pruebas in vitro que B. thuringiensis suprime el crecimiento e inhibe la producción de fumosina de F. verticillioides, por lo que concluyeron que la bacteria, además de su capacidad para controlar plagas insectiles, tiene potencial como agente de control biológico de hongos fitopatógenos. Asimismo, L. sphaericus mostró crecimiento rápido y actividad inhibitoria elevada cuando se cultivó de manera dual con F. verticillioides (Figura 2K). Un estudio reciente evidenció una elevada actividad de Lysinibacillus sp. contra diversas bacterias y hongos (Ahamad, Iqbal, Haseeb, & Khan, 2014); la actividad antimicrobiana se atribuyó a las bacteriocinas, sugiriendo que dicha bacteria representa una alternativa para controlar el deterioro microbiano de productos alimenticios.
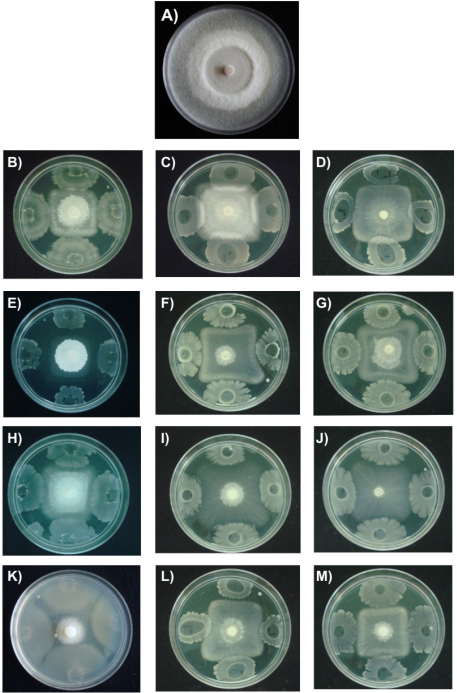
Figura 2 Efecto de bacterias rizosféricas en el crecimiento micelial de Fusarium verticillioides en agar nutritivo (AN) a 28 °C durante siete días y en caldo nutritivo (CN) por 12 y 24 h. A) Control, B) B. subtilis (AN); C) B. subtilis (CN, 12 h); D) B. subtilis (CN, 24 h); E) B. mojavensis (AN); F) B. mojavensis (CN, 12 h); G) B. mojavensis (CN, 24 h); H) B. thuringiensis (AN); I) B. thuringiensis (CN, 12 h); J) B. thuringiensis (CN, 24 h); K) L. sphaericus (AN); L) L. sphaericus (CN, 12 h); M) L. sphaericus (24 h).
En general, las rizobacterias son muy diversas y pueden tener potencial como agentes de control biológico con base en su actividad antagonista, destacando las especies de los géneros Bacillus y Pseudomonas, las cuales pueden inhibir el desarrollo de fitopatógenos tales como Fusarium oxysporum Schlechtendal, Rhizoctonia solani Kuhn, Pythium spp. (Beneduzi, Ambrosini, & Passaglia, 2012). En particular, en la rizósfera de J. curcas se han aislado bacterias del género Enterobacter, Bacillus y Pseudomonas con el objetivo de promover el crecimiento vegetal, pero sin evaluar la actividad antifúngica de estas rizobacterias (Jha, Patel, & Saraf, 2012; Patel & Saraf, 2013); por tanto, los resultados obtenidos en esta investigación son de interés para el manejo de enfermedades fúngicas del cultivo.
Efecto de las rizobacterias en la morfología de las hifas de F. verticillioides
La Figura 3 muestra las hifas de F. verticillioides tratadas con diferentes rizobacterias. A los 7 y 14 días, el testigo presentó hifas septadas rectilíneas con grosor uniforme y contenido celular homogéneo (Figuras 3A y 3F). Las rizobacterias causaron afectaciones en la morfología hifal manifestadas de varias formas. B. subtilis provocó encurvamiento y engrosamiento que desencadenó la vacuolización celular a los 14 días (Figuras 3B y 3G); B. mojavensis indujo engrosamiento (siete días) y vacuolización (14 días) (Figuras 3C y 3H); B. thuringiensis provocó ligeros engrosamientos (siete días) y encurvamientos (14 días) (Figuras 3D y 3I), mientras que L. sphaericus generó mayores cambios en la morfología mediante la formación de septos más cercanos y vacuolización celular desde los siete días de cultivo (Figuras 3E y 3J).
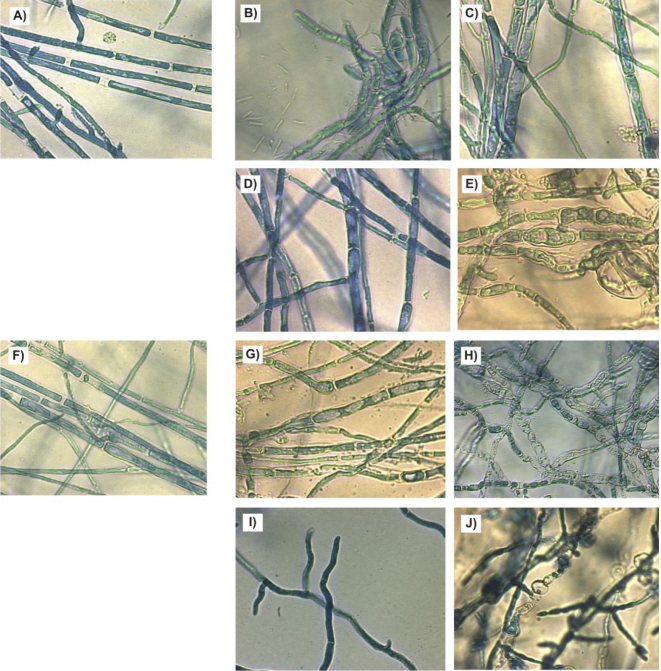
Figura 3 Morfología hifal de F. verticillioides por efecto de bacterias rizosféricas durante siete y 14 días de crecimiento en agar nutritivo a 28 °C. A) Control 7 d, B) B. subtilis 7 d, C) B. mojavensis 7 d, D). B. thuringiensis 7 d, E) L. sphaericus 7 d, F) Control 14 d, G) B. subtilis 14 d, H) B. mojavensis 14 d, I) B. thuringiensis 14 d, J) L. sphaericus 14 d.
En general, las rizobacterias afectaron la morfología de las hifas de F. verticillioides, fundamentalmente en lo relativo al grosor, rugosidad, vacuolización y, probablemente, en la salida de material intracelular. Otras investigaciones han mostrado que las rizobacterias pueden afectar la morfología de Curvularia lunata (Wakker) Boedijn (Basha & Ulaganathan, 2002). En particular, se conoce que diversas especies del género Bacillus afectan la morfología de las hifas de diferentes hongos y se ha propuesto que los microorganismos antagonistas puedan inducir distintos mecanismos de defensa en los hongos, entre los que destaca la deposición de quitina en la pared celular. No obstante, se ha informado que algunas especies de Bacillus son capaces de superar estas defensas y causar daños severos en las células fúngicas (Chérif et al., 2002).
Mortalidad y reducción del peso de L. zonatus por efecto de B. thuringiensis y L. sphaericus
Bajo las condiciones de estudio, B. thuringiensis y L. sphaericus no tuvieron efecto estadísticamente significativo (P = 0.05) sobre la mortalidad de la ninfa 4 de L. zonatus con respecto al testigo. De manera similar, tampoco hubo efecto significativo de las bacterias sobre el peso de la ninfa 4 a la ninfa 5 con respecto al testigo (Cuadro 2).
Cuadro 2 Efecto de Bacillus thuringiensis y Lysinibacillus sphaericus sobre la mortalidad y peso de Leptoglossus zonatus.
| Tratamientos | Leptoglossus zonatus | |
|---|---|---|
| Mortalidad (%)* | Peso ninfa 4 a 5 (mg)** | |
| Testigo | 33.33 a | 50.16 ± 18.80 a |
| Bacillus thuringiensis | 46.66 a | 42.61 ± 12.04 a |
| Lysinibacillus sphaericus | 36.66 a | 44.02 ± 17.21 a |
*Chi-cuadrada (Ӽ2), **ANOVA de una vía. Letras iguales en la misma columna indican que no hay diferencias estadísticas significativas de acuerdo con el método Holm-Sidak (P = 0.05).
En el presente trabajo, B. thuringiensis y L. sphaericus no tuvieron efecto entomopatógeno sobre L. zonatus. Existen pocos estudios donde la aplicación de B. thuringiensis y L. sphaericus haya sido exitoso sobre el control de Hemiptera. Al respecto, Schünemann, Knaak, y Fiuza (2014) mencionaron que realmente se sabe poco sobre la toxicidad de B. thuringiensis sobre la orden Hemiptera, debido a que existen pocos trabajos que evalúan el efecto. La mayoría de los estudios exitosos sobre la actividad entomopatógena de las bacterias se han probado en la etapa larval de insectos holometábolos que se alimentan masticando hojas. Después de que las bacterias son ingeridas, las toxinas se insertan en la membrana peritrófica del intestino medio donde actúan formando poros, causando la vacuolización del citoplasma y, posteriormente, una disrupción celular, ocasionando que el insecto no pueda alimentarse y finalmente muera. Los hemípteros evolucionaron para alimentarse de dieta líquida (Stockhoff & Conlan, 2003), desarrollando un aparato bucal picador chupador, por lo que el intestino medio varía en morfología, actividad funcional, carece de membrana peritrófica y de ciertas enzimas digestivas hidrolíticas como la tripsina, necesarias para la acción de las toxinas. Por tal razón, las toxinas de B. thuringiensis no interaccionaron con el tracto digestivo del insecto; sin embargo, recientemente se ha logrado expresar una proteína insecticida de 35 kDa de dicha bacteria que afecta la supervivencia y el desarrollo de la chinche Lygus hesperus (Knight) en plantas transgénicas de algodón (Baum et al., 2012). Lo anterior significa que pueden existir proteínas tóxicas contra chinches, pero se tiene que investigar la manera de que tales proteínas interaccionen con el tracto digestivo de las chinches. Por lo tanto, en trabajos posteriores es importante buscar la forma más efectiva de proporcionar las bacterias a los insectos.
Considerando que este es el primer trabajo que evalúa la actividad entomopatógena de B. thuringensis y L. sphaericus sobre L. zonatus, ya que hasta la fecha no existen reportes de trabajos realizados en estos organismos, es necesario considerar la evaluación en otros estados biológicos del insecto y concentraciones de cristales proteicos. Sobre todo es importante buscar un mecanismo para que las proteínas tóxicas de estas bacterias puedan actuar en el sistema digestivo de los Heteroptera, a través de una enzima capaz de iniciar el proceso en el tracto digestivo de las chinches.
Conclusiones
Las bacterias rizosféricas B. subtilis, B. mojavensis, B. thuringiensis y L. sphaericus inhibieron el crecimiento micelial y afectaron la morfología hifal de F. verticillioides con independencia del medio y tiempos de cultivo utilizados. Las rizobacterias B. thuringiensis y L. sphaericus no afectaron la mortalidad ni el desarrollo de L. zonatus. En general, las cepas de bacterias rizosféricas evidenciaron actividad antagonista contra F. verticillioides y no mostraron actividad entomopatógena contra L. zonatus. Este trabajo permite ampliar el potencial de uso de bacterias antagonistas que puedan ser empleadas dentro de las estrategias de manejo integrado de plagas y enfermedades.
Agradecimientos
Agradecemos el apoyo financiero para la realización de este trabajo brindado por el Instituto Politécnico Nacional a través de la Secretaría de Investigación y Posgrado.
REFERENCIAS
Abbott, W. S. (1925). A method of computing the effectiveness of an insecticides. Journal of Economic Entomology, 18, 265-267. doi: 10.1093/jee/18.2.265a [ Links ]
Ahmad, V., Iqbal, A. M. Z., Haseeb, M., & Khan, M. S. (2014). Antimicrobial potential of bacteriocin producing Lysinibacillus jx416856 against foodborne bacterial and fungal pathogens, isolated from fruits and vegetable waste. Anaerobe, 27, 87-95. doi: 10.1016/j.anaerobe.2014.04.001 [ Links ]
Bacon, C. W., & Hinton, D. M. (2002). Endophytic and biological control potential of Bacillus mojavensis and related species. Biological Control, 23, 274-284. doi: 10.1006/bcon.2001.1016 [ Links ]
Bacon, C. W., Hinton, D. M., Mitchell, T. R., Snook, M. E., & Olubajo, B. (2012). Characterization of endophytic strains of Bacillus mojavensis and their production of surfactin isomers. Biological Control, 62, 1-9. doi: 10.1016/j.biocontrol.2012.03.006 [ Links ]
Basha, S., & Ulaganathan, K. (2002). Antagonism of Bacillus species (strain BC121) towards Curvularia lunata. Current Science, 82, 1457-1463. Retrieved from http://www.iisc.ernet.in/currsci/jun252002/1457.pdf [ Links ]
Basili, M., & Fontini, F. (2012). Biofuel from Jatropha curcas: Environmental sustainability and option value. Ecological Economics, 78, 1-8. doi: 10.1016/j.ecolecon.2012.03.010 [ Links ]
Baum, J. A., Sukuru, U. R., Penn, S. R., Meyer, S. E., Subbarao, S., Shi, X., & Clark, T. L. (2012). Cotton plants expressing a hemipteran-active Bacillus thuringiensis crystal protein impact the development and survival of Lygus hesperus (Hemiptera: Miridae) nymphs. Journal of Economic Entomology, 105, 616-624. doi: 10.1603/EC11207 [ Links ]
Becker, K., Wulfmeyer, V., Berger, T., Gebel, J., & Münch, W. (2013). Carbon farming in hot, dry coastal areas: An option for climate change mitigation. Earth System Dynamics, 4, 237-251. doi: 10.5194/esd-4-237-2013 [ Links ]
Beneduzi, A., Ambrosini, A., & Passaglia, L. M. P. (2012). Plant growth-promoting rhizobacteria (PGPR): Their potential as antagonists and biocontrol agents. Genetics and Molecular Biology, 35, 1044-1051. doi: 10.1590/S1415-47572012000600020 [ Links ]
Berry, C. (2012). The bacterium, Lysinibacillus sphaericus, as an insect pathogen. Journal of Invertebrate Pathology, 109, 1-10. doi: 10.1016/j.jip.2011.11.008 [ Links ]
Chérif, M., Sadfi, N., Benhamou, N., Boudabbous, A., Boubaker, A., Hajlaoui, M. R., & Tirilly, Y. (2002). Ultrastructure and cytochemistry of in vitro interactions of the antagonistic bacteria Bacillus cereus X16 and B. thuringiensis 55T with Fusarium roseum var. sambucinum. Journal of Plant Pathology, 84, 83-93. doi: 10.4454/jpp.v84i2.1091 [ Links ]
Dharmaputra, O. S., Worang, R. L., Syarief, R., & Tahudin, M. (2009). The quality of physic nut (Jatropha curcas) seed affected by water activity and duration of storage. Microbiology Indonesia, 3, 139-145. Retrieved from http://jurnal.permi.or.id/index.php/mionline/article/view/138/15 [ Links ]
Dias, L. A. S., Missio, R. F., & Dias, D. C. F. S. (2012). Antiquity, botany, origin and domestication of Jatropha curcas (Euphorbiaceae), a plant species with potential for biodiesel production. Genetics and Molecular Research, 11, 2719-2728. doi: 10.4238/2012.June.25.6 [ Links ]
Dussán, J. G., Andrade, D. R. L., Lozano, L. C. A., Vanegas, S. P. M. (2002). Physiologic and genetic characterization of Bacillus sphaericus native strains. Revista Colombiana de Biotecnología, 4, 89-99. Retrieved from http://www.revistas.unal.edu.co/index.php/biotecnologia/article/view/30097/30289 [ Links ]
Fresnedo-Ramírez, J., & Orozco-Ramírez, Q. (2013). Diversity and distribution of genus Jatropha in Mexico. Genetic Resources and Crop Evolution, 60, 1087-1104. doi: 10.1007/s10722-012-9906-7 [ Links ]
Grimm, C., & Somarriba, A. (1999). Suitability of physic nut (Jatropha curcas L.) as single host plant for the leaf-footed bug Leptoglossus zonatus Dallas (Het., Coreidae). Journal of Applied Entomology, 123, 347-350. doi: 10.1046/j.1439-0418.1999.00380 [ Links ]
Guo, Z., Chen, R., Xing, R., Liu, S., Yu, H., Wang, P., Li, P. (2006). Novel derivarives of chitosan and their antifungal activities in vitro. Carbohydrate Research, 341(3), 351-354. doi: 10.1016/j.carres.2005.11.002 [ Links ]
Jha, C. K., Patel, D., & Saraf, M. (2012). Stimulation of the growth of Jatropha curcas by the plant growth promoting bacterium Enterobacter cancerogenus MSA2. World Journal of Microbiology and Biotechnology, 28, 891-899. doi: 10.1007/s11274-011-0886-0 [ Links ]
Latha, P., Anand, T., Prakasam, V., Jonathan, E. I., Paramathma, M., & Samiyappan, R. (2011). Combining Pseudomonas, Bacillus and Trichoderma strains with organic amendments and micronutrient to enhance suppression of collar and root rot disease in physic nut. Applied Soil Ecology, 49, 215-223. doi: 10.1016/j.apsoil.2011.05.003 [ Links ]
McPherson, J. E., Packauskas, R. J., Taylor, S. J., & O´Brien, M. F. (1990). Eastern range extension of Leptoglossus occidentalis with a key to Leptoglossus species of America North of Mexico (Heteroptera: Coreidae). Great Lakes Entomology, 23, 99-104. [ Links ]
Patel, D., & Saraf, M. (2013). Influence of soil ameliorants and microflora on induction of antioxidant enzymes and growth promotion of Jatropha curcas L. under saline condition. European Journal of Soil Biology, 55, 47-54. doi: 10.1016/j.ejsobi.2012.12.004 [ Links ]
Poopathi, S., Mani, C., Thirugnanasambantham, K., Praba, V. L., Ahangar, N. A., & Balagangakharan, K. (2014). Identification and characterization of a novel marine Bacillus cereus for mosquito control. Parasitology Research, 113, 323-332. doi: 10.1007/s00436-013-3658-y [ Links ]
Rocha, L. O., Tralamazza, S. M., Reis, G. M., Rabinovitch, L., Barbosa, C. B., & Corrêa, B. (2014). Multi-method approach for characterizing the interaction between Fusarium verticillioides and Bacillus thuringiensis Subsp. Kurstaki. PloS ONE, 9(4), e92189. doi: 10.1371/journal.pone.0092189 [ Links ]
Schünemann, R., Knaak, N., & Fiuza, L. M. (2014). Mode of action and specificity of Bacillus thuringiensis toxins in the control of caterpillars and stink bugs in soybean culture. ISRN Microbiology, 2014, Article ID 135675. doi: 10.1155/2014/135675 [ Links ]
SigmaPlot. (2008). SigmaPlot. Exact graphs for exact sciences, V.11.0. Point Richmond, CA, USA: Systat Software Inc. [ Links ]
Stockhoff, B., & Conlan, C. (2003). Control de plagas de insectos hemípteros con Bacillus thuringiensis. España: ES Patente núm. 2194108T3. 16-11-2003. Retrieved from http://www.espatentes.com/pdf/2194108_t3.pdf [ Links ]
Tepole-García, R. E., Pineda-Guillermo, S., Martínez-Herrera, J., & Castrejón-Gómez, V. R. (2012). Records of two pest species, Leptoglossus zonatus (Heteroptera: Coreidae) and Pachycoris klugii (Heteroptera: Scutelleridae), feeding on the physic nut, Jatropha curcas, in Mexico. Florida Entomology, 95, 208-210. doi: 10.1653/024.095.0135 [ Links ]
Terren, M., Mignon, J., Declerck, C., Jijakli, H., Savery, S., Jacquet de Haveskercke, P., Mergeai, G. (2012). Principal disease and insect pest of Jatropha curcas L. in the lower valley of the Senegal River. Tropicultura, 30, 222-229. Obtenido de http://www.tropicultura.org/text/v30n4/222.pdf [ Links ]
Van Rooijen, L. W. (2014). Pioneering in marginal fields: Jatropha for carbon credits and restoring degraded land in Eastern Indonesia. Sustainability, 6, 2223-2247. doi: 10.3390/su6042223 [ Links ]
Wani, S. P., Chander, G., Sahrawat, K. L., Srinivasa-Rao, Ch., Raghvendra, G., Susanna, P., & Pavani, M. (2012). Carbon sequestration and land rehabilitation through Jatropha curcas L. plantation in degraded lands. Agriculture, Ecosystems and Environment, 161, 112-120. doi: 10.1016/j.agee.2012.07.028 [ Links ]
Recibido: 20 de Mayo de 2015; Aprobado: 18 de Abril de 2016











 texto en
texto en 


