Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.22 no.3 Chapingo sep./dic. 2016
https://doi.org/10.5154/r.rchscfa.2015.09.042
Articles
Patrones de diversidad y distribución de helechos y licopodios en un bosque mesófilo de montaña de México
1Universidad Autónoma del Estado de Hidalgo (UAEH), Centro de Investigaciones Biológicas. Ciudad Universitaria, Carretera Pachuca-Tulancingo km 4.5. C. P. 42184. Mineral de la Reforma, Hidalgo, México.
2Comisión Nacional Forestal (CONAFOR). Plutarco Elías Calles 2a Sección. C. P. 42035. Pachuca, Hidalgo, México.
3Colegio de Postgraduados, Postgrado en Botánica. Carretera México-Texcoco km 36.5. C. P. 56230. Montecillo, Texcoco, Estado de México, México.
La relación de la riqueza, diversidad y distribución de especies de helechos y licopodios con algunas variables climáticas y edáficas se analizó en el bosque mesófilo de montaña del municipio de Tlanchinol, Hidalgo. Se establecieron 24 parcelas de muestreo de 400 m2 cada una, en tres pisos altitudinales situados entre 1,107 y 1,903 m. La diversidad alfa y beta, y el valor de importancia relativa (VIR) de las especies se estimaron en cada parcela. La relación entre la riqueza, diversidad, VIR y las variables ambientales se estableció mediante análisis de redundancia, regresión lineal y árboles de regresión. Pocas especies presentaron VIR altos por parcela; los valores de riqueza y diversidad no mostraron diferencias estadísticamente significativas (P < 0.05) con respecto a la altitud, pero sí con la temperatura mínima del mes más frío, precipitación del trimestre más cálido, orientación y pendiente. La diversidad beta incrementó con la altitud; esta diversidad fue baja entre pisos cercanos y alta en los extremos del gradiente. La distribución de las especies se relacionó positivamente con la materia orgánica, isotermalidad y contenido de sodio; y negativamente con la precipitación del mes más seco, evapotranspiración real anual y evapotranspiración real en la temporada de lluvias.
Palabras clave: Altitud; árboles de regresión; bosques templados; ordenación; pteridofitas
The relationship between the richness, diversity and distribution of fern and lycophyte species and some climatic and soil variables in the mountain cloud forest of the municipality of Tlanchinol, Hidalgo, Mexico, was analyzed. Twenty-four sampling plots of 400 m2 each were established in three elevational ranges between 1,107 and 1,903 m. In each plot, alpha and beta diversity, and the relative importance value (RIV) of the species were estimated. The relationship between richness, diversity, RIV and environmental variables was established by redundancy, linear regression and regression tree analysis. Few species showed high RIV per plot; richness and diversity values showed no statistically significant differences (P < 0.05) with respect to elevation, but did with respect to the minimum temperature of coldest month, precipitation of warmest quarter, orientation and slope. Beta diversity increased with elevation, was low between nearby elevational ranges and was high at the ends of the gradient. Species distribution was positively related to organic matter, isothermality and sodium content, and negatively with precipitation of driest month, annual actual evapotranspiration and actual evapotranspiration in the rainy season.
Keywords: Elevation; regression trees; temperate forests; ordination; pteridophytes
Introducción
Es aceptado ampliamente que la diversidad de especies de plantas decrece conforme la altitud incrementa; sin embargo, tal disminución no es lineal necesariamente, puesto que hay mayor número de especies en altitudes intermedias (Rahbek, 2005; Sánchez-González & López-Mata, 2005). En el caso específico de los helechos y licopodios (Pteridofitas), algunos estudios confirman la respuesta unimodal en la diversidad de especies (Kluge, Kessler, & Dunn, 2006; Watkins, Cardelu, Colwell, & Moran, 2006). Como la altitud es una variable ambiental que no tiene efecto directo sobre las plantas (Körner, 2007), se ha propuesto que la diversidad de especies de pteridofitas es mayor en altitudes intermedias, porque es ahí donde las condiciones propicias de humedad elevada y temperatura moderada se presentan (Kluge et al., 2006).
Los helechos y licopodios representan un componente estructural importante en los bosques, participan activamente en la regeneración de éstos, influyen en las condiciones de luz en el sotobosque y en la disponibilidad de nutrimentos y contenido de agua del suelo; por ello, ambos grupos de plantas se consideran indicadores de la calidad del ambiente (Karst, Gilbert, & Lechowics, 2005; Tejero-Díez, Torres-Díaz, & Gual-Díaz, 2014). Estudios recientes se han enfocado en conocer los patrones de riqueza, diversidad y distribución de los helechos y licopodios a lo largo de gradientes ambientales en diferentes regiones y tipos de vegetación. Los resultados de estas investigaciones indican que, independientemente de la escala espacial analizada, la diversidad y distribución en ambos grupos de plantas están relacionadas estrechamente con la humedad ambiental y la topografía (Jones et al., 2008; Karst et al., 2005; Sánchez-González, Álvarez-Zúñiga, & Tejero-Díez, 2010), y que a escala local, los factores edáficos adquieren relevancia (Jones et al., 2008; Karst et al., 2005).
El bosque mesófilo de montaña (BMM) de México es el tipo de vegetación con mayor riqueza de especies por unidad de área (Rzedowski, 1978; Villaseñor, 2010). La distribución del BMM es discontinua y fragmentada en forma de archipiélagos (Vázquez-García, 1995) y restringida a zonas montañosas con topografía muy accidentada, en donde predominan condiciones de humedad elevada y temperatura moderada, ideales para el desarrollo de los helechos y licopodios (Tejero-Díez et al., 2014). El estado de Hidalgo ocupa el tercer lugar nacional en cuanto a superficie ocupada por BMM. Este tipo de vegetación se encuentra en grave riesgo de desaparecer, debido a la creciente fragmentación que resulta del cambio en el uso del suelo, y a la falta de planes para el manejo y conservación (González-Espinosa et al., 2012; Villaseñor, 2010).
No se conocen estudios sobre los patrones de riqueza, diversidad y distribución de los helechos y licopodios a nivel local o regional en los fragmentos de BMM de México. En tal contexto, se plantearon los siguientes objetivos: 1) aportar información sobre dichos patrones, a lo largo de un gradiente altitudinal en el BMM de Tlanchinol, Hidalgo, y 2) establecer la relación de la riqueza, diversidad y valores de importancia estructural de ambos grupos de plantas, con respecto a las variables climáticas y edáficas. Se plantea además, que las condiciones climáticas características del BMM representan un modelo natural ideal para probar: a) si los factores edáficos y topográficos son más relevantes que los climáticos (temperatura y humedad), para explicar la diversidad y distribución de helechos y licopodios a escala local, como lo sugieren Jones et al. (2008) y Karst et al. (2005), y b) si las preferencias ecológicas de ambos grupos de plantas son tan específicas como para reflejarse en cambios en los parámetros estructurales entre sitios cercanos espacialmente, como se reporta en otros hábitats y ecosistemas (Cárdenas, Halme, & Tuomisto, 2007; Cuevas, Sánchez-González, & Tejero-Díez, 2013; Jones et al., 2008; Karst et al., 2005; Sánchez-González et al., 2010).
Materiales y métodos
Zona de estudio
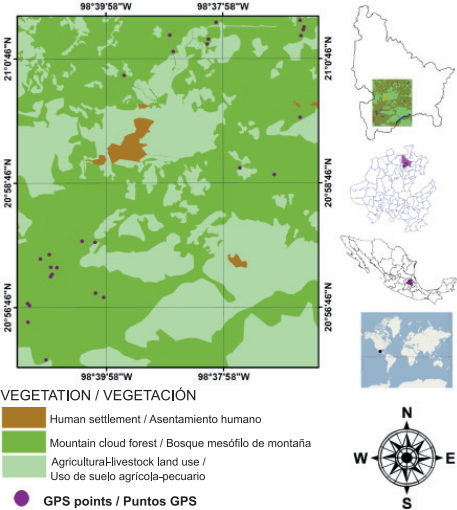
Tlanchinol se localiza en la porción norte del estado de Hidalgo; el municipio limita al norte con el estado de San Luis Potosí, al sur con el municipio de Calnali, al oeste con el municipio de Lolotla y al este con los municipios de Huazalingo y Huejutla (Figura 1). Tlanchinol ocupa una superficie cercana a 380 km2 y representa 1.9 % de la superficie estatal; geográficamente se encuentra entre los paralelos 21° 00’ - 21° 10’ LN y 98° 30’ - 98° 35’ LO, a una altitud promedio de 1,590 m (Instituto Nacional de Estadística, Geografía e Informática [INEGI], 1996). La topografía es abrupta en gran parte del municipio, con muchas barrancas, además de tener mesetas y valles; al este presenta una planicie y al oeste algunos llanos constituidos en 90 % por pendientes mayores de 10 % (INEGI, 1996). El clima templado predomina con temperatura promedio de 17.2 °C y precipitación pluvial anual de 2,156 mm, con lluvias principalmente en verano (mayo a septiembre) y en menor proporción en invierno (INEGI, 2004; Pavón & Meza, 2009). El BMM de Tlanchinol se caracteriza por la presencia de árboles perennifolios y algunos caducifolios. Una de las especies características es Liquidambar macrophylla Oerst., también se observan Alnus acuminata Kunth, Bejaria aestuans Mutis ex L., Clethra mexicana DC., Dalbergia palo-escrito Rzed. & Guridi-Gómez y Quercus spp. L.; en el estrato arbustivo se encuentran Bocconia frutescens L. y Decatropis bicolor (Zucc.) Radlk. (Luna, Ocegueda, & Alcántara, 1994; Ponce-Vargas, Luna-Vega, Alcántara-Ayala, & Ruiz-Jiménez, 2006).
Trabajo en campo
El muestreo y recolección de ejemplares de pteridofitas del BMM de Tlanchinol, Hidalgo, se hicieron durante siete recorridos de campo realizados entre marzo de 2009 y febrero de 2010. Las localidades de muestreo se seleccionaron con base en tres criterios básicos: 1) altitud (determinada con geoposicionador Garmin, GPSmap 60CS, Kansas, EUA), 2) ausencia o escasez de señales de disturbio por actividades humanas o fenómenos naturales y 3) cobertura del dosel ≥ 50 % (verificado con un densitómetro esférico (Model A, Bartlesville, Oklahoma, EUA). Los últimos dos criterios se consideraron indicadores indirectos de la presencia de vegetación primaria conservada (Pérez-Paredes, Sánchez-González, & Tejero-Díez, 2014).
La riqueza, diversidad, valores estructurales y distribución de las especies de helechos y licopodios se determinaron con base en el establecimiento de 24 parcelas de muestreo (una por localidad seleccionada) de 400 m2 cada una, en tres diferentes pisos altitudinales; el primer piso fluctuó de 1,100 a 1,400 m; el segundo de 1,401 a 1,700 m y el tercero de 1,701 a 2,000 m. El tamaño de parcela elegido fue el área mínima utilizada en estudios ecológicos con helechos y licopodios en bosques neotropicales (Pérez-Paredes et al., 2014; Watkins et al., 2006). En cada parcela se obtuvieron datos estándar de cobertura y densidad de cada especie (Matteucci & Colma, 1982), considerando tres hábitos de crecimiento: epifitas, epipétricas y terrestres (Álvarez-Zúñiga, Sánchez-González, López-Mata, & Tejero-Díez, 2012).
Trabajo en laboratorio
Determinación de las especies. Las especies se determinaron con base en la obra de Mickel y Smith (2004) y para algunos géneros se consultó literatura reciente (Ebihara, Dubuisson, Iwatsuki, Hennequin, & Ito, 2006; Labiak, 2011). Un ejemplar de cada especie fue montado para su integración en la colección del herbario HGOM del Centro de Investigaciones Biológicas de la Universidad Autónoma del Estado de Hidalgo. Un duplicado de cada ejemplar se depositó en el Herbario Nacional MEXU de la Universidad Nacional Autónoma de México.
Valores estructurales. La importancia estructural a lo largo del gradiente altitudinal se estimó con base en el valor de importancia relativa (VIR) de cada especie, a partir de los valores de cobertura y densidad relativa (Matteucci & Colma, 1982).
Riqueza y diversidad de especies. La riqueza de especies se definió como el número de especies en cada localidad de muestreo. La diversidad de especies se estimó con el índice propuesto por Jost (2006), a partir de la transformación de los valores del índice de Shannon-Wiener obtenidos con el programa de cálculo PAST 2.01 (Hammer, Harper, & Ryan, 2009).
Diversidad beta. La tasa de reemplazo de especies entre pisos de altitud se estimó como el inverso del índice de semejanza de Sørensen (Koleff, Gaston, & Lennon, 2003), también se calculó el número de especies compartidas entre pisos altitudinales, utilizando el programa de cálculo EstimateS 8.2 (Colwell, 2015).
Variables ambientales. Con base en la localización (latitud y longitud) de cada parcela de muestreo, se estimaron 19 variables climáticas con el programa DIVA-GIS 7.3.0.1 (Hijmans, Guarino, Jarvis, & O’Brien, 2007), a partir de la información climática de los años 1950-2000, incluida en la página web de WorldClim-Global Climate Data (2015): temperatura media anual (TMA), rango promedio de temperaturas diarias (RPTD = Tmax-Tmin), isotermalidad [I = (BIO2/ BIO7) × 100], estacionalidad de la temperatura (ET = desviación estándar × 100), temperatura máxima del mes más cálido (TMMC), temperatura mínima del mes más frío (TMMF), rango anual de la temperatura (RAT = BIO5-BIO6), temperatura media del trimestre más húmedo (TMTH), temperatura media del trimestre más seco (TMTS), temperatura media del trimestre más cálido (TMTC), temperatura media del trimestre más frío (TMTF), precipitación anual (PA), precipitación del mes más húmedo (PMH), precipitación del mes más seco (PMS), estacionalidad de la precipitación (EP), precipitación del trimestre más húmedo (PTH), precipitación del trimestre más seco (PTS), precipitación del trimestre más cálido (PTC), precipitación del trimestre más frío (PTF). Las variables edáficas y topográficas fueron las siguientes: Calcio (Ca), conductividad eléctrica (CE), carbono orgánico (CO), potasio (K), magnesio (Mg), materia orgánica (MO), sodio (Na), potencial de hidrógeno (pH), altitud (Al), orientación (Or) y pendiente (Pe).
Relación entre la estructura y las variables climáticas y edáficas. La relación se estableció mediante un análisis de redundancia (RDA), una técnica de ordenación directa (un caso especial de regresión múltiple) donde los valores estructurales de las especies se relacionan directamente con las variables ambientales (Palmer, 2015). La opción selección hacia adelante (forward), incluida en el programa CANOCO (Ter Braak & Šmilauer, 1998), permitió elegir las variables que mejor explicaron la variación en los datos. Con base en la prueba de Monte Carlo, se determinó si los valores de los ejes de la ordenación y los valores de correlación entre las especies y las variables ambientales obtenidas con el RDA fueron estadísticamente significativos (P < 0.05).
Relación de la riqueza y diversidad con las variables climáticas y edáficas. La relación se estimó mediante el uso de métodos paramétricos (análisis de regresión lineal) y no paramétricos (árboles de regresión) con el programa de cálculo STATISTICA versión 7 (StatSoft Inc., 2004). Los árboles de regresión no hacen suposiciones a priori sobre algún tipo de asociación entre las variables estudiadas y facilitan la interpretación de sus relaciones, lo que no se logra si se emplean modelos estadísticos lineales (Sánchez-González & López-Mata, 2005).
Resultados y discusión
Riqueza y diversidad de especies
Los cambios más conspicuos en la composición y diversidad de especies vegetales en regiones montañosas están relacionados con diferencias en altitud (Rahbek, 2005; Slik et al., 2009). En el presente estudio, la riqueza total a lo largo del gradiente altitudinal fue de 78 especies de helechos y licopodios; no obstante, los valores de riqueza y diversidad de ambos grupos taxonómicos no mostraron relación significativa (P < 0.05) con respecto a la altitud (Figura 2). Esto contrasta con los resultados obtenidos en otras investigaciones que se refieren a una respuesta unimodal (Rahbek, 2005; Sánchez-González & López-Mata, 2005; Sang, 2008; Zhu, Jiang, Liu, Xiong, & Kang, 2007) o lo menos común, respuestas positivas o negativas entre la altitud y la riqueza de especies, para diferentes grupos de plantas y ecosistemas (Rahbek, 2005; Slik et al., 2009). Es importante recalcar que la altitud es una variable ambiental que afecta la composición y estructura de las comunidades de manera indirecta y compleja, pues las especies responden a una combinación intrincada de variables climáticas (temperatura, precipitación), edáficas y topográficas (Pinokiyo, Singh, & Singh, 2008; Sang, 2008; Slik et al., 2009). En el caso de los helechos y licopodios, es frecuente que la riqueza y diversidad se incrementen en altitudes intermedias, donde la humedad es idónea para su reproducción y desarrollo (Kluge et al., 2006; Watkins et al., 2006), y que disminuyan tanto en altitudes bajas, debido a la escasez de agua por el aumento de la temperatura, como en altitudes elevadas por las bajas temperaturas (Cuevas et al., 2013; Kluge et al., 2006; Sánchez-González et al., 2010). De acuerdo con Whittaker, Willis, y Field (2001) puede ser complejo definir una serie de variables específicas responsables del cambio en la diversidad de especies, ya que éstas pueden diferir significativamente entre sistemas ecológicos y a través de escalas espaciales y temporales. Sang (2008) menciona que en las montañas Tianshan, China, el agua influyó más en la diversidad de especies de plantas en altitudes bajas, la temperatura en altitudes elevadas y las características físicas y químicas del suelo en altitudes intermedias.
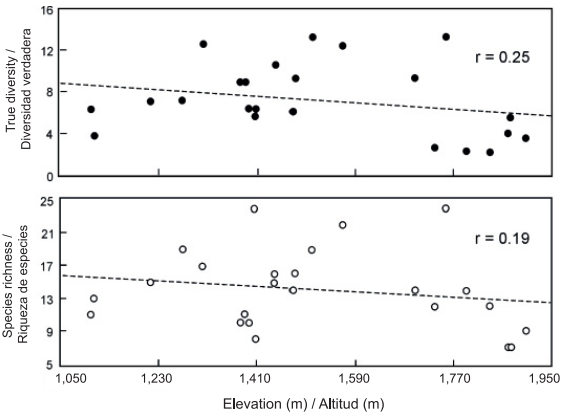
Figura 2 Riqueza y diversidad de especies de helechos y licopodios a lo largo del gradiente altitudinal estudiado (1,107 m - 1,903 m) en Tlanchinol, Hidalgo. La relación con la altitud no fue estadísticamente significativa (P < 0.05).
En el municipio de Tlanchinol, las condiciones de humedad y temperatura no mostraron alguna tendencia significativa de cambio conforme la altitud incrementó, tal vez porque el intervalo estudiado fue pequeño (menos de 1,000 m). Por esta misma razón no fue posible discernir algún patrón de cambio en los valores de riqueza y diversidad de especies a lo largo del gradiente de altitud. Además, es probable que factores como la pendiente, la exposición, el área de los cerros, cañadas, barrancas y montañas, o los factores edáficos (con impacto fisiológico más directo) de las parcelas de muestreo, estén más relacionados que la altitud con la variación local de humedad y temperatura y, por ende, con la riqueza y diversidad de especies de helechos y licopodios (Pausas & Austin, 2001).
El Cuadro 1 muestra el número de especies por piso de recolección. El número de especies compartidas entre pisos de altitud contiguos fue alto (baja diversidad beta), en cambio, el número de especies compartidas fue bajo (alta diversidad beta) en los pisos de altitud más lejanos, situados en los extremos del gradiente (1,107-1,903 m). El cambio en la composición de especies es más evidente conforme aumenta la distancia geográfica entre sitios y, por lo tanto, cuando las diferencias ambientales locales se vuelven más profundas (Sánchez-González & López-Mata, 2005; Sang, 2008; Wana & Beierkuhnlein, 2011).
Cuadro 1 Número de especies de helechos y licopodios por piso de recolección (diagonal), número de especies compartidas (diagonal superior) y diversidad beta (diagonal inferior) entre pisos altitudinales del bosque mesófilo de montaña de Tlanchinol, Hidalgo.
| Pisos de altitud (m) | 1,100-1,400 | 1,401-1,700 | 1,701-2,000 |
|---|---|---|---|
| Número de especies compartidas | |||
| 1,100-1,400 | 44 | 36 | 23 |
| 1,401-1,700 | 0.33 | 63 | 31 |
| 1,701-2,000 | 0.45 | 0.39 | 39 |
| Diversidad beta | |||
Relación entre la riqueza de especies y las variables ambientales
Con base en la correlación significativa (r = 0.56, P < 0.01) entre la riqueza y los índices de diversidad estimados, se utilizó sólo la riqueza de especies como variable de respuesta en el análisis de regresión simple y en el árbol de regresión. La relación lineal entre la riqueza y las variables ambientales no fue estadísticamente significativa (P < 0.05), por lo que no se muestra la matriz de correlación. Los métodos de análisis estadístico que suponen algún tipo de relación entre variables (lineal, unimodal), no son del todo adecuados para estudiar la asociación entre riqueza, diversidad de especies y las variables ambientales, porque las relaciones más comunes en la naturaleza son de tipo no lineal (Kallimanis, Ragia, Sgardelis, & Pantis, 2007; Sánchez-González & López-Mata, 2005).
En el presente estudio, el árbol de regresión facilitó y simplificó la interpretación de los resultados. La Figura 3 muestra la estructura del árbol, el cual presenta dos opciones relacionadas con una menor o mayor riqueza de especies: la primera opción sugiere que la riqueza de especies fue baja (flechas con líneas discontinuas) en los sitios donde la temperatura mínima del mes más frío (TMMF) fue menor de 0.77 %. La segunda opción sugiere que la riqueza de especies fue mayor en sitios con TMMF mayor de 0.77 % y precipitación del trimestre más cálido del año (PTC) menor de 2.67 %. En cambio, la riqueza de especies fue baja en los sitios donde la PTC fue mayor de 2.67 %, la orientación (Or) mayor de 1.82 % y la pendiente del terreno (Pe) mayor de 89.75 %. Todas las variables seleccionadas se relacionan directa o indirectamente con las condiciones de temperatura y disponibilidad de agua para los helechos y licopodios. Los valores de riqueza difirieron poco con respecto a la pendiente del terreno. Esto concuerda con la opinión de que solo cuando la pendiente está estrechamente relacionada con otras variables ambientales, el impacto de dicho factor es evidente sobre la composición y estructura de la vegetación de México (Rzedowski, 1978).
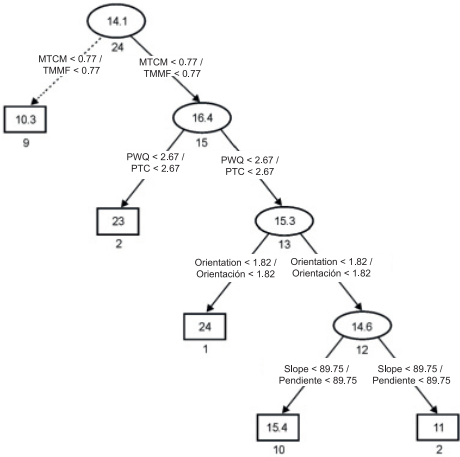
Figura 3 Árbol de regresión que esquematiza la riqueza de especies en el bosque mesófilo de montaña de Tlanchinol, Hidalgo. Los rectángulos y elipses representan los nodos terminales y no terminales, respectivamente. Los números en cada elipse o rectángulo indican el promedio de riqueza de especies. Los números bajo cada elipse o rectángulo son la suma de cuadrados asociados con el promedio aritmético de las muestras. Los valores en las conexiones entre nodos representan los criterios de decisión. Los vectores con líneas continuas muestran la vía con riqueza de especies más alta y los vectores con líneas discontinuas indican la vía con riqueza de especies más baja. TMMF: temperatura mínima del mes más frío, PTC: precipitación del trimestre más cálido.
Richter (2008) menciona que una topografía compleja es fundamental para explicar la estructura petrográfica, edáfica y climática, y la diversidad de especies. Agrega que, en muchas montañas tropicales, existe una variedad extraordinaria de hábitats húmedos, subhúmedos y secos en estrecha proximidad, debido a la presencia de terrenos extremadamente heterogéneos con pendientes de diferente exposición. El BMM de Tlanchinol es un ejemplo de ello; debido a su intrincada orografía, la precipitación pluvial y la temperatura pueden diferir significativamente en sitios relativamente cercanos, de tan solo unos kilómetros de distancia, influyendo en los cambios de riqueza y diversidad de especies de helechos y licopodios.
Valor de importancia relativa de las especies
El Cuadro 2 presenta el VIR de las especies estudiadas en el BMM de Tlanchinol, Hidalgo. Las especies con VIR mayor de 10 % (especies dominantes) en el piso de menor altitud (1,100-1,400 m) fueron: Alsophila firma (Baker) D. S. Conant, Asplenium sessilifolium Desv. var. sessilifolium, Ctenitis melanosticta (Kunze) Copel., Cyathea fulva (M. Martens & Galeotti) Fée, Dennstaedtia bipinnata (Cav.) Maxon y Lophosoria quadripinnata (J. F. Gmel.) C. Chr.; en el piso altitudinal medio (1,401-1,700 m); A. firma, Asplenium cuspidatum Lam., Blechnum appendiculatum Willd., C. fulva, Elaphoglossum sartorii (Liebm.) Mickel, Hypolepis repens (L.) C. Presl., L. quadripinnata, Phanerophlebia juglandifolia (Humb. Onpl. ex Willd.) J. Sm. y Plagiogyria pectinata (Liemb.) Lellinger; y en el piso altitudinal superior (1,701-2,000 m): E. obscurum (E. Fourn.) C. Chr., E. sartorii, L. quadripinnata, P. pectinata y Polystichum ordinatum Liebm. Las especies con VIR alto se distribuyen en los dos primeros pisos de altitud del gradiente analizado, lo cual influye en la fisonomía de la vegetación, pues son las más importantes desde el punto de vista estructural. Las especies restantes con VIR bajos se distribuyen de manera variable a lo largo del gradiente de altitud e incluyen desde las restringidas a un solo piso, hasta las presentes en todo el gradiente estudiado. En los tres pisos de altitud, las especies de helechos de mayor talla presentaron los VIR más altos, destacando L. quadripinnata por su amplia distribución a lo largo del gradiente (1,100 a 1,950 m).
Cuadro 2 Valor de importancia relativa de las especies de helechos y licopodios del bosque mesófilo de montaña de Tlanchinol en tres diferentes pisos altitudinales. Pisos de altitud: A = 1,100-1,400 m, B = 1,401-1,700 m, C = 1,701-2,000 m.
| Especies | Valor de importancia relativa | ||
|---|---|---|---|
| A | B | C | |
| Adiantum andicola Liebm. | - | 1.8 | 1.7 |
| Adiantum braunii Mett. ex Kuhn | 8.2 | - | - |
| Alsophila firma (Baker) D. S. Conant | 25.3 | 10.5 | - |
| Arachniodes denticulada (Sw.) Ching | - | 8.9 | - |
| Asplenium abscissum Willd. | 7.5 | 2.1 | - |
| Asplenium auriculatum Sw. | 1.7 | 8.6 | 3.2 |
| Asplenium cuspidatum Lam. | - | 10.5 | - |
| Asplenium monanthes L. | - | 5.6 | 3.8 |
| Asplenium serra Langsd. & Fisch. | 3.5 | - | - |
| Asplenium sessilifolium Desv. var. sessilifolium | 11.7 | 1.5 | 4.5 |
| Asplenium tuerckheimii Maxon | - | 1.5 | - |
| Blechnum appendiculatum Willd. | - | 11.6 | - |
| Blechnum occidentale L. | 6.3 | 3.4 | 3 |
| Blechnum schiedeanum Hieron. | 0.9 | - | - |
| Botrychium decompositum M. Martens & Galeotti | - | 6.2 | - |
| Campyloneurum angustifolium (Sw.) Fée | 3.4 | 2.1 | 0.2 |
| Campyloneurum xalapense Fée | 5.2 | 3.5 | - |
| Ctenitis equestris (Kunze) Ching var. equestris | 6.8 | 1.9 | - |
| Ctenitis erinacea A.R. Sm. | 9.6 | - | - |
| Ctenitis melanosticta (Kunze) Copel. | 13.9 | 6.3 | - |
| Cyathea fulva (M. Martens & Galeotti) Fée | 37.3 | 25.2 | - |
| Cystopteris fragilis (L.) Bernh. | 1 | - | - |
| Dennstaedtia bipinnata (Cav.) Maxon | 12.1 | 3.7 | - |
| Dennstaedtia cicutaria (Poir) Hieron. | 1 | 8 | - |
| Didymoglossum reptans (Sw.) C. Presl | - | 0.6 | - |
| Diplazium franconis Liebm. | 0.3 | 2.2 | - |
| Diplazium lonchophyllum Kunze | 6.7 | 2.8 | 5.7 |
| Diplazium ternatum Liebm. | 5.2 | 0.7 | - |
| Diplopterygium bancroftti (Hook.) A.R. Sm. | - | 1.8 | - |
| Elaphoglossum erinaceum T. Moore | - | - | 5.2 |
| Elaphoglossum glaucum T. Moore | - | 5.6 | 0.3 |
| Elaphoglossum obscurum (E. Fourn.) C. Chr. | 1.7 | 0.3 | 17.5 |
| Elaphoglossum peltatum (Sw.) Urb. | - | 1.3 | - |
| Elaphoglossum potosianum Christ. | - | - | 2.1 |
| Elaphoglossum sartorii (Liebm.) Mickel | - | 16.9 | 18.5 |
| Hymenophyllum polyanthos Sw. | 0.3 | 4.3 | - |
| Hypolepis repens (L.) C. Presl | 2.6 | 13.2 | - |
| Lophosoria quadripinnata (J. F. Gmel.) C. Chr. | 70.2 | 17.7 | 37 |
| Lycopodiella cernua (L.) Pic. Serm. | - | 0.2 | - |
| Marattia weinmanniifolia Liebm. | 1.8 | 4.2 | 3.7 |
| Melpomene leptostoma Fée | - | - | 0.2 |
| Pecluma alfredii (Rosents.) M. G. Price | 6.6 | 4.6 | 3.1 |
| Phanerophlebia gastonyi Yatsk. | 5.4 | 5 | - |
| Phanerophlebia juglandifolia (Humb. & Bonpl. ex Willd.) J. Sm. | 1 | 10.6 | 8.4 |
| Phlebodium pseudoaureum (Cav.) Lellinger | 9.1 | 0.5 | 3.4 |
| Pityrogramma ebenea (L.) Proctor | - | 1.2 | - |
| Plagiogyria pectinata (Liemb.) Lellinger | - | 13.3 | 39.9 |
| Pleopeltis crassinervata (Fée) T. Moore | 1.1 | 2 | 0.7 |
| Pleopeltis lepidotricha (Fée) A. R. Sm. & Tejero | 3.6 | 2.1 | 1.9 |
| Pleopeltis mexicana Feé | - | 7.6 | 2.9 |
| Pleopeltis plebeia (Schltdl. & Cham.) A.R.Sm. & Tejero | 9.1 | 4 | 4.2 |
| Pleopeltis polylepis (Roem. ex Kunze) T. Moore var. polypepis | 1.4 | - | 0.9 |
| Pleopeltis polypodioides (L.) E. G. Andrews & Windham | - | 3.2 | - |
| Polyphlebium hymenophylloides (L.) Ebihara & Dubuisson | - | 0.3 | - |
| Polypodium fraternum Schltdl. & Cham. | - | 4.6 | 1.3 |
| Polypodium longepinnulatum E. Fourn. | 3.7 | 2 | 2.7 |
| Polypodium plesiosorum Kunze | 3.9 | 1.4 | 2.4 |
| Polypodium rhodopleuron Kunze | 1.7 | 3.3 | 3.6 |
| Polystichum ordinatum Liebm. | - | - | 11.9 |
| Psilotum complanatum Sw. | 1.7 | 3.2 | - |
| Pteridium arachnoideum (Kaulf.) Maxon | - | 7.1 | - |
| Pteridium caudatum (L.) Maxon | - | - | 4.2 |
| Pteris orizabae M. Martens & Galeotti | 4.8 | 6 | 6.8 |
| Selaginella arsenei Weath. | - | 5.9 | - |
| Selaginella hoffmannii Hieron. | 2.6 | - | - |
| Selaginella lineolata Mickel & Beitel | - | - | 0.3 |
| Selaginella pallescens (C. Presl) Spring in Martius | 4.3 | 0.4 | - |
| Selaginella silvestris Aspl. | - | 3.5 | - |
| Selaginella stellata Spring | 7.1 | - | - |
| Stenogrammitis prionodes (Mickel & Beitel) Labiak | - | 0.6 | 0.1 |
| Thelypteris atrovirens (C.Chr.) C.F. Reed | 3.4 | 1.2 | 2.8 |
| Thelypteris dentata (Forssk.) E. P. St. John | - | 0.3 | - |
| Thelypteris kunthii (Desv.) C. V. Morton | - | - | 1.5 |
| Thelypteris oligocarpa (Humb. & Bonpl. ex Willd.) Ching | 4.1 | - | - |
| Vandesboschia radicans (Sw.) Copel. | 4.1 | 5.2 | 1.1 |
| Vittaria graminifolia Kaulf. | - | 2.3 | 0.15 |
| Woodwardia semicordata Mickel & Beitel | 2.8 | 4.3 | 2.9 |
| Woodwardia spinulosa M. Martens & Galeotti | - | 1.2 | - |
Es probable que la variación en los valores estructurales de los helechos y licopodios radique en las características del BMM, donde hay diversas asociaciones vegetales que difieren entre sí en cuanto a la altura, fenología y especies dominantes (Rzedowski, 1978). La heterogeneidad ambiental en el BMM de Tlanchinol se expresa en tal forma que, en cada localidad o parcela de muestreo existen condiciones ambientales particulares, independientes de la altitud, que afectan o favorecen la dominancia e importancia relativa (VIR) de una o más especies. Sin embargo, no todas las variables ambientales analizadas tienen la misma influencia sobre la densidad y la cobertura de los individuos de las especies de helechos y licopodios (Álvarez-Zúñiga et al., 2012). Se ha documentado que en las partes altas de las montañas, la composición y estructura de las comunidades vegetales frecuentemente se relacionan con la temperatura o con otros parámetros climáticos, mientras que en las partes bajas pueden estar determinadas por otros factores bióticos y abióticos (Ohmann & Spies, 1998; Sánchez-González & López-Mata, 2005; Sang, 2008).
Relación entre los valores estructurales y las variables ambientales
La Figura 4 muestra la ordenación de los sitios y los factores ambientales obtenida mediante el análisis de redundancia (RDA). De acuerdo con el Cuadro 3, los valores de las raíces características indican que hay buena separación entre los sitios (cada sitio marcado con un símbolo en la Figura 4 representa el centroide de la distribución de un conjunto de especies) a lo largo de los dos primeros ejes de variación, asociada a los gradientes ambientales. En el diagrama de ordenación se distingue un grupo constituido por las parcelas de muestreo 1, 2, 7, 11, 13, 14 y 15; otro grupo integrado por las parcelas 5, 12, 16, 17, 18 y 24; y un tercer grupo formado por las parcelas 4, 8, 9, 10, 20, 21, 22 y 23. Las parcelas de muestreo 3, 6 y 19 se observan separadas entre sí y con respecto a las demás, por lo que no constituyen algún grupo.
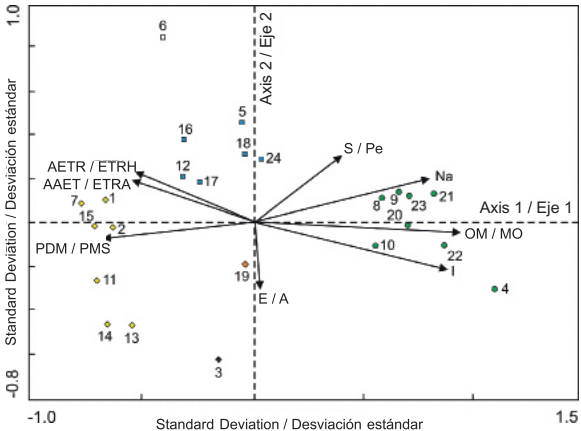
Figura 4 Diagrama de ordenación de los 24 sitios de muestreo y de las ocho variables ambientales que presentaron los valores de correlación más altos con respecto a los dos primeros ejes de variación en el bosque mesófilo de montaña de Tlanchinol, Hidalgo. A: Altitud, ETRA: Evapotranspiración real anual, ETRH: Evapotranspiración real en la temporada lluviosa del año, I: Isotermalidad, MO: Materia Orgánica, Na: Sodio, Pe: Pendiente, PMS: Precipitación del mes más seco.
Cuadro 3 Análisis de redundancia realizado con datos de valores estructurales de las especies de helechos y licopodios de 24 sitios muestreados y 12 variables ambientales del bosque mesófilo de montaña de Tlanchinol, Hidalgo.
| Valores estimados | Ejes de ordenación | |
|---|---|---|
| 1 | 2 | |
| Raíces características | 0.31 | 0.08 |
| Correlación especies-factores ambientales | 0.87 | 0.80 |
| Varianza acumulada (%) | ||
| De las especies | 31.60 | 40.20 |
| De la relación especie-ambiente | 54.30 | 69.10 |
Las variables ambientales que presentaron mayor correlación positiva con el primer eje de ordenación fueron, en orden de importancia: materia orgánica, isotermalidad y contenido de sodio (Cuadro 4, Figura 4). Las variables con mayor correlación negativa para el mismo eje fueron: precipitación del mes más seco, evapotranspiración real anual y evapotranspiración real en la temporada lluviosa del año. En cuanto al segundo eje de ordenación, la variable con mayor correlación negativa fue la altitud y las variables con mayor correlación positiva fueron la pendiente y la temperatura media anual (Cuadro 4, Figura 4). De acuerdo con el valor del factor de inflación de la varianza (FIV), tres de las variables seleccionadas contribuyeron significativa e independientemente a la ordenación (FIV < 12): materia orgánica, pendiente e isotermalidad. Los valores de las variables restantes presentaron autocorrelación alta.
Cuadro 4 Correlación entre los dos primeros ejes de la ordenación y las once variables ambientales elegidas con la opción “selección hacia delante” del programa CANOCO, para evaluar la relación entre los valores estructurales de las especies de helechos y licopodios y las variables climáticas y edáficas de Tlanchinol, Hidalgo.
| Variable ambiental | Eje 1 | Eje 2 |
|---|---|---|
| Materia orgánica | 0.61 | -0.05 |
| Pendiente | 0.26 | 0.36 |
| Evapotranspiración real anual | -0.36 | 0.22 |
| Evapotranspiración real de la temporada lluviosa del año | -0.36 | 0.22 |
| Orientación | -0.13 | 0.14 |
| Isotermalidad | 0.57 | -0.25 |
| Sodio | 0.52 | 0.24 |
| Precipitación del trimestre más cálido | -0.31 | 0.08 |
| Altitud | 0.01 | -0.34 |
| Precipitación del mes más seco | -0.44 | -0.09 |
| Temperatura medial anual | -0.14 | 0.27 |
Los datos aleatorizados generados con permutaciones Monte Carlo indican que el valor de la raíz característica del primer eje de la ordenación fue estadísticamente significativo (P < 0.05). Esto sugiere que los valores obtenidos con el RDA no se deben al azar y que el diagrama de ordenación proporciona una representación significativa de la distribución de los ensambles de helechos y licopodios en las parcelas de muestreo (Cuadro 4). Si bien existe un cambio gradual en la composición de especies a lo largo del gradiente altitudinal examinado mediante el análisis de ordenación, fue posible distinguir grupos conformados por ensambles de especies de helechos y licopodios, separados de otros grupos probablemente por tener requerimientos y tolerancias ambientales diferentes (Rodríguez, Pacheco, & Zavala, 2008).
Los gradientes de altitud se consideran entre los “experimentos naturales” más poderosos para probar respuestas ecológicas y evolutivas de la biota a influencias del medio. Sin embargo, es conveniente que los resultados se interpreten considerando factores que no necesariamente son específicos de la altitud, tales como la humedad, las horas de insolación, el viento, la duración de la temporada, la geología (Körner, 2007) e incluso las actividades humanas (Rodríguez et al., 2008).
En el BMM de Tlanchinol, la riqueza, distribución y abundancia de las especies de helechos y licopodios están definidas principalmente por la materia orgánica, isotermalidad, contenido de sodio, precipitación del mes más seco, evapotranspiración real anual y evapotranspiración real en la temporada lluviosa del año; dichas variables no fueron dependientes de la altitud ni correlacionadas con ésta. En los BMM, de manera particular, la función del clima debe resaltarse como un elemento que no solo actúa de forma directa sobre las plantas, sino que también tiene influencia, a menudo decisiva, en los procesos de formación del suelo y en la conformación de la topografía (González-Espinosa et al., 2012; Rzedowski, 1978).
La influencia de los factores edáficos sobre la distribución y abundancia de distintos grupos de plantas a escala local ha sido corroborada en varias investigaciones (Jones et al., 2008; Karst et al., 2005; Sánchez-González & López-Mata, 2005). La materia orgánica es muy importante en la estabilidad de los agregados del suelo, influye sobre la porosidad y, por lo tanto, sobre el intercambio gaseoso e hídrico, y al ser un reservorio de nutrimentos se relaciona con la disponibilidad de los mismos (Schoenholtz, Van Miegroet, & Burger, 2000). Las otras variables (precipitación del mes más seco, evapotranspiración real anual y evapotranspiración real en la temporada lluviosa del año), que resultaron importantes en la explicación de la estructura y distribución de las especies, están directamente relacionadas con la retención de humedad en el suelo y en las plantas. Las diferencias en la composición y en la dominancia (VIR) de las especies en cada parcela de muestreo son, probablemente, resultado del efecto combinado de múltiples variables ambientales; siendo la materia orgánica, el contenido de sodio, la precipitación y la temperatura de especial relevancia para ambos grupos de plantas (Kluge et al., 2006).
Conclusiones
Los resultados del presente estudio confirman que los helechos y licopodios son excelentes indicadores de las condiciones ambientales a escala local y de paisaje. Los valores de riqueza y diversidad de las especies se relacionaron principalmente con cambios en las condiciones de humedad y temperatura a escala de paisaje, pero los cambios en los valores estructurales de las especies fueron más informativos de las preferencias ecológicas a escala local. La composición de especies difirió en forma más evidente conforme la distancia geográfica entre sitios aumentó, debido probablemente a diferencias ambientales más profundas en los extremos del gradiente de altitud. La ordenación mostró que los factores edáficos, la humedad y la temperatura son las variables ambientales que mejor se relacionan con la composición y grado de importancia sinecológica de las especies a lo largo del gradiente altitudinal estudiado (1,107-1,903 m).
Agradecimientos
El presente estudio fue apoyado parcialmente por el proyecto FOMIX-HGO-2012-C01-191908: Diversidad biológica del estado de Hidalgo (tercera etapa). Los autores agradecen ampliamente las sugerencias y comentarios de dos revisores anónimos que contribuyeron a mejorar este artículo.
REFERENCIAS
Álvarez-Zúñiga, E., Sánchez-González, A., López-Mata, L., & Tejero-Díez, J. D. (2012). Composición y abundancia de las pteridofitas en el bosque mesófilo de montaña del municipio de Tlanchinol, Hidalgo, México. Botanical Sciences, 90, 163-177. doi: 10.17129/botsci.481 [ Links ]
Cárdenas, G. G., Halme, J. K., Tuomisto, H. (2007). Riqueza y distribución ecológica de especies de pteridofitas en la zona del río Yavarí-Mirín, Amazonía Peruana. Biotropica, 39, 637-646. doi: 10.1111/j.1744-7429.2007.00308.x [ Links ]
Colwell, R. K. (2015). EstimateS. Statistical estimation of species richness and shared species from samples version 8.2. Connecticut, USA: University of Connecticut. Retrieved from http://viceroy.eeb.uconn.edu/EstimateS/ [ Links ]
Cuevas, H. A. L., Sánchez-González, A., & Tejero-Díez, J. D. (2013). Pteridophytes of a semiarid natural protected area in Central Mexico. Natural Areas Journal, 33, 177- 188. doi: 10.3375/043.033.0208 [ Links ]
Ebihara, A., Dubuisson, J. Y., Iwatsuki, K., Hennequin, S., & Ito, M. (2006). A taxonomic revision of the Hymenophyllaceae. Blumea, 51, 221-280. doi: 10.3767/000651906X622210 [ Links ]
González-Espinosa, M., Meave, J. A., Ramírez-Marcial, N., Toledo-Acevedes, T., Lorea-Hernández, F. G., & Ibarra-Manríquez, G. (2012). Los bosques de niebla de México: conservación y restauración de su componente arbóreo. Ecosistemas, 21, 36-52. Retrieved frome http:// www.redalyc.org/articulo.oa?id=54026849004 [ Links ]
Hammer, O., Harper, D. A. T., & Ryan, P. D. (2009). PAST-Palaeontological Statistics, ver. 1.89. Retrieved from http://vanguardia.udea.edu.co/cursos/PAST/past.pdf [ Links ]
Hijmans, R., Guarino, L., Jarvis, A., & O’Brien, R. (2007). DIVA-GIS free, simple & effective v.7.3.0.1. CA, USA: LizardTech, Inc. Retrieved from http://www.diva-gis.org/ [ Links ]
Instituto Nacional de Estadística Geografía e Informática (INEGI). (1996). Tlanchinol, estado de Hidalgo. Aguascalientes, México: Autor. [ Links ]
Instituto Nacional de Estadística Geografía e Informática (INEGI). (2004). Anuario estadístico. Hidalgo. I, II. Aguascalientes, México. Autor. [ Links ]
Jones, M. M., Tuomisto, H., Borcard, D., Legendre, P., Clark, D. B., & Olivas, P. C. (2008). Explaining variation in tropical plant community composition: Influence of environmental and spatial data quality. Oecologia, 155, 593-604. doi: 10.1007/s00442-007-0923-8 [ Links ]
Jost, L. (2006). Entropy and diversity. Oikos, 9, 363-375. doi: 10.1111/j.2006.0030-1299.14714.x [ Links ]
Kallimanis, A. S., Ragia, V., Sgardelis, S. P., & Pantis, J. D. (2007). Using regression trees to predict alpha diversity based upon geographical and habitat characteristics. Biodiversity and Conservation, 16, 3863- 3876. doi: 10.1007/s10531-007-9186-2 [ Links ]
Karst, J., Gilbert, T. B., & Lechowics, M. J. (2005). Fern community assembly: The roles of chance and the environment at local and intermediate scales. Ecology, 86, 2473-2486. doi: 10.1890/04-1420 [ Links ]
Kluge, J., Kessler, M., & Dunn, R. R. (2006). What drives elevational patterns of diversity? A test of geometric constraints, climate and species pool effects for pteridophytes on an elevational gradient in Costa Rica. Global Ecology and Biogeography, 15, 358-371. doi: 10.1111/j.1466-822X.2006.00223.x [ Links ]
Koleff, P., Gaston, K. J., & Lennon, J. J. (2003). Measuring beta diversity for presence-absence data. Journal of Animal Ecology, 72, 367-382. doi: 10.1046/j.1365-2656.2003.00710.x [ Links ]
Körner, C. (2007). The use of ´altitude´ in ecological research. Trends in Ecology and Evolution, 22, 569-574. doi: 10.1016/j.tree.2007.09.006 [ Links ]
Labiak, P. H. (2011). Stenogrammitis, a new genus of grammitid ferns segregated from Lellingeria (Polypodiaceae). Brittonia, 63(1), 139-149. doi: 10.1007/s12228-010-9148-y [ Links ]
Luna, V. I., Ocegueda, C. S. &, Alcántara, A. O. (1994). Florística y notas biogeográficas del bosque mesófilo de montaña del municipio de Tlanchinol, Hidalgo, México. Anales del Instituto de Biología, Universidad Autónoma de México, Serie Botánica, 65, 31-62. Retrieved from www.ejournal.unam.mx/bot/065-01/BOT65104.pdf [ Links ]
Matteucci, S. D., & Colma, A. (1982). Metodología para el estudio de la vegetación. Washington, DC, USA: Secretaria General de la Organización de los Estados Americanos-Programa Regional de Desarrollo Científico y Tecnológico. [ Links ]
Mickel, J. T., & Smith, A. R. (2004). The Pteridophytes of Mexico (Memoirs of the New York botanical garden). New York, USA: NYBG press. [ Links ]
Ohmann, L. J., & Spies, A. T. (1998). Regional gradient analysis and spatial pattern of woody plant communities of Oregon forest. Ecological Monographs, 68, 151-182. doi: 10.1890/0012-9615(1998)068[0151:RGAASP]2.0.CO;2 [ Links ]
Palmer, W. M. (2015). Ordination methods for ecologists. Consultado 12-03-2014 en Consultado 12-03-2014 en http://ordination.okstate.edu/ [ Links ]
Pausas, J. G., & Austin, M. P. (2001). Patterns of plant species richness in relation to different environments: an appraisal. Journal of Vegetation Science, 12, 153-166. doi: 10.2307/3236601 [ Links ]
Pavón, N. P., & Meza, M. (2009). Cambio climático en el estado de Hidalgo: clasificación y tendencias climáticas. Hidalgo, México. Universidad Autónoma del Estado de Hidalgo. [ Links ]
Pérez-Paredes, M. G., Sánchez-González, A., & Tejero-Díez, J. D. (2014). Estructura poblacional y características del hábitat de dos especies de Cyatheaceae del estado de Hidalgo. Botanical Sciences, 92, 259-271. doi: 10.17129/botsci.48 [ Links ]
Pinokiyo, A., Singh, K. P., & Singh, J. S. (2008). Diversity and distribution of lichens in relation to altitude within a protected biodiversity hot spot, north-east India. The Lichenologist, 40, 47-62. doi: 10.1017/S0024282908007214 [ Links ]
Ponce-Vargas, A., Luna-Vega, I., Alcántara-Ayala, O., & Ruiz-Jiménez, C. A. (2006). Florística del bosque mesófilo de montaña de Monte Grande, Lolotla, Hidalgo, México. Revista Mexicana de Biodiversidad, 77, 177-190. www.ejournal.unam.mx/bio/BIOD77-02/BIOS770204.pdf [ Links ]
Rahbek, C. (2005). The role of spatial scale and the perception of large-scale species-richness patterns. Ecology Letters, 8, 224-239. doi: 10.1111/j.1461-0248.2004.00701.x [ Links ]
Richter, M. (2008). Tropical mountain forests - distribution and general features. In R. S. Gradstein, J. Homeier, & D. Gansert (Eds.). The tropical mountain forest-patterns and processes in a biodiversity hotspot (pp. 7-24). Germany: The Biodiversity and Ecology Series. [ Links ]
Rodríguez, R. L., Pacheco, L., & Zavala, H. J. A. (2008). Pteridofitas indicadoras de alteración ambiental en el bosque templado de San Jerónimo Amanalco, Texcoco, México. Revista de Biología Tropical, 56, 641- 656. doi: 10.15517/rbt.v56i2.5614 [ Links ]
Rzedowski, J. (1978). Vegetación de México. México, D. F.: Limusa. [ Links ]
Sánchez-González, A., & López-Mata, L. (2005). Plant species richness and diversity along an altitudinal gradient in the Sierra Nevada, Mexico. Diversity and Distribution, 11, 567-575. doi: 10.1111/j.1366-9516.2005.00186.x [ Links ]
Sánchez-González, A., Álvarez-Zúñiga, E., & Tejero-Díez, J. D. (2010). Richness and distribution patterns of ferns and lycopods in Los Mármoles National Park, Hidalgo, Mexico. The Journal of the Torrey Botanical Society, 137, 373-379. doi: 10.3159/10-RA-002 [ Links ]
Sang, W. (2008). Plant diversity patterns and their relationships with soil and climatic factors along an altitudinal gradient in the middle Tianshan Mountain area, Xinjiang, China. The Ecological Society of Japan, 24, 303-314. doi:10.1007/s11284-008-0507-z [ Links ]
Schoenholtz, S. H., Van Miegroet, H., & Burger, J. A. (2000). A review of chemical and physical properties as indicators of forest soil quality: Challenges and opportunities. Forest Ecology and Management, 138, 335-356. doi: 10.1016/S0378-1127(00)00423-0 [ Links ]
Slik, J. W. F., Raes, N., Shin-Ichiro, A., Brearley, Q. F., Cannon, H. C., Meijaard, E., & Wulffraat, S. (2009). Environmental correlates for tropical tree diversity and distribution patterns in Borneo. Diversity and Distributions, 15, 523- 532. doi: 10.1111/j.1472-4642.2009.00557.x [ Links ]
StatSoft Inc. (2004). STATISTICA (data analysis software system) , version 7. Tulsa, OK, USA: Author. [ Links ]
Tejero-Díez, J. D., Torres-Díaz, A. N., & Gual-Díaz, M. (2014). Licopodios y helechos en el bosque mesófilo de montaña de México. En M. Gual-Díaz & A. Rendón-Correa (Eds.), Bosques mesófilos de montaña de México, diversidad, ecología y manejo (pp. 197-220). México, D. F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. [ Links ]
Ter Braak, C. J. F., & Šmilauer, T. (1998). CANOCO Reference manual and user´s guide to Canoco for Windows: Software for canonical community ordination (version 4). New York, USA: Microcomputer Power. [ Links ]
Vázquez-Garcia, J. A. (1995). Cloud forest archipelagos: Preservation of fragmented montane ecosystems in tropical America. In L. S. Hamilton, J. O. Juvik & F. N. Scatena (Eds.), Tropical montane cloud forests (pp. 315- 332). New York, USA: Springer-Verlag. [ Links ]
Villaseñor, J. L. (2010). El bosque húmedo de montaña en México y sus plantas vasculares: catálogo florístico-taxonómico. México, D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad-Universidad Nacional Autónoma de México. Retrieved from http://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/Bosque%20humedo%20de%20montana.pdf [ Links ]
Wana, D., & Beierkuhnlein, C. (2011). Responses of plant functional types to environmental gradients in the south-west Ethiopian highlands. Journal of Tropical Ecology, 27, 289-304. doi: 10.1017/S0266467410000799 [ Links ]
Watkins, J. E., Cardelu, C., Colwell, R. K., & Moran, R. C. (2006). Species richness and distribution of ferns along an elevational gradient in Costa Rica. American Journal of Botany, 93, 73-83. doi: 10.3732/ajb.93.1.73 [ Links ]
Whittaker, R. J., Willis, K. J., & Field, R. (2001). Scale and species richness: Towards a general, hierarchical theory of species diversity. Journal of Biogeography, 28, 453-470. doi: 10.1046/j.1365-2699.2001.00563.x [ Links ]
WorldClim-Global Climate Data (2015). WorldClim-Global Climate Data. Free climate data for ecological modeling and GIS. Consultado 20-08-2014 en Consultado 20-08-2014 en http://worldclim.org/bioclim [ Links ]
Zhu, Y., Jiang, Y., Liu, Q., Xiong, M., & Kang, M. (2007). Altitudinal pattern of vascular plant species richness based on equal-area belts in Mt. Helan. Biodiversity Science, 15, 408-418. doi: 10.1360/biodiv.060307 [ Links ]
Recibido: 30 de Septiembre de 2015; Aprobado: 28 de Marzo de 2016











 texto en
texto en