Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.20 no.3 Chapingo sep./dic. 2014
https://doi.org/10.5154/r.rchscfa.2014.01.001
Crecimiento de Cedrela odorata L. Biofertilizada con Rhizophagus intraradices y Azospirillum brasilense en vivero
Growth of Cedrela odorata L. Biofertilized with Rhizophagus intraradices and Azospirillum brasilense under nursery conditions
Juan F. Aguirre-Medina1*; Francisco O. Mina-Briones1; Jorge Cadena-Iñiguez2; Joni D. Dardón-Zunun1; Dante A. Hernández-Sedas1
1 Universidad Autónoma de Chiapas, Facultad de Ciencias Agrícolas Campus IV. Entronque carretera costera y Huehuetán pueblo, km 1. C. P. 30660. Huehuetán, Chiapas, México. Correo-e: juanf56@prodigy.net.mx Tel.: 964 6270128, fax 964 6270439 (* Autor para correspondencia).
2 Colegio de Postgraduados, campus Montecillo. km 36.5 carretera México-Texcoco. C. P. 56230. Texcoco, Edo. de México, México.
Recibido: 21 de enero, 2014
Aceptado: 20 de agosto, 2014
RESUMEN
Cedrela odorata L. es una especie que se distingue por la calidad de su madera. El cedro establecido en campo debe adaptarse a cambios en disponibilidad de recursos; la sobrevivencia es mayor cuando el sistema radical se asocia con microorganismos que mejoran la nutrición y crecimiento. El objetivo del presente trabajo fue evaluar el efecto de Rhizophagus intraradices y Azospirillum brasilense sobre el crecimiento de C. odorata y la capacidad de absorción de nitrógeno (N) y fósforo (P). Las semillas de cedro se sembraron en macetas de acuerdo con los siguientes tratamientos: testigo, fertilización 15N-15p-15K, R. intraradices, A. brasilense, R. intraradices + A. brasilense, y R. intraradices + A. brasilense + fertilización 15N-15p-15K. Las variables morfológicas y fisiológicas de rendimiento y la colonización radical se registraron cada 28 días, y los contenidos de N y P, al final del experimento (140 días). En general, R. intraradices promovió mayor crecimiento vegetal (P ≤ 0.05) de los componentes morfológicos y fisiológicos del rendimiento. La altura máxima (97 cm) se registró en las plantas con R. intraradices + A. brasilense + fertilización 15N-15p-15K, representando 40 % más altura que el testigo. El N y P incrementaron con la inoculación de los microorganismos solos y combinados.
Palabras clave: Componentes del rendimiento, nitrógeno, fósforo, colonización micorrízica.
ABSTRACT
Cedrela odorata L. is a species distinguished by the quality of its wood. Cedar established in the field must adapt to changes in resource availability; survival is greater when the root system is associated with microorganisms that improve nutrition and growth. The aim of this study was to evaluate the effect of Rhizophagus intraradices and Azospirillum brasilense on the growth of C. odorata and its nitrogen (N) and phosphorus (P) uptake capacity. Cedar seeds were sown in pots in accordance with the following treatments: control, 15N-15P-15K fertilization, R. intraradices, A. brasilense, R. intraradices + A. brasilense, and R. intraradices + A. brasilense + A. brasilense + 15N-15P-15K fertilization. Morphological and physiological yield variables and root colonization were recorded every 28 days, and N and P contents at the end of the experiment (140 days). In general, R. intraradices promoted greater plant growth (P ≤ 0.05) of morphological and physiological yield components. The maximum height (97 cm) was recorded in plants with R. intraradices + A. brasilense + 15N-15P-15K fertilization, representing 40 % more height than the control. N and P increased with the inoculation of the microorganisms alone and combined.
Keywords: Yield components, nitrogen, phosphorous, mycorrhizal colonization.
INTRODUCCIÓN
Los ecosistemas forestales son afectados por diversos factores ambientales y antropogénicos como la sequía y el establecimiento de cultivos anuales; dichas acciones han ocasionado la degradación (Secretaria del Medio ambiente y Recursos Naturales [SEMARNAT], 2005). Algunas especies maderables como Cedrela odorata L., con amplia distribución en el trópico e importancia económica y ecológica (Galán, De los Santos, & Valdez, 2008), han disminuido su abundancia natural por aumento de la explotación y la regeneración poco exitosa.
Las especies maderables de interés comercial como el cedro son propagadas masivamente en vivero mediante procedimientos rápidos con diferentes sustratos. Sin embargo, tales procedimientos no han considerado el fortalecimiento del desarrollo radical de la planta huésped mediante la biofertilización con microrganismos del suelo. Los biofertilizantes son productos a base de un microorganismo no patógeno que al inocularse puede vivir asociado o en simbiosis con la planta. Estos tipos de microorganismos ayudan a incrementar el suministro, disponibilidad y acceso físico de nutrimentos mediante diversos mecanismos de acción e inducen mayor crecimiento en la planta huésped. Los microrganismos más utilizados en la agricultura mexicana son hongos endomicorrízicos y bacterias fijadoras de N; ambos han favorecido el desarrollo vegetal y reproductivo de los cultivos anuales en los campos de los productores (Aguirre-Medina, 2006) y en cultivos perennes en vivero. El efecto benéfico de las micorrizas se ha demostrado en Coffea arabica L. (Aguirre-Medina et al., 2011) y Tabebuia donnell-smithii (Rose) Miranda (Aguirre-Medina, Aguirre-Cadena, Cadena-Iñiguez, & Avendaño-Arrazate, 2012). También se ha reportado el efecto de Glomus intraradices Schenk et Smith en co-inoculación con la bacteria fijadora de N Azospirillum brasilense Tarrand, Krieg et Döbereiner en Theobroma cacao L. (Aguirre-Medina, Mendoza-López, Cadena-Iñiguez, & Avendaño-Arrazate, 2007).
El objetivo del presente trabajo fue evaluar el efecto de los microorganismos Rhizophagus intraradices (Schenck et Sm.) Walker et Schuessler y A. brasilense sobre el crecimiento de C. odorata y su capacidad de absorción de N y P.
MATERIALES Y MÉTODOS
La investigación se desarrolló (febrero a noviembre de 2012) en un vivero del Campo Experimental Rosario Izapa, ubicado en el km 18 de la carretera Tapachula-Cacaohatan, municipio de Tuxtla Chico, Chiapas. El vivero se localiza en el paralelo 14o 40' LN y 92o 10' LO, a 435 m de altitud. El clima es cálido húmedo con lluvias en verano e influencia de monzón. La precipitación promedio es de 4,720 mm anuales y la temperatura media, considerada isotermal, es de 25.4 °C.
Las semillas de C. odorata se colectaron de árboles de copa densa, fuste recto y sin presencia de daños por plagas y enfermedades. La colecta se realizó en la colonia El Triunfo, municipio de Escuintla, Chiapas (15° 19' LN - 92° 33' LO). El sustrato se preparó con una mezcla de suelo, arena de río lavada y estiércol de bovino. El suelo se obtuvo a una profundidad de 0-30 cm en los terrenos de Rosario Izapa, Chiapas, caracterizados como andosoles mólicos (Grajales, De la Piedra, & López, 2008). El suelo se mezcló con arena de rio previamente lavada y tamizada, en proporción 1:1 (V/V). El estiércol de bovino, previamente deshidratado, esterilizado (Bunema® 55 GE [Metam sodio N-metil ditiocarbamato, dosis de 500 litros⋅ha-1], Buckman, México) y molido, ocupó 10 % del volumen de bolsas de plástico (25 x 35 cm) con capacidad de 6 kg. Cabe mencionar que el suelo no se esterilizó con el fin de conocer la interacción con la microbiota regional. Fisicoquímicamente, el sustrato tuvo los siguientes componentes y características: arena (79.76 %), limo (12 %), arcilla (8.24 %), textura arena migajonosa, materia orgánica (8.9 %), pH 7.74, N (0.43 %), P (179 ppm), K (906 ppm), Na (52 ppm), Mg (108 ppm), Ca (257 ppm), capacidad de intercambio catiónico (CIC: 4.72 mg⋅100 g-1), conductividad eléctrica (CE: 0.86 dS⋅m-1). Las bolsas se perforaron en la parte inferior para favorecer el drenaje y se llenaron con el sustrato. Las bolsas se colocaron sobre bancales de fierro. El hongo R. intraradices con 40 esporas⋅g de suelo-1 y 95 % de colonización radical en la planta huésped se aplicó en las semillas de C. odorata. La cantidad de hongo utilizada se calculó con base en el 6 % del peso de la semilla. La bacteria A. brasilense fue proporcionada por la Benemérita Universidad Autónoma de Puebla (BUAP) con 9 x 106 ufc⋅g de turba-1. La cantidad de bacteria aplicada en las semillas de C. odorata se calculó con base en el 4 % del peso de la semilla. Los microorganismos fueron adheridos a las semillas con carboximetilcelulosa.
Las semillas se sembraron en macetas, a 3 cm de profundidad, de acuerdo con los siguientes tratamientos: Testigo, fertilización 15N-15P-15K, R. intraradices, A. brasilense, R. intraradices + A. brasilense, y R. intraradices + A. brasilense + fertlización 15N-15P-15K. Los tratamientos se distribuyeron en un diseño completamente al azar con cinco repeticiones. Las variables morfológicas (altura de la planta, diámetro del tallo, número de hojas y colonización radical) y fisiológicas (área foliar y biomasa seca de la raíz, tallo y hoja) de rendimiento se registraron cada 28 días hasta el día 140. La altura de la planta se obtuvo con una cinta métrica midiendo de la corona radical hasta la yema apical; el diámetro del tallo se midió a 5 cm de distancia de la corona radical hacia el ápice con un vernier digital (AutoTEC™, China); y el área foliar (cm2) se obtuvo con un integrador de área foliar (LICOR, LI 3100a, USA). La colonización micorrizica (%) se determinó según Phillips y Hayman (1970). Por otra parte, la materia seca se determinó en estufa de aire forzado por 72 h a 75-80 °C. Los componentes del rendimiento de la parte aérea y radical se pesaron en una báscula analítica (Ohaus, Adventurer Pro, USA). Finalmente, los contenidos de N (Micro-Kjeldahl) y P se cuantificaron en un espectro-fotómetro (Thermo Fisher Scientific, modelo 400 ¼, USA).
Los efectos entre tratamientos se determinaron a través de un análisis de varianza para cada variable con el procedimiento PROC ANOVA. Posteriormente se hizo una comparación de medias (Tukey, P ≤ 0.05) utilizando el programa computacional Statistical Analysis System, versión 8.1 (SAS, 1999-2000).
RESULTADOS Y DISCUSIÓN
El Cuadro 1 muestra el crecimiento de las plantas de C. odorata con los tratamientos aplicados (biofertilizantes y fertilizante químico). La altura de la planta fue estadísticamente diferente (P ≤ 0.05) durante los muestreos a los 28, 56, 112 y 140 días. La altura máxima alcanzada fue de 97 cm y se registró en las plantas con R. intraradices + A. brasilense + fertilización 15N-15P-15K, representando 40 % más altura que el testigo absoluto.
En el caso del diámetro del tallo, las diferencias (P ≤ 0.05) se encontraron a los 28 y 84 días. Al final del experimento (140 días), estadísticamente, el diámetro del tallo fue similar; sin embargo, en las plantas inoculadas con R. intraradices fue 8 % mayor que el testigo. En otras plantas como el cacao, se reporta mayor incremento en el grosor del tallo con A. brasilense que con G. intraradices (Aguirre-Medina et al., 2007). En Tectona grandis L. E y Astronium graveolens Jacq., el incremento del diámetro del tallo se logró con Glomus fasciculatum (Thaxter) Gerdemann & Trappe y representó 11.8 % más en comparación con el testigo (Hernández & Salas, 2009).
El número de hojas fue estadísticamente diferente (P ≤ 0.05) a los 56,84,112 y 140 días. La simbiosis doble (R. intraradices y A. brasilense) sin fertilizante químico produjo nueve hojas más que el testigo (Cuadro 1). En el caso de los hongos micorrízicos, la actividad fotosintética se incrementa después de la colonización (Sylvia, 2005). En cultivos perennes como el cacao (Aguirre-Medina et al., 2007) y cafeto (Aguirre-Medina et al., 2011) se ha registrado mayor desarrollo vegetal con la inoculación de microorganismos. Este hecho sugiere que el incremento en el desarrollo de la planta hospedera, puede deberse a una mayor capacidad de absorción de nutrientes.
En todos los casos, los tratamientos con los microorganismos solos o combinados indujeron mayor crecimiento en el cedro en comparación con el testigo. Posiblemente, el crecimiento se produjo por el aumento en la capacidad de absorción de las plantas micorrizadas (Leigh, Hodge, & Fitter, 2009) y la mineralización y solubilización de nutrientes (Wright, Scholes, Read, & Rolfe, 2005), o bien, por el mayor crecimiento radical promovido por A. brasilense (Hungría, Campo, Souza, & Pedresa, 2004). Las diferencias pueden estar influenciadas por la fase de colonización de los microorganismos en la raíz, sobre todo en el primer muestreo (28 días), que corresponde a la fase de establecimiento de la simbiosis. La simbiosis micorrízica genera un sistema radical complementario que favorece el aporte de nutrientes y agua a la planta y, con ello, cambios en su fisiología (Barea, Azcón y Azcón-Aguilar, 2002) que pudieron inducir las diferencias en el desarrollo de las estructuras de la planta (Cuadro 1).
La colonización radical del cedro fue amplia desde el inicio de la evaluación con o sin la inoculación de los microorganismos. A partir de los 56 ddt, la colonización incrementó al doble en los tratamientos biofertilizados. La presencia de otros hongos micorrízicos en el sustrato, como parte de la microbiota regional, se confirma con los porcentajes de colonización en los testigos sin biofertilización. Al respecto, el número de esporas no debió ser un factor limitante, pero la menor inducción en el desarrollo vegetal con la endomicorriza contenida en el sustrato sin biofertilizar sugiere efecto diferencial en la capacidad para estimular el crecimiento del cedro. La inoculación con A. brasílense promovió la colonización radical de las micorrizas contenidas en el sustrato. Los porcentajes fueron similares a los encontrados con la inoculación de R. intraradices. Zambrano y Díaz (2008) señalan que las bacterias promovieron selectivamente el establecimiento de la simbiosis de Gmelina arbórea Roxb con los hongos. Estos resultados confirman la capacidad de colonización de R. intraradices, como ha sucedido también en otros cultivos anuales y perennes (Aguirre-Medina et al., 2006, 2007, 2011; Wright et al., 2005).
El Cuadro 2 presenta las variables fisiológicas evaluadas en C. odorata biofertilizada y fertilizada químicamente. El peso seco radical presentó la mayor variación de respuesta en los tratamientos biofertilizados. La biomasa radical incrementó cuando los microorganismos se aplicaron individualmente. Al final de la evaluación, el mayor incremento se obtuvo con R. intraradices y representó el doble de la biomasa radical del testigo y alrededor de 40 % más que los otros tratamientos biofertilizados. El mayor crecimiento de la raíz puede estar relacionado con el incremento de algunas sustancias del crecimiento, producto de la simbiosis. Aguirre-Medina et al. (2011) citan incremento en el peso seco del sistema radical de C. arabica, al aplicar G. intraradices y A. brasilense solos y combinados.
La biomasa del tallo y la hoja muestran poca variación durante los muestreos iniciales y la respuesta más contrastante se presentó al final del estudio. El peso seco del tallo fue mayor con R. intraradices y fue estadísticamente superior (P ≤ 0.05) que el resto de los tratamientos a los 140 días después del tratamiento (ddt) (Cuadro 2). La falta de interacción entre los tratamientos puede estar relacionada con la demanda de fotosintatos por los microorganismos en la etapa inicial de su establecimiento. En esta etapa, la disponibilidad de carbohidratos hacia el vástago disminuye, dado que la mayoría de los compuestos son requeridos por la raíz (Roveda & Polo, 2007). Wright et al. (2005) reportaron concentraciones mayores de carbohidratos solubles en las raíces micorrizadas de maíz. Después del periodo de establecimiento, normalmente, inicia el mecanismo de transporte de nutrientes a la planta y el concomitante incremento en biomasa. Resultados semejantes se encontraron en plantas de Acacia farnesiana (L.) Willd. y Prosopis glandulosa Torr. inoculadas con G. intraradices FS-18 (Hernández-Martínez, Cetina-Alcalá, González-Chávez, & Cervantes-Martínez, 2006).
El peso seco de las hojas fue contrastante por efecto de los microorganismos de los 112 a los 140 ddt, pero la mayor influencia se presentó al final de la evaluación con R. intraradices (Cuadro 2). El área foliar presenta similitud con la biomasa seca de la hoja, en general, la respuesta a la inoculación de los microorganismos a través del tiempo presentó diferencias estadísticas desde los 28 ddt; este efecto fue semejante hasta los 112 ddt. Al final del estudio, la mayor área foliar del cedro se presentó con R. intraradices (Cuadro 2). Los beneficios de la simbiosis micorrízica sobre la inducción de mayor área foliar en la planta huésped se han encontrado en otras especies como Eucalyptus camaldulensis Dehnh (Pereira, Sánchez, Ríos, & Miguel, 2001) y C. arabica (Aguirre-Medina et al., 2011). Los resultados anteriores indican que la acumulación de materia seca en los órganos de la planta de C. odorata varía según el microorganismo aplicado y que su efecto también es diferencial a través del tiempo.
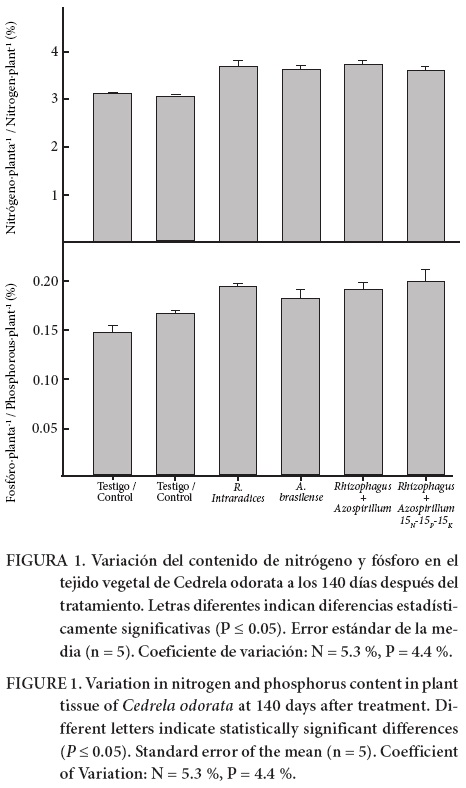
Con respecto a los nutrientes, la Figura 1 muestra los contenidos en C. odorata a los 140 ddt. El contenido de N fue mayor y estadísticamente diferente (P ≤ 0.05) en los tratamientos biofertilizados. En otros estudios, la inoculación con hongos micorrizicos incrementó el contenido de N en el tejido vegetal de A. graveolens Jacq., T. grandis, T. amazónica (J. F. Gmel.) Excell, G. arborea (Hernández & Salas, 2009) y C. arabica (Aguirre-Medina et al., 2011). El contenido de P incrementó en los tratamientos con R. intraradices y fueron estadísticamente diferentes (P ≤ 0.05) al testigo y al tratamiento fertilizado químicamente. Uno de los principales beneficios que las plantas reciben en simbiosis con los hongos micorrizicos es la aportación de P. Muchos estudios han demostrado que las plantas micorrizadas absorben P del suelo de manera más eficiente que las plantas no colonizadas (Aguirre-Medina & Kohashi-Shibata, 2002). Se han obtenido resultados semejantes en el incremento de absorción de P en plantas de C. arabica y Araucaria angustifolia (Bertol.) Kuntze inoculadas con G. intraradices y R. intraradices, respectivamente (Aguirre-Medina et al., 2011; Moreira-Souza & Cardoso, 2002). De acuerdo con los resultados obtenidos, los microorganismos pueden facilitar el transporte de N y P en las plantas de cedro; cabe mencionar que es posible establecer que R. intraradices beneficia la reducción del uso de fertilizantes fosfatados en los viveros.
CONCLUSIONES
La biofertilización con R. intraradices, solo o en combinación con A. brasilense, promovió mayor crecimiento vegetal en los componentes morfológicos y fisiológicos del rendimiento de la planta de C. odorata. Los contenidos de N y P en el tejido vegetal del cedro incrementaron con la inoculación de los microrganismos solos o combinados.
REFERENCIAS
Aguirre-Medina, J. F., & Kohashi-Shibata, J. (2002). Dinámica de la colonización micorrizica y su efecto sobre los componentes del rendimiento y el contenido de fósforo en frijol común. Agricultura Técnica en México, 28 (1), 23-33. Obtenido de http://www.inifap.gob.mx/SitePages/revistas/rmca.aspx [ Links ]
Aguirre-Medina, J. F. (2006). Biofertilizantes microbianos: Experiencias agronómicas del programa nacional del INIFAP en México. México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias-Centro de Investigaciones Regionales Pacífico Sur-Campo Experimental Rosario Iza-pa. Obtenido de http://biblioteca.inifap.gob.mx:8080/jspui/handle/123456789/3633 [ Links ]
Aguirre-Medina, J. F., Mendoza-López, A., Cadena-Iñiguez, J., & Avendaño-Arrazate C. H. (2007). La biofertilización del cacao (Theobroma cacao L.) en vivero con Azospirillum brasilense Tarrand, Krieg et Döbereiner y Glomus intraradices Schenk et Smith. Interciencia, 32(8), 1-6. Obtenido de http://www.redalyc.org/articulo.oa?id=33932808 [ Links ]
Aguirre-Medina, J. F., Moroyoqui-Ovilla, D. M., Mendoza-López, A., Cadena-Iñiguez, J., Avendaño-Arrazate, C. H., & Aguirre-Cadena, J. F. (2011). Aplicación de A. brasilense y G. intraradices a Coffea arabica en vivero. Agronomía Mesoamericana, 22(1), 1-10. Obtenido de http://www.mag.go.cr/rev_meso/v22n01_071.pdf [ Links ]
Aguirre-Medina, J. F., Aguirre-Cadena, J. F., Cadena-Iñiguez, J., & Avendaño-Arrazate, C. H. (2012). Biofertilización en plantas de la selva húmeda tropical. México: Colegio de Postgraduados. [ Links ]
Barea, J. M., Azcón, R., & Azcón-Aguilar, C. (2002). Mycorrhizo-sphere interactions to improve plant fitness and soil quality. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 81(1-4), 343- 351. Obtenido de http://bashanis.org/barea/bareafitness.pdf [ Links ]
Galán, L. R., De los Santos, P. H. M., & Valdez, H. J. I. (2008). Crecimiento y rendimiento de Cedrela odorata L. y Tabebuia donnell-smithii Rose en San José Chacalapa, Pochutla, Oaxaca. Madera y Bosques, 14(2), 65-82. Obtenido de http://www.redalyc.org/pdf/617/61711316006.pdf [ Links ]
Grajales, M., De la Piedra, R., & López, J. (2008). Diagnóstico biofísico y socioeconómico de la parte media y alta de la subcuenca Cohatán en el Soconusco, Chiapas. Avances en Investigación Agropecuaria, 12(1), 29-44. Obtenido de http://www.ucol.mx/revaia/portal/pdf/2008/enero/2.pdf [ Links ]
Hernández, W., & Salas, E. (2009). La inoculación con Glomus fasciculatum en el crecimiento de cuatro especies forestales en vivero y campo. Agronomía Costarricense, 33(1), 17-30. Obtenido de http://www.latindex.ucr.ac.cr/agrocostar-33-1/agrocostar-33-1-02.pdf [ Links ]
Hernández-Martínez, M., Cetina-Alcalá, V. M., González-Chávez, M. C., & Cervantes-Martínez, C. T. (2006). Inoculación micorrízica y su efecto en el crecimiento de dos leguminosas arbóreas. Terra Latinoamericana, 24(1), 65-73. Obtenido de http://www.redalyc.org/articulo.oa?id=57311494008&idp=1&cid=2815540 [ Links ]
Hungría, M., Campo, R. J., Souza, E. M., & Pedrosa, F. O. (2004). Inoculation with selected strains of Azospirillum brasilense and A. lipoferum improves yields of maize and wheat in Brazil. Plant and Soil, 331, 413-425. doi: 10.1007/s11104-009-0262-0 [ Links ]
Leigh, J., Hodge, A., & Fitter, A. H. (2009). Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material. New Phytologist, 181, 199-207. doi: 10.1111/j.1469-8137.2008.02630.x [ Links ]
Moreira-Souza, M., & Cardoso, E. J. B. N. (2002). Dependência micorrízica de Araucaria angustifolia (Bert.) O. Ktze. sob doses de fósforo. Revista Brasileira de Ciência do Solo, 26(4), 905-912. Obtenido de www.redalyc.org/pdf/1802/180218306008.pdf [ Links ]
Pereira, G., Sanchez, M., Rios, D., & Miguel, A. H. (2001). Micorrizas vesículo arbusculares y su incidencia en el crecimiento de plántulas de Eucalyptus camaldulensis Dehnn. Bosque, 22(2), 39-44. Obtenido de http://mingaonline.uach.cl/pdf/bosque/v22n2/art04.pdf [ Links ]
Phillips, J. M., & Hayman, D. J. (1970). Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 55, 158-161. doi: 10.1016/S0007-1536(70)80110-3 [ Links ]
Roveda, R., & Polo, C. (2007). Mecanismos de adaptación de maíz asociado a Rhizophagus spp. en suelos con bajo fósforo disponible. Agronomía Colombiana, 25(2), 349-356. Obtenido de http://www.redalyc.org/pdf/1803/180320296019.pdf [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). (2005). Indicadores básicos del desempeño ambiental de México: 2005. Proyecto PNUD-SEMARNAT. México, D. F.: Autor. Consultado 12-02-13 en http://app1.semarnat.gob.mx/dgeia/indicadores04/index.htm [ Links ]
Statistical Analysis System (SAS). (1999-2000). SAS/STAT user's Guide: Ver 8.1. Cary NC, USA: SAS Institute Inc. [ Links ]
Sylvia, M. D. (2005). Mycorrhizal symbioses. In M. D. Sylvia, J. J. Fuhrmann, G. P. Harte, & A. D. Zuberer (Eds.), Principies and applications of soil microbiology (pp. 263-282, 2nd ed.). New Jersey, USA. Pearson Prentice Hall. [ Links ]
Wright, D. P., Scholes, J. D., Read, D. J., & Rolfe, S. A. (2005). European and African maize cultivars differ in their physiological and molecular responses to mycorrhizal infection. New phytologist, 167, 881-896. doi.10.1111/ j. 1469-8137.2005.01472.x [ Links ]
Zambrano, J. A., & Diaz, L. A. (2008). Efecto de la inoculación de Azospirillum brasilense y Glomus sp. en Gmelina arbórea durante su germinación y manejo en vivero. Universitas Scientiarum, 13(2), 162-170. Obtenido de http://revistas.javeriana.edu.co/index.php/scientarium/article/view/1420/882 [ Links ]














