Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.18 no.3 Chapingo ago./dic. 2012
https://doi.org/10.5154/r.rchscfa.2011.11.093
Interacción planta-hongos micorrízicos arbusculares
Plant-arbuscular mycorrhizal fungi interactions
Gabriel Camarena-Gutiérrez
Unidad de Morfología y Función, FES Iztacala, UNAM. Av. de los Ejidos Núm. 1, Los Reyes Iztacala, Tlalnepantla, Estado de México, MÉXICO. C. P. 547090. Correo-e: datura@servidor.unam.mx.
Recibido: 13 de diciembre de 2011
Aceptado: 19 de abril de 2012
RESUMEN
La simbiosis de la micorriza arbuscular está formada por las raíces de más del 80 % de las especies de plantas terrestres y los hongos Zigomicetes del Orden Glomales. Los efectos benéficos de esta simbiosis suceden como resultado de un diálogo molecular complejo entre los socios simbióticos. La identificación de las moléculas involucradas en este proceso es un prerrequisito para una mayor comprensión de la simbiosis. Hay evidencia de los eventos de señalización-reconocimiento en diferentes estados de las interacciones planta-hongo en la micorriza arbuscular, pero no se conoce la naturaleza de las moléculas señal y los procesos de percepción-transducción. Para conocer el potencial de la micorriza arbuscular en la agricultura sustentable, es preciso identificar las moléculas principales de la interacción planta-hongo. Existen numerosos métodos disponibles para el análisis molecular de los hongos arbusculares que ayudan a comprender la interacción dinámica entre las plantas y éstos.
Palabras Clave: Micorriza, estrigolactonas, aparato de pre-penetración
ABSTRACT
Arbuscular mycorrhizal symbiosis is formed between the roots of over 80 % of all terrestrial plant species and Zygomycete fungi of the order Glomales. The beneficial effects of this symbiosis occur as a result of a complex molecular dialogue between the two symbiotic partners. Identifying the molecules involved in this dialogue is a prerequisite for a better understanding of the symbiosis. Although there is evidence for an interplay of signaling-recognition events at different stages during plant-fungal interactions in arbuscular mycorrhiza, the nature of signaling molecules and signal perception/trans-duction processes are still not known. To unlock the potential of arbuscular mycorrhiza for sustainable agriculture, we must identify the key molecular players. A number of methods are available for those researchers considering the addition of molecular analyses of arbuscular fungi to their research projects and weighing the various approaches they might take. Increasingly powerful molecular methods for analyzing arbuscular communities make this area of research available to a much wider range of researchers.
Keywords: Mycorrhiza, strigolactones, pre-penetration apparatus.
INTRODUCCIÓN
Las plantas han desarrollado numerosas estrategias desde que colonizaron los ecosistemas terrestres, para hacer frente a los diversos retos bióticos y abióticos. Una de las más eficaces es la capacidad de los sistemas de raíces, para establecer relaciones simbióticas mutualistas benéficas con los microorganismos. La micorriza, una forma intrincada de asociación de las raíces con algunos grupos de hongos, es la más frecuente y representa a los órganos de absorción de la mayoría de las plantas en la naturaleza (Gianinazzi-Pearson, 1984). Esta asociación cumple una función muy importante en la explotación eficaz de los recursos minerales del suelo y en la protección de las raíces contra una serie de patógenos. Por ello, las micorrizas son fundamentales para la supervivencia de muchos taxones de plantas en diversos ecosistemas, incluyendo muchas especies de cultivo (Bethlenfalvay & Linderman, 1992).
El término micorriza describe la asociación simbiótica de las raíces de plantas con hifas de hongos especializados del suelo, y se considera el órgano principal involucrado en la captación de nutrientes por la mayoría de las plantas terrestres. Se pueden distinguir siete tipos de asociaciones en función de su morfología y de los taxones de plantas asociados con hongos: 1) Ectendo-micorrizas. Son asociaciones formadas entre un número limitado de ascomicetos y los géneros de coníferas Pinus y Larix; tienen un manto y una estructura compleja altamente ramificada llamada red de Hartig. Después de la formación de esta red, se desarrolla la hifa intracelular en células de la epidermis y en la corteza (Yu, Egger, & Peterson, 2001); 2) Ericoide. Representa un tipo único de micorrizas confinadas a varias familias del orden Ericales. Las plantas que desarrollan este tipo de micorriza forman raíces laterales muy finas que carecen de crecimiento secundario. Cada raíz consiste de un cilindro vascular delgado, una o dos capas de células corticales y una capa de epidermis. La asociación incluye la colonización de las células de la epidermis por la hifa, seguida de la formación de un complejo de hifas ramificadas (Cairney & Ashford, 2002); 3) Arbutoide. Dos géneros de la familia Ericaceae (Arbutus y Arctostaphylos) y varios géneros en Pyrolaceae forman micorrizas arbutoides típicas. Estas micorrizas tienen un manto, una red de Hartig y forman complejos hifales intracelulares confinados a la epidermis (Molina & Trappe, 1982); 4) Monotropoide. Las especies de plantas que tienen esta micorriza son no fotosintéticas. La evidencia sugiere que los hongos que forman este tipo de micorriza se asocian también a árboles vecinos fotosintéticamente activos, y que han desarrollado un mecanismo para obtener sus fotosintatos. Bjõrkman (1960) demostró que se pueden mover fotosintatos desde árboles vecinos a Monotropa hypopithys; 5) Orquideoide. Sólo se desarrollan en la familia Orchidaceae. La principal característica de esta micorriza es la formación de pelotones dentro de las células de la planta (Smith & Read, 1997); 6) Ectomicorriza. Aunque hay mucha variación estructural y morfológica, se pueden distinguir tres características reconocidas para tipificar esta asociación: la formación de un manto o vaina de hifas que cubren porciones considerables de raíces laterales, el desarrollo de hifas entre las células de la raíz para formar la red de Hartig, y la hifa que emana del manto y crece en el suelo (Peterson, Massicote, & Melville, 2004); 7) Arbuscular. También llamada micorriza vesicular-arbuscular. Es una asociación entre las raíces de la mayoría de plantas vasculares y un grupo pequeño de hongos del nuevo phylum Glomeromycota (Schübler, Schwarzott, & Walker, 2001). Esta micorriza se caracteriza por la presencia de una hifa intra o intercelular, arbúsculos (hifas finamente ramificadas que participan en el intercambio de nutrientes), micelio extra-radical que conecta a la raíz con el suelo, y esporas formadas en el micelio extra-radical. Algunas especies forman estructuras llamadas vesículas que son porciones de hifa que se llenan de cuerpos lipídicos, dando a este grupo el nombre de micorriza vesicular-arbuscular.
Las micorrizas más abundantes y con una distribución amplia en el planeta son las ectomicorrizas y las arbusculares. En esta revisión se resaltan algunos conocimientos sobre el proceso de colonización en la micorriza arbuscular; las propiedades de la interfase simbiótica, los genes involucrados de la planta y una lista de oligo-nucleótidos que se están utilizando en la investigación molecular, para la identificación de las especies de hongos micorrízicos en esta interacción.
Colonización de la raíz
La compatibilidad de las plantas con los hongos micorrízicos es un fenómeno generalizado y antiguo. Aproximadamente 80 % de las familias de plantas son capaces de establecer micorrizas arbusculares (MA). La evidencia de fósiles sugiere que este tipo de simbiosis existía desde hace 400 millones de años en los tejidos de las primeras plantas terrestres (Pirozynski & Dalpé, 1989). Como tal, la capacidad de las plantas para formar MA debe estar bajo el control de mecanismos que se han conservado en los nuevos taxones de plantas. Esta compatibilidad también implica que en las plantas, los procesos de reconocimiento selectivo discriminen entre los microorganismos benéficos y perjudiciales y que los determinantes genéticos esenciales para el establecimiento de MA son comunes a una parte extensa del reino vegetal. En contraste con la gama amplia de hospedantes y, a pesar de sus antiguos orígenes, sólo seis géneros (Figura 1) de hongos pertenecientes al orden Glomales de los Zigomicetes han desarrollado la capacidad para formar MA (Morton & Benny, 1990).
Las esporas de muchas especies no requieren factores de la planta hospedante para la germinación e iniciación del crecimiento de la hifa. No obstante, el continuo crecimiento de ésta, la diferenciación en estructuras de infección y la penetración al hospedante son afectadas por señales de las plantas. Cuando una espora de un hongo micorrízico germina, ramifica en todas las direcciones para incrementar la oportunidad de encontrar raíces. Sin embargo, en ausencia del hospedante, el crecimiento de ésta se limita a un periodo de 20 a 30 días. Después de este lapso, varias modificaciones en la morfología como la retracción del citoplasma de los ápices, la producción de septos y el desarrollo de ramas laterales, indican la terminación del crecimiento de la hifa (Bonfante & Perotto, 1995). La percepción de las señales correctas, provenientes de las raíces de la planta, promueven la morfogénesis diferencial que consiste en una ramificación profusa de hifas y su proliferación. En ausencia de tales señales, no ocurre ninguna morfogénesis ni formación del apresorio. Se ha demostrado que las flavonas (hepertina, naringenina y apigenina), el flavonoide quercitina y los isoflavonoides, estimulan el crecimiento de hifas in vitro. También se sugiere que estos compuestos promueven la interacción entre células durante las primeras fases de la simbiosis arbuscular (Sharma & Johri, 2002).
El reconocimiento rápido de un invasor potencial es un prerrequisito para iniciar una defensa efectiva de la planta. Esto se realiza a través del reconocimiento de moléculas señal específicas conocidas como elicitores. Éstos pueden ser secretados por el microbio (elicitor exógeno) o generados como resultado de una ruptura física o química de la pared celular de la planta (elicitor endógeno). En la interacción planta-hongo micorrizógeno arbuscular se han encontrado algunos eventos similares a los de la interacción planta-patógeno. En una interacción compatible con micorrizas arbusculares (MA) se ha observado una respuesta hipersensitiva parecida a la que sucede cuando la planta es confrontada con un patógeno. También se ha detectado un estallido oxidativo en los sitios donde las puntas de las hifas de Glomus intraradices intentan penetrar una célula de la corteza de la raíz de Medicago truncatula (Zeze, Hosny, Tuinen, Gianinazzi-Pearson, & Dulieu, 1999). Esta repuesta hipersensitiva está caracterizada por una defensa química rápida, localizada y por la muerte de células de la planta que rodean el sitio de infección.
Durante los primeros momentos de formación de la micorriza arbuscular, como en el caso de micorrizas de tabaco, se ha observado un incremento transitorio de la actividad de las enzimas catalasa y peroxidasa, lo cual coincide con la formación del apresorio y la penetración del hongo en la raíz. El aumento de la actividad de estas enzimas también coincide con la acumulación de ácido salicílico (AS); una molécula señal involucrada en la vía de transducción de señales activadas en las reacciones planta-patógeno (Blilou, Bueno, Ocampo, & García-Garrido, 2000). Un posible mecanismo para atenuar la respuesta de defensa de la planta puede ser el bloqueo de los componentes de la vía de transducción de las señales, que activa dicha respuesta. Entre estos componentes se encuentran el ácido salicílico y las especies reactivas de oxígeno que participan como segundos mensajeros en las micorrizas arbusculares (Figura 2). Aunque no se han medido los niveles de las especies reactivas de oxígeno y H2O2, existen evidencias indirectas que sugieren que los niveles de este último en la micorriza son elevados (Zeze et al., 1999). El aumento en la actividad de la catalasa y peroxidasa se puede deber a la función que tienen como antioxidantes, para cualquier molécula activa de oxígeno que ha sido generada durante los estados iniciales de la penetración del hongo. El H2O2 y otras especies reactivas de oxígeno están involucradas en la cascada de transducción de señales en las interacciones planta-patógeno. Por tanto, es posible que la degradación de H2O2 por la catalasa en la micorriza arbuscular sea el mecanismo para evadir la activación de los genes de respuesta de defensa (Van Camp, Van Montagu, & Inzé, 1998).

Desarrollo del arbúsculo
Simultáneamente al crecimiento inter o intracelular de la hifa del hongo micorrízico arbuscular, la hifa terminal se diferencia en arbúsculos dentro de ciertas células corticales. Se ha sugerido que el desarrollo de arbúsculos en estas células puede ser regulado por un gradiente de carbono debido a la proximidad con el sistema vascular (Blee & Anderson, 1998). Aun cuando la colonización de las células corticales es esencial para la diferenciación del arbúsculo, no se conocen las señales que disparan las ramificaciones dicotómicas de la hifa para formarlo. La diferenciación del arbúsculo está acompañada de varios cambios fisiológicos en la célula de la planta, cuyas vacuolas se fragmentan aumentando el volumen de citoplasma y el número de organelos (Bonfante & Perotto, 1995). Las células que contienen arbúsculos muestran un núcleo hipertrofiado, número mayor de mitocondrias y niveles ligeros de actividad transcripcional (Fester, Strack, & Hause, 2001).
El carbono de la planta es transportado al hongo a través de dos membranas en la interfase simbiótica. Este carbono primero es liberado en el espacio periar-buscular, probablemente en la forma de sacarosa, después se fracciona en hexosas y es tomado por el hongo MA a través del transporte por la membrana del hongo. En el citoplasma del hongo, las hexosas son convertidas en grânulos de glucógeno y gotas de triglicéridos, que sirven como unidades disponibles para el transporte a larga distancia a través de la red de hifas.
Los nutrientes adquiridos por el hongo desde el suelo, cruzan la membrana plasmâtica, son transportados a la hifa intra-radical incluyendo los arbúsculos, y finalmente atraviesan la membrana periarbuscular para alcanzar el citoplasma de la planta. El fosfato es movilizado por transportadores de fosfato del hongo que estân presentes en la hifa extra-radical. Posteriormente, es transportado hacia la raíz y la hifa intra-radical, en forma de grânulos de fosfato envueltos en vesículas de membrana. La carga negativa de estos grânulos probablemente los hace vehículos para el transporte de metales y arginina. El nitrógeno es captado en la hifa extra-radical por transportadores de amonio, nitrato o aminoâcidos, que lo transportan principalmente como arginina. Dentro de la hifa intra-radical el nitrógeno se libera de ella en forma de urea y puede ser transportado directamente a la planta o después ser transformado en amonio. Durante el desarrollo y senescencia del arbúsculo se ha observado la activación del ciclo de los âcidos tricarboxilicos y la biosíntesis de aminoâcidos, âcidos grasos y apocarotenoides, indicando una fuerte inducción del metabolismo de la planta (Parniske, 2008). También se ha observado un re-arreglo del citoesqueleto (Lohse et al., 2005).
Harrison (2005) sugiere que ocurren al menos dos señales durante el desarrollo del arbúsculo. Una señal autónoma de la célula que podría ser responsable de la activación de la expresión de ciertos genes exclusivamente en las células que contienen arbúsculos (es decir, transportadores de fosfato específicos de micorrizas, una celulasa, una quitinasa, y una ATPasa). La señal no autónoma de la célula debe estar involucrada en la activación de genes específicos en células que contienen arbúsculos (es decir, una proteína GST [Glutation-Stransferasa], una quitinasa y una p-13-endoglucanasa). Los arbúsculos son estructuras efímeras y su periodo de vida puede alcanzar de cuatro a diez días (Sanders, Tinker, Black, & Palmerly, 1977). Después de este periodo, se observa la formación de un septo en la hifa del arbúsculo y la estructura se colapsa. Durante la senescencia y colapso del arbúsculo se observa una producción localizada de especies reactivas de oxígeno. Después que los arbúsculos se colapsan son degradados completamente y las células de la planta regresan a su fisiología normal.
Diversidad molecular de hongos micorrízicos arbusculares
La investigación de hongos micorrízicos arbusculares iniciada por Mosse (1973) fue seguida vigorosamente por numerosos investigadores en todo el mundo. Una gran cantidad de trabajos tienen que ver con aspectos benéficos de esta micorriza sobre el crecimiento de la planta. Esto indica la necesidad de desarrollar cultivos de hongos arbusculares como bio-inoculantes para la agricultura, forestería y horticultura. Se han producido relativamente pocos trabajos dirigidos al cultivo, filogenia, aspectos taxonómicos y naturaleza de la simbiosis. Las razones de ello son principalmente tres: 1) los hongos micorrízicos arbusculares son simbiontes obligados y pocos autores han hecho el intento de cultivarlos en medio axénico, 2) no hay características confiables para la filogenia y taxonomía debido a que estos hongos no producen estados sexuales y sólo existen en estado imperfecto; en ausencia de esporas, las estructuras intra-radicales permiten la identificación a nivel de familia en el mejor de los casos (Merryweather & Fitter, 1998), y 3) la identificación de los micosimbiontes actuales confiere mayores beneficios al hospedante, debido a que encuentra una variedad de esporas de hongos MA en la vecindad de la raíz. Los enfoques de la identificación molecular tienen el potencial para revolucionar nuestra comprensión del hongo micorrízico arbuscular. Este enfoque puede permitir la posibilidad de investigar acerca de su evolución, el diâlogo cruzado entre los socios simbiontes, que es la base para el progreso futuro en el campo de las interacciones planta-microbio (Franken & Requena, 2001).
Tendencias de la investigación en las señales de la simbiosis micorrízica arbuscular
La pregunta de cómo se establece la interacción entre simbiontes sin disparar eventos de rechazo había frenado la investigación. Algunas de las razones fueron las características de la simbiosis MA, tales como la carencia de especificidad entre los simbiontes, el estatus obligado del hongo y el desarrollo asincrónico. Sin embargo, el trabajo de Akiyama (2005) hizo una aportación importante a la comprensión del inicio de la interacción entre los simbiontes. Akiyama identificó y caracterizó los compuestos químicos en los exudados de la raíz que producen cambios morfogenéticos en la misma. Estos cambios son cruciales al convertir los tubos germinales con potencial de crecimiento limitado, en micelio presimbiótico que tiene la capacidad de iniciar la colonización de las raíces. Lo anterior significa un paso crucial en la vida de un simbionte obligado. Los cambios incluyen una alteración râpida en la expresión de genes y un aumento en la actividad mitocondrial (Lohse et al., 2005). Los compuestos activos son estrigolactonas (Figura 3) y son efectivas a concentraciones extremadamente bajas. Este comportamiento sugiere que actúan a través de vías de señales que permiten el catabolismo de lípidos como la fuente principal de carbono para el hongo. Estos hallazgos permitirân desarrollar investigaciones controladas de los cambios del metabolismo que ocurren en los tubos germinales del hongo. Por otro lado, Genre (2005) demostró cómo las células de la epidermis de la raíz ensamblan una estructura intracelular especial antes de que ocurra la penetración. Para ello, usó clones de raíz de Medicago truncatula que expresan a la proteína verde fluorescente (GFP) en el citoesqueleto y retículo endoplásmico. Mediante la utilización del microscopio confocal pudo seguir las respuestas de las células de la epidermis para la formación del apresorio del hongo y la penetración de la hifa en células vivas. Observó que el núcleo de la célula de la epidermis se mueve permitiendo la formación de un aparato de pre-prenetración especial que se forma dentro de una columna citoplâsmica. La fluorescencia mostró un arreglo de alta densidad y un haz de microfilamentos paralelo a la columna. Este efecto se asoció con una región de cisternas densas del retículo endoplásmico. Una vez que el aparato de pre-penetración se forma; la entrada del hongo y el crecimiento de la hifa a través de la célula siguen precisamente el camino definido por el citoesqueleto y las estructuras del retículo endoplásmico.

Los métodos moleculares para la investigación de las micorrizas arbusculares
Además de la observación de las características morfológicas, frecuentemente se emplean técnicas bioquímicas y fisiológicas, principalmente en levaduras. Sin embargo, estos métodos son muy laboriosos, requieren de mucho tiempo y suministran una resolución taxonómica insuficiente en hongos filamentosos. En contraste, dos avances técnicos importantes han estimulado el uso de técnicas moleculares. El primero, la llegada de PCR (Reacción en Cadena de la Polimerasa) que ha permitido el análisis de pequeños grupos celulares o aun de una sola espora, material seco de herbario o de organismos extintos. El segundo, la selección de iniciadores (primers) específicos para hongos que han permitido un fácil acceso a las secuencias de nucleótidos.
El análisis de la composición de bases del ADN en nueve especies demostró que los genomas contienen muchas secuencias repetidas de ADN y que hay un contenido bajo de las bases guanina y citosina (35 %) con niveles altos de metilcitosina. Se han logrado avances significativos para revelar los mecanismos que gobiernan la simbiosis, particularmente, con relación a la respuesta molecular del hospedante y los genes involucrados. La localización de tales genes y su baja activación sugiere que alguna vía de señales en la micorriza arbuscular y otras interacciones planta-microbio puede ser compartida. La hipótesis para explicar las respuestas de defensa atenuadas en la planta incluyen la degradación de elicitores; señales celulares a través de flujos alterados de azúcares y balance hormonal (Blee & Anderson, 2000).
El grupo de genes del ADN ribosomal
Las tecnologías moleculares han sido exitosas, particularmente, para estudiar secuencias de ADN ribosomal (ADNr) en los hongos micorrízicos arbusculares. Una célula en crecimiento tiene millones de ribosomas para la producción de proteínas. El ARN ribosomal (ARNr) es el componente estructural esencial de los ribosomas. Debido a ello, millones de copias de cada tipo de molécula de RNA 5S, 5.8S, 18S y 28S tienen que ser sintetizadas en cada generación celular con el fin de que la célula llene los requerimientos para la síntesis de proteínas. Las copias múltiples altamente conservadas de los genes ARNr en un cromosoma dado están localizadas en tándem. Cada gen está separado del siguiente por regiones conocidas como DNA espaciador, el cual varía en tamaño y secuencia entre especies. Un grupo de genes consiste de moléculas de ARNr 18S, 5.8S y 28S, que están separadas por un espaciador interno transcrito ITS-1 e ITS-2 (Internal Transcribed Spacer) (Figura 4).
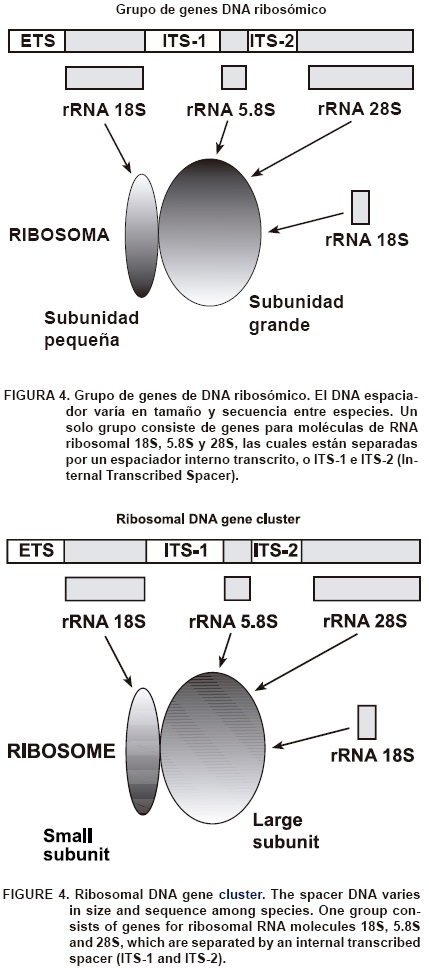
Existe una fuerte presión selectiva (evolución) para mantener funcional al DNAr, debido a que sus moléculas intactas de ARNr son esenciales para la generación de ribosomas, síntesis de proteínas y función celular. Los genes del ribosoma pertenecen a los genes más conservados en las células de eucariontes mostrando similitud de secuencias incluso entre taxones filogenéticos distantes. Sin embargo, en las regiones ITS-1 e ITS-2 se encuentra menos homología debido a que esas zonas de ADN no contribuyen al ARN estructural. Por lo tanto, se aplica menos presión selectiva en dichas regiones, pudiéndose encontrar diferencias (mutaciones puntuales) en la secuencia de ADN aun entre especies del mismo género. Debido a estas características los datos moleculares del ADNr son muy utilizados para la determinación de relaciones filogenéticas o para discriminar especies estrechamente relacionadas.
Inicialmente, los primers que ganaron una aceptación amplia para trabajar con la región ITS fueron los ITS1 e ITS4. Estos primers amplifican en un número elevado de especies de hongos y trabajan adecuadamente para analizar el ADN aislado de organismos individuales. Sin embargo, dichos iniciadores presentan un inconveniente ya que al aislar los ácidos nucleicos de la interacción planta-hongo, no excluyen las secuencias de las plantas. Posteriormente se diseñaron primers que excluyen a las plantas, como los ITS1-F e ITS4-B con un uso amplio en el análisis de ITS de hongos, aunque también se han desarrollado otros primers (Cuadro 1) (Ram, Pavan, & Reddy, 2005). Kendall y Rygiewicz (2005) publicaron recientemente un conjunto de primers para utilizarse en amplificaciones anidadas de secuencias de ITS. Este conjunto de primers para Dicariomicota sirven como base para un intervalo amplio de sistemas de análisis de comunidades microbianas, particularmente, en asociación con plantas. Estos métodos emergentes para el análisis molecular de las comunidades microbianas están permitiendo el aumento de los muestreos. A su vez, el aumento de éstos es la fuerza detrás de la caracterización de dichos grupos complejos y diversos espacialmente.

Perspectivas
En el futuro, los estudios de la simbiosis de los hongos arbusculares se beneficiarán del desarrollo de las técnicas moleculares. El acoplamiento de estas técnicas con la experimentación fisiológica tradicional, ayudará a la comprensión de la interacción dinámica entre plantas y hongos. El desarrollo de los métodos moleculares permitirá realizar estudios filogenéticos que den coherencia histórica entre los grupos de los niveles taxonómicos superiores. Por otra parte, también permitirá realizar aplicaciones para el diagnóstico; es decir, el reconocimiento de entidades taxonómicas definidas, así como la epidemiología y la genética de poblaciones. Además, se podrán vigilar los brotes de entidades sub-específicas con relación al análisis de poblaciones y su modo de reproducción.
REFERENCIAS
Akiyama, K. (2005). Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi. Nature, 435, 824-827. doi:10.1038/nature03608 [ Links ]
Bethlenfalvay, G. J., & Linderman, J. A. (1992). Mycorrhizae and crop productivity. USA: Horticultural Crops Research Laboratory, USDA-ARS. [ Links ]
Blee, K. A., & Anderson, A. J. (1998). Regulation of arbuscule formation by carbon in the plant. Plant Journal, 16, 523-530. doi: 10.1046/j.1365-313x.1998.00315.x [ Links ]
Blee, K. A., & Anderson, A. J. (2000). Defense responses in plant to arbuscular mycorrhizal fungi. In G. K. Podila, & D.D. Douds (Eds.), Current advances in mycorrhizae research (pp. 27-43). USA: APS Press. [ Links ]
Blilou, I., Bueno, P., Ocampo, J. A., & García-Garrido, J. M. (2000). Induction of catalase and ascorbato peroxidase activities in tobacco roots inoculated with the arbuscular mycorrhizal fungus Glomus mosseae. Mycological Research, 104, 722-725. doi: 10.1017/S095375629900204X [ Links ]
Björkman, E. (1960) Monotropa hypopithys L. An epiparasite on tree roots. Physiologia Plantarum, 13, 308-327. doi: 10.1111/j.1399-3054.1960.tb08034.x [ Links ]
Bonfante, P., & Peroto, S. (1995). Strategies of arbuscular mycorrhizal fungi when infecting host plants. New Phytologist 130, 3-21. Obtenido de http://www.jstor.org/stable/2558536 [ Links ]
Cairney, J. W. G., & Ashford, A. E. (2002). Biology of mycorrhizal associations of epacrids (Ericaceae). New Phytologist, 154, 305-326. doi: 10.1046/j.1469 8137.2002.00398.x [ Links ]
Fester, T., Strack, D., & Hause, B. (2001). Reorganization of tobacco root plastids during arbuscule development. Planta, 213, 864-868. doi: 10.1007/s004250100561 [ Links ]
Franken, P., & Requena, N. (2001). Analysis of gene expression in arbuscular mycorrhizas: New approaches and challenges. New Phytologist, 213(6), 517-523. doi: 10.1046/j.1469-8137.2001.00123.x [ Links ]
García-Garrido, J. M., & Ocampo, J. A. (2002). Regulation of the plant defense response in arbuscular mycorrhiza symbiosis. Journal of Experimental Botany 53, 1377-1386. doi: 10.1093/jex-bot/53.373.1377 [ Links ]
Gianinazzil-Pearson, V. (1984). Host-fungus specificity, recognition and compatibility in mycorrhizae. In D. P. S., Verma & T. Hohon (Eds.), Genes involved in microbe-plant interaction (pp. 225-253). Springer-Verlag. [ Links ]
Genre, A. (2005). Arbuscular mycorrhizal fungi elicit novel intracellular apparatus in Medicago truncatula root epidermal cells before infection. Plant Cell, 17, 3489-3499. doi: 10. 1105/ tpc. 105.035410 [ Links ]
Harrison, M. J. (2005). Signaling in the arbuscular mycorrhizal symbiosis. Annual Review of Microbiology, 59, 19-42. doi: 10.1146/ annurev.micro.58.030603.123749 [ Links ]
INN, N., GELFANG, J., Y WHITE, T. (Eds.) PCR Protocols: A Guide to methods and aplication. 1990 Academic Press. [ Links ]
Kendall J. M., & Rygiewicz, P. T. (2005). Fungal-specific PCR primers developed for analysis of the ITS region of environmental DNA extracts. BMC Microbiology, 5, 28-38. doi: 10.1186/1471-21805-28. [ Links ]
Lohse, S., Schliemann, W., Ammer, C., Kopka, J., Strack, D., & Fester, T. (2005). Organization and metabolism of plastids and mitochondria in arbuscular mycorrhizal roots of Medicago truncatula. Plant Physiology, 139, 329-340. doi: 10. 1104/ pp. 105.061457 [ Links ]
Merryweather, J. W., & Fitter, A. H. (1998). The arbuscular mycorrhizal fungi of Hyacinthoides nonscripta II. Seasonal and spatial pattern of fungal populations. New Phytologist, 138, 131-142. doi: 10.1046/j.1469-8137.1998.00888.x [ Links ]
Molina, R., & Trappe, J. M. (1982). Lack of mycorrhizal specificity by the ericaceoushost Arbutus menziesii and Arctostaphylos uva-ursi. New Phytologist, 90, 495-509. doi: 10.1111/j.1469-8137.1982.tb04482.x [ Links ]
Montaño, N. M., Camargo-Ricalde, S. L., García-Sánchez, R., & Monroy A. (2007). Micorrizas arbusculares en ecosistemas áridos y semiáridos (Arbuscular mycorrhizae in arid and semiarid ecosystems). México: Instituto Nacional de Ecología-SEMARNAT, Mundi-Prensa S.A. de C.V., UAM-Iztapalapa, FES Zaragoza, UNAM. [ Links ]
Morton, J. B., & Benny, S. L. (1990). Revised classification of arbuscular mycorrhizal fungi (Zygomycetes): A new order, Glomales, two new suborders, Glomineae and Gigasporineae, and two new families, Acaulosporaceae and Gigaporaceae, with an emendation of Glomaceae. Mycotaxon, 37, 471-491. [ Links ]
Mosse, B. (1973). Advances in the study of vesicular arbuscular my-corrhizae. Annual Review Phytopathology,11, 171-196. doi: 10.1146/annurev.py.11.090173.001131 [ Links ]
Parniske, M. (2008). Arbuscular mycorrhiza: The mother of plant root endosymbioses. Nature Reviews Microbiology, 6, 763-775. doi:10.1038/nrmicro1987 [ Links ]
Peterson, L., Massicote, H. G., & Melville L. H. (2004). Mycorrhizas: Anatomy and Cell Biology. USA: NRC Research Press [ Links ]
Pirozynski, K. A., & Dalpe, Y. (1989). Geological history of the Glomaceae with particular reference to mycorrhizal symbiosis. Symbiosis, 7, 1-36. [ Links ]
Ram, R., Pavan, K. P., & Reddy, S. M. (2005). Molecular methods for research on arbuscular mycorrhizal fungi in India: Problems and prospects. Current Science, 89(10), 1699-1709. Obtenido de http://www.iisc.ernet.in/currsci/nov252005/1699.pdf [ Links ]
Sanders, F. E., Tinker, P. B., Black, R. L. B., & Palmerly, S. M. (1977). Development of endomycorrhizal root systems: 1. Spread of infection and growth-promoting effects with 4 species of vesicular-arbuscular endophyte. New Phytologist, 78, 257-268. doi: 10.1111/j.1469-8137.1977.tb04829.x [ Links ]
Sharma, A. K., & Johri, B. N. (2002). Arbuscular Mycorrhizae. USA: Science Publishers. [ Links ]
Schübler, A., Schwarzott, D., & Walker, C. (2001). A new fungal phylum, the Glomeromycota: Phylogeny and evolution. Mycologycal Research, 105, 1413-1421. doi: 10. 1017/S0953756201005196 [ Links ]
Smith, S. E., & Read, D. J. (1997). Mycorrhizal Symbiosis. London: Academic Press [ Links ]
Van Camp, W., Van Montagu, M., & Inzé, D. (1998). H2O2 y NO: Redox signals in disease resistance. Trends in Plant Science, 3, 330-334. [ Links ]
Yu, T. E., Egger, K. N., & Peterson, R. L. (2001). Ectendomycorrhizal associations-characteristics and functions. Mycorrhiza, 11, 167-177. doi: 10.1007/s005720100110 [ Links ]
Zeze, A., Hosny, M., Tuinen, D. V., Gianinazzi-Pearson, V., & Dulieu, H. (1999). MYCDIRE, a dispersed repetitive DNA element in arbuscular mycorrhizal fungi. Mycological Research, 103, 572-576. doi:10.1017/S0953756298007497 [ Links ]














