Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.18 no.3 Chapingo ago./dic. 2012
https://doi.org/10.5154/r.rchscfa.2011.05.039
Poder calorífico y material inorgánico en la corteza de seis árboles frutales
Calorific value and inorganic material in the bark of six fruit trees
Ricardo Martínez-Pérez1; Fabiola E. Pedraza-Bucio1; José Apolinar-Cortes2; Javier López-Miranda3; J. Guadalupe Rutiaga-Quiñones1*
1 Facultad de Ingeniería en Tecnología de la Madera (FITECMA). Universidad Michoacana de San Nicolás de Hidalgo (UMSNH). Apartado postal num. 580, Col. Centro. C. P. 58000. Morelia, Michoacán, México. Correo-e: rutiaga@umich.mx (*Autor para correspondencia).
2 Facultad de Ingeniería Química. UMSNH. Apartado postal num. 580, Col. Centro. C. P. 58000. Morelia, Michoacán, México.
3 Departamento de Ingenierías Química y Bioquímica. Instituto Tecnológico de Durango. Boulevard Felipe Pescador 1830 Ote., Col. Nueva Vizcaya. C. P. 34080. Durango, Dgo., México.
Recibido: 29 de mayo de 2011
Aceptado: 05 de junio de 2012
RESUMEN
El poder calorífico y el contenido de sustancias minerales (cenizas) se determinaron en la corteza de seis especies arbóreas frutales (Annona cherimola Mill., Citrus aurantifolia Swingle, Malus domestica Borkh., Psidium guajava L., Prunus dulcis [Mill.] D. A. Webb y Tamarindus indica L.). Las cenizas obtenidas fueron analizadas mediante rayos X. Los valores encontrados de poder calorífico variaron de 3,453.49 kcal·kg-1 en T. indica a 4,076.10 kcal·kg1 en P. guajava. En el caso de las cenizas, los resultados fluctuaron de 5.76 % en P. guajava a 21.93 % en T. indica. Se observó que un contenido mayor de minerales en las cortezas tiende a disminuir su poder calorífico. Los elementos químicos comunes en las muestras analizadas fueron calcio, potasio, magnesio, fósforo y azufre. No se detectaron metales pesados en las muestras de la corteza.
Palabras Clave: Latifoliadas, combustión, contenido de cenizas, elementos químicos, análisis por rayos X.
ABSTRACT
Calorific value and mineral matter (ash) content were determined in the bark of six fruit tree species (Annona cherimola Mill., Citrus aurantifolia Swingle, Malus domestica Borkh., Psidium guajava L., Prunus dulcis [Mill.] D. A. Webb and Tamarindus indica L.). Ashes obtained were analyzed by X-ray.The calorific values found ranged from 3,453.49 kcal·kg-1 in T. indica to 4,076.10 kcal·kg1 in P. guajava. In the case of the ashes, the results ranged from 5.76 % in Psidium guajava to 21.93 % in Tamarindus indica. It was observed that a higher content of minerals in the bark tends to decrease its calorific value. The common chemical elements in the samples analyzed were calcium, potassium, magnesium, phosphorus and sulfur. No heavy metals were detected in the samples of the bark.
Keywords: Broad-leaved, combustion, ash content, chemicals, X-ray analysis.
INTRODUCCIÓN
La madera y la corteza están formadas químicamente por polisacáridos y lignina, además de sustancias extraíbles y sustancias inorgánicas; las cantidades varían de acuerdo con la especie y lugar, entre otros factores (Fengel & Wegener, 1983). Con relación a las sustancias minerales, se han encontrado aproximadamente 60 elementos distintos en diferentes vegetales. Es probable que en éstos se puedan hallar todos los elementos químicos naturales existentes, pues las raíces pueden absorber, en cierta proporción, cualquier elemento del medio que se encuentre en forma soluble (Gil, 1995). Así, algunos estudios han reportado para diversas maderas, entre otros elementos, la presencia de tierras raras (Rutiaga & García, 1999; Villaseñor & Rutiaga, 2000; Young & Guinn, 1966).
La proporción de corteza en el árbol varía según la especie dependiendo de su diámetro y de su altura. Aunque no se dispone de datos sobre la cantidad de corteza de los árboles estudiados, es conocido, por ejemplo, que Pinus sylvestris tiene valores de 5 a 18 % (Standke & Schneider, 1981). Otros reportes para diferentes especies de árboles indican que el volumen de corteza varía de 10 a 20 % (Grassia, 2009; Lassasenaho, Melkas, & Alden, 2005; Malone & Liang, 2009; Sonmez, Keles, & Tilki, 2007). Estos datos sugieren que la cantidad de corteza que genera un árbol, pudiera ser un residuo susceptible de aprovechamiento energético.
La madera ha sido utilizada para obtener energía por su combustión, pirólisis, gasificación y licuefacción (Fengel & Wegener, 1983). Actualmente, estos y otros materiales lignocelulósicos, como los residuos agrícolas, están tomando singular importancia en el desarrollo de energéticos más amigables con el medio ambiente. La finalidad es sustituir total o parcialmente el uso de combustibles fósiles a corto o mediano plazo, ya que éstos generan productos contaminantes como SOx. En nuestro medio es frecuente el uso de residuos de la biomasa forestal con fines energéticos, y el de las especies de árboles frutales como leña (Niembro, 1990). En tal contexto, los objetivos de la presente investigación fueron determinar el poder calorífico y el contenido de cenizas en la corteza de seis especies de árboles frutales, y detectar la presencia de elementos químicos en dichas cenizas.
MATERIALES Y MÉTODOS
Material de estudio
Se recolectaron muestras de corteza de seis especies de árboles frutales (Cuadro 1) en un predio particular de Acámbaro, Guanajuato, México. La ubicación geográfica del municipio es 20° 2' latitud norte y 100° 43' longitud oeste, a una altitud de 1,860 m, con rango de precipitación de 700-900 mm y temperatura de 10 a 20 °C, con clima semicálido subhúmedo (Instituto Nacional de Estadística y Geografía [INEGI], 2011). Las muestras se dejaron secar al aire libre, después fueron molidas y la harina obtenida fue tamizada para obtener material de malla 40. La harina tamizada se almacenó en bolsas de plástico selladas, hasta ser utilizada. Previo al proceso de calcinación, se determinó el porcentaje de humedad de cada muestra por el método de deshidratación T 264 cm-97 (TAPPI, 2000a).
Determinación del poder calorífico
De cada muestra de corteza, se formaron seis pastillas de 1 g base seca en una prensa de laboratorio aplicando una presión de 1,000 kgcm-2. El poder calorífico en las muestras preparadas se determinó con la técnica T Parr 1341 ns-78 (TAPPI, 2000b), utilizando una bomba calorimétrica (Parr, modelo 6772). Las muestras fueron acondicionadas a un promedio de 8 % de humedad.
Determinación del contenido de cenizas
Las muestras de madera fueron sometidas a calcinación en mufla a 525 °C para determinar el contenido de cenizas (sustancias inorgánicas), de acuerdo con la norma T 211 om-93 (TAPPI, 2000c).
Análisis de las cenizas
El microanálisis cualitativo de las cenizas se realizó en un espectrómetro de rayos X acoplado a un microscopio electrónico de barrido (Jeol, modelo JSM-6400) bajo las siguientes condiciones de operación: 20 kV y 8.5 s.
Análisis estadístico
Todos los análisis se realizaron por sextuplicado, a excepción del microanálisis que se llevó a cabo por duplicado. Las diferencias estadísticas en las muestras con relación a su poder calorífico y al contenido de cenizas se determinó con un análisis de varianza a 95 % de confianza y se aplicó la prueba de rangos múltiples de la diferencia mínima significativa (DMS) (Gutiérrez & De la Vara, 2004). Los datos recabados fueron procesados en el programa Statgraphics Plus Versión 4.0.
RESULTADOS Y DISCUSIÓN
Poder calorífico
Los resultados del poder calorífico en las muestras de corteza se muestran en el Cuadro 2. El análisis de varianza mostró que existe diferencia estadísticamente significativa (P < 0.05) en los valores del poder calorífico de las cortezas estudiadas, tal como se aprecia en la Figura 1. Los resultados variaron de 3,453.49 kcal·kg-1 para T. indica (Tin) a 4,076.21 kcal kg-1 para P. guajava (Pgu). Promediando los valores obtenidos se tiene como resultado 3,764.56 kcal·kg-1, valor menor comparado con 4,484 kcal·kg-1 (Kollmann, 1959) y 4,371 kcal·kg-1 (Puri, Singh, & Bhushan, 1994), reportados como promedios para las cortezas. Esta diferencia puede ser atribuible al contenido de humedad de las muestras al ser analizadas, pues es conocido que la humedad del material afecta su poder calorífico. También puede ser atribuida a la presencia de sustancias extraíbles en las cortezas, pues ellas suelen incrementar su valor, sobre todo si se trata de resinas (Kollmann, 1959). Sin embargo, el valor promedio de 3,764.56 kcal·kg-1 se encuentra dentro del rango (3,600 a 4,700 kcal·kg-1) reportado para maderas (ASINEL, 1992).
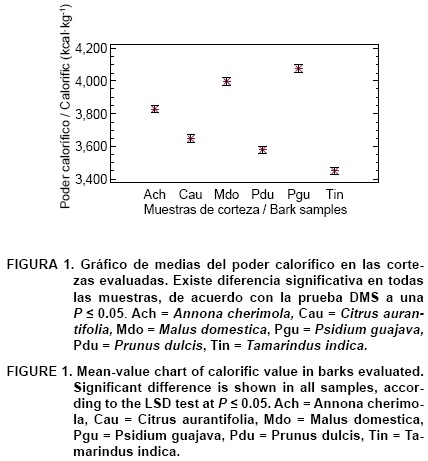
Contenido de cenizas
En el Cuadro 2 se presentan los resultados del contenido de sustancias inorgánicas en las muestras de corteza. El análisis de varianza indica que existe diferencia estadísticamente significativa (P < 0.05) en el contenido de cenizas. Los valores encontrados variaron de 5.76 % en P. guajava (Pgu) a 21.93 % en T. indica (Tin). El amplio rango refleja la variabilidad natural existente en este material lignocelulósico (Cuadro 2, Figura 2). El resultado coincide con el hecho de que la cantidad de sustancias minerales varía apreciablemente según las especies, pues existe un código genético del contenido salino. Además, en las plantas superiores pueden existir notables diferencias entre los grupos encontrándose valores de 3 a 5 % y hasta de 20 % de cenizas (Gil, 1995). Esta diferencia se observó en los resultados aquí obtenidos, incluso, en dos especies de la familia Rosaceae; M. domestica con 10.96 % y P. dulcis con un valor de 18.86 %. Solamente los valores de cenizas encontrados para M. domestica, C. aurantifolia y P. guajava son los que se ubican dentro del rango (5 a 10 %) reportado para cortezas (Kollmann, 1959); las otras tres especies contienen valores mayores. En general, todos los valores aquí obtenidos son superiores si se comparan con los reportados para diferentes especies de árboles no frutales (Fengel & Wegener, 1983; Harun & Labos-ky, 1985; Kollmann, 1959; Labosky, 1979; McGinnis & Parikh, 1975; Usta & Kara, 1997). Esto puede indicar que probablemente exista mayor concentración de sustancias minerales en la corteza de las especies frutales comparadas con las especies maderables.
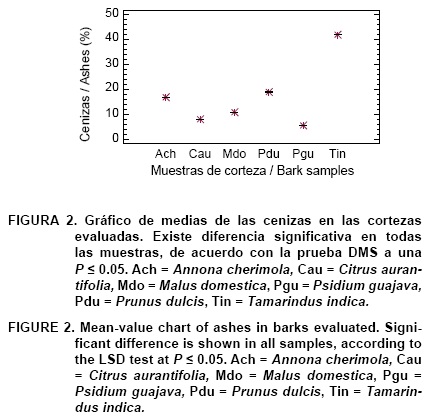
En la Figura 3 aparecen la gráfica y el modelo matemático de ajuste (R = -0.73) obtenidos al correlacionar los datos de poder calorífico y del contenido de cenizas. En la gráfica se puede observar la tendencia de que el poder calorífico tiende a disminuir a mayor contenido de sustancias minerales, tal como lo señala la literatura (Fengel & Wegener, 1983).

Análisis de las cenizas
Actualmente se conocen cuatro tipos de hormonas que intervienen en el crecimiento de las plantas (auxinas, giberelinas, citocininas e inhibidores) y también se han reconocido las propiedades hormonales del etileno (Lira, 2007). Además de estas sustancias orgánicas, existen sustancias inorgánicas que juegan un rol importante como elementos de nutrición para el crecimiento de los árboles (Fengel & Wegener, 1983; Scheffer & Schachtschabel, 1998). En el Cuadro 3 se presentan los elementos detectados en las muestras estudiadas, los cuales pertenecen precisamente a los elementos químicos que son comunes en las plantas vasculares (Gil, 1995). Se detectaron cinco elementos (magnesio, fósforo, azufre, potasio y calcio) de los siete que son conocidos como macroelementos o macronutrientes y que los vegetales requieren para su completo crecimiento (Gil, 1995). Con relación a los seis elementos llamados micronutrientes o microelementos (manganeso, zinc, boro, cobre, cloro y molibdeno) (Gil, 1995), sólo se detectó cloro. Los otros elementos presentes (sodio, aluminio y silicio) en las muestras estudiadas son minerales que muchas plantas suelen también requerir para su desarrollo, además de los ya señalados (Gil, 1995). El resultado del microanálisis de las cenizas concuerda en general con los datos reportados en la literatura. Por ejemplo, Choong, Abdullah, y Kowalczuk (1976) detectaron sodio, potasio, calcio, magnesio, zinc y fósforo en diferentes cortezas y maderas de especies de latifolias; además, Fengel y Wegener (1983) señalan que los elementos comunes y que se encuentran en mayor proporción, son el calcio, potasio, magnesio y fósforo. La mayoría de los elementos químicos detectados en las muestras estudiadas han sido también identificados en maderas y cortezas de diferentes especies (Choong et al., 1976; Cutter, McGinnes, & McKown, 1980; Young & Guinn, 1966).
La concentración porcentual relativa de los elementos químicos presentes en las cenizas de las cortezas fue variada (Cuadro 3). El flúor fue identificado en cinco de las seis cortezas con valores de 5.04 a 7.89 %. Es un elemento abundante en la naturaleza, encontrado principalmente como fluorita, criolita y fluoroapatita (Cotton & Wilkinson, 1990). El flúor está presente en las plantas en concentraciones bajas (Restrepo & Pinheiro, 2009), es fácilmente asimilable por ellas en forma soluble y no existen pruebas de su toxicidad si es absorbido sólo por las raíces. En cambio, si el flúor es transportado por el aire es tóxico para las plantas (Kabata-Pendias, 1986), reduce la fotosíntesis también en árboles forestales (Thimann, Critchfield, & Zimmermann, 1958) y es considerado un elemento extraño al metabolismo de los vegetales (Seoánez, 2002).
El sodio se detectó en cuatro de las seis cortezas. Se trata de un elemento que se encuentra en el suelo como catión monovalente y estimula el crecimiento de algunas plantas (Gil, 1995).
El magnesio se encuentra en forma libre, adsorbido a las micelas. La forma fija se halla en minerales como la magnesita (MgCO3), el olivino (MgFe)2SiO4 y la dolomita (MgCO3.CaCO3), que pueden suministrar cantidades suficientes del elemento a las plantas para su crecimiento. La función más importante del magnesio está en relación con la fotosíntesis y el metabolismo glucídico (Gil, 1995). Este elemento fue encontrado en todas las cortezas estudiadas con valores de 3.19 a 9.29 %.
El aluminio sólo fue detectado en dos cortezas. Se trata de un elemento abundante en la corteza terrestre, aunque en la solución del suelo se encuentra en muy bajas concentraciones en forma soluble. Este elemento puede ser benéfico para el crecimiento de las plantas (Gil, 1995).
El silicio es el segundo elemento en abundancia en la corteza terrestre que se encuentra fijo en los silicatos, es adsorbido y se encuentra también en la solución del suelo, por lo general, en forma de ácido monosílico. Es un elemento que da rigidez a las hojas, mejorando así la fotosíntesis (Gil, 1995). El silicio fue encontrado en cuatro cortezas en concentraciones de 0.04 a 1.20 %.
En todas las muestras estudiadas, el fósforo fue detectado con valores de 1.02 a 4.39 %. La mayor parte del fósforo se halla en la fracción inorgánica del suelo, principalmente en forma de iones fosfato (PO43-, HPO42- y H2PO41-) y ácido ortofosfórico (H3PO4). Además de sus funciones metabólicas, el fósforo asume funciones reguladoras controlando diversas enzimas, por ejemplo, en la fotosíntesis y la glucólisis (Gil, 1995).
El azufre se encuentra en la materia orgánica en descomposición y en el humus; sin embargo, la mayor parte se encuentra en un suelo fértil, en forma de minerales insolubles como la pirita (FeS), la esfalerita (ZnS), la calcopirita (CuFeS2) y el yeso (CaSO4) que fácilmente se oxidan a sulfatos. El azufre se encuentra en las plantas como elemento plástico en las proteínas, como cisteína, cistina y metionina, como grupo -SH o puente -S-S-; sustituyentes que se encuentran en los centros activos de muchas enzimas (Gil, 1995). El azufre fue detectado en todas las muestras de corteza con valores de 0.63 a 1.74 %.
El cloro se encuentra en la solución del suelo como anión monovalente. Sus funciones son inciertas pero es esencial in vitro para el desprendimiento fotosintético del oxígeno, lo que indica que está relacionado con el transporte electrónico en la oxidación del agua. Otra función conocida es la de aumentar la actividad de la asparaginasintetasa que transforma la glutamina en asparagina y ácido glutamínico (Gil, 1995). Este elemento fue encontrado en cuatro cortezas, cuya concentración varió de 0.09 a 2.45 %.
El potasio se detectó en todas las cortezas estudiadas con valores de 8.51 a 27.8 %. Este elemento se halla en el suelo en forma de catión, aunque se puede encontrar también asociado con el humus. La mayor parte del potasio, junto con el calcio y el magnesio, se encuentra formando parte de silicatos en minerales como los feldespatos, la biotita, la moscovita, la illita, la montmorillonita y la anortita. Éstas son formas combinadas que no son directamente accesibles por las plantas, pero de donde se liberan dichos elementos, como iones solubles, en la disolución del suelo. El potasio forma asociaciones con las proteínas y ayuda a activar enzimas (Gil, 1995).
El calcio es el catión intercambiable mayoritario de los suelos fértiles, se halla asociado a la materia orgánica del suelo. Este elemento es importante en la formación y mantenimiento de las membranas celulares y de las estructuras lipídicas por su facilidad para establecer enlaces reversibles. También exhibe funciones como activador enzimático en las amilasas, fosfolipasas, argininaquinasa, adenosintrifosfatasa, adeniltoquinasa, pudiendo asimismo activar otras enzimas que requieren magnesio, como algunas ATPasas (Gil, 1995). El calcio estuvo presente en todas las cortezas con valores de 49.12 a 76.82 %.
En todas las muestras de cortezas estudiadas, los elementos mayoritarios en concentración fueron el calcio y el potasio, lo que coincide con la literatura (Choong, et al., 1976; Fengel & Wegener, 1983). También se observó que, en general, la concentración de fósforo fue mayor a la del azufre en todas las muestras analizadas como se señala en la literatura (Gil, 1995).
Es importante señalar que en las muestras analizadas no se detectaron metales pesados como plomo, zinc, níquel, cobre y cromo, que fueron encontrados en cortezas de pino y han sido referentes de contaminación del aire (Kord & Kord, 2011). Lo anterior indica que en el lugar de colecta de los árboles estudiados no existe este tipo de contaminación. Los metales pesados que se logran detectar no parecen ocasionar efectos benéficos sobre los vegetales, más bien pueden resultar tóxicos y su presencia está relacionada con niveles de contaminación (Marschner, 1986).
CONCLUSIONES
Existe diferencia estadísticamente significativa (P < 0.05) en el poder calorífico de las cortezas estudiadas, con valores de 3,453.49 kcal kg-1 (T. indica) a 4,076.21 kcal kg-1 (P. guajava). El mismo comportamiento se presenta en el contenido de cenizas con valores de 5.76 % (P. guajava) a 41.93 % (T indica). En las muestras analizadas se observó que el poder calorífico tiende a disminuir a mayor contenido de sustancias minerales. Los elementos químicos detectados en las muestras de corteza son comunes en los vegetales y son los que requieren para su desarrollo: calcio, potasio, magnesio, fósforo y azufre, siendo el calcio y el potasio los de mayor concentración. No se detectaron metales pesados en las muestras estudiadas.
AGRADECIMIENTOS
Los autores agradecen el apoyo al proyecto CIC-21.3-JGRQ de la Coordinación de la Investigación Científica de la Universidad Michoacana de San Nicolás de Hidalgo, dentro del cual se realizó el presente trabajo.
REFERENCIAS
ASINEL. (1992). La biomasa y sus aplicaciones energéticas. In F. M. Martín, & M. C. Michelena (Eds.), Energías renovables "Los Biocombustibles". Madrid: Ediciones Mundi-Prensa. [ Links ]
Choong, E. T., Abdullah, G., & Kowalczuk, J. (1976). LSU Wood utilization. Notes No. 29. USA: Louisiana State University. [ Links ]
Cotton, F. A., & Wilkinson, G. (1990). Química inorgánica avanzada. México: Limusa. [ Links ]
Cutter, B. E., McGinnes, E. A., & McKown, D. H. (1980). Inorganic concentrations in selected woods and charcoals measured using NAA. Wood and Fiber, 12, 72-79. Obtenido de http://swst.metapress.com/content/5102624300075602/ [ Links ]
Fengel, D., & Wegener, G. (1983). Wood: Chemistry, ultrastructure, reactions. Berlin, Alemania: Walter de Gruyter & Co. [ Links ]
Gil, M. F. (1995). Elementos de fisiología vegetal. Madrid, España: Ediciones Mundi-Prensa. [ Links ]
Grassia, A. (2009). Estimating bark thickness in natural stands of Eucalyptus. Austral Ecology, 5(4), 411-417. doi: 10.1111/j.14429993.1980.tb01265.x [ Links ]
Gutiérrez, P. H. G., & De la Vara, S. R. (2004). Análisis y diseño de experimentos. México: McGraw-Hill Interamericana. [ Links ]
Harun, J., & Labosky, P. J. (1985). Chemical constituents of five northeastern barks. Wood and Fiber Science, 17(2), 274-280. Obtenido de http://swst.metapress.com/content/vg7r3624j7g6361v/ [ Links ]
Instituto Nacional de Estadística y Geografía (INEGI). (2011). México en cifras. Acámbaro, Guanajuato. Consultado 4-01-2011 en http://www.inegi.org.mx/movil/MexicoCifras/mexicoCifras.aspx?em=11002&i=e [ Links ]
Kabata-Pendias, A. (1983). La agresión química a la biosfera. Unasylva, 141. Obtenido de http://www.fao.org/docrep/q2570S/q2570s00.htm#Contents [ Links ]
Kollmann, F. (1959). Tecnología de la madera y sus aplicaciones (Vol. 1). Madrid, España: Instituto Forestal de Investigaciones y Experiencias y Servicio de la Madera. [ Links ]
Kord, B., & Kord, B. (2011). Heavy metal levels in pine (Pinus eldarica Medw.) tree barks as indicators of atmospheric polluton. Bio-Resources, 6(2), 927-935. Obtenido de http://www.ncsu.edu/bioresources/BioRes_06/BioRes_06_2_0927_Kord_K_Heavy_Metal_Pine_Barks_Indicat_Air_Pollution_1363.pdf [ Links ]
Labosky, P. J. (1979). Chemical constituents of four southern pine barks. Wood Science, 12(2), 80-85. [ Links ]
Lassasenaho, J., Melkas, T., & Alden, S. (2005). Modelling bark thickness of Picea abies with taper curves. Forest Ecology and Management, 206(1-3), 35-47. doi: 10.1016/j.foreco.2004.10.058 [ Links ]
Lira, S. R. H. (2007). Fisiología vegetal. México: Trillas. [ Links ]
Malone, T., & Liang, J. (2009). A bark thickness model for white sprouce in Alaska Northern Forest. International Journal of Forestry Research, 2009 (Article ID 876965). doi: 10.1155/2009/876965 [ Links ]
Marschner, H. (1986). Mineral nutrition of higher plants. USA: Academic Press. [ Links ]
McGinnis, G. D., & Parikh, S. (1975). The chemical constituents of loblolly pine bark. Wood Science, 7(4), 295-297. [ Links ]
Niembro, R. A. (1990). Árboles y arbustos útiles de México. México: Limusa. [ Links ]
Puri, S., Singh, S., & Bhushan, B. (1994). Evaluation of fuelwood quality of indigenous and exotic tree species of India's semiarid region. Agroforestry Systems, 26(2), 123-130. doi: 10.1007/bf00707010 [ Links ]
Restrepo R. J., & Pínheiro, S. (2009). Agricultura orgánica. Santiago de Cali, Colombia: Feriva, S. A. [ Links ]
Rutiaga, Q. J. G., & García D. J. (1999). Elementos químicos en las cenizas del duramen de dos maderas tropicales. Ciencia Forestal en México, 24(86), 7. [ Links ]
Scheffer, F., & Schachtschabel, P. (1998). Lehrbuch der Bodenkunde (14 Auflage ed.). Sttutgart, Alemania: Ferdinand Enke. [ Links ]
Seoánez, C. M. (2002). Tratado de la contaminación atmosférica. Madrid, España: Ediciones Multi-Prensa. [ Links ]
Sonmez, T., Keles, S., & Tilki, F. (2007). Effect of aspect tree age and tree diameter on bark thickness of Picea orientalis. Scandinavian Journal of Forest Research, 22(3), 193-197. doi: 10.1080/02827580701314716 [ Links ]
Standke, W., & Schneider, A. (1981). Untersuchungen über das Sorptionsverhalten des Bastund Borkenanteils verschiedener Baumrinden. Holz als Rohund Wekstoff, 39, 489-493. [ Links ]
TAPPI. (2000a). Tappi test methods T 264 cm-97. Preparation of wood for chemical analysis. Atlanta, USA: Autor. [ Links ]
TAPPI. (2000b). Tappi test methods T parr-1341 ns 78. Determinación de calores de combustión de licores negros de procesos químicos de obtención de pulpa celulósica y otras sustancias. Atlanta, USA: Autor. [ Links ] Wood Products, 55(2), 268-268. doi: 10.1007/bf02990561 [ Links ]
TAPPI. (2000c). Tappi test methods T 211 om-93. Ash in wood and pulp. Atlanta, USA: Autor. [ Links ]
Thimann, K. V., Critchfield, W. B., & Zimmermann, M. H. (1958). The physiology of forest trees. New York, USA: The Roland Press Company. [ Links ]
Usta, M., & Kara, Z. (1997). The chemical composition of wood and bark of Cedrus libani A. Rich. European Journal of Wood and Wood Products, 55(2), 268-268. doi: 10.11007/bf02990561 [ Links ]
Villaseñor, A. J. C., & Rutiaga, Q. J. G. (2000). La madera de Casuarina equisetifolia L., química e índices de calidad de pulpa. Madera y Bosques, 6(1), 29-40. Obtenido de http://redalyc.uaemex.mx/pdf/617/61760103.pdf [ Links ]
Young, H. E., & Guinn, V. P. (1966). Chemical elements in complete mature trees of seven species en Maine. Tappi, 49(5), 190-197. [ Links ]














