Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.18 no.1 Chapingo ene./abr. 2012
https://doi.org/10.5154/r.rchscfa.2011.03.025
Descomposición y liberación de nitrógeno y materia orgánica en hojas de Leucaena leucocephala (Lam.) de Wit, Guazuma ulmifolia Lam. Y Moringa oleifera Lam. en un banco mixto de forraje
Descomposition and nutrient release patterns of leaves of Leucaena leucocephala (Lam.) de Wit, Guazuma ulmifolia Lam. and Moringa oleifera Lam. in a mixed fodder bank
Judith Petit-Aldana1, 3¶; Gabriel Uribe-Valle2; Fernando Casanova-Lugo3; Javier Solorio-Sánchez 3; Luis Ramírez-Avilés3.
1, 3 Universidad de los Andes. Facultad de Ciencias Forestales y Ambientales. Escuela Técnica Superior Forestal, Mérida, VENEZUELA. Correo-e: jcpetita@ula.ve (¶Autor para correspondencia).
2 Investigador Titular C. (Jubilado) Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). km 21, Antigua Carretera Mérida-Motul. Mocochá, Yucatán, MÉXICO.
3 Cuerpo Académico de Producción Animal en Agroecosistemas Tropicales. Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán, MÉXICO.
Recibido: 18 de marzo, 2011
Aceptado: 30 de noviembre, 2011
RESUMEN
Se evaluaron las tasas de descomposición, la liberación de N y MO en hojas de Leucaena leucocephala (Lam.) de Wit, Guazuma ulmifolia Lam. y Moringa oleifera Lam. en un banco mixto de forraje en Yucatán, México, en las épocas de lluvias y sequía, en un diseño de bloques completos al azar, cinco tratamientos y cuatro repeticiones. Se llenaron 120 bolsas con hojas frescas de las especies colectadas, y se colocaron en cada unidad experimental. Se evaluaron tres periodos de incubación para cada tratamiento: cuatro, ocho, y 16 semanas por cada época. A finales del experimento se observó que el proceso de descomposición fue más rápido en la temporada de lluvias. La pérdida de peso y la liberación de N y MO fueron más aceleradas en M. oleifera en monocultivo y en la asociación L. leucocephala con M. oleifera. Los patrones de descomposición de todas las especies siguieron el modelo exponencial simple, con más del 80 % de la masa inicial incorporada al final del periodo de estudio. Se concluye que L. leucocephala, G. ulmifolia y M. oleifera en monocultivo y asociadas, demostraron su capacidad para producir considerables cantidades de materia orgánica y liberar importantes cantidades de N en cortos periodos.
Palabras clave: Agroforestería, forraje, descomposición, química del follaje, nitrógeno, materia orgánica.
ABSTRACT
Decomposition rates and nitrogen (N) and organic matter (OM) release patterns of leaves of Leucaena leucocephala (Lam.) de Wit, Guazuma ulmifolia Lam. and Moringa oleifera Lam. in a mixed fodder bank in Yucatán, Mexico, in the rainy and dry seasons, were assessed. The experimental units were formed in a randomized complete block design with five treatments and four replicates. A total of 120 litterbags were filled with fresh leaves of the species collected and placed in each experimental unit. We assessed three incubation periods per treatment: four, eight and 16 weeks for each season (rainy and dry). At the end of the experiment, it was apparent that the decomposition process was faster in the rainy season. Weight loss and N and OM release were faster in M. oleifera in monoculture and L. leucocephala and M. oleifera mixed. The decomposition patterns of all species followed the simple exponential model, with more than 80 % of the initial mass incorporated by the end of the study period. We concluded that G. ulmifolia, L. leucocephala, and M. oleifera in monoculture and mixtures demonstrated their ability to produce considerable amounts of OM and release significant amounts of N in short periods.
Key words: Agroforestry, fodder, decomposition, leaf litter chemistry, nitrogen, organic matter.
INTRODUCCIÓN
La descomposición consiste en una serie de procesos físicos y químicos por medio de los cuales la hojarasca y el follaje se reducen a sus constituyentes químicos elementales (Aerts, 1997), lo cual constituye uno de los hechos más importantes en los ecosistemas por su aporte de nutrimentos al suelo (Aber y Melillo, 1991).
Se considera que la agroforestería permite mantener un reciclaje de nutrientes más eficaz que la agricultura. Esta hipótesis se basa en parte en estudios sobre el reciclaje eficiente de los nutrimentos de la hojarasca de los árboles en ecosistemas naturales, así como en el supuesto de que en los sistemas agroforestales los árboles transfieren igualmente los nutrimentos a los cultivos intercalados. Actualmente, se le está dando una mayor importancia al estudio del aporte de minerales a través de la descomposición de materia orgánica que ofrecen los árboles de especies leguminosas y no leguminosas en los sistemas agroforestales. Los árboles son capaces de mantener o aumentar la fertilidad de los suelos a través del reciclaje de nutrimentos; es decir, logran el mantenimiento de la materia orgánica del suelo por medio de la producción y descomposición de hojarasca y de los residuos de podas (Mafongoya et al., 1998; Palm y Sánchez, 1990).
Las tasas de descomposición son un indicador de la funcionalidad de los procesos de los ecosistemas en el suelo y de los ciclos de nutrimentos, que incluyen descomposición de la hojarasca y el aporte de nutrimentos y en el que los organismos del suelo desempeñan un papel central (Tian y Badejo, 2001).
Aunque se ha generado mucha investigación en torno de la incorporación de especies forrajeras en sistemas silvopastoriles, existe escasa información sobre el proceso de descomposición y mineralización, por lo que el objetivo de este trabajo consistió en estudiar las tasas de descomposición y los patrones de liberación de nitrógeno y materia orgánica en hojas de Leucaena leucocephala (Lam.) de Wit, Guazuma ulmifolia Lam. y Moringa oleifera Lam. en un banco mixto de forraje, en Yucatán, México.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en el área de agroecología del campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán, durante el periodo de mayo de 2008 a abril de 2009. La zona presenta un clima Aw0 según la clasificación de Köppen modificada por García (1988), con una precipitación promedio anual de 953 mm, concentrándose de junio a octubre el 82 % de las precipitaciones. En la Figura 1 se muestran la precipitación (mm) y las temperaturas mínimas y máximas presentadas durante el periodo experimental, que va de mayo de 2008 a abril de 2009.

La temperatura media anual es de 26.5 ºC, siendo el mes de abril el más caluroso, ya que se alcanzan temperaturas máximas de 38 ºC y mínimas de 22.3 ºC; el mes más frío es diciembre, con una temperatura máxima de 29.2 ºC y una mínima de 18.8 ºC. La humedad relativa varía de 66 %, en el mes de abril, a 85 %, en el mes de septiembre. Los suelos predominantes de esta zona son litosoles "tsek´el" en nomenclatura maya (Bautista et al., 2005).
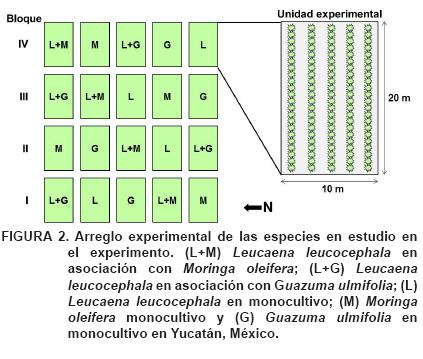
El área experimental tiene una historia de uso como sistema de corte y acarreo de forraje, el cual ha estado operando durante siete años. Las podas que se realizan son totales, pues se remueve la mayor parte de toda la biomasa foliar (>90 % del follaje) cuatro veces al año: dos podas en época seca y dos en época de lluvias (Solorio, 2005). Las unidades experimentales se encuentran arregladas en un diseño de bloques completos al azar con cinco tratamientos y cuatro bloques por tratamiento (Figura 2). En total se establecieron 20 parcelas (cinco parcelas por bloque) de 10 x 20 m. con las especies L. leucocephala (Lam.) de Wit., G. ulmifolia Lam. y M. oleifera Lam., ya sea en monocultivo o asociadas entre sí, las cuales fueron plantadas en hileras a lo largo de la parcela, con una separación de 2 m entre hileras y de 0.5 m entre plantas. La densidad de plantas para el sistema asociado fue del doble en comparación con el monocultivo (10,000 y 20,000 plantas·ha-1, respectivamente). Cada parcela consta de cinco hileras, donde solamente tres hileras se considera la parcela útil. Asimismo, se realizan deshierbes dos veces al año.
El Cuadro 1, indica las características físicas y químicas del suelo en el área experimental, en donde se observa una alta pedregosidad (74 %) y bajas proporciones de suelo (26 %), que son limitantes físicas para la producción de forraje. Los contenidos de N (0.95 %) y P (6.6 %) se consideran bajos, mientras el C (6.2 %) es adecuado.

A finales de enero y abril (época de sequía) y julio y octubre (época de lluvias), se podaron los árboles a una altura de 1.0 m sobre el nivel suelo, correspondiendo los dos primeros cortes a la época seca y los dos últimos a la época de lluvias. En cada corte se cuantificó el rendimiento de forraje (kg MS·ha-1).
Para el experimento de descomposición se construyeron bolsas de nylon (litterbags), de 30 cm x 30 cm y 2 mm de abertura de la malla, y se llenaron con hojas frescas (follaje verde) colectadas de la segunda poda de lluvias de 2008 y de la primera poda de sequía 2009 de cada parcela, estas bolsas fueron colocadas semienterradas en el suelo, al comienzo, centro y final de los callejones formados por los árboles. En total se utilizaron 120 bolsas por cada época del año (cinco tratamientos, tres periodos de incubación y ocho repeticiones). Se evaluaron tres periodos de incubación para cada tratamiento: cuatro, ocho, y 16 semanas de acuerdo a los pesos iniciales del follaje, tal y como se muestra a continuación:
Una mezcla de 101 g de hojas frescas de L. leucocephala + G. ulmifolia, equivalente a 41 g de materia seca (20.5 g de L. leucocephala + 20.5 g de G. ulmifolia).
100 g de hojas frescas de L. leucocephala, equivalente a 39 g de materia seca.
100 g de hojas frescas de G. ulmifolia, equivalente a 42 g de materia seca.
Una mezcla de 119 g de hojas frescas de L. leucocephala + Moringa oleifera, equivalente a 39 g de materia seca (20 g L. leucocephala + 18 g de Moringaoleifera).
136 g de hojas frescas de Moringa oleifera, equivalente a 35 g de materia seca.
En las semanas previstas se retiraron las bolsas de cada unidad experimental y se extrajo el material, el cual se separó y limpió cuidadosamente de acuerdo al tratamiento y a la especie, para luego secarse en una estufa de circulación de aire forzado a 60 ºC hasta peso constante (durante 48 h aproximadamente), la cantidad obtenida se registró como peso seco del material remanente en gramos. Con base en lo anterior se calculó el porcentaje de masa remanente (MR) de acuerdo a la siguiente ecuación (1):

MR= Masa remanente
Mt= Peso seco del material remanente en el tiempo t
M0= Peso inicial del material verde
La constante de descomposición k, fue calculada por la siguiente ecuación (2):

Donde M0 es la masa en el tiempo 0; Mt es la masa en el tiempo t; t el tiempo de incubación (semanas) y k la constante de descomposición.
Para determinar la constante de descomposición exponencial (k), se aplicó el modelo exponencial simple (ecuación 3):

Posteriormente, las muestras fueron molidas en partículas menores de 0.5 mm y llevadas a laboratorio, donde se determinaron el contenido de proteína cruda (PC) y la fracción de carbono (C) con ayuda del analizador elemental Leco CN 2000®.
Los datos obtenidos se compararon mediante un análisis de varianza de acuerdo al diseño de bloques completos al azar con el programa Statgraphics© para Windows versión 5.1. Cuando se presentaron diferencias significativas se aplicó la prueba de comparación de medias de Tukey al 5 % de error Tipo I.

Donde Yij es la observación en la unidad experimental; μ es el efecto medio; ϯi efecto del tratamiento i; βj efecto del bloque j; y εij es el error experimental.
RESULTADOS Y ANÁLISIS
Dinámica de la descomposición del follaje
Pérdida de peso
Los tratamientos registraron comportamientos diferentes en los periodos de descomposición evaluados (Cuadro 2); así, en la temporada de lluvias se detectaron diferencias estadísticamente significativas en las semanas 4 y 16 con valores de P<F = 0.005 y 0.001, respectivamente, en contraste con la época de sequía, donde en todos los periodos evaluados se reportaron diferencias estadísticamente significativas entre los tratamientos (P<F= 0.000 para cuatro y ocho semanas; 0.006 para 16 semanas).
Por otra parte, también se aprecia en el Cuadro 2 la pérdida de peso de los diferentes tratamientos durante las épocas de lluvias y de sequía. Se distingue que la descomposición es más acelerada en el periodo de lluvias, pues a las cuatro semanas se ha incorporado aproximadamente el 77 % de la masa inicial y al final del periodo (16 semanas) alrededor del 93 %. Por el contrario, en la temporada de sequía se incorporó cerca del 63 y 78 % para los mismos periodos.
Al mismo tiempo, se observa que la más rápida descomposición en los monocultivos correspondió a M.oleifera (aproximadamente 96 %) y la más lenta a L. leucocephala (92.3 %), en contraste con las asociaciones donde L. leucocephala con M. oleifera incorporó cerca del 94 % y 90 % cuando está asociada a G. ulmifolia.
Mientras tanto, para la temporada de sequía se observa que la velocidad de descomposición en los monocultivos sigue el orden: G. ulmifolia< L. leucocephala< M.oleifera con valores de 61.4, 76.5 y 92.6 %, respectivamente. Mientras que en las asociaciones L. leucocephala con G. ulmifolia incorporó cerca del 72 % y cuando está asociada con M. oleifera el 86.5 %
En forma general, el proceso de descomposición fue mayor en el periodo de lluvias con aproximadamente 87 % de la masa incorporada, en tanto que en la temporada de sequía se incorporó alrededor del 70 %, prevaleciendo una diferencia de cerca del 17 % entre las épocas.
Igualmente, se observa que entre épocas se presentaron diferencias estadísticamente significativas en todos los periodos de evaluación con valores de P<F = 0.002, 0.000 y 0.001, para las cuatro, ocho y 16 semanas, respectivamente. Es de hacer notar que en ninguno de los periodos evaluados se detectaron interacciones entre las épocas y los tratamientos (P<F= 0.971, 0.797 y 0.974 para las cuatro, ocho y 16 semanas).
La Figura 3 muestra las ecuaciones de predicción con las constantes de descomposición (k), los coeficientes de regresión (R2) y las probabilidades (P<F) de la pérdida de peso, halladas tras la aplicación del modelo exponencial simple (Y= ae-bt), para los diferentes tratamientos en las temporadas de lluvias y sequía. En los monocultivos los valores de k fluctúan entre -0.31 y -0.41 y son netamente superiores que los estimados para el periodo de sequía, a excepción de la constante de descomposición de M. oleifera, que muestra un valor de k= -0.50. En las asociaciones los valores de k en lluvias también son mayores que en la temporada de sequía. Asimismo, los R2 para los monocultivos y las asociaciones en la época de lluvias predicen entre 98 y 99 % el proceso de descomposición, en tanto para la temporada de sequía también existe una buena predicción. (83-98 %).
Las pérdidas de peso presentadas por los tratamientos evaluados fueron rápidas en la fase inicial del ensayo, debido a que este proceso inicial es realizado por la macrofauna, que es la encargada de fragmentar físicamente los residuos vegetales con el fin de mejorar las condiciones del material para que la microfauna pueda continuar con el proceso de descomposición. La fase final es llevada a cabo por hongos y bacterias del suelo (Reynolds y Hunter, 2001). Igualmente, la descomposición inicial está también relacionada con la concentración de elementos solubles en agua y carbohidratos, mientras que la fase final de la descomposición está más relacionada con los contenidos de lignina presentes en los materiales (Preston y Trofymow, 2000). Por otro lado, la calidad y cantidad de recursos del suelo y la hojarasca afectan directamente la abundancia, composición y actividad de la comunidad descomponedora. Los datos obtenidos para determinar el peso seco remanente de los cinco tratamientos, se ajustaron bien al modelo exponencial simple. Esto concuerda con otros estudios realizados sobre descomposición (Palm y Sánchez, 1990; Mungia, 2003).
Descomposición y patrones de liberación de Nitrógeno
En el Cuadro 3 se indica el comportamiento del N y se puede observar que entre los tratamientos se presentaron diferencias estadísticamente significativas solo durante la época de lluvias, con valores de P<F= 0.000 y 0.001 en los tres periodos de muestreo (cuatro, ocho y 16 semanas), al contrario de la temporada de sequía, donde los tratamientos se comportaron de forma similar durante los tres periodos de evaluación y no se observaron diferencias estadísticamente significativas con P<F= 0.987, 0.872 y 0.915 para las cuatro, ocho y 16 semanas.
En la temporada de lluvias se presentó una rápida liberación de N, al final del periodo de evaluación (16 semanas). En los monocultivos se observó la siguiente secuencia: M. oleifera >L. leucocephala > G. ulmifolia con valores de 92.5, 92.6 y 95.9 %. En las asociaciones L. leucocephala con M. oleifera, la liberación fue más rápida (85.4 %) que cuando está asociada con G. ulmifolia (79 %).
Por otra parte, en la temporada de sequía el proceso de descomposición fue más lento, G. ulmifolia en monocultivo fue la de menor velocidad en liberar el 72.5 % de N a las16 semanas, mientras M. oleifera fue la más veloz con 94.5 % a las 16 semanas. Por su parte, L. leucocephala liberó el 78.5 %. En las asociaciones también se evidenció una lenta descomposición durante los periodos de incubación: L. leucocephala con G. ulmifolia, liberó menos N (54 % al final del periodo) que cuando está asociada a M. oleifera (67 %). (Cuadro 3).
Al comparar la liberación promedio de N en las dos épocas del año, se observó que en lluvias fue aproximadamente el 71 % y en sequía 66 %. Asimismo, se presentaron diferencias estadísticamente significativas entre las épocas en los periodos de descomposición de cuatro, ocho y 16 semanas (P<F0.039, 0.001 y 0.004); además no hubo efecto de la interacción entre épocas y tratamientos, tal como se observa en el Cuadro 3.
Solorio (2005), en el mismo banco mixto de proteínas, a la edad de dos años, observó una rápida liberación de N en M. oleifera, moderada en L. leucocephalay lenta en G. ulmifolia las primeras cuatro semanas en la época de lluvias (67, 47 y 14 %), mientras que en las asociaciones L. leucocephala con M. oleifera obtuvo la mayor liberación (47 %). Para la temporada de sequía reporta que la liberación de N siguió la misma tendencia, que al cotejarla con los resultados de esta investigación muestra que son muy similares.
Otros estudios realizados en plantaciones puras y mixtas de Pseudosamanea guachapele (Kunth) Harms y Eucalyptus grandis W. Hill. en Brasil por Balieiro et al. (2008), encontraron que a pesar de que la liberación de N y P para P. guachapele y E. grandis no se ajustaba bien al modelo exponencial, observaron una tendencia a la liberación más rápida de estos elementos en las plantaciones mixtas de estas dos especies a las 22 semanas, en comparación con las plantaciones puras. Por su parte, Wang et al. (2008) en plantaciones puras y mixtas de Cunninghamia lanceolata (Lamb.) Hook. y Michelia macclurei Dandy al sur de China, encontraron que la liberación de N estuvo entre el 47 al 66 % en las plantaciones puras, mientras que en las mixtas fue más rápida.
En el Himalaya central, en una plantación mixta establecida en tierras agrícolas abandonadas, Semwal etal. (2003) estudiaron la composición química y los patrones de descomposición de seis especies de árboles de uso múltiple: Alnus nepalensis D. Don., Albizzia lebbek (L.) Benth.,Boehmeria rugulosa Wedd.,Dalbergia sissoo DC., Ficus glomerata Roxb. y F. roxburghii Steud. y reportan que las tasas más altas de liberación de N y P se produjeron durante la temporada de lluvias.
El patrón que mejor caracterizó la descomposición y liberación de N, fue el modelo simple exponencial. La Figura 4 muestra las ecuaciones de predicción y las constantes de descomposición (-k), los coeficientes de regresión (R2) y la probabilidades (P<) para el nitrógeno, tanto en temporada de lluvias como en sequía, según la aplicación del modelo exponencial simple (Y= ae-bt), para los diferentes tratamientos en las temporadas de lluvias y sequía. En los monocultivos los valores de k fluctúan entre -0.34 y -0.48 y son netamente superiores que los estimados para el periodo de sequía, exceptuando el k para M. oleifera (-0.58) en sequía. En las asociaciones los valores de k en lluvias, también son mayores que en la temporada de sequía. Asimismo, los R2 predicen el proceso de descomposición para los monocultivos (99 %) y las asociaciones (95 %) en la época de lluvias y >80 % para el periodo de sequía.
Descomposición y patrones de liberación de materia orgánica.
En el Cuadro 4 se aprecia que para la MO ocurrieron diferencias significativas entre los tratamientos en la época de lluvias (P<F= 0.000 y 0.000) y sequía (P<F= 0.000 y 0.0024) sólo en los periodos evaluados a las cuatro y 16 semanas, respectivamente.
En el periodo lluvioso el proceso de incorporación de MO fue más rápido. En los monocultivos, al final del periodo de estudio, la secuencia fue M. oleifera > G. ulmifolia > L. leucocephala con 96.8, 93.3 y 92.9 %, respectivamente. Mientras que en las asociaciones, L. leucocephala con M. oleifera, incorporó el 85.5 % y cuando está asociada con G. ulmifolia el 83.8 %.
Para la época de sequía al final del periodo (16 semanas), en los monocultivos M. oleifera incorporó rápidamente el 94.5 % de la MO, seguida de L. leucocephala y G. ulmifolia con 77.5 y 63.3 %, respectivamente. En las asociaciones se observó que la incorporación fue mayor en L. leucocephala con M. oleifera que cuando esta con G. ulmifolia, con 62.5 y 53.8 %, respectivamente (Cuadro 4).
Al comparar la incorporación promedio de MO en las dos épocas del año, se observó que en lluvias fue aproximadamente el 83 % y en sequía 61 %.
Asimismo, ocurrieron diferencias estadísticamente significativas entre las épocas del año con valores P< F= 0.006, 0.000 y 0.001 para los tres periodos de evaluación, y no hubo efecto de la interacción entre épocas y tratamientos.
Solorio (2005) reporta que no encontró diferencias significativas entre los tratamientos para la época de sequía. En los monocultivos, a las cuatro semanas L.leucocephala liberó el 45 % de la MO, mientras que en M. oleifera y G. ulmifolia el proceso fue más lento, para el mismo periodo, observándose valores de 41 y 33 %, respectivamente. Al final del proceso M. oleifera incorporó el 79 % de MO. En las asociaciones, a las cuatro semanas L. leucocephala y M. oleifera (41 %) y L. leucocephala con G. ulmifolia (32 %), al final del periodo experimental la asociación de L. leucocephala con M.oleifera liberó el 79 %. En la temporada de lluvias en los monocultivos la más rápida descomposición fue para M.oleifera (87 %) y la más lenta para G. ulmifolia (62 %) a las 16 semanas. La asociación L. leucocephala con M.oleifera presentó la descomposición más rápida. Confrontando estos resultados con los aquí considerados se observaron diferencias importantes en cuanto al comportamiento de las especies en monocultivos y asociadas en las dos épocas del año, en cuanto a la velocidad del proceso de descomposición durante el periodo de investigación.
La Figura 5 muestra las ecuaciones predictivas y los coeficientes de descomposición (k), los coeficientes de regresión (R2) y las probabilidades (P<) para la MO, y el modelo que mejor caracterizó la descomposición y liberación de MO fue el simple exponencial (Y= ae-bt) tanto en temporada de lluvias como en sequía. En los monocultivos los valores de k fluctúan entre -0.33 y -0.48 y son superiores a los estimados para el periodo de sequía, a excepción de la constante de descomposición de M.oleifera, que muestra un valor de k de -0.59. En las asociaciones, los valores de k en lluvias también son mayores que en la temporada de sequía. De igual forma, los coeficientes de regresión (R2) predicen que el proceso de descomposición puede ser explicado en 99 % para los monocultivos y 98 % en las asociaciones para la época de lluvias; en tanto para la temporada de sequía, también existe una adecuada predicción (>80 %).
Hairiah (1999) argumenta que las prácticas de manejo de la materia orgánica tales como los sistemas de setos vivos con cultivos intercalados pueden tener un gran impacto en la descomposición, la mineralización de nutrimentos y la actividad microbiana. Trabajos realizados en Lampung (Indonesia) en un bosque secundario encontraron cantidades más altas de biomasa microbiana (106 mg·kg-1), poblaciones microbianas totales (224 x 104 UFC) y actividad microbiana (7 mg·kg-1·día-1 de CO2 producido) en comparación con lo hallado en parcelas de ocho años en sistemas de setos vivos con cultivos intercalados y aportes de poda de Peltophorum adnatun Griseb., Gliricidia sepium (Jacq.) Walp., Calliandra calothyrsus Meisn.,L. leucocephala oFlemingiamacrophylla (Willd.) Merr. En las mismas parcelas registraron siete especies de lombrices de tierra bajo el bosque secundario, que disminuyó a seis en el sistema de setos vivos con cultivos intercalados (Peltophorum, Gliricidia y la asociación Peltophorum+ Gliricidia) y cinco especies en las parcelas testigo (sin setos vivos), respectivamente.
Los residuos de cultivos, hojarasca, restos de podas incorporados al suelo, son determinantes para la actividad de los microorganismos, ya que constituyen una fuente importante de energía para su crecimiento (Da Costa, 1995), representando un 1-5 % del C y N y hasta 19 % del P orgánico (Meléndez et al., 1995).
Petit et al. (2009) señalan que las especies arbóreas poseen elementos de alto valor nutricional que ayudan a reducir problemas de fertilidad en los suelos; ello incorporando hojarasca de buena calidad para un eficiente reciclaje de nutrimentos y de esta manera aumentar la posibilidad de mejorar la productividad de las especie(s) asociada(s). Del mismo modo, las leguminosas arbóreas pueden establecer simbiosis con bacterias y hongos, que mejoran la disponibilidad de elementos limitantes para su crecimiento, y añaden que la asociación de especies arbóreas puede utilizarse para satisfacer una amplia gama de objetivos productivos, ecológicos y económicos. Sin embargo, esto no sólo depende de las características de las especies, sino también en gran medida de los recursos disponibles del sitio, tales como luz, agua y nutrimentos del suelo, así como también del manejo del agroecosistema.
Por otra parte, Richards et al. (2010) afirman que si las tasas de descomposición son constantes o aumentan, una mayor producción de hojarasca o cambios en el ritmo de las aportaciones en plantaciones mixtas podrían aumentar el suministro de nutrientes al suelo, en comparación con los monocultivos; e ilustran con un ejemplo de un experimento en árboles tropicales, en el cual la producción de la madera y hojarasca sobre el suelo fueron superiores en las mezclas de tres especies que en sus correspondientes monocultivos, debido a que las interacciones interespecíficas influyen en el crecimiento y la captura de nutrimentos, mientras que las tasas de descomposición de hojarasca no fueron afectadas.
CONCLUSIONES
Leucaena leucocephala, Guazuma ulmifolia y Moringa oleifera en monocultivo y asociadas, demostraron su capacidad para producir considerables cantidades de materia orgánica y liberar importantes cantidades de N en cortos periodos. La pérdida de masa inicial del follaje fue más rápida en la época de lluvias; los patrones de descomposición de todas las especies siguieron el modelo exponencial simple, con más del 80 % de la masa inicial incorporada al final del periodo de estudio (16 semanas).
La pérdida de peso fue más rápida en Moringa oleifera > asociación L. leucocephala con M. oleifera > L.leucocephala> asociación L. leucocephala con G. ulmifolia > G. ulmifolia., mientras la liberación de N fue más rápida en Moringa oleifera y más lenta en la asociación L. leucocephala con G. ulmifolia. Por su lado, que las hojas de L. leucocephala y G. ulmifolia liberaron N a tasas con valores intermedios. Lo anterior tiene significativas implicaciones para la sincronización de la liberación de nutrimentos con la absorción de los cultivos en sistemas de bajos insumos (e. g. agricultura migratoria) en los trópicos, donde los ciclos de rotación son frecuentes (Jordan, 1985). En este sentido las especies estudiadas en esta investigación tendrían un trascendental valor para el caso del N y la MO liberada, y puede inferirse que la disponibilidad de estos elementos podría utilizarse en diferentes sistemas agroforestales de acuerdo a los requerimientos de N y al ciclo de rotación, por ejemplo en cultivos en callejones con combinaciones agrosilvicolas (maíz, calabaza, frijoles, entre otros) y silvopastoriles (árboles en pastizales, bancos y asociaciones forrajeras), y también como métodos de conservación de suelos en zonas con problemas de erosión.
AGRADECIMIENTOS
A la Universidad de los Andes, de Mérida, Venezuela, financiadora de los estudios doctorales de la Profesora Judith Petit Aldana, al Consejo Nacional de Ciencia y Tecnología de México y al personal técnico del área de forrajes del campus de Ciencias Biológicas y Agropecuarias de la UADY.
LITERATURA CITADA
Aber, J., Melillo, J. (1991). Terrestrial Ecosystems. USA: Saunders College Publishing. [ Links ]
Aerts, R. (1997). Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: a triangular relationship. Oikos, 79: 439-449. [ Links ]
Balieiro, F., Rodrigues, B., Pereira, M., De Faria, S.,Franco, A.,Campello, E. (2008). Biological nitrogen fixation a nutrient release from litter of the guachapele leguminous tree under pure and mixed plantation with eucalyptus. Cerne. 14(3),185-193. [ Links ]
Bautista, F., Palma-López, D., Huchin-Malta, W. (2005). Actualización de la clasificación de los suelos del estado de Yucatán. En: F. Bautista y G. Palacio (Eds.) Caracterización y Manejo de los Suelos dela Península de Yucatán: Implicaciones Agropecuarias, Forestales y Ambientales (105-122).México: Universidad Autónoma de Campeche, Universidad Autónoma de Yucatán. [ Links ]
Conagua. (2010). Boletín meteorológico del estado de Yucatán. México. Recuperado de http://www.conagua.gob.mx/OCPY07/Contenido/Documentos/BolEst.pdf [ Links ]
Da Costa, M. (1995). Abonos verdes: una práctica indispensable en los sistemas agrícolas de las regiones tropicales y subtropicales. En García, J.E y Monte-Najera, J. (eds.). Agricultura Orgánica (91-119). San José, Costa Rica: EUNE. [ Links ]
García, E. (1988). Modificaciones al sistema de clasificación climática de Köppen para adaptarlos a lascondiciones de la República Mexicana. México: Universidad Nacional Autónoma de México. [ Links ]
Hairiah, K. (1999). Changes of decomposition rate of different litter quality under different soil biological condition. En: A. Gafur, FX. Susilo, M. Utomo y M. van Noordwijk (eds.).Proceedings of a Workshopon Management of Agrobiodiversity in Indonesia forSustainable Land Use and Global EnvironmentalBenefits(29-39) Bogor: UNILA/PUSLIBANGTAN. [ Links ]
Mafongoya, P. L., Giller, K. E., Palm, C. A. (1998). Decomposition and nutrient release patterns of prunings and litter of agroforestry trees. Agroforestry Systems, 38: 77-97. [ Links ]
Meléndez, G., Szott, T., Ricse, A. (1995). Mineralización de nitrógeno de material foliar de especies de Inga. En: Szott, L. T.( eds ),Nitrogen fixing tree,research report (35-41). Morrilton, Ark. USA, Turrialba, Costa Rica: CATIE. [ Links ]
Mungia, R. (2003). Tasas de descomposición y liberación de nutrientes de hojarasca de E. deglupta, C.arabica y de hojas verdes de E. poeppigiana solas y en mezclas. Tesis MSc. Turrialba, Costa Rica: CATIE. [ Links ]
Palm, C. A., Sánchez, P. A. (1990). Decomposition and nutrient release of the leaves of three tropical legumes. Biotropica, 22, 330-338. [ Links ]
Petit, A. J., Casanova, L. F., Solorio, S. F. J. (2009). Asociación de especies arbóreas forrajeras para mejorar la productividad y el reciclaje de nutrimentos. Agricultura Técnica en México.35 (11), 107-116. [ Links ]
Preston C. M., Trofymow, J. A. (2000). Canadian intersite decomposition experiment working group, variability in litter quality and its relationship to litter decay in canadian forests. Canadian of Journal of Botany. 78: 1269-1287. [ Links ]
Reynolds B. C, Hunter, M. D. (2001). Responses of soil respiration, soil nutrients, and litter decomposition to inputs from canopy herbivores. Soil Biol. Biochem.33: 1641-1652. [ Links ]
Richards, A., Forrester, D., Bauhus, J., Scherer-Lorenzen, M. (2010). The influence of mixed tree plantations on the nutrition of individual species: a review.Tree Physiology: 30(9): 1192-1208. doi: 10.1093/treephys/tpq035. [ Links ]
Semwal, R. L., Maikhuri, R. K., Rao, K. S., Sen, K. K., Saxena, K. G. (2003). Leaf litter decomposition and nutrient release patterns of six multipurpose tree species of central Himalaya, India. Biomassand Bioenergy,24, 3-11. [ Links ]
Solorio, S. F. J. 2005. Soil fertility and nutrient cyclingin pure and mixed fodder bank systems usingleguminous and non/leguminous shrubs. PhD Thesis, Institute of Atmospheric and Environment Science. Edinburgh, Scotland. doi: 10.1016/S0961.9534(02)00087-9 [ Links ]
Tian G., Badejo, M. A. (2001). Soil fauna and soil fertility. En: G. Tian , Jerry L. Hatfield , F. Ishida (Eds), Sustaining Soil Fertility in West Africa (45–67). Madison, Wisconsin: SSSA Special Publication [ Links ]
Wang, Q., Wang, S., Huang, Y. (2008). Comparisons of litterfall, litter decomposition and nutrient return in a monoculture Cunninghamia lanceolata and a mixed stand in southern China. Forest Ecologyand Management, 255, 1210–1218. doi: 10.1016/ j.foreco2007. 10.026. [ Links ]














