Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo serie ciencias forestales y del ambiente
versão On-line ISSN 2007-4018versão impressa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.17 no.3 Chapingo Set./Dez. 2011
Potencial de la organogénesis como estrategia para la masificación in vitro de Fitzroya cupressoides en Sudamérica Austral
Potential of organogenesis as a strategy for in vitro propagation of Fitzroya cupressoides in Austral South America
José Vidal Cob-Uicab1*; Ana M. Sabja2; Darcy Ríos-Leal3; Antonio Lara-Aguilar4; Pablo J. Donoso4; Mauro E. González4; Bernardo Escobar4
1 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. MÉXICO. Correo-e: cob.jose@inifap.gob.mx (*Autor para correspondencia).
2 GenFor S. A. Valdivia, Chile.
3 Facultad de Ciencias Forestales y Centro de Biotecnología, Universidad de Concepción-Chile
4 Universidad Austral de Chile. Facultad de Ciencias Forestales y Recursos Naturales. CHILE.
Recibido: 22 de noviembre, 2010
Aceptado: 25 de marzo, 2011
RESUMEN
Fitzroya cupressoides (alerce) es una conífera endémica de Sudamérica austral cuya madera ostenta atributos de belleza y durabilidad. El presente estudio evaluó el efecto de componentes hormonales suplementado con medios de cultivo sobre la capacidad organogénica de Fitzroya cupressoides, y se analizó el proceso de regeneración in vitro mediante estudios histológicos. Se ensayó el medio de cultivo básico Quorin y Lepoivre (QL) suplementado con diferentes concentraciones de ácido indol 3-butírico (AIB), 6-bencilaminopurina (BAP) y ácido 2,4-diclorofenoxiacético (2,4-D) utilizando segmentos nodales y hojas aciculares. Se utilizó un diseño completamente al azar con cinco repeticiones balanceado; la unidad experimental fue un frasco de vidrio conteniendo un explante, y la inducción de callogénesis correspondió a una placa petri con cuatro explantes foliares. Hubo efectos significativos (P = 0.001) del tratamiento sobre las variables respuesta número de brotes y elongación caulinar. La prueba de rangos múltiples de Duncan confirmó que los tratamientos que observaron diferencias significativas fueron 0.1 mg·L-1 de AIB y 1.5 mg·L-1 de BAP para número de brotes por explante y 0.1 mg·L-1 AIB y 1.0 mg·L-1 de BAP para la elongación caulinar. El análisis histológico demostró la proliferación de estructuras meristemáticas a partir de tejido subepidérmico.
Palabras clave: 2,4-diclorofenoxiacético, callogénesis, segmentos nodales, propagación in vitro.
ABSTRACT
Fitzroya cupressoides, commonly known as Alerce in South American Spanish, is a conifer species native to southern South America, where its wood is highly prized for its beauty and durability. This study evaluated the effect of hormonal components supplemented with culture media on the organogenic process of Fitzroya cupressoides and analyzed the in vitro regeneration process by histological studies. The Quorin-Lepoivre (QL) basic culture medium, supplemented with different concentrations of indole 3-butyric acid (IBA), 6-benzylaminopurine (BA) and 2,4-dichlorophenoxyacetic acid (2,4-D), was tested using nodal segments and acicular leaves. A completely randomized design with five balanced replications was used; the experimental unit was a glass jar containing an explant, while a petri dish containing four foliar explants was used for inducing callogenesis. The treatment factor had significant (P = 0.001) effects on the response variables number of shoots and caulinary elongation. Duncan's multiple range test confirmed that the treatments that had significant differences were 0.1 mg·L-1 of IBA and 1.5 mg·L-1 of BA for number of shoots per explant and 0.1 mg·L-1 IBA and 1.0 mg·L-1 of BA for caulinary elongation. Histological studies demonstrated the proliferation of meristematic structures from sub-epidermal tissue.
Key words: 2,4-dichlorophenoxyacetic acid (2,4-D), callogenesis, nodal segments, in vitro propagation.
INTRODUCCIÓN
Fitzroya cupressoides (Mol.) Johnston (Alerce) es una especie arbórea dioica, excepcionalmente monoica (Grosfeld y Barthélemy 2001, Donoso et al. 2006). Pertenece a uno de los tres géneros monotípicos que posee la familia Cupressaceae en los bosques templados de Sudamérica austral (Veblen et al., 1976; Donoso et al., 2006). En Chile, Fitzroya cupressoides ocurre en poblaciones disyuntas entre los 39° 50' y los 43° S. En Argentina, su distribución abarca desde los 40° 57' hasta los 42° 45' S (Donoso, 1981; Kitzberger et al., 2000; Premoli et al., 2003). Esta especie es sumamente longeva, habiéndose fechado mediante técnicas dendrocronológicas un individuo de 3,622 años (Lara y Villalba, 1993), lo que convierte en la segunda especie más longeva del mundo después de Bristlecone pine, Pinus longaeva (Currey, 1965; Lara y Villalba, 1993).
La belleza y la durabilidad de la madera de Fitzroya cupressoides fueron determinante para su aprovechamiento y explotación desde fines del siglo XVI, cortándose árboles de Alerce en forma indiscriminada para la construcción de casas e iglesias que hoy tienen gran valor arquitectónico y cultural (Lara, 1998; Donoso et al., 2006). Otros factores tales como la frecuencia de incendios, cambios en el uso del suelo y expansión urbana contribuyeron a la transformación de poblaciones de Fitzroya cupressoides, convirtiéndola en una especie vulnerable que, actualmente, está protegida nacional e internacionalmente (Donoso et al., 2006).
Por otro lado, la producción de semillas es cíclica, y es común que sean inviables en una alta proporción de los árboles productores en un año determinado. Específicamente, las semillas poseen cierto grado de latencia que es necesario romper mediante estratificación en frío por lo menos durante 30 días, encontrándose el óptimo en términos de capacidad y energía germinativa con 60 días de estratificación en frío, con lo que se logra un 24 % de capacidad germinativa (Donoso et al., 1993; Donoso et al., 2006).
Frente a este escenario, el cultivo in vitro de tejidos vegetales es una alternativa potencial para superar algunas de las dificultades antes mencionadas. Asimismo, constituye una etapa importante para el establecimiento de un banco ex situ de germoplasma libre de enfermedades y patógenos (Uribe et al., 2008).
El objetivo de este estudio fue evaluar la capacidad organogénica in vitro de Fitzroya cupressoides. Específicamente, determinar el efecto del ácido 2,4-D diclorofenoxiacético sobre la inducción de callogénesis y realizar estudios histológicos del proceso de regeneración in vitro. Lo anterior, como una aportación en los inicios del establecimiento con cimientos científicos de un banco de germoplasma libre de enfermedades y patógenos con fines futuros de recuperación, conservación y propagación in vitro de Fitzroya cupressoides.
MATERIALES Y MÉTODOS
El estudio se realizó en el laboratorio de micropropagación y biotecnología forestal de la empresa GenFor, S. A., ubicada en la ciudad de Valdivia, Chile. Valdivia se localiza entre las coordenadas geográficas 39° 49' de latitud S y 73° 14' de longitud W.
Material vegetal. Como material vegetal inicial se utilizaron plántulas logradas a partir de semillas germinadas y mantenidas durante cuatro meses en vivero. Las plántulas fueron sometidas a un tratamiento en vivero aplicando una solución fungicida y bactericida de captan 1.5 gr·L-1, benlate 1.8 gr·L-1 y phyton 1.0 ml·L-1, respectivamente. Las aplicaciones se realizaron mediante una solución compuesta por captan y benlate en dos fases de siete días cada una, vía foliar. Entre cada fase se aplicó phyton vía radicular, y 24 horas antes de la introducción a laboratorio las plántulas fueron asperjadas utilizando únicamente una solución phyton.
Transcurrido el periodo anterior, se procedió a escindir ramas laterales de las plántulas, a las cuales se les cortaron las acículas a tres milímetros de la base y se eliminaron las brácteas evitando desprender la porción caulinar. Posteriormente, se realizaron dos enjuagues en agua corriente durante cinco minutos y tres minutos. Finalmente, se efectuó un último enjuague en agua destilada estéril durante cinco minutos y se cortaron segmentos nodales de dos a tres centímetros de longitud.
A continuación, bajo cámara de flujo laminar y en agitación continua, se inició la asepsia superficial de los explantes mediante una inmersión en solución de etanol al 70 % v/v durante cinco minutos, seguida de dos enjuagues de tres minutos cada uno con agua destilada estéril. Posteriormente, fueron inmersos en una solución de NaClO (hipoclorito de sodio) al 50 % v/v más una gota de Tween 20, manteniéndolos en agitación continua durante 20 minutos. Por último, se efectuaron tres enjuagues consecutivos con agua destilada estéril durante 3, 4 y 5 minutos.
Finalmente, los explantes fueron cultivados en tubos de ensayo conteniendo 15 ml de medio de cultivo gelificado con agar-agar y se incubaron en cámara de crecimiento a 25 ± 1° C, bajo un fotoperiodo de 16 horas de luz fría y a una intensidad lumínica de 40 µmol·m-2·s-1.
Después de 90 días del establecimiento del cultivo, bajo cámara de flujo laminar auxiliándose con pinzas y bisturí se procedió a la escisión de acículas como explante para la inducción de callos. A éstas se les realizaron heridas en forma de pinchazos y cortes a lo largo del nervio central colocando dos en posición adaxial y dos en posición axial por cada placa petri que contenía 25 ml de medio de cultivo. Las placas petri conteniendo los explantes foliares fueron incubadas en cámara de crecimiento bajo condiciones de oscuridad.
Medio de cultivo. En las etapas de establecimiento, proliferación y elongación caulinar el medio de cultivo utilizado correspondió a QL (Quorin y Lepoivre 1977) suplementado con la combinación y balance hormonal: 0.1 mg·L-1/1.0 mg·L-1, 0.1 mg·L-1/1.5 mg·L-1 y 0.5 mg·L-1/2.0 mg·L-1 de AIB (ácido indol 3-butírico) y BAP (6-bencilaminopurina) (Cuadro 1). Bajo este modelo de desarrollo morfogénico las variables que se evaluaron fueron número de brotes por explante y elongación caulinar por explante.

Para la inducción de callos, el medio de cultivo base fue QL suplementado con las siguientes concentraciones hormonales: 2.0 mg·L-1, 2.5 mg·L-1 y 3.0 mg·L-1 de 2.4-D (ácido 2.4-diclorofenoxiacétido) (Cuadro 1). Como fuente energética se le agregó sacarosa (30 g·L-1), gelificada con agar-agar (7 g·L-1). El pH fue ajustado a 5.7 con NaOH (hidróxido de sodio) previa inclusión del agar y esterilizado en autoclave a 120° C y 1 atm de presión durante 15 minutos. Bajo este modelo de desarrollo morfogénico como respuesta se cuantificó el porcentaje de formación de callo, diámetro en mm y color de callo.
Diseño experimental y análisis estadístico. El experimento se estableció bajo un diseño completamente al azar con cinco repeticiones balanceado. En las fases de proliferación y elongación caulinar la unidad experimental fue un frasco de vidrio con un explante, estableciéndose quince frascos de cultivo por cada tratamiento. En la inducción de callo la unidad experimental correspondió a una placa petri conteniendo cuatro explantes foliares, con lo que se constituyeron quince unidades por cada tratamiento. Se realizó un análisis de varianza a través del procedimiento PROC GLM del programa estadístico SAS (Statistical Analysis System, 1992). Finalmente, la comparación de medias de los tratamientos se realizó mediante el procedimiento prueba de rangos múltiples de Duncan.
Estudio histológico. Para el estudio histológico se tomaron 20 acículas, diez durante las etapas de proliferación y elongación caulinar y diez a los 120 días de iniciado el cultivo. Las muestras fueron Ajadas entre 24-48 horas en FAA [formalina (5 %)-ácido acético (5 %)-alcohol etílico (90 %)]. Posteriormente, se lavaron con agua corriente durante 24 horas. Una vez concluido el lavado, el tejido fue deshidratado en soluciones seriadas de alcohol etílico (50, 75, 85 y 95 %) cada dos horas. Seguidamente, las muestras se sumergieron tres veces en alcohol etílico puro, durante dos horas en los primeros dos inmersiones y durante toda la noche en la última traslación. Luego se realizaron tres inmersiones en xilol por dos horas en cada deslizamiento, y se impregnaron tres veces en parafina cada dos horas. A continuación, las muestras se incluyeron en bloques de parafina a los que se les realizaron cortes en secciones transversales y longitudinales con un grosor de 5-8 µm utilizando un micrótomo de deslizamiento vertical. Finalmente, cada corte fue adherido a un portaobjetos y teñido con azul de astra safranina al 1 %. Para la observación de las muestras se utilizó un microscopio Axioskop OPTON, y las imágenes se fotografiaron con una cámara digital Canon Power Shot G5 adaptada al microscopio.
RESULTADOS Y DISCUSIÓN
La aplicación de la solución fungicida y bactericida a las plantas donantes, aunada al procedimiento aséptico que se realizó en laboratorio, fue efectiva en un 100 % en el control de la contaminación endógena. Específicamente, a los 90 días de cultivo se observaron brotes de aspecto vigoroso y hojas aciculares de tono verde oscuro de apariencia más gruesa que exhibieron ausencia de contaminación (Figuras 1A-C). De acuerdo a las características evaluadas, este fue el periodo de tiempo de cultivo seleccionado para la obtención de los explantes foliares que fueron cultivados para la inducción de callo.

Acorde a los resultados del ANOVA, el factor tratamiento observó efecto significativo (P<0.001, F = 104.72) sobre las variables número de brotes y elongación caulinar. Lo anterior indica la existencia de un efecto diferente significativo producto de alguno de los tratamientos sobre las variables dependientes.
En relación al número de brotes, hubo diferencias significativas con respecto a los tres niveles hormonales analizados (Cuadro 2). Específicamente, el tratamiento T2 (0.1/1.5 mg·L-1) fue el que originó un mayor número de brotes, exhibiendo en promedio cinco brotes por explante (Figura 1B). En contraste, el tratamiento T3 (0.5/2.0 mg·L-1) estimuló múltiples puntos de crecimiento (Figura 1C), atribuibles a la proporción auxina-citoquinina reflejándose en elevadas tasas de proliferación. En la fase de elongación caulinar, el tratamiento T1 (0.1/1.0 mg·L-1) fue el que produjo un efecto positivo significativo (Cuadro 2). Bajo esta proporción hormonal se lograron microtallos que observaron tallas en promedio 18 mm de longitud a los 90 días de cultivo (Figura 1A, Cuadro 2). Por el contrario, los explantes que fueron cultivados en el tratamiento T2 (0.1/1.5 mg·L-1) produjeron brotes que exhibieron tallas en promedio de 8 mm de longitud en el mismo periodo de cultivo (Figura 1B, Cuadro 2). Congruente con estos resultados, se demuestra y fundamenta el papel elemental de las relaciones hormonales auxina-citoquinina como un factor clave en el control de la morfogénesis.

La formación de callo se inició en la superficie adaxial de las acículas, principalmente en la región del nervio central asociado siempre a la herida. Concretamente, a los 30 días de cultivo se comenzó a observar la presencia y formación de callos en los tres tratamientos estudiados. A los 45 días de cultivo se evidenció la formación de gran cantidad de callos con una coloración que varió desde el blanco crema a amarillento, pasando por el verde hasta el café claro (Figura 1D-F). Las evaluaciones evidenciaron que la concentración de 3.0 mg·L-1 de 2,4-D fue la que presentó el porcentaje más alto de callogénesis por explante, redundando en un mayor grado de tejido diferenciado. Asimismo, los callos exhibieron una coloración verde, un mejor tamaño y una consistencia más friable (Figura 1F, Cuadro 2). Acorde a lo anterior, se definió como el tratamiento más adecuado para la producción de callo por las características que exhibieron, principalmente la consistencia más friable como una particularidad fundamental para estudios subsecuentes.
Estudio histológico. En la secuencia de imágenes de la Figura 2A-F se aprecia la formación de protuberancias en segmentos nodales y hojas aciculares de Fitzroya cupressoides. Las Figuras 2A y 2B conciernen a un corte de la sección transversal de una protuberancia separada del explante inicial, en el cual se aprecia la formación de un domo meristemático (DM) y la presencia de dos primordios foliares (PF), originando de esta forma un meristemo caulinar (MC).
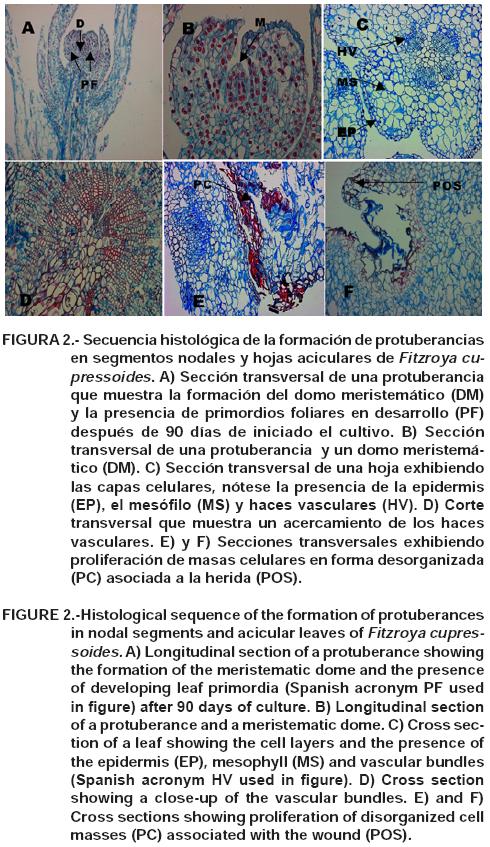
Las Figuras 2C-F muestran un corte de la sección transversal de una acícula incluyendo los diferentes momentos de muestreo. Las Figuras 2C y 2D corresponden a un corte antes de realizar las heridas a la acícula, destacándose el nivel de organización y la disposición de los tejidos que conforman las capas celulares de la epidermis (EP), mesófilo (MS) y en el centro los haces vasculares (HV). Las Figuras 2E y 2F muestran una sección transversal de la región adaxial de la hoja a los 45 días de iniciado el cultivo in vitro. Específicamente, en la Figura 2E se observa una proliferación celular desordenada como respuesta al estímulo hormonal y asociada a la herida. En la Figura 2F se aprecia el crecimiento de estructuras meristemáticas (POS) originadas a partir del tejido subepidérmico (mesófilo).
Estos resultados indican y fundamentan la presencia de una actividad morfogénica en el mesófilo de la hoja, lo que redunda en protuberancias que alcanzan un estado de diferenciación, permitiéndole independencia y con ello la organización de un meristemo caulinar.
En el ámbito del cultivo in vitro de tejidos vegetales, las principales dificultades se deben en parte a los problemas de contaminación endógena que presenta el material vegetal y las características recalcitrantes de la especie (Leslie y McGranahan 1992, Caboni et al. 1996). De acuerdo con Cassells (1991), la microbiota contaminante en el cultivo in vitro de tejidos vegetales es la causa de pérdidas económicas muy importantes. Al respecto, Alvarado (1998) expone que en la lucha por prevenir o eliminar los contaminantes en el cultivo in vitro, se ensayan y ponen en práctica diferentes opciones que van desde tratamientos a las plantas donantes e incremento de las medidas de asepsia, hasta la utilización de productos antimicrobianos de origen sintético o natural.
Los resultados obtenidos en este estudio demuestran que la aplicación de fungicidas y bactericidas a las plantas donantes, previo al establecimiento in vitro, es una alternativa viable que contribuye a la prevención y disminución de la contaminación endógena del material vegetal. Asimismo, se confirma la importancia de la aplicación de un protocolo de desinfección riguroso, el cual permitió incrementar los coeficientes de proliferación.
Por otro lado, es imprescindible la utilización de una relación hormonal auxina-citoquinina apropiada que promueva la división y elongación celular. Al respecto, Fraga et al. (2002), Tang et al. (2004a) y Ramarosandratanam y Van Staden (2005), sugieren que las diferencias en la respuesta a la división y elongación celular de los tipos de explantes tienen un vínculo con la existencia de marcadores de tipo bioquímico o diferencias en concentraciones hormonales endógenas. Edwald (1998) menciona que la bencilaminopurina en dosis mayores con relación a la auxina es efectiva para la inducción de brotes en coníferas.
En este estdio la combinación y dosis hormonal compuesta por 0.1/1.5 mg·L-1 de AIB/BAP (tratamiento T2) (Cuadro 2) fue la que favoreció un mayor número de brotes por explante. Estos resultados coinciden con los obtenidos en Pinus canariensis por Martínez et al. (1990), Pinus halepensis por Lambardi et al. (1993), en Pinus sp. por Niella y Rocha (2001) y en Picea chihuahuana por Mata et al. (2001), donde las mejores respuestas en la tasa de proliferación se lograron en concentraciones similares de BA complementadas al medio nutritivo. No obstante, Pierik (1990) señala que los requerimientos de citoquininas son extremadamente variables y dependen del contenido endógeno de cada especie.
La elongación caulinar se favoreció conforme se disminuyó la concentración de BA, estableciéndose una concentración óptima de 0.1/1.0 mg·L-1 de AIB/BAP (tratamiento T1) (Cuadro 2) atribuible a una disminución de la división celular y promoviéndose la elongación del tejido debido a la acción de las auxinas. En contraste, los microtallos que fueron cultivados en el tratamiento T3 (0.5/2.0 mg·L-1) no elongaron originando arrosetamiento de los explantes (Figura 1C, Cuadro 2), lo cual se explica por la alta concentración de citoquinina presente en el medio de cultivo.
Por otra parte, se evidencia la efectividad en la respuesta del tejido foliar para lograr con éxito la formación de callo. En las coníferas los mayores éxitos en la inducción de callo se han logrado empleando como explante embriones cigóticos maduros e inmaduros, debido a que poseen un alto potencial embriogénico en relación con cualquier otra parte de la planta (Tang et al., 1998; Tang y Newton, 2004). No obstante, se ha demostrado la posibilidad de formar y obtener callo a partir de hojas jóvenes como explante inicial (Conde et al., 2004).
La formación de callo ocurrió en los tejidos que conforman el nervio central de la hoja (Figura 1F). Al respecto, Caboni et al. (1999) señalan que la alta densidad de tejidos vasculares que existe en la región del nervio central, es la principal causa de la elevada respuesta en la formación de masa callosa. Concretamente, las células subepidérmicas de la superficie adaxial de la hoja se dividen anticlinalmente para formar el parénquima clorofílico en empalizada, mientras que el resto de las células de este tejido no sufren cambios y son las que dan origen al parénquima clorofílico esponjoso. Consecuentemente, en condiciones inductivas favorables las células que deberían formar el parénquima clorofílico en empalizada continúan dividiéndose y forman así una masa callosa.
Otros estudios concluyentes sugieren que la formación de callo a partir de células poco diferenciadas (Lara et al., 2003), ocurre debido a la proximidad de estas últimas con tejidos meristemáticos existentes como el procambium, donde se asume que la concentración de los reguladores de crecimiento es mayor.
La formación de callo estuvo siempre asociada a la herida (Figura 1D-F). Ésta desempeña un papel fundamental como factor de estrés que promueve un mecanismo de defensa, manifestándose en una respuesta morfogénica en los tejidos vegetales. Adicionalmente, las heridas permiten poner en contacto directo algunos tejidos internos con el medio de cultivo y facilitan la absorción de los reguladores de crecimiento (George, 1993).
La composición y concentración de los reguladores de crecimiento en el medio de cultivo son factores determinantes para inducir la formación de callo. Algunas especies sólo requieren de la acción de las auxinas para que se promueva la proliferación de células tipo callo (Robledo y Carrillo, 2004; Montero et al., 2006). Concretamente, una de las auxinas comúnmente empleada en el medio de inducción es el 2,4-D (ácido 2,4-diclorofenoxiacético) con un efecto inductor efectivo, al cual se le atribuye una tendencia a suprimir la morfogénesis dando como resultado una rápida proliferación de células tipo callo (Trejo et al., 2002; Olmos et al., 2004; Robledo y Carrillo, 2004; Montero et al., 2006).
El análisis histológico confirmó la presencia de estructuras meristemáticas, las cuales al dividirse por mitosis dieron origen a nuevas estructuras (Figura 2A, 2B y 2F). Asimismo, evidenció que la formación de las estructuras nodulares estuvo asociada a la herida (Figura 2F), como factor de estrés que redundó en un desarrollo morfogenético in vitro.
CONCLUSIONES
El cultivo in vitro de tejidos vegetales a partir de segmentos nodales escindidos de plántulas de Fitzroya cupressoides, es factible en las fases de proliferación y elongación caulinar. Asimismo, se evidenció la viabilidad del éxito en la inducción de callogénesis a partir de hojas aciculares. Consecuentemente, este estudio pionero en implicar a esta especie demostró el potencial de esta herramienta biotecnológica como una alternativa viable para el rescate, conservación y masificación in vitro de Fitzroya cupressoides. No obstante, se requiere optimizar el proceso mediante la realización de otros estudios.
AGRADECIMIENTOS
Al Programa Internacional de Becas del International Fellowships Fund (IFF) de la Fundación Ford, por la beca otorgada al primer autor para realizar estudios de doctorado en la Universidad Austral de Chile. A la Escuela de Graduados de la Facultad de Ciencias Forestales y Recursos Naturales, por el financiamiento parcial otorgado para la adquisición de productos químicos en la fase experimental. Al personal investigador de GenFor, S. A., por las facilidades, comentarios y sugerencias durante el desarrollo de la fase experimental.
LITERATURA CITADA
Alvarado, Y. (1998). Contaminación microbiana en el cultivo in vitro de plantas. In: Propagación y mejora genética de piantas por biotecnología. Pérez, J. N. (edit.). Cuba. Instituto de Biotecnología de las Plantas. [ Links ]
Caboni, E. M., Tonelli, P., Lauri, S. D., & Damiano, C. (1999). In vitro shoot regeneration from leaves of wild pear. Plant Ceil, Tissue and Organ Cult. 59,1-7. [ Links ]
Caboni, E. M., Lauri, S., Tonelli, P., Falasca, G., & Damiano, C. (1996). Root induction by Agrobacterium rhizogenes in walnut. Plant Sci. 208,118-203. [ Links ]
Cassells, A. C. (1991). Problems in tissue culture: culture contamination. In; Micropropagation. Edited by Debergh and Zimmerman. Netherlands. Dordrecht, The Netherland. Kluwer Academic Publisher. [ Links ]
Conde, P., Loureiro, J., & Santos, C. (2004). Somatic embryogenesis and plant regeneration from leaves of Uimus minor Mill. Plant Ceii 22,632-639. [ Links ]
Currey, D. R. (1965). An ancient bristlecone pine stand in Eastern Nevada. Ecology 46,564-566. [ Links ]
Donoso, C. (1981). Investigación y desarrollo forestal. Tipos forestales de los bosques nativos de Chile. Documento de trabajo 38. Santiago, Chile. Corporación Nacional Forestal. [ Links ]
Donoso, C., Cortes, M., & Escobar, B. (1993). Efecto del árbol semillero y la época de cosecha de semillas en la capacidad germinativa en vivero de Fitzroya cupressoides. Bosque 14(1),63-71. [ Links ]
Donoso, C., Lara, A., Escobar, B., Premoli, A., & Souto, C. (2006). Autoecología de las especies coniferas Chilenas. Fitzroya cupressoides (Molina) I. M. Johnst. In; Las especies arbóreas de los bosques templados de Chile y Argentina. Autoecología. Ed. Donoso, C. Valdivia, Chile. Ediciones Marisa Cuneo. [ Links ]
Edwald, D. (1998). Advances in tisuee culture of adult larch. In Vitro Ceil. Dev. Biol. Plant. 34(4),325-330. [ Links ]
Fraga, M., Canal, M., & Rodriguez, R. (2002). In vitro morphogenic potential of differently aged Pinus radiata D. Don trees correlates with polyamines and DNA methylation levels. Plant Ceil, Tissue and Organ Cult 70 (2),139-145. [ Links ]
George, E. (1993). Plant propagation by tissue culture. Exegetics. [ Links ]
Grosfeld, J., & Barthélemy, D. (2001). Dioecy in Fitzroya cupressoides (Molina) I.M. Johnst. and Pilgerodendron uviferum (D.Don.) Florin (cupressoides). Life Sciences 324,245-250. [ Links ]
Kitzberger, T., Pérez, A., Iglesias, G., Premoli, A., & Veblen, T. T. (2000). Distribución y estado de conservación de Alerce (Fitzroya cupressoides Mol) Johnst en Argentina. Bosque 21(1),79-89. [ Links ]
Lambardi, M., Sharma, K. K., & Thorpe, T. A. (1993). Optimization of in vitro bud induction and plantlet formation from mature embryos of alepo pine (Pinus halepensis Mill). In Vitro Cell y Dev. Biol. 29,189-197. [ Links ]
LARA, A. (1998). Alerces, gigantes milenarios del bosque nativo. (Fitzroya cupressoides trees: the millenary giants of the native forests): 94-102. In: Defensores del bosque Chileno (Eds.). La tragedia del bosque Chileno. Santiago, Chile. Ocho libros editores. [ Links ]
Lara, A., & Villalba, R. (1993). A 3,620-year temperature reconstruction from Fitzroya cupressoides tree rings in southern south America. Science 260,1104-1106. [ Links ]
Lara, A., Valverde, R., & Gómez, L. (2003). Histología de embriones somáticos y brotes adventicios inducidos en hojas de Psychotria acuminata. Agronomía Costarricense 27(1), 37-48. [ Links ]
Leslie, C., & Mcgranahan, G. (1992). Micropropagation of persian Walnut (Juglans regia L.). Biotechnology in Agriculture and Forestry 18,137-150. [ Links ]
Martínez, P., Harry, I. S., & Thorpe, T. A. (1990). In Vitro regeneration of plantlets of Canary Island pine (Pinus canariensis). Can. J. For. Res. 20,1200-1211. [ Links ]
Mata, M. R., Chávez, M., & Boettler, R. B. (2001). In vitro regeneration of plantets from in mature zygotic embryos of Picea chihuahuana Martínez, an endemic Mexican endangered species. In Vitro Cell y Dev. Biol. 1,73-85. [ Links ]
Montero, C., Macías, E., & Wong-Vega, L. (2006). Organogénesis directa y múltiple en tejidos juveniles de guandú (Cajanus cajan L. Millsp). Invet. Pens. Crit. 4,20-31. [ Links ]
Niella, F., & Rocha, P. (2001). Research and development of vegetative propagation techniques for Pinus sp. In: The Northeast Region of Argentina. Proceedings of the 26 Th Biennial Southern Forest Tree Improvement Conference. Jeffrey, F.D. (Ed). Athens, GA, USA. Dean-Georgia University. [ Links ]
Olmos, S., Luciani, G., & Galdeano, E. (2004). Métodos de propagación y conservación de germoplasma. In: Biotecnología y mejoramiento vegetal. Echenique, V., Rubinstein, C., & Mroginski, L. (Eds). Buenos Aires, Argentina: Consejo Argentino para la Información y el Desarrollo de la Biotecnología. [ Links ]
Pierik, R. (1990). Cultivo in vitro de plantas superiores. Madrid, España. Ediciones Mundi-Prensa. [ Links ]
Premoli, A. C., Vergara, R., Souto, C. P., Lara, A., & Newton, C. (2003). Lowland valleys shelter ancient Fitzroya cupressoides in temperate South America. The Royal Society of New Zealand 33,1-9. [ Links ]
Quorin, M., & Lepoivre, P. (1977). Etudes de mileux adaptes aux cultures in vitro de prunes. Acta Horticulturae 78,437-442. [ Links ]
Ramarosandratanam, A., & Van Stadem, J. (2005). Changes in competence for somatic embryogenesis in Norway spruce zygotic embryo segments. Journal of Plant Physiology. 162, 583-588. [ Links ]
Robledo, A., & Carrillo, G. (2004). Regeneración in vitro de plantas de Chile (Capsicum annuum L.) mediante cultivo de cotiledones e hipocótilos. Fitotecnia Mexicana 27,121-126. [ Links ]
SAS Institute Inc. (1992). Statistical Analysis System. 6.03 Edition. Cary, NC. USA. 1028 P. [ Links ]
Tang, W., Harrys, L., Outhavong, C., & Newton, R. 2004. The effect of different plant growth regulators on adventitious shoot formation from Pinus virginiana Mill. zygotic embryo explants. Plant Cell, Tissue and Organ Culture 78(3),237-240. [ Links ]
Tang, W., & Newton, R. (2004). Increase of polyphenol oxidase and decrease of polyamines correlate with tissue browning in Virginia pine (Pinus virginiana Mill). Plant Science 167, 621-628. [ Links ]
Tang, W., Ouyang, F., & Guo, C. (1998). Plant regeneration though organogenesis from callus induced from mature zygotic embryos of loblolly pine. Plant Cell Rep 17, 557-560. [ Links ]
Trejo, G., Maldonado, U., Jiménez, A., Blanqueto, M., Salcedo, G., Martínez, P., & de Jesús, A. (2002). Reguladores de crecimiento en la regeneración de plantas a partir de anteras de arroz Oriza sativa L. (Cultivar Japónica H2005). Agrociencia 36, 441-449. [ Links ]
Uribe, M., Delaveau, C., Garcés, M., & Escobar, R. (2008). Efecto de asepsia y fitohormonas en el establecimiento in vitro de Berberidopsis corallina, a partir de segmentos nodales. Bosque 29(1),58-64. [ Links ]
Veblen, T., Delmastro, R., & Schlatter, J. (1976). The conservation of Fitzroya cupressoides and its environment in southern Chile. Environ. Conserv. 3(4),291-301. [ Links ]














