Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.17 no.3 Chapingo sep./dic. 2011
Coexistencia trófica de aves carpinteras (Picidae) en un bosque de Pinus cembroides (Zucc.) del área natural protegida Peña Alta, San Diego de la Unión, Guanajuato
Trophic coexistence of woodpeckers (Picidae) in a Pinus cembroides (Zucc.) forest of the natural protected area know as Peña Alta, San Diego de la Union, Guanajuato
Saúl Ugalde-Lezama1; Luis A. Tarango-Arámbula2*; Gustavo Ramírez-Valverde3; Armando Equihua-Martínez4; Juan I. Valdez-Hernández5
Colegio de Postgraduados. km 36.5 Carretera México-Texcoco. Montecillo, Estado de México. C. P. 56230, Programas de Ganadería1, Forestal5, Estadística3, Entomología y Acarología4. Campus San Luis Potosí2. Correo-e: ltarango@colpos.mx (*Autor para correspondencia).
Recibido:8 de diciembre 2010
Aprobado:16 de junio 2011
RESUMEN
Estudiar la coexistencia trófica en aves es relevante para su manejo y conservación. Para ello, de enero a octubre de 2008 se identificaron técnicas de cacería y componentes entomológicos de las dietas de aves piciformes. Para la observación de las aves se usó la técnica de búsqueda intensiva en puntos de radio fijo, y para su captura, redes de niebla. Melanerpes formicivorous y Picoides scalaris prefirieron las técnicas de cacería Perforar y Colectar. Dichas técnicas se explicaron por cinco y cuatro variables (P<0.05), respectivamente. Los estratos más utilizados fueron Pinus cembroides y Quercus spp. Los órdenes de insectos más consumidos fueron Coleóptera y Hemíptera. Las principales familias registradas corresponden a Scolytidae, Curculionidae, Pentatomidae, Cicadellidae, Cleridae y Melyridae. Los insectos más consumidos fueron los tipo Plaga (P), No Plaga (NP) y Predadores (PR). Se registró una proporción significativa de individuos (X2=9.19, X20.001(5)=20.5) de insectos en las dietas. Sin embargo, no fue posible registrar todos los fragmentos (X2=56.33, X20.001(5)=20.5). El número de individuos (a=0.05, P-value=0.2317) y fragmentos (a=0.05, P-value=0.2606) entre especies fue similar. Siete variables (P<0.05) determinaron la ocurrencia de grasa y el consumo de presas. Los Picidos bajo estudio, a pesar de poseer anatomías, fisiologías y etologías similares, coexistieron tróficamente segregados durante la procuración alimenticia, minimizando de esta manera la competencia interespecífica.
Palabras clave: Trófico, dietas, Pinus cembroides, Melanerpes formicivorous, Picoides scalaris, Peña Alta.
ABSTRACT
The study of trophic coexistence in bird species is relevant to their management and conservation. From January to October 2008, feeding behaviors and entomological diet components of Melanerpes formicivorous and Picoides scalaris were identified. Fixed radius points were used to observe birds, mist nest were used to capture them. Melanerpes formicivorous and Picoides scalaris preferred the hunting techniques Drilling and Collecting during feeding behaviors. These hunting techniques were explained by five and four variables (P<0.05), respectively. The strata Pinus cembroides and Quercus spp were the most common by both species. Coleoptera and Hemíptera were the most consumed insect orders. The main families recorded correspond to Scolytidae, Curculionidae, Penta-tomidae, Cicadellidae, Cleridae and Melyridae. The types of insects most consumed by both species were Pest (P), No Pest (NP) and Predators (PR). A significant proportion of individuals (X2=9.19, X20001(5)=20.5) of insects in diets was recorded. However, it was not possible to record all insect fragments (X2=56.33, X20.001(5) =20.5). The number of individuals (a=0.05, P-value=0.2317) and fragments (a=0.05, P-value=0.2606) among species was similar. Seven variables (P<0.05) determined the occurrence of fat and consumption of prey. Although the two species of woodpeckers studied have similar anatomy, physiology and ethology, they trophically coexisted in ANPPA segregated during their feeding process minimizing, in this way, interspecific competition.
Key words: Trophic, diets, Pinus cembroides, Melanerpes formicivorous, Picoides scalaris, Peña Alta.
INTRODUCCIÓN
Los pájaros carpinteros forman parte de una gran familia de la clase Aves, orden Piciforme, ampliamente distribuidos en el mundo, excepto en Madagascar, Australia y latitudes extremas (Short, 1980; Alabarce, 1981). Mundialmente se han registrado 183 especies representadas en 24 géneros; la región del Neotrópico concentra el mayor número de éstas con 95 especies distribuidas en 11 géneros (Short, 1985). En México se reportan 27 especies (Winkler y Christie, 2002; Benz et al., 2006), siendo Picoides y Melanerpes dos géneros que habitan algunos de sus bosques de pino templados (Jackson, 1971; Almazán-Núñez et al., 2009; Ugalde-Lezama et al., 2010). Estas aves han desarrollado evolutivamente adaptaciones morfológicas, anatómicas y etológicas, las cuales les han permitido desplazarse con habilidad entre la vegetación (Scortecci, 1969), y trepar y consumir larvas e insectos de los troncos. Otras especies, por el contrario, tienen una dieta más diversificada que incluye frutas frescas y semillas (Stacey, 1981; Sick, 1985; Mikich, 2002).
Short (1971), Morrison y With (1987), Grubb y Woodrey (1990) y Block (1991) realizaron estudios en los que el dimorfismo sexual desempeña un papel importante en la segregación de sus recursos alimenticios y uso diferencial del hábitat; particularmente en aves del género Picoides, familia Picidae (e.g. Picoides nuttallii). Otras especies como Melanerpes formicivorous, que también consume insectos, presentan un espectro trófico más amplio, incluyendo en su dieta desde bellotas hasta lagartijas; sin embargo, en el Neotrópico la composición entomológica de la dieta de ambos picidos se desconoce (Kattan, 1988; Koenig et al., 1995; Winkler et al., 1995; Koenig y Haydock, 1999). Por su parte, Patterer et al. (2003) estudiaron las dietas de Melanerpes candidus y Colaptes melanochloros basándose en sus contenidos estomacales, pero sólo indicaron los grandes grupos de organismos que conforman dichas dietas.
Los bosques de México presentan perturbaciones antropogénicas y disturbios naturales que, a través de la pérdida de su cobertura vegetal, han modificado su estructura, composición y dinámica natural (Rzedowski, 1978). El Área Natural Protegida Peña Alta (ANPPA) presenta condiciones de bosques con diferentes grados de perturbación, las cuales ocasionan diferentes patrones en su biodiversidad, favoreciendo a diversas especies de insectos (IEEG, 2002). El ANPPA alberga una importante comunidad de aves conformada por 60 especies clasificadas en cuatro órdenes y 20 familias; en donde la familia Picidae se representa en esta área únicamente por Picoides scalaris y Melanerpes formicivorous y de las cuales no existen estudios en esta región del Neotrópico sobre sus técnicas de cacería, y preferencia y composición entomológica de sus dietas, en función de diferencias morfológicas (Almazán-Núñez et al., 2009), que permitan definir patrones de coexistencia trófica. Por lo tanto, los objetivos del presente estudio fueron a) determinar las técnicas de cacería utilizadas por Melanerpes formicivorous y Picoides scalaris durante su alimentación, b) definir la composición entomológica de sus dietas y c) evaluar la coexistencia trófica de dichas especies; todo ello considerando sus diferencias morfológicas (e.g. condición de grasa corporal, estructura del cráneo y pico).
MATERIALES Y MÉTODOS
Área de estudio
Se localiza en la porción sur del Área Natural Protegida Peña Alta (ANPPA), a 21° 27' 30.6" latitud norte, 100° 59' 6.5" longitud oeste, entre las cotas 2,147 a 2,332 m del sistema montañoso Cubo-Las Nieves. El área de estudio corresponde a un rodal de área Pinus cembroides [Zucc.] (Miranda y Hernández-X, 1963); el clima corresponde a BS1k Semiseco, con una temperatura media anual de entre 12 y 22 °C, presentando un invierno fresco con temperaturas inferiores a los 18 °C en el mes más frío y una precipitación promedio anual de 550 mm (IEEG, 2002). Este estudio se desarrolló en una superficie de 117.5 ha, la cual incluye condiciones de bosque semiconservado (BDC) y bosque perturbado (BDA; Figura 1). Sin embargo, en el proceso de identificación de la coexistencia trófica, objeto de este estudio, no se consideraron en el análisis estas dos condiciones de bosque.

Muestreo y registro de aves
Para el muestreo del área de estudio y obtener una independencia estadística de los datos, se definieron y establecieron 25 Unidades de Elección (UEl; 11 en BDC y 14 en BDA) mediante un muestreo sistemático (MS) y un muestreo simple aleatorio (MSA) acompañado de una elección sistemática (ES) con distancias mínimas entre cada UEl de 250 m. (Figura 1).
Durante enero-octubre 2008, se realizaron 10 muestreos de aves cuya duración fluctuó entre las 6:00 y 12:00 h, horario en que las aves tienen mayor actividad; sin embargo, éstos se realizaron media hora después de salir el sol y solamente en días con óptimas condiciones climáticas (Robbins et al., 1986; Silva y Sherry, 1992; Lovette y Holmes, 1995). Estos muestreos se condujeron con dos esquemas complementarios de monitoreo, para aumentar la probabilidad de detección de especies e individuos de comportamiento quieto y silencioso (López-DeCasenave et al., 1998): 1) búsqueda intensiva en puntos con radio fijo de 25 m (Ambrose, 1989; Ralph et al., 1996) y 2) captura con redes de niebla mediante esfuerzo constante (Hutto et al., 1986; Rappole et al., 1998; Wunderle, 1994). La implementación de estas técnicas de monitoreo fue en función del diseño de muestreo definido y con base en las alturas (estratos verticales de la vegetación).
La observación de las aves mediante búsqueda intensiva en puntos con radio fijo de 25 m se desarrolló empleando simultáneamente el método de muestreo focal (Altmann, 1974; Altmann y Altmann, 2003), en el cual el observador se ubica primeramente en el centro de la UEl y recorre lentamente su interior hasta detectar a un ave, registrando sólo aquellas que mostraron alguna técnica de cacería marcada (Robinson y Holmes, 1982). Sólo se consideró en el análisis la primera exhibición de las aves por alguna técnica de cacería con una duración >20 segundos (Wunderle y Latta, 1998). Para evitar pseudorrepeticiones, únicamente se registró la primera técnica de cacería mostrada por cada individuo en las UEl (Wagner, 1981). Las observaciones de las aves se llevaron a cabo en periodos de 10 min; comenzando un minuto después de que el observador llegara a la UEl y permitir así que el comportamiento de las mismas se adaptara a su presencia (Reynolds et al., 1980; Hutto et al., 1986; Ralph et al., 1996). La identificación de las aves se realizó mediante el uso de binoculares (25 x 50 m; Bushnell) y guías de campo (e.g. Peterson y Chalif, 1989; National Geographic Society, 2002). Además, se registró el número de individuos por especie, estrato utilizado durante su alimentación [Pino (PIN); Encino (ENC); Suelo (SUEL); Arbustivas (ABU); Mezquite (MEZ); Zacate (ZAC); Huizache (HUI); Aéreo (AER); Otros] y sus técnicas de cacería [Perforar (PER); Colectar (COL); Bajar (BAJ); Remover (REM); Arrebatar (ARR); Impulsar (IMP); Revolotear (REV); Barrer (BAR); Perseguir (PERS); Semirrevolotear (SEMIREV); Inspeccionar (INS); Otras], con base en los criterios de uso del hábitat y comportamientos tróficos propuestos por Fitzpatrick (1981), Szaro y Jakle (1982), Remsen y Robinson (1990); así como su comportamiento gregario y movimiento unidireccional (Elgar et al., 1983).
La captura de las aves se desarrolló al siguiente día, después de Analizar el proceso de observación en cada UEI, en un horario de 6:00 a 12:00; para ello, se emplearon redes ornitológicas de niebla de 12 x 2.6 m y luz de malla de 36 mm (Ralph et al., 1996; DeSante et al., 2004) colocadas en todo el plano vertical de la vegetación y revisadas cada 60 min. Las aves capturadas fueron medidas anatómica (e.g. ancho, largo del pico, cráneo, longitud total) y morfológicamente (e.g. grasa corporal) mediante los criterios de Robbins et al. (1986) y colocadas individualmente en cajas de cartón (15 x 15 x 10 cm) durante 60 min, periodo durante el cual se obtuvieron muestras de sus excretas y conservadas en alcohol al 70 %. Los componentes fecales, con base en sus características morfológicas, fueron separados (utilizando un microscopio estereoscópico con resolución de 10-80 x; Gámez-Virués et al., 2007) y categorizados en fragmentos de insectos y no insectos empleando el protocolo de Whitaker (1988). Los fragmentos de insectos se identificaron como tipo [Plaga, (P); No Plaga (NP); Parásito (PA); Predator (PR)], orden y familia utilizando las referencias de Comstock (1918), Borror y DeLong (1971), Borror et al. (1989), Equihua (1989), Naumann (1991), Stehr (1991), Lepley (1994) y una colección propia creada durante el presente estudio (Medianero et al., 2003). Una vez separados los componentes entomológicos, se siguieron los criterios de Rosenberg y Cooper (1990) para definir el número de fragmentos, individuos y proporción de sus restos.
Análisis de datos
Las asociaciones gráficas de las especies de pájaros carpinteros con las técnicas de cacería, estratos y tipos de insectos utilizados durante su alimentación, se generaron mediante Análisis de Correspondencias Simples (ACS; Benzécri, 1984; Greenacre, 2002; Härdle y Simar, 2007), utilizando el software Statistica v. 9.1. (Stat. Soft., 2010).
Las preferencias de las aves se definieron mediante Índices de Frecuencias de Observación (FO; Curts, 1993) modificados por Ugalde-Lezama et al. (2009). Para definir el índice de preferencia por algún estrato en particular se utilizó la siguiente ecuación: FO=(No. de aves registradas en un estrato/No. total de aves registradas en todos los estratos)*100; para identificar la técnica de cacería se empleó: FO=(No. de aves registrando una técnica de cacería particular/No. total de aves registradas en todas las técnicas de cacería)*100; y para definir la contribución de cada categoría entomológica en las dietas de las mismas: FO=(No. de familias de insectos registradas en la dieta de una especie de ave/No. total de familias de insectos registradas en la dieta de dicha especie de ave)*100. Dichos índices se calcularon con el software Microsoft Excel (2007).
Las probabilidades de presencia o ausencia para la ocurrencia de las técnicas de cacería y la condición de grasa corporal asociada al consumo de presas, se calcularon con Análisis de Regresión Logística Simple (ARLS; Truett et al., 1967). Durante estos análisis, las estructuras de los modelos se ajustaron mediante un procedimiento por pasos (Stepwise), con criterio de clasificación del mínimo Akaike (AIC; Akaike, 1969; Guisan y Zimmerman, 2000) para seleccionar, en ambos casos, el mejor modelo (Jongman et al., 1995; Zocchi y Atkinson, 1999). Durante este proceso, se consideraron coeficientes estadísticamente significativos aquellos en los que P<0.05 (McCullagh y Nelder, 1989; González-Oreja, 2003). Ambos análisis se realizaron usando los Modelos Lineales Generalizados (GLM) del software R v. 2.11.0. (Dalgaard, 2006; R, 2010).
Para determinar si las proporciones de individuos y fragmentos esperadas por familia de insecto eran las mismas en las dietas de ambas especies de aves, se utilizó una prueba de homogeneidad de X para tablas de contingencia (Parker, 1976; Krebs, 1978; Molinero, 2003) utilizando el software JMP IN v. 8.0.1 (Academic SAS Institute Inc., 2009). Las hipótesis contrastadas fueron: 1) Ho: La proporción de fragmentos por familia de insectos encontrados en las dietas de ambas especies de aves es igual en el área de estudio vs. Ha: La proporción de fragmentos por familia de insectos encontrados en las dietas de ambas especies de aves difiere en el área de estudio; y 2) Ho: La proporción de individuos por familia de insectos encontrados en las dietas de ambas especies de aves es la que presumiblemente se puede observar en el área de estudio vs. Ha: La proporción de individuos por familia de insectos encontrados en las dietas de ambas especies de aves no es la que presumiblemente se puede observar en el área de estudio.
En virtud de que no se cumplieron los supuestos de normalidad (Shapiro-Wilk) y homogeneidad de varianzas (Bartlett) para el uso de estadística paramétrica (Análisis de Varianza; ANOVA; Sokal y Rohlf, 1981), las posibles diferencias significativas en el número de individuos y los fragmentos por familia de insectos registrados en las dietas de ambas especies se llevaron a cabo con pruebas de estadística no paramétrica (Kruskal-Wallis para el contraste de k medianas; Zar, 1999) considerando una significancia de α=0.05 y empleando el software R v. 2.11.0. (Myles y Douglas, 1973; R, 2010).
RESULTADOS Y DISCUSIÓN
Los ACS mostraron asociación del 100 % entre las especies de pájaros carpinteros y las técnicas de cacería, estratos y tipos de insectos [órdenes, familias y tipos (P, NP, PA, PR); así como de los coleópteros y hemípteros (P, NP, PR)] registrados en sus dietas (Figuras 2, 3 y 4, respectivamente).
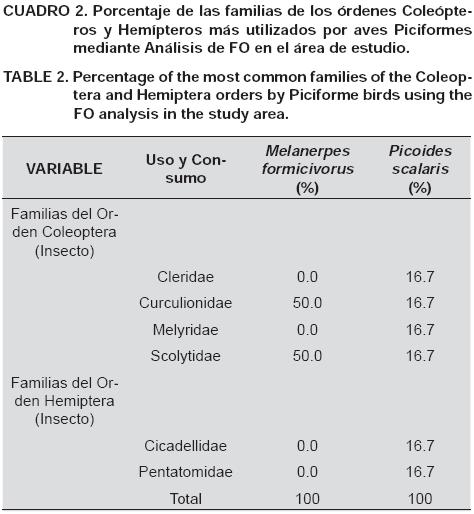
La distribución de frecuencias mostradas como porcentajes (FO) de los estratos de alimentación, las técnicas de cacería, así como de las familias de insectos de los órdenes Coleópteros y Hemípteros más consumidas por especie, señalan que Melanerpes formicivorous y Picoides scalaris utilizaron dichos recursos en diferente proporción en el área estudiada (Cuadros 1 y 2).
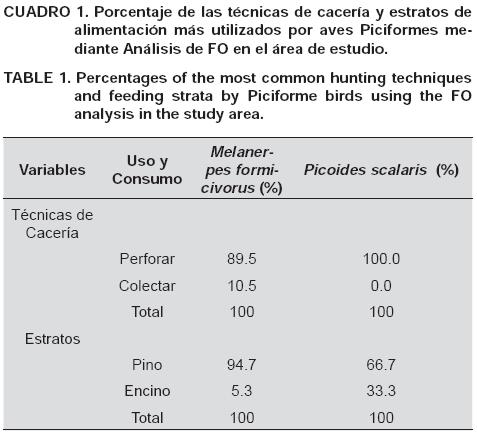
De acuerdo con Errington (1930), los comportamientos alimenticios de fauna silvestre y su incidencia en las comunidades vegetales contribuyen a mejorar su manejo y conservación. En este contexto, los ACS y FO mostraron que Melanerpes formicivorous y Picoides scalaris pueden coexistir, porque de manera gregaria o solitaria utilizan diferentes estratos vegetales (segregación) y técnicas de cacería durante su alimentación; ambas especies perforaron la corteza para la obtención de sus presas. Sin embargo, Melanerpes formicivorous también colectó insectos fitófagos sobre el dosel; por lo tanto, las recomendaciones para el manejo y conservación de ambas especies de carpinteros en el área de estudio, deberán enfocarse al diseño de estrategias que mejoren el hábitat y coadyuven a crear mejores condiciones de los troncos y el follaje. Estos resultados son explicados por Harrison et al. (1991), Mahon (1992), Camphuysen y Webb (1999) y Ostrand (1999), quienes señalan que las aves comúnmente forman grupos de alimentación, consecuencia de la conglomeración de presas, la cual atrae a especies de predadores que interactúan entre sí. Los picidos que encontraron sitios con una concentración sobresaliente de insectos funcionaron como indicadores catalíticos, es decir, señalaron a otras aves la ubicación de áreas con alta densidad de presas. Según Mills (1998), dicha conducta es explicada a través del reclutamiento visual durante el cual los individuos que utilizaron la técnica de cacería con una mayor duración, atrajeron a otras aves insectívoras. El gregarismo exhibido por las aves picidas durante su alimentación es similar al reportado por Root (1967) y Guariguata y Kattan (2002), quienes señalan que las aves se agrupan en gremios de especies o individuos que demandan niveles de algún recurso o funciones ecológicas similares de algún recurso o funciones ecológicas similares. Esto explica parcialmente la técnica de perforar por parte de ambas especies, ya que fueron capaces de encontrar grupos de presas incluso bajo la corteza.
Por otra parte, los ACS y FO mostraron que ambas especies coexisten debido a que presentaron asociaciones con dos estratos de alimentación, registrándose las mayores relaciones interespecíficas en troncos, ramas y follaje de Pinus cembroides; sin embargo, el estrato vegetal Quercus spp. fue utilizado en menor proporción. La utilización del estrato Pinus cembroides respondió a la dominancia de pináceas (95%) en el área bajo estudio aunada a la etología trófica y las características morfológicas de las aves, aspectos que les proporcionaron ventajas para explotar nichos específicos. Esto concuerda parcialmente con Grigera et al. (1994); Johnson (2000); Becerra y Grigera (2005), quienes señalan como estratos más utilizados por algunas aves, incluyendo a M. candidus, a los troncos y ramas, debido a su disponibilidad y a que poseen alimento durante todo el año; sin embargo, no reportan el uso específico del follaje. Por su parte, Carrascal y Tellería (1985) y López-DeCasenave (2001) encontraron que los estratos constituyen una variable importante en la segregación trófica en aves.
La plasticidad ecológica exhibida por las dos especies de aves en el área de estudio, ilustró cómo éstas optimizaron su adecuación trófica en función de la utilización de distintos niveles de Pinus cembroides. Esto difiere de lo reportado por Cooper et al. (1988), Greenberg (1990) y Greenberg et al. (1997), quienes observaron un mayor uso de huizache y mezquite por parte de ciertos picidos en otras regiones. La permanencia de dichas aves en el área de estudio seguramente estuvo condicionada por la disponibilidad de estratos portadores de alimento, a los que se ajustaron las técnicas de cacería de cada especie. Por ejemplo, la técnica Perforar les permitió estar presentes durante todo el año debido a que aun en invierno encontraron larvas e insectos sobre y debajo de la corteza y ramas; en contraste, la técnica Colectar le facilitó a Melanerpes formicivorous la recolección de presas en el follaje, particularmente durante la primavera, disminuyendo con ello la competencia alimenticia con Picoides scalaris y permitiendo su coexistencia trófica.
Gámez-Virués et al. (2007) argumentaron que la información de las dietas de aves permite conocer parte de su historia natural con fines de manejo de sus hábitats, de tal forma que se adapte o maximice el número de sus individuos. En este contexto, el ACS evidenció que Melanerpes formicivorous y Picoides scalaris usaron dos órdenes de insectos, consumiendo ambas coleópteros; sin embargo, Picoides scalaris se alimentó además de hemípteros. De igual forma, los ACS y FO señalaron que dichas aves consumieron seis familias de insectos depredando ambas especies a Scolytidae y Curculionidae; no obstante, Picoides scalaris consumió adicionalmente a Pentatomidae, Cicadellidae, Cleridae y Melyridae. Asimismo, el ACS indicó que entre las dos especies de carpinteros consumieron tres tipos de insectos (P, NP, PR), particularmente componentes entomológicos plaga, y sólo Picoides scalaris consumió presas no plaga y predadores. Por su parte, el ACS para coleópteros y hemípteros mostró que dichas especies de aves capturaron dos tipos (P, PR) de estos insectos, consumiendo ambas presas plagas; sin embargo, exclusivamente Picoides scalaris consumió predadores. Los resultados de la presente investigación coinciden parcialmente con lo reportado por Vigil (1973), Beltzer et al. (1995) y Rosas-Espinoza et al. (2008), quienes muestran el consumo de presas de algunas familias de los órdenes de coleópteros, hemípteros, himenópteros y lepidópteros; además de bellotas de diferentes especies de encinos, semillas y frutos por parte de C. melanochloros, M. candidus y Melanerpes formicivorous. Si bien las familias de insectos registradas en dichas especies de aves no coinciden con las registradas en el presente estudio, para Melanerpes formicivorous coincide el consumo del orden Coleóptera, lo cual apoya además lo reportado por Chatellenaz (2008) y Recher y Majer (2006), quienes sugieren que en algunos ecosistemas de Argentina y Australia algunas aves residentes (e.g. Melanerpes formicivorous y Picoides scalaris, para el área bajo estudio) contribuyen significativamente al control biológico de algunas plagas forestales del orden Coleóptera mediante depredación.
Los modelos de ARLS de las técnicas de cacería Perforar, Colectar y de Condición de Grasa Corporal presentaron un AIC de 76.9, 835.2 y 192.8, respectivamente. Los resultados obtenidos en los GLM (Cuadros 3, 4 y 5), respectivamente, señalan las variables que determinaron la probabilidad de ocurrencia para ambas técnicas de cacería y una óptima condición de grasa. De acuerdo con estos modelos, los pájaros carpinteros registrados en el ANPPA respondieron a variaciones en esos componentes o variables.
Así, los resultados del ARLS sugieren que las técnicas de cacería estuvieron también determinadas por la disponibilidad de estratos vegetales en un plano vertical (alturas), en donde estas condiciones particulares del hábitat influyeron sobre la presencia de larvas e insectos presa y sobre la etología trófica de los pájaros carpinteros. Por ello, la altura a la que se alimentaron dichas aves determinó la distribución de presas y consecuentemente el despliegue de ciertas técnicas de cacería, como lo sugieren parcialmente MacArthur (1958), Holmes et al. (1979), Marini y Cavalcanti (1993) y Latta y Wunderle (1998), quienes encontraron que algunas aves, incluyendo picidos, se alimentan en las áreas de transición definidas por los estratos con altura media y superior.
La diversidad de estratos de alimentación en el área de estudio, las técnicas de cacería utilizadas y la altura fueron variables que le permitieron a ambas especies separar sus nichos ecológicos. De acuerdo con Nocedal (1984), la utilización de la estructura vertical en bosques templados es selectiva a troncos, ramas y follaje del estrato superior, lugar desde donde las especies estudiadas ubicaron a sus presas y definieron qué técnica de cacería utilizar.
El ARLS también señaló que la condición de grasa corporal en pájaros carpinteros se determinó por factores ambientales propios del área de estudio y por variables morfológicas (e.g. cráneo y pico) que influyeron en el consumo de ciertos tipos de insectos y en la selección, conducta trófica y condición corporal del ave. Este patrón ha sido mostrado por aves frugívoras, en las cuales la morfología del pico y otras estructuras dependen del tamaño, forma, textura y tipo de alimento consumido (Wiens y Rotenberry, 1987; Gill, 1990; Colorado, 2004; Montaldo, 2005; Tietz y Johnson, 2007). Los resultados de esta investigación apoyan lo propuesto por Howe (1984) y Levey y Stiles (1994) quienes señalan que el pico es una adaptación clave, por lo que su tamaño, forma y fortaleza afecta su dieta, como sucedió en este estudio entre la morfología de las aves y el consumo de taxas de diversos tamaños. Dichas adaptaciones le permiten a las aves disminuir el riesgo de consumir alimentos dañinos y localizar fuentes de alimento por medio de fijación de imágenes (Ricklefs, 1990). Asimismo, las variables morfológicas influyeron en la condición corporal de las aves, y pocas especies de aves se incluyeron en un solo gremio trófico consumiendo otros recursos (e.g. semillas, este estudio) como consecuencia de la escasez de presas durante ciertos periodos clave.
De acuerdo con las pruebas de homogeneidad para el número de individuos y fragmentos (Cuadros 6 y 7, respectivamente), se observó una proporción adecuada de individuos de las diferentes familias de insectos que potencialmente consumen los pájaros carpinteros (X2=9.19, X20.001(5)=20.5). Sin embargo, no fue posible registrar todos los fragmentos de dichas presas (X2=56.33, X20.001(5)=20.5).
El número de individuos (P-value=0.2317) y fragmentos (P-value=0.2606) registrados en las dietas de ambas especies de aves no difirieron significativamente (Cuadros 8 y 9, respectivamente). Estos resultados podrían explicarse por los procesos fisiológicos de digestión de cada especie y el tiempo de consumo previo a la obtención de las excretas, las cuales, según Rosenberg y Cooper (1990), tienen rangos diferenciales de digestión. Sin embargo, el análisis de las excretas provee información valiosa sobre el tipo y tamaño de presas consumidas (Ralph et al., 1985). Los resultados del análisis de las excretas coinciden con lo encontrado por Baker y Brooks (1982) y Wurtz (1995), quienes demostraron que las aves tienen un efecto controlador de las poblaciones de insectos plaga y que la presencia de aves en el Área Natural Protegida Peña Alta se debe a la disponibilidad diferencial de taxas alimenticios a través del año.
CONCLUSIONES
A pesar de que Melanerpes formicivorous y Picoides scaiaris poseen características anatómicas, fisiológicas y de comportamiento similares, éstas coexistieron tróficamente en el ANPPA mostrando diferentes estrategias durante la procuración de alimentos mediante el uso de diferentes estratos, diferentes técnicas de cacería y obtuvieron diferentes órdenes de insectos (restricción trófica de Melanerpes formicivorous y tendencia depredadora de Picoides scaiaris); estas estrategias mostradas por las dos especies coadyuvaron a disminuir su competencia interespecífica. La presente investigación aporta nuevos registros para México de los componentes entomológicos que conforman las dietas de Melanerpes formicivorous y Picoides scalaris en un bosque de Pinus cembroides del estado de Guanajuato, y establece las bases para futuros estudios de esta naturaleza.
AGRADECIMIENTOS
Al C. Agustín Rodríguez Fuentes, por la identificación del material entomológico, y a la M.C. Beatriz C. Aguilar Valdez, por el préstamo de equipo ornitológico (Universidad Autónoma Chapingo); M.C. Jorge Valdez C., por el análisis de muestras en laboratorio (Colegio de Postgraduados); Instituto de Ecología del estado de Guanajuato (IEEG), por la autorización de trabajo en el área de estudio; Biól. Fernando De La Cruz Romero, C.P. Alicia Karina Gómez Rojas, Ing. José Domingo Cruz Labana, C. Juan Nava Londet, C. Antonio Ontiveros Fiscal y C. Juan Hernández Rocha (ANPPA) por las facilidades y apoyo brindados durante la realización de los trabajos de campo; Dr. Juan José Ramírez Delgadillo, por las sugerencias para mejorar el manuscrito.
LITERATURA CITADA
Academic SAS Institute INC. (2009). JMP IN Versión 8.0.1: Statistics for the Apple Macintosh. Statistics and Graphics Guide. Cary, North Carolina, USA: Academic SAS Inc. [ Links ]
Akaike, H. (1969). Fitting autoregressive models for prediction. Annals of the Institute of Statistical Mathematics, 21, 243-247. [ Links ]
Alabarce, E. (1981). Estudio comparativo de la porción superior del tracto digestivo y alimentación de dos Picidos de la provincia de Tucumán. Acta Zoológica Lilloana 26, 129-137. [ Links ]
Almazán-Núñez, R. C., Puebla-Olivares, F. y Almazán-Juárez, Á. (2009). Diversidad de aves en bosques de Pino-Encino del centro de Guerrero, México. Acta Zoológica Mexicana (n. s), 25 (1), 123-142. [ Links ]
Altmann, J. (1974). Observational study of behavior: sampling methods. Behaviour, 49, 227-267. [ Links ]
Altmann, S. A.& Altmann, J. (2003). The transformation of behaviour field studies. Animal Behaviour, 65, 413-423. [ Links ]
Ambrose, S. (1989). The Australian bird count—have we got your numbers?. Moonee Ponds, Vic. 3039, Australia: The Royal Australasian Ornithologists Union. [ Links ]
Baker, J. A. & Brooks, R. J. (1982). Impact of raptor predation on a declining vole population. Journal of Mammalogy, 63, 297-300. [ Links ]
Becerra, S. R. M. y Grigera, D. (2005). Dinámica estacional del ensamblaje de aves de un bosque Norpatagónico de Lenga (Nothofagus pumilio) y su relación con la disponibilidad de estratos de alimentación. Hornero, 20 (2), 131-139. [ Links ]
Beltzer, A. H., Paporello De Amsler, G. y Neffen, MA. I. (1995). Biología alimentaria del carpintero real Colaptes melanochloros (Aves:Picidae) en el Valle Aluvial del Río Paraná, Argentina. Anales de Biología Animal, 20 (9), 53-59. [ Links ]
Benz, B. W., Robbins, M. B. & Peterson, A. T. (2006). Evolutionary history of woodpeckers and allies (Aves: Picidae): Placing key taxa on the phylogenetic tree. Molecular Phylogenetics and Evolution, 40, 389-399. [ Links ]
Benzécri, F. (1984). Practique de lanalyse des donnes. Analyse des correspondences and classification. Paris, Dunod: Exposé élémentaire. [ Links ]
Block, W. M. (1991). Foraging ecology of Nutall's Woodpecker. The Auk, 108, 303-317. [ Links ]
Borror, D. J. & DeLong, D. M. (1971). An Introduction to the Study of Insects, 3th Ed. New York, USA: Holt, Rinehart and Winston, Inc. [ Links ]
Borror, D. J., Triplehorn, A. & Johnson, N. F. (1989). An introduction to the study of insects. 6th ed. Orlando, Florida, USA: Harcourt Brace College Publishing. [ Links ]
Camphuysen, C. J. & Webb, A. (1999). Multi-species feeding associations in North Sea seabirds: jointly exploiting a patchy environment. Ardea, 87, 177-198. [ Links ]
Carrascal, L. M. y Tellería, J. L. (1985). Estudio multidimensional del uso de espacio en un grupo de aves insectívoras forestales durante el invierno. Ardeola, 32 (1), 95-113. [ Links ]
Chatellenaz, M. L. (2008). Ecología alimentaria de dos especies simpátricas del género Basileuterus en el Noreste de Argentina. Hornero, 23 (2), 87-93. [ Links ]
Colorado, Z. G. J. (2004). Relación de la morfometría de aves con gremios alimenticios. Boletín SAO, 14 (27), 25-32. [ Links ]
Comstock, J. H. (1918). Outline of laboratory work in the study of the venation of the wings of insects. Ithaca, New York, USA: The Comstock Publishing Company. [ Links ]
Cooper, S. M., Owen-Smith, N. & Bryant, J. P. (1988). Foliage acceptability to browsing ruminants in relation to seasonal changes in the leaf chemistry of woody plants in a South African savanna. Oecologia, 75, 336-442. [ Links ]
Curts, J. (1993). Análisis exploratorio de datos. En P. M. A. Salas y C. O. Trejo (Eds.), Las aves de la Sierra Purépecha del Estado de Michoacán (14 p.). Distrito Federal, México: SARH. [ Links ]
Dalgaard, P. (2006). Repeated measures tools for multivariate linear models: book of abstracts. Vienna, Austria: The R User International. [ Links ]
DeSante, D. F., Saracco, J. F. y Romo, D. Á. C. A. (2004). Instrucciones para el establecimiento y manejo de estaciones de anillamiento de aves del programa MoSI (Monitoreo Sobrevivencia Invernal). Morelos, México: The Institute for Bird Populations y Universidad Autónoma del Estado de Morelos. [ Links ]
Elgar, M. A., Burren, P. J. & Posen, M. (1983). Vigilance and perception of flock size in foraging House Sparrow (Passer domesticus L.). Behaviour, 93, 215-223. [ Links ]
Equihua, M. A. (1989). Estados inmaduros de los insectos. Texcoco, Estado de México: Colegio de Postgraduados. [ Links ]
Errington, P. L. (1930). The pellet analysis method of raptor food habits study. The Condor, 32, 292-296. [ Links ]
Fitzpatrick, J. W. (1981). Search strategies of tyrant flycatchers. Animal Behaviour, 29, 810-821. [ Links ]
Gámez-Virués, S., Ronald, S. B., Geoff, M. G., Cilla, K., Anantanarayanan, R. & Helen, I. N. (2007). Arthropod prey of shelterbelt-associated birds: linking faecal samples with biological control of agricultural pests. Australian Journal of Entomology, 46, 325-331. [ Links ]
Gill, F. B. (1990). Ornithology. New York, USA: W. H. Freeman and Company. [ Links ]
González-Oreja, J. A. (2003). Aplicación de análisis multivariantes al estudio de las relaciones entre las aves y sus hábitats: un ejemplo con Passeriformes montanos no forestales. Ardeola, 50 (1), 47-58. [ Links ]
Greenacre, M. J. (2002). Correspondence analysis of the Spanish National Healt Survey. Gaceta Sanitaria, 16 (2), 160-170. [ Links ]
Greenberg, R. (1990). Ecological plasticity, neophobia, and resource use in birds. Studies in Avian Biology, 13, 29-37. [ Links ]
Greenberg, R., Bichier, P. & Sterling, J. (1997). Acacia, cattle and migratory birds in southeastern Mexico. Biological Conservation, 80, 235-237. [ Links ]
Grigera, D., Úbeda, C. y Calí, S. (1994). Caracterización ecológica de la asamblea de Tetrápodos del Parque y Reserva Nacional Nahuel Huapi. Revista Chilena de Historia Natural, 67, 273-298. [ Links ]
Grubb, T. C. Jr. & Woodrey, M. S. (1990). Sex, age, intraspecific dominance status, and the use of food by birds wintering in temperate-deciduous and cold-coniferous woodlands: a review. Studies in Avian Biology, 13, 270-279. [ Links ]
Guariguata, M. R. & Kattan, G. H. (2002). Ecología y conservación de bosques neotropicales. Cartago, Costa Rica: Ediciones LUR. [ Links ]
Guisan, A. & Zimmermann, N. E. (2000). Predictive habitat distribution models in ecology. Ecological Modelling, 135, 147-186. [ Links ]
Härdle, W. & Simar, L. (2007). Applied multivariate statistical analysis. New York, USA: Springer. [ Links ]
Harrison, N. M., Whitehouse, M. J., Heinemann, D., Prince, P. A., Hunt, G. L. Jr. & Veit, R. R. (1991). Observations of multispecies seabirds flocks around South Georgia. The Auk, 108, 801-810. [ Links ]
Holmes, R. T., Schultz, J. C. & Nothnagle, P. (1979). Bird predation on forest insects: an exclosure experiment. Science, 206, 462-463. [ Links ]
Howe, H. F. (1984). Implications of seed dispersal by animals for tropical reserve management. Biological Conservation, 30, 261-281. [ Links ]
Hutto, R. L., Pleschet, S. M. & Hendricks, P. (1986). A fixed-radius point count method for non-breeding and breeding season use. The Auk, 103, 593-602. [ Links ]
IEEG. (2002). Programa de manejo del Área Natural Protegida Peña Alta. Guanajuato, México: Instituto de Ecología del Estado de Guanajuato (IEEG). [ Links ]
Jackson, J. A. (1971). The evolution, taxonomy, distribution, past populations and current status of the Red-Cockaded Woodpecker. In R. L. Thompson (Ed.), The ecoiogy and management of the Red-Cockaded Woodpecker (pp. 4-29). Florida, USA: Fish and Wildlife Service. [ Links ]
Johnson, M. D. (2000). Evaluation of an arthropod sampling technique for measuring food availability for forest insectivorous birds. Journal of Fieid Ornithology, 71 (1), 88-109. [ Links ]
Jongman, R. H. G., Braak, C. J. F. T. & Tongeren, O. F. R. V. (1995). Data Anaiysis in Community and Landscape Ecoiogy. New York, USA: Cambridge University Press. [ Links ]
Kattan, G. (1988). Food habits and social organization of Acorn Woodpeckers in Colombia. The Condor, 90, 100-106. [ Links ]
Koening, W. D. & Haydock, J. (1999). Oak, acorns, and the geographical ecology of Acorn Woodpeckers. Journai of Biogeography, 26, 159-165. [ Links ]
Koening, W. D., Stacey, P. B., Stanback, M. T. & Mumme, R. L. (1995). Acorn Woodpecker (Meianerpes formicivorous). In A. Poole & F. Gill (Eds.), The birds of North America (pp. 58-68). Washington D. C., USA: The American Ornithologists Union. [ Links ]
Krebs, Ch. J. (1978). Ecoiogy: The experimentaianaiysis of distribution and abundance 2th. New York, USA: Harper and Row Publishers. [ Links ]
Latta, S. C. & Wunderle, J. M. Jr. (1998). The assemblage of birds foraging in Native West Indian Pine (Pinus occidentaiis) forests of the Dominican Republic during nonbreeding season. Biotropica, 30 (4), 645-656. [ Links ]
Lepley, M. (1994). L'étude des pelotes de réjection d'oiseaux insectivores: méthode, limite, et atlas de restes de proies du faucon crécerellette Falco naumanni en Plaine de Crau. Faune de Provence CEEP, 15, 5-15. [ Links ]
Levey, D. J. & Stiles, F. G. (1994). Birds: Ecology, behavior, and taxonomic affinities. In L. A. McDade, K. S. Bawa, H. A. Hespenheide & G. S. Hartshorn (Eds.), The Jungie: Ecoiogy and Naturai History of a Neotropicai Rain Forest (pp. 217-228). Chicago, USA: University of Chicago Press. [ Links ]
López-DeCasenave, J. (2001). Estructura gremial y organización de un ensamblaje de aves dei desierto dei Monte. Trabajo de Grado de Doctorado no publicado. Universidad de Buenos Aires. Argentina. [ Links ]
López-DeCasenave, J., Pellot, J. P., Caziani, S. M., Mermoz, M. & Protomastro, J. (1998). Responses of avian assemblages to a natural edge in a Chaco semiarid forest in Argentina. The Auk, 115 (2), 425-435. [ Links ]
Lovette, I. J. & Holmes, R. T. (1995). Foraging behavior of American Redstarts in breeding and wintering habitats: implications for relative food availability. The Condor, 97, 782-791. [ Links ]
MacArthur, R. H. (1958). Population ecology of some warblers of northeastern coniferous forests. Ecoiogy, 39, 599-619. [ Links ]
Mahon, T. E. (1992). The role of Marbled Murrelets in mixed-species feeding flocks in British Columbia. The Wiison Buiietin, 104, 738-743. [ Links ]
Marini, M. A. & Cavalcanti, R. B. (1993). Habitat and foraging substrate use of three Basileuterus warblers from Central Brazil. Ornitología Neotropicai, 4 (2), 43-57. [ Links ]
McCullagh, P. & Nelder, J. A. (1989). Generalized linear models 2th. London, England: Chapman and Hall. [ Links ]
Medianero, E., Valderrama, A. y Barrios, H. (2003). Diversidad de insectos minadores de hojas y formadores de agallas en el dosel y sotobosque del bosque tropical. Acta Zoológica Mexicana, 89, 153-168. [ Links ]
Microsoft Excel. (2007). Microsoft Excel. New York: Microsoft Office for Windows. [ Links ]
Mikich, S. B. (2002). Fruit consumption by four Woodpecker species (Picidae:Aves) in Semideciduous Seasonal Forest remnants of South Brazil. Arquivos de Ciencias Veterinárias e Zoologia da UNIPAR, 5 (2), 177-186. [ Links ]
Mills, K. L. (1998). Multispecies seabird feeding flocks in the Galápagos Islands. The Condor, 100, 277-285. [ Links ]
Miranda, F. y Hernández-X, E. (1963). Los tipos de vegetación de México y su clasificación. Boletín de la Sociedad Botánica de México, 28, 29-179. [ Links ]
Molinero, L. M. (2003). Análisis de tablas de contingencia de más de dos variables cualitativas. Madrid, España: Sociedad Española de Hipertensión. [ Links ]
Montaldo, N. H. (2005). Aves frugívoras de un relicto de selva subtropical ribereña en Argentina: manipulación de frutos y destino de las semillas. Hornero, 20 (2), 163-172. [ Links ]
Morrison, M. L. & With, K. A. (1987). Interseasonal and intersexual resource partitioning in Hairy and White-headed Woodpeckers. The Auk, 104, 225-233. [ Links ]
Myles, H. & Douglas, A. W. (1973). Nonparametric statistical inference. New York, USA: John Wiley and Sons. [ Links ]
National Geographic Society. (2002). Field guide to the birds of North America 4th. Washington D.C., USA: National Geographic Society. [ Links ]
Naumann, I. D. (1991). The Insects of Australia: A Textbook for Students and Research Workers 2th. Melbourne, Australia: CSIRO Publishing. [ Links ]
Nocedal, J. (1984). Estructura y utilización de las comunidades de pájaros en bosques templados del Valle de México. Acta Zoológica Mexicana, 6, 1-45. [ Links ]
Ostrand, W. D. (1999). Marbled murrelets as initiators of feeding flocks in Prince William Sound, Alaska. Waterbirds, 22, 314-318. [ Links ]
Parker, R. E. (1976). Estadística para biólogos. Barcelona, España: Ediciones Omega S. A. [ Links ]
Patterer, A. N., Beltzer, A. H. & Rossetti, M. A. (2003). Dieta de Melanerpes candidus carpintero blanco (Aves:Picidade) en el Valle de Inundación del Río de Paraná, Argentina. Revista FAVE-Ciencias Veterinarias, 2 (2), 132-139. [ Links ]
Peterson, R. T. y Chalif, E. L. (1989). Aves de México. Guía de campo. México, Distrito Federal: Editorial Diana. [ Links ]
R, (2010). The R foundation for statistical computing R-versión 2.11.0. New York: R Copyright. [ Links ]
Ralph, C. J., Geupel, G. R., Pyle, P., Martín, Th. E., DeSante, D. F. y Milá, B. (1996). Manual de métodos de campo para el monitoreo de aves terrestres. New York, USA: Department of Agriculture and Forest Service. [ Links ]
Ralph, C. P., Nagata, S. E. & Ralph, J. (1985). Analysis of droppings to describe diets of small birds. Journal of Field Ornithology, 56, 165-174. [ Links ]
Rappole, J. H., Winker, K. & Powell, G. V. N. (1998). Migratory bird habitat use in Southern Mexico: Mist nets versus point counts. Journal of Field Ornithology, 69 (4), 635-646. [ Links ]
Recher, H. F. & Majer, J. D. (2006). Effects of bird predation on canopy arthropods in Wandoo Eucalyptus Wandoo Woodland. Austral Ecology, 31, 349-360. [ Links ]
Remsen, J. V. Jr. & Robinson, S. K. (1990). A classification scheme for foraging behavior of birds in terrestrial habitats. Studies in Avian Biology, 13, 144-160. [ Links ]
Reynolds, R. T., Scott, J. M. & Nussbaum, R. A. (1980). A variable circular-plot method for estimating bird numbers. The Condor, 82, 309-313. [ Links ]
Ricklefs, R. E. (1990). Ecology. New York, USA: W. H. Freeman and Company. [ Links ]
Robbins, C. S., Bystrack, D. & Geissler, P. H. (1986). The breeding bird survey: Its first fifteen years 1965-1979. New York, USA: Fish and Wildlife Service. [ Links ]
Robinson, S. K. & Holmes, R. T. (1982). Foraging behavior of forest birds: the relationships among search tactics, diet, and habitat structure. Ecology, 63, 1918-1931. [ Links ]
Root, R. B. (1967). The niche exploitation pattern of the blue-gray gnatcatcher. Ecological Monographs, 37, 317-350. [ Links ]
Rosas-Espinoza, V. C., Maya-Elizarraras, E., Reyna-Bustos, O. F. & Huerta-Martínez, F. M. (2008). Diet of Acorn Woodpeckers at La Primavera Forest, Jalisco, Mexico. The Wilson Journal of Ornithology, 120 (3), 494-498. [ Links ]
Rosenberg, K. V. & Cooper, R. J. 1990. Quantification of diets approaches to avian diet analysis. Studies in Avian Biology, 13, 80-90. [ Links ]
Rzedowski, J. (1978). Vegetación de México. México, Distrito Federal: Editorial Limusa. [ Links ]
Scortecci, G. (1969). Los animales como son, donde viven y como viven?. Vol. III. Barcelona, España: Vergara. [ Links ]
Short, L. L. (1980). Woodpeckers of the world. The Bulletin of the American Museum of Natural History, 4, 1-664. [ Links ]
Short, L. L. (1985). Neotropical-Afrotropical Barbet and Woodpecker radiations: a comparison. Ornithological Monographs, 36, 559-574. [ Links ]
Short, L. L. Jr. (1971). The systematics and behavior of some North American Woodpeckers, genus Picoides (Birds). The Bulletin of the American Museum of Natural History, 149, 1-118. [ Links ]
Sick, H. (1985). Ornitología brasileira: Uma introducáo. Vol. 1. Brasilia, Brasil: Universidad de Brasilia. [ Links ]
Silva, A. & Sherry, T. W. (1992). Surveying wintering warbler populations in Jamaica: point counts with and without broadcast vocalizations. The Condor, 94, 924-936. [ Links ]
Sokal, R. R. & Rohlf, F. J. (1981). Biometry, 2th. New York, USA: W. H. Freeman and Company. [ Links ]
Stacey, P.B. (1981). Foraging behavior of the Acorn Woodpecker in Belize, Central America. The Condor, 83, 336-339. [ Links ]
StatSoft. (2010). Statistica (data analysis software system), Statistica version 9.1. Tulsa, USA: StatSoft. Inc. [ Links ]
Stehr, F. W. (1991). Immature insects. Vol. 2. New York, USA: Kendall, Hunt Publishing Company. [ Links ]
Szaro, R. C.& Jakle, M. D.(1982). Comparison of variable circular-plot and spot-map methods in desert riparian and scrub habitats. The Wilson Bulletin, 94, 546-550. [ Links ]
Tietz, J. R. & Johnson, M. D. (2007). Stopover ecology and habitat selection of juvenile Swainson's Thrushes during fall migration along the Northern California Coast. The Condor, 109 (4), 795-807. [ Links ]
Truett, J., Cornfield, J. & Kannel, W. (1967). A multivariate analysis of the risk of coronary heart disease in Framingham. Journal of Chronic Diseases, 20 (7), 511-524. [ Links ]
Ugalde-Lezama, S., Alcántara-Carbajal, J. L., Valdez-Hernández, J. I., Ramírez-Valverde, G., Velázquez-Mendoza, J., & Tarango-Arámbula, L. A. (2010). Riqueza, abundancia y diversidad de aves en un bosque templado con diferentes condiciones de perturbación. Agrociencia, 44, 159-169. [ Links ]
Ugalde-Lezama, S., Valdez-Hernández, J. I., Ramírez-Valverde, G., Alcántara-Carbajal, J. L. y Velázquez-Mendoza, J. (2009). Distribución vertical de aves en un bosque templado con diferente perturbación. Madera y Bosques, 15 (1), 5-26. [ Links ]
Vigil, C. (1973). Aves Argentinas y Sudamericanas. Buenos Aires, Argentina: Editorial Atlántida. [ Links ]
Wagner, J. L. (1981). Visibility and bias in avian foraging data. The Condor, 83, 263-264. [ Links ]
Whitaker, J. O. Jr. (1988). Food habits analysis of insectivorous bats. In T. H. Kunz, (Ed.), Ecological and behavioral methods for the study of bats (pp. 171-189). Washington D.C., USA: Smithsonian Institution Press. [ Links ]
Wiens, J. A. & Rotenberry, J. T. (1987). Diet relationships among North American grassland and shrubsteppe birds. Oecologia, 42, 253-292. [ Links ]
Winkler, H. & Christie, D. A. (2002). Family Picidae (Woodpeckers). In J. Del Hoyo, A. Elliot and J. Sargatal (Eds.), Handbook of the birds of the world, Vol. 7, Jacamars to Woodpeckers (pp. 296-555). Barcelona, España: Lynx Editions. [ Links ]
Winkler, H. D., Christie, D. A. & Nurney, D. (1995). Woodpeckers, an identification guide to the Woodpeckers of the world. New York, USA: Houghton Mifflin Company. [ Links ]
Wunderle, J. M. Jr. (1994). Métodos para contar aves terrestres del Caribe. Louisiana, USA: U.S. Department of Agriculture, Forest Service. [ Links ]
Wunderle, J. M. Jr. & Latta, S. C. (1998). The assemblage of birds foraging in native west Indian pine (Pinus occidentalis) forests of Dominican Republic during the nonbreeding season. Biotropica, 30 (4), 645-656. [ Links ]
Wurtz, T. L. (1995). Domestic geese: biological weed control in an agricultural setting. Ecological Applications, 5, 570-578. [ Links ]
Zar, J. H. (1999). Biostatistical analysis 4th. New Jersey, USA: Prentice Hall, Inc. [ Links ]
Zocchi, S. S. & Atkinson, A. C. (1999). Optimum Experimental Designs for Multinomial Logistic Models. Biometrics, 55 (2), 437-444. [ Links ]














