Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.17 no.2 Chapingo ago. 2011
https://doi.org/10.5154/r.rchscfa.2010.09.077
Producción de clorofila en Pinus pseudostrobus en etapas juveniles bajo diferentes ambientes de desarrollo
Chlorophyll production in Pinus pseudostrobus juveniles under different development environments
Víctor Hugo Cambrón–Sandoval1¶; María Luisa España–Boquera1; Nahum M. Sánchez–Vargas1; Cuauhtémoc Sáenz–Romero1; J. Jesús Vargas–Hernández2; Yvonne Herrerías–Diego3
1 Instituto de Investigaciones Agropecuarias y Forestales, (IIAF–UMSNH), Morelia, Michoacán, MÉXICO. Correo–e: hugo.cambron@gmail.com (¶Autor para correspondencia), nsanchezv@yahoo.com, csaenzromero@gmail.mx, boquera@zeus.umich.mx.
2 Forestal, Colegio de Postgraduados. Carr. México–Texcoco km 36.5, Montecillo, Estado de México. C. P. 56230. MÉXICO. Correo–e: vargashj@colpos.mx,
3 Facultad de Biología Universidad Michoacana de San Nicolás de Hidalgo (UMSNH) Correo–e: ydiego@oikos.unam.mx.
Recibido: 14 de septiembre, 2010
Aceptado: 24 de enero, 2011
RESUMEN
Limitar la cantidad de radiación reduce la actividad fotosintética, causando estrés y alteraciones morfológicas y fisiológicas en el desarrollo de las plantas. El presente estudio analizó el efecto del estrés causado por dos niveles de competencia en familias de medios hermanos de Pinus pseudostrobus Lindl. Alta competencia inter–familiar (ambiente II) y alta competencia intra–familiar (ambiente III), comparado con un ambiente de baja competencia (I). Se cuantificó el contenido de clorofila total, a, b y la relación entre clorofilas a/b, como una indicación del nivel de estrés, en plantas de 10 meses de edad usando el método de Barnes. Las plantas se establecieron en un ensayo de jardín común, con un diseño de parcelas divididas con cuatro bloques y tres plantas por parcela. En la condición I, la clorofila total fue significativamente mayor (P<0.05); no observándose diferencias entre las otras condiciones (P>0.05). Un análisis separado de las clorofilas mostró menor contenido de clorofila a en plantas rodeadas de individuos genéticamente similares (ambiente III), que cuando fueron diferentes (ambiente II); al contrario, la clorofila b fue mayor en individuos genéticamente similares (ambiente III). En conclusión, la competencia intra–familiar fue mayor que la inter–familiar, suponiendo un mayor nivel de estrés.
Palabras clave: Clorofila total, clorofila a, clorofila b, clorofila a/b, competencia, densidad.
ABSTRACT
Limiting the amount of sun radiation reduces photosynthetic activity, causing stress and morphological and/or physiological changes in plant development. This study analyzed the stress effect caused by two levels of competition in Pinus pseudostrobus Lindl half–sib families: high inter–family (environment II) and high intra–family (environment III) competition, compared with a low level of competition (environment I). Total chlorophyll, chlorophyll–a, and chlorophyll–b content, plus the chlorophyll a/b ratio, were quantified as an indicator of stress level in 10–month–old plants using the Barnes method. Plants were established in a common garden test under a split–plot design with four replications and three individuals per plot. Total chlorophyll was significantly higher (P<0.05) in environment I; no differences (P>0.05) were observed between the other competition environments. A separate analysis of chlorophylls showed lower chlorophyll–a content in plants surrounded by genetically–similar plants (environment III) as opposed to genetically–different ones (environment II); conversely, chlorophyll–b content was higher in genetically–similar plants (environment III). In conclusion, intra–genotypic competition was generally stronger than inter–genotypic competition, under high levels of stress.
Key words: Half–sib families; total chlorophyll, a chlorophyll, b chlorophyll, a/b chlorophyll, competition environment.
INTRODUCCIÓN
El Pinus pseudostrobus Lindl., es una de las especies forestales de mayor importancia en México. Debido a sus cualidades forestales, ha sido establecida con éxito fuera de su distribución natural en: Brasil (Ferreira et al., 1972), Sudáfrica, Colombia y Venezuela (Wright y Wessels, 1992), lo que la ha llevado a desarrollar plasticidad para ser competitiva en los nuevos ambientes. La tolerancia a la competencia es la habilidad de las plántulas para sobrevivir y crecer en presencia de otras, las cuales también buscan los mismos recursos, como luz, agua y nutrientes (Noland et al., 2001).
Las plantas tienden a responder de forma morfológica y fisiológica a las condiciones ambientales en las que se desarrollan (Townsend y Hanover, 1972), modificando la velocidad de crecimiento, la producción de estructuras secundarias y la cantidad de pigmentos entre otras características. La clorofila, responsable de la fotosíntesis en que la energía lumínica es transformada en energía química por plantas, algas y algunas bacterias (Vermaas, 1998), se considera una medida indirecta del estado nutricional de la planta, que por la estrecha relación con el nitrógeno total de las hojas, se ha utilizado como un buen estimador de la condición del dosel en bosques de coníferas (Zarco–Tejada et al., 2004).
Los factores exógenos importantes para que se lleve a cabo la transformación lumínica son: energía radiante, humedad, temperatura y estrés hídrico (Kaufmann y Linder, 1996). Las plantas sometidas a cualquier tipo de estrés tienden a perder capacidad fotosintética y disminuir el contenido de clorofila de sus hojas (Carter y Knapp, 2001). En hojas jóvenes de pino bajo condiciones de competencia, disminuye el Ca+ y la clorofila total (Carter et al., 1989), esto manifiesta la habilidad de las especies para adaptarse morfológica o fisiológicamente, para capturar y utilizar eficazmente, la escasa luz disponible.
La clorofila total es la suma de las clorofilas a y b. La clorofila a, es el pigmento principal, que transforma la energía lumínica en energía química, la cual se utiliza en el crecimiento de las plantas, por lo que se considera un pigmento activo. Por su parte, la clorofila b absorbe la luz en longitudes de onda diferentes que la clorofila a; la luz se transfiere después a la clorofila a, que la transforma en energía; por esto, a la clorofila b se le considera un pigmento accesorio y forma parte de las antenas colectoras (García–Breijo et al., 2006). La disminución en la intensidad de la luz reduce la actividad fotosintética y la concentración de clorofila b tiende a ser mayor, afectando la relación de clorofilas a/b dentro de la planta (Shafiqur et al., 2000). Una reducción en el espacio de crecimiento, tendría como efecto una disminución en la cantidad de luz, creando diferencias en el desarrollo de los individuos cuando se modifica la densidad de plantación, aunado a esto el comportamiento de los individuos suele ser distinto cuando crecen junto a individuos de diferente genotipo (competencia inter–familiar), que cuando lo hacen junto a individuos de su propio genotipo (competencia intra–familiar), (Adams et al., 1973). En este contexto, en el presente estudio se comparó el efecto de la competencia intra– e inter–familiar, en los niveles de estrés, tomando como indicador la variación en el contenido de clorofila total, clorofilas a y b, y la relación entre clorofilas a/b, en familias de medios hermanos de P. pseudostrobus, en un ensayo de jardín común.
MATERIALES Y MÉTODOS
Establecimiento del ensayo
Se utilizaron semillas de P. pseudostrobus de 13 árboles madre (familias), en lotes individuales, identificados por separado durante el estudio, que fueron recolectados en bosques naturales de la Comunidad Indígena de Nuevo San Juan Parangaricutiro, Michoacán, México, entre los 2,100 y los 2,800 m de altura. Las semillas germinaron en condiciones de laboratorio y posteriormente se trasplantaron a contenedores rígidos Copperblocks de 220 cm3 de capacidad, en donde crecieron por tres meses. Después, las plántulas fueron establecidas en un ensayo de jardín común, que consistió en un cajón rectangular de 15.0 m de largo x 1.2 m de ancho x 0.6 m de alto; llenado con capas de 20 cm de espuma volcánica gruesa, 5 cm de tezontle, 10 cm de tierra de encinar y 20 cm de turba de musgo sphagnum, perlita expandida y vermiculita en proporción de 2:1:1 en volumen. El ensayo contaba con un sistema de riego automatizado a través de nebulizadores ubicados cada 1.15 m de distancia a una altura de 1.90 m, con una capacidad de riego de 125 cm3 * minuto. Con periodos de riego de 20 minutos cada tercer día (Sólo en época de estiaje se realizaron riegos diarios).
El ensayo se estableció bajo un diseño de parcelas divididas, con cuatro repeticiones y tres individuos como unidad experimental; las parcelas grandes fueron las condiciones de competencia y las chicas las familias. Se probaron tres condiciones: I) baja competencia inter–familiar, con familias mezcladas, plantadas a un espaciamiento de 0.25 m × 0.12 m; esta condición actuó como referencia de no competencia, ya que permitió el libre desarrollo de las plantas en las primeras etapas de crecimiento; II) alta competencia inter–familiar, con familias mezcladas plantadas a 0.12 m × 0.06 m, y III) alta competencia intra–familiar, con familias plantadas en subparcelas unifamiliares a 0.12 m × 0.06 m.
Las condiciones I y II permitieron evaluar el efecto del nivel de competencia asociada a la densidad de plantación y las condiciones II y III el efecto del tipo de interacción genotípica (inter– vs. intra–familiar). Entre cada condición de competencia se utilizaron fajas de protección de un genotipo diferente a los genotipos probados, para evitar un efecto de borde. Se muestrearon tres plantas por parcela para el análisis; en las parcelas de competencia intra–familiar, con 16 plantas, se usaron tres de las plantas centrales rodeadas por individuos de la misma familia, teniendo 117 individuos por unidad experimental y 156 individuos por parcela, haciendo un total de 468 individuos. La cosecha de las muestras biológicas se realizó del 1° al 4 de diciembre del 2008, colectando las muestras de 7 a 9:00 horas a.m. (para evitar los rayos de sol más fuertes). Al momento de la cosecha el desarrollo en altura promedio por condición de competencia de los individuos, fue de 61.84 ± 3.07 cm en la baja competencia inter–familiar (I), 48.58 ± 4.12 cm en la alta competencia inter–familiar (II) y 47.17 ± 3.79 cm en la alta competencia intra–familiar (III).
Variables evaluadas
A los 10 meses de establecido el ensayo, se estimó el contenido de clorofila total, clorofila a, clorofila b y la relación a/b. Se tomó una muestra de hojas de la parte central de cada planta seleccionada, en cantidades de 100 a 120 mg de materia fresca, la cual se sometió a un proceso de extracción de clorofila, en DMSO (Dimetilsulfoxido), según el método de Barnes et al. (1992). Los resultados se expresaron en cantidad de clorofila a, b y total, por unidad de superficie foliar (gm–2).
Análisis de datos
Se realizó un análisis de varianza para determinar las posibles diferencias en contenido de clorofilas en los genotipos, según la condición de competencia (procedimiento MIXED) (SAS, 2006). Para ello se utilizó el siguiente modelo, en el que C se consideró como efecto fijo.

donde: Y..., es el valor observado del l–ésimo individuo en la k–ésima familia, en la j–ésima condición de competencia y en el i–ésimo bloque; j es el valor promedio de la población; es el efecto del i–ésimo bloque; Cj es el efecto fijo de la j–ésima condición de competencia; BCij es el efecto de la interacción del i–ésimo bloque con la j–ésima condición de competencia; Fk es el efecto de la k–ésima familia; CFjk es el efecto de interacción de la j–ésima condición de competencia con la k–ésima familia; BCFijk es la interacción del i–ésimo bloque con la j–ésima condición de competencia y la k–ésima familia y eijkl es el error dentro de parcela.
RESULTADOS Y DISCUSIÓN
Clorofila total
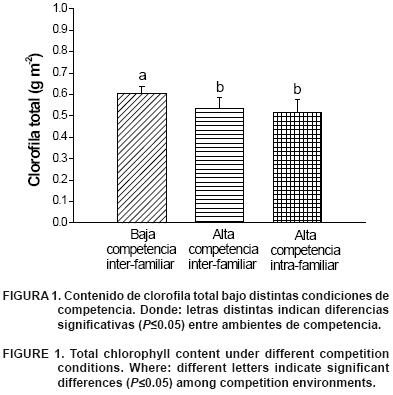
El contenido de clorofila total en Pinus pseudostrobus (Figura 1) se encontró en la amplitud de 42.3 µg·cm–2 y 63.1 µg· cm–2, que corresponde al intervalo superior estimado para Pinus sylvestris, con un contenido entre 26.8 y 56.8 µg· cm–2 (Zarco–Tejada et al., 2004); también se hallaron diferencias significativas en clorofila total entre densidades de plantación (P<0.05) (Figura 1). Ya que el ensayo se estableció en similitud de sustrato y cantidad de agua disponible, la única condición que pudo afectar la cantidad de pigmentos fue el efecto de sombra, como consecuencia de la alta densidad. Estos resultados son similares a los reportados en estudios con palmeras, como Euterpe edulis Mart., en el que se manipuló la intensidad de la radiación lumínica, aduciendo que cuando la cantidad de radiación disminuye, la cantidad de pigmentos también lo hace en forma proporcional (Nakazono et al., 2001) y, como consecuencia, el crecimiento es menor. Dentro de la condición III se presentó una reducción de la cantidad de pigmentos de clorofila total (–1.9 %), con respecto a la condición II; sin embargo, esta diferencia no fue significativa (P>0.05), ya que las condiciones de espacio dentro de cada condición fueron similares.
Clorofila a
Se observaron diferencias significativas (P≤0.05) en la cantidad de clorofila a, entre las condiciones de competencia, tanto por efecto del espaciamiento (condición I vs. II y I vs. III), como por efecto del arreglo de los genotipos (condiciones II vs. III) (Figura 2). La condición I, en la que las plantas crecieron sin competencia y por lo tanto sin estrés, fue la que presentó mayor contenido de clorofila a (Figura 2). Estos resultados son comparables a los obtenidos por Medina–Cano et al. (2006), en estudios realizados con dos variedades de naranjilla (Solanum quitoense Lam.), bajo condiciones de sombreado y exposición solar (como en las condiciones I vs. II y I vs. III), donde observaron que la producción de clorofila a fue mayor en individuos que crecieron en condiciones de mayor cantidad de radiación solar (+67 %), que en aquellos que se desarrollaron bajo sombra. En la condición III el contenido de clorofila a fue menor que en la II (Figura 2). Esto indica que las plantas que crecen en competencia intra–familiar tienen un nivel de estrés superior al de las plantas en competencia inter–familiar.

Clorofila b
El contenido de clorofila b fue similar entre densidades (condiciones I vs. II), pero fue significativamente diferente (P≤0.05) con respecto a la alta competencia intra–familiar (I vs. III y II vs. III) (Figura 3). Este resultado puede ser explicado como una respuesta al estrés debido a la presión de crecer junto a individuos competitivamente similares (condición III), lo cual puede llegar a causar un efecto de estrés más severo que el solo efecto de la sombra (condición II), esto cuando se tienen crecimientos similares, requerimientos de nutrimentos, crecimiento de la raíz, etc. Esta respuesta a la variación de luz mediada por la densidad, coincide con individuos que son sometidos a un fuerte sombreado o un estrés excesivo, produciendo mayor cantidad de clorofila b que aquellos que crecen en condiciones óptimas de luz, como los estudiados por Nakazono et al. (2001).

Relación a/b
La relación entre clorofilas a/b varió según la condición de competencia, encontrándose diferencias significativas (P≤0.05) entre las tres condiciones (Figura 4). Las relaciones fueron de 5.2 a 3.4, valores inferiores a los consignados para acículas jóvenes de Pinus halepensis Mill., por López–Donate et al. (2000) (de 7.8 a 5.9); sin embargo, esta proporción puede variar de acuerdo a la especie, la época del año, la hora y las condiciones climáticas. Evidentemente, la relación entre clorofilas a/b, se deriva de los comportamientos de las clorofilas a y b por separado: el contenido de clorofila a disminuyó de la condición I a la II y de la II a la III, mientras que el de clorofila b aumentó, por lo que la relación a/b disminuyó de la condición I a la II y de la II a la III. El reajuste en la proporción de los contenidos de los dos pigmentos, de acuerdo al nivel de estrés, se puede entender como una respuesta típica de plasticidad fotosintética (Mitchell y Arnott, 1995; Groninger et al., 1996).

Fisiológicamente la plasticidad fotosintética se explica por la activación de los pigmentos accesorios cuando el funcionamiento de los pigmentos activos se ve disminuido, de tal forma que la combinación de ambos facilita la captación de luz y la capacidad fotosintética de la planta en condiciones difíciles. Así, la alta densidad se confirma como una situación de estrés con respecto a un mayor espaciamiento, ya que la baja competencia interfamiliar (condición I) presenta una relación a/b mayor que la alta competencia inter–familiar (condición II) y la alta competencia intra–familiar (condición III). Del mismo modo, la condición III supone una condición de estrés mayor, ya que presenta una relación a/b menor que la condición II. Estudios que nos ayudan a entender la condición de competencia (III) intra–familiar, pueden ser los estudios con clones de Eucalyptus (individuos genéticamente iguales), en los cuales se pudo determinar que bajo condiciones de alta densidad (estrés por reducción de espacio), las parcelas monoclonales son más sensibles que las parcelas de medios hermanos (competencia interfamiliar) en variables como la altura y el diámetro (Bouvet et al., 2005). Este tipo de estrés también es causante de una disminución en la cantidad de pigmentos de clorofila (Carter and Knapp, 2001). Por lo cual en nuestro estudio los individuos que se desarrollaron bajo la condición de competencia III, presentaron niveles de estrés superiores a las condiciones de competencia I y II.
Una forma de visualizar este comportamiento es considerando que en la condición III, todos los individuos de cada subparcela, al ser genéticamente similares, presentaban casi la misma altura total, y las hojas muestreadas también estaban, aproximadamente, a la misma altura. Al ser alta la densidad, se tomaron hojas sombreadas, independientemente del genotipo. Sin embargo, en la condición II, cada individuo estaba rodeado de individuos genéticamente diferentes, y por lo tanto de diferentes alturas, lo que implicó que las hojas muestreadas, en el nivel medio de tallo, estuvieran en algunos casos a la luz (genotipos más altos) y en otros a la sombra. Es decir, mientras que en la condición III todas las plantas estaban estresadas (nivel promedio de estrés alto), en la condición II había plantas con menos estrés (con estrés compensado y en promedio menor).
Un comportamiento similar en la relación entre clorofilas se observó en especies de Euterpe edulis Mart., (palmera) en las que la menor relación a/b se presentó en individuos con mayor estrés, asociado a una disminución en la cantidad de luz (Nakazono et al., 2001).
CONCLUSIONES
De acuerdo a los contenidos de clorofila total, a, b y la relación de clorofilas a/b, fue posible determinar que la condición de competencia III (plantas rodeadas de individuos genéticamente similares), representa un nivel de estrés mayor en comparación con la condición de competencia II (individuos genéticamente diferentes), basándonos en las menores cantidades de pigmentos de clorofila a y una mayor cantidad de clorofila b en individuos que crecieron bajo esta condición de competencia (III).
En general, la competencia intra–familiar representa condiciones de competencia más fuerte que la interfamiliar, suponiendo un mayor nivel de estrés para las plantas con menor cantidad de luz, la cual es bloqueada por individuos contiguos que presentan mejor desarrollo bajo las mismas condiciones de competencia. Sin embargo, sería necesario un estudio más detallado que considere, separadamente, cada genotipo, además de considerar el desarrollo periódico en el crecimiento y la cantidad de radiación dentro de cada condición de competencia.
AGRADECIMENTOS
Este trabajo fue financiado con fondos de la Coordinación de la Investigación Científica (CIC) de la Universidad Michoacana de San Nicolás de Hidalgo y del proyecto de Fondos Mixtos CONACYT–Gobierno del estado de Michoacán clave 63532; y con beca–CONACYT para el primer autor. Agradecemos a Omar Champo Jiménez su apoyo en la realización de las extracciones de clorofila.
LITERATURA CITADA
ADAMS W. T.; ROBERTS, J., H.; ZOBEL, B., J. 1973. Intergenotypic interactions among families of Loblolly Pine (Pinus taeda L.). Theoretical and Applied Genetetic 43: 319–322. [ Links ]
BARNES, J., D.; BALAGUER, L.; MANRIQUE, E.; ELVIRA, S.; DAVISON, W. 1992. A reappraisal of the use of DMSO for the extraction and determination of chlorophylls–a and chlorophylls–b in lichens and higher plants. Environmental and Experimental Botany 32: 85–100. [ Links ]
JEAN–MARC B.; VIGNERON, P.; SAYA, A. 2005. Phenotypic plasticity of growth trajectory and ontogenic allometry in response to density for Eucalyptus hybrid clones and families. Annals of Botany. 96: 811–821. DOI: 10.1093/aob/mci231 [ Links ]
CARTER, G.; KNAPP, A. 2001. Leaf optical properties in higher plants: linking spectral characteristics to stress and chlorophyll concentration. American Journal of Botany 88(4): 677–684. DOI: 10.1111/j.1365–3040.1989.tb01945.x [ Links ]
CARTER, G.; PALIWAL, K.; PATHRE, U.; GREEN, T.; MITCHELL, R; GJERSTAD, D. 1989. Effect of competition and leaf age on visible and infrared reflectance in pine foliage. Plant Cell and Environment 12(3): 309–315. [ Links ]
FERREIRA, M.; MASCARENHAS, SOBRINHO, J. 1972. The introduction of Mexican pines into the region of Poços de Caldas. IPEF Piracicaba 4: 95–109. [ Links ]
GARCÍA–BREIJO F., J.; ROSELLÓ, CASELLES, J; SANTAMARINA–SIURANA, M., P. 2006. Introducción al funcionamiento de las plantas. Editorial: Universidad Politécnica de Valencia. Valencia, España. 181. [ Links ]
GRONINGER, J., W.; SEILER, J., R.; PETERSON, J., A.; KREH, R., E. 1996. Growth and photosynthetic responses of four Virginia piedmont tree species to shade. Tree Physiology 16: 773–778. [ Links ]
KAUFMANN, M., R.; LINDER, S. 1996. Tree physiology research in a changing world. Tree Physiology 16(1/2): 1–4. DOI: 10.1093/ treephys/16.1–2.1 [ Links ]
LÓPEZ–DONATE, J., Á.; OROZCO–BAYO, E.; SÁEZ–MARTÍNEZ, J., J.; MARTÍNEZ–SÁNCHEZ, J., J. 2000. Variaciones morfológicas y bioquímicas en la acículas de Pinus halepensis MilI. Tras someterse a distintas intensidades de poda. Cuadernos de la Sociedad Española de Ciencias Forestales 10: 133–138. [ Links ]
MEDINA–CANO, C., I.; MARTÍNEZ–BUSTAMANTE, E.; LOBO–ARIAS, M.; LÓPEZ–NÚÑEZ, J., C.; RIAÑO–HERRERA, N., M. 2006. Comportamiento bioquímico y del intercambio gaseoso del Lulo (Solanum quitoense Lam.) a plena exposición solar en el bosque húmedo montano bajo del oriente antiqueño Colombiano. Revista Facultad Nacional de Agronomía Medellín 59(1): 3123–3146. [ Links ]
MITCHEL, A., K.; ARNOTT, J., T. 1995. Effects of shade on the morphology and physiology of amabilis fir and western hemlock seedlings. New Forests. 10: 79–98. [ Links ]
NAKAZONO, M., E.; DA COSTA, M., C.; FUTATSUGI, K.; SILVEIRA, P., M. 2001. Crescimento inicial de Euterpe edulis Mart. em diferentes regimes de luz. Revista Brasileira de Botânica 24(2): 173–179. [ Links ]
NOLAND, T., L.; MOHAMMED, G., H.; WAGNER, R., G. 2001. Morphological characteristics associated with tolerance to competition from herbaceous vegetation for seedlings of jack pine, black spruce and white pine. New Forests 21: 199–215. DOI: 10.1023/A:1012091917395 [ Links ]
SAS INSTITUTE, INC. 2006. SAS / STAT Guide for Personal Computers, Version 9.1, Raleigh, North Carolina, USA. 1028 p. [ Links ]
SHAFIQUR, R., K.; ROBIN, R., D.; THOMAS, E., S. 2000. Effects of shade on morphology, chlorophyll concentration and chlorophyll fluorescence of four Pacific Northwest conifer species. New Forests 19: 171–186. DOI: 10.1023/A:1006645632023. [ Links ]
TOWNSEND, A., M.; HANOVER, J., W. 1972. Altitudinal variation in photosynthesis, growth, and monoterpene composition of western white pine (Pinus monticola Dougl.) seedlings. Silvae Genetica 21(3–4): 133–139. [ Links ]
VERMAAS, F., W. 1998. An introduction to photosynthesis and its applications. The World & I 3(1): 158–165. [ Links ]
WRIGTH, J., A.; WESSELS, A. 1992. Laboratory scale pulping of Pinus pseudostrobus, P. maximinoi and P. patula. Instituto de Pesquisas Florestais (IPEF) International, Piracicaba 2: 39–44. [ Links ]
ZARCO–TEJADA, P.; MILLER, J.; HARRON, J.; HU, B.; NOLAND, T.; GOEL, N.; MOHAMMED, G.; SAMPSON, P. 2004. Needle chlorophyll content estimation through model inversion using hyperspectral data from boreal conifer forest canopies. Remote Sensing of Environment 89(2): 189–199. DOI: 10.1016/j.rse.2002.06.002. [ Links ]














