Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.17 no.1 Chapingo ene./abr. 2011
https://doi.org/10.5154/r.rchscfa.2010.02.002
Contenido y traslocación de plomo en avena ( Avena sativa , L.) y haba ( Vicia faba , L.) de un suelo contaminado
Lead content and translocation in oats ( Avena Sativa , L.) and broad bean ( Vicia faba , L.) in contaminated soil
Elizabeth García–Gallegos1,3, Elizabeth Hernández–Acosta2, Edelmira García–Nieto3 y Otilio A. Acevedo–Sandoval1.
1 Universidad Autónoma del Estado de Hidalgo, Centro de Investigaciones Químicas, Ciudad Universitaria, Carretera Pachuca–Tulancingo km 4.5, C. P. 42184 Col. Carboneras Mineral de la Reforma, Hidalgo. México. Correo–e: gallegoseg@hotmail.com.
2 Universidad Autónoma Chapingo km 38.5 Carretera México–Texcoco, C. P. 56230, Chapingo, Estado de México. Correo–e: elizahac@yahoo.com.mx.
3 Universidad Autónoma de Tlaxcala, Centro de Investigación en Genética y Ambiente. Av. Universidad Núm. 1, Col. La Loma Xicohtencatl, Tlaxcala. C. P. 90070.
Recibido: 10 de febrero, 2010
Aceptado: 20 de julio 2010
RESUMEN
Un experimento en invernadero se estableció para determinar la concentración de plomo (Pb) en suelo, raíz y parte aérea de haba y avena; se calculó el factor de bioconcentración y traslocación en las dos especies. Se probaron 50, 100 y 150 mg·Pb·kg–1 de suelo, incluyendo un control. Las plantas se colectaron a los 60 días después de la siembra y se midieron altura de planta (AP), volumen radical (VR) y biomasa seca total (BST), además del contenido de Pb en suelo, raíz y parte aérea. La cuantificación de Pb se realizó por espectrofotometría de absorción atómica. El suelo cultivado con haba presentó un 28.48 % de PbEDTA. Las variables AP, VR y BST no fueron afectadas de manera drástica por las concentraciones de Pb probadas. Las plantas de haba y avena absorbieron un total de 55 mg·kg–1 y 45.3 mg·kg–1, respectivamente, las cuales se consideran tóxicas para plantas cultivadas. Los resultados pueden servir de base para ampliar el conocimiento del contenido de Pb absorbido y traslocado en plantas de haba y avena, ya que la capacidad de tolerar y absorber Pb es específica de la especie, inclusive de la variedad de planta.
Palabras clave: Cultivos, suelo, metales pesados, contaminación.
ABSTRACT
A greenhouse experiment was established to determine the concentration of lead (Pb) in soil, root and aerial part of broad bean and oats. The bioconcentration and translocation factors in the two species were calculated, and 50, 100 and 150 mg·Pb·kg–1 of soil, including a control, were tested. Plants were collected 60 days after sowing and plant height (PH), root volume (RV) and total dry biomass (TDB) were measured, as well as Pb content in soil, root and aerial part. The quantification of Pb was performed by atomic absorption spectrophotometry. The soil cultivated with broad bean presented 28.48 % PbEDTA. The PH, RV and TDB variables were not drastically affected by the Pb concentrations tested. The broad bean and oat plants absorbed a total of 55 mg·kg–1 and 45.3 mg·kg–1, respectively, which are considered toxic concentrations for cultivated plants. The results can serve as a base to expand knowledge of Pb content absorbed and translocated in broad bean and oat plants, as the ability to tolerate and absorb Pb is specific to the species, including the variety of plant.
Key words: Crops, soil, heavy metals, pollution.
INTRODUCCIÓN
El incremento de la población provoca el uso intensivo del suelo para la producción de alimentos, y como resultado aumenta la aplicación de fertilizantes, pesticidas y enmiendas orgánicas con el objeto de mejorar la condición nutrimental del suelo (Bradl, 2005), lo que aunado al uso de aguas de mala calidad y a la actividad industrial aumenta la concentración de metales pesados (Kabata–Pendias y Mukherjee, 2007). Los metales se transfieren del suelo a las plantas, dependiendo de la especiación química, pH del suelo, materia orgánica, capacidad de intercambio catiónico, contenido de arcilla, carbonatos y potencial redox. Entre ellos se encuentran el plomo, arsénico, mercurio, cadmio, cromo, níquel y zinc (Kabala y Singh, 2001; Micó et al., 2006).
El plomo (Pb) es un metal que ha sido empleado desde hace más de 5,000 años para activar la economía de varias industrias, ya que se emplea en la fabricación de baterías, pigmentos y municiones, etc. Es un elemento ampliamente distribuido en los suelos; los minerales con Pb más comunes son la galena (PbS), cerusita (PbCO3) y anglesita (PbSO4). En los suelos agrícolas se pueden presentar niveles de 2 a 300 mg·kg–1 (Bradl, 2005).
Yang et al. (2000) mencionan que los suelos contaminados con Pb pueden causar un decremento en la productividad de los cultivos, ocasionando un serio problema para la agricultura. El incremento significativo en el contenido de Pb en los suelos cultivados se ha observado en la cercanía de las áreas industriales, y aunque no es esencial para las plantas, este elemento se puede absorber y acumular en diferentes partes de las mismas, siendo mayor la concentración en la raíz (Kabata–Pendias y Mukherjee, 2007). Sharma y Shanker (2005) reportan que el contenido de Pb en varios órganos de la planta tiende a decrecer en el siguiente orden: raíz> hoja>tallo>inflorescencia>semilla. Sin embargo, las hojas difieren en su capacidad para acumular Pb; al respecto, Godzik (1993) menciona que el máximo contenido de Pb se localiza en las hojas.
Las plantas expuestas a Pb muestran un considerable decremento en peso seco y una declinación en el contenido de clorofila, y por lo tanto en la actividad fotosintética (Kosobrukhov et al., 2004). Wierzbicka (1998) menciona que el peso seco se ve incrementado en plántulas de maíz debido al aumento de la síntesis de polisacáridos de la pared celular.
El Pb tiene la capacidad de bioacumularse en las plantas y se biomagnifica a lo largo de la cadena alimentaria (Rubio et al., 2004). La absorción del Pb del suelo depende de la especie vegetal, características del suelo y su contenido. Las plantas pueden adoptar distintas estrategias ante la presencia de metales en su entorno. Unas basan su resistencia a los metales a través de una eficiente exclusión del metal, restringiendo su transporte a la parte aérea. Otras prefieren acumular el metal en la parte aérea, en una forma no tóxica para la planta (Llugany et al., 2007).
Existen ciertos factores que permiten conocer la capacidad que tienen las plantas para absorber y traslocar metales del suelo a la parte aérea (Lokeshwari y Chandrappa, 2006). Olivares y Peña (2009) definen al factor de bioconcentración (FB) como el cociente entre la concentración de metales en los órganos aéreos y la del suelo; mientras, el factor de traslocación (FT) es definido como el cociente entre la concentración del metal en los órganos aéreos y raíz (Zhang et al., 2006; Olivares y Peña, 2009).
Por lo anterior, los objetivos del trabajo son: 1) determinar la concentración de Pb en raíz y parte aérea de haba y avena; además de Pb extractable en suelo para calcular la bioconcentración de Pb en las plantas; 2) calcular el factor de traslocación de Pb de la raíz a la parte aérea en las dos especies.
MATERIALES Y MÉTODOS
El estudio se realizó en invernadero con un suelo procedente del municipio de Ixtacuixtla de Mariano Matamoros, estado de Tlaxcala, México, localizado en los 19° 50' N y 98° 21'O. Para el muestreo del suelo se empleó el método de zig zag, como lo establece la NOM–021–SEMARNAT–2000 (DOF, 2002). En el laboratorio el suelo se secó a temperatura ambiente y a la sombra; posteriormente, se tamizó en malla 2 mm con el objeto de homogenizar el tamaño de partícula. Se tomó una muestra para determinarle de acuerdo a la NOM–021: pH (relación 1:2 suelo:agua), conductividad eléctrica (CE) en extracto de saturación, materia orgánica (MO) por el método de Walkley y Black, textura empleando el hidrómetro de Bouyoucos, y la concentración de Pb extractable se determinó por EDTA (ácido dietilentriaminopentacético) al 0.005 M, cuantificado por espectrofotometría de absorción atómica.
El material vegetal utilizado para el experimento fueron semillas de haba y avena procedentes de suelos libres de agroquímicos, localizados en el municipio citado, las cuales fueron lavadas con hipoclorito de sodio al 3 % y 3 enjuagues de agua destilada (Curto et al., 2005).
Se estableció un diseño unifactorial con cuatro tratamientos (50, 100 y 150 mg– kg–1, incluyendo un control) con 10 repeticiones cada uno, lo que dio un total de 40 unidades experimentales por especie. El suelo se mezcló perfectamente con la respectiva concentración de Pb en un recipiente de plástico; como contaminante se utilizó nitrato de plomo Pb(NO3)2. La unidad experimental fue una maceta de plástico de 500 g; las semillas se sembraron de manera directa en el suelo, y durante el crecimiento y desarrollo de las plantas bajo condiciones de invernadero la humedad del suelo se mantuvo constante.
Las plantas se cosecharon a los 60 días y se midió altura de planta (AP) con una regla graduada en centímetros, enseguida se cortó la parte aérea al ras del suelo y con cuidado se extrajo la raíz, la cual se lavó con agua destilada para medir volumen radical (VR) mediante el volumen de agua desplazada en una probeta de 500 y 100 mL para haba y avena, respectivamente (Wu et al., 2005).
Posteriormente se colocaron la parte aérea y la raíz en bolsas de papel para secarlas en horno a una temperatura de 75 °C por 24 horas; al Anal se obtuvo el peso seco en balanza analítica, y para obtener biomasa seca total (BST) se sumaron los pesos secos de raíz y parte aérea (Zhang et al., 2006). Después, las muestras de la parte aérea y raíz de las plantas se molieron en un mortero de ágata y pasaron por un tamiz de malla 2 mm, para luego ser sometidas a una digestión con una mezcla de ácido perclórico y sulfúrico en proporción 1:4 (Alcántar y Sandoval, 1999).
De cada una de las unidades experimentales se tomó una muestra de suelo, la cual se secó y pasó por una malla con abertura de 2 mm para posteriormente determinar la concentración de PbEDTA de acuerdo al procedimiento que establece la NOM–021–SEMARNAT–2000 (DOF, 2002). La cuantificación de PbEDTA en suelo, Pb en raíz y parte aérea (incluyendo tallo y hojas) de haba y avena se cuantificó por espectrofotometría de absorción atómica.
Para el análisis de los datos se utilizó el paquete estadístico Statgraphics versión 4.0, realizando estadística descriptiva de las variables evaluadas, análisis de varianza y una prueba de medias Tukey a un nivel de significancia de 0.05 de probabilidad de error.
Se calculó el factor de bioconcentración de acuerdo a Olivares y Peña (2009) tanto en raíz como en la parte aérea de haba y avena, a través de la siguiente fórmula.
FB = CPb en tejido vegetal (raíz, parte aérea) / CPbEDTA del suelo
Donde:
FB = Factor de bioconcentración
CPb = Concentración de Pb en tejido vegetal
CPbEDTA = Concentración de Pb extractable del suelo
y el factor de traslocación de raíz a la parte aérea de haba y avena de acuerdo a Zhang et al. (2006) y Olivares y Peña (2009) utilizando la siguiente relación.
FT = CPb en parte aérea / CPb en raíz
Donde:
FT = Factor de traslocación
CPb = Concentración de Pb en la parte aérea y raíz
RESULTADOS Y DISCUSIÓN
El suelo previo a contaminarse con Pb presentó un pH de 7.2, 0.54 % de materia orgánica, 0.56 dSm–1 de conductividad eléctrica y predominando la fracción arena con 42 %, seguido de arcilla con un 26 %. El Cuadro 1 presenta las concentraciones de PbEDTA en el suelo, las cuales fueron estadísticamente significativas (P≤0.05) tanto en el suelo cultivado con haba como en el cultivado con avena. El suelo cultivado con haba presentó una mayor concentración de PbEDTA que el suelo procedente de avena. Con 50 mg·kg–1 el suelo de haba tuvo un incremento del 37.41 % de PbEDTA con respecto al suelo cultivado con avena; mientras con 100 mg·kg–1 disminuyó a un 15.66 % y finalmente al contaminar con 150 mg·kg–1 se presentó nuevamente un incremento en un 28.48 %.

Las variables agronómicas AP y VR de haba de acuerdo con el análisis de varianza presentan diferencias estadísticamente significativas (P≤0.05); de acuerdo con la prueba de Tukey (Cuadro 2), los valores de AP fueron diferentes al control con las concentraciones de 50 y 100 mg·kg–1; mientras el VR fue estadísticamente diferente al control en el tratamiento con 100 mg·kg–1. Las concentraciones de Pb utilizadas no impidieron el crecimiento de la planta. En avena los valores de las variables AP, BST y VR mostraron diferencias altamente significativas (P≤0.05) (Cuadro 3), y la prueba Tukey determinó que el suelo con 150 mg·kg–1 es diferente al control en AP y BST. El VR es diferente al control con respecto a los tratamientos con 100 y 150 mg·kg–1. Estas tres variables medidas en avena incrementaron su valor al aumentar la concentración de Pb en el suelo; en cambio, en las plantas de haba los valores prácticamente se mantienen constantes entre los tratamientos y el control.
Al comparar la absorción de Pb en raíz y parte aérea, se observó que en ambos cultivos la raíz fue el órgano que presentó los valores más altos, con diferencias estadísticamente significativas (P≤0.05) entre las dosis probadas, observándose los mayores valores en raíz y parte aérea de las plantas de haba respecto a las plantas de avena; inclusive en el suelo control la raíz de haba presentó un 0.05±0.01 mg kg–1 y la raíz de avena un 0.04±0.01 mg·kg–1 (Cuadro 3).
En el Cuadro 4 se aprecia la existencia de un factor de bioconcentración FB>1 en la parte aérea y raíz de haba y avena cultivados en el suelo control. Sin embargo, al contaminarse con 50, 100 y 150 mg·kg–1 ambos, la parte aérea y raíz de avena y haba presentaron un FB<1.
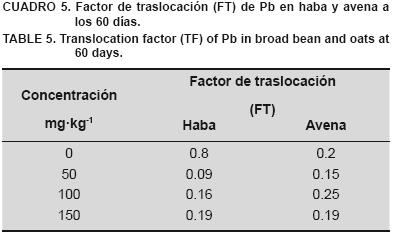
Los valores del factor de traslocación (FT) se reportan en el Cuadro 5. El FT de Pb fue mayor en haba en el suelo sin contaminar; al contaminar con 50 mg·kg–1 las plantas de avena presentaron un FT de 0.15, mientras las de haba 0.09. Con una concentración en el suelo de 100 mg·kg–1 el máximo valor de FT se observó en avena y finalmente con 150 mg·kg–1 el FT disminuyó para las dos especies.
Las concentraciones de Pb en el suelo extraído con DTPA rebasan los límites normales que establece la NOM–021–SEMARNAT–2000 (DOF, 2002); sin embargo, no se considera peligroso, ya que los valores no exceden los 300 mg·kg–1 que marca la norma para el establecimiento de cultivos. El DTPA (ácido dietilentriaminopentacético) tiene como finalidad recuperar elementos metálicos que se encuentran en forma intercambiable o ligados a la materia orgánica, además de disolver formas precipitadas, obteniéndose especies de metales móviles y potencialmente móviles (Podlesáková et al., 2001).
Adicionalmente los autores señalan que al contaminar suelos de manera artificial se pueden comparar los efectos que provocan los metales en las plantas, con aquellas que crecen en suelos no contaminados; una desventaja es el hecho de introducir condiciones de alta movilidad del metal que no existen de manera natural en el suelo, ya que el equilibrio entre el suelo y el metal que se introdujo se alcanzaría en décadas. Lokeshwari y Chandrappa (2006) citan que la absorción de Pb por las plantas es regulada por el pH, tamaño de la partícula y capacidad de intercambio del suelo, así como por la exudación de la raíz y otros parámetros fisicoquímicos del suelo. Aunque la concentración total de Pb en muchos suelos contaminados es alta, la fracción biodisponible (soluble en agua e intercambiable) es usualmente muy baja debido a la fuerte asociación del Pb con la materia orgánica, óxidos de Fe–Mn, contenido de arcilla y fosfatos. En el caso del suelo utilizado para el experimento se presentó un bajo contenido de materia orgánica y una baja proporción de arcilla, además de un pH neutro, lo que ocasiona que existan pocos sitios de intercambio (Kabata–Pendias y Mukherjee, 2007).
Las concentraciones de Pb adicionadas al suelo permitieron que las plantas de haba y avena continuaran su crecimiento y desarrollo. Esto es similar a lo encontrado por Wu et al. (2005), quienes reportaron que Vicia cracca L. crecida en un suelo contaminado con 334±22 mg·kg–1 Pb en el suelo mostró una AP de 79.2±14.6 cm, mientras en el suelo sin contaminar presentó una AP de 80.9±5.9 cm. El contenido de biomasa seca en el suelo contaminado tuvo 10.8±1.7 g y en el suelo sin contaminar 12.6±0.6 g. Los autores concluyen que Vicia cracca puede continuar su crecimiento y desarrollo de manera normal. No obstante, Kosobrukhov et al. (2004) mencionan que puede existir un decremento del peso seco de algunas plantas al aumentar las concentraciones de Pb en el suelo, dependiendo de la especie vegetal y especiación del metal. La planta de haba en este estudio mostró un incremento en AP, BST y VR al aumentar las concentraciones de Pb al suelo.
Hedaya (2008) reporta que al crecer haba en una solución nutritiva con 48 mM Pb se obtuvo un incremento de su peso seco con respecto al control. No es evidente que el Pb sea esencial para el crecimiento de varias especies de plantas, aunque existen reportes sobre el efecto de estimulación de algunas sales de Pb (Pb(NO3)2) a bajas concentraciones sobre el crecimiento de plantas (Kabata–Pendias y Pendias, 2001). Experiencias realizadas por Titov et al. (1996) indicaron que una concentración de Pb igual a 2 mgL–1 provocaba una ligera disminución en el crecimiento de las raíces de cebada; una concentración igual a 20 mgL–1 causaba una reducción severa y ante una concentración de 200 mgL–1 el crecimiento era fuertemente afectado. Sin embargo, los tallos resultaban más resistentes y aún a una concentración de 2 gL–1 el crecimiento no era suprimido.
Díaz et al. (2001) reportaron que en Triticum aestivum bajo condiciones de hidroponía y con 100 mg PbL–1 en la etapa de espigamiento aparecieron franjas cloróticas a lo largo de las hojas, como consecuencia de la disminución del contenido de clorofila y de la deficiencia de micronutrimentos. Por ello concluyen que a concentraciones relativamente elevadas y dependiendo de la etapa de desarrollo, el Pb puede alterar el balance nutrimental y los procesos fisiológicos de la planta, tales como la síntesis de clorofila, fotosíntesis y el crecimiento, dando como consecuencia cambios morfológicos en la planta.
Békésiova et al. (2008) trabajaron con raíz de haba, chícharo, cebada, maíz y soya, las cuales fueron expuestas a diferentes concentraciones de Pb (300 y 500 mgL–1); en cada caso los efectos tóxicos fueron reflejados en el retardo del crecimiento de la raíz al compararlo con el control. La especie más tolerante fue haba y la más sensible cebada. Sin embargo, cereales como trigo, arroz, avena, cebada, maíz y sorgo son plantas que recientemente se han propuesto para ser utilizadas como plantas fitorremediadoras, ya que tienen la capacidad de tolerar altas concentraciones de metales, entre los que se encuentra el Pb (Kabata–Pendias y Mukherjee, 2007).
Los niveles de Pb acumulados en la raíz y parte aérea de haba y avena a los 60 días de crecimiento se incrementaron con las concentraciones de Pb. Los resultados muestran que más Pb fue localizado en la raíz que en la parte aérea. Estos resultados concuerdan con los reportados por Malkowski et al. (2002), quienes señalan que la concentración de Pb es mayor en la raíz de plántulas de maíz al incrementarse las concentraciones de Pb en solución. De la misma manera, Hedaya (2008) determinó una mayor concentración de Pb en la raíz que en hojas de haba, y Wu et al. (2005) reportan, en el mismo sentido, que la raíz de Vicia cracca absorbe una mayor cantidad de Pb en la raíz. Las raíces pueden acumular arriba de 3 a 50 veces más Pb que las hojas (Wozny et al., 1995). Zhang et al. (2006) reportaron que en un suelo contaminado con Pb a una concentración de 388±23 mg·kg–1 la raíz de Vicia faba absorbe una mayor cantidad de Pb 273.1±2 y el tallo 3.3±1.1 mg·kg–1, coincidiendo con los resultados obtenidos en este trabajo.
Las concentraciones probadas en este estudio permitieron que las plantas de haba acumularan en su tejido una concentración total de 55 mg Pbkg–1, y las plantas de avena una cantidad de 45.3 mg·kg–1. Kabata–Pendias y Pendias (2001) consideran que niveles de Pb en las plantas de 30 a 300 mg·kg–1 son tóxicos, y de 5 a 10 mg·kg–1 son niveles normales; por ello, de acuerdo con estos autores, los niveles de Pb encontrados en las plantas de avena y haba, son considerados como niveles tóxicos si se toma en cuenta la planta completa, pero sí se considera sólo la parte aérea los niveles encontrados se encuentran dentro del rango de normales, y en raíz los valores son tóxicos.
Rashed y Awadallah (1998) mencionan que las hojas de haba presentaron 0.1 mg·kg–1 de Pb al realizar un muestreo de plantas en suelos agrícolas cercanos a asentamientos urbanos, concluyendo que los niveles encontrados no son considerados tóxicos para el hombre o animales. Existen valores de referencia para el suelo, pero para especies vegetales pocos países son los que tienen una normatividad para metales pesados; por ejemplo, Noruega ha establecido que cereales y leguminosas deben tener 0.1 mg·kg–1 de tejido vegetal, Australia 2.0 mg·kg–1 tejido vegetal en hortalizas y Reino Unido, 1.0 mg·kg–1 en frutas y hortalizas (Ansorena, 1996). La concentración permitida de Pb en vegetales de hoja en Europa (EC, 2006) es de 0.3 mg·kg–1 peso fresco y 2 mg·kg–1 peso seco. En México, hasta este momento no se tienen límites establecidos.
La bioconcentración de Pb en haba y avena en el suelo control fue > 20 en la parte aérea y raíz; McGrath y Zhao (2003) mencionaron que para una fitoextracción exitosa de metales es necesario alcanzar valores de FB > 20. Sin embargo, aun con valores de FB bajos, las plantas de haba y avena pueden absorber concentraciones mayores de Pb.
Zehra et al. (2009) reportaron que los valores de FB pueden ser mayores en suelos no contaminados que en suelos contaminados dependiendo de la especie de planta, sus exudados, las propiedades fisicoquímicas del suelo, concentración y las formas químicas del contaminante en el suelo. Kabata–Pendias y Pendias (2001) señalan que los exudados de las raíces de las plantas tienden a acidificar el medio, lo que trae como consecuencia una disminución del pH, ocasionando que los metales sean biodisponibles.
La planta de trigo acumula concentraciones de 380 mg·kg–1 de Pb, y el valor de FB generalmente decrece al incrementar la concentración de Pb en el suelo (Wang et al., 2002). En plantas como Silybum marianum y Rumex dentatus los valores de FB respecto al Pb fueron mayores en raíz y tallo, 0.33, 0.149; 0.037, 0.164, respectivamente (Zehra et al., 2009).
En el Cuadro 5 se observa que el factor de traslocación (FT) tanto en la planta de haba como de avena es menor a 1. Al respecto, Baker (1981) señala que un FT por encima de 1 indica que se produce una traslocación de la raíz a la parte aérea, lo cual es característico de las plantas acumuladoras. Mientras, el valor de FT 0.1 señala que existe una exclusión del metal dentro del tejido de la planta (Khan et al., 2009), lo que se observa en haba y avena con las concentraciones de 50, 100 y 150 mg·kg–1; excepto en avena con la concentración de 100 mg·kg–1, la cual presentó un FT de 0.25.
CONCLUSIONES
Las concentraciones de Pb incorporadas al suelo permitieron el crecimiento y desarrollo de las plantas de haba y avena. La raíz de las dos especies fue el órgano que presentó las mayores concentraciones de Pb. Los resultados obtenidos en este trabajo pueden servir de base para ampliar el conocimiento del contenido de Pb absorbido y traslocado en plantas de haba y avena, ya que la capacidad de tolerar y absorber Pb es específica de la especie, inclusive de la variedad de planta.
LITERATURA CITADA
ALCÁNTAR, G. G.; SANDOVAL, M. 1999. Manual de análisis químico de tejido vegetal. Publicación especial 10. Sociedad Mexicana de la Ciencia del Suelo, A.C. Chapingo, México. 156 p. [ Links ]
ANSORENA, M. J. 1996. La contaminación del suelo. Sustra 40 (1): 1 – 49. [ Links ]
BAKER, A. J. M. 1981. Acumulators and excluders strategies in the response of plants to heavy metals. Journal of Plant Nutrition. 3: 643–654 [ Links ]
BÉKÉSIOVÁ, B.; HRASKA, S.; LIBANTOVÁ, J; MORAVCIKOVÁ, J.; MATUSIKOVÁ I. 2008. Heavy–metal stress induced accumulation of chitinase isoforms in plants. Mol. Biol. Rep. 35: 579–588. [ Links ]
BRADL, H. B. 2005. Heavy metals in the environment. Elsevier Academic Press, Netherlands. 283 p. [ Links ]
CURTO, L. L.; GUZMÁN, M. J.; SÁNCHEZ, G. M. 2005. Técnicas para el desarrollo en angiospermas. 2ª. edición. Coordinación de servicios editoriales. Facultad de Ciencias, Universidad Nacional Autónoma de México (UNAM). 178 p. [ Links ]
DIARIO OFICIAL DE LA FEDERACIÓN (DOF). 2002. NOM–021–RECNAT–2000. Norma Oficial Mexicana Que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreos y análisis. 31 de diciembre 2002. 85 p. [ Links ]
DÍAZ, A. I.; LARQUÉ, A. U.; ALCÁNTAR, G.; CARRILLO, R.; VÁZQUEZ, A. 2001. Alteración de algunos procesos fisiológicos en trigo por la adición de plomo. Rev. Int. Contam. Ambient. 17: 79–90. [ Links ]
EUROPEAN COMMISSION (E. C.). 2006. Setting maximum levels for certain contaminants in foodstuffs. European Commission. Regulation No. 1881/2006. 364: 19–20. [ Links ]
GODZIK, B. 1993. Heavy metal contents in plants from zinc dumps and reference area. Pol. Bot. Stud. 5: 113–132. [ Links ]
HEDAYA, A. K. 2008. Lead accumulation and its effect on photosynthesis and free amino acids in Vicia faba grown hydroponically. Australian J. Basic Appl. Sci. 2 (3): 438–446. [ Links ]
KABALA, C.; SINGH, B. R. 2001. Fractionation and mobility of copper, lead and zinc in soil profiles in the vicinity of a copper smelter. J. Environ. Qual. 30: 485–492. [ Links ]
KABATA–PENDIAS, A.; PENDIAS, H. 2001. Trace elements in soils and plants. Third edition. C.R.C. Press Boca Raton Florida, USA. 413 p. [ Links ]
KABATA–PENDIAS A.; MUKHERJEE, A. B. 2007. Trace elements from soil to human. Springer Berlin. 561 p. [ Links ]
KHAN, S.; FAROOQ, R.; SHAHBAZ, S.; KHAN, A. M.; SADIQUE, M. 2009. Health risk assessment of heavy metals for population via consumption of vegetables. World App. Sci. J. 6: 1602–1606. [ Links ]
KOSOBRUKHOV, A.; KNYAZEVA, I.; MUDRIK, V. 2004. Plantago major plants responses to increase content of lead in soil: growth and photosynthesis. Plant Grow. Regul. 42: 145–151. [ Links ]
LLUGANY, M.; TOLRÁ, R.; POSCHNRIEDER, C.; BARCELÓ, J. 2007. Hiperacumulación de metales: ¿una ventaja para la planta y para el hombre? Ecosistemas 16(2): 1–7. [ Links ]
LOKESHWARI, H.; CHANDRAPPA, G. T. 2006. Impact of heavy metal contamination of Bellandur Lake on soil and cultivated vegetation. Current Sci. 91(5): 622–627. [ Links ]
MALKOWSKI, E.; KITA, A.; GALAS, W.; KAREZ, W.; KUPERBERG, M. 2002. Lead distribution in corn seedling (Zea mays L.) and its effect on growth and the concentrations of potassium and calcium. Plant and Soil. 37: 69–79. [ Links ]
McGRATH, S. P.; ZHAO, F. J. 2003. Phytoextraction of metals and metalloids from contaminated soils. Curr. Opin. Biotechnol. 14: 277–282. [ Links ]
MICÓ, C.; RECATALÁ, L.; PERIS, M.; SÁNCHEZ, J. 2006. Assessing heavy metal sources in agricultural soils of an European Mediterranean area by multivariate analysis. Chemosphere 65: 863–872. [ Links ]
OLIVARES, E.; PEÑA E. 2009. Bioconcentración de elementos minerales en Amaranthus dubius (bledo, pira), creciendo silvestre en cultivos del estado miranda, Venezuela, y utilizado en alimentación. Interciencia. 34: 604–611. [ Links ]
PODLESÁKOVÁ, E.; NEMECEK, J.; VÁCHA, R. 2001. Mobility and bioavailability of trace elements in soils. In: ISKANDAR, I.K. and KIRKHAM, M.B (editors). 2001. Trace elements in soil. Bioavailability, flux and transfer. Lewis Publishers. United States of America. 286 p. [ Links ]
RASHED, M. N.; AWADALLAH, R. M. 1998. Trace elements in faba bean (Vicia faba L.) plant and soil as determined by atomic absorption spectroscopy and ion selective electrode. J. Sci. Food. Agric. 77: 18–24. [ Links ]
RUBIO, C.; GUTIÉRREZ, A. J.; MARTÍN–IZQUIERDO, R. E.; REVERT, C.; LOZANO, G.; HARDISSON, A. 2004. El plomo como contaminante alimentario. Rev. Toxicol. 21: 72–80. [ Links ]
SHARMA, P.; SHANKER, R. 2005. Lead toxicity in plants. Braz. J. Plant. Physiol. 17(1): 35–52. [ Links ]
TITOV, A. F.; TALANOVA, V. V.; BOEVA, N. P. 1996. Growth responses of barley and wheat seedlings to lead and cadmium. Biol. Plant. 38(3): 431–436. [ Links ]
WANG, R. Q.; LIU, M. X.; CUI, S. Y.; DONG, T. Y.; CHRISTIE P. 2002. Responses of legume and non–legume crop species to heavy metals in soils with multiple metal contamination. J. Environ. Sci. Health. A. 37: 611–621. [ Links ]
WIERZBICKA, M. 1998. Lead in the apoplast of Allium cepa L. root tips–ultra structural studies. Plant Sci. 133: 105–119. [ Links ]
WOZNY, A.; SCHNEIDER, J.; GWOZDZ, E. A. 1995. The effects of lead and kinetin on greening barley leaves. Biol. Plant. 37: 541–552. [ Links ]
WU, C.; CHEN, X.; JIANJUN, T. 2005. Lead accumulation in weed communities with various species. Comm. Soil Sci. Plant Anal. 36: 1891–1902. [ Links ]
YANG Y–Y.; JUNG, J.; SONG, W.; SUH, H.; LEE, Y. 2000. Identification of rice varieties with high tolerance or sensitivity to lead and characterization of the mechanism of tolerance. Plant Physiol. 124:1019–1026. [ Links ]
ZHANG, X.H.; LIN, A. J.; CHEN, B. D.; WANG, Y. S.; SMITH, S. E.; SMITH, F. A. 2006. Effects of Glomus mosseae on the toxicity of heavy metals to Vicia faba. J. Environ. Sci. 18: 721–726. [ Links ]
ZEHRA, S. A.; ARSHAD, M.; MAHMOOD, T.; WAHEED, A. 2009. Assessment of heavy metal accumulation and their translocation in plant species. African J. Biotechnology. 8: 2802 – 2810. [ Links ]














