Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.14 no.2 Chapingo jul./dic. 2008
Evaluación del estrato arbóreo en un área restaurada post–incendio en el parque ecológico Chipinque, México
Evaluation of arboreal stratum in a recovered area post–fire in the Chipinque ecological park, Mexico.
E. Alanís–Rodríguez1; J. Jiménez–Pérez2; D. Espinoza–Vizcarra3; E. Jurado–Ybarra2; Oscar A. Aguirre–Calderón2; Marco A. González–Tagle2
1 Departamento de Investigación y Manejo de Recursos Naturales del Parque Ecológico Chipinque, A. C., Correo–e: ealanis@chipinque.org.mx
2 Facultad de Ciencias Forestales de la Universidad Autónoma de Nuevo León. Nuevo León, Monterrey
3 Escuela de Biología de la Benemérita Universidad Autónoma de Puebla. Puebla, Pue.
Recibido: 21 de mayo, 2008
Aceptado: 5 de agosto, 2008
RESUMEN
Las prácticas de restauración ecológica realizadas después de los incendios forestales en los bosques mixtos de pino encino del Parque Ecológico Chipinque (PECh), México, han sido escasamente monitoreadas, y se desconoce su efectividad. Para ello, se evaluó en el 2007 el estrato arbóreo de áreas restauradas y no restauradas del incendio suscitado en 1998 y se compararon con un ecosistema maduro de referencia. Los resultados mostraron diferencias significativas en términos de diversidad–abundancia con base en el método de t de Hutcheson (P ≤ 0.05) en los tres sitios muestreados, de lo que se deriva que los incendios forestales y prácticas de restauración ejercidos en estas áreas modifican la diversidad y abundancia de las especies arbóreas y arbustivas presentes. Se registró un total de 11 especies arbóreas y arbustivas pertenecientes a siete familias, siendo la más importante la Fagaceae, con cuatro especies (Quercus rysophylla, Q. canbyi, Q. laeta y Q. laceyi), ya que este grupo se ve favorecido con los incendios forestales superficiales, debido a la capacidad de rebrote que es estimulado ante los efectos del aumento de la temperatura del suelo causada por el fuego.
Palabras clave: restauración ecológica, diversidad.
ABSTRACT
Restoration ecology practices undertaken after forest fires in a Pine–Oak forest at Parque Ecologico Chipinque, have been poorly monitored, and its efficiency is unknown. In 2007 the arboreal stratum of restored and not restored areas that were burnt in wildfires of 1998 was compared with a mature ecosystem of reference. The results showed significant differences in terms of diversity–abundance (t of Hutcheson (P ≤ 0.05) in the three sample plots. This implies that forest fires and restoration practices made in these areas modified diversity and abundance of shrub and tree species. A total of 11 shrub and tree species belonging to 7 families was registered. Quercus (Fagaceae), with four species (Quercus rysophylla, Q. canbyi, Q. laeta and Q. laceyi), was the most common genus, perhaps because it was favoured with superficial forest fires, due to its ability to resprout after fire.
Key words: restoration ecology, diversity.
INTRODUCCIÓN
Los disturbios son eventos discretos en el tiempo, que modifican la estructura de un ecosistema, comunidad o población y cambian el ambiente físico, sustrato o la disponibilidad de recursos (Corral et al., 2002; Caribello, 2003). Su constante presencia a lo largo del tiempo contribuye a la gran pérdida de biodiversidad de los ecosistemas forestales (Lindenmayer et al., 2000). El deterioro de éstos se acentúa por diversos factores, que inciden en su degradación y deforestación, siendo los incendios uno de los disturbios más importantes (González et al., 2005). En 1997 y 1998 se presentó una alta incidencia de incendios forestales en el mundo, en México se quemaron 585,000 ha (CONAFOR, 2007), incluyendo zonas de conservación como el Parque Ecológico Chipinque (PECh) en Nuevo León, en este parque se quemaron 500 ha, de las cuales 100 se clasificaron con daño de severidad alta, ya que perdieron totalmente la cubierta vegetal dejando el suelo desnudo y expuesto a la erosión (García, 2000).
Para la recuperación de las áreas afectadas se recurrió a la restauración ecológica (Mayer, 2006), la cual se define como el conjunto de acciones con una visión a largo plazo, mediante el cual se asiste, facilita o simula la sucesión natural (Keith, 2004; Ruiz y Mitchell, 2005; Cipollini et al., 2005) obteniendo más rápidamente la estructura y función del ecosistema (Barrera y Ríos, 2002), y la biomasa, complejidad y determinación (Figura 1) de las interacciones entre los organismos (Caribello, 2003; Chauhan, 2005).

En el PECh se estableció un plan de acción, definido por un grupo multidisciplinario de expertos, donde se presicaron las siguientes cuatro fases: delimitación de áreas afectadas, clasificación de afectación, técnicas de rehabilitación y monitoreo (García, 2000). Parte fundamental del plan de acción es el monitoreo del ecosistema, el cual es un registro ordenado de datos, que fungen como una herramienta para la evaluación periódica y continua, reflejando el desempeño de los diferentes componentes del proyecto a lo largo del tiempo y permite juzgar la pertinencia de los sistemas aplicados y propone esquemas alternativos para lograr los objetivos planteados hacia la condición de ecosistemas de referencia establecidos (Keith, 2004). Sin embargo, a la fecha existen escasos estudios relacionados con el monitoreo del ecosistema. La hipótesis es que las comunidades impactadas por el incendio forestal con restauración y sin restauración no presentarán diferencia significativa en la riqueza y diversidad de especies arbóreas y arbustivas.
Los objetivos de la presente investigación son evaluar la condición post–incendio de especies arbóreas y arbustivas en áreas con y sin restauración en un ecosistema de bosque mixto, estimando indicadores ecológicos y la diversidad alfa y beta de las comunidades. Con ello se contribuye al entendimiento que tienen las especies que conforman esta comunidad en las diferentes etapas sucesionales y se estima la diversidad en ecosistemas restaurados.
MATERIAL Y MÉTODOS
El estudio se realizó dentro del Parque Ecológico Chipinque (Figura 2) el cual forma parte del Área Natural Protegida (ANP) Parque Nacional Cumbres de Monterrey (PNCM). El PECh posee una extensión de 1,815,89 ha, localizadas en los municipios de San Pedro Garza García y Monterrey, Nuevo León, presentando alturas que varían de los 740 a los 2,200 m. situándose entre las coordenadas geográficas 100°18' y 100°24' de longitud oeste y los 25°33' y 25°35' de latitud norte (Parque Ecológico Chipinque, 2007).

Para lograr los objetivos trazados en esta investigación, en el 2007 se evaluó una zona impactada por un incendio forestal ocurrido en abril de 1998, el incendio fue superficial y de copa y duró seis días impactando significativamente los elementos vegetales. Como estrategia evolutiva el Pinus pseudostrobus tiende a resistir los incendios (Rodríguez y Fulé, 2003), pero debido a la intensidad y duración del incendio hubo escasa sobrevivencia. En cambio las especies del género Quercus tienen como estrategia evolutiva la capacidad de rebrotar (Zavala, 2001); García (2000) desarrolló un estudio en el área donde cuantificó que la mayoría de los ejemplares presentó de 4 a 8 rebrotes, llegando a presentar hasta 36.
En el año 2007, nueve años después del incendio forestal, se muestrearon comunidades vegetales en las áreas impactadas, una restaurada y otra sin restaurar. Ambas áreas tenían la misma composición vegetal previa al incendio y presentan condiciones ecológicas similares (ecosistema mixto de pino–encino, altitud entre los 1,100 y 1,250 m, suelo litosol, exposición oeste). La única diferencia fue que en un área se llevó a cabo la sucesión natural sin intervención antropogénica y en la otra área se implementó un programa de restauración ecológica donde se realizaron prácticas silvícolas para favorecer la sucesión natural, colocando barreras naturales en 1998 (material arbóreo incendiado colocado de forma perpendicular a la pendiente, el cual sirvió de forma natural para la acumulación de suelo de arrastre) se plantaron 2,000 ind·ha–1 de P. pseudostrobus de 15 cm de altura procedentes del vivero de la Facultad de Ciencias Forestales de la UANL (Iturbide N. L.) en septiembre (época de mayor precipitación) y se podaron los rebrotes de encino una vez al año durante los próximos seis años (1998–2003) dejando únicamente el que presentaba las mejores características fenotípicas (García, 2000) para disminuir la cobertura foliar y favorecer el crecimiento del P. pseudostrobus ya que es una especie heliófita (González et al., 2008).
Dada la alta densidad de individuos se establecieron sitios de 100 m2 (Alanís et al., 2008) con una equidistancia de 20 metros para evitar variaciones edáficas y, altitudinales, después se elaboró una curva especie–área (Mostacedo y Fredericksen, 2000) para cada comunidad (Figura 3) con la finalidad de estimar el número mínimo de sitios necesarios con los que se obtiene información representativa de la diversidad de especies. Para cotejar los resultados de las áreas impactadas por el incendio se evaluó un ecosistema maduro de referencia, eligiendo un bosque contiguo al área incendiada, que según González et al. (2008) fue impactado por un incendio en 1868 y se establecieron cinco parcelas de 375 m2. En total se realizaron cinco sitios por comunidad.

En las tres áreas se obtuvieron los parámetros dasométricos de altura total (h) y diámetro (d0.30) de especies arbóreas y arbustivas con un diámetro mayor a 1.5 cm para tener mayor representación.
En cada comunidad se evaluaron los siguientes índices de diversidad (Magurran, 2004):
Indicadores ecológicos
Para determinar el valor ecológico de las especies se utilizó el Índice de valor de Importancia (I.V.I.) (Grela, 2003; Caranqui, 2006; Isango, 2007), el cual se define como [1]:

Donde Ai es la abundancia relativa, Di es la dominancia relativa y Fi la frecuencia relativa.
Diversidad Alfa
La diversidad Alfa es la riqueza de especies de una comunidad que se considera homogénea (Smith y Smith, 2000; McCune y Grace, 2002), para su estimación se utilizaron los índices de Margalef y Menhinick junto con el índice de diversidad de especies de Shannon & Weiner. El índice de diversidad de Margalef [2] (Clifford y Stephenson, 1975) se estimó con la ecuación:

y el de Menhinick [3] (Whittaker, 1977) con:

Donde s es el número de especies y N es el número total de individuos. El índice de diversidad de Shannon & Weiner (Shannon, 1948; Whittaker, 1977) se estimó mediante la ecuación [4].

Donde S es el número de especies presentes, ln es logaritmo natural y pi es la proporción de las especies pi = ni / N; ni es el número de individuos de la especie i y N es el número total de individuos.
La prueba de hipótesis sobre la similitud o diferencia en la diversidad–abundancia entre los sitios muestreados se calculó con base en el método de t de Hutcheson (Magurran 1988) dada por la ecuación [5] y con los grados de libertad estimados por la ecuación [6].

Donde: Hi = índice de Shannon del área i; Var Hi = varianza del índice de Shannon del área i. Ni = número total de individuos en i–esíma área.
La varianza se estimó a partir de la ecuación [7]

Donde S = total de especies del área i; pi = proporción de la especie i n el área i.
El índice de diversidad de Simpson (Simpson, 1949) se estimó con la fórmula [8]:

Donde pi es la proporción de individuos de la i–ésima especie. Este índice varía inversamente con la heterogeneidad.
Diversidad Beta
La diversidad Beta o diversidad entre hábitats es el grado de reemplazo de especies (diversidad entre comunidades), pudiéndose evaluar con base en índices o coeficientes de similitud/disimilitud a partir de datos cuantitativos, como el de Morisita Horn que se expresa mediante la ecuación [9] (Moreno, 2001; Magurran, 2004).

Donde: ani = número de individuos de la i–esíma especie en el sitio A; bnj = número de individuos de la j–esíma especie en el sitio B, y da y db se describen a continuación:

RESULTADOS YDISCUSIÓN
El ecosistema restaurado presentó seis especies, el no restaurado 10 y el de referencia siete. En total se registraron 11 especies arbóreas y arbustivas pertenecientes a siete familias, siendo la más importante la Fagaceae, con cuatro especies (Quercus rysophylla, Q. canbyi, Q. laeta y Q. laceyi), ya que este grupo se ve favorecido con los incendios forestales superficiales, debido a la capacidad de rebrotar que se estimula ante los efectos del aumento de la temperatura del suelo causada por el fuego (Zavala, 2000; González et al., 2007).
Indicadores ecológicos
Área no restaurada
La Cuadro 1 muestra los datos de la comunidad no restaurada, Quercus rysophylla presenta un 39.15 % del total de individuos de esta zona, abarcando un 32.05 % del total del área basal. Las tres especies con mayor peso ecológico fueron pertenecientes al género Quercus, sumando 192.57 % de valor de importancia. Seguido de estas especies se encuentra el Pinus pseudostrobus teniendo escasa abundancia (Ar = 2.12) pero gran dominancia (Dr = 31.22), debido a que en esta zona sobrevivieron escasos ejemplares adultos.

Área restaurada
En el Cuadro 2 se muestran los valores relativos de abundancia (N/ha), dominancia (G= m2·ha–1), frecuencia y valor de importancia de las especies arbóreas y arbustivas de esta zona, teniendo nuevamente a Q. rysophylla en primer lugar con 117.04 % del total del IVI, debido a que presentó los valores más altos de las tres observaciones ecológicas. La segunda especie con mayor peso ecológico es P pseudostrobus (IVI= 56.80) la cual presenta una alta abundancia (Ar=26.07) pero baja dominancia (Dr=12.21) debido a que esta especie es heliófita y el promedio de su altura (3,9 m) respecto a los encinos [Q. rysophylla (5.22 m), Q. canbyi (4.83m) y Q. laeta (4.79m)] es considerablemente menor, estando por ende a la sombra de estos, teniendo como resultado una notable disminución en su desarrollo.

Área de referencia
En esta área se encontró que P. pseudostrobus es la especie más dominante abarcando 87.55 % del total del área basal y 38.59 % del total de individuos presentes. Es seguido por cuatro especies del género Quercus los cuales suman 12.33 % del área basal total y una densidad de 57.04 % (Cuadro 3) encontrándose ampliamente distribuidos por toda la zona. Estos datos coinciden con los de González et al. (2007) donde mencionan que los ecosistemas maduros presentan alta presencia de P. pseudostrobus.

Diversidad Alfa
Las áreas impactadas por el incendio presentan diferencia en la riqueza específica (Cuadro 4), siendo el área no restaurada la que presenta mayor riqueza de acuerdo a los índices de Margalef (DMn = 1.72) y Menhinick (DMn = 0.73) y el área restaurada la menor (DMg= 0.88; DMn= 0.34), lo que es de esperarse, pues estos índices son sensibles al número de especies.

Referente a los índices de diversidad de Shannon (H') (Cuadro 4), se encontró que el ecosistema no restaurado es el que muestra mayor diversidad (H' –1.60) seguido por el de referencia (H'–1.50) y el restaurado (H'–1.40). Esta información concuerda con la de González et al. (2008), donde menciona que los ecosistemas impactados por incendios forestales presentan mayor diversidad en especies arbóreas y son más heterogéneos que los ecosistemas clímax.
La prueba de similitud o diferencia en la diversidad entre las áreas estudiadas estimado mediante el índice de Shannon (H'NR = 1.60; H'RE = 1.40; H'REF = 1.50) mostró diferencias significativas en términos de diversidad y abundancia (P≤0.05), de lo que se deriva que los incendios forestales y prácticas de restauración ejercidos en estas áreas modifican la diversidad y abundancia de las especies arbóreas y arbustivas presentes.
Diversidad Beta
El análisis realizado con el índice de Morisita–Horn (Cuadro 5), mostró que el área restaurada y no restaurada son las que presentan mayor similitud 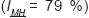 y corrobora la diferencia significativa existente entre las áreas con base en el método de t de Hutcheson.
y corrobora la diferencia significativa existente entre las áreas con base en el método de t de Hutcheson.

Dentro de los ecosistemas en recuperación, el que presenta mayor similitud al ecosistema de referencia es el restaurado (IMH = 23 %), ya que las prácticas silvícolas realizadas han cumplido con la función, que es acelerar la dinámica sucesional para que en un tiempo menor el ecosistema esté en las condiciones que originalmente estaba.
CONCLUSIÓN
Con base en los resultados obtenidos, se demostró que las áreas perturbadas post–incendio con y sin restauración ecológica presentan diferencias estadísticas en su composición arbórea. El ecosistema restaurado presenta menor riqueza y diversidad comparado con el ecosistema que se estableció de manera natural, pero se asemeja más al ecosistema de referencia. Esta información concuerda con la de González et al. (2008),–+ donde encontraron que los ecosistemas boscosos de la Sierra Madre Oriental presentan mayor riqueza y diversidad en las primeras etapas sucesionales. Por lo tanto, el programa de restauración ecológica puede considerarse un éxito, ya que el ecosistema restaurado se está interviniendo para que posea condiciones similares a un ecosistema maduro y con ello se establecerán las interacciones ecológicas de un ecosistema clímax.
AGRADECIMIENTOS
Al personal del Parque Ecológico Chipinque por todas las facilidades otorgadas para el establecimiento de esta investigación y especialmente al Biol. Erik Meléndez y Biol. Cecilia García por su apoyo en campo y a la Ing. Silvia Rivera por sus valiosos comentarios. El Parque Ecológico Chipinque apoyó con beca de manutención al tercer autor.
LITERATURA CITADA
ALANÍS, E.; JIMÉNEZ, J.; AGUIRRE, O.; TREVIÑO, E.; JURADO, E.; GONZÁLEZ, M. 2008. Efecto del uso del suelo en la fitodiversidad del matorral espinoso tamaulipeco. Revista Ciencia UANL. 8:56–62. [ Links ]
BARRERA, J.; RÍOS, H. 2002. Acercamiento a la ecología de la restauración. Pérez–Arbelaezia (13) 33–46. [ Links ]
CARANQUI, J. 2006. Composition and estructure of a montane forest in Tambo Palictahua, Chimborazo. Iyonia: a Journal of Ecology and Application. 9(1): 35–41. [ Links ]
CARIBELLO, J. 2003. Restauración de Ecosistemas a partir del manejo de la vegetación, Guía Metodológica. Ministerio de ambiente, vivienda y desarrollo territorial. Colombia. 96 pp. [ Links ]
CHAUHAN, M. 2005. Book Review. Rehabilitation and Restoration of Degraded Forests. Restoration Ecology. 13(3): 578–579. [ Links ]
CIPOLLINI, K.; MARUYAMA, A.; ZIMMERMAN, C. 2005. Planning for restoration: A decision Analysis Approach to prioritization. Restoration Ecology. 13(3): 460–470. [ Links ]
CLIFFORD, H.; STEPHENSON, W. 1975. An introduction to numerical classification, Academia Press, London. [ Links ]
CONAFOR, 2007. Comisión Nacional Forestal. http://www.conafor.org.mx Áreas afectadas por incendios forestales. [ Links ]
CORRAL, J.; AGUIRRE, O.A.; JIMÉNEZ, J.; NÁVAR, J. J. 2002. Muestreo de diversidad y observaciones ecológicas del estrato arbóreo del bosque Mesófilo de Montaña "El Cielo", Tamaulipas, México. Revista Chapingo. Serie ciencias forestales y del ambiente 8(2): 125–131. [ Links ]
GARCÍA, D. A. 2000. Restauración de la vegetación en los bosques de encino y pino en el Parque Ecológico Chipinque, México. Tesis de licenciatura. FCF, UANL. [ Links ]
GONZÁLEZ, M. A.; HIMMELSBACH, W.; JIMÉNEZ, J.; MÜLLER, B. 2005. Reconstruction of fire history in pine–oak forests in the Sierra Madre Oriental, Mexico. Forestarchiv 76: 138–143. [ Links ]
GONZÁLEZ, M.A.; SCHWENDENM, L.; JIMÉNEZ, J.; HIMMELSBACH, L. 2007. Reconstrucción del historial de incendios y estructura forestal en bosques mixtos de pino Encino en la Sierra Madre Oriental. Maderas y Bosques. 13(2): 51–63. [ Links ]
GONZÁLEZ, M. A.; SCHWENDENMANN, L.; JIMÉNEZ, J.; SCHULZ, R. 2008. Forest structure and woody plant species composition along a fire chronosequence in mixed pine–oak forest in the Sierra Madre Oriental, Northeast Mexico. Forest Ecology and Management 256: 161–167. [ Links ]
GRELA, I. A. 2003. Avaliação do estádio sucessional de uma floresta subtropical de "quebrada" na região norte do Uruguai. Acta Bot. Bras. 17(2): 315–324. [ Links ]
ISANGO, J. A. 2007. Stand Structure and Tree Species Composition of Tanzania Biombo Woodlans: A Case Study from Miombo Woodlands of Community Based Forest Management in Iringa District. Working Papers of the Finnish Forest Research Institute. 50: 43–56. [ Links ]
KEITH, B. 2004. Global restoration network. Ecological Restoration. Vol. 22(4): 252 pp. [ Links ]
LINDENMAYER, D.; MARGULES, C.R.; BOTKIN, D. B. 2000. Indicators of Biodiversity for Ecologically Sustainable Forest Management. Conservation Biology. 14(4): 941–950. [ Links ]
MAGURRAN, A. 1988. Ecological diversity and its measurement. Princeton University Press. New Jersey. 179 p. [ Links ]
MAGURRAN, A. 2004. Measuring Biological Diversity. Blackwell Science Ldt. Blackwell Publishing Company. Oxford, UK. 256 pp. [ Links ]
MAYER, P. 2006. Biodiversity–The appreciation of different thought styles and values helps to clarify the term. Restoration Ecology. 14(1): 105–111. [ Links ]
MCCUNE, B.; GRACE, J.B. 2002. Analysis of Ecological Communities. MjM Sostware Desing, Oregon USA, 217 pp. [ Links ]
MORENO, C. E. 2001. Métodos para medir la biodiversidad. SEA. Editado por Cooperación Iberoamericana (CYTED), UNESCO (ORCYT) y SEA. Vol. 1. Pachuca, Hidalgo, México. 83 pp. [ Links ]
MOSTACEDO, B.; FREDERICKSEN, T. S. 2000. Manual de métodos básicos de muestreo y análisis en ecología vegetal. BOLFOR; Santa Cruz, Bolivia. 87 pp. [ Links ]
PARQUE ECOLÓGICO CHIPINQUE (PECh). 2007. Programa de Manejo y Conservación del Parque Ecológico Chipinque. [ Links ]
RODRIGUEZ, D. A.; FULÉ, P. 2003. Fire ecology of Mexican pines and a fire management proposal. International Journal of Wildland Fire 12(1): 23–37. La cita de Chauhan, M. 2005 aparece arriba del gráfico No. 1. [ Links ]
RUIZ, M.; MITCHELL, T. 2005. Restoration Success: How is it being measured? Restoration Ecology. 13(3): 569–577. [ Links ]
SHANNON, C. 1948. The mathematical theory of communication. En C. E. Sahnnon; W. Weaver (Ed). Univ. of Illinois. Press 134–154. [ Links ]
SIMPSON, E. 1949. Measurement of diversity. Nature, 163, 688 p. [ Links ]
SMITH, R. L.; SMITH, T. M. 2000. Ecología. 4ª edición. Pearson. Addison Wesley. España. 301–355. [ Links ]
WHITTAKER, R. 1977. Evolution of species diversity in land communities. Evolutionary Biology, Vol. 10. Plenum, New York. USA. 60–66. [ Links ]
ZAVALA, F. 2000. El fuego y la presencia de encinos. Ciencia Ergo Sum. 7(3): 269–276. [ Links ]
ZAVALA, F. 2001. Introducción a la ecología de la regeneración natural de encinos. Universidad autónoma de Chapingo. México. 94 pp. [ Links ]














