Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.14 no.1 Chapingo ene./jun. 2008
Ecología de la herbivoria
Ecology of herbivory
D. Granados–Sánchez1; P. Ruíz–Puga2; H. Barrera–Escorcia2
1 División de Ciencias Forestales. Universidad Autónoma Chapingo. Km. 38.5, Carretera México–Texcoco. Chapingo, Estado de México. C. P. 56230.
2 Facultad de Estudios Superiores. Iztacala. Universidad Nacional Autónoma de México. Av. De los Barrios Núm. 1. Tlalnepantla, Estado de México. C. P. 54090.
Recibido: 31 de marzo, 2008
Aceptado: 23 de abril, 2008
RESUMEN
En este trabajo se analizó cómo un venado que se alimenta de arbustos o un ratón come semillas, ambos practican una forma de depredación llamada herbivorismo. El hecho de alimentarse de las plantas tiene consecuencias de supervivencia, tanto para los vegetales como para los herbívoros. La substracción de tejidos vegetales, hojas, corteza, tallos, raíces y savia influye sobre la capacidad de la planta para sobrevivir, aunque no sea consumida por completo. También se investigó, que a pesar de que una planta no puede escapar de sus enemigos herbívoros, puede defenderse químicamente. Muchas plantas atraen, resisten e inhiben a otros organismos produciendo sustancias químicas especiales, conocidas como metabolitos secundarios. También se puntualiza que los productos primarios son sustancias como las proteínas, los hidratos de carbono y los lípidos, producidos y utilizados por todos los seres vivos. Sin embargo, las plantas pueden diferir tan radicalmente en sus productos secundarios como en su morfología externa.
Palabras clave: plantas, herbívoro, metabolitos secundarios, defensa.
ABSTRACT
In this work is analyzed how a deer feeds from shrubs or how a mice feeds from seeds. Both practice a form of predation named herbivory. The fact is that to feed on plants has consequences on survival, both on plants and herbivores. The removal of plant tissues, bark, stems and sap influences the capacity of the plant to survive, despite not all of it is consumed. Also is studied that despite a plant cannot escape from their herbivore enemies, it can defend itself chemically. Many plants attract, resist or inhibit to other organisms producing special chemical substances, known as secondary metabolites. Also is pointed out that the primary products are substances such as proteins, carbohydrates, and lipids, all produced and utilized by the living organisms. However, plants can have so many differences in their secondary products, as in their external aspect.
Keywords: plants, herbivores, secondary metabolites, defence.
INTRODUCCIÓN
La vida existe porque las plantas utilizan la energía del sol para convertir el bióxido de carbono y agua en moléculas orgánicas que los animales comen. Las primeras plantas terrestres emergieron de lagos, ríos y pantanos hace 450 millones de años, y es probable que los animales un poco después. Los herbívoros desarrollados en los antiguos lagos y océanos, indudablemente fueron parte de la primera vida sobre la tierra.
Un factor importante en la evolución de las plantas ha sido el referente a los llamados metabolitos secundarios vegetales. En un tiempo considerados como sustancias de desecho, estos incluyen un conjunto de sustancias químicamente no relacionadas, como por ejemplo alcaloides, quinonas, aceites esenciales (terpenos), glucósidos (sustancias cianogénicas y saponinas), flavonoides y rafidios (cristales de oxalato de calcio con aspecto de agujas). En la naturaleza, estas sustancias químicas parecen tener una función importante al restringir las cualidades gustativas de las plantas en las que se encuentran o bien inducen a los animales a evitarlas (Braekman et al., 1998).
La selección natural es una fuerte lucha inexorable e intrínseca entre plantas y animales. En cada pedazo de madera, corteza, pradera y bosque, las plantas usan herramientas mecánicas y químicas para sobrevivir y reproducirse en compañía de herbívoros que las pueden destruir. Los herbívoros igualmente luchan por neutralizar las defensas de las plantas y al mismo tiempo, reproducirse en competencia con otras especies, por lo que las interrelaciones entre plantas y herbívoros son dinámicas (Schowalter, 1981).
La defensa de las plantas
Protección Mecánica. Se presentan estructuras externas defensivas en tallos, hojas, frutos, flores, frente a animales de tamaños diferentes, llegando en ocasiones a ser del tamaño del pelo de un mamífero, como en las especies de cactus espinosos, cuyas espinas son modificaciones de las hojas, éstas rechazan a los mamíferos; los herbívoros pequeños, tales como insectos, pueden ser dañados y dejarlos indispuestos, heridos o hasta muertos, por las defensas epidérmicas en tallos y hojas de tamaño diminuto. La protección mecánica contra pequeños insectos o ácaros son extremadamente importantes en plantas cultivadas.
Reducción de Digestibilidad. Lo más importante de las defensas de las plantas son los compuestos llamados polímeros o cristales inorgánicos, que hacen a la pared celular indigerible por los animales. Estos polímeros y cristales de sílice generalmente inhiben la digestión debido a que los animales no tienen enzimas para hacerlo. La celulosa y la hemicelulosa son compuestos polisacáridos con proporciones de 80–90 % del peso seco de la mayor parte de la planta; por lo que los herbívoros requieren de numerosas modificaciones en el aparato digestivo que permita fermentaciones lentas por microorganismos simbióticos. Sistemáticamente el exceso en el consumo de taninos presentes en la corteza reduce el crecimiento y pérdida de peso, además de otros síntomas por la mala nutrición (Dicke et al., 1990).
Toxinas. Algunos de los compuestos químicos (metabolitos secundarios) de las plantas pueden ser tóxicos para algunos animales. Las toxinas son consideradas como un componente secundario o alelo químicos que tienen el papel defensivo contra los animales. Estos compuestos químicos son almacenados en la pared celular de tejidos que aún no tienen la rigidez que proporciona la lignina o los silicatos, tal como en los brotes, hojas jóvenes, y frutos inmaduros. Las toxinas de los alcaloides provocan la inhibición de la síntesis de DNA y RNA (la cafeína), inhiben la mitosis (colchicina), la función de las membranas (tomatinas).
Terpenos: Algunos terpenos son esenciales para el metabolismo de la planta, como la hormona del crecimiento vegetal (ácido giberélico). El papel principal de defensa se restringe a taxas vegetales particulares, indicando esto respuestas evolutivas a herbívoros que son peculiares a plantas específicas. Los monoterpenos llamados piretroides son insecticidas efectivos que tienen un efecto instantáneo, sobre insectos voladores y no son tóxicos para los mamíferos. Otros monoterpenos son responsables de la resistencia de la Tuja plicata al ataque de termitas y de larvas de escarabajos descortezadores (Cipollini y Levey, 1997).
Comedores de Plantas: Herbivoría
Los animales herbívoros varían en tamaño desde diminutos áfidos hasta enormes elefantes. Algunos herbívoros comen sólo hierba, otros consumen hojas, corteza, savia, raíces, semillas, frutos, flores, néctar o polen. Parte de la energía almacenada en forma de carbohidratos en las plantas se transforma en tejido del herbívoro, que a su vez satisface las necesidades energéticas de los animales del siguiente nivel trófico, los carnívoros. Los herbívoros, situados en el centro de las cadenas alimenticias, ocupan una buena situación para mantener el equilibrio de los niveles por encima y por debajo de ellos, o para alterarlo de forma drástica (Dyer et al., 1993).
Es evidente que la capacidad para fabricar estas sustancias químicas y para retenerlas en sus tejidos resulta ser un paso evolutivo importante para las plantas y les proporciona una protección bioquímica contra muchos herbívoros. Los herbívoros no se ubican claramente en las categorías de parásito o depredador. Un búfalo o venado que pasta, arranca y mata algunas hierbas, pero casi siempre actúa como una podadora de pasto que recorta, pero no mata las plantas. Como quiera que se les clasifique, los herbívoros ejercen una fuerte presión selectiva sobre las plantas. Las plantas han perfeccionado diversas adaptaciones químicas que disuaden a sus "depredadores" herbívoros. Muchas de ellas, como el "pirul", sintetizan sustancias tóxicas y de sabor desagradable.
A medida que las plantas perfeccionaban sustancias tóxicas para su defensa, ciertos insectos encontraron formas de eliminar la toxicidad de estas sustancias o incluso de utilizarlas. El resultado de todo esto es que prácticamente toda planta tóxica sirve de alimento al menos a un tipo de insecto. Por ejemplo, las mariposas monarca depositan sus huevecillos en el algodoncillo, cuando sus larvas eclosionan, consumen la planta tóxica. Las orugas no sólo toleran el veneno del algodoncillo, sino que además lo almacenan en sus tejidos como defensa contra sus propios depredadores. Después de la metamorfosis, la mariposa monarca conserva la toxina almacenada. Los algodoncillos (Asclepiadaceae) se encuentran dotados de alcaloides y glicósidos cardiacos, que tienen un potente efecto en los vertebrados, los principales depredadores potenciales de los insectos herbívoros. Si un pájaro ingiere una mariposa monarca, sufre diversos trastornos gástricos y vómitos (Figura 1); con lo que los patrones anaranjados y negros típicos de la mariposa monarca se evitarán en lo sucesivo por parte del depredador (Seigler, 1991).
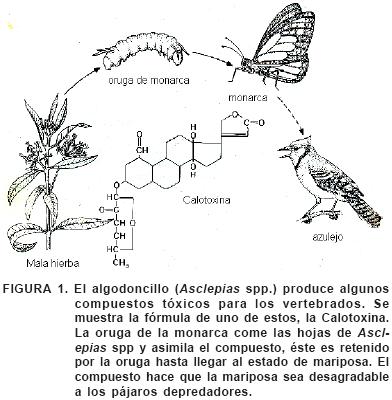
Los pastos han incorporado sustancias silíceas (vítreas) duras en sus hojas que disuaden a todos los depredadores herbívoros salvo a los que cuentan con dientes moledores fuertes y mandíbulas poderosas, como los rumiantes. Por consiguiente, la presión ambiental ha favorecido la aparición de dientes más largos y duros en los animales que pastan. Un ejemplo de esto es la coevolución de los caballos y de los pastos que les sirven de alimento. En una escala de tiempo evolutiva los pastos endurecieron sus hojas para reducir la actividad depredadora, y los caballos adquirieron dientes más largos con cubiertas de esmalte más gruesas que resisten el desgaste (Owen, 1980).
Los herbívoros tienen medidas mecánicas, bioquímicas y conductuales para contrarrestar las defensas de las plantas. Así los insectos herbívoros usan adaptaciones conductuales para superar el reto de digerir los tejidos vegetales. Tanto la morfología como la fisiología de los vertebrados e invertebrados están adaptados para albergar simbiontes microbianos que aumenten la digestibilidad reduciendo los polímeros de los tejidos vegetales y que ayuden a degradar las toxinas vegetales. Una larga evolución ha dado a los insectos una gran variedad de herramientas para fragmentar parte de las plantas de tal manera que estos mastican, muerden, chupan, diferentes partes de la planta. Los herbívoros mamíferos rumiantes también usan la fermentación para digerir las fibras vegetales y son sistemas tan eficientes como los del rumen. A pesar de la gran actividad microbiana en el intestino muchos materiales vegetales no pueden ser digeridos, esto depende principalmente de: 1) Volumen del fluido microbiano, 2) Tiempo en que el alimento parcialmente digerido es retenido en el intestino y, 3) Proporción de fibra lignificada o de material indigerible en plantas de forraje (Baldwin, 1994).
Los insectos que se alimentan de plantas son mucho más pequeños que los vertebrados herbívoros y consecuentemente no pueden tener un volumen grande de simbiontes microbianos para la fermentación. Los insectos herbívoros se limitan a una selección de dieta y a una gran variedad de medios para mantener microbios simbióticos que luchen contra las defensas y la fibra vegetal. Largos intestinos sirven como cámaras digestivas en miniatura, análogos a los intestinos de los vertebrados. Muchos insectos tienen microbios mutualistas intracelulares llamados Micetocitos que juegan un papel diferente en los diversos insectos, incluyendo la degradación de las células, grasas, proteínas y almidones: síntesis de vitaminas y, a veces, de fijación de nitrógeno. Estos endosimbiontes pueden estar en los tejidos normales del insecto o ser agrupados en órganos especiales llamados Micetotomas que se encuentran en varias regiones del tracto digestivo.
Se encuentran herbívoros en todos los niveles de la vida animal, de los protozoos a los primates. Pueden comer cualquier tipo de alimento vegetal, desde los líquenes que comen los renos, a la madera de árboles gigantes que se comen las termitas y larvas de escarabajos. Los peligros son los mismos para todos: escasez de alimentos por diversas razones, en algunos casos complicada por la caza y el envenenamiento (Dyer et al., 1993).
Sin embargo, el papel de los herbívoros no es tan sólo comer y ser comidos. Los frugívoros se encargan de dispersar las semillas de las plantas, y los animales que se alimentan de flores o de alguna parte de la flor son responsables de la polinización, aunque no en tan alto grado como los insectos polinizadores (Janzen, 1966; Beck y Reese, 1976). Ciertas plantas, sobre todo en los trópicos, deben su existencia a los colibríes, murciélagos, roedores e incluso monos que visitan sus flores. Los pequeños herbívoros, como las ardillas, ratas, marmotas y lemmings, favorecen el crecimiento de la vegetación natural, enriqueciendo el suelo con sus excrementos y manteniéndolo aireado con sus túneles y madrigueras. Los grandes herbívoros, como los elefantes, rinocerontes, búfalos e hipopótamos, son los <<niveladores de terrenos>>, y se cree que ellos crearon el mosaico de bosques y praderas tan típicos de África. La evolución de los grandes herbívoros permitió la evolución de los grandes carnívoros sociales: los leones, los lobos (Palo y Robbins, 1991).
Los problemas del herbivorismo. Dado que las plantas son el alimento de mayor abundancia en el planeta, el herbivorismo ha sido una forma de vida común entre los mamíferos desde hace 65 millones de años, por lo menos; aunque los herbívoros tienen que resolver varios problemas. Hay muchos tejidos vegetales cuya digestión es difícil, suelen contener muy pocas proteínas y llegan a tener sustancias químicas defensivas. Dichos compuestos, afectan las dietas y estrategias alimentarias de los animales y en algunos casos, han influido en otros aspectos de sus ciclos de vida.
Los ciclos de vida de ciertos mamíferos folívoros (que se alimentan de hojas) surgieron quizá bajo la presión selectiva de las sustancias químicas que disminuyen la digestibilidad y las plantas de escaso contenido energético. La baja tasa metabólica de los perezosos arborícolas y los monos aulladores neotropicales, es tal vez, una adaptación para llevar su dieta folívora (Hagerman y Robbins, 1993). Los dos especialistas norteamericanos que consumen acículas de coníferas son ejemplos interesantes. Sus ciclos de vida se apartan de modo notorio del ciclo general de los roedores; es probable que las diferencias sean el precio que se tuvo que pagar por consumir un alimento abundante y predecible, aunque protegido por sustancias que reducen la digestibilidad. Los ratones arborícolas rojos, que se alimentan de las acículas del pino–abeto douglas, jamás alcanzan grandes densidades poblacionales y sus camadas son pequeñas, por lo general dos crías y de lento crecimiento, mientras que la mayor parte de los ratones de campo alcanzan grandes densidades y tienen camadas numerosas de crías de rápido desarrollo; sin embargo, la rata nopalera que se alimenta del follaje del junípero, jamás llega a ser abundante y por lo general sólo tiene una cría, que crece y alcanza la madurez sexual lentamente (Hagerman y Robbins, 1993).
Las plantas pueden compensar la pérdida de hojas incrementando la tasa fotosintética en las hojas que quedan. Sin embargo, pueden verse afectadas negativamente por la pérdida de nutrientes, según la edad y los tejidos que hayan sido extraídos. Las hojas jóvenes son estructuras dependientes, ya que importan y consumen nutrientes provenientes de las reservas de las raíces y otros tejidos de la planta. Al ir madurando, las hojas se convierten en un exportador neto de nutrientes, alcanzando un máximo de producción justo antes de la senescencia. Los herbívoros ramoneadores, se alimentan principalmente de las hojas más gustosas y nutritivas. En cambio, tienden a evitar las hojas más viejas, según parece, porque suelen contener ciertos compuestos secundarios (taninos, por ejemplo). Cuando los ramoneadores centran su actividad consumidora en las hojas jóvenes, eliminan una cantidad considerable de nutrientes de las plantas.
Las plantas reaccionan a la pérdida de hojas con una explosión de nuevo crecimiento, con un consumo de nutrientes que de otra forma hubieran ido a parar al crecimiento y la reproducción. La defoliación también hace que la planta recurra a defensas químicas, con un costo considerable. Con frecuencia, la extracción de nutrientes y fenoles de las raíces las expone al ataque por parte de los hongos, mientras la planta concentra sus defensas en las partes aéreas. La defoliación severa, y el posterior crecimiento foliar, alteran fisiológicamente a la planta afectada. Los factores reguladores del crecimiento controlan los cambios en el estado de actividad de las yemas cuando se eliminan las hojas. La planta utiliza entonces sus reservas de alimento para mantener vivos sus tejidos hasta que crecen las hojas nuevas. Algunos fitófagos, tales como los áfidos, no consumen los tejidos de la planta, sino directamente sus jugos, particularmente en las hojas y brotes nuevos. Estos insectos chupadores de savia pueden hacer bajar en un 25 % las tasas de crecimiento y biomasa de las plantas, (Lehtila y Strauss,1999).
El ramoneo moderado, incluso en la vegetación de un bosque, puede constituir un efecto estimulante, induciendo un aumento de la producción de biomasa, aunque a costa de una pérdida de vigor y de nutrientes almacenados en las raíces. El grado de estimulación depende del tipo de planta, de la disponibilidad de nutrientes y de la humedad. En general, el ramoneo suele hacer aumentar la biomasa de hierbas, hasta cierto punto. A partir de ahí, la producción de tejidos disminuye.
Sin embargo, las hierbas están bien adaptadas al ramoneo y, hasta cierto punto, les beneficia. Debido a que en este caso el meristemo, el origen del nuevo crecimiento, se sitúa cerca del suelo, los ramoneadores comen primeramente las partes viejas, antes que los tejidos jóvenes. El ramoneo estimula la producción, al eliminar los tejidos más viejos que funcionan con unas tasas fotosintéticas menores. Por tanto, reduce la tasa de envejecimiento de las hojas, prolongando así la producción fotosintética activa. Además, el ramoneo también hace aumentar la intensidad de luz que llega a las hojas jóvenes de las capas inferiores, entre otros efectos beneficiosos. Algunas hierbas pueden mantener su vigor solamente bajo la presión del ramoneo, incluso cuando la defoliación reduce su tasa de reproducción sexual. En ausencia del ramoneo, algunas hierbas dominantes llegan a desaparecer.
Estas defensas químicas inducidas por el consumo herbívoro reducen drásticamente la cantidad de forraje disponible para las liebres en el momento preciso en que las grandes poblaciones necesitan enormes cantidades de alimento, de modo que en ocasiones tiene lugar un colapso repentino de la población. Estas plantas no producen alimento utilizable sino hasta tres años después del consumo intenso, de modo que sólo entonces comienza a recuperarse la población de liebres, se especula que las defensas químicas de las plantas alimenticias influyen de modo definitivo, en esa forma, en el ciclo poblacional de diez años de las liebres de las nieves.
Desde luego, los mamíferos no prefieren los tejidos vegetales con altas concentraciones de sustancias defensivas. El follaje de las coníferas, por ejemplo, suele ser un alimento de emergencia o que se consume en pequeñas cantidades junto con una diversidad de plantas. También hay otras plantas, además de las coníferas, que producen altas concentraciones de sustancias defensivas que las protegen de los herbívoros. Después de ser consumida intensamente por las liebres de las nieves (Lepus americanus), cuatro especies de árboles de Alaska (no coníferas) produjeron tallos adventicios (tallos que surgen de tejidos más o menos maduros sin conexión con el meristemo apical) con concentraciones en extremo altas de resinas terpénicas y fenólicas. Puesto que dichas resinas repelen a las liebres, estos animales evitan el consumo de los citados tallos.
Las plantas y los metabolitos secundarios
Muchas plantas atraen, resisten e inhiben a otros organismos produciendo sustancias químicas especiales conocidas como productos secundarios. Los productos primarios son sustancias como las proteínas, los hidratos de carbono y los lípidos producidos y utilizados por todos los seres vivos. A pesar de que todos los organismos utilizan los mismos tipos de productos primarios, las plantas pueden diferir tan radicalmente en sus productos secundarios como en su aspecto externo.
Existen más de 10,000 productos secundarios de las plantas que varían en su peso molecular desde 70 a más de 400,000 Daltones, pero la mayoría tiene peso molecular bajo. Algunos son producidos sólo por una especie, mientras otros son característicos de todo un género o incluso de una familia. Estos compuestos ayudan a las plantas a compensar el hecho de que son incapaces de moverse. Los efectos de los productos secundarios de defensa en los animales son diversos. Algunos actúan sobre el sistema nervioso de los insectos herbívoros, moluscos o mamíferos. Otros imitan las hormonas naturales de los insectos, causando que algunas larvas no puedan desarrollarse en adultos. Otros dañan el sistema digestivo de los herbívoros. Algunos productos secundarios son tóxicos para las pestes fúngicas, (Beck y Reese, 1976; Bergey et al., 1996).
Las partes efímeras de los vegetales (partes que sólo existen por poco tiempo), como flores, frutos o retoños, suelen estar protegidas por toxinas que, posiblemente, aparecieron como respuesta a la presión ejercida por los consumidores generalistas. Las toxinas exhiben pocas variaciones de una planta a otra de la misma especie. Las hojas maduras, por otro lado, son un alimento predecible y abundante, que además existe por periodos considerables. Quizá en respuesta ante la presión de los especialistas, las hojas maduras también han producido compuestos secundarios con un alto grado de variación individual. Estas sustancias químicas entorpecen la digestión.
Las hojas de muchas plantas contienen taninos que se combinan con enzimas digestivas y no digestivas que poseen los mamíferos, desnaturalizándolas. Los aceites volátiles de las coníferas contienen terpenoides; se sabe que algunos terpenoides del junípero tienen acción antimicrobiana en el rumen del venado. Puesto que la fermentación microbiana en el rumen produce la mayor cantidad de energía (50 a 70 %) necesaria para los rumiantes, los compuestos secundarios antimicrobianos (Figura 2) , inhiben de modo considerable la digestión en esos mamíferos, y también la inhiben en el ciego de los roedores.
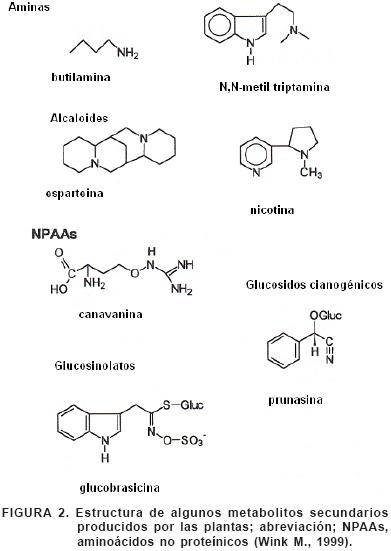
La diferencia entre compuestos primarios y secundarios es arbitraria; parte de los metabolitos primarios, también son usados en la defensa. Las tres principales categorías de metabolitos secundarios de defensa son los fenólicos, los alcaloides, y los terpenos. Compuestos de defensa adicionales incluyen proteínas y aminoácidos tóxicos, inhibidores de proteasas, y compuestos cianogénicos. Los fenólicos incluyen una gran variedad de químicos que consisten de un anillo aromático con un grupo hidroxilo unido, –OH (Figura 3). Probablemente los compuestos fenólicos más importantes para la defensa en angiospermas y gimnospermas, son los taninos, los cuales reducen la digestibilidad de los tejidos de las plantas. Ellos están empaquetados en las vacuolas celulares y están presentes en altas concentraciones en las hojas de los árboles, como en la familia Fabaceae, Fagaceae, Mirtaceae, y Poligonaceae. Otro grupo importante de compuestos fenólicos son las ligninas, las cuales impregnan las paredes celulares, dando fuerza estructural a la planta y proporcionándole una barrera contra el ataque de herbívoros y patógenos. Otros compuestos fenólicos incluyen saponinas venenosas así como flavonoides y antocianinas, pigmentos que dan a las flores y los frutos, sus colores (Baldwin, 1994).

Los alcaloides son otro amplio grupo de compuestos e incluyen muchos que son usados como fármacos. Alrededor de 10,000 alcaloides han sido aislados y sus estructuras analizadas. Los alcaloides son moléculas relativamente pequeñas que contienen nitrógeno. Muchos son tóxicos para los herbívoros. Los alcaloides son altamente específicos para las especies de plantas o grupo de especies en las que se encuentran. Son efectivos en pequeñas cantidades (como es el caso de la cocaína, la nicotina y la cafeína) aunque en algunos casos particulares las plantas o partes de ellas producen altas concentraciones de alcaloides. Los terpenos están en todas las plantas, y un individuo puede contener muchos terpenos diferentes.
Los terpenos juegan una amplia variedad de papeles funcionales en las plantas. Están compuestos de múltiples unidades isopreno, pueden ser moléculas grandes o pequeñas, dependiendo de cuantas unidades de isopreno contengan. El compuesto isopreno es emitido en las hojas de algunas especies de plantas (como el género Eucalyptus), en grandes cantidades y puede servir para protegerlos del daño por calor. El látex (savia de leche) se encuentra entre los miembros de las familias Euphorbiaceae y Apocynaceae contienen terpenoides tóxicos de defensa. Los aceites son los responsables de las características de sabor y aroma de las mentas (Lamiaceae) y son terpenos; ellos detienen a los herbívoros y reducen el crecimiento de las bacterias y de los hongos. Los glucósidos cardíacos pueden causar daño al corazón en los vertebrados y son venenosos para muchos insectos; estos terpenos son producidos por muchas especies de plantas que no están relacionadas, incluyendo especies de la familia Scrophulariaceae (como Digitalis) y de la familia Apocynaceae (como Asclepias y Apocynum). Las fitoecdisonas son terpenos que imitan las hormonas de los insectos y alteran el desarrollo de la larva del insecto; son producidos por un número de taxas, incluyendo helechos, cícadas, y algunas angiospermas (Barbosa, y Wagner, 1989) (Figura 4).

Las plantas en la familia Brassicaceae contienen metabolitos secundarios característicos, principalmente glucosinolatos, que son repelentes efectivos de la mayoría de los herbívoros. Estos aceites precursores de la mostaza casi detienen completamente a los mamíferos y a los insectos no adaptados. Los glucosinolatos no son efectivos contra insectos herbívoros que han llegado a estar especializados en esta familia; sin embargo, y sólo en altas concentraciones, pueden ofrecer cierta protección.
Los glucosinolatos no sólo pueden afectar la interacción entre plantas y herbívoros, sino que también pueden controlar indirectamente la distribución y abundancia de las plantas. Cardamine cordifolia (Brassicaceae) es nativa de las Montañas Rocallosas de Norteamérica, donde crece sólo en los bordes del bosque húmedo sombreado. Ellas pueden ser restringidas a sitios soleados por la gran vulnerabilidad a herbívoros crónicos de aquellos sitios. En una serie de experimentos, las plantas que crecieron en sitios soleados experimentaron un gran estrés hídrico, el cual redujo sus concentraciones de glucosinolato. Consecuentemente, las plantas tuvieron más insectos herbívoros y sufrieron un gran daño (Larcher, 2003). Así, la herbivoria puede estar controlando la distribución de las plantas provocando daño diferencial entre los microhábitats.
Los metabolitos secundarios desempeñan múltiples papeles. Mientras numerosos productos secundarios cumplen funciones de protección, otros son esencialmente atractivos para los polinizadores y dispersantes de las semillas. La canavanina es un aminoácido que no se encuentra en las proteínas, pero que es muy similar al aminoácido arginina, presente en casi todas las proteínas. La canavanina desempeña dos funciones importantes en las plantas que la producen en cantidades significativas. La primera es como compuesto que almacena nitrógeno en las semillas. La segunda es de defensa y se basa en la similitud de la canavanina con la arginina: muchas larvas de insectos que consumen tejidos de las plantas que contienen canavanina se envenenan. La canavanina es incorporada en las proteínas del insecto en algunos lugares donde el ADN ha codificado para la arginina debido a que la enzima que carga los ARNt específicos para la arginina no puede discriminar con precisión entre los dos aminoácidos. Las proteínas resultantes terminan con una estructura terciaria modificada y por ende, con una actividad biológica reducida. Estos defectos en la estructura de las proteínas conducen a anormalidades en el desarrollo que matan al insecto. Algunas larvas de insectos pueden comer tejidos de plantas que contienen canavanina y desarrollarse normalmente. En estas larvas, la enzima que carga el ARNt específico para la arginina discrimina con precisión entre arginina y canavanina. Por lo tanto, la canavanina que ingieren no es incorporada en las proteínas que forman y la larva no resulta afectada (De Moraes et al., 1998).
Las defensas de las plantas surgen como resultado de una serie de señales. Los insectos que se alimentan de hojas de tomate dañan las células, conduciendo a una cadena de acontecimientos que incluyen la formación de hormonas y finalizan con la producción de un insecticida. Los pasos de señalización comprometidos en la producción de un compuesto defensivo, involucran dos hormonas. La sistemina, que es una hormona polipeptídica, la primera hormona polipeptídica descubierta en las plantas y los jasmonatos, los cuales se forman a partir de un ácido graso insaturado, el ácido linolénico. El paso final en esta serie es la producción de un inhibidor de la proteasa. Una vez en el tracto digestivo del insecto el inhibidor interfiere con las proteínas de la digestión y esto atrofia el crecimiento del insecto (Baldwin, 1994; Creelman y Muller, 1997). Los jasmonatos también forman parte del "pedido de ayuda", en ese caso, una sustancia liberada por la oruga al estar masticando, constituye la primera señal, que conduce a la formación de jasmonatos por parte de la planta. Éstos, a su vez, desencadenan la formación de compuestos volátiles que atraen a los insectos que depredan a las orugas.
Teoría clásica de la defensa vegetal
La teoría clásica predice que taxas relacionados de insectos llegan a "encerrarse" químicamente en un círculo con taxas de plantas relacionadas (Berryman, 1988).
Existen muchos estudios con relación a por qué los animales comen sólo algunas especies de plantas y no otras, algunos confirman esta teoría; sin embargo, otros no están de acuerdo con ellas, lo cual ha propiciado el surgimiento de otras:
En adaptación a los metabolitos secundarios presentes en familias de plantas, eventualmente los insectos pierden la capacidad de desintoxicarse de estos alelos químicos presentes en otras plantas no relacionadas filogenéticamente. Algunas otras familias de plantas adquieren una compleja defensa que excluye a los herbívoros especialistas.
Teoría de la apariencia vegetal. Establece que las plantas son fácilmente encontradas (aparentes) por los herbívoros y han evolucionado desarrollando defensas químicas diferentes a las que producen plantas difíciles de encontrar (no aparentes) para los animales. Esto implica que las plantas aparentes deben invertir más recursos para producir reductores cuantitativos de digestibilidad que les permitan defenderse de "todos" los herbívoros; en cambio, las plantas no aparentes deben "confiar" en escaparse espacial y temporalmente y además producir pequeñas cantidades de toxinas que son efectivas contra los herbívoros especialistas (Baldwin, 1994).
Ejemplo de plantas aparentes son los árboles, arbustos y hierbas perennes de bosques clímax, praderas y savanas, se piensa que se defienden con hojas pobres en nutrientes, lignificadas, con taninos o silicatos que reducen su valor nutricional para los herbívoros. Plantas no aparentes serían las hierbas de vida corta ubicadas en los primeros estados sucesionales o de praderas recientemente perturbadas. No necesitan defensa generalizada más que algunas toxinas simples, de efectos más bien cualitativos sobre el metabolismo de los herbívoros, por ejemplo, alcaloides, glucosinolatos y terpenoides que son nocivos a la mayoría de los herbívoros, pero que son fácilmente desintoxicados por los herbívoros especialistas que han evolucionado sistemas apropiados (Whittaker, 1970).
El principio de esta teoría puede ser aplicado a partes específicas de las plantas, por ejemplo, tejidos lignificados u hojas maduras, que se asume tienen defensa permanente, mientras que defensas temporales se dan en tejidos efímeros pero muy importantes como las yemas, primordios o semillas.
La teoría de la apariencia debe mucha claridad a los estudios de Feeny (1975; 1976) en dos tipos de plantas; encinos (aparente) y mostaza (no aparente) en donde los conceptos anteriores se aplican muy bien, este autor encontró que; los contrastes entre la química de los encinos y la mostaza son fuertes, el complejo de fenoles y celulosa lignificada tan importante en el encino están totalmente ausentes en la mostaza, en cambio, ésta contiene pequeñas cantidades de glucosinolatos que no se encuentran en el encino. Sin embargo, aunque estos estudios son contundentes para afirmar la teoría, existen consideraciones que suponen la no–generalización de esta teoría a todas las plantas y todos los herbívoros, por las diferencias tan grandes que pueden encontrarse en cada uno de ellos.
Una limitación de esta teoría es la predicción de los patrones de defensa vegetal, esto debido a que no existe distinción absoluta entre los patrones y tipos de defensa que presentan los diferentes tipos de plantas; es decir, algunas especies leñosas tienen defensas cualitativas (toxinas) además de las ligninas y fenoles reductores de la digestibilidad y algunas hierbas tienen altos niveles de fenoles además de las toxinas.
Teoría de la asignación de recursos. Esta teoría sugiere que la capacidad defensiva de las especies está en función de su capacidad de reemplazar partes perdidas con los recursos a su disposición, más que la apariencia a los herbívoros. Esto es, a diferencia de la teoría de la Apariencia, la Disponibilidad de recursos asume que la fisiología inherente al crecimiento, la capacidad fotosintética y la disponibilidad de nutrientes son los factores que determinan la cantidad y tipos de defensas que las plantas usan (Berryman, 1988).
Se ha establecido que existen tres variables básicas que determinan la cantidad y tipos de defensas desarrolladas por las plantas, éstas son: a) Tasa intrínseca de crecimiento, b) Disponibilidad total de recursos y c) Balance carbono/ nitrógeno. Estas tres variables interaccionan para determinar si la inversión en defensa será alta o baja, si los elementos de defensa son inmóviles (lignina, taninos) y si son con base en carbono (ligninas, taninos, terpenos) o con base en nitrógeno (alcaloides, cianógenos, aminoácidos no proteínicos). La tasa intrínseca de crecimiento es un elemento importante en esta teoría, ya que sugiere que las plantas de rápido crecimiento (usualmente árboles y hierbas de estados sucesionales tempranos) invertirán relativamente poco en defensa de cualquier tipo y éstas serán moléculas móviles fácilmente metabolisables por los herbívoros; estas especies "minimizan" la elaboración de lignina y taninos que podrían inhibir la elaboración de tejidos (Cipollini y Levey, 1997).
Las plantas de lento crecimiento invierten más en defensa con polímeros complejos (lignina y taninos) y favorecen el uso de estas defensas inmóviles, las cuales, una vez empleadas son elementos permanentes de las hojas y tallos. El costo energético del tipo de defensa es otro punto en que las dos Teorías (de la apariencia y disponibilidad de recursos) difieren, por que la primera asume que las defensas cuantitativas (polímeros en altas concentraciones) tienen costos energéticos más altos que las cualitativas (toxinas). En cambio, la Disponibilidad de recursos considera que lo anterior no siempre es cierto, pues los polímeros sólo se sintetizan una vez, mientras que las toxinas, aunque son moléculas más pequeñas, se están continuamente sintetizando y destruyendo, por lo que su costo energético a la larga puede ser más alto que los otros. (De Moraes et al., 1998).
Las defensas cuantitativas son más ventajosas cuando la limitación de recursos impone una tasa de crecimiento baja a las plantas y cuando los tejidos no requieren ser constantemente reemplazados. En cambio, las defensas cualitativas tienen ventajas para las plantas de rápido crecimiento. Un punto importante de la teoría de la asignación de recursos es que permite explicar los patrones cambiantes de defensas en tejidos jóvenes y maduros, es decir, establece que los tejidos jóvenes de rápido crecimiento usan defensas móviles (cualitativas) y los tejidos maduros requieren las defensas inmóviles (cuantitativas). En resumen, para esta teoría es la economía del crecimiento, más que la apariencia de los herbívoros, lo que determina los patrones de defensas de las plantas. En cuanto al papel del balance C/N esta teoría predice que el tipo de nutrientes disponibles determina si la defensa será basada en carbono o en nitrógeno (Braekman et al., 1998).
Las plantas que crecen sobre suelos pobres en nitrógeno usarán toxinas basadas en carbón (ejemplo, terpenoides) como defensas móviles, a diferencia de aquellas que crecen sobre suelos fértiles, que usarán toxinas basadas en nitrógeno (Alcaloides). En la comparación que se hace de las tres teorías, aparentemente se observa más consistencia en la teoría de la asignación de recursos, específicamente en los siguientes aspectos:
– Explica mejor las diferencias químicas entre tejidos jóvenes y maduros, esto se asume porque los tejidos jóvenes en plantas que crecen sobre suelos pobres en N, producen defensas basadas en C más que en Nitrógeno.
– También predice la alta tasa de herbivoría sobre el follaje de plantas de estados sucesionales tempranos, asumiendo que el rápido crecimiento permite un reemplazo rápido de tejidos pobremente defendidos.
– En general clarifica los mecanismos que las plantas usan para enfrentar los retos de adaptación de los herbívoros. Aunque no ofrece mucha información acerca de la especialización de los herbívoros, ni de la coevolución de los herbívoros–plantas.
Sin embargo, se considera que estas teorías pueden complementarse o ser asimiladas en una teoría más general de la defensa de las plantas contra la acción de los herbívoros. Las defensas de las plantas incluyen: 1) protección mecánica en la superficie de la planta 2) compuestos polímeros de cristales de sílice, que reducen la digestibilidad de los animales y, 3) tóxicos vegetales en muy bajas concentraciones que matan o repelen a herbívoros pequeños (Barbosa y Wagner, 1989).
Defensas inducidas contra constitutivas. Son defensas que pueden ser desarrolladas en las plantas superiores o inducidas por daños de herbívoros o por enfermedades. Las constitutivas son la protección permanente de las especies vegetales e incluye la mayoría de las protecciones mecánicas externas como las espinas, tricomas y también una gran variedad de compuestos químicos que reducen la digestibilidad de los tejidos vegetales o son venenosos para los herbívoros. Las defensas inducidas son respuestas de las plantas a los daños del tejido. Las proteinasas inhibitorias y otras defensas químicas son ahora consideradas como defensas inducibles (Stamp, 1996). Las defensas mecánicas, estructurales y alelo químicas, abordadas en este escrito son una parte de la inmensa variedad de mecanismos que las plantas usan para responder a la herbivoría, es necesario enfatizar dos puntos:
1) Se ha nombrado a estos productos metabolitos secundarios y la información acerca de los efectos ecológicos de los compuestos secundarios es escasa. La toxicidad de un alelo químico es rara vez conocida más que para una pequeña fracción de insectos, aves, mamíferos o patógenos que pueden probarlos o comerlos en la naturaleza. 2) Una especie vegetal dada tiene varios sistemas de protección no sólo uno o dos, por ejemplo, una leguminosa puede tener tricomas cuando es una plántula, hojas duras y tallo lignificado cuando es un adulto, además pueden tener terpenoides, las semillas pueden tener alcaloides y aminoácidos tóxicos. La diversidad alelo química de una especie es rara vez conocida y las consecuencias de protección de un sistema de defensa mecánica, estructural o alelo químico no ha sido bien establecido para muchas plantas silvestres, (Lehtilä y Strauss, 1999).
Las defensas constitutivas son aquellas que están presentes en una planta a pesar del daño por el herbívoro. Ellas pueden estar presentes durante toda la vida de la planta o pueden cambiar cuando crecen o maduran. Las respuestas inducidas están promovidas por el ataque de herbívoros. Si estas respuestas sirven para proteger a las plantas, ellas son llamadas defensas inducidas; si ellas tienen un efecto negativo en el ataque por herbívoros, son llamadas resistencias inducidas. Ambas defensas, físicas y bioquímicas pueden ser inducidas.
Un ejemplo clásico de una defensa inducida es la producción de los glucósidos cianogénicos por Trifolium repens (trébol blanco, Fabaceae) cuando las hojas son dañadas; esta respuesta puede también ser inducida por daño por heladas. Los glucósidos cianogénicos son un agente efectivo contra caracoles, los cuales son herbívoros voraces en regiones con inviernos húmedos y suaves. La capacidad para producir estos compuestos de defensa es controlada por dos genes, y en poblaciones de trébol blanco en la Gran Bretaña son polimórficas para la característica. En la presencia de caracoles, las plantas que tuvieron la capacidad de producir glucósidos cianogénicos tuvieron una alta proporción de sobrevivencia comparada con aquellas que no tuvieron la habilidad de producir glucosilados cianogénicos. En la ausencia de caracoles, aquellas plantas tuvieron crecimiento y reproducción reducidos comparados con las acianogénicas. Como se predijo por la teoría evolutiva, áreas con una alta densidad de caracoles tuvieron una alta proporción de individuos cianogénicos, mientras aquellas con pocos herbívoros tuvieron una preponderancia de individuos acianogénicos (Berryman, 1988; Baldwin, 1994).
En un estudio de Lepidium virginianum (Brassicacea), mostró que las defensas inducidas fueron efectivas contra herbívoros generalistas, pero no contra un herbívoro especializado contra aquella planta. La producción de savia por las coníferas en respuesta al ataque de escarabajos de la corteza es un ejemplo de una respuesta inducida. La savia de las coníferas contiene cantidades sustanciales de varios terpenos (incluyendo monoterpenos y sesquiterpenos) así como fenólicos y otros compuestos que son particularmente tóxicos para el hongo simbiótico que ataca con sus socios escarabajos (Krause et al., 1993) encontraron que el daño causado mecánicamente a los árboles causa la producción de pequeñas cantidades de monoterpenos, mientras que los árboles que son atacados por hongos respondieron con cantidades masivas de monoterpenos. Los árboles respondieron más fuertemente a aquellos hongos particularmente asociados con especies de escarabajos de la corteza que ordinariamente los atacan (Chararas, 1989).
Algunos metabolitos secundarios han evolucionado para la protección contra virus, bacterias, hongos, competencia vegetal y, muy importante, contra herbívoros (babosas, caracoles, artrópodos y vertebrados). En suma, los metabolitos secundarios pueden servir como compuestos señal para atraer animales para la polinización (monoterpenos fragantes, antocianinas coloreadas o carotenoides) y para dispersión de semillas (Cipollini y Levey, 1997). En algunas instancias, ambas actividades son exhibidas por el mismo compuesto: las antocianinas o los monoterpenos pueden ser atrayentes de insectos en las flores pero son insecticidas y antimicrobianos al mismo tiempo en las hojas.
La defensa contra herbívoros y patógenos no es necesariamente constitutiva. Investigaciones en décadas recientes mostraron que los daños mecánicos y la infección disparan distintos eventos en las plantas. Por ejemplo, un daño mecánico puede guiar a una decompartamentalización, liberando de esta forma químicos de defensa (protoxinas como los glucosinatos, glucósidos cianogénicos, saponinas bidesmosídicas, aliínas, ranunculina, cumaroil glucósidos) y mezclas de ellos con enzimas hidrolizantes, como la β–glicosidasa, mirosinasa, nitrilasa o aliinasa. Los alelo químicos activos son el resultado (Hartmann y Witte, 1995).
Contra resistencia: Contra ataque químico
Entre las interacciones poblacionales, la herbivoría constituye todavía un reto en muchos aspectos de la ecología vegetal y animal. Así, preguntas como: ¿De qué manera las plantas escapan de los herbívoros en tiempo y espacio?, ¿Por qué algunas son más exitosas que otras?, ¿Por qué algunos individuos sobreviven sin daños mientras sus vecinos son ramoneados o mordisqueados?, ¿Por qué los árboles escapan de la defoliación en algunos años y en otros son prácticamente desnudados por millones de escarabajos?, representan en alguna manera la directriz de los estudios modernos de la ecología de poblaciones. En este sentido algunas teorías han surgido para tratar de proporcionar los principios de organización básicos para el entendimiento de estas relaciones, por ejemplo: la teoría de la apariencia ofrece una perspectiva sobre la base de la facilidad con que las plantas son localizadas por los herbívoros; la teoría de la asignación de recursos se refiere a la "disponibilidad" de las plantas para movilizar recursos de defensa contra los herbívoros (Bernays y Chapman, 1994). Ambas ideas se sustentan en la idea propuesta por la teoría clásica de que las plantas han evolucionado en el sentido de tener la capacidad de respuesta defensiva que es contrarrestada por la evolución adaptativa de los animales que las consumen. Puesto que la presencia de sustancias químicas defensivas en las plantas es un fenómeno generalizado, este factor ha obligado a los herbívoros a adquirir contramedidas. Una de las medidas es la degradación microbiana. Casi todas las plantas que sirven de alimento a los herbívoros contienen oxalatos, que para los organismos no adaptados pueden resultar mortales. Ciertos mamíferos, incluyendo conejos, roedores, cerdos, caballos y algunos artiodáctilos rumiantes, y el ser humano, degradan los oxalatos por acción microbiana en su intestino grueso o su rumen (Cronin, 1998).
Los oxalatos presentes en el alimento favorecen a las bacterias intestinales o ruminales, que los utilizan para sí y de ese modo proliferan; el mayor número de las poblaciones microbianas se traduce en más rapidez de degradación de los oxalatos (Larcher, 2003.). Los herbívoros adaptados de esta manera son capaces de tolerar concentraciones de oxalatos que matarían a cualquier organismo no adaptado. La capacidad de ciertos roedores silvestres para devorar grandes cantidades de plantas que contienen oxalatos se debe, probablemente, a una adaptación de sus bacterias intestinales o fecales.
Una segunda contramedida es la alimentación selectiva; es decir, la capacidad de discriminar entre las plantas individuales para sólo ingerir aquellas que tienen concentraciones bajas de sustancias defensivas. Esta alimentación selectiva tan esmerada depende de las variaciones intra específicas de compuestos secundarios entre las plantas. Este tipo de variación está muy bien documentado lo que también sucede con la alimentación selectiva entre los mamíferos, los monos aulladores (Alouatta palliata) que se alimentan de hojas se vieron obligados a ser selectivos por la adquisición de sustancias químicas defensivas por parte de ciertos árboles (Cipollini y Levey, 1997).
Los monos sólo se alimentan de las hojas de ciertos árboles individuales de determinadas especies, y por lo general sólo consumen los pecíolos, en los que hay menores concentraciones de sustancias defensivas que en la lámina de la hoja. El precio de los descuidos es muy alto: tres de seis monos aulladores que habían estado comiendo las hojas de uno de dos árboles con hojas tóxicas murieron, lo que también le ocurrió a una hembra que repentinamente tuvo convulsiones y cayó desde lo alto de un árbol.
Pero también existen ejemplos menos impresionantes. Los venados son capaces de identificar muestras de junípero con bajas concentraciones de aceites volátiles, y las ratas nopaleras de Stephens se alimentan en varias ocasiones de ciertos árboles individuales de junípero, pero jamás lo hacen de otros. Mediante un cuidadoso estudio experimental se logró aislar la sustancia química que determina la selectividad alimentaria de la ardilla (Sciurus aberti). Esta ardilla depende del tejido cortical de las ramitas de pino ponderosa como alimento invernal. Las ramitas de los árboles en los que se alimentan las ardillas tienen menores concentraciones de monoterpenos (compuestos que tienen un efecto repelente o tóxico sobre algunos animales) que los árboles cercanos en los que no se alimentan las ardillas; asimismo, los experimentos en el laboratorio han demostrado que las ardillas escogen las ramitas con las concentraciones más bajas del monoterpeno pinero (Kurz, 1989).
Un tercer mecanismo a través del cual los animales evitan los efectos de las sustancias defensivas es tener una dieta variada. Mediante la ingestión de una variedad de plantas, los herbívoros logran mantener las concentraciones de sustancias defensivas en niveles suficientemente bajos como para tolerarlas.
Los pastos recurren al sílice para defenderse de los herbívoros. McNaugthon (1985b), descubrió que los pastos de las planicies del Serengeti, Tanzania, que están sometidos a la más intensa presión continua por apacentamiento que se observe en cualquier hábitat terrestre (McNaughton, 1985a), tienen concentraciones en extremo altas de sílice en sus tejidos. El contenido de sílice es mucho más alto en los pastos de las áreas más intensamente consumidas, y las partes de la planta con la concentración más alta son las menos accesibles (tallos y raíces). Los efectos adversos del sílice en los herbívoros son un aceleramiento del desgaste dental, cáncer en el esófago y formación de cálculos síliceos en las vías urinarias; estos últimos pueden ser mortales para el ganado doméstico. Los dientes de corona alta de los ungulados herbívoros y otros animales que se alimentan de pastos, como muchos roedores arvicolinos, son una probable respuesta a la rápida abrasión que provoca el sílice, aunque se sabe muy poco de otros mecanismos de adaptación de esos mamíferos para contrarrestar los efectos de ese elemento.
Cultivo microbiano, el tubo digestivo de los herbívoros tiene una microflora de bacterias, flagelados y protozoarios que sintetizan las vitaminas necesarias y que rompen el material vegetal y que desintoxican los alelos químicos a través de la fermentación anaeróbica. Estos son esencialmente microbios simbiontes. Los intestinos de los vertebrados muestran modificaciones funcionales y estructurales para la herbivoría, la fermentación en los mamíferos antes o después de que los productos alimenticios entren al estomago, la celulosa y hemicelulosa son degradados a azúcares y almidones en el rumen lleno de microbios (Bernays, y Chapman, 1994).
Los algodoncillos como Asclepias syriaca son plantas que producen látex (laticíferas). Cuando se dañan liberan cantidades copiosas de látex tóxico desde sus canales laticíferos. Durante años se ha sospechado que el látex disuade a los insectos de que coman la planta, porque los insectos que se alimentan de plantas laticíferas mueren. Un apoyo más fuerte para esta hipótesis fue proporcionado por los estudios de las poblaciones de campo de Lbidomera clivícollis, un escarabajo que es uno de los pocos insectos que se alimentan de A. syriaca. Estos escarabajos muestran un comportamiento prealimentario sorprendente: cortan algunas venas de las hojas antes de instalarse a comer.
El corte de las venas, con sus laticíferos adyacentes, causa una pérdida masiva del látex o interrumpe la llegada del látex a una porción río abajo del corte. Entonces los escarabajos se mueven a la porción libre de látex y comen su contenido (Ahmad, 1983).
¿Este comportamiento de los escarabajos niega el valor adaptativo de la protección del látex? En absoluto. Sigue existiendo gran número de pestes de insectos potenciales que son disuadidos eficazmente por el látex. Y la evolución prosigue. Con el tiempo, las plantas de vencetógidos que producen mayores concentraciones de toxinas pueden ser seleccionadas en virtud de su capacidad para destruir a los escarabajos que cortan los laticíferos.
Los herbívoros tienen microbios para protegerse de los compuestos secundarios de las plantas. Un sistema generalizado de enzimas proporciona protección contra una enorme variedad de toxinas vegetales. Además algunos insectos parecen haber evolucionado mecanismos específicos de desintoxicación por toxinas de sus plantas hospederas regulares. Cultivo microbiano, el tracto digestivo de los herbívoros tiene una microflora de bacterias, flagelados y protozoarios que sintetizan las vitaminas necesarias, que rompen el material vegetal y que desintoxican los alelos químicos a través de la fermentación anaeróbica. Estos son esencialmente microbios simbiontes. Los intestinos de los vertebrados muestran modificaciones funcionales y estructurales para la herbivoría, la fermentación en los mamíferos antes o después de que los productos alimenticios entran al estomago, la celulosa y hemicelulosa son degradados a azúcares y almidones en el rumen lleno de microbios (Brown y Trigo, 1995; Stamp, 1996).
Las oxidasas son enzimas que se encuentran en las membranas que desintoxican una amplia variedad de venenos vegetales. En los vertebrados la actividad de las oxidasas ocurre en varios órganos pero es más alta en los microsomas del retículo endoplasmico de células hepáticas. En los insectos los sitios usuales son los cuerpos grasos del intestino medio. Hay tres características importantes del sistema oxidasas de función mixta.
1) Catalizan las reacciones oxidativas resultando en productos polares que son fácilmente excretados.
2) Ellos no son específicos, es decir aceptan muchos sustratos químicos.
3) Son fácilmente inducidos por exposiciones a nuevas toxinas.
Usando alelos químicos. Actualmente algunos insectos incorporan algunas toxinas vegetales en su propia química protectora, por ejemplo, las orugas y los adultos de la mariposa monarca almacenan glucósidos cardiacos obtenidos de malezas de la cual ellos se alimentan, esto hace que los pájaros depredadores vomiten inmediatamente después de haber comido una oruga o un adulto. Esta experiencia es tan traumática para las aves que evitan encuentros futuros con estos insectos o a los que se parecen a él.
Elección y evasión. Los animales que comen muchas especies de plantas (polífagos) encuentran un mundo diferente de aquellos que comen sólo algunas especies (oligófagos) o de aquellas que comen sólo una especie (monófagos). Los polífagos deben usar simbiontes microbianos y defensas fisiológicas para contrarrestar una amplia variedad de toxinas y fibras vegetales. Los oligófagos deben sentir y evadir a las plantas que su sistema digestivo no puede asimilar (Hagerman, y Butler. 1991).
Una compleja defensa de las plantas requiere una complicada adaptación de los herbívoros, los animales difieren en su capacidad de usar diferentes plantas como alimento. Cada especie vegetal contiene varios compuestos tóxicos y reductores de la digestibilidad que los defiende a los diferentes herbívoros. Los efectos combinados de varios alelos químicos son frecuentemente más grandes que la suma de sus efectos separados (Nilsen et al., 1984).
Las plantas ganan tanto de los efectos combinados como individuales de las toxinas y reductores de la digestibilidad en sus tejidos. Su capacidad para sobrevivir en un mundo de herbívoros depende de su habilidad para evitarlos en el espacio y en el tiempo y de su capacidad para asimilar carbono y nutrientes necesarios para sistematizar sus defensas. Los animales necesitan más que adaptaciones morfológicas y fuerza mecánica para rebasar la defensa de las plantas. Los herbívoros pueden emplear un enorme volumen de simbiontes microbianos, usar adaptaciones sensoriales y conductas que permitan seleccionar su alimento (Whittaker, 1970).
Las plantas no se auto envenenan. ¿Por qué razón las sustancias químicas tóxicas para los herbívoros y los microbios no matan a las plantas que las producen? Las plantas que producen productos secundarios tóxicos suelen utilizar una de las siguientes medidas para protegerse:
• El material tóxico es aislado en un compartimiento especial, como la vacuola central.
• La sustancia tóxica es producida sólo después que las células de la planta ya han sido dañadas.
• La planta utiliza enzimas modificadas o receptores modificados que no reconocen la sustancia tóxica.
El primer método es más común. Las plantas que utilizan este método almacenan sus venenos en vacuolas si éstas son solubles en agua. Si son hidrofóbicos, los venenos son almacenados en laticíferos (canales que contienen un látex blanco y gomoso) o disueltos en ceras sobre la superficie epidérmica (Dussourd y Eisner, 1987). Este almacenamiento compartimentalizado mantiene la sustancia tóxica fuera de las mitocondrias, los cloroplastos y otras partes de la propia maquinaria metabólica de la planta.
Algunas plantas almacenan los precursores de las sustancias tóxicas en un compartimiento, como la epidermis y las enzimas que convierten los precursores al veneno activo en otro compartimiento, como el mesófilo. Estas plantas producen sustancias tóxicas sólo después de haber sido dañadas. Cuando un herbívoro mastica parte de la planta, las células se rompen y las enzimas se ponen en contacto con los precursores, generando el producto tóxico. La única parte de la planta dañada por el material tóxico es la que fue deteriorada por el herbívoro. Las plantas que responden al ataque produciendo cianuro –un fuerte inhibidor de la respiración celular– en todos los organismos que respiran están entre las que utilizan esta forma de protección. La tercera forma de protección es utilizada por las plantas que producen canavanina que se describieron antes. Estas plantas producen una enzima que carga ARNt para arginina que no se une a la canavanina. Sin embargo, como hemos visto, algunos herbívoros pueden evadir el envenenamiento de la canavanina de manera similar, lo que demuestra que la defensa de ninguna planta es perfecta. (Ahmad, 1983).
CONCLUSIONES
Las plantas, en el ecosistema, tienen un efecto notable sobre los herbívoros. Para éstos, no es crítica la cantidad de alimento, sino la calidad. Debido a la complejidad de los procesos digestivos necesarios para fragmentar la celulosa y convertir los tejidos vegetales en tejidos animales, se necesita un alimento de alta calidad, rico en nitrógeno. Sin esa calidad, los herbívoros pueden morir de inanición, incluso con el estómago lleno. El alimento de mala calidad es resistente, leñoso, fibroso e indigesto. Los alimentos de buena calidad suelen ser tejidos jóvenes, blandos y verdes, o pueden ser órganos de almacenamiento tales como raíces, tubérculos y semillas. La mayor parte del alimento disponible es de baja calidad, y los herbívoros que se ven obligados a consumirlo sufren una mortalidad elevada o una baja tasa reproductiva. Un problema añadido es la tarea de superar las diferentes defensas que poseen las plantas.
La base de la defensa química de los vegetales consiste en la acumulación de diversos tipos de proteínas tóxicas, terpenos y taninos. Estos productos secundarios, tóxicos incluso para las mismas plantas, deben almacenarse en vacuolas celulares, y ser liberados solamente al romperse las células. Además, para poder utilizarse como un veneno por contacto o un inhibidor volátil, deben guardarse en glándulas epidérmicas y ser excretados desde allí. La producción y el almacenamiento de estas sustancias tóxicas son costosas para la planta, lo cual supone un compromiso entre el gasto defensivo y el esfuerzo reproductivo.
El método defensivo utilizado depende de la planta en cuestión, las cuales se agrupan en dos tipos principales: plantas perennes y plantas herbáceas de ciclo corto. Un grupo incluye plantas leñosas de vida larga, grandes y conspicuas, de las cuales se alimentan los herbívoros. Estas plantas poseen los mecanismos defensivos más costosos, los denominados inhibidores cuantitativos, los cuales dificultan la digestión y, por tanto, también la asimilación de energía a partir del alimento. Estos productos químicos suelen ser taninos y resinas, concentrados cerca de los tejidos superficiales de las hojas, la corteza y las semillas. Con su presencia los tejidos vegetales se endurecen, se reduce la capacidad de los microorganismos para fragmentarlos dentro de los sistemas digestivos de los herbívoros, y se hacen también menos apetecibles. El problema de este sistema defensivo es su largo tiempo de respuesta. Por ejemplo, después de una defoliación provocada por las larvas de la "mariposa medidor", el encino (Quercusrobur) aumentará, un año más tarde, su contenido en fenoles y taninos y la dureza de sus hojas, (Feeny, 1976)
Las plantas de vida corta, principalmente anuales y perennes, utilizan inhibidores cualitativos que son sustancias tóxicas tales como los compuestos cianogénicos, y alcaloides tales como la nicotina, cocaína, morfina y mezcalina, los cuales interfieren con el metabolismo. Las plantas pueden sintetizar estos compuestos con un bajo costo energético. Son efectivos a baja concentración y se transportan fácilmente al lugar que ha sido atacado. Pueden llevarse de un sitio a otro de la planta, desde los puntos de crecimiento hasta las hojas o tallos, raíces y semillas. También pueden pasarse de las semillas a las plántulas. Estas sustancias protegen básicamente contra herbívoros generalistas.
Existen unos pocos herbívoros que han desarrollado mecanismos para evitar los efectos de estas defensas químicas. Algunos insectos pueden absorber estas sustancias o neutralizar su toxicidad mediante su actividad metabólica. Incluso hay algunos que pueden almacenar las toxinas vegetales y utilizarlas en beneficio propio para su defensa, como hacen las mariposas monarcas, o emplearlas en la producción de feromonas. Algunos escarabajos y orugas cortan una especie de zanjas circulares en las hojas antes de alimentarse de ellas, con lo que evitan la llegada del flujo de las defensas químicas de la planta al área de la hoja que van a consumir. Además, las plantas también pueden emplear los mecanismos de defensa menos costosos: hojas pilosas, pinchos y espinas, unas estructuras que aparecieron tempranamente en la evolución, presumiblemente cuando las plantas eran objeto de una presión depredadora incluso mayor (Rhoades y Cates, 1976a; Rhoades, y Cates, 1976b; Rhoades, 1979).
LITERATURA CITADA
AHMAD, S. 1983. Mixed–function oxidase activity in a generalist herbivore in relation to its biology, food plants and feeding history. Ecology, 64 235–43. [ Links ]
BALDWIN, I. 1994. Chemical changes rapidly induced by folivory, In: Insect Plant Interactions. (ed. E.A. Bernays), CRC Press, Boca Raton, pp. 1–23. [ Links ]
BARBOSA, P.; WAGNER, M. R. 1989. Introduction to Forest and Shade Tree Insects. San Diego: Academic. Press. [ Links ]
BECK, S. D.; REESE, J. C. 1976. Insect–plant interactions: nutrition and metabolism. En Recent Advances in phytochemistry, Vol. 10.10. J. W. Wallace y R. L. Mansell. Eds. Plenum Press, Nueva York, p. 41–92 [ Links ]
BERGEY, D. R.; HOWE, G. A.; RYAN, C. A. 1996. Polypeptide signaling for plant defensive signaling in animals. Proceedings of the National Academy of Sciences (USA). 93: 12052–12058. [ Links ]
BERNAYS, E. A.; CHAPMAN, R. F. 1994. Host–Plant Selection by Phytophagous Insects. Chapman & Hall, New York, p. 312. [ Links ]
BERRYMAN, A. A. 1988. Towards a unified theory of plant defense. In: Mechanisms of Woody plant Defense Against Insects, Search for Pattrern, ed. W. J. Mattson, J. Levieux & C. B. Bernard Dagon, pp. 39–55. New York: Springer Verlag. [ Links ]
BRAEKMAN, J. C.; DALOZE, D.; PASTEELS, J. M. 1998. Alkaloids in animals, in Alkaloids: Biochemistry, Ecology and Medicinal Applications (eds. M.F. Roberts and M. Wink), Plenum, New York, pp. 349–78. [ Links ]
BROWN, K.; TRIGO, J. R. 1995. The ecological activity of alkaloids, in The Alkaloids (ed. G. A. Cordell). Vol. 47, pp. 227–354. [ Links ]
CHARARAS, C. 1989. Los insectos parásitos de los bosques. Mundo Científico No. 15 pp. 616–628. [ Links ]
CIPOLLINI, M. L.; LEVEY, D. J. 1997. Secondary metabolites of fleshy vertebrate–dispesed fruits: adaptive hypotheses and implications for seed dispersal. Amer. Naturalist, 150 346–73. [ Links ]
CREELMAN, R. A.; MULLET, J. E. 1997. Biosynthesis and action of jasmonates in plants. Annu. Rev. Plant Physiol. Plant Mol. Biol., 48 355–81. [ Links ]
CRONIN, G. 1998. Between–species and temporal variation in Acacia–ant–herbivore interactions. Biotropica 30: 135–139. [ Links ]
DE MORAES, C. M.; LEWIS, W. J.; Paré, P. W.; ALBORN, H. T.; TUMLINSON, J. H. 1998. Herbivore infested plants selectively attract parasitoids. Nature, 393 570–73. [ Links ]
DICKE, M.; SABELIUS, M. W.; TAKABAYASHI, J.; BRUIN, J.; POSTHUMUS, M. A. 1990. Plant strategies of manipulating predator–prey interactions through allelochemicals: prospects for application in pest control. J. Chem. Ecol., 16 309–118. [ Links ]
DUSSOURD, D. E.; EISNER, T. 1987. Vein–cutting behavior: insect counterploy to latex defence of plants. Science, 237 898–901. [ Links ]
DYER, M. I.; SEASTEDT, T. R.; TURNER, C. L. 1993. Herbivory and its consequences. Ecological Applications 3:654–665. [ Links ]
FEENY, P. O. 1975. Biochemical Coevolution between plants and their insect herbivores. Pages 1–19 in L.E. Gilbert and P.H. Raven, eds. Coevolution of animals and plants. University of Texas Press, Austin. [ Links ]
FEENY, P. O. 1976. Plant apparency and chemical defense. Pages 1–40 in J.M. Wallace and R.L. Mansell, eds. Biochemical interaction between plants and insects. Plenum, New York. [ Links ]
HAGERMAN, A. E.; BUTLER, L. G. 1991. Tannins and Lignins. Pp. 355–385 In: G. A. Rosenthal and M. R. Berenbaum (eds.). The Chemical Participants (Herbivores: Their Interactions with Secondary Plant Metabolites, 2nd Ed., Vol 1). Academic Press, San Diego, CA. [ Links ]
HAGERMAN, A. E.; ROBBINS, C. T. 1993. Induced Responses to Herbivory. University of Chicago Press, Chicago. p. 210. [ Links ]
HARTMANN, T.; WITTE, L. 1995. Chemistry, biology and chemoecology of the pyrrolizidine alkaloids, in Alkaloids: Chemical and Biological Perspectives (ed. S.W. Pelletier), Vol. 9, Pergamon, Oxford, pp. 155–233. [ Links ]
JANZEN, D. H. 1966. Coevolution of mutualism between ants and acacias in Central America, Evolution 20:249–275. [ Links ]
KRAUSE, S. C.; RAFFA, K. F.; WAGNER M. R. 1993. Tree response to stress: a role in sawfly outbreaks. In Sawfly Life History Adaptations to woody plants, ed M. R. Wagner & K. F. Raffa, pp. 211 – 27. San Diego Academic. Press. [ Links ]
KURZ, W. 1989. Primary and Secondary Metabolism in Cell Cultures. 11. Springer, Heidelberg. [ Links ]
LARCHER W. 2003. Physiological Plant Ecology. Springer–Verlag, Austria; pp. 27–32. [ Links ]
LEHTILÄ, K.; Strauss, S. Y. 1999. Effects of foliar herbivory on male and female reproductive traits of wild radish, Raphanus raphanistrum. Ecology 80(1) 116–124. [ Links ]
McNAUGHTON, S. J. 1985a. Ecology of a grazing ecosystems: the Serengeti, Ecological Monographs 55:259–294. [ Links ]
McNAUGHTON, S. J. 1986. On plants and herbivores. American Naturalist 128: 765–770. [ Links ]
NILSEN, E. T.; SHARIFI, M. R.; VIRGINIA, R. A.; RUNDEL P. W. 1984. Phenology of warm desert phreatophytes: seasonal growth and herbivory in glandulosa var torreyana (honey mesquite) Journal of Arid Environments 13: 217–229. [ Links ]
OWEN, D. F. 1980. How plants may benefit from the animals that eat them. Oikos 35: 230–235. [ Links ]
PALO, T.; ROBBINS, C. T. 1991. Plant Defenses Against Mammalian Herbivory, CRC Press, Boca Raton, FL. [ Links ]
SCHOWALTER, T. D. 1981. Insect herbivore relationship to the state of the host plant: Biotic regulatión of ecosystem nutrient Cycling throug ecological succession. Oikos 37: 126–130. [ Links ]
SEIGLER, D. S. 1991. Cyanide and cyanogenic glycosides. Pp. 35–77 In: G. A. Rosenthal, and M. R. Berenbaum (eds), The Chemical Participants (Herbivores: Their Interactions with Secondary Plant Metabolites, 2nd Ed., Vol. 1). Academic, San Diego, CA. [ Links ]
STAMP, N. 1996. Developing a theory of plant–insect herbivory interactions: are we there yet? Bulletin of the Ecological Society of America 77: 51–61. [ Links ]
WHITTAKER, R. H. 1970. The biochemical ecology of higher plants. En: Sondheimer, E. y J. B. Simeone (Directores de la edición), Chemical Ecology, Academic Press. Nueva York. [ Links ]
WINK, M. 1999. Biochemistry of Plants Secondary Metabolism. Annual Plant Reviews, Volume 2. Boca Ratón, U.S.A. [ Links ]














