Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo serie ciencias forestales y del ambiente
versión On-line ISSN 2007-4018versión impresa ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.14 no.1 Chapingo ene./jun. 2008
Nota científica
Desinfección y selección de inóculo in vitro de Abies religiosa
In vitro desinfection and explant selection of Abies religiosa
J. G. Álvarez–Moctezuma1; J. L. Rodríguez–de–la–O2; J. García–Ruíz2
1 División de Ciencias Forestales, Universidad Autónoma Chapingo, Apartado Postal 37, Chapingo, Estado de México. C. P. 56230. Teléfono: 01 (595) 952–1500 Ext. 5468. Fax: 01 (595) 952–1637. Correo–e: jogualmo@correo.chapingo.mx. Autor para correspondencia.
2 Departamento de Fitotecnia, Universidad Autónoma Chapingo, Km. 38.5 Carretera México–Texcoco, Chapingo, Estado de México. C. P. 56230 Teléfono: 01 (595) 952–1500 Ext. 6236 y 6325. Correo–e: jrguez@correo.chapingo.mx.
Recibido: 23 de octubre, 2006
Aceptado: 30 de enero, 2007
RESUMEN
Los bosques de Abies religiosa en el Ajusco (México) están en declinación. Se requiere reestablecer poblaciones a partir de algunos árboles supervivientes en laderas afectadas. Los objetivos fueron evaluar las condiciones in vitro que permitan el establecimiento aséptico de semillas y seleccionar el inóculo más adecuado para la producción de plántulas en A. religiosa. Para la germinación in vitro se probaron desinfectantes (H2O2, C2H5OH, NaOCl). Se evaluaron inóculos (semilla completa, embriones aislados completos o mitades –corte transversal–, y cotiledones y primeras hojas verdaderas de plántulas germinadas in vitro) para su establecimiento in vitro. El mejor tratamiento para desinfectar la semilla de A. religiosa es sumergirla en H2O2 (3 % v/v) y agitar 24 h. Los mejores inóculos para la propagación in vitro fueron la semilla completa y primeras hojas primarias.
Palabras clave: asepsia, H2O2, CH3OH, NaOCl, abeto, semilla.
ABSTRACT
Abies religiosa forests in Ajusco (Mexico) are in declination. It is required to restore populations using some survivor trees from affected slopes. The aims were to evaluate in vitro environmental for aseptic establishment of seeds and select the ad hoc explants for plantlet production in A. religiosa. Disinfectants were tested (H2O2, C2H5OH, NaOCl) for in vitro germination. Explants were evaluated (complete seed, complete or half –transversal cut– isolated embryo, and cotyledons and first leaves from in vitro germinated plantlets) for their in vitro establishment. The best treatment for A. religiosa seed disinfection is dips it in 3% v/v H2O2 and shakes 24 h. The best explants for in vitro propagation were complete seed and first leaves.
Keywords: asepsis, H2O2, CH3OH, NaOCl, fir, seed.
INTRODUCCIÓN
El A. religiosa es arborescente, crece a elevadas altitudes y los bosques que forma representan la vegetación clímax en la región (Martínez, 1953) se distribuye en nueve entidades federativas de México (Gómez, 2003). Sus principales usos son madera, papel, medicina, techado (Bojorges, 1990), árbol de navidad (Elizaldi, 1979) y captura de carbono (Valenzuela, 2001).
Los bosques de A. religiosa del Ajusco son amenazados por factores crecientes que los han conducido a un proceso de declinación (Álvarez et al., 1998). Se requiere reestablecer las poblaciones originales, a partir de la escasa semilla de los árboles supervivientes en las laderas más afectadas. Las técnicas in vitro asegurarán la reproducción del material.
El objetivo del presente estudio fue evaluar las condiciones in vitro que permitan el establecimiento aséptico de semillas y seleccionar el inóculo más adecuado para la producción de plántulas en A. religiosa.
MATERIALES Y MÉTODOS
La semilla fue recolectada en la primavera del 2006, bajo polinización abierta en el Ajusco, México. Se usó el Laboratorio de Cultivo de Tejidos del Departamento de Fitotecnia de la Universidad Autónoma Chapingo, donde la semilla fue lavada con detergente y enjuagada con agua corriente; después se colocó en etanol al 70 % durante un minuto.
Desinfección
Los tratamientos fueron a) H2O2 al 3 % (v/v) y se agitó 24 h en Orbit Shaker, b) C2H5OH al 70 % (v/v) durante 1 min, c) NaOCl al 3, 5 y 10 % (v/v) durante 5, 15 o 20 min y d) agua desionizada estéril. Se lavó tres veces con agua estéril. La sala de incubación a 28.05 µMm–2s–1 (lámpara fluorescente DURO–TEST, Slim Line 75W), fotoperíodo: 16 h luz y 25 °C (±2 °C). El medio de cultivo fue Murashige y Skoog (1962) al 50 % con 0.60 µM de tiamina, 277 µjM de inositol, ácido cítrico y ácido ascórbico a un pH de 5.7 ±1; se esterilizó por 20 min y la cristalería y material durante 40 min a 120 °C y 1.5 kg·cm–2. Se contaron semillas contaminadas y necrosadas a los 32 días.
Prueba de inóculo
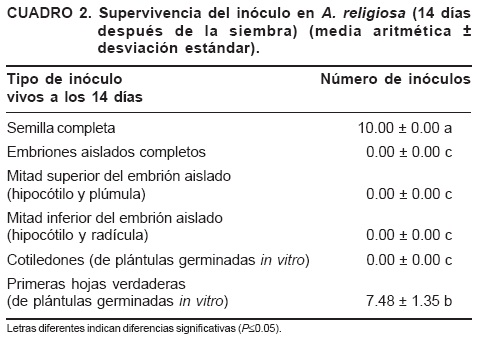
Los inóculos evaluados fueron a) semilla completa, b) embriones aislados completos, c) embriones cortados en mitades (corte transversal), d) cotiledones y e) primeras hojas verdaderas de plántulas germinadas in vitro. Se cultivaron en las condiciones mencionadas. A los 14 días se contabilizaron los inóculos vivos.
Para ambos estudios el diseño fue completamente al azar con 20 repeticiones (cajas Petri con 10 semillas cada una). Los datos se transformaron [x'=(x+0.5)–2] para el análisis de varianza. Las medias se compararon con la prueba de Diferencia Mínima Significativa (DMS).
RESULTADOS Y DISCUSIÓN
Desinfección
El H2O2 mostró la menor cantidad de semillas contaminadas y necrosadas. En el caso de NaOCl, a mayor concentración y tiempo de exposición, menor incidencia de hongos y bacterias, pero aumentaron las semillas necrosadas por toxicidad (DMS, P<0.05) (Cuadro 1).
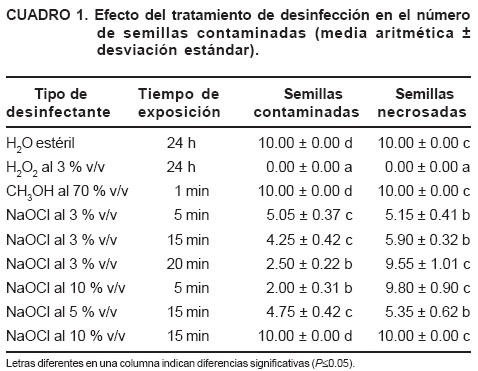
El H2O2 es eficaz en la desinfección de semilla forestal en Pseudotsuga menziesii (Dumroese et al., 1988) y en Pinus ponderosa reduce niveles de Fusarium (James y Genz, 1981). El H2O2 incrementa la germinación en Pinus spp. porque ablanda la testa y aumenta la permeabilidad (Barnett, 1998). El H2O2 es más oxidativo que el cloro o ClO2 (Barnett, 1998), se degrada en agua (ATSDR, 2004) y libera O2 y H2O, sin residuos tóxicos (Barnett, 1998). El H2O2 es bactericida, viricida y fungicida (HRM, 1993) y las bacterias no tienen enzimas para degradarlo (láñez, 1998). La agitación minimiza la demanda química del O2 (Sánchez, 2004) y reduce la infección bacteriana (Riofrío, 2004).
Grahsl et al. (1991) desinfectaron semilla de Abies alba en una solución de NaOCl durante 24 h, los embriones aislados pasan a una inmersión de CH3OH con ácido ascórbico. El C2H5OH y NaOCl también fueron efectivos para desinfectar semilla de Agave parrasana (Santacruz et al., 1999) y A. victoriae–reginae (Martínez et al., 2003). El cloro es eficaz en la mayoría de las bacterias patógenas, pero es imprevisible contra hongos y virus (HRM, 1993); el cloro oxida el material celular (EPA, 1999). El C2H5OH actúa desnaturalizando las proteínas, disolviendo las capas lipídicas y como agente deshidratante; es letal para bacterias, irregular para hongos y virus e inocuo sobre esporas; al combinarlo tiene mayor acción germicida (Mateos, 2004).
Para una desinfección externa de la semilla García et al. (1994) remojaron semilla de Pinus pinea en C2H5OH al 70 % durante 2 min y HgCl al 0.3 % por 15 min. Se ha desinfectado con C2H5OH y HgCl en Pinus spp. (Tang y Ouyang, 1999).
Prueba de inóculo
A los 14 días después de la siembra, los únicos inóculos vivos fueron la semilla completa y primeras hojas verdaderas de plántulas germinadas in vitro. La semilla iniciaba el proceso de germinación. Los otros inóculos se necrosaron (DMS, P<0.05) (Cuadro 2).
La regeneración de plantas en especies forestales vía embriogénesis somática y organogénesis está progresando. Se ha obtenido la regeneración de órganos y embriones a partir de semilla en Abies alba (Schuller et al., 1989; 2000), A. fraseri (Guevin y Kirby, 1997), Acer pseudoplatanus (Grahsl et al., 1991), Picea abies, (Verhagen y Wann, 1989), P. sitchensis (Drake et al., 1997), Pinus pinea (García et al., 1994), P. radiata (Schestibratov et al., 2003), P. taeda (Tang y Ouyang, 1999; Niella y Rocha, 2004), Quercus glauca y Q. leucotrichophora (Purohit et al., 2002).
Los inóculos comúnmente usados para promover la regeneración de coníferas son ricos en almidón, como cotiledones, hipocótilos y embriones (Roca y Mroginski, 1991). En coníferas, la principal fuente de inóculo para la inducción de callo son embriones aislados de semilla, ya que poseen un potencial embriogénico mayor comparado con cualquier otra parte de la planta adulta. Grahsl et al. (1991) utilizaron hipocótilos aislados de semillas, y Schuller et al. (1989) embriones cortados longitudinal y transversalmente. Cotiledones de P. pinea se usaron para inducción de yemas (García et al., 1994). Pero los embriones aislados no fueron un buen inóculo en A. religiosa (DMS, P<0.05).
Sin embargo, se requiere seguir evaluando inóculos en estructuras de individuos adultos (David, 1987), que puedan ser valorados forestalmente y propagarse masivamente in vitro los individuos sobresalientes.
CONCLUSIONES
El mejor tratamiento para desinfectar la semilla de A. religiosa es sumergirla en H2O2 (3 % v/v) y agitar 24 h. Los mejores inóculos para la propagación in vitro fueron la semilla completa y en segundo lugar las primeras hojas primarias.
AGRADECIMIENTOS
A CONAFOR y CONACYT (CONAFOR–2002–C01–6181).
LITERATURA CITADA
ÁLVAREZ, D.; LAGUNA, G.; ROSAS, I. 1998, Macroscopic and microscopic symptoms in Abies religiosa exposed to ozone in a forest near Mexico City. Environ Pollut 103: 251–259. [ Links ]
ATSDR. 2004. Peroxide of hydrogen. Agency for Toxic Substances and Disease Registry Atlanta. http://www.atsdr.cdc.gov/. 30 mayo 2005. [ Links ]
BARNETT, J. P. 1998. Disinfecting seeds with hydrogen peroxide. http://www.sfws.auburn.edu/sfnmc/class/fy614/peroxide.html. 30 mayo 2005. [ Links ]
BOJORGES, S. J. A. 1990. Índice del sitio para Oyamel (Abies religiosa) en Zoquiapan. Tesis de Licenciatura. Universidad Autónoma Chapingo. México. 57 p. [ Links ]
DAVID, A. 1987. In vitro propagation of Gymnosperms. J.M. Bonga, D.J. Durzan (eds). Cell and Tissue Culture in Forestry. Dordrecht. Boston. pp: 72–109. [ Links ]
DRAKE P. M. W.; JOHN, A.; POWER, J. B.; DAVEY, M. R. 1997. Cytokinin pulse mediated shoot organogenesis from cotyledons of Sitka spruce and high frequency in vitro rooting of shoots. Plant Cell, Tissue Organ Cult. 50: 147–151. [ Links ]
DUMROESE, R. K.; JAMES, R. L.; WENNY, D. L.; GILLIGAN, C.J. 1988. Douglas–fir seed treatments: effects on seedborne organisms and germination. In: Landis, T.D. (ed). USDA For. Serv. Gen. Tech. Rep. RM–167. p. 155–160. [ Links ]
ELIZALDI, C. N. N. 1979. Uso de preservadores en árboles de Navidad (Abies religiosa). Tesis de Licenciatura. Universidad Autónoma Chapingo. México. 48 pp. [ Links ]
EPA. 1999. Desinfección con cloro. Environmental Protection Agency Washington, http://www.epa.gov/own/mtb/cs–99–062.pdf. 30 mayo 2005. [ Links ]
GARCÍA, F. L.; SERRANO, L.; PARDOS, J. A. 1994. In vitro shoot organogenesis from excised immature cotyledons and microcuttings production in Pine. Plant Cell, Tissue Organ Cult. 36: 135–140. [ Links ]
GRAHSL, A.; SCHMIDT, J.; WILHELM, E. 1991. Somatic embryogenesis and organogenesis of embryonic explants of Abies alba & Acer pseudoplatanus. In: Ahuja, M. (ed) Woody Plant Biotechnology. Plenum. New York: 201–203. [ Links ]
GUEVIN, T. G.; KIRBY, E. G. 1997. Induction of embryogenesis in cultured mature zygotic embryos of Abies fraseri. Plant Cell, Tissue Organ Cult. 49: 219–222. [ Links ]
GÓMEZ, G. R. 2003. Estado del conocimiento de Abies religiosa (HBK) Schl. et Cham). Tesis de Licenciatura. Universidad Autónoma Chapingo. México. 450 p. [ Links ]
HRM. 1993. Esterilización, desinfección, antisépticos y desinfectantes. Hospital Ramos Mejía. Arg. http://www.ramosmejia.org.ar. 30 mayo 2005. [ Links ]
IÁÑEZ, P. E. 1998. Metabolismo energético. Curso de microbiología general. Univ. Nal. del Nordeste. Arg. http://www.fai.unne.edu.ar/. 30 mayo 2005. [ Links ]
JAMES, R. L.; GENZ, D. 1981. Ponderosa pine seed treatments: effects on seed germination & disease incidence. Missoula. North. Reg. Report 81–16,13p. [ Links ]
MARTÍNEZ, M. 1953. Las Pináceas del estado de México. Dirección de Agricultura y Ganadería. México. pp: 47–57. [ Links ]
MARTÍNEZ, P. A.; Ortega, L. P.; Chávez, V. M.; Bye, R. 2003. Somatic embryogenesis and organogenesis of Agave victoriae–reginae. Plant Cell, Tissue Organ Cult. 74: 135–142. [ Links ]
MATEOS, P. F. 2004. Control de las poblaciones microbianas: Esterilización y desinfección. Univ. Salamanca. http://www.atl–gestion. 30 mayo 2005. [ Links ]
MURASHIGE, T.; SKOOG F. 1962. A revised medium for rapid growth and bioassays with tobacco cultures. Physiol. Plant. 15: 473–497. [ Links ]
NIELLA, F.; ROCHA, P. 2004. Factores que afectan la formación de brotes adventicios a partir de embriones maduros de Pinus taeda L. vía organogénesis. Univ. Nal. Misiones. Arg. s/p. 30 mayo 2005. [ Links ]
PUROHIT, V. K.; TAMTA, S.; CHANDRA, S.; VYAS, P.; PALNI, L. M. S.; NANDI, S. K. 2002. In vitro multiplication of Quercus leucotrichophora and Q. glauca. Plant Cell, Tissue Organ Cult. 69: 121–133. [ Links ]
RIOFRIO, M. 2004. Growing Peppers inthe HomeGarden. http://www.g6csy.net 30 mayo 2005. [ Links ]
ROCA, W. M.; MROGINSKI, L.A. 1991. Cultivo de Tejidos en la agricultura, Fundamentos y aplicaciones. Centro Internacional de Agricultura Tropical. Cali, Colombia. pp: 143–172. [ Links ]
SÁNCHEZ, Y. J. M. 2004. Producción de bioinsecticida a base de Bacillus thuringiensis. http://monografias.com/trabajos15/. 30 mayo 2005. [ Links ]
SANTACRUZ, R. F.; GUTIÉRREZ, P. H.; RODRÍGUEZ, G B. 1999. Efficient in vitro propagation of Agave parrasana. Plant Cell, Tissue Organ Cult. 56: 163–167. [ Links ]
SCHESTIBRATOV, K. A.; MIKHAILOV, R. V.; DOLGOV, S. V. 2003. Plantlet regeneration from subculturable nodular callus of Pinus radiata. Plant Cell, Tissue Organ Cult. 72: 139–146. [ Links ]
SCHULLER, A.; KIRCHNER, R.; REUTHER, G. 2000. Interaction of plant growth regulators and organic C and N components in the formation and maturation of Abies alba somatic embryos. Plant Cell, Tissue Organ Cult. 17: 53–58. [ Links ]
SCHULLER, A.; REUTHER, G.; GEIER, T. 1989. Somatic embryogenesis from seed explants of Abies alba. Plant Cell, Tissue Organ Cult. 60: 23–31. [ Links ]
TANG, W.; OUYANG, F. 1999. Plant regeneration via organogenesis from six families of loblolly pine. Plant Cell, Tissue Organ Cult. 58: 223–226. [ Links ]
VALENZUELA, H. T. 2001. Estimación del secuestro de carbono en bosques naturales de A. religiosa. Tesis. Universidad Autónoma Chapingo. México. 127 p. [ Links ]
VERHAGEN, S. A.; WANN, S.R. 1989. Norway spruce somatic embryogenesis: high–frequency initiation from light–cultured mature embryos. Plant Cell, Tissue Organ Cult. 16:103–111. [ Links ]














