Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista bio ciencias
versão On-line ISSN 2007-3380
Revista bio ciencias vol.10 Tepic 2023 Epub 22-Fev-2024
https://doi.org/10.15741/revbio.10.e1382
Artículo Original
Actividad Antagónica de Pseudomonas donghuensis y Bacillus subtilis para el manejo de fitopatógenos del “Damping off” del cultivo del chile.
1 Departamento de Parasitología. Universidad Autónoma Agraria Antonio Narro. Calzada Antonio Narro 1923, Buenavista, C.P. 25315, Saltillo, Coahuila, México.
2 Instituto Tecnológico Superior De El Mante. Carretera Federal Libre Mante-Ciudad Valles Km 6.7, Congregación Quintero, Tamaulipas; C. P. 89930, Tamaulipas, México.
3 Laboratorio de Microbiología Ambiental, Instituto de Investigaciones en Química y Biología. Universidad Michoacana de San Nicolás de Hidalgo. Avenida Francisco J Mujica S/N. Colonia Felicitas del Rio, C. P. 58000, Morelia, Michoacán, México.
Se evaluó la efectividad de Pseudomonas donghuensis y Bacillus subtilis para el control de Fusarium oxysporum y Pythium aphanidermatum causantes del ahogamiento de plántulas de chile en invernadero. Se comprobó su patogenicidad para ocasionar la enfermedad y se realizaron pruebas de antagonismo en placas con PDA enriquecido. Mediante la confrontación in vitro de estos fitopatógenos con tres cepas de Bacillus subtilis se comprobó que este esporulado inhibió en mayor o menor grado (39.35- 56.24 %) el crecimiento micelial de F. oxysporum, pero no tuvo efecto alguno para P. aphanidermatum, ningún Bacillus inhibió a este Oomycete, debido a su rápido crecimiento en la placa de cultivo (36 h de incubación). En contraste P. donghuensis inhibió en un 56 % el crecimiento de P. aphanidermatum, y no presentó efecto inhibitorio para F. oxysporum, por lo que la mezcla de ambos antagonistas pudiera tener potencial para el control de los problemas de ahogamiento ‘‘Damping off” causados por estos fitopatógenos.
KEY WORDS: Bacillus subtilis; Damping off; Fusarium oxysporum; Pseudomonas donghuensis; Pythium aphanidermatum.
ABSTRACT The effectiveness of the Bacillus subtilis and Pseudomonas donghuensis strains for the control of Fusarium oxysporum and Pythium aphanidermatum, which cause the drowning of chili seedlings in the greenhouse, was evaluated. Its pathogenicity to cause the disease was verified and antagonism tests were obtained in culture plates with enriched PDA. Through the in vitro confrontation of these phytopathogens with three strains of the species Bacillus subtilis, it was observed that this sporulate has the capacity to inhibit to a greater or lesser degree (39.35- 56.24 %) the mycelial growth of F. oxysporum, but not the from P. aphanidermatum, none of the Bacillus isolates used in this study had an effect in inhibiting this Oomycete, since it grew faster than the spore-forming bacteria, since P. aphanidermatum developed and grew to fill the culture plate in just 36 hours. On the other hand, P. donghuensis inhibited the growth of this last phytopathogen by 56 %, however, it did not present an inhibition effect against F. oxysporum, so it could be feasible to use mixtures of these two antagonists for the management of this disease and be able to control Damping off problems caused by these phytopathogens.
KEY WORDS: subtilis; Damping off; Fusarium oxysporum; Pseudomonas donghuensis; Pythium aphanidermatum
Introducción
Una de las enfermedades más común que afecta la producción plántula de chile en almácigos y en invernadero es conocida como “Damping off. Los fitopatógenos que la provocan son un complejo de hongos que incluyen a Fusarium spp, Rhizoctonia solani, y los oomycetos Pythium spp y Phytophthora capsici (González et al., 2013; Larios et al., 2019). Esta enfermedad se considera cosmopolita y una de las más importantes en plántulas, por ocasionar perdidas hasta del 100 %. Los daños por esta enfermedad se observan en etapa de preemergencia, postemergencia y en campo después del trasplante (Reveles-Hernández et al., 2010; Hernández- Hernández et al., 2018). Los síntomas de esta enfermedad son; pudrición de semillas, necrosamiento del hipocótilo, estrangulamiento necrótico en la base del tallo, pudrición de raíces, marchitez y la muerte de la plántula (Reveles-Hernández et al., 2010). Para su control los agricultores se basan principalmente aplicaciones de fungicidas químicos (Captan, Metalaxil, Azoxystrobin, entre otros), donde se reporta baja efectividad y resistencia de los fitopatógenos, además de toxicidad al hombre y contaminación ambiental (Castillo- Reyes et al., 2015; Hernández- Hernández et al., 2018; Larios et al., 2019).
Una opción de manejo alternativo de las enfermedades vegetales es el control biológico mediante la aplicación de microorganismos antagonistas (Hernández- Hernández et al., 2018; Larios et al., 2019), en los que se encuentran varias especies de Bacillus spp, Pseudomonas spp, Trichoderma spp, entre otros (Asaka & Shoda, 1996; Gravel et al., 2005), los cuales no son perjudiciales para la salud y el ambiente (Larios et al., 2019), ni causan resistencia (Espinoza-Ahumada et al., 2019). Estos microrganismos actúan por diferentes modos de acción, como lo son: parasitismo, competencia por espacio y nutrientes, síntesis de antibióticos o inducción de resistencia sistémica en las plantas (Chirino- Valle et al., 2016; Espinoza-Ahumada et al., 2019), además, algunos géneros son considerados como promotores del crecimiento vegetal (Sivasakthi et al., 2014). Entre las especies que destacan por su alta capacidad de producir compuestos antifúngicas de bajo peso molecular sobresale la especie Pseudomonas donghuensis la cual produce cinco veces más sideróforos que las demás especies, siendo esta especie una buena opción para el control de fitopatógenos (Gao et al., 2015), ya que ha demostrado poseer efecto antagónico en contra de diversos fitopatógenos (Ossowicki et al., 2017). Por lo anterior, este trabajo se realizó con el propósito de comprobar la efectividad de aislados bacterianos (Bacillus subtilis y P. donghuensis) capaces de inhibir el crecimiento de los agentes causantes del “Damping off” del chile, como una alternativa biológica para el manejo de esta enfermedad.
Material y Métodos
Ubicación del experimento
El trabajo de investigación se realizó en Laboratorio de Microbiología del Departamento de Parasitología Agrícola de la Universidad Autónoma Agraria Antonio Narro (UAAAN) ubicada en Calzada Antonio Narro 1923, Buenavista, 25315 Saltillo, Coahuila, México.
Material biológico
Las cepas de las bacterias antagonistas fueron proporcionadas por el cepario de Microbiología del Departamento de Parasitología de la UAAAN, las cuales consistieron en tres aislados del género Bacillus spp (B15, BITV y BIBT) y un aislado de Pseudomonas sp (Pd) recuperado de raíz de zacatón (Muhlenbergia macroura). Los aislados se reactivaron y purificaron en Agar nutritivo (AN) y se incubaron a 28 ± 2 °C por 72 h.
Los aislamientos de Bacillus spp y de Pseudomonas sp se identificaron molecularmente con base en la secuenciación del gen 16S del DNAr. Los genes se amplificaron con el usó de un termociclador Verity para PCR de punto final (Applied Biosystems) (Jang- Jih et al., 2000) en las instalaciones del Laboratorio Nacional de Biotecnología Agrícola, Médica y Ambiental (LANBAMA) ubicado en San Luis Potosí, México. Adicionalmente las especies ya habían sido caracterizadas morfológicamente al microscópio compuesto y por pruebas bioquímicas.
El aislamiento de los fitopatógenos se realizó de muestras de plántulas de chile serrano de 30 días de cultivo, con síntomas de “Damping off” y procedentes de invernaderos de la región agrícola de Parras de la Fuente, Coahuila, México, durante el verano del año 2019. Para el aislamiento de los hongos fitopatógenos, se eliminó los residuos de sustrato del cepellón, se lavó la planta completa con agua potable en condiciones asépticas, se cortaron pequeños trozos de raíces y tallos con bisturí estéril y se desinfectaron en una solución de NaClO al 1 % por 3 min, se lavó por tres ocasiones con agua destilada estéril por 1.30 min y se dejó secar dentro de una campana de flujo laminar sobre papel estraza estéril. Una vez secos se transfirieron a cajas Petri con Medio de cultivo Papa-Dextrosa-Agar (PDA) o V8-Agar (V8-A) y se incubaron a 26 ± 2 °C por 3 días, al observar crecimiento de micelio, este se transfirió a Agar Agua (AA) por 48 horas y se purifico por punta de hifa en cajas Petri con PDA y V8-A.
Prueba de patogenicidad
Se utilizó la técnica empleada por Sánchez et al. (1975) y modificada por Espinoza-Ahumada et al. (2019), para ello se germinaron en medio AA 50 semillas de chile hibrido Platino, que se desinfectaron por 3 min en una solución de NaClO al 1 % y lavaron en agua destilada estéril en tres ocasiones. A los 5 días después de la siembra, una vez que desarrollaron el hipocótilo, se transfirieron en grupos de tres semillas a cajas Petri con medio de cultivo AA, cuando se observó el desarrollo de raíz y cotiledones (dos días después), se inoculó en el centro de las cajas Petri un explante de cultivo de 3 mm de diámetro con micelio del fitopatógeno purificado. Las cajas Petri se incubaron a 26 ± 2°C con un fotoperiodo de 12:12 (luz: obscuridad). Para determinar la patogenicidad se evaluó la mortalidad de las plántulas, por nueve días, para ello se utilizó una escala visual de severidad descrita por Apodaca et al. (2004) con modificaciones, donde; 0 = sin síntomas planta sana, 1 = puntos pequeños necróticos en la raíz o en cotiledones, 2 = necrosamiento en la base de la raíz, 3 = raíz necrosada hasta en un 50 %, 4 = raíz o planta completamente necrosada. Los datos obtenidos se analizaron a través de un análisis de varianza (ANOVA) para estratificar los tratamientos a través de una comparación de medias por Tukey (p ≤ 0.05) y bajo un diseño completamente al azar con dos tratamientos (1 = Pythium aphanidermatum, 2 = Fusarium oxysporum), un testigo absoluto y tres repeticiones.
Determinación del antagonismo In vitro
Este se realizó mediante la técnica de confrontación dual entre antagonista y fitopatógeno en placas con Agar Nutritivo Caldo de Papa (ANCP), para ello las cajas fueron marcadas en cuatro puntos equidistantes cardinales, en cada uno se colocó una asada de cada cepa antagonista, después de 24 o 72 horas se colocó un explante en forma de disco con micelio de cada fitopatógeno por separado y se incubaron a 26 ± 2 °C, hasta que el micelio del testigo lleno por completo la caja de cultivo. El experimento se realizó bajo un diseño completamente al azar con 4 tratamientos (B15, BITV, BIBT y Pd) y un testigo, con 4 repeticiones por tratamiento para cada fitopatógeno (Fusarium y Pythium). Se midió el crecimiento radial del fitopatógeno (mm) en confrontación con cada cepa bacteriana, este se transformó a porcentaje de inhibición (%I), usando la formula %I= (C-T)/Cx100 descrita por Castillo- Reyes et al. (2015), donde C es el diámetro del testigo y T es el tratamiento. Los datos se sometieron a un análisis de varianza (ANVA) y una prueba de comparación de medias de Tukey (p ≤ 0.05), con el programa estadístico InfoStat versión 2019.1.2.0.
Resultados y Discusión
Identificación y caracterización de Bacillus spp y Pseudomonas sp
Las especies bacterianas se identificaron con base a su secuenciación del gen 16S del rRNA. Las especies del género Bacillus denominadas B15, BITV y BIBT mostraron una similitud del 91.91, 98.36 y 96.15 % con la especie B. subtilis con claves de acceso al genbank de MK616213.1, MH619505.1 y KY010584.1 respectivamente. Aunque la cepa B15 coincide con un porcentaje del 91.91 % con la especie B. subtilis este porcentaje se considera bajo, además, esta cepa en estudios anteriores presentó un porcentaje más alto (94.12 %) de similitud con la especie Bacillus pumilus al realizársele pruebas morfológicas y bioquímicas (Ordaz, 2004), por lo que la identificación morfológica y bioquímica es más aceptable. Las tres cepas (B15, BITV y BIBT) presentaron forma típica de bacilo doble con producción de endospora (Figura 1A, B y C), tinción Gram+ y catalasa positiva (Sosa et al., 2005).
Por su parte la bacteria del género Pseudomonas mostró una similitud de un 96.12 % con la especie Pseudomonas donghuensis con clave de acceso MK883145.1. Dicha bacteria aislada de raíz de M. macroura y por siembra en estría en Agar fosfatos (NBRIP) (Flores et al., 2014) presentó formación de colonia amarilla translucida característica del género Pseudomonas spp. Al inicio el aislamiento presentó irregularidad para solubilizar el fosfato tricalcico. Esta bacteria se presentó en forma de bacilo vegetativo individual o en pares, no esporulada (Figura 1D), Gram- (Figura 1E) con flagelos polares y catalasa positiva. En AN a las 48h de incubación sus colonias generan un pigmento amarillo (Figura 1F), mientras en medio King B no producen fluorescencia y sus colonias muestran bordes irregulares. Gao et al. (2012) reportaron por primera vez a esta especie de Pseudomonas la cual denominaron como Pseudomonas HYS, posteriormente, Gao et al. (2015) la clasificaron como una nueva especie la cual denominaron P. donghuensis aislada de agua del Lago Donghu de Wuhan en China, otros investigadores reportan su aislamiento de la rizosfera de tomate (Ossowicki et al., 2017), algodón (Tao et al., 2020) y suelo agrícola (Ágaras et al., 2018). Las características presentadas por P. donghuensis aislada en esta investigación son similares a las descritas por Ágaras et al. (2018) para la especie P. donghuensis SVBP6, pero diferentes a las reportadas por Gao et al. (2015) los cuales señalan que P. donghuensis HYS desarrolla fluorescencia en agar King A y B, mientras que nuestra cepa no produjo florescencia en medio King B al igual que la reportada por Ágaras et al. (2018).
Identificación de las especies causantes de “Damping off”
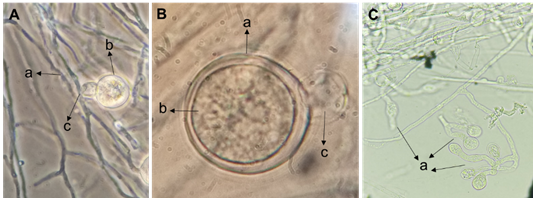
De las plántulas de chile se aisló un hongo y un oomyceto responsables de “Damping off”. El hongo fitopatógeno mostró hifas septadas, clamidosporas globosas (Figura 2Aa), fialides cortas (Figura 2Ab) donde se insertan microconidias bicelulares en forma de riñón (Figura 2Ba), macroconidias curvas en forma de canoa de tres (Figura 2Bb y Cb) o cuatro septas (Figura 2Ca), con célula pie (Figura 2Bc), además de la formación de esporodoquio (Figura 2D). Estas características morfológicas microscópicas observadas correspondieron al género F. oxysporum según las claves taxonómicas especializadas de Leslie y Summerell (2006).
La identificación y reporte del oomyceto correspondió a Pythium aphanidermatum, dicho trabajo se publicó anteriormente a esta investigación y se reporta como una cepa agresiva y de crecimiento rápido para provocar “Damping off” (Jiménez-Pérez et al., 2022). Se comprobó que las hifas fueron toruloides cenocíticas (Figura 3Aa), oogonios terminales esféricos lisos (Figura 3Aa, Ba), oósporas apleroticas (Figura 3Bb), anteridios diclinos o monoclinos (Figura 3Ac, Bc), y esporangios filamentosos e irregulares (Figura 3Ca), tal y como se observan en la Figura 3 (Van der Plaats-Niterink, 1981; Watanabe, 2010; Jiménez-Pérez et al., 2022).
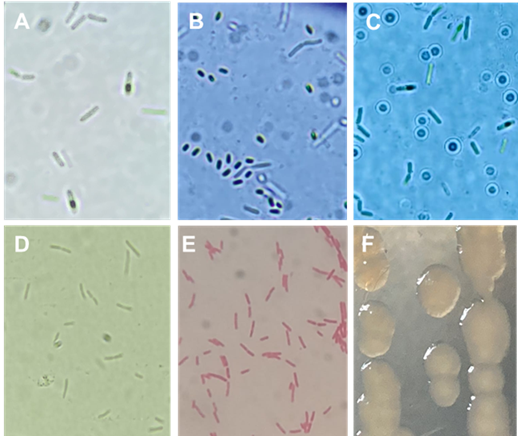
Figura 1 Características morfológicas de Bacillus subtilis y Pseudomonas donghuensis. A, B y C) células vegetativas y producción de endoesporas de B. subtilis (A- B15, B- BITV y C- BIBT). D) P. donghuensis células vegetativas, B) tinción Gram. C) colonia bacteriana en medio de cultivo AN.
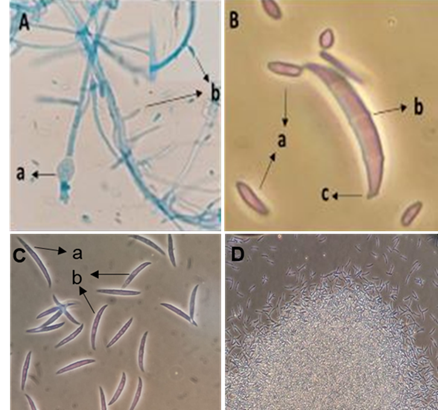
Figura 2 Observación microscópica de Fusarium oxysporum. A) a- Clamidospora globosa y b- Fialides, B) a- Microconidias, b- Macroconidia de 3 septos y c- célula pie. C) a- Macroconidias de 4 septos y b- de 3 septos. D) Esporodoquio.
Prueba patogenicidad
En la prueba de patogenicidad, las plántulas chile inoculadas con explante de cultivo con micelio de F. oxysporum (Figura 4B) a los cuatro ddi causaron puntos necróticos en la raíz, que se desarrollaron y crecieron hasta necrosar por completo las plántulas a los nueve ddi, además, se detectó crecimiento abundante de micelio blanco que cubría por completo a las plántulas, por lo cual ocasiono el 100 % de la mortalidad de las plántulas (Figura 4E). En plántulas de chile inoculadas con P. aphanidermatum (Figura 4C), a los tres ddi mostraron necrosis, raíces colonizadas por micelio, los cotiledones con manchas necróticas y a los cinco ddi las plántulas mostraron abundante crecimiento de micelio, ocasionando el 100 % de la mortalidad de las plántulas (Figura 4F). En testigos se observó crecimiento de raíz, tallo y cotiledones normal, sin signos o síntomas de necrosis (Figura 4A-D). De acuerdo a la escala de severidad de Apodaca et al. (2004) el nivel de daño observado en los cotiledones, hipocótilo y raíz de las plántulas inoculadas con P. aphanidermatum y F. oxysporum es del más alto nivel (4), ya que fueron causantes la muerte de las plántulas, mientras que en los testigos no hubo daños. Por ello se comprueba que las especies P. aphanidermatum y F. oxysporum fueron agentes causales del “Damping off” y muerte de plántulas de chile.
Los resultados de este estudio coinciden con los reportes de otros autores, sobre la capacidad de estos fitopatógenos para causar “Damping off”, como Gravel et al. (2005) que reportaron a P. aphanidermatum y P. ultimum como agentes etiológicos del “Damping off” y pudrición de semillas en plántulas de tomate, al igual que González et al. (2013), que reportan a los fitopatógenos Pythium y Fusarium en almácigos de tomate. Mientras que Sánchez et al. (2015) reportan a F. oxysporum como agente causal del “Damping off” en almácigos de cebollas. De manera similar Rivera-Jiménez et al. (2018) reportaron que F. oxysporum causó la muerte de un 49.54 % de plántulas de chile poblano en 30 días de la prueba en condiciones de invernadero, en contraste con este trabajo que se realizó en condiciones in vitro y donde provocó una mayor mortalidad de plántulas en menor tiempo (9ddi).
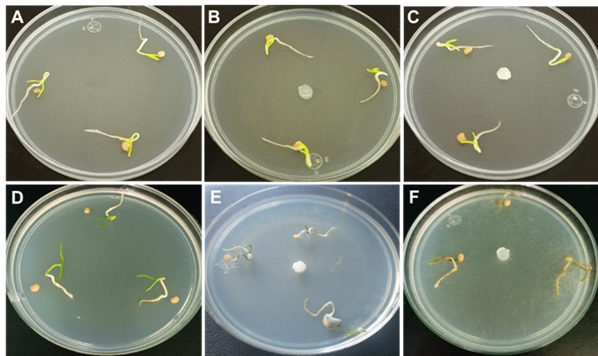
Figura 4 Prueba de patogenicidad. A) Tratamiento testigo. B) Tratamiento inoculado con F. oxysporum. C) Tratamiento inoculado con P. aphanidermatum. D) Tratamiento testigo a los nueve ddi. E) Tratamiento inoculado con F. oxysporum a los nueve ddi. F) Tratamiento inoculados con P. aphanidermatum a los cinco ddi.
Determinación del antagonismo In vitro
En las confrontaciones de F. oxysporum con cepas de Bacillus subtilis y P. donghuensis, se encontró diferencia estadística significativa (p ≤ 0,05) en el porcentaje de inhibición. Todas las cepas de Bacillus mostraron capacidad inhibitoria, siendo B. subtilis (BITV) la de mayor eficiencia para inhibir el crecimiento micelial de F. oxysporum, en un 56.24 % (Fig. 5- C), seguida de B. subtilis (BIBT) con 49.62 % (Figura 5A) y el aislado de B. subtilis (B15) con la menor inhibición (39.35 %) (Figura 5B). La cepa de P. donghuensis (Pd) no inhibió el crecimiento de F. oxysporum (Figura 5D) durante los seis días que duró el experimento, tiempo que tardo el testigo en crecer en toda la placa de cultivo (Figura 5E) (Tabla 1).
Tabla 1 Porcentaje de inhibición in vitro de los tratamientos contra Fusarium oxysporum a los seis días de la confrontación.
| Tratamientos | ||
|---|---|---|
| Cepa | Clave | Medias |
| Bacillus subtilis | BITV | 56.24A |
| Bacillus subtilis | BIBT | 49.62B |
| Bacillus subtilis | B15 | 39.35C |
| Pseudomonas donghuensis | Pd | 0.00D |
| Testigo | Testigo | 0.00D |
*Medias con una letra en común no son significativamente diferentes (p > 0.05).
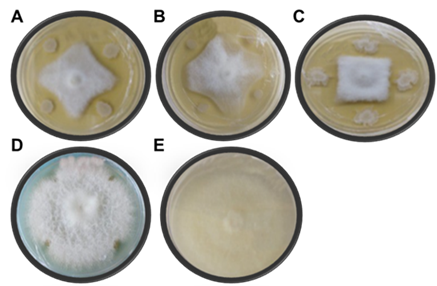
Figura 5 Antagonismo in vitro de las diferentes cepas de Bacillus spp., en contra de F. oxysporum a los seis días de confrontación en comparación con el testigo. A) BIBT, B) B15, C) BITV, D) Pd. y E) Testigo.
Para las confrontaciones contra P. aphanidermatum los tratamientos se realizaron 72 horas antes de inocular el fitopatógeno, pues este oomiceto mostró un crecimiento micelial muy rápido al desarrollarse en toda la caja de cultivo en solo 32 horas de incubación (Figura 6E). A diferencia del ensayo de F. oxysporum ninguna de las cepas de B. subtilis mostró inhibición contra este oomyceto (Figura 6A-C), solo la cepa de P. donghuensis inhibió en un 56 % el crecimiento micelial del P. aphanidermatum (Figura 6D) (Tabla 2).
Tabla 2 Porcentaje de inhibición in vitro de los diferentes tratamientos contra Pythium aphanidermatum a las 32 horas de la confrontación.
| Tratamientos | ||
|---|---|---|
| Cepa | Clave | Medias |
| Pseudomonas donghuensis | Pd | 56.00A |
| Bacillus subtilis | BITV | 0.00B |
| Bacillus subtilis | BIBT | 0.00B |
| Bacillus subtilis | B15 | 0.00B |
| Testigo | Testigo | 0.00D |
*Medias con una letra en común no son significativamente diferentes (p > 0.05).
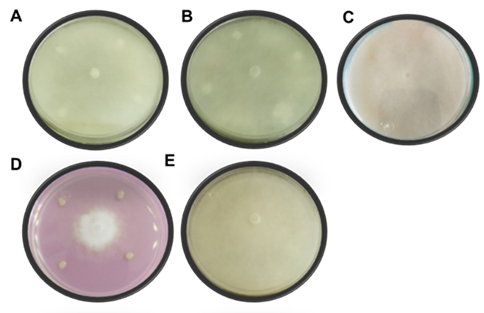
Figura 6 Antagonismo in vitro de las diferentes cepas contra P. aphanidermatum a las 32 horas después de la confrontación. A) BIBT, B) BITV, C) B15, D) Pd, y E) Testigo.
Existen diversos estudios que demuestran la capacidad antagónica del género B. subtilis en contra de diversos fitopatógenos, por ejemplo, Mejía- Bautista et al. (2016) reportan rangos de inhibición variados (21.28- 71.70 %) en contra de dos cepas de Fusarium (F. equiseti y F. solani) en confrontación con 10 cepas de Bacillus spp (4- B. subtilis, 1- B. cerus, 1- B. amyloliquefaciens y 4- Bacillus spp) siendo las cepas de B. subtilis CBMT51 y CBRF8 las de mayor actividad inhibitoria con porcentajes de inhibición del 71.70 % y 69.92 % en contra de F. equiseti y F. solani respectivamente, mientras que en esta investigación se obtuvieron rangos de inhibición del 39.35 al 56.24 % con las tres cepas de Bacillus en contra de F. oxysporum. Khedher et al. (2020) reportaron la inhibición de F. oxysporum del 54.7 % utilizando a B. subtilis, siendo este resultado similar al obtenido en este trabajo (56.24 %) utilizando la cepa de B. subtilis (BITV). Por su parte Sosa et al. (2005) confrontando 17 cepas de Bacillus spp, demostraron su capacidad inhibitoria en contra de diversos fitopatógenos, siendo P. aphanidermatum uno de ellos, contrastando con nuestra investigación donde ninguna de las tres cepas de Bacillus logro inhibir al oomyceto a las 32 h que duro el experimento a diferencia del trabajo de Sosa et al. (2005) el cual la cepa de P. aphanidermatum presento un crecimiento lento de 72 h para llenar la caja Petri. Algunos autores mencionan que la inhibición generada por Bacillus spp se debe a la capacidad de síntesis de algunos antibioticos (Iturina A y surfactina) y enzimas líticas (Asaka & Shoda, 1996; Sosa et al., 2005)
Los resultados obtenidos con P. donghuensis respaldan lo propuesto por Gao et al. (2015) quienes sugieren a esta especie como candidata para control biológico por su alta capacidad de síntesis de sideroforos, la cual es mayor que otras cepas (Gao et al., 2012). Existen reportes del antagonismo de P. donghuensis en contra de algunos fitopatógenos, por ejemplo, Ossowicki et al. (2017) reportan la inhibición del crecimiento de Rhizoctonia solani, Fusarium culmorum, Verticillium dahliae y Pythium ultimum con la cepa de P. donghuensis P482. Esta misma cepa (P482) también demostró tener efectividad contra bacterias como; Dickeya solani y Pseudomonas syringae pv. syringae (Matuszewska et al., 2021). Tao et al. (2020) inhibieron a V. dahliae con la cepa P. donghuensis 22G5. De manera similar, Muzio et al. (2020) reportaron la inhibición de Macrophomina phaseolina por P. donghuensis SVBP6. Los autores citados atribuyen la capacidad antagonista de P. donghuensis a su alta capacidad de síntesis sideroforos especialmente del 7-hidroxitropolona un sideróforo no fluorescente, no reportado en otras especies de Pseudomonas. En la actualidad aún son pocos los estudios realizados con esta especie de Pseudomonas en contra de hongos fitopatógenos, teniéndose solamente reportes con las cepas mencionadas anteriormente denominadas P482, 22G5 y SVBP6, tal es el caso que en la actualidad no se encuentran resultados de una cepa de P. donghuensis capaz de inhibir a P. aphanidermatum y sin actividad inhibitoria en contra de F. oxysporum como se demostrado en este trabajo.
Conclusiones
Se confirma como agentes causales de “Damping off” a los géneros F. oxysporum y P. aphanidermatum aislados de plántulas de chile con síntomas de la enfermedad y comprobada su patogenicidad.
El efecto inhibitorio de las bacterias antagónicas depende de la especie y del tipo de fitopatógeno contra el que se confronte, ya que los aislamientos de B. subtilis tuvieron la capacidad de inhibir el crecimiento micelial de Fusarium, pero no el de Pythium, y en contraste P. donghuensis que inhibió al oomyceto, pero no al deuteromyceto. Debido a lo cual para futuros experimentos se proyecta usar mezclas de ambos antagonistas formulados para un control más eficiente del “Damping off”.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el apoyo económico otorgado para realizar los estudios de posgrado.
REFERENCIAS
Ágaras, B. C., Iriarte, A., & Valverde, C. F. (2018). Genomic insights into the broad antifungal activity, plant-probiotic properties, and their regulation, in Pseudomonas donghuensisstrain SVBP6. PLOS ONE, 13(3), e0194088. https://doi.org/10.1371/journal.pone.0194088 [ Links ]
Apodaca, S. M. A., Zavaleta M. E., Osada K. S., García, E. R., & Valenzuela, U. J. G. (2004). Pudrición de la corona del chile (Capsicum annuum L.) en Sinaloa, México.Revista Mexicana de Fitopatología, 22(1), 22-29. http://www.redalyc.org/articulo.oa?id=61222104 [ Links ]
Asaka, O., & Shoda, M. (1996). Biocontrol of Rhizoctonia solani damping-off of tomato with Bacillus subtilis RB14. Applied and Environmental Microbiology, 62(11), 4081-4085. https://doi.org/10.1128/aem.62.11.4081-4085.1996 [ Links ]
Castillo-Reyes, F., Hernández-Castillo, F. D., Gallegos-Morales, G., Flores-Olivas, A., Rodríguez-Herrera, R., & Aguilar, C. N. (2015). Efectividad in vitro de Bacillus y polifenoles de plantas nativas de México sobre Rhizoctonia Solani.Revista Mexicana de Ciencias Agrícolas, 6(3), 549-562.https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007093420150003 00009&lng=es&tlng=es [ Links ]
Chirino- Valle. I., Kandula, D., Littejohn, C., Hill, R., Wlaker, M. Shields, M., Cummings, N., Heittiarachchi, D. & Wratten, S. (2016). Potential of the beneficial fungus Trichoderma to enhance ecosystem-services provision in the biofuel grass Miscanthus x giganteus in agriculture. Scientific Reports, 6(25109), 1-8. https://doi.org/10.1038/srep25109 [ Links ]
Espinoza-Ahumada, C. A., Gallegos-Morales, G. , Ochoa-Fuentes, Y. M., Hernández-Castillo, F. D. , Méndez-Aguilar, R., & Rodríguez-Guerra, R. (2019). Antagonistas microbianos para biocontrol de la marchitez y su efecto promotor en el rendimiento de chile serrano. Revista Mexicana de Ciencias Agrícolas , 10(23), 187-197. https://doi.org/10.29312/ remexca . v0i 23. 2020 [ Links ]
Flores, G. A. C., González, V. V. M., Aguilar, G. C. N., & Herrera, R. R. (2014). Biofertilizantes microbianos. Plaza y Valdés, S.A de C.V., 1, 139- 162. [ Links ]
Gao, J., Yu, X., & Xie, Z. (2012). Draft genome sequence of high-siderophore-yielding Pseudomonas sp. strain HYS. Journal of Bacteriology, 194, 4121-4121. https://doi.org/10.1128/JB.00688-12 [ Links ]
Gao, J., Xie, G., Peng, F., & Xie, Z. (2015).Pseudomonas donghuensissp. nov., exhibiting high-yields of siderophore. Antonie van Leeuwenhoek, 107, 83-94. https://doi.org/10. 1007/ s10 482-014-0306-1 [ Links ]
González, A. A., Mateos R. R. A., López M. M., Hernández S. M. de la L., & González C. A. (2013). Alternativas para el manejo de Damping off en plántulas de tomate Lycopersicum esculentum Mill (L, 1753) (Solanales: Solanaceae). Revista Biológico Agropecuaria Tuxpan, 1(1), 1-10. https://doi.org/10.47808/revistabioagro.v1i1.211 [ Links ]
Gravel, V., Martinez, C., Antoun, H., & Tweddell, R. J. (2005). Antagonist microorganisms with the ability to control Pythium Damping-off of tomato seeds in rockwool.BioControl, 50(5), 771-786. https://doi.org/10.1007/s10526-005-1312-z [ Links ]
Hernández-Hernández, E. J., Hernández-Ríos, I., Almaraz-Suarez, J. J., López-López, A., Torres-Aquino, M., & Morales F. F. J. (2018). Caracterización in vitro de rizobacterias y su antagonismo con hongos causantes del damping off en chile. Revista Mexicana de Ciencias Agrícolas,9(3), 525-537. https://doi.org/10.29312/remexca.v9i3.335 [ Links ]
Jang- Jih, L., Cherng-Lih, P., Shih- Yi, L., & Chih-Chieng, W. (2000). Use of PCR with universal primers and restriction endonuclease digestions for detection and identification of common bacterial pathogens in cerebrospinal fluid. Journal of Clinical Microbiology, 38(6), 2076-2080. https://doi.org/10.1128/JCM.38.6.2076-2080.2000 [ Links ]
Jiménez-Pérez, O., Gallegos-Morales, G. , Hernández-Castillo, F. D. , Cepeda-Siller, M., & Espinoza-Ahumada, C. A. (2022). Characterization and pathogenicity of a Pythium aphanidermatum isolate causing ‘damping off’ in pepper seedlings. Mexican Journal of Phytopathology, 40(1), 116- 130. https://doi.org/10.18781/R.MEX.FIT.2109-3 [ Links ]
Khedher, S. B., Mejdoub-Trabelsi, B., & Tounsi, S. (2020). Biological potential of Bacillus subtilis V26 for the control of Fusarium wilt and tuber dry rot on potato caused by Fusarium species and the promotion of plant growth. Biological Control, 152, 104444. https://doi.org/10.1016/j.biocontrol.2020.104444 [ Links ]
Larios, L. E. J., Valdovinos, N. J. J. W., Chan, C. W., García, L. F. A., Manzo, S. G., & Buenrostro, N. M. T. (2019). Biocontrol de Damping off y promoción del crecimiento vegetativo en plantas de Capsicum chinense (Jacq) con Trichoderma spp.Revista Mexicana de Ciencias Agrícolas,10(3), 471-483. https://dx.doi.org/10.29312/remexca.v10i3.332 [ Links ]
Leslie, J. F., & Summerell, B. A. (2006). The Fusarium burkinafaso. Laboratory manual. Blackwell Publishing, State Avenue, Ames, Iowa, 212- 218. [ Links ]
Matuszewska, M., Maciąg, T., Rajewska, M., Wierzbicka, A., & Jafra, S. (2021). The carbon source-dependent pattern of antimicrobial activity and gene expression in Pseudomonas donghuensis P482. Scientific Reports, 11(10994). https://doi.org/10.1038/s41598-021-90488-w [ Links ]
Mejía- Bautista, M. Á., Reyes- Ramírez, A., Cristóbal- Alejo, J., Tun- Suárez, J. M., Borges- Gómez, L. C., & Pacheco- Aguilar, J. R. (2016). Bacillus spp. in the Control of Wilt Caused by Fusarium spp. in Capsicum chinense. Revista Mexicana de Fitopatología, 34(3), 208-222. https://doi.org/10.18781/R.MEX.FIT.1603-1 [ Links ]
Muzio, F. M., Agaras, B. C., Masi, M., Tuzi, A., Evidente, A., & Valverde, C. (2020). 7-hydroxytropolone is the main metabolite responsible for the fungal antagonism of Pseudomonas donghuensis strain SVBP6. Environmental Microbiology. 22(7), 2550-2563. https://doi.org/10.1111/1462-2920.14925 [ Links ]
Ordaz, S. S. (2004). Control Microbiano mediante bacterias esporuladas de la costra negra de la papa (Rhizoctonia solani Kühn) en invernadero. Tesis de Licenciatura, Universidad Autónoma Agraria Antonio Narro. [ Links ]
Ossowicki A., Jafra S., & Garbeva P. (2017). The antimicrobial volatile power of the rhizospheric isolate Pseudomonas donghuensis P482. PLOS ONE 12(3), e0174362. https://doi.org/10.1371/journal.pone.0174362 [ Links ]
Reveles-Hernández, M., Huchín-Alarcón, S., Velásquez-Valle, R., Trejo-Calzada, R., & Ruíz-Torres, J. (2010). Producción de plántula de chile en invernadero. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Campo Experimental Valle del Guadiana. Folleto Tecnico Núm. 41. CIRNOC- INIFAP, 40. https://hopelchen. tec nm .mx/ prin cip al/ sylabus/fpdb/recursos/r125647.PDF [ Links ]
Rivera-Jiménez, M. N., Zavaleta-Mancera, H.A., Rebollar-Alviter, A., Aguilar-Rincón, V.H., García-de-los-Santos, G., Vaquera-Huerta, H., & Silva-Rojas, H.V. (2018). Phylogenetics and histology provide insight into damping-off infections of ‘Poblano’ pepper seedlings caused by Fusarium wilt in greenhouses.Mycological Progress, 17(11), 1237-1249. https://doi.org/10.1007/s11557-018-1441-2 [ Links ]
Sánchez, L. E., Endo, R. M., & Leary, J. V. (1975). A rapid technique for identifyng the clones of Fusarium oxysporum f. sp. lycopersici causing crown and root rot of tomato. Phytopathology. 65(6):726-727.https://www.apsnet.org/publications/phytopathology/backissues/Documents/1975Articles/Phyto65n06_726.PDF [ Links ]
Sánchez, A. D., Barrera, V., Reybet, G. E., & Sosa, M. C. (2015). Biocontrol con Trichoderma spp. de Fusarium oxysporum causal del “mal de almácigos” en pre y post emergencia en cebolla. Revista de la Facultad de Agronomía, La Plata, 114 (1), 61-70. http://sedici.unlp.edu.ar/handle/10915/47308 [ Links ]
Sivasakthi, S., Usharani, G., & Saranraj, P. (2014). Biocontrol potentiality of plant growth promoting bacteria (PGPR)-Pseudomonas fluorescens and Bacillus subtilis: A review.African Journal of Agricultural Research, 9(16), 1265-1277. http://www.labamerex.com /images/ nov028 / 2014-Biocontrol-Potencialidad-de-Bacillus-Pseudomonas.pdf [ Links ]
Sosa, L. A. I., Pazos, V., & Torres, D. (2005). Aislamiento y selección de bacterias pertenecientes al género Bacillus con potencialidades para el control biológico en semilleros de tabaco. Centro Agrícola, 32 (3), 25-29. http://cagricola.uclv.edu.cu/descargas/pdf/V32-Numero_3/ cag05 3051434.pdf [ Links ]
Tao, X., Zhang, H., Gao, M., Li, M., Zhao T., & Guan, X. (2020). Pseudomonas species isolated via high-throughput screening significantly protect cotton plants against Verticillium wilt. AMB Express, 10(193), 1-12. https://doi.org/10.1186/s13568-020-01132-1 [ Links ]
Watanabe, T. (2010). Pictorial atlas of soil and seed fungi: morphologies of cultured fungi and key to species. Third edition. CRC Press Taylor & Francis, Gruop Boca Raton London New York, 26-68. https://doi.org/10.1201/EBK1439804193 [ Links ]
Van der Plaats-Niterink, A. J. (1981). Monograph of the Genus Pythium. Studies in Mycology,(21). https://www.studiesinmycology.org/sim/Sim21/full%20text.htm [ Links ]
Recibido: 18 de Julio de 2022; Aprobado: 11 de Enero de 2023; Publicado: 12 de Febrero de 2023











 texto em
texto em