Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.7 Tepic 2020 Epub Nov 18, 2020
https://doi.org/10.15741/revbio.07.e796
Artículos originales
Almacenamiento postcosecha de frutos: Alternativa para mejorar la calidad fisiológica de semillas de chile habanero
1Tecnológico Nacional de México/Instituto Tecnológico de Conkal, Avenida Tecnológico s/n, C.P. 97345, Conkal, Yucatán, México.
2Catedrático CONACYT-Instituto Tecnológico de Conkal, Avenida Tecnológico s/n, C.P. 97345 Conkal, Yucatán, México.
3Catedrático CONACYT-Centro de Investigación y de Estudios Avanzados del IPN, Unidad Mérida, Antigua carretera a Progreso Km 6, Cordemex, Loma Bonita Xcumpich, C.P. 97310 Mérida, Yucatán, México.
4Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias, Campo Experimental Mocochá, km 25 antigua carretera Mérida-Motul, C.P. 97454, Mocochá, Yucatán, México.
Uno de los principales problemas del chile habanero (Capsicum chinense) es la heterogeneidad en la germinación, esto podría deberse a semillas de baja calidad, inmaduras fisiológicamente al momento de ser extraídas del fruto. El objetivo de este estudio fue determinar el efecto del almacenamiento postcosecha de frutos sobre la germinación de semillas obtenidas en diferentes estados de maduración. Se cosecharon frutos verdes (UR), pintos (HR) y maduros (R), que se almacenaron durante 7 y 14 días antes de extraerles las semillas, el testigo no se almacenó. Se evaluó porcentaje (%G) y tasa de germinación (GR), porcentaje (%E) y tasa de emergencia (ER), conductividad eléctrica (EC), longitud radicular (RL) y tasa de crecimiento relativo de radícula (RGRRL). El almacenamiento postcosecha de los frutos durante 14 días incrementó el porcentaje de germinación (R14 = 98 %, HR14 = 94 % y UR14 = 91 %), la emergencia (R14 = 98 %, HR14 = 88 % y UR14 = 94 %) y la tasa de germinación (R14 = 19.22, HR14 = 20.08 y UR14 = 17.59 germinadas/día). La tasa de emergencia más alta fue en R14 y UR14 (13.93 y 12.67 plántulas/día, respectivamente). A los 7 días después de la siembra las raíces de R14 (3.8 cm) fueron las más largas. El almacenamiento de frutos durante 14 días disminuyó la EC de la solución donde se embebieron las semillas (UR14 = 0.6, HR14 = 0.6 y R14 = 0.6 µS mL-1). Cosechar frutos inmaduros (verdes o pintos) y almacenarlos durante 14 días mejoró los atributos fisiológicos de las semillas de chile habanero.
Palabras clave: Capsicum chinense; calidad fisiológica; conductividad eléctrica; emergencia de plántulas; germinación
A heterogeneous germination is one of the main problems in habanero pepper (Capsicum chinense) cultivation, this could be due to poor quality seeds, physiologically immature at the time of being extracted from the fruit. The aim of this study was to determine the effect of post-harvest storage of fruits on the germination of seeds obtained at different ripening stages of fruits. Thus, unripe (green color = UR), half ripe (half green and half orange=HR) and ripe (orange color = R) fruits were harvested and stored during 7 and 14 days before extracting the seeds, control fruits were not stored. The parameters evaluated were: germination (%G) and germination rate (GR), emergence (%E) and emergence rate (ER), electrical conductivity (EC), root length (RL) and relative growth rate of root length (RGRRL). The post-harvest storage of fruits during 14 days increased seeds germination (R14 = 98 %, HR14 = 94 % and UR14 = 91 %), seedlings emergence (R14 = 98%, HR14 = 88% and UR14 = 94%) and germination rate (R14 = 19.22, HR14 = 20.08 and UR14 = 17.59 germinated/ day). The highest emergence rate was both in R14 and in UR14 (13.93 and 12.67 seedlings/day, respectively). At 7 days after sowing, roots of R14 (3.8 cm) were the longest. The storage of fruits during 14 days decreased the EC of the solution where seeds were soaked (UR14 = 0.6, HR14 = 0.6 and R14 = 0.6 μS mL-1). Therefore, harvesting both unripe and half-ripe fruits with an after storage during 14 days improved the physiological attributes of habanero pepper seeds.
Key words: Capsicum chinense; physiological quality; electrical conductivity; seedlings emergence; germination
Introducción
El chile habanero (Capsicum chinense Jacq.) es uno de los cultivos hortícolas de mayor importancia culinaria, social y económica en la Península de Yucatán. En el año 2010 el Instituto Mexicano de la Propiedad Intelectual otorgó la denominación de origen “Chile habanero de la Península de Yucatán” (DOF, 2010), esto incrementó la demanda del fruto tanto en fresco como para la industria (Zavala et al., 2013). Sin embargo, la pérdida de viabilidad y baja germinación de la semilla, así como la heterogeneidad en la emergencia de las plántulas, son de los principales problemas que se presentan en este cultivo (Garruña-Hernández et al., 2014); algunos de los factores a los que se atribuyen estos problemas son el estado de madurez del fruto a la hora de la cosecha, la posición del fruto en la planta y las sustancias inhibidoras en la cubierta de la semilla (Randle & Honma, 1981). Otros factores, como el proceso de extracción, el contenido de humedad y la selección de la semilla, provocan alteraciones fisiológicas y bioquímicas que influyen en la calidad fisiológica de las semillas y las plántulas (Doijode, 2001; Vidigal et al., 2009). En este sentido, se sabe que la maduración de los frutos del género Capsicum afecta la germinación de las semillas (Vidigal et al., 2006; Zavala et al., 2015). Algunos estudios realizados en Capsicum annuum demostraron que almacenar los frutos antes de extraer las semillas permite completar la madurez del embrión e incrementar la germinación y el vigor de las semillas (Dias et al., 2006; Dos-Santos et al., 2016). Sin embargo, en el caso de Capsicum chinense nos planteamos la siguiente pregunta ¿La maduración del fruto y el tiempo de almacenamiento postcosecha incrementan el porcentaje y la velocidad tanto en la germinación de las semillas como en la emergencia de las plántulas? Con base en lo anterior, el objetivo de este estudio fue identificar la etapa adecuada de madurez del fruto para obtener semillas de calidad y determinar el efecto del almacenamiento postcosecha de los frutos sobre la germinación y la emergencia.
Material y Métodos
Producción de semillas
Se estableció un semillero de chile habanero (Capsicum chinense Jacq.) en Motul, Yucatán. Se utilizaron semillas de la variedad Mayapán proporcionadas por el INIFAP campo experimental Mococha, se sembraron en charolas germinadoras con sustrato a base de musgo canadiense (Sunshine, Proveedora Agrícola, Guadalajara, México). A los 35 días después de la siembra (das) las plántulas se establecieron en una parcela de 200 m2 en el campo experimental Mocochá del INIFAP. La distancia de siembra entre plantas fue de 0.30 m y entre filas de 1.50 m. El manejo agronómico se realizó de acuerdo a Tun (2001).
Aproximadamente a los 45 das comenzó la floración, en esa etapa se etiquetaron las flores que estaban en antesis. Los frutos se cosecharon inmaduros (verdes), medio-maduros (pintos) y maduros (naranjas) a los 28, 35 y 40 días post-antesis (dpa), respectivamente. A una parte de los frutos cosechados se les extrajo las semillas inmediatamente (testigo: frutos sin almacenar), como tradicionalmente lo hacen los productores de plántulas de la región. Otra parte de los frutos cosechados (verdes, pintos y maduros) se almacenaron durante 7 y 14 días postcosecha, a una temperatura de 25 ± 2 °C y 60 % de humedad relativa (HR). Después del período de almacenamiento correspondiente, las semillas se extrajeron de los frutos con un descorazonador de manzanas, se desinfectaron con cloro al 2 % durante tres minutos y se enjuagaron con agua destilada tres veces. Finalmente, las semillas se secaron a la sombra hasta alcanzar un contenido de humedad dentro del rango de 6-10 % (SNICS, 2014), la prueba de contenido de humedad se realizó de acuerdo a la Asociación Internacional de Pruebas de Semillas (ISTA, 2004). Las semillas se almacenaron en bolsas de polietileno plateadas y se conservaron en refrigeración a 10 °C hasta su evaluación (7 días después). Los tratamientos fueron: V fruto verde sin almacenar, V7 = fruto verde almacenado 7 días, V14 = fruto verde almacenado 14 días, P = fruto pinto sin almacenar, P7 = fruto pinto almacenado 7 días, P14 = fruto pinto almacenado 14 días, M = fruto maduro sin almacenar, M7 = fruto maduro almacenado 7 días, M14 = fruto maduro almacenado 14 días.
Variables evaluadas
Todas las evaluaciones de germinación, emergencia y crecimiento se realizaron en el laboratorio de Biotecnología y Fisiología Vegetal del Instituto Tecnológico de Conkal, México.
Para determinar el contenido de humedad (MC), cinco muestras de 0.5 g de semillas de cada uno de los tratamientos se secaron en un horno de convección de aire forzado a 103 °C hasta obtener el peso seco constante (aproximadamente 17 h). El peso fresco inicial (FW) y el peso seco final (DW) se utilizaron para calcular el contenido de humedad de semillas de acuerdo al ISTA (2004) con la siguiente formula:
La conductividad eléctrica (EC) se determinó sumergiendo durante 24 horas un lote de 50 semillas en 50 mL de agua destilada desionizada a 25 °C, las lecturas se realizaron con un conductímetro (Consort C931, Debruyne Instruments, Wichelen, Bélgica). Se evaluaron cuatro repeticiones de 50 semillas por tratamiento de acuerdo a Vidigal et al. (2009). El porcentaje de germinación (%G) se evaluó sembrando 20 semillas por caja Petri, se utilizaron cajas de 90 mm de diámetro, y como sustrato se utilizaron toallas de papel humectadas con 4 mL de agua destilada desionizada, se establecieron cinco cajas por tratamiento, cada caja representó una repetición. El cuarto de crecimiento donde se evaluó la germinación tenía una temperatura de 22 ± 1 °C, una humedad relativa de 60 % y se encontraba en total oscuridad. La germinación se contabilizó durante 14 días y se consideró una semilla germinada cuando se observó la protrusión radicular. Se utilizó la fórmula:
dónde %G = porcentaje de germinación, n = número total de semillas germinadas al final de la evaluación y N = número de semillas sembradas.
La emergencia de plántulas se evaluó en charolas germinadoras de 200 cavidades durante 7 días. Se sembraron 20 semillas por repetición y cinco repeticiones por tratamiento. Se utilizó como sustrato musgo canadiense (Sunshine, Proveedora Agrícola, Guadalajara, México). Para calcular el porcentaje de emergencia (%E) se utilizó la misma fórmula con la que se calculó el %G.
Para obtener la tasa de germinación (GR) se contabilizó la germinación durante 14 días y se calculó con la fórmula para velocidad de germinación de semillas propuesta por el ISTA (2004):
dónde GR = tasa de germinación, ni = número de semillas germinadas durante el intervalo Ti, Ti = tiempo desde la siembra hasta el día del conteo.
Para la tasa de emergencia (ER) se contabilizó a diario el número de plántulas emergidas hasta los 7 das y se utilizó la misma fórmula con la que se calculó la GR.
La longitud de radícula se evaluó a los 7 y 14 das, se tomaron fotografías de 10 plántulas por tratamiento y se procesaron con el software ImageJ (National Institute of Health, Maryland, Estados Unidos) para calcular la longitud de la radícula.
Con los datos de longitud de la radícula se calculó la tasa de crecimiento relativa de la longitud radicular, de acuerdo a la fórmula propuesta por Hunt et al. (2002):
dónde RGRRL = tasa de crecimiento relativo de la longitud de la radícula; lnL1 = logaritmo natural de la longitud de la radícula a los 7 das; lnL2 = logaritmo natural de la longitud de la radícula a los 14 das; T1 = día que se efectuó la primera medición (7 das); T2 = día que se efectuó la segunda medición (14 das).
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar, con arreglo bi-factorial, un factor fue el estado de maduración de los frutos (verdes, pintos y maduros) y otro factor el periodo de almacenamiento postcosecha de los frutos (7 y 14 días postcosecha; testigo = sin almacenar). Los datos en porcentaje fueron transformados con la raíz cuadrada de arcoseno; a todos los datos se les realizó un análisis de varianza (ANOVA, p≤0.05). Se realizó una prueba de comparación de medias (Tukey, α = 0.05) en las variables donde hubo diferencias significativas entre tratamientos. Los análisis se realizaron en el software Statistica 7 (Statsoft, Tulsa, Ok, USA).
Resultados y Discusión
En el análisis de varianza se encontraron diferencias estadísticas significativas en todas las variables. Los factores almacenamiento postcosecha y maduración de fruto tuvieron diferencias estadísticas altamente significativas (p≤0.01). En la interacción de los factores (almacenamiento x maduración), la conductividad eléctrica y los parámetros de germinación (%G y GR) fueron altamente significativos (p≤0.01); mientras que los parámetros de emergencia (%E y ER) y crecimiento radicular (RL7, RL14 y RGRRL) tuvieron diferencias significativas (p≤0.05) (Tabla 1).
Tabla 1 F-valor del contenido de humedad (MC), conductividad eléctrica (EC), porcentaje de germinación (%G), porcentaje de emergencia (%E), tasa de germinación (GR), tasa de emergencia (ER), longitud radicular a los 7 (RL7) y 14 (RL14) días después de la siembra y tasa de crecimiento relativa de la longitud de raíz (RGRRL), de semillas provenientes de frutos de chile habanero cosechados en diferentes estados de maduración y almacenamiento postcosecha.
| Treatments | MC | EC | %G | %E | GR | ER | RL7 | RL14 | RGRRL |
|---|---|---|---|---|---|---|---|---|---|
| APdeF | 0.22ns | 224.14** | 73.05** | 45.32** | 310.42** | 137.69** | 167.43** | 93.50** | 60.00** |
| EMdeF | 3.44ns | 226.71** | 55.79** | 32.13** | 111.21** | 85.97** | 48.70** | 17.16** | 10.90** |
| APdeF x EMdeF | 1.10ns | 64.71** | 12.29** | 12.03* | 29.54** | 33.78* | 6.21* | 4.07* | 4.98* |
| CV | 12.41 | 6.41 | 9.03 | 15.54 | 7.46 | 11.34 | 28.13 | 26.27 | 33.46 |
ns = no significancia; * = diferencias significativas (p≤0.05); ** = diferencias altamente significativas (p≤0.01). APdeF = almacenamiento postcosecha de frutos; EMdeF = estado de maduración de frutos; CV = coeficiente de variación.
Contenido de humedad
El contenido de humedad en las semillas de todos los tratamientos estuvo entre 6 y 10 %. De acuerdo con Copeland & McDonald (2001), ese es el intervalo de humedad de las semillas vivas, además es el rango que establece el SNICS (2014) en todas las categorías de semillas (básicas, registrada, certificada y habilitada).
Conductividad eléctrica
La conductividad eléctrica (EC) de las semillas está asociada al flujo de solutos (aminoácidos, azúcares) y electrolitos (principalmente potasio) a través de las membranas celulares (Vidigal et al., 2009). De acuerdo a la comparación de medias la EC más baja se observó en los tres estados de maduración con 14 días de almacenamiento (UR14, 0.6; HR14, 0.6; R14, 0.6 µS mL-1) y en las semillas de frutos pintos y maduros con 7 días de almacenamiento (HR7, 0.6; R7, 0.6 µS mL-1); los valores de conductividad eléctrica más altos fueron en las semillas de frutos verdes sin almacenar (UR, 1.5 µS mL-1) (Figura 1). Valores bajos de conductividad eléctrica en semillas es un indicador de membranas celulares estables, con menor flujo de solutos y electrolitos (Powell, 1986), es decir, son semillas con mayor vigor, germinación y viabilidad. Bajo este contexto, las semillas de los frutos verdes sin almacenar tuvieron mayor flujo de solutos y electrolitos, es probable que las semillas se encontraban en un estado de madurez fisiológicamente inmaduro. Sin embargo, al almacenar los frutos verdes durante 14 días (UR14) la conductividad eléctrica de las semillas disminuyó 40 % (lenta liberación de solutos y electrolitos), esto indica que durante el almacenamiento postcosecha de los frutos las semillas continuaron su maduración y estabilizaron sus membranas celulares (Dias et al., 2006).
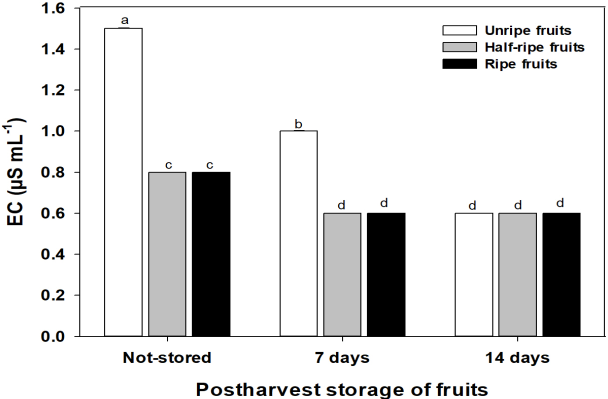
Figura 1 Conductividad eléctrica (EC) de semillas de chile habanero (Capsicum chinense Jacq.) extraídas de frutos verdes (Unripe), pintos (Half-ripe) y maduros (ripe); sin almacenar (not-stored) y almacenados durante 7 y 14 días postcosecha. Literales diferentes indican diferencias estadísticas entre tratamientos (Tukey, α = 0.05; DMS = 0.00606). n = 200.
Germinación y emergencia
El almacenamiento postcosecha de los frutos durante 14 días incrementó el porcentaje de germinación de las semillas en los tres estados de maduración de frutos (R14, 98 %; HR14, 94 % y UR14, 91 %), muy cerca estuvo el porcentaje de germinación de las semillas R7 (91 %); pero, la germinación de HR7 (73 %), HR (69 %) y UR7 (61 %) fue al menos 25 % inferior a la de R14; así mismo, la germinación de las semillas obtenidas de frutos verdes sin almacenar fue la más baja (18 %) (Figura 2A). Es evidente que la maduración del fruto al momento de la cosecha afectó la germinación de las semillas (UR, 18 %; HR, 69 % y R, 83 %). Además, el almacenamiento postcosecha de los frutos antes de obtener sus semillas incrementó el porcentaje final de germinación, sin importar el estado de maduración en el que se cosecharon los frutos, es decir, la germinación de las semillas provenientes de frutos verdes, pintos y maduros almacenados durante 14 días incrementó 73, 25 y 15 %, respectivamente en comparación con los frutos sin almacenar. Es probable que el embrión de las semillas inmaduras (UR) tenga las estructuras (radícula, hipocótilo y cotiledones) necesarias para germinar, pero sin la madurez fisiológica y las reservas que se requieren durante la germinación (Ohto et al., 2007; Trigiano et al., 2008). Almacenar los frutos de chile habanero (verdes, pintos, maduros) por 14 días incrementó la germinación con valores mayores a 90 %, este valor es superior al requerido para semillas de chile habanero (85 %) en las categorías (básica, registrada, certificada y habilitada) del SNICS (2014) y a lo reportado por Dos-Santos et al. (2016) quienes obtuvieron 85 % de germinación en semillas de frutos maduros de C. chinense almacenados por siete días. En este sentido, Carrillo et al. (2009) mencionan que las semillas del género Capsicum completan su madurez fisiológica pasando por un período de reposo, que puede ser de una a seis semanas después de que los frutos fueron cosechados. La viabilidad de las semillas asociada a los tiempos de almacenamiento postcosecha de los frutos se atribuye a que los frutos del género Capsicum son climatéricos y continúan su maduración fisiológica en paralelo con el embrión de la semilla, esto permite que la semilla termine su proceso de formación y disminuya el contenido de ácido abscísico (ABA) preparándose para la germinación (Kermode, 1995).
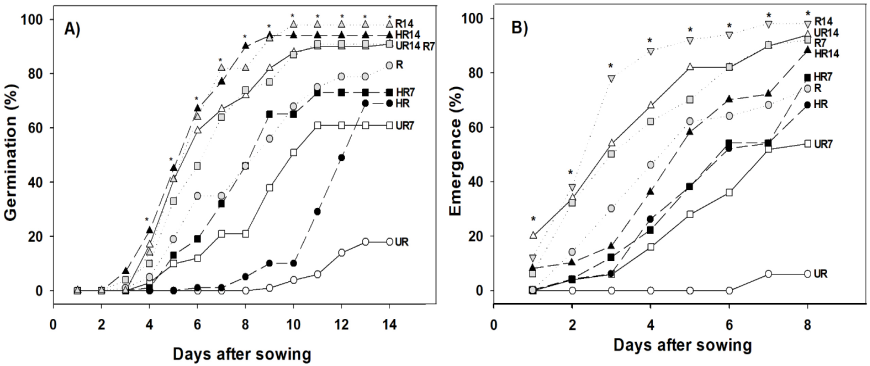
Figura 2 A) Germinación de semillas y B) Emergencia de plántulas de chile habanero (Capsicum chinense Jacq.) extraídas de frutos verdes (UR), pintos (HR) y maduros (R); sin almacenar y almacenados durante 7 (UR7, HR7 y R7) y 14 (UR14, HR14 y R14) días postcosecha. Los datos son medias, * = diferencias estadísticas significativas entre tratamientos (ANOVA, p ≤ 0.05; DMS en %G = 0.177; DMS en %E = 0.294), n = 100.
En la emergencia de plántulas se observaron diferencias estadísticas significativas (p≤0.05) desde el primer día después de la siembra. El almacenamiento de los frutos postcosecha favoreció la emergencia de las plántulas, los tratamientos R14 (98 %), HR14 (88 %) y UR14 (94 %) superaron a los tratamientos sin almacenamiento R (74 %), HR (68 %) y UR (6 %) por 24, 20 y 88 %, respectivamente; R7 (92 %) fue el único de los tratamientos almacenados durante siete días con emergencia de plántulas superior al 85 %, el resto de los tratamientos estuvo por debajo del 80 % (Figura 2B). En este sentido, Doijode (2001) menciona que durante el almacenamiento postcosecha de los frutos, el embrión continúa su proceso de maduración fisiológica hasta completar una adecuada formación en todas sus etapas (histodiferenciación, acumulación de reservas y tolerancia a la desecación), lo cual desencadena cambios en las concentraciones endógenas de ácido giberélico y ácido abscisico, esto favorece la emergencia y la longitud radicular de las plántulas.
Tasa de germinación y emergencia
Las tasas de germinación y emergencia son un indicador de la velocidad a la que germinan las semillas y emergen las plántulas, respectivamente. Al igual que en el porcentaje de germinación (%G), la tasa de germinación (GR) de semillas provenientes de los tratamientos R14 (19.22 germinadas/día), HR14 (20.08 germinadas/día), UR14 (17.59 germinadas/día) y R7 (16.62 germinadas/día) fue estadísticamente superior (Tukey, α = 0.05) al resto de los tratamientos (Tabla 2), esta tendencia se observó desde el séptimo día después de la siembra donde sólo estos tratamientos (R14, HR14, UR14 y HR7) habían superado el 50 % de la germinación (Figura 2A). Sin embargo, en la tasa de emergencia (ER) el número de plántulas emergidas por día de R14 (13.93 plántulas/día) fue estadísticamente similar a las de UR14 (12.67 plántulas/día), pero superior al resto de los tratamientos (Tukey, α = 0.05); con excepción de R7 (9.95 plántulas/día) y R (7.05 plántulas/día) los tratamientos provenientes de frutos almacenados siete días (HR7 y UR7) y sin almacenar (HR y UR) tuvieron tasas de emergencia por debajo de 5 plántulas/día (Tabla 2), lo cual se reflejó en el porcentaje de emergencia (Figura 2B). De acuerdo con Matthews & Khajeh-Hosseini (2006) una germinación lenta produce plántulas heterogéneas, pero tasas altas de emergencia se correlacionan con plántulas más grandes y homogéneas (Demir et al., 2008). Así mismo, Bradford (2004) y Bewley et al. (2013) mencionan que frutos inmaduros (verdes) proporcionan semillas de baja calidad, pero almacenarlos por un periodo de tiempo antes de la extracción de las semillas, puede incrementar la germinación hasta 73 % y la emergencia de plántulas hasta 88 %.
Tabla 2 Tasa de germinación (GR) y emergencia (ER) de semillas de chile habanero (Capsicum chinense Jacq.) extraídas de frutos verdes (UR), pintos (HR) y maduros (R); sin almacenar y almacenados durante 7 y 14 días postcosecha.
| Treatments | GR (germinated/day) |
ER (seedlings/day) |
|---|---|---|
| Unripe | 0.98 ± 0.26 e | 0.16 ± 0.11 f |
| Unripe 7 days | 7.88 ± 0.75 c | 3.38 ± 0.33 e |
| Unripe 14 days | 17.59 ± 0.61 a | 12.67± 0.57 ab |
| Half-ripe | 4.00 ± 0.27 d | 4.30 ± 0.73 e |
| Half-ripe 7 days | 10.72 ± 0.67 bc | 4.56 ± 0.25 de |
| Half-ripe 14 days | 20.08 ± 0.88 a | 7.19 ± 0.88 cd |
| Ripe | 12.08 ± 1.13 b | 7.05 ± 0.84 cd |
| Ripe 7 days | 16.62 ± 0.36 a | 9.95 ± 0.43 bc |
| Ripe 14 ays | 19.22 ± 0.55 a | 13.93 ± 0.63 a |
Los datos son medias ± EE. Literales diferentes en la misma columna indican diferencias estadísticas significativas entre tratamientos (Tukey, α = 0.05; DMS en GR = 0.051; DMS en ER = 0.057). n = 100.
Longitud y tasa de crecimiento relativo de las radículas
En la longitud de raíces de plántulas, tanto a los siete como a los catorce días después de la siembra (das) se observaron diferencias estadísticas significativas (ANOVA, p≤0.05) entre tratamientos. A los 7 das las raíces de R14 (3.8 cm) fueron las más largas; en contraste, las raíces de UR (0 cm) no crecieron (Figura 3A). A los 14 das R14 tuvo las raíces más largas (6.3 cm), pero los valores de los tratamientos HR14 (5.2 cm), UR14 (5.5 cm) y R7 (5.3 cm) fueron muy cercanos; sin embargo, las raíces de UR fueron las más cortas (0.49 cm) (Figura 3A). En la tasa de crecimiento relativo con base en la longitud radicular (RGRRL) se observaron tendencias muy similares. En los tres tratamientos donde se almacenaron los frutos durante 14 días (R14, HR14 y UR14, 1.57, 1.56 y 1.63 mm cm-1 día-1, respectivamente) y en R7 (1.58 mm cm-1 día-1) y HR7 (1.53 mm cm-1 día-1) no hubo diferencias estadísticas significativas, pero sí fueron estadísticamente superiores a los tratamientos HR (1.24 mm cm-1 día-1), UR7 (1.33 mm cm-1 día-1) y UR (0 mm cm-1 día-1) (Figura 3B).
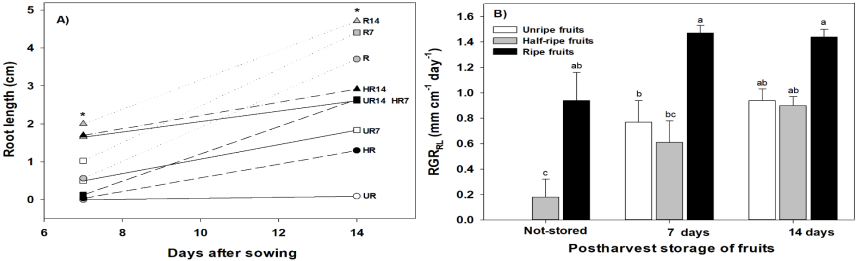
Figura 3 A) Longitud de raíz (RL) y B) Tasa de crecimiento relativo de la RL (RGRRL) de plántulas de chile habanero (Capsicum chinense Jacq.) provenientes de semillas extraídas de frutos verdes (UR), pintos (HR) y maduros (R); sin almacenar (not-stored) y almacenados durante 7 (UR7, HR7 y R7) y 14 (UR14, HR14 y R14) días post cosecha. Los datos son medias ± EE. * = diferencias estadísticas significativas (ANOVA, p≤0.05). Literales diferentes indican diferencias estadísticas entre tratamientos (Tukey, α = 0.05, DMS en RL a los 7 días = 0.418; DMS en RL a los 14 días = 0.856; DMS RGRRL = 0.366), n = 50
En general, la longitud radicular de plántulas incrementó con el almacenamiento y con la maduración del fruto, en este trabajo las raíces de las plántulas provenientes de semillas colectadas de frutos verdes y pintos sin almacenar fueron las que menor crecimiento presentaron (Figura 4). Al respecto, Cervantes et al. (1998) y Paponov et al. (2000) mencionan que la deficiencia en el incremento de la longitud radicular deja en desventaja a las plántulas para obtener recursos para subsistir.

Figura 4 Semillas de chile habanero a los siete días después de la siembra, extraídas de frutos verdes (UR), pintos (HR) y maduros (R); sin almacenar y almacenados durante 7 (UR7, HR7 y R7) y 14 (UR14, HR14 y R14) días postcosecha.
De acuerdo con el ISTA (2004), el vigor de la semilla es la suma total de las propiedades que determinan el nivel potencial de actividad y desarrollo durante la germinación y la emergencia de la plántula. Es evidente que las semillas de frutos maduros per se producen plántulas más vigorosas, pero almacenar frutos pintos o verdes durante 14 días antes de extraer sus semillas, propicia la producción de plántulas vigorosas. En este sentido, se asume que el embrión de las semillas de chile habanero continuó su proceso de maduración mientras permaneció unido a la placenta del fruto, sin importar que el fruto estuviera en la planta o en almacenamiento postcosecha. En la industria semillera cosechar frutos verdes o pintos para la extracción de semillas en lugar de esperar a que el fruto alcance su madurez total en la planta es importante porque evita la exposición de frutos a daños bióticos o abióticos en campo. De igual manera, adelantar la cosecha de los frutos (verdes y pintos) puede incrementar el número de cortes en el ciclo de un cultivo, debido a que los asimilados de carbono (fotosintatos) que demandan los frutos para su maduración se canalizan a la formación de nuevos primordios florales (Marcelis et al., 2004; Garruña-Hernández et al., 2012).
Conclusión
Cosechar frutos tanto verdes como pintos y almacenarlos por 14 días incrementa los atributos fisiológicos de las semillas y la calidad de las plántulas, lo que permite obtener valores similares a los de las semillas obtenidas de frutos maduros. El almacenamiento postcosecha de los frutos antes de la extracción de las semillas incrementó el porcentaje y las tasas de germinación y emergencia, disminuyó la conductividad eléctrica de la solución donde se embebieron las semillas y aumentó el crecimiento en las raíces de las plántulas desde la primera semana después de la siembra. Con los conocimientos generados en este estudio se recomienda a los productores de semillas, cosechar frutos de chile habanero inmaduros (verdes y pintos) y almacenarlos durante 14 días, para que terminen de madurar antes de extraer las semillas; con esto se obtienen semillas de calidad y se evita la competencia entre frutos en la planta.
Agradecimientos
Se agradece al CONACYT por la beca número 703739 para la realización de estudios de posgrado, al INIFAP campo experimental Mocochá y al Instituto Tecnológico de Conkal por las facilidades para realizar esta investigación.
REFERENCIAS
Bewley, J. D., Bradford, K. J., Hilhorst, W. M. H. and Nonogaky, H. (2013). Seeds physiology of development, germination and dormarcy. Third Edition. Springer. New York, U.S.A. 392 p. https://doi.org/10.1017/S0960258513000287 [ Links ]
Bradford, K. J. (2004). Seed production and quality. 1st. edition. Department of Vegetable Crops. University of California. Davis, California, U.S.A. 134 p. [ Links ]
Carrillo, E. P., Mejía, J. A., Carballo, A., García, G., Aguilar, V. and Corona, T. (2009). Calidad de semilla en colectas de chile de agua (Capsicum annuum L.) de los valles centrales de Oaxaca, México. Agricultura Técnica en México 35: 257-266. http://www.redalyc.org/articulo.oa?id=60812263002 [ Links ]
Cervantes, V., Arriaga, V., Meave, J. and Carabias, J. (1998). Growth analysis of nine multipurpose woody legumes native from southern Mexico. Forest Ecology and Management 110: 329-341. https://doi.org/10.1016/S0378-1127(98)00298-9 [ Links ]
Copeland, L. O. & McDonald, M. B. (2001). Principles of seed science and technology. 4th Ed. Burgues publishing company. pp 122-169. https://doi.org/10.1007/978-1-4615-1619-4 [ Links ]
Demir, I., Ermis, S., Mavi, K. and Matthews, S. (2008). Mean germination time of pepper seed lots (Capsicum annuum L.) predicts size and uniformity of seedlings in germination tests and transplant modules. Seed Science and Technology 36: 21-30. https://doi.org/10.15258/sst.2008.36.1.02 [ Links ]
Dias, D. C. F. S., Ribeiro, F. P., Dias, L. A. S., Silva, D. J. H. and Vidigal, D. S. (2006). Tomato seed quality in relation to fruit maturation and postharvest storage. Seed Science and Technology 34: 691-699. https://doi.org/10.15258/sst.2006.34.3.15 [ Links ]
DOF, (Declaratoria general de protección de la denominación de origen “Chile habanero de la Península de Yucatán”). (2010). México D.F. http://dof.gob.mx/nota_detalle.php?codigo=5145315&fecha=04/06/2010 [ Links ]
Doijode, S. D. (2001). Seed storage of horticultural crops. Haworth Press. New York, USA. 339 p. https://doi. org/10.1201/9781439800072 [ Links ]
Dos-Santos, H. O., Franchi, S. M., Walace, R., Oliveira, R. M., Von-Pinho, E. V., Franco, S. D. and Moreira, M. L. (2016). Physiological quality of habanero pepper (Capsicum chinense) seeds based on development and drying process. African Journal of Agriculture, 11: 1102-1109. https://doi.org/10.5897/AJAR2015.10462 [ Links ]
Garruña-Hernández, R., Canto, A., Mijangos-Cortés, J. O., Islas, I., Pinzón, L. and Orellana, R. (2012). Changes in flowering and fruiting of Habanero pepper in response to higher temperature and CO2. Journal of Food, Agriculture & Environment 10: 802-808. https://www.researchgate.net/profile/Rene_Garruna/publication/267865766_ Changes_in_flowering_and_fruiting_of_Habanero_pepper_in_response_to_higher_temperature_and_CO2/links/545cf0040cf27487b44d458d/Changes-in-flowering-and-fruiting-of-Habanero-pepper-in-response-to-higher-temperature-and-CO2.pdf [ Links ]
Garruña-Hernández, R., Latournerie-Moreno, L., Ayala-Garay, O., Santamaría, J. and Pinzón-López, L. (2014). Acondicionamiento pre-siembra: una opción para incrementar la germinación de semillas de chile habanero (Capsicum chinense Jacq.). Agrociencia 48: 420-422. http://www.scielo.org.mx/scielo.php?pid=S1405-31952014000400006&script=sci_arttext&tlng=en [ Links ]
Hunt, R., Causton, D. R., Shipley, B. and Askew, A. P. (2002). A modern tool for classical plant growth analysis. Annals of botany, 90(4), 485-488. https://doi.org/10.1093/aob/mcf214 [ Links ]
ISTA, (International Seed Testing Association). (2004). International Rules for Seed Testing. Rules 2004. ISTA Editions. Bassersdorf, CH-Switzerland. 243 p. [ Links ]
Kermode, A. R. (1995). Regulatory mechanisms in the transition from seed development to germination: interactions between the embryo and the seed environment. In: J. Kigel, G. Galili, (eds). Seed Development and Germination. Marcel Dekker, Inc. New York. pp: 273-332. ISBN 0-8247-9229-7 [ Links ]
Marcelis, L. F. M., Heuvelink, E., Hofman-Eijer, L. R. B., Bakker, J. D. and Xue, L. B. (2004). Flower and fruit abortion in sweet pepper in relation to source and sink strength. Journal of Experimental Botany 406: 2261-2268. https:// doi.org/10.1093/jxb/erh245 [ Links ]
Matthews, S. & Khajeh-Hosseini, M. (2006). Mean germination time as indicator of emergence performance in soil of seed lots of maize (Zea mays). Seed Science and Technology 34: 339-347. https://doi.org/10.15258/sst.2006.34.2.09 [ Links ]
Ohto, M. A., Stone, S. L. and Harada, J. J. (2007). Genetic control of seed development and seed mass. In: K J Bradford, H Nonogaki (eds). Seed Development, Dormancy and Germination. Blackwell Publishing. Iowa, USA. pp:1-49. https://doi.org/10.1002/9780470988848.ch1 [ Links ]
Paponov, I. A., Posepanov, O. G., Lebedinskai, S. and Koshkin, E. I. (2000). Growth and biomass allocation with varying nitrogen availability of near-isogenic pea lines with differing foliage structure. Annals of Botany 85: 563-569. https://doi.org/10.1006/anbo.2000.1115 [ Links ]
Powell, A. (1986). Cell membranes and seed leachate conductivity in relation to the quality of seed for sowing. Journal of Seed Technology, 10(2), 81-100. http://www.jstor.org/stable/23432796 [ Links ]
Randle, W. M. & Honma, S. (1981). Dormancy in peppers. Scientia Horticulturae 14: 19-25. https://doi.org/10.1016/0304-4238(81)90074-1 [ Links ]
SNICS, (Servicio Nacional de Inspección y Certificación de Semillas). (2014). Reglas para la calificación de semilla de chile (Capsicum spp.). México. 13 p. [ Links ]
Trigiano, R. N., Follum, R. A. and Beyl, C. A. (2008). Sexual reproduction in angiosperms. In: C A Beyl, R N Trigiano (eds.). Plant Propagation Concepts and Laboratory Exercises. CRC Press Taylor & Francis Group. US.A. pp: 379-389. [ Links ]
Tun, D. J. C. (2001). Chile habanero: Características y tecnología de producción. SAGARPA Instituto Nacional de Investigaciones Forestales, Agricolas y Pecuarias. Centro de Investigación Regional Sureste. Mocochá, Yucatán, México. 74 p. [ Links ]
Vidigal, D., Dias, D., Naveira, D. S. P. C., Rocha, F. B. and Bhering, M. C. (2006). Qualidade fisiológica de sementes de tomate em função da idade e do armazenamento pós-colheita dos frutos. Revista Brasileira de Sementes. 28(3), 87-93. https://dx.doi.org/10.1590/S0101-31222006000300013 [ Links ]
Vidigal, D., Dias, D., Von-Pinho, E. R. V. and Dias, L. A. S. (2009). Sweet pepper seed quality and lea-protein activity in relation to fruit maturation and post-harvest storage. Seed Science and Technology. 37: 192-201. https://doi. org/10.15258/sst.2009.37.1.21 [ Links ]
Zavala, M. J., Hernández Pinto, D., Vázquez, M., Hernández Pinto, J., López, A. and Baeza, J. J. (2015). Almacenamiento postcosecha de frutos como mecanismo para mejorar la calidad fisiológica de las semillas de dulce e x´catik (Capsicum annum L.). In: XVIII Congreso Internacional en Ciencias Agrícolas. Mexicali Baja California México pp 1028-1035. [ Links ]
Zavala, M. J., López, A., Santamaría, F. and Baeza, J. J. (2013). Calidad de semillas de chile habanero (Capsicum chinense Jacq.) mediante el acondicionamiento postcosecha de frutos. In: 10ª Convención mundial del chile. Durango, Durango. pp: 282-287. [ Links ]
Como citar este artículo: Hernández-Pinto, C., Garruña, R., Andueza-Noh, R., Hernández-Núñez, E., Zavala-León, M. J., Pérez-Gutiérrez, A. (2020). Post-harvest storage of fruits: An alternative to improve physiological quality in habanero pepper seeds. Revista Bio Ciencias 7, e796. doi: https://doi.org/10.15741/revbio.07.e796
Recibido: 15 de Agosto de 2019; Aprobado: 06 de Febrero de 2020











 text in
text in 


