Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista bio ciencias
versão On-line ISSN 2007-3380
Revista bio ciencias vol.6 spe Tepic 2019 Epub 14-Nov-2019
https://doi.org/10.15741/revbio.06.nesp.e456
Artículos Originales
Capacidad de adherencia e índice de invasión de cepas de L. monocytogenes aisladas de alimentos y casos clínicos en México
1Universidad Autónoma de Sinaloa, Facultad de Ciencias Químico Biológicas, Culiacán, Sinaloa, México.
2Universidad Nacional Autónoma de México, Unidad de Investigación Básica y Clínica en Enfermedades Infecciosas, Departamento de Salud Pública/División de Investigación Facultad de Medicina. Ciudad de México, México.
3Unidad de Hemato-Oncología e Investigación Hospital Infantil de México Federico Gómez, Laboratorio de Patogenicidad Bacteriana, Ciudad de México, México.
4Centro de Investigación en Alimentación y Desarrollo, A.C., Laboratorio Nacional para la Investigación en Inocuidad Alimentaria, Coordinación-Culiacán. Culiacán, Sinaloa, México.
Evaluar la capacidad de adherencia e invasión de diferentes genotipos de Listeria monocytogenes recuperadas de alimentos y casos clínicos en México, para definir la relación patogénica entre ambos grupos. Se evaluaron 30 cepas de L. monocytogenes aisladas de alimentos (n=23) y casos clínicos (n=7) previamente tipificadas por serología y electroforesis en gel de campo pulsado. El fenotipo de virulencia se determinó mediante la capacidad de adherencia e invasión en células HEp-2, HT-29 y Caco-2. Las 30 cepas mostraron un patrón de adherencia difuso con daño celular, y presentaron un índice de invasión significativo asociado a la cepa (p=0.000), serotipo (p=0.018) y genotipo (p=0.001), pero no respecto al origen (p=0.658). Las 23 cepas aisladas de alimentos se clasificaron con fenotipo invasivo alto (4.3 %), moderado (87.0 %) y bajo (8.7 %) según el fenotipo presentado por las cepas clínicas y control. Las características observadas en los dos grupos de cepas estudiadas infieren que L. monocytogenes independiente de su procedencia es un microorganismo patógeno con diferente grado de virulencia, y de manera alterna sugiere la participación de los alimentos en la transmisión de la bacteria en los casos de listeriosis en México.
Palabras clave: Alimentos; Listeria monocytogenes; Listeriosis; Virulencia
To evaluate the adherence and invasion capacity of different Listeria monocytogenes genotypes recovered from food samples and clinical cases in Mexico, and to know the pathogenic relationship between both groups of strains. Thirty strains of L. monocytogenes isolated from food (n=23) and clinical cases (n=7) previously typed by serology and pulsed-field gel electrophoresis were evaluated. The virulence phenotype was determined by the adhesion and invasion capacity in HEp-2, HT-29 and Caco2 cells. The L. monocytogenes strains analyzed showed diffuse adherence pattern and cell damage, a marked invasion index associated to the strain (p=0.000), serotype (p=0.018) and genotype (p=0.001), but not regarding to origin (p=0.685) were observed. The 23 strains isolated from food were classified with high (4.3 %), moderate (87.0 %) and low (8.7 %) invasion phenotype according to the phenotype presented by clinical and control strains. The characteristics identified in both strain groups infer that L. monocytogenes independent of its origin is a pathogen with different virulence degree, and supports the foods participation in the bacteria transmission and listeriosis cases in Mexico.
Key words: Food; Listeria monocytogenes; Listeriosis; Virulence
Introducción
Listeria monocytogenes es el patógeno responsable de la listeriosis, enfermedad que afecta al hombre, y considerada un problema de salud pública debido a la severidad de los padecimientos y la alta tasa de mortalidad (20-30 %) que genera en la población vulnerable (Zunabovic et al., 2011). Meningitis, septicemia y aborto son formas clínicas invasivas de la listeriosis, y la gastroenteritis no invasiva, ambos tipos difieren en términos de sintomatología, población, dosis infecciosa y tiempo de incubación (Posfay-Barbe & Wald, 2009; Camejo et al., 2011). La principal vía de infección del patógeno es por consumo de productos lácteos con o sin pasteurización, embutidos, y hortalizas contaminados, lo que da lugar a brotes de listeriosis (CDC, 2017; Raheem, 2016).
Dada la importancia clínica y epidemiológica de L. monocytogenes, se han implementado diversos métodos para su detección y tipificación con la intención de definir con precisión las cepas involucradas en brotes (CDC, 2017), y localizar los puntos de contaminación en la cadena alimentaria. El Centro de Prevención y Control de Enfermedades (CDC) de los Estados Unidos de América, basado en la detección y tipificación de L. monocytogenes, permite reportar anualmente los casos de listeriosis (≈1500) asociados al consumo de alimentos con una tasa de mortalidad de 17 % (Scallan et al., 2011). En general, los países en desarrollo no consideran obligatorio el reporte de listeriosis, hecho que probablemente repercute en la baja incidencia del padecimiento (Tod & Notermans, 2011).
Existen numerosos estudios que refieren la presencia de L. monocytogenes en los alimentos, y señalan el riesgo que estos representan en la listeriosis de origen alimentario (Adzitey & Huda, 2010). La supervivencia, transmisión y patogénesis de L. monocytogenes está condicionada por la capacidad de adaptación de la bacteria (Zunabovic et al., 2011; Roberts & Wiedmann, 2003), la naturaleza del alimento (Midelet-Bourdin et al., 2006), y la diversidad entre los serotipos de la especie (Jaradat & Bhunia, 2003). Se asume que los 13 serotipos de L. monocytogenes son potencialmente virulentos debido a que poseen un locus cromosomal de virulencia (prfA, plcA, plcB, hlyA, mpl, acta) denominado isla de patogenicidad-1, y genes de invasión (Internalinas) necesarios para establecer el ciclo infectivo basado en adherencia, invasión, sobrevivencia y multiplicación dentro de células fagocíticas y no-fagocíticas del hospedero (Camejo et al., 2011; Vázquez-Boland et al., 2001). Sin embargo, los serotipos 1/2a, 1/2b, y 4b se han identificado en la mayoría de los casos de listeriosis (Orsi et al., 2011), por lo que es importante evaluar si las cepas de origen alimentario independientemente del serotipo presentan ciertas propiedades de virulencia.
Aunque, en México se ha reportado la presencia de L. monocytogenes en diversos alimentos (Castañeda-Ruelas et al., 2013; Silva et al., 2007; Vázquez-Salinas et al., 2001; Saltijeral et al., 1999), son pocos los casos clínicos descritos, lo anterior probablemente por el hecho de que la listeriosis no es una enfermedad de declaración obligatoria (Castañeda-Ruelas et al., 2014). En 2016, la Dirección General de Epidemiología de México reportó 4,476,041 casos de infecciones intestinales, 25,896 casos de intoxicación alimentaria bacteriana y 628 casos de meningitis, pero, la etiología de ambos cuadros clínicos no fue definida (DGE, 2018). No obstante, que entre 1967-2006, se reportaron algunos casos de listeriosis, los cuales a pesar del tratamiento con antibióticos tuvieron una tasa de mortalidad del 50 % (Espinoza-Gómez et al., 2006; Castrejón-Alba et al., 1997; Kraus et al., 1994), en ninguno de ellos se realizó la búsqueda de la fuente y la cepa de L. monocytogenes responsable de la infección.
Una posible explicación del porqué en México no se conoce la relación entre la listeriosis y su agente causal, posiblemente se debe a fallas para establecer el diagnóstico clínico y por ende el etiológico. Por otro lado, aunque, se ha trabajado sobre la presencia de L. monocytogenes en diferentes alimentos, la información sobre las cepas aisladas se ha limitado a su identificación bioquímica por lo que no se sabe si presentan características que permitan establecer el ciclo infectivo en el hospedero. El propósito del presente estudio consistió en analizar algunas propiedades de virulencia de cepas de L. monocytogenes aisladas de alimentos y casos clínicos, para definir la importancia de los alimentos en la transmisión de cepas virulentas a los humanos.
Materiales y Métodos
Cepas
Se evaluaron 30 cepas de L. monocytogenes, siete cepas de casos clínicos de listeriosis y 23 cepas aisladas de alimentos (Tabla I), previamente tipificadas por serotipo y electroforesis en gel de campo pulsado [PFGE] (Castañeda-Ruelas et al., 2013). Para los ensayos de virulencia se incluyeron las cepas control de L. monocytogenes ATCC 7644, y los patotipos de E. coli (EAEC-49766, EPEC2348/69 y EAEC-O42). Se estandarizó una suspensión bacteriana en búfer de fosfato estéril (PBS) de 1.0 (≈3x108 ufc/mL) en la escala Macfarland.
Tabla 1 Descripción de cepas de L. monocytogenes aisladas de alimentos y casos clínicos en México.
| Genotype | Serotype | Source | Site isolation | Total strains (n=40) |
|---|---|---|---|---|
| A | 4 b | Raw chicken | Sinaloa | 1 |
| A | N.D. | Clinical | Mexico | 1 |
| C | 1/2 c | Raw meat | Sinaloa | 2 |
| D | 1/2 a | Frankfurters | Sinaloa | 7 |
| F | 4 b | Raw chicken | Sinaloa | 1 |
| G | 4 b | Raw chicken | Sinaloa | 1 |
| H | 4 b | Raw chicken | Sinaloa | 2 |
| I | 4 b | Raw chicken | Sinaloa | 4 |
| J | 1/2 b | Raw meat | Sinaloa | 1 |
| K | 1/2 b | Raw meat | Sinaloa | 1 |
| L | 1/2 b | Raw meat | Sinaloa | 1 |
| M | 1/2 b | Raw chicken | Sinaloa | 1 |
| N | 3 b | Raw meat | Sinaloa | 1 |
| X1 | N.D. | Clinical | Mexico | 1 |
| X3 | N.D. | Clinical | Mexico | 1 |
| X4 | N.D. | Clinical | Mexico | 2 |
| X5 | N.D. | Clinical | Mexico | 1 |
aEl genotipo se determinó mediante el método de electroforesis en gel de campo de pulso.
Cultivo de células
Las líneas celulares utilizadas fueron CaCo-2 (células de adenocarcinoma colorrectal humano), HT-29 (células de adenocarcinoma de colon humano), y HEp2 (células de carcinoma laríngeo humanos). Las células CaCo-2 y HT-29 se cultivaron como monocapas en frascos de 75 cm2 con medio Dulbecco Eagle modificado (DMEM) suplementado con suero bovino fetal al 10 % (v/v), aminoácidos no esenciales al 1 % (v/v) y solución de antibióticos al 1 % (v/v) (100 μg/mL de penicilina y 100 μg/ mL de estreptomicina). Las células HEp-2 se cultivaron en medio mínimo esencial (MEM) suplementado con suero bovino fetal al 10 % (v/v), L-glutamina 2 mM, y antibióticos al 1 % (v/v). Para los ensayos de adherencia e invasión, las células se cultivaron en DMEM y MEM sin antibióticos por 24 h. Las células se mantuvieron a 37 °C bajo 5 % de CO2.
Ensayo de adherencia
El perfil de adherencia se determinó utilizando las líneas HEp-2, HT-29 y Caco-2, como describe Cravioto et al. (1991). En placas de cultivo celular con lentejas de vidrio se cultivaron monocapas de células con confluencia del 95 % (105 células/pozo), y se inocularon con las cepas de L. monocytogenes en proporción de multiplicidad de infección (MOI) de 10:1. Las placas inoculadas se incubaron a 37 °C durante 3 h. Las lentejas con las monocapas infectadas se lavaron con PBS, se fijaron con metanol, y se tiñeron con tinción Giemsa. Las lentejas se examinaron bajo el lente de 100x con aceite de inmersión en un microscopio de luz. Para considerar positiva la prueba de adherencia se deben contar con ≥10 bacterias adheridas en los contornos o sobre su superficie de las células en el 25 % de la monocapa de células, y que los controles negativos no muestren bacterias adheridas a las células. Para clasificar el patrón de adherencia se utilizaron las cepas control EPEC-2348/69, EAEC-49766 y EAEC-O42 que presentan el patrón localizado, agregativo y difuso, respectivamente.
Ensayo de invasión
El índice de invasión se analizó mediante el ensayo de invasión basado en gentamicina en células HEp-2 y HT-29 según lo descrito por Jaradat & Bhunia (2003), con modificaciones menores. Se seleccionaron solo dichas líneas de células para evaluar el índice de invasión de las cepas de L. monocytogenes debido a que no se consideró necesario utilizar dos líneas de células de origen intestinal. Brevemente, se cultivaron en placas de cultivo celular monocapas de células hasta una confluencia del 95 % (105 células/pozo), y se inocularon con un MOI de 10:1 con las cepas bacterianas. Las monocapas inoculadas se incubaron a 37 °C durante 90 min; transcurrido este tiempo se lavaron con PBS, y se incubaron adicionalmente 90 min a 37 ºC en medio DMEM suplementado con gentamicina (100 µg/mL) para eliminar las bacterias extracelulares. Posteriormente, las monocapas se lavaron con PBS, y las células fueron lisadas. La cuantificación del inóculo y células intracelulares de L. monocytogenes se realizó en diluciones seriales en agar Oxford, y el valor se expresó en Logufc/mL. El índice de invasión se calculó dividiendo la concentración de bacterias internalizadas (con gentamicina) entre la concentración del inóculo. La cepa de L. monocytogenes ATCC4976 fue incluida como control positivo.
Análisis estadístico
Los ensayos de adherencia e invasión se realizaron dos veces por duplicado para cada cepa evaluada. Para el ensayo de invasión se realizó un análisis ANOVA de dos vías (cepas de L. monocytogenes y tipo de células) completamente al azar con la prueba de Tukey y Dunnet. Adicionalmente, se realizó la prueba de Kruskal-Wallis para determinar la asociación del índice de invasión con las variables categóricas origen, serotipo y PFGE. Un valor p≤0.05 fue considerado estadísticamente significativo (Minitab17).
Resultados y Discusión
Las 30 cepas de L. monocytogenes analizadas se adhirieron a las células HT-29, HEp-2 y Caco-2 con un patrón de adherencia difuso y/o agregativo (Figura 1), lo que sugiere la capacidad para colonizar e iniciar su ciclo de invasión en el hospedero. No se observó un patrón de adherencia diferencial de acuerdo con el perfil de PFGE, origen (clínicas y alimentarias) y/o serotipo entre las cepas. Sin embargo, mostraron diferentes niveles de adherencia, daño o destrucción celular de la monocapa y la formación de las prolongaciones célula-célula (Figura 1).

Figura 1 Micrografía del patrón de adherencia difusa de cepas de L. monocytogenes en células HEp-2, HT-29 y Caco-2. (A) control de células Caco-2, (B) control de células de HT-29, (C) control de HEp-2, (D) serotipo 4b en células Caco-2, (E) serotipo 1/2c en células HT-29, (F) serotipo 1/2b en células HEp-2, (G) cepa clínica en células Caco-2, (H) serotipo 3b en células HT-29, (I) serotipo 1/2a en células HEp-2. Aumento 100x.
La capacidad de L. monocytogenes para invadir las células HT-29 y HEp-2 varió de 0.422-0.865 y de 0.307-0.858, respectivamente, observándose diferencias estadísticas entre cepas (p=0.000), líneas celulares (p=0.001), serotipo (p=0.018) y perfil electroforético (p=0.001), pero no respecto al origen (p=0.658). Es decir, el índice de invasión de las cepas de L. monocytogenes se observa como una propiedad no estable. El perfil de invasión global expresado por las cepas de origen alimentario (n=23) se determinó con respecto a la cepa control de L. monocytogenes ATCC 4976 previamente reportada con potencial patogénico (Jaradat & Bhunia, 2003); la mayoría (87 %) de las cepas corresponde a un índice de invasión similar a la cepa control y las cepas de origen clínico. No obstante, una cepa correspondiente al serotipo 1/2a (cepa 10) presentó un fenotipo de invasión superior a la cepa de L. monocytogenes ATCC 4976. Mientras que, aislados de los serotipos 4b (cepa 116) y 1/2c (cepa 101) mostraron un fenotipo menor (Figura 2).
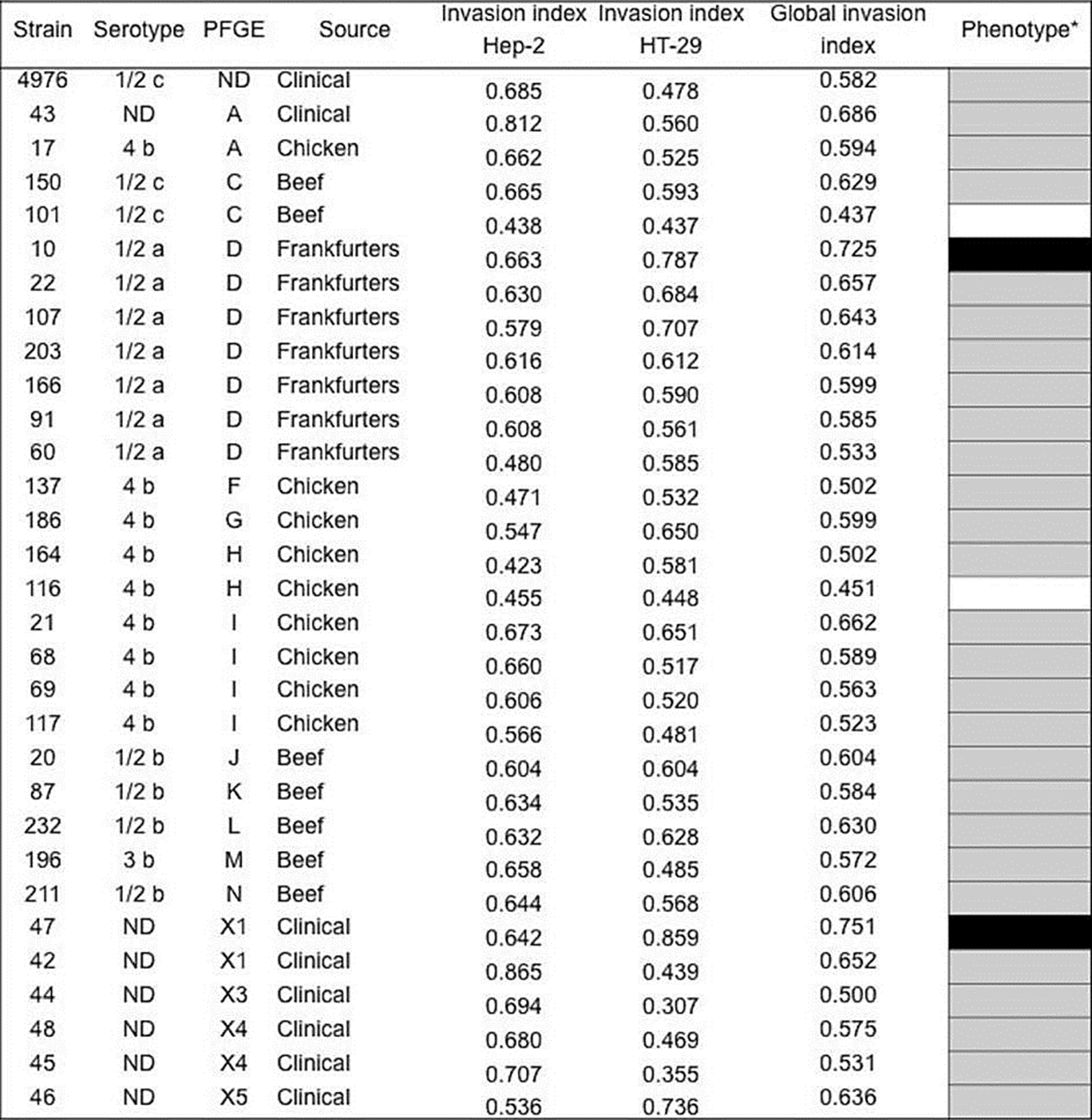
Figura 2 Fenotipo de invasión de cepas de Listeria monocytogenes aisladas de alimentos y casos clínicos en México. aEl fenotipo de invasión promedio se determinó respecto a la cepa control L. monocytogenes ATCC4976 en las células HEp2 y HT-29; fenotipo alto (negro), fenotipo similar (gris), y fenotipo bajo (blanco). La media de los fenotipos de invasión entre las cepas es estadísticamente diferente en las células HEp-2 y HT-29 (p<0.05). N.D: No determinado.
El estudio comparativo del fenotipo de adherencia e invasión de cepas de L. monocytogenes aisladas de alimentos y casos clínicos, es la primera descripción al respecto que se hace en México. En la literatura se refiere que la mayoría de los casos de listeriosis son vinculados con los serotipos 1/2a, 1/2b y 4b, y que su transmisión es a través de los alimentos (Orsi et al., 2011). Nuestro estudio muestra que la mayoría de las cepas de origen alimentario pertenecen a dichos serotipos con potencial y capacidad patogénica in vitro en líneas celulares.
Para iniciar el evento de invasión a las células del hospedero y garantizar la progresión del ciclo intracelular de L. monocytogenes, la adherencia es un proceso primordial (Camejo et al., 2011; Vázquez-Boland et al., 2001). Algunos estudios han cuantificado la capacidad de adherencia de L. monocytogenes, encontrando diferencias del grado de expresión de acuerdo al serotipo (Jaradat & Bhunia, 2003). Sin embargo, la información sobre la descripción de la topología de la célula hospedera infectada por L. monocytogenes es escasa. En este estudio se identificó que las cepas de L. monocytogenes presentan un patrón de adherencia difusa similar al descrito en E. coli (Nataro & Kaper, 1998), el cual no mostró relación con el serotipo y el origen de las bacterias ni con las células epiteliales ensayadas.
En el modelo de células epiteliales polarizadas se ha observado que la invasión del patógeno se realiza mediante una adherencia basolateral, lo cual es resultado de la interacción entre las proteínas de superficie bacteriana (Internalinas) y la proteína E-cadherina que rodea las uniones de la célula hospedera (Pentecost et al., 2006). En este sentido, el fenotipo difuso de las cepas evaluadas se relaciona con esta descripción, y con la influencia de la bacteria sobre la tipología de la célula hospedera infectada al mostrar daño celular y las prolongaciones célula-célula. L. monocytogenes puede ocasionar daño celular por efecto de la invasión o por la potencial capacidad de producir toxinas, ambas propiedades patogénicas características de la bacteria (Camejo et al., 2011; Pentecost et al., 2006; Vázquez-Boland et al., 2001). Scalestky et al. (2002) describieron la presencia de diferentes fenotipos de adherencia y su relación con las manifestaciones clínicas inducida por E. coli que es un microorganismo altamente diversificado, hecho que contrasta con lo observado con L. monocytogenes que no presenta fenotipos de adherencia diferenciales.
Previamente en México, Vázquez-Salinas et al. (2001) identificó cepas aisladas de alimentos con serotipo 4 y 1/2 que en un modelo murino se identificaron como bacterias no virulentas y virulentas, respectivamente. En contraste, en el presente estudio al evaluar el grado de invasión de las cepas de origen alimentario se observaron diferencias al hacer el análisis entre cepas/serotipos/PFGE, lo que permite concluir que la virulencia de L. monocytogenes es una propiedad individual que varía entre las diferentes cepas. En este sentido, algunos estudios han descrito la no relación del grado de invasión con la expresión de adherencia o hemólisis de cepas y/o serotipos de L. monocytogenes (Jaradat & Buhnia, 2003). Rychli et al. (2014) señalan que genomas de diferentes cepas de L. monocytogenes mantienen un grupo similar de genes de virulencia funcional (isla de patogenicidad-1) permitiendo el ciclo infectivo, pero, con genes de virulencia distintivos de cada cepa que reflejan la magnitud de su virulencia. Adicionalmente, se observó mayor afinidad de L. monocytogenes por las células HT29, esto podría atribuirse al origen intestinal de las células y la capacidad del patógeno para causar enfermedades gastrointestinales (Posfay-Barbe & Wald, 2009).
De acuerdo con otros estudios, nuestros resultados confirmaron que L. monocytogenes independiente de su procedencia son patógenos con diferente grado de virulencia, y que esta puede estar condicionada por el serotipo o su perfil genético (Indrawattana et al., 2011; Larsen et al., 2002). La información al respecto refiere que algunas cepas de L. monocytogenes aisladas de alimentos pueden tener un potencial humano-patógeno limitado (Roberts et al., 2005), y que en ciertos casos depende de la matriz y temperatura de almacenamiento del alimento (Midelet-Bourdin et al., 2006), o se relaciona con factores moleculares adicionales que contribuyen al ciclo patogénico (Roberts & Wiedmann, 2003). Aunque, con algunas diferencias por la capacidad invasiva observada en las cepas origen alimentario y las clínicas se puede proponer la participación de los alimentos como fuente de transmisión de clones de L. monocytogenes potencialmente patogénicos y responsables de la Listeriosis en México.
Conclusiones
En México L. monocytogenes no es un patógeno de diagnóstico obligatorio en los casos clínicos sospechosos. Sin embargo, hay informes de casos esporádicos y estudios que sustentan la prevalencia del patógeno en los alimentos. Nuestros resultados mostraron que la mayoría de los serotipos de L. monocytogenes aislados de alimentos tienen la capacidad de adherirse e invadir las células hospederas similar al comportamiento de las cepas clínicas, y que los alimentos representan una vía principal de transmisión. Ante esto surge la necesidad de implementar medidas para realizar un control más estricto en los alimentos, mediante la búsqueda intencional de L. monocytogenes como patógeno de transmisión alimentaria en México. Por otro lado es importante plantear a los médicos que en los casos clínicos de abortos o problemas neurológicos en los que no se establezca el diagnóstico, es conveniente considerar la posible participación de la bacteria. Los estudios moleculares de la bacteria se muestran como una posibilidad promisoria, para desarrollar sistemas para su identificación rápida y para conocer más sobre la genómica del microorganismo.
Agradecimientos
Agradecemos el apoyo técnico de la QFB. Celida Martínez-Rodríguez adscrita al Laboratorio Nacional para la Investigación en Inocuidad Alimentaria CONACyTCIAD Culiacán, y Laboratorio de Patogenicidad Bacteriana, Unidad de Hemato-Oncología e Investigación Hospital Infantil de México Federico Gómez.
REFERENCIAS
Adzitey, F. & Huda, N. (2010). Listeria monocytogenes in foods: incidences and possible control measures. African Journal of Microbiology Research, 4(25): 2848-2855. http://www.academicjournals.org/journal/AJMR/article-full-text-pdf/7A1422817340 [ Links ]
Camejo, A., Carvalho, F., Reis, O., Leitão, E., Sousa, S. and Cabanes, D. (2011). The arsenal of virulence factors deployed by Listeria monocytogenes to promote its cell infection cycle. Review. Jounal Virulence 2(5): 379-394. http://doi.org/10.4161/viru.2.5.17703 [ Links ]
Castañeda-Ruelas, G., Castro-del-Campo, N., León, J., Valdez, J., Guzmán-Uriarte, R., Luchansky, J., Portto-Fett, A. C. S., Shoyer, B. A. and Chaidez, C. (2013). Prevalence, levels, and relatedness of Listeria monocytogenes isolated from raw and ready-to-eat foods at retail markets in Culiacan, Sinaloa, Mexico. Journal of Microbiology Research 3(2): 92-98. http://article.sapub.org/10.5923.j.microbiology.20130302.06.html [ Links ]
Castañeda-Ruelas, G., Eslava-Campos, C., Castro-del-Campo, N., León-Félix, J. and Chaidez-Quiroz, C. (2014). Listeriosis en México: importancia clínica y epidemiológica. Salud Publica de México, 56: 1-6. http://saludpublica.mx/index.php/spm/article/view/7393/10271 [ Links ]
Castrejón-Alba, M., Mateo-Balmelli, T. and Pérez-Miravete, A. (1997). Meningoencefalitis por Listeria monocytogenes en niños inmunocomprometidos. Boletín Médico del Hospital Infantil de México, 54(2): 76-80. http://www.imbiomed.com/1/1/articulos.php?method=showDetail&id_articulo=12607&id_seccion=134&id_ ejemplar=1300&id_revista=20 [ Links ]
CDC. (Centro de Enfermedades Contagiosas). (2017) Listeria outbreaks. https://www.cdc.gov/listeria/outbreaks/index.html Last checked: January 10th 2018. [ Links ]
Cravioto, A., Tello, A., Navarro, A., Ruiz, J., Villafan, H., Uribe, F. and Eslava, C. (1991) Association of Escherichia coli HEp-2 adherence patterns with type and duration of diarrhoea. The Lancet, 2: 262-264. http://doi.org/10.1016/01406736(91)90868-P [ Links ]
DGE (Dirección General de Epidemiológica). (2018). Sistema Nacional de Epidemiología. Sistema Único de Información. Boletín Epidemiológico Boletín Epidemiológico http://187.191.75.115/anuario/2016/morbilidad/nacional/distribucion_casos_nuevos_ enfermedad_fuente_notificacion.pdf Last checked: January 30th 2018. [ Links ]
Espinoza-Gómez, F., Newton, O., Melnikov, V. and Pinzón, L. (2006). Peritonitis bacteriana espontánea por Listeria. monocytogenes, en un paciente con cirrosis hepática caso clinico. Revista Médica de Chile, 134: 1171-1174. http://doi.org/10.4067/S0034-98872006000900013 [ Links ]
Indrawattana, N., Nibaddhasobon, T., Sookrung, N., Chongsa-Nguan, M., Tungtrongchitr, A, Makino, S, Tungyong, W. and Chaimcumpa, W. (2011). Prevalence of Listeria monocytogenes in raw meats marketed in Bangkok and characterization of the isolates by phenotypic and molecular methods. Journal of Health, Population and Nutrition, 29(1): 26-38. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3075055/ [ Links ]
Jaradat, Z. & Bhunia, A. (2003) Adhesion, invasion, and translocation characteristics of Listeria monocytogenes serotypes in Caco-2 cell and mouse models. Applied Environmental Microbiology, 69: 3640-3645. http://doi.org/10.1128/ AEM.69.6.3640-3645.2003 [ Links ]
Kraus, A., Cabral, A., Sifuentes-Osornio, J. and Alarcón-Segovia, C. (1994). Listeriosis in patients with connective tissue diseases. Journal of Rheumatology, 21(4): 635-638. https://www.ncbi.nlm.nih.gov/pubmed/8035385 [ Links ]
Larsen, C., Nørrung, B., Sommer, H. and Jakobsen, M. (2002) In vitro and in vivo invasiveness of different pulsed-field gel electrophoresis types of Listeria monocytogenes. Applied of Environmental Microbiology, 68: 5698-5703. http://doi.org/10.1128/AEM.68.11.5698-5703.2002 [ Links ]
Midelet-Bourdin, G., Leleu, G., Copin, S., Roche, S. M., Velge, P. and Malle, P. (2006). Modification of a virulence-associated phenotype after growth of Listeria monocytogenes on food. Journal of Applied Microbiology, 10: 300-308. http://doi.org/10.1111/j.1365-2672.2006.02925.x [ Links ]
Nataro, J. B. & Kaper J. P. (1998) Diarrheagenic Escherichia coliI. Clinical Microbiology Review, 11(1): 142-201. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC121379/ [ Links ]
Orsi, R., den-Bakker H. and Wiedmann, M. (2011). Listeria monocytogenes lineages: Genomics, evolution, ecology, and phenotypic characteristics. International Journal of Medical Microbiology 301: 79-96. http://doi.org/10.1016/j. ijmm.2010.05.002 [ Links ]
Pentecost, M., Otto, G., Theriot, J. and Amieva, M. (2006). Listeria monocytogenes invades the epithelia junctions at sites of cell extrusion. PLoS Pathogens, 2: 29-40. http://doi.org./10.1371/journal.ppat.0020003 [ Links ]
Posfay-Barbe, K. & Wald, E (2009). Listeriosis. Seminars Fetal and Neonatal Medicine 14:228-233. http://doi.org/10.1016/j.siny.2009.01.006 [ Links ]
Raheem, D. (2016). Outbreaks of listeriosis associated with deli meats and cheese: an overview. AIMS Microbiololy, 2(3): 230-250. http://doi.org/10.3934/microbiol.2016.3.230 [ Links ]
Roberts, A., Chan, Y. and Wiedmann, M. (2005). Definition of genetically distinct attenuation mechanisms in naturally virulence-attenuated Listeria monocytogenes by comparative cell culture and molecular characterization. Applied and Environmental Microbiology, 71: 3900-3910. http://doi.org/10.1128/AEM.71.7.3900-3910.2005 [ Links ]
Roberts, A. & Wiedmann, M. (2003). Pathogen, host, and environmental factors contributing to the pathogenesis of listeriosis. Cellula and Molecular Life Science, 60: 904-918. https://doi.org/10.1007/s00018-003-2225-6 [ Links ]
Rychli, K., Müller, A., Zaiser, A., Schoder, D., Allerberger, F., Wagner, M. and Schmit-Esser, S. (2014). Genome sequencing of Listeria monocytogenes “Quargel” listeriosis outbreak strains reveals two different strains with distinct in vitro virulence potential. PLoS ONE, 9: e89964. http://doi.org/10.1371/journal.pone.0089964 [ Links ]
Saltijeral, J., Alvarez, V. and García, B. (1999). Presence of Listeria in Mexican cheeses. Journal of Food Safety, 19: 241-247. http://doi.org/10.1111/j.1745-4565.1999.tb00249.x [ Links ]
Scaletsky, C. A., Fabbricotti, S. H., Silva, S. O. C., Morais, M. B. and Fagundes-Neto, U. (2002). Hep-2 adherent Escherichia coli strains associated to with acute infantile diarrhea. Emerging Infection Diseases, 8: 855-858. http://doi.org/10.3201/eid0808.010492 [ Links ]
Scallan, E., Griffin, P., Angulo, F., Tauxe, R,. Widdowson, M., Roy, S., Jones, J. L. and Griffin, P. M. (2011). Foodborne illness acquired in the United States. Emerging Infectious Diseases, 17(1): 7-15. http://doi.org/10.3201/eid1701.P11101 [ Links ]
Silva, L., Pérez, C., Barreras, A. and Figueroa, F. (2007) Identification of Listeria spp. In frankfurters products exhibited for sale. Journal of Animal Veterinary Advance, 6(3): 314-316. http://docsdrive.com/pdfs/medwelljournals/javaa/2007/314-316.pdf [ Links ]
Todd, E.C.D. & Notermans, S. (2011). Surveillance of listeriosis and its causative pathogen, Listeria monocytogenes. Food Control, 22(9), 1484-1490. https://doi.org/10.1016/j.foodcont.2010.07.021 [ Links ]
Vázquez-Boland, J., Khun, M., Berche, P., Chakraborty, T., Domínguez-Bernal, G., Goebel, W., González-Zorn, B., Wehland, J. and Kreft, J. (2001). Listeria pathogenesis and molecular virulence determinants. Clinical Microbiology Review, 14: 584-640. http://doi.org/10.1128/CMR.14.3.584-640.2001 [ Links ]
Vázquez-Salinas, C., Rodas-Suárez, O. and Quiñonez-Ramírez, E. (2001) Occurrence of Listeria species in raw milk in farms on the outskirt of Mexico city. Food Microbiology, 18: 177-181. http://doi.org/10.1006/fmic.2000.0389 [ Links ]
Zunabovic, M., Domig, K. J. and Kneifel, W. (2011) Practical relevance of methodologies for detecting and tracing of Listeria monocytogenes in ready-to-eat foods and manufacture environments - A review. LWT - Food Science and Technology, 44: 351-362. https://doi.org/10.1016/j.lwt.2010.08.005 [ Links ]
Como citar este artículo: Castañeda-Ruelas, G. M., Salazar-Jiménez, E. P., Hernández-Chiñas, U., Eslava-Campos, C., Chaidez-Quiroz, C.. (2019). Adhesion capacity and invasion index of L. monocytogenes strainsisolated from food and clinical cases in Mexico. Revista Bio Ciencias 6, e456. doi: http://dx.doi.org/10.15741/revbio.06.02.03
Recibido: 13 de Febrero de 2018; Aprobado: 30 de Mayo de 2018











 texto em
texto em 


