Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista bio ciencias
versão On-line ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub 02-Out-2020
https://doi.org/10.15741/revbio.06.e665
Artículos Originales
Inactivación de pectinmetilesterasa de mango por calentamiento óhmico
1 Instituto Politécnico Nacional. CICATA-IPN Unidad Querétaro, Cerro Blanco No. 141, Col. Colinas del Cimatario, C.P. 76090, Santiago de Querétaro, Querétaro, México.
2 Posgrado en Ciencia y Tecnología de los Alimentos, Research and Graduate Studies in Food Science, School of Chemistry, Universidad Autónoma de Querétaro, Cerro de las Campanas S/N. Col. Centro, C.P. 76010, Santiago de Querétaro, México.
El presente trabajo trata sobre la inactivación térmica de pectinmetilesterasa (PME) de mango parcialmente purificada aplicando calentamiento óhmico. Las variables de estudio fueron la conductividad eléctrica inicial (0.29 a 0.48 S m-1), el campo eléctrico aplicado (17, 20 y 23 V/ cm) y temperatura de tratamiento (30 a 72 ºC). Se midió la conductividad eléctrica en función de la temperatura de pulpa de mango ataúlfo con 3 niveles de maduración. Se encontró que cada estado de madurez tiene un valor diferente de conductividad, por lo tanto, se procedió a estudiar el efecto de la conductividad eléctrica inicial en la inactivación de PME por calentamiento óhmico. Se encontró que la inactivación de PME tiene una dependencia directa con la conductividad inicial. A conductividad inicial mayor también es mayor la inactivación de PME a un valor de voltaje constante. Por otro lado se encontró que la inactivación de PME depende del valor de campo eléctrico aplicado: A mayor campo eléctrico aplicado mayor es la inactivación de PME. Se reportan los valores D obtenidos de la cinética de inactivación de PME por calentamiento óhmico. Se concluye que la inactivación de PME de mango por calentamiento óhmico depende del campo eléctrico aplicado, como se ha reportado ampliamente, pero también de la conductividad inicial.
Palabras clave: Mango; pectinmetilesterasa; inactivación térmica; calentamiento óhmico
The work herein is about the thermal inactivation of pectin methylesterase (PME) partially purified mango when applying ohmic heating. The variables of the study were the initial electrical conductivity (0.29 to 0.48 S m-1), the applied electric field (17, 20 and 23 V/cm) and treatment temperature (30 to 72 °C). The electrical conductivity was measured in relation to the temperature of Ataulfo mango pulp had 3 ripening levels. It was found that for each ripening level a different electrical conductivity value was obtained, hence, we proceeded to study the effect of the initial electrical conductivity in the inactivation of the PME when ohmic heating is used. It was found that the inactivation of the PME has a direct dependency with the initial electrical conductivity. When the initial electrical conductivity is higher, the inactivation of the PME is also higher at a constant electric field value. On the other hand, it was found that the inactivation of the PME depends on the value of the applied electric field. With a higher applied electric field, the inactivation of the PME is higher. The D values were obtained from the kinetic inactivation of PME when the ohmic heating was applied. It is concluded that the inactivation of mango’s PME by ohmic heating depends on the applied electric field, as it has been widely reported, but it also depends on the initial conductivity.
Key words: Mango; Pectin methylesterase; Thermal inactivation; ohmic heating
Introducción
Los procesos térmicos aplicados en frutas como mango tienen como objetivo pasteurizar pero también inactivar enzimas (Lewis & Heppell, 2000; Diaz-Cruz et al., 2016).
La ventaja de la inactivación enzimática radica en detener procesos naturales de deterioro como cambios de coloración, cambios en viscosidad o separación de fase liquida-Solida. La enzima pectin metilestererasa (PME) tiene la capacidad de demetoxilar el C-6 de residuos galacturonicos de estructuras poliméricas de pectina, ocasionando cambios en la turbidez y en la separación de fases de productos vegetales (Carabalí-Miranda et al., 2009). Se ha reportado que la PME contiene fracciones termoestables y termolábiles ocasionando variaciones en la estabilidad térmica de jugos de pitaya, naranja, zanahoria y acerola (Castaldo et al., 1997). En este sentido, cabe resaltar que los problemas tecnológicos asociados con PME se han atribuido a pectinesterasas termoestables en jugos de cítricos, las cuales son determinantes en el establecimiento de los valores de pasteurización (Versteeg et al., 1980).
En frutos como mango ataúlfo, los estudios de inactivación enzimática de PME son limitados y con distintos resultados acerca de la actividad de esta enzima, en este sentido, (Ashraf et al., 1981) determinó que en pulpa de mango senescente, la actividad de pectinesterasa es mayor que en cualquier etapa de maduración y que esta información permite elegir el estado de madurez más conveniente; sin embargo, Roe & Bruemmer, (1981), reportaron que en la primera etapa de maduración del fruto, esta enzima aumenta su actividad pero luego se estabiliza e incluso disminuye en algunas ocasiones, así mismo, se ha demostrado mayor actividad en el pericarpio que en el mesocarpio con 39 (PME) unidades por cada 100 g en pericarpio y de 4.5 (PME) unidades por cada 100 g en mesocarpio (Labib et al., 1995). Estudios realizados por Jamsazzadeh et al. (2015) indican que existe inhibición de PME por parte de glicoproteínas, explicando así la variabilidad de los resultados en la literatura así como la baja o nula actividad ocasionalmente detectada de esta enzima en diversas frutas.
En general para la preservación de la turbidez y textura de pulpas de mango es necesario que la PME sea inactivada o inhibida. En la literatura se han reportado varios estudios de inactivación de PME tanto por proceso tradicional (intercambiadores de calor) como por calentamiento óhmico.
El calentamiento óhmico o calentamiento por efecto Joule, es una tecnología emergente en el procesamiento de alimentos que aprovecha el movimiento de iones y electrolitos para calentar una matriz alimenticia cuando se le aplica un potencial eléctrico (Castro et al., 2003). El calentamiento óhmico ha mostrado eficacia en distintos campos de la conservación de alimentos, desde procesos de escaldado hasta procesos más específicos como la inactivación de enzimas y microrganismos (Jakób et al., 2010).
Uno de los parámetros importantes para el calentamiento óhmico es la conductividad eléctrica (σ [S/m]) del alimento. La conductividad eléctrica depende principalmente de la temperatura, frecuencia del voltaje aplicado, concentración de electrólitos y tamaño de partícula de los sólidos. La presencia de substancias iónicas tales como ácidos y sales en los alimentos incrementa la conductividad (Palaniappan & Sastry, 1991; Somavat et al., 2012).
En estudios reportados sobre pasteurización e inactivación de enzimas por calentamiento óhmico no se toma en cuenta el valor de la conductividad inicial pero se sabe que es un parámetro importante porque determina la potencia inicial entregada y por lo tanto la razón de calentamiento. Por lo anterior, el objetivo del presente trabajo es determinar el efecto de la conductividad inicial y del potencial eléctrico aplicado en la inactivación térmica de PME de mango ataúlfo utilizando calentamiento óhmico.
Material y Métodos
Extracción de PME.
Se obtuvo bagazo de pulpa de mangos maduros (17° Brix, pH de 4.1+0.2) de la variedad ataúlfo mediante un extractor de jugos comercial (Jack Lalanne Power Juicer, USA). El bagazo de pulpa de mango obtenido fue utilizado para la extracción de PME. El método utilizado para la extracción de PME fue el reportado por Vercet et al. (1999) y Labib et al. (1995) con algunas modificaciones; el bagazo de mango fue suspendido en un mezcla con una solución amortiguadora de borato-acetato (B-A) (0.45 mol/L ácido bórico, 0.1 mol/L tetraborato de sodio, 0.3 mol/L acetato de sodio) pH 8.3 proporción 1:3, conteniendo 0.2 mol/L NaCl. La mezcla se agitó durante 4 h seguidas de 12 h en reposo a 4 °C.
El extracto obtenido fue centrifugado a 3000 g y el sobrenadante fue dializado durante 12 h contra B-A diluido 1:1000, posteriormente el dializado fue sometido a precipitación selectiva (salting out) con sulfato de amonio al 30-80 % de saturación. El precipitado resultante fue re-disuelto en proporción 1:3 en 1:100 B-A, para después ser dializado contra la solución 1:1000 B-A. El dializado resultante fue considerado como un extracto crudo enzimático conteniendo PME denominado E-PME.
Obtención de fracción termoestable de PME de mango ataúlfo.
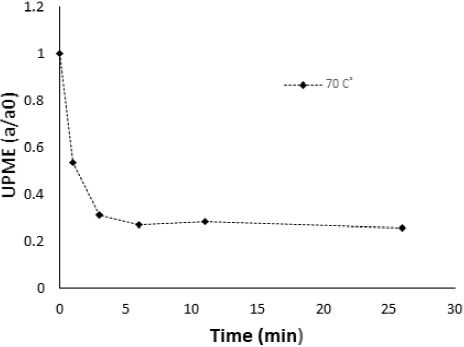
La existencia de fracciones termolábiles y termo estables de PME de mango fue reportada con anterioridad por Labib et al. (1995). Para evitar los efectos de la fracción temolabil se procedió a aplicar a la E-PME de mango un tratamiento isotérmico a 70º C por calentamiento convencional (baño maría) de acuerdo a lo reportado por Diaz-Cruz et al. (2016). La Figura 1 muestra la cinética de inactivación donde se mide la inactivación de la fracción termolábil (antes de los 10 minutos) y la fracción termoestable posterior a este tiempo. La fracción termoestable de PME (PME-T) representó el 15 % del total de actividad del extracto E-PME de mango. El extracto termoestable de PME (PME-T) fue liofilizado y almacenado. La PME-T liofilizada fue re-suspendida en agua destilada y de nuevo dializada contra agua destilada para su uso en la cinética de inactivación tanto por tratamiento tradicional como por calentamiento óhmico.
Determinación de actividad de PME.
La actividad de PME fue cuantificada por titulación de los grupos carboxilo libres de pectina con 10 mM NaOH usando un pH-Stat automático (Metrohm, Herisau, Switzerland). Los ensayos fueron realizados usando 10 mL de una solución de pectina de manzana 70-75 % grado de esterificación (Sigma-Aldrich) al 1 % como sustrato, conteniendo 0.2 mol/L NaCl, ajustando el pH de mezcla a 8.5 con 0.1 N NaOH bajo consideraciones de autodegradación de la pectina descritas por Renard & Tibault, (1996), y finalmente ajustando el pH a 7 con 10 mM HCl, inmediatamente después de adicionar 1.6 mL de extracto crudo de PME para control de pH durante el tiempo de reacción. El pH se mantuvo a 7 mediante la adición de 10 mM NaOH por un periodo de 10-15 min a 30 °C. Una unidad de actividad de PME (UPME) fue definida como unidad de enzima capaz de liberar 1 mmol de grupos carboxilo/ min (Balaban et al., 1991) y calculada de acuerdo a la Ecuación 1.
Tratamientos térmicos por el proceso tradicional TP.
Volúmenes de 1.6 mL de E-PME fueron tratados a diferentes tiempos y temperaturas (68-78 °C) en tubos de cristal de 1.7 mL por triplicado. Los tubos fueron colocados en baño de agua a temperatura seleccionada. Después de los tratamientos, las muestras fueron inmediatamente enfriadas en un baño de agua fría, finalmente se analizó la actividad residual de PME dentro de los primeros 60 min posteriores a cada tratamiento. Los tiempos de calentamiento fueron registrados a partir de que las muestras alcanzaron la temperatura deseada.
Tratamientos por calentamiento óhmico.
Los tratamientos por calentamiento óhmico fueron realizados aplicando tres intensidades de campo eléctrico (17, 20 y 23 V/cm) en un dispositivo de calentamiento óhmico construido en laboratorio. Se utilizó una celda de calentamiento cubica con agitación magnética por imán para garantizar una temperatura homogénea en todo el volumen. La temperatura fue monitoreada en diferentes puntos de la celda. Aplicado el tratamiento, las muestras fueron inmediatamente enfriadas en un baño de agua fría y analizada la actividad residual de PME.
Equipo de calentamiento óhmico.
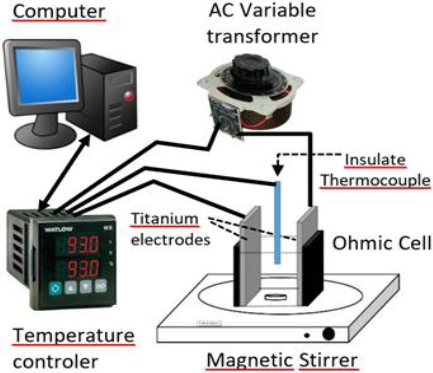
El equipo de calentamiento óhmico utilizado fue construido en CICATA-IPN Unidad Querétaro, México, como se muestra en la Figura 2. El equipo consta de un transformador variable (STACO, US, 220 VAC); un control de temperatura con rampa de calentamiento e interface tipo RS232 a una computadora (Watlow Series 981); 2 multímetros de banco desktop (Model 34410A, Agilent) para adquirir los valores de voltaje y corriente AC a una computadora (no se muestran en la Figura 2); un termopar aislado tipo T (Physitemp Intruments, model IT-18) y un agitador magnético (CORNING, model PC-320). Las celdas de calentamiento óhmico utilizadas para medir la actividad de PME, fueron construidas como cubos de acrílico de 1cm x 1.7cm x 1 cm con 2 electrodos de titanio de 1cm x 1.7 cm, y se incorporó un agitador magnético de 4 mm para homogeneizar la temperatura en la celda.
Determinación de los valores de KE y D.
La actividad residual de PME obtenida a partir de cada tratamiento por calentamiento óhmico y por tratamiento convencional fue calculada como un porcentaje de la actividad enzimática en extracto sin tratamiento térmico. Se utilizó un modelo cinético de primer orden para ajustar los datos experimentales correspondientes a la actividad residual. Ecuación 2.
Donde a and b son la actividad inicial y residual respectivamente al tiempo t [min], k E es la constante de la razón de inactivación [1/min] y t es el tiempo [min].
Para una mejor representación de los datos se utilizó el tiempo de reducción decimal o valor D. El valor D es definido como el tiempo necesario, a una temperatura dada, para que la actividad enzimática se reduzca en un ciclo logarítmico, es decir, el 90 %. Para el cálculo del valor D se utilizó la ecuación 3:
Donde D es el tiempo de reducción decimal [min].
Análisis estadístico
Los datos obtenidos se analizaron mediante ANOVA y la comparación de medias se realizó mediante la prueba de Tukey a p≤0.05. El análisis estadístico fue desarrollado utilizando el programa Minitab 16 (Minitab Inc, 2010). Se reporta la media ± la desviación estándar de tres réplicas.
Resultados y Discusión
Conductividad eléctrica de pulpa de mango con tres estados de madurez.
Se midió la conductividad eléctrica en función de la temperatura de mango variedad ataúlfo con madurez nivel L3 (14.1º Brix), L4 (15.4º Brix) and L5 (17.0º Brix) según la clasificación de Kader (2015). La conductividad eléctrica tiene una dependencia lineal con respecto a la temperatura como se muestra en la Figura 3. Se observa que los 3 estados de madurez no mostraron ninguna diferencia significa (p≤0.05) pero si una tendencia donde la conductividad correspondiente a madurez L5 es mayor a las conductividades de madurez L4 y madurez L3. Estas conductividades eléctricas concuerdan con lo reportado por Sosa-Morales et al. (2009). Los valores de conductividad obtenidos de mango a diferentes grados de madurez se tomaron como referencia para estudiar el efecto de la conductividad inicial durante calentamiento óhmico (Tabla 1).
Tabla 1 Conductividad eléctrica (S*m-1) de pulpa de mango de tres estados de madurez y conductividad eléctrica (S*m-1) de ECE termo-resistente a diferentes concentraciones de NaCl.
| Temperature (°C) |
Electrical conductivity of different ripe states of Ataulfo mango's pulp (S*m-1) |
Electrical conductivity of PME-T with different NaCl concentration(S*m-1) |
||||||
|---|---|---|---|---|---|---|---|---|
| L3 | L4 | L5 | 0.021 | 0.028 | 0.031 | 0.035 | 0.043 | |
| 30 | 0.38 ± 0.10 | 0.37 ± 0.06 | 0.40 ± 0.08 | 0.29 ± 0.02 | 0.34 ± 0.02 | 0.37 ± 0.02 | 0.46 ± 0.03 | 0.48 ± 0.02 |
| 36 | 0.43 ± 0.11 | 0.42 ± 0.09 | 0.45 ± 0.09 | 0.32 ± 0.02 | 0.38 ± 0.02 | 0.45 ± 0.02 | 0.53 ± 0.02 | 0.57 ± 0.06 |
| 42 | 0.45 ± 0.12 | 0.47 ± 0.10 | 0.50 ± 0.10 | 0.36 ± 0.02 | 0.44 ± 0.02 | 0.52 ± 0.02 | 0.61 ± 0.02 | 0.66 ± 0.04 |
| 48 | 0.50 ± 0.12 | 0.52 ± 0.12 | 0.55 ± 0.12 | 0.40 ± 0.02 | 0.51 ± 0.02 | 0.59 ± 0.02 | 0.70 ± 0.02 | 0.75 ± 0.04 |
| 54 | 0.55 ± 0.14 | 0.57 ± 0.13 | 0.59 ± 0.12 | 0.45 ± 0.02 | 0.58 ± 0.02 | 0.67 ± 0.02 | 0.77 ± 0.02 | 0.83 ± 0.05 |
| 60 | 0.59 ± 0.14 | 0.62 ± 0.14 | 0.63 ± 0.13 | 0.49 ± 0.02 | 0.65 ± 0.02 | 0.75 ± 0.02 | 0.85 ± 0.02 | 0.94 ± 0.05 |
| 66 | 0.65 ± 0.15 | 0.67 ± 0.15 | 0.69 ± 0.15 | 0.53 ± 0.02 | 0.71 ± 0.02 | 0.84 ± 0.02 | 0.93 ± 0.02 | 1.06 ± 0.05 |
| 72 | 0.72 ± 0.15 | 0.72 ± 0.15 | 0.74 ± 0.15 | 0.56 ± 0.02 | 0.75 ± 0.02 | 0.90 ± 0.02 | 1.00 ± 0.02 | 1.12 ± 0.05 |
Conductividad eléctrica de PME-T.
La conductividad eléctrica inicial es un parámetro muy importante cuando se utiliza calentamiento óhmico. Por ello se procedió a investigar el efecto que tiene la conductividad eléctrica inicial PME-T en el perfil de calentamiento cuando se aplica un campo eléctrico. La conductividad inicial de PME-T se ajustó con NaCl con el fin de evaluar el efecto de la conductividad eléctrica inicial en la inactivación de la enzima. Los valores de conductividad eléctrica inicial son los que se muestran en la Tabla 1 con su correspondiente concentración de NaCl utilizada (rango de conductividad inicial de 0.29 a 0.48 S/m).
La Figura 4 muestra los perfiles de temperatura en función del tiempo para cada conductividad eléctrica inicial de PME-T obtenida aplicando un campo eléctrico constante de 20 V/cm y hasta una temperatura de 72 °C. Se muestra que la velocidad de calentamiento o pendiente de calentamiento depende de la conductividad eléctrica inicial. Esto quiere decir que el valor inicial de la conductividad eléctrica determina la razón de calentamiento de la muestra y por lo tanto el tiempo para alcanzar la temperatura de proceso. Como la conductividad eléctrica depende del contenido de solidos solubles en el agua, entonces la conductividad eléctrica es una función del estado de madurez del mango, como se mencionó anteriormente. Por lo tanto, la inactivación de la enzima PME por calentamiento óhmico dependerá del valor inicial de la conductividad eléctrica. En el calentamiento óhmico la potencia eléctrica es calculada por medio de la ley de Joule que dice que la potencia eléctrica entregada es una función del voltaje y de la conductividad (Sarang et al., 2008). Así, de acuerdo con los resultados, la razón de calentamiento depende de la conductividad eléctrica inicial y por lo tanto de la potencia aplicada. A una alta conductividad inicial, una mayor potencia es aplicada alcanzando rápidamente la temperatura de procesamiento. Ahora será necesario conocer el efecto de la conductividad eléctrica inicial en la actividad residual.
Actividad residual de PME-T con diferentes concentraciones de NaCl por calentamiento óhmico y proceso tradicional.
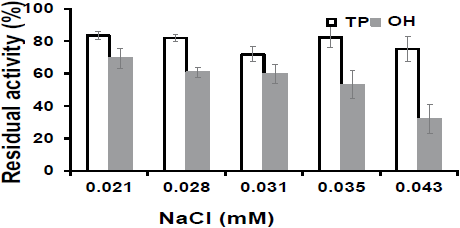
A continuación se procedió a obtener la actividad residual de PME-T durante un tratamiento térmico por calentamiento óhmico (OH) y por proceso tradicional (TP) para determinar el efecto de la conductividad eléctrica inicial en la inactivación de PME. Se aplicó un campo eléctrico de 20 V/cm. Los resultados se muestran en la Figura 5. Los tratamientos con calentamiento óhmico presentaron un menor valor de actividad residual de PME que los tratamientos por proceso tradicional, existiendo una relación inversamente proporcional entre la conductividad eléctrica inicial y la actividad residual. A mayor conductividad eléctrica inicial menor actividad residual. En la Figura 5 se observa que en el proceso tradicional TP no existe un efecto significativo de la actividad residual. También se puede observar que no existe efecto de la concentración de NaCl en la inactivación de la enzima ya que la actividad residual se mantiene constante. Por lo tanto podemos afirmar que existe un efecto importante entre la actividad residual y la conductividad eléctrica inicial cuando se aplica calentamiento óhmico. Este es un resultado importante de la presente investigación.
Cinéticas de inactivación de PME durante calentamiento óhmico.
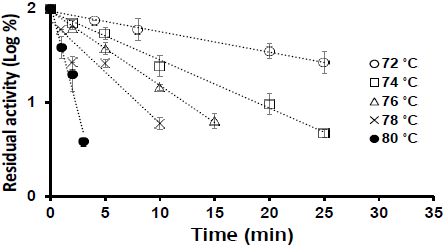
Una vez que se determinó el efecto de la conductividad inicial en la inactivación de PME-T, se procede a realizar experimentos para determinar el efecto del campo eléctrico a una conductividad constante. El valor de conductividad eléctrica inicial elegida fue de 0.037 S/m correspondiente al valor promedio del rango de conductividades iniciales de la Tabla 1. La concentración de NaCl fue de 0.031 mM dando una conductividad eléctrica de 0.037 S/m a 30 ºC. Se realizaron las mismas cinéticas de inactivación del extracto PME-T para un proceso convencional. La Figura 6 muestra la cinética de inactivación de PME-T por calentamiento óhmico a un campo eléctrico de 20 V/cm. Los resultados muestran que existe un efecto del campo eléctrico en la inactivación del extracto de PME-T. A mayor campo eléctrico, menor actividad residual a una misma temperatura. De acuerdo a algunos autores el efecto del campo eléctrico en la inactivación de la enzima PME es debido a la polarización de las moléculas de la enzima produciendo un efecto de electrolisis o bien la corriente eléctrica dentro del alimento produce una electroporación en la membrana celular inhibiendo la acción enzimática (Camargo et al., 2010). Este es un resultado importante porque muestra que el proceso por calentamiento óhmico inactiva la enzima PME a una temperatura menor permitiendo que el mango pueda mantener sus características texturales debido a un menor tratamiento térmico. Lo que es importante en el proceso de pasteurización.
La Tabla 2 muestra los valores D y los valores de constante de inactivation rate constant kE obtenidas de la cinética de inactivación de PME-T tanto por calentamiento óhmico como por proceso tradicional. Se observa que los valores de KE se incrementan de acuerdo a la temperatura pero también de acuerdo al potencial aplicado. Con respecto al proceso tradicional el valor D a 78 ºC es de 20.95 pero para calentamiento óhmico a la misma temperatura los valores D varían de acuerdo al voltaje aplicado: para un campo eléctrico de 17 V/cm el valor D a 78º fue de 13.34; para un campo eléctrico de 20 V/cm el valor D a 78 ºC fue de 5.73; y a un campo de 23V/cm el valor D a 78 ºC fue de 3.99. Como el valor D es el tiempo en el cual la actividad enzimática es reducida un ciclo logarítmico, entonces, los resultados indican que la inactivación de la enzima por calentamiento óhmico se lleva a cabo más rápidamente que por el proceso tradicional a una misma temperatura, por ejemplo, cuando se aplica 20 V/ cm, la actividad residual se reduce casi a un ciclo logarítmico más comparando con el proceso tradicional. Este resultado es importante pues garantiza la inactivación de la enzima. También se observa que es posible obtener un mismo valor D a temperaturas menores cuando se aplican diferentes campos eléctricos. Esto indica que el calentamiento óhmico puede lograr la misma inactividad enzimática que un proceso convencional pero a una temperatura menor, teniendo como ventaja que a menor tratamiento térmico sus propiedades funcionales y texturales se conserven (Jakób et al., 2010).
Tabla 2 Valores D y kE de inactivación de PME durante calentamiento óhmico.
| Treatment / Electric Field strength | Temperature (ºC.) | D Value (min) |
Constant of inactivation (ke [sec-1]) |
|---|---|---|---|
| 72 | 82.67 | 0.03 | |
| Traditional | 74 | 56.22 | 0.04 |
| 76 | 36.24 | 0.06 | |
| Process | 78 | 20.95 | 0.11 |
| 72 | 45.40 | 0.05 | |
| 74 | 31.08 | 0.07 | |
| 17 V/cm | 76 | 21.80 | 0.11 |
| 78 | 13.34 | 0.17 | |
| 72 | 38.97 | 0.06 | |
| 74 | 18.67 | 0.12 | |
| 20 V/cm | 76 | 12.29 | 0.19 |
| 78 | 5.73 | 0.40 | |
| 72 | 41.85 | 0.06 | |
| 74 | 30.36 | 0.18 | |
| 23 V/cm | 76 | 5.98 | 0.38 |
| 78 | 3.99 | 0.58 |
Si bien la discusión acerca de las causas primarias de la inactivación de PME por calentamiento óhmico aún son tema de debate, en este trabajo se muestran dos hechos importantes: 1) La conductividad eléctrica inicial tiene efecto en la inactivación de PME-T a un campo eléctrico constante, y 2) El campo eléctrico tiene un efecto de inactivación de PME-T a conductividad constante. Esto quiere decir que el aumento de portadores de carga por adición de NaCl beneficia a la inactivación de PME-T por calentamiento óhmico.
Conclusiones
En el presente estudio se mostró que la conductividad eléctrica inicial de un extracto de PME de mango durante calentamiento óhmico tiene un efecto sobre la actividad residual de PME. A una mayor conductividad inicial existe una menor actividad residual de PME. También se muestra que el efecto del campo eléctrico durante calentamiento óhmico es directamente proporcional a la inactividad enzimática de extracto de PME de mango. A mayor campo eléctrico mayor inactividad enzimática a una misma temperatura. Esto demuestra el efecto sinérgico del calentamiento óhmico entre la conductividad y el campo eléctrico.
El presente estudio muestra que el calentamiento óhmico puede lograr la misma inactividad enzimática de PME de mango que un proceso convencional pero a una temperatura menor, teniendo como ventaja una menor degradación de sus propiedades funcionales y texturales.
Agradecimientos
Los autores desean agradecer al Instituto Politécnico Nacional y CONACYT por su apoyo financiero a través de la subvención SIP 20161290 y 20171461.
REFERENCIAS
Ashraf, M; Khan, N; Ahmad, M. and Elahi, M. (1981). Studies on the pectinesterase activity and some chemical constituents of some pakistani mango varieties during storage ripening. Journal of Agricultural and Food Chemistry, 29(3): 526-528. https://doi.org/10.1021/jf00105a023 [ Links ]
Balaban, M. O., Arreola, A. G., Marshall, M., Peplow, A., Wei, C. I. and Cornell, J. (1991). Inactivation of Pectinesterase in Orange Juice by Supercritical Carbon Dioxide. Journal of Food Science, 56(3): 743-746. https://doi.org/10.1111/j.1365-2621.1991.tb05372.x [ Links ]
Camargo Knirsch Marcos, Alves dos Santos Carolina, Martins de Oliveira Soares Vicente António Augusto, and Vessoni Penna Thereza Christina, (2010). Ohmic heating - a review, Trends in Food Science & Technology, 21(9): 436-441. https://doi.org/10.1016/j.tifs.2010.06.003 [ Links ]
Carabalí-Miranda Ingrid, Narváez-Cuenca Carlos, and Restrepo-Sánchez Luz (2009). Extracción y medida de actividad de Pectin Metil Estearasa en Pitaya Amarilla (Acanthocereus pitajaya), enzima relacionada con el ablandamiento. Acta biol. Colomb. 14(2): 73-82. https://www.redalyc.org/pdf/3190/319027883006.pdf [ Links ]
Castro, I., Teixeira, J. A., Salengke, S., Sastry, S. K. and Vicente, A. A. (2003). The influence of field strength, sugar and solid content on electrical conductivity of strawberry products. Journal of Food Process Engineering, 26(1): 17-29. https://onlinelibrary.wiley.com/doi/epdf/10.1111/j.1745-4530.2003.tb00587.x [ Links ]
Castaldo, D., Laratta, B., Loiudice, R., Giovane, A., Quagliuolo, L. and Servillo, L. (1997). Presence of Residual Pectin Methylesterase Activity in Thermally Stabilized Industrial Fruit Preparations. LWT - Food Science and Technology, 30(5): 479-484. http://dx.doi.org/10.1006/fstl.1996.0211 [ Links ]
Diaz-Cruz, C. A., Regalado-Gonzalez, C., Morales-Sanchez E., Velazquez, G., Gonzalez-Jasso, E. and Amaya-Llano, S. L. (2016). Thermal inactivation kinetics of partially purified mango pectin methylesterase. Food Science and Technology (Campinas). 36(2): 282-285. https://doi.org/10.1590/1678-457X.02815 [ Links ]
Jakób, A., Bryjak, J., Wójtowicz, H., Illeová, V., Annus, J. and Polakovič, M. (2010). Inactivation kinetics of food enzymes during ohmic heating. Food Chemistry. 123(2): 369-376. https://doi.org/10.1016/j.foodchem.2010.04.047 [ Links ]
Jamsazzadeh Kermani, Z., Shpigelman, A., Houben, K., ten Geuzendam, B., Van Loey, A. M. and Hendrickx, M. E. (2015). Study of mango endogenous pectinases as a tool to engineer mango purée consistency. Food Chemistry, 172(1): 272-282. https://doi.org/10.1016/j.foodchem.2014.09.077 [ Links ]
Kader A del A. (2015). Mango: Recommendations for Maintaining Postharvest Quality. 2015 [ Links ]
Labib, A. A. S., El-Ashwah, F. A., Omran, H. T. and Askar, A. (1995). Heat-inactivation of mango pectinesterase and polygalacturonase. Food Chemistry. 53(2): 137-142. https://doi.org/10.1016/0308-8146(95)90778-6 [ Links ]
Lewis M. C. & Heppell N. (2000). Continuous Thermal Processing of Foods Pasteurization and UHT Sterilization. ISBN: 0-8342-1259-5 https://www.springer.com/gp/book/9780834212596#reviews [ Links ]
Minitab Inc. (2010). Minitab LLC. https://www.minitab.com [ Links ]
Palaniappan, S. & Sastry, S. K. (1991). Electrical conductivity of selected juices: influences of temperature, solids content, applied voltage, and particle size. Journal of Food Process Engineering. 14(4): 247-260. https://doi.org/10.1111/j.1745-4530.1991.tb00135.x [ Links ]
Renard, C. M. G. C. & Thibault, J.-F. (1996). Degradation of pectins in alkaline conditions: kinetics of demethylation. Carbohydrate Research. 286:139-150. https://doi.org/10.1016/0008-6215(96)00056-0 [ Links ]
Roe, B. & Bruemmer, J. H. (1981). Changes in pectic substances and enzymes during ripening and storage of Keitt mangoes. Journal of Food Science, 46:189. https://doi.org/10.1111/j.1365-2621.1981.tb14560.x [ Links ]
Sarang S., Sastry S. K. and Knipe L. (2008). Electrical conductivity of fruits and meats during ohmic heating. Journal of Food Engineering. 87: 351-356. https://doi.org/10.1016/j.jfoodeng.2007.12.012 [ Links ]
Somavat, R., Mohamed M. H., Chung Y. K., Yousef A. E. and Sastry S. K., (2012). Accelerated inactivation of Geobacillus stearothermophilus spores by ohmic heating. Journal of Food Engineering. 108: 69-76. https://doi.org/10.1016/j.jfoodeng.2011.07.028 [ Links ]
Sosa-Morales A, Tiwari C, Wang C, Tang C, Garcia A. and Lopez-Malo B. (2009). Dielectric heating as a potential post-harvest treatment of disinfesting mangoes, Part I: Relation between dielectric properties and ripening. Biosystems engineering. 103(3): 297-303 https://doi.org/10.1016/j.biosystemseng.2009.02.015 [ Links ]
Vercet, A., Lopez, P. and Burgos, J. (1999). Inactivation of Heat-Resistant Pectinmethylesterase from Orange by Manothermosonication. J Agric Food Chem. 47(2): 432-437. https://doi.org/10.1021/jf980566v [ Links ]
Versteeg, C., Rombouts, F. M., Spaansen, C. H. and Pilnik, W. (1980). Thermostability and orange juice cloud destabilizing properties of multiple pectinesterases from orange. Journal of Food Science. 45: 969-9777. https://doi.org/10.1111/j.1365-2621.1980.tb07489.x [ Links ]
Como citar este artículo: Morales-Sánchez, E., Díaz-Cruz, A., Regalado, C., Velázquez, G., González-Jasso, E., Gaytán-Martínez, M. (2019). Inactivación de pectinmetilesterasa de mango por calentamiento óhmico. Revista Bio Ciencias 6, e665. doi: https://doi.org/10.15741/revbio.06.e665
Recibido: 05 de Febrero de 2019; Aprobado: 12 de Julio de 2019











 texto em
texto em