Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista bio ciencias
versão On-line ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub 02-Out-2020
https://doi.org/10.15741/revbio.06.e470
Artículos Originales
El medio de cultivo influye en la actividad promotora del crecimiento vegetal de Gluconacetobacter diazotrophicus en zanahoria y remolacha
1Instituto de Investigaciones Fundamentales en Agricultura Tropical “Alejandro de Humboldt”, Cuba.
2Facultad de Biología, Universidad de La Habana. Calle 25 #455 e/ J e I Vedado, La Habana. Cuba.
Para el crecimiento de Gluconacetobacter diazotrophicus se han utilizado diferentes medios de cultivos, aunque existen pocos trabajos que ilustran cómo estos afectan las características del microorganismo y su efecto en la planta. El objetivo de esta investigación fue evaluar en condiciones in vitro e in vivo el efecto de cinco medios de cultivos sobre el potencial como promotor del crecimiento vegetal de esta especie bacteriana en zanahoria y remolacha. La concentración del microorganismo después de 48 horas de fermentación en zaranda rotatoria se mantuvo en el orden de 1012 CFU. mL-1para todos los medios de cultivo evaluados. Al finalizar el proceso fermentativo la bacteria presentó un crecimiento estable en un medio carente de nitrógeno combinado; sin embargo, las diferencias en los halos de solubilización en el medio NBRIP indican una afectación en la capacidad de solubilización de fósforo. El efecto de la aplicación de los productos finales de la fermentación sobre zanahoria y remolacha depende del medio utilizado para el crecimiento del microorganismo. Variantes como el SG y SYP producen una mayor influencia sobre el follaje, mientras que el medio MA (elaborado a base de arroz) sobresale por su efecto sobre las raíces de ambas especies hortícolas. De esta forma se demuestra que el medio de cultivo influye en las características como promotor del crecimiento vegetal de G. diazotrophicus en zanahoria y remolacha.
Palabras clave: Gluconacetobacter diazotrophicus; bioproductos; metabolismo
For Gluconacetobacter diazotrophicus cultivation have been used different media, but a few researches shows the changes in the plant growth promoting traits of this microorganism. The aim of this work was to evaluate in vitro and in vivo conditions the effect of five culture media in plant growth promotion activity of this bacterium in carrot and sugar beet. The bacterium concentration after 48 hours of fermentation in a shaker was 1012 CFU.mL-1 in all media. After the fermentation process, the bacterium has stable growth in culture medium without combine nitrogen; but it has difference in the solubilization halo in NBRIP medium, indicating the affectation of phosphorous solubilisation ability. The effect of final fermentation products application over carrot and sugar beet also depend of the medium used for microorganism growth. Media like SG and SYP where better for the action over lives and MA medium (rice) was better in the action over root in both vegetables species. The results show the influence of culture medium in plant growth promotion activities of G. diazotrophicus in carrot and sugar beet.
Key words: Gluconacetobacter diazotrophicus; bioproduct; metabolism
Introducción
Gluconacetobacter diazotrophicus es una bacteria endófita perteneciente al phylum Proteobacteria, sección Alfa, orden Rhodospirillales y familia Acetobactereceae. Tiene grandes atractivos para la elaboración de biofertilizantes por su capacidad de fijar nitrógeno atmosférico, producir ácido indolacético (IAA), solubilizar nutrientes minerales y presentar actividad antagonista frente a organismos fitopatógenos (Reis et al., 2015). A ello se le une los resultados positivos obtenidos por su inoculación sobre gramíneas (Kumarasamy & Santhaguru, 2011 ; Indi et al., 2014; Patil et al., 2011; Hernández-Escareño et al., 2015) y viandas tropicales (Dibut et al., 2011).
En la literatura se describen diferentes medios de cultivo utilizados para el crecimiento de esta especie bacteriana. El medio LGIM líquido, se empleó por Molinari & Bioardi (2013) para evaluar la producción de biomasa y levana, mientras que en el 2011, Dibut et al. (2011) obtuvieron un biopreparado de uso agrícola en el medio SG. En las investigaciones realizadas para determinar la influencia del ácido glucónico en la actividad antagonista del microorganismo se usó el medio DYGS (Nieto-Peñalver et al., 2014), al igual que para investigar aspectos relacionados con el proceso de colonización endofítica (Alquéres et al., 2013). Aunque el medio de cultivo utilizado para el crecimiento del microorganismo puede ejercer efectos sobre su metabolismo, no se encontró en la literatura consultada ninguna investigación donde se demuestre su acción sobre el potencial como bacteria promotora del crecimiento vegetal de la especie bacteriana. Este aspecto es de gran importancia para la aplicación biotecnológica de G. diazotrophicus. Igualmente resulta determinante para el empleo del microorganismo en la obtención de bioproductos que estimulen el crecimiento de especies vegetales de interés económico, ya que de la composición del medio dependerá entonces la efectividad de estos.
El objetivo de este trabajo fue determinar la influencia del medio de cultivo utilizado para el crecimiento de G. diazotrophicus en su potencial como bacteria promotora del crecimiento vegetal in vitro e in vivo.
Material y Métodos
El trabajo se desarrolló durante los años 2012-2014
Cepa bacteriana y medios de cultivo
Se utilizó la cepa INIFAT Gd-42 de Gluconacetobacter diazotrophicus conservada en la Colección de Bacterias Beneficiosas del Instituto de Investigaciones Fundamentales de Agricultura Tropical Alejandro de Humboldt (INIFAT) (Ríos et al., 2016b). El microorganismo fue crecido en condiciones de fermentación sumergida en agitador orbital a 150 rpm, a 28 ± 2 °C de temperatura. En el estudio se utilizaron cinco medios de cultivo previamente empleados en el estudio de esta bacteria: LGI (Cavalcante & Döbereiner, 1998); SG (Döbereiner et al., 1993); SYP (Caballero-Mellado & Martínez-Romero, 1994); una modificación del medio DYGS (Siqueira et al., 2009) y el medio MA (Ortega, 2012) (Tabla 1). Todos se prepararon en matraces Erlenmeyers de 500 mL que contenían 250 mL de volumen efectivo, los que se inocularon con la cepa pura. El crecimiento del microorganismo se evaluó por conteo de colonias en medio sólido y calculando las unidades formadoras de colonias (CFU mL-1) (Madigan et al., 2014). Las muestras se tomaron cada dos horas durante las primeras 12 horas de cultivo y a partir de ese momento, cada cuatro hasta finalizar las 48 horas de fermentación.
Tabla 1 Composición de los medios de cultivo utilizados en el estudio (para cada litro).
| LGI | SG | SYP | DYGS | MA |
|---|---|---|---|---|
| Sucrose 50 g | Glycerol 10 mL | Sucrose 10 g | Sucrose 10 g | Sucrose 50 g |
| Sugar 50 g | ||||
| Triptone 5.0 | Bacteriological Peptone 2g | |||
| Glutamic acid 1.5 | Rice cooked extract 50 g | |||
| Yeast extract 0.03 | Yeast extract 1 | Yeast extract 3 g | Yeast extract 3 g | Yeast extract 5 g |
| K2HPO4 0.1 | K2HPO4 0,1 | K2HPO4 1g | MgSO4 1.5 g | |
| KH2PO4 0.3 | KH2PO4 0,3 | KH2PO4 EG | MgSO4 1.5 g | |
| CaCl22H2O 0.01 | MgSO4 7H20 | KH2PO4 3g | K2HPO4 1.0 g | |
| MgSO47H2O 0.1 | 0.1 | KH2PO4 3g | ||
| Na2MoO4 2H2O | CaCl2 2H|2O | |||
| 0.001 | 0,001 | |||
| FeCl3 6H2O 0.005 | Na2MoO4 2H2O | |||
| 0.001 | ||||
| FeCl3 6H2O | ||||
| 0.05 | ||||
| pH 5.5 | pH 6.0 | pH 6.0 | pH 6.0 | |
| Cavalcante & Döbereiner, 1998 | Döbereiner et al., 1993 | Caballero-Mellado & Martínez-Romero, 1994 | Siqueira et al., 2009 | Ortega, 2012 |
Evaluación in vitro de la actividad fijadora de nitrógeno y de solubilización de fósforo
Una vez crecida la bacteria en los cinco medios de cultivo, se evaluó en condiciones in vitro su capacidad de fijar nitrógeno atmosférico y de solubilizar fósforo. Para el primer caso se utilizó un criterio cualitativo (Pérez et al., 2014), basado en el crecimiento del microorganismo durante cinco inoculaciones sucesivas realizadas por punción en el medio LGI semisólido libre de nitrógeno combinado (Cavalcante & Döbereiner, 1998). La solubilización de fósforo se evaluó a partir de la resta entre el halo de solubilización y el halo decrecimiento de la colonia formado en el medio NBRIP (Nautiyal, 1999) a las 72 horas de incubación. En ambas determinaciones la bacteria se mantuvo a una temperatura de 28 ± 2 °C y se realizaron tres repeticiones de cada uno.
Evaluación de la actividad estimuladora del crecimiento de las plantas
Para conocer el efecto del medio de cultivo sobre la acción estimuladora de G. diazotrophicus en condiciones in vivo se realizó un experimento en casa de cristal. Se utilizaron macetas de 2 kg de capacidad que se rellenaron con suelo Ferralítico Rojo (Hernández et al., 2015) sin esterilizar, caracterizado por presentar un 2.85 % de materia orgánica, pH de 7.3 unidades, 2.09 ppm de fósforo asimilable y un contenido de iones Ca2+, Mg2+, Na+ y K+ de 19.1; 4.2; 0.11 y 0.38 c.mol.kg suelo-1.
Se emplearon semillas sin esterilizar de zanahoria (Daucus carota L.) cultivar New Kuroda y de remolacha (Beta vulgaris L.) cultivar Detroit Red. Para la obtención de los productos se cultivó G. diazotrophicus en los cinco medios de cultivo por separado en condiciones de fermentación sumergida en zaranda orbital a 150 rpm de agitación, a 28 ± 2 °C de temperatura. Cada cultivo se resuspendió en agua común en una proporción del 10 %, obteniendo una densidad de población final de la bacteria de 108 CFU.mL-1. La solución final se aplicó por aspersión al suelo, a razón de 10 mL por maceta, posterior a la germinación de la semilla de ambos cultivos, entendiendo ésta como la emergencia de la planta por encima de la superficie del suelo, la que se correspondió con un periodo de tiempo de 15 días después de sembradas. A los 60 días para el caso de la remolacha y 70 días para la zanahoria, correspondientes a plantas de 75 y 85 días de edad, respectivamente, se evaluaron como indicadores de crecimiento el largo (cm) y el diámetro (cm) de la raíz, considerando para este último la zona más ancha del órgano (1 cm del ápice), el número de hojas, la altura de las plantas (cm), el peso fresco de la planta (g). Para los dos primeros indicadores se utilizó un pie de Rey (0.01 mm de error), mientras que en la medición de la altura de la planta se empleó una regla graduada y se midió, para ambas especies vegetales, desde el ápice de la raíz hasta el inicio de las hojas. El peso fresco fue cuantificado con una balanza semianalítica (0.01 g de error). Se utilizaron 20 plantas por tratamiento (medio de cultivo). Se adicionó un testigo con la misma cantidad de plantas, donde se aplicó solamente agua común.
Pruebas estadísticas
Los resultados obtenidos en cada una de las determinaciones realizadas se promediaron con el programa Microsoft Office Excel sobre Windows, el que también se empleó para elaborar los gráficos y para el cálculo de la desviación estándar de la media. El procesamiento estadístico se realizó con el empleo del programa STATGRAPHICS versión 5.0, con el que también se comprobó la normalidad y homogeneidad de las varianzas de los tratamientos, según las pruebas de Kolmogorov-Smirnov, Cochran C, Hartley y Bartlett. Se utilizó un Diseño Completamente Aleatorizado. Se realizó un Análisis de Varianza (ANOVA) con una prueba de Duncan al 5 % de significación.
Resultados
Al analizar las curvas de crecimiento de la cepa INIFAT Gd-42 de G. diazotrophicus se destaca el establecimiento de varias etapas en los cinco medios de cultivo utilizados (Figura 1), lo que corresponde con un crecimiento diáuxico. La primera se encuentra enmarcada entre las horas 0 y 10, la segunda entre 10 y 16, la tercera, entre las 16 y 24, la cuarta entre 24 y 36 y la última desde las 36 hasta las 48 h. Esta última etapa corresponde con la fase estacionaria del crecimiento. En las anteriores, se pueden observar las características típicas de un crecimiento diáuxico, donde existen dos fases lag seguidas de su correspondiente fase exponencial. Los valores de concentración del microorganismo oscilaron en el orden de las 1012 CFU.mL-1, y no mostraron diferencias estadísticas significativas al completar las 48 horas del proceso fermentativo.
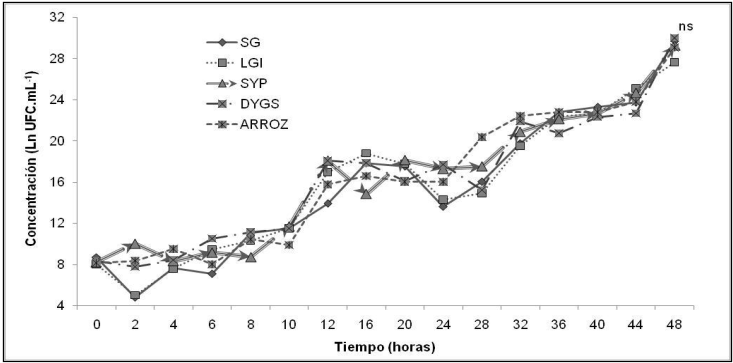
Figura 1 Comportamiento de la concentración de G. diazotrophicus cepa INIFAT Gd-42 crecien-do en cinco medios de cultivo. 48 horas: Esx: 0.386189; CV (%): 5.08.
Aunque se mantuvo estable la concentración de la bacteria, durante el estudio se comprobaron sus características, tanto en condiciones in vitro como el efecto que puede producir la aplicación del producto final de la fermentación sobre la zanahoria y la remolacha in vivo, en relación con el medio de cultivo utilizado para el crecimiento de la cepa. El microorganismo mantuvo su crecimiento durante cinco inoculaciones sucesivas en medio de cultivo semisólido carente de nitrógeno combinado, resultado que sugiere que la bacteria mantuvo su capacidad de fijar nitrógeno atmosférico. Por otra parte, el halo de solubilización producido en el medio sólido NBRIP fue mayor cuando el microorganismo creció previamente en los medios SYP y MA (Tabla 2), lo que indica que el medio utilizado para el crecimiento del microorganismo afecta su capacidad de solubilizar fósforo.
Tabla 2 Solubilización de fósforo en medio NBRIP por la cepa INIFAT Gd-42 de G. diazotrophicus creciendo en diferentes medios de cultivo.
| Culture media | Solubilization halo (cm) |
|---|---|
| LGI | 0.10 b |
| SYP | 0.16 a |
| DYGS | 0.09 b |
| SG | 0.11 b |
| MA | 0.16 a |
| Esx | 0.0059 |
| CV (%) | 32.49 |
Nota: Letras diferentes indican diferencias estadísticamente significativas, ANOVA y Duncan (5%).
Al realizar el estudio en condiciones in vivo, se observaron diferencias en la estimulación del crecimiento de los dos cultivos hortícolas estudiados, en dependencia del medio de cultivo donde creció el microorganismo durante el proceso fermentativo.
Para el caso de la zanahoria, existen diferencias de las variables medidas con los diferentes tratamientos (Tabla 3). La cepa de G. diazotrophicus crecida en el medio SG ejerció mayor efecto en las variables medidas en la parte aérea de las plantas, como altura y peso fresco de las hojas mientras que no existen diferencias de este tratamiento con el testigo en cuanto al número de hojas. Cuando la bacteria creció en el medio MA, se observó un efecto positivo respecto al testigo y superior al resto de los tratamientos en la zona radical, donde se midieron el diámetro y el largo de la raíz, así como su peso fresco.
Tabla 3 Efecto de G. diazotrophicus INIFAT Gd-42 cultivado en diferentes medios de cultivo en cultivo de zanahoria (Daucus carota L.).
| Culture media | Height (cm) | Number of leaves | Leaves weight (g) | Root diameter (cm) | Root length (cm) | Root Fresh weight (g) |
|---|---|---|---|---|---|---|
| SG | 36 a | 8.29 a | 5.73 a | 2.925 b | 5.75 b | 0.45 b |
| LGI | 25.94 cd | 6.88 bcd | 3.85 bc | 1.2 c | 6.7 b | 0.156 c |
| SYP | 29.81 bc | 6.43 cd | 2.58cd | 3.1 b | 6.375 b | 0.30 bc |
| DYGS | 22.85 d | 6.13 d | 1.69 d | 2.475 b | 6.375 b | 0.17 c |
| MA | 31.31 b | 7.56 ab | 4.7 ab | 5.56 a | 7.9 a | 0.92 a |
| non-inoculated | 30.0 b | 7.29 abc | 4.04 b | 1.475 c | 6.175 b | 0.244 c |
| Esx | 1.3852 | 0.3557 | 0.4715 | 0.3012 | 0.3655 | 0.0543 |
| CV (%) | 18.83 | 16.52 | 48.92 | 55.79 | 14.72 | 74.32 |
Nota: Letras diferentes indican diferencias estadísticamente significativas, ANOVA y Duncan (5 %).
Para la remolacha se manifiesta un mayor efecto en comparación con el testigo no inoculado (Tabla 4). En la parte aérea de la planta se obtiene mayor altura con la bacteria crecida en el medio SG y mayor número de hojas cuando se inoculó con el producto de la fermentación en medio SYP. El efecto sobre la raíz fue más marcado, se muestran diferencias significativas para todos los medios con respecto a la variante no inoculada con el microorganismo. En el largo de la raíz los productos obtenido en los medios MA, SYP, SYGS y LGI son superiores al testigo, y en el diámetro de esta, los mejores resultados se obtuvieron con la bacteria crecida en los medios MA, SYP, SYGS y SG, aunque también hay diferencias del efecto en LGI con el testigo. En el caso de la variable peso fresco de la planta, se destaca el efecto de la bacteria crecida en medio MA sobre el resto de los tratamientos, incluido en testigo no inoculado.
Tabla 4 Efecto de G. diazotrophicus crecido en diferentes medios sobre el cultivo de la remolacha (Beta vulgaris L.).
| Culture media |
Height (cm) |
Number of leaves |
Root diameter (cm) |
Root length (cm) |
Root Fresh weight (g) |
|---|---|---|---|---|---|
| SG | 20.33 a | 3.33 b | 3.40 a | 2.63 bc | 3.88 abc |
| LGI | 17.8 bc | 3.67 b | 2.80 b | 2.83 b | 4.1 abc |
| SYP | 16.67 c | 4.8 a | 3.50 a | 3.0 ab | 4.38 ab |
| DYGS | 17.83 bc | 3.83 ab | 4.20 a | 2.98 ab | 3.84 bc |
| MA | 19.00 ab | 4.33 ab | 4.20 a | 3.32 a | 4.73 a |
| Testigo | 17.25 bc | 3.50 b | 2.30 c | 2.32 c | 3.27 c |
| Esx | 0.7323 | 0.3694 | 0.3574 | 0.1488 | 0.2436 |
| CV (%) | 11.02 | 24.79 | 28.83 | 16.22 | 16.05 |
Nota: Letras diferentes indican diferencias estadísticamente significativas, ANOVA y Duncan (5%).
Discusión
Diferentes medios de cultivo se han utilizado para el crecimiento de G. diazotrophicus (Eskin et al., 2014). Por ejemplo, el medio DYGS (Siqueira et al., 2009) se empleó en ensayos de fermentación para evaluar el efecto de sustancias osmoprotectoras sobre esta especie bacteriana; mientras que el medio SYP, se ha utilizado en la determinación del efecto de distintas concentraciones de fitohormonas sobre el microorganismo (Rojas et al., 2015). Para el crecimiento de la bacteria con el fin de evaluar el efecto de su aplicación sobre especies vegetales como viandas tropicales (Dibut et al., 2011) y gramíneas (Muthukumarasamy et al., 2006) se han utilizado medios como el LGI y SG, respectivamente.
Sin embargo, en la literatura consultada no se encontraron trabajos donde se evalúe la acción que ejerce el medio de cultivo sobre el potencial como bacteria promotora del crecimiento vegetal de G. diazotrophicus, incluyendo su efecto en estimulación que se produce por la aplicación sobre hortalizas, del producto final de la fermentación del microorganismo. Tampoco existe un consenso acerca de cuál medio emplear para la obtención de un bioproducto de uso agrícola, pero el empleo de medios a base de productos naturales, son más atractivos considerando los aspectos económicos y ambientales. Por esta razón se evaluó, en condiciones in vitro e in vivo, el potencial como bacteria promotora del crecimiento vegetal de la cepa INIFAT Gd-42 de G. diazotrophicus, después de crecer en cinco medios de cultivo.
La curva de crecimiento obtenida en todos los casos es similar a la descrita por Molinari & Bioardi (2013). Según estos autores existen pocos estudios acerca del crecimiento de G. diazotrophicus en presencia de sacarosa como fuente de carbono. El establecimiento de un crecimiento diaúxico probablemente esté asociado a la presencia de la sacarosa como fuente de carbono y a la imposibilidad del microorganismo de transformar este azúcar de forma directa, así como al consumo gradual de los diferentes sustratos que se originan por la actividad de la enzima levanosacarasa (Hernández et al., 1995; Molinari & Bioardi, 2013). En todos los medios utilizados se obtuvo un crecimiento diáuxico, y se pueden apreciar las dos fases de adaptación o lag, y de crecimiento exponencial, típico de utilizar más de una fuente de carbono y energía presentes en el medio. La bacteria utilizará primero la fuente de energía que le permita crecer mejor, y posteriormente al agotarse esta, otras presentes en el medio (Madigan et al., 2014). En todos los medios existe más de un compuesto que puede tener esta función como se puede observar en la Tabla 1. No obstante, en cuanto a los valores de concentración final de la bacteria alcanzados, estos fueron semejantes entre sí y a los referidos en los trabajos de Dibut et al. (2011) y Luna et al. (2010).
El hecho de que una formulación elaborada a partir de un producto natural como el arroz, sustente el crecimiento de la bacteria, constituye un resultado alentador desde el punto de vista tecnológico, pues para el escalado de un bioproducto se necesitan medios poco complejos donde se incorporen fuentes naturales. Por lo tanto, esta podría ser una variante a explotar en la búsqueda de un biofertilizante que tenga como principio activo esta especie bacteriana. El medio de arroz (MA) puede proveer al microorganismo de vitaminas del complejo B, minerales, proteínas, aminoácidos y otros nutrientes que están presentes en el grano de arroz (Pinciroli, 2010) y que pueden contribuir al crecimiento de la bacteria, obteniéndose un medio rico en nutrientes a partir del cocinado del arroz y la mezcla con los otros componentes del medio.
La capacidad de fijar nitrógeno fue descrita para G. diazotrophicus desde su aislamiento (Cavalcante & Döbereiner, 1998). Existen referencias donde se asocia la posibilidad de crecimiento de los microorganismos en medios semisólidos carentes de nitrógeno combinado con el proceso de fijación biológica de nitrógeno (Pérez et al., 2014; de la Fé et al, 2015), criterio utilizado en el estudio para determinar el mantenimiento de esta característica en la bacteria. Sin embargo, sería interesante demostrar en investigaciones posteriores que tampoco se afecta la cantidad de nitrógeno atmosférico que puede transformar el microorganismo. Por otra parte, las diferencias en los halos de solubilización de fósforo está en correspondencia con lo que plantearon Crespo et al. (2011), quienes describieron la influencia de la fuente de carbono en el potencial de solubilización de G. diazotrophicus y demostraron que el incremento de fósforo soluble es proporcional al de ácido glucónico. Este método semicuantitativo permite tener una referencia del mantenimiento de la capacidad de solubilización de fosfatos por la bacteria.
La estimulación de indicadores del crecimiento por la inoculación de bacterias promotoras puede estar asociada, además de la contribución de nutrientes realizada por la fijación biológica de nitrógeno y la solubilización de fósforo, a otros factores como la liberación de fitohormonas (Pazos et al., 2016) y la colonización del ambiente rizosférico y endófito (Jha et al., 2013). Para el caso de G. diazotrophicus se describe la capacidad de liberar hormonas, fundamentalmente ácido indolacético, aspecto que también puede ser afectado por el medio de cultivo utilizado para el crecimiento de la bacteria (Patil et al., 2011), produciendo la estimulación particular de algún órgano de la planta. Otros autores describen la influencia de la fuente de carbono en la producción de exopolisacáridos, compuestos de gran importancia para la formación de biopelículas, la tolerancia al estrés y el establecimiento de la bacteria en el interior de los cultivos (Meneses et al., 2011).
La capacidad de G. diazotrophicus de incrementar el crecimiento de cultivos hospederos naturales u ocasionales ha sido demostrada fundamentalmente para gramíneas (Nautiyal, 1999), con algunos trabajos en viandas y frutales (Dibut et al., 2011). Para hortalizas, autores como Hazza et al. (2014) y Kumar et al. (2013) demostraron la posibilidad de colonización de G. diazotrophicus en zanahoria y el aumento de los rendimientos de la remolacha por la aplicación del microorganismo. En Cuba, Ríos et al. (2016a) obtuvieron resultados alentadores en interacción con zanahoria y remolacha. Sin embargo, en el presente trabajo se demuestra que el efecto en la estimulación del crecimiento en estos cultivos dependerá del medio de cultivo empleado para el crecimiento de la bacteria, por lo que debe prestarse atención a su composición para obtener los mejores resultados agronómicos. Esto se demuestra fundamentalmente a nivel de raíz, órgano de vital importancia agronómica en estos cultivos. Por esta razón en este caso es suficiente para el análisis de la estimulación del crecimiento de la planta las medidas de peso freso, ya que justamente la raíz es lo que se consume para la alimentación humana.
De forma general queda demostrado que el medio de cultivo influye en el potencial estimulador del crecimiento de G. diazotrophicus, por lo que es un aspecto importante a tener en cuenta en la obtención biotecnológica de productos de uso agrícola para el beneficio de especies vegetales de importancia económica.
Conclusiones
El medio de cultivo utilizado para el crecimiento de G. diazotrophicus influye en su potencial estimulador del crecimiento vegetal. El empleo de un medio de cultivo compuesto fundamentalmente por arroz, sacarosa y azúcar comercial, produce mayores beneficios en la estimulación del crecimiento de zanahoria y remolacha comparado con otras alternativas como el SG, el SYP, el DYGS y el LGI.
REFERENCIAS
Alquéres S., Meneses C., Rouws L., Rothballer M., Baldani I., Schmid M. and Hartmann M. (2013). The Bacterial Superoxi-de Dismutase and Glutathione Reductase Are Crucial for Endophytic Colonization of Rice Roots by Gluconace-tobacter diazotrophicus PAL5. MPMI; 26(8): 937-945. https://doi.org/10.1094/MPMI-12-12-0286-R [ Links ]
Caballero-Mellado J. & Martínez-Romero E. (1994). Limited genetic diversity in the endophytic sugarcane bacterium Acetobacter diazotrophicus. Applied and Environmental Microbiology 60(5): 1532-1537. https://aem.asm.org/content/aem/60/5/1532.full.pdf [ Links ]
Cavalcante V.A. & Döbereiner J. (1988). A new acid-tolerant nitrogen-fixing bacterium associated with sugarcane. Plant and Soil 108: 23-31. https://doi.org/10.1007/BF02370096 [ Links ]
Crespo J.M., Bioardi J.L. and Luna M.F. (2011). Mineral phosphate solubilization activity of Gluconacetobacter diazotrophicus under P-limitation and plant root environment. Agricultural Sciences 2(1): 16-22. https://doi.org/10.4236/as.2011.21003 [ Links ]
de la Fé Y., Díaz A., Restrepo G.M., Diván-Baldani V.L. and Hernández A. (2015). Diversidad de bacterias diazotróficas asociativas potencialmente eficientes en cultivos de importancia económica. Revista Cubana de Ciencias Biológicas 4(1): 17-26. http://www.rccb.uh.cu/index.php/RCCB/article/view/85 [ Links ]
Dibut B., Ríos Y. and Ortega M. (2011). Estudio de la asociación Gluconacetobacter diazotrophicus-viandas tropicales establecidas sobre suelo Ferralítico Rojo. II. Determinación del método de inoculación más eficiente para la incorporación de G. diazotrophicus en los cultivos de boniato, yuca y malanga. Cultivos Tropopicales 32(4): 20-26. http://scielo.sld.cu/scielo.php?script=sci_serial&lng=es&pid=0258-5936 [ Links ]
Döbereiner J., Reis V. M., Paula M. A. and Olivares F. L. (1993) Endophytic diazotrophs in sugarcane, cereals and tuber plants. In: Palacios R, Mora J, Newton WE, editors. New Horizons in Nitrogen Fixation. p. 671-676. https://doi.org/10.1007/978-94-017-2416-6_55 [ Links ]
Eskin A., Vessey K. and Tian L. (2014). Research progress and perspective of nitrogen fixing bacterium Gluconacetobac-ter diazotrophicus, in monocot plants. International Journal of Agronomy; 208383(2014): 1-13. http://dx.doi.org/10.1155/2014/208383 [ Links ]
Hazza J. (2014). GUS-gene as visual marker for Gluconacetobacter diazotrophicus co-cultivated with carrot plantlets. International Journal of Science and Technology; 3(12): 776-779. http://www.journalofsciences-technology.org/archive/2014/dec_vol_3_no_12/6112114535361.pdf [ Links ]
Hernández A., Pérez J., Bosch D. and Castro N. (2015). Clasificación de los suelos de Cuba 2015. Instituto Nacional de Ciencias Agrícolas, Instituto de Suelos. Ediciones INCA, San José de las Lajas, Mayabeque; 45-48. http://ediciones.inca.edu.cu/files/libros/clasificacionsueloscuba_%202015.pdf [ Links ]
Hernández L., Arrieta J., Menendez C., Vazquez R., Coego A., Suarez V., Selman G., Petit-Glatron M.F. and Chambert R. (1995). Isolation of enzymatic properties of levansucrase secreted by Acetobacter diazotrophicus SRT4, a bacterium associated with sugar cane. Biocehmical Journal 309: 113-118. https://doi.org/10.1042/bj3090113 [ Links ]
Hernández-Escareño J.J., Gabriel Morales P., Farías Rodríguez R. and Sánchez-Yáñez J.M. (2015). Inoculación de Burkholderia cepacia y Gluconacetobacter diazotrophicus sobre la fenología y biomasa de Triticum aestivum var. Nana F2007 a 50% de fertilizante nitrogenado. Scientia Agropecuaria 6 (1): 07- 16. https://doi.org/10.17268/sci.agropecu.2015.01.01 [ Links ]
Indi D.V., Nalawade S.V., Deshmukh S.U. and Pawar S.M. (2014). Response of Sugarcane Varieties to Nitrogen and Phosphorus as Inoculated by Gluconacetobacter diazotrophicus and PBS. International Journal of Plant and Soil Science 3(3): 260-269. https://s3.amazonaws.com/academia.edu.documents/32820510/Indi332013IJPSS6246_1.pdf?response-content-disposition=inline%3B%20fil ename%3DIndi332013IJPSS6246_1.pdf&X-Amz-Algorithm=AWS4-HMAC-SHA256&X-Amz-Credential=AKIAIWOWYYGZ2Y53UL3A%2F20190624%2Fus-east-1%2Fs3%2Faws4_request&X-Amz-Date=20190624T183646Z&X-Amz-Expires=3600&X-Amz-SignedHeaders=host&X-Amz-Signature=2ae2b3168262237ac220c65bdcd291a15614d39704c3556a688056aac6f97d39 [ Links ]
Jha P.N., Grupta G., Jha P. and Mehrotra R. (2013). Association of rhizopheric/endophytic bacteria with plants: a potential gateway to sustainable agriculture. Greener Journal of Agricultural Science; 3(2): 73-84. https://pdfs.semanticscholar.org/cd5b/fcc939a317a32f772e99d277a47e515ccd3e.pdf [ Links ]
Kumar J.A., Sreeramulu K.R. and Kushala G. (2013). Effect of microbial inoculants on the yield of beet-root (Beta vulgaris). Asian Journal of Bio Science 8(1): 6-10 https://www.cabdirect.org/cabdirect/abstract/20133288683 [ Links ]
Kumarasamy V. & Santhaguru K. (2011). Growth performance of Sorghum bicolor (L.) Moench in response to inoculation with Gluconacetobacter diazotrophicus. Genetics and Plant Physiology 1(3-4): 130-138. http://www.bio21.bas.bg/ippg/bg/wp-content/uploads/2012/06/GPP_1_3-4_130-138.pdf. [ Links ]
Luna M.F., Galar M.L., Aprea J., Molinari M.L. and Boiardi J.L. (2010). Colonization of sorghum and wheat by seed inoculation with Gluconacetobacter diazotrophicus. Biotechnolgy Letters 32: 1071-1076. https://doi.org/10.1007/s10529-010-0256-2 [ Links ]
Madigan M., Martinco J., Stahl D. and Clarck D. (2014) Brock Biology of Microorganisms. Thirteenth Edition, 2014; pp. 1155. [ Links ]
Mehnaz, S. & Lazarovits G. (2006). Inoculation effects of Pseudomonas putida, Gluconacetobacter azotocaptans and Azospirillum lipoferum on corn plant growth under greenhouse conditions. Microbial Ecology. 51: 326-335. https://doi.org/10.1007/s00248-006-9039-7 [ Links ]
Meneses C.H.S.G., Rouws L.F.M., Simões-Araújo J.L., Vidal M.S. and Baldani J.I. (2013). Exopolysaccharide production is required for biofilm formation and plant colonization by the nitrogen-fixing endophyte Gluconacetobacter diazotrophicus. Molecular Plant Microbe Interations 24(2): 1448-1458. https://doi.org/10.1094/MPMI-05-11-0127 [ Links ]
Molinari M.L. & Bioardi, J.L. (2013). Levan production by Gluconacetobacter diazotrophicus. Electronic Journal of Biotechnology 16(3) . http://dx.doi.org/10.2225/vol16-issue3-fulltext-9 [ Links ]
Muthukumarasamy R., Govindarajan M., Vadivelu M. and Revathi G. (2006) N-fertilizer saving by the inoculation of Gluconacetobacter diazotrophicus and Herbaspirillum sp. in micropropagated sugarcane plants. Microbiological Research 161: 238-245. https://doi.org/10.1016/j.micres.2005.08.007 [ Links ]
Nautiyal SC. (1999). An efficient microbiological growth medium for screening phosphate solubilizing microorganism. FEMS Microbiol Letters 170: 265-275. https://doi.org/10.1111/j.1574-6968.1999.tb13383.x [ Links ]
Nieto-Peñalver C.G., Savino M.J., Bertini E.V., Sánchez L.A. and de Figueroa L.I.C. (2014). Gluconic acid produced by Gluconacetobacter diazotrophicus possesses antimicrobial properties. Research in Microbiology; 165: 549-558. https://doi.org/10.1016/j.resmic.2014.06.003 [ Links ]
Ortega, M. (2012). Medio de arroz (MA). Comunicación personal. Laboratorio de Fermentaciones, Grupo Agrobiotecnología, INIFAT. Santiago de las Vegas, Boyeros, La Habana, Cuba. [ Links ]
Patil N.B., Gajbhiye M., Ahiwale S.S., Gunjal A.B. and Kapadnis P.B. (2011). Optimization of Indole 3acetic acid (IAA) production by Acetobacter diazotrophicus L1 isolated from Sugarcane. International Journal of Environmental Sciences 2(1): 295-302 https://www.researchgate.net/profile/Aparna_Gunjal/publication/279804624_Optimization_of_Indole_3acetic_acid_IAA_production_by_Acetobacter_diazotrophicus_L1_isolated_from_Sugarcane/links/561dc1fe08ae50795afd8371/Optimization-of-Indole-3acetic-acid-IAA-production-by-Acetobacter-diazotrophicus-L1-isolated-from-Sugarcane.pdf [ Links ]
Pazos L.A., Marín V., Morales Y.E., Baez A., Villalobos M.A., Pérez M. and Muñoz-Rojas J. (2016) Uso de microorganismos benéficos para reducir los daños causados por la revolución verde. Revista Iberoamericana de Ciencias 7 (3): 72-85. http://www.reibci.org/publicados/2016/dic/2000114.pdf. [ Links ]
Pérez A., Tuberquia A. and Amell D. (2014). Actividad in vitro de bacterias endófitas fijadoras de nitrógeno y solubilizadoras de fosfatos. Agronomía Mesoamericana; 25(2): 213-223. http://www.scielo.sa.cr/pdf/am/v25n2/a01v25n2.pdf [ Links ]
Pinciroli M. (2011). Proteínas de arroz: propiedades estructurales y funcionales. Tesis en opción del título de Magister en Tecnología e Higiene de los Alimentos Programa Arroz. Facultad de Ciencias Agrarias y Forestales Centro de Investigación y Desarrollo en Criotecnología de Alimentos. Universidad Nacional de la Plata. Pp.81. http://sedici.unlp.edu.ar/bitstream/handle/10915/1828/Documento_completo__.pdf?sequence=3&isAllowed=y [ Links ]
Reis V.M. & dos Santos K.R. (2015). Nitrogen fixing bacteria in the family Acetobacteraceae and their role in agriculture. Journal of Basic Microbiology 54: 1-19. https://doi.org/10.1002/jobm.201400898 [ Links ]
Ríos Y., Dibut B., Rojas M.M., Ortega M., Arozarena N. and Rodríguez J. (2016a). Interacción de la bacteria Gluconacetobacter diazotrophicus y hortalizas de raíz. Cultivos Tropicales 37 No. especial: 28-32. http://scielo.sld.cu/scielo.php?pid=S0258-59362016000500004&script=sci_arttext&tlng=en [ Links ]
Ríos Y., Rojas M.M., Ortega M., Dibut B. and Rodríguez J. (2016b). Aislamiento y caracterización de cepas de Gluconacetobacter diazotrophicus. Cultivos Tropicales 37(1): 34-39. http://scielo.sld.cu/scielo.php?pid=S0258-59362016000100005&script=sci_arttext&tlng=pt [ Links ]
Rojas M.M., Rodríguez A.J., González L. and Heydrich M. (2015). Influencia de diferentes factores en el crecimiento de bacterias endófitas de caña de azúcar. Revista Colombiana de Biotecnología; 17 (2): 149-155. https://dialnet.unirioja.es/servlet/articulo?codigo=5430273 [ Links ]
Siqueira F., Cardosos R., Oliveira E., Moura M., Quintana V.M. and Amorim M. (2009). Glycine Betadine Enhances Growth Of Nitrogen-Fixing bacteria Gluconacetobacter diazotrophicus PAL5 under saline stress conditions. Current Microbiology 59: 593-599. https://doi.org/10.1007/s00284-009-9479-7 [ Links ]
1Como citar este artículo: Ríos Rocafull, Y., Sánchez López, M.I., Dibut Álvarez, B. L., Ortega García, M., Tejeda González, G., Rodríguez Sánchez, J., Rojas Badía, M. M. (2019). The culture medium effect in plant growth promotion activity of Gluconacetobacter diazotrophicus in carrot and sugar beet. Revista Bio Ciencias 6, e470. doi: https://doi.org/10.15741/revbio.06.e470
Recibido: 21 de Marzo de 2018; Aprobado: 27 de Junio de 2019











 texto em
texto em 


