Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista bio ciencias
versión On-line ISSN 2007-3380
Revista bio ciencias vol.6 Tepic ene. 2019 Epub 02-Oct-2020
https://doi.org/10.15741/revbio.06.e565
Artículos Originales
Proantocianidinas y actividad enzimática en fruto de mamey zapote (Pouteria sapota) durante su maduración
1Universidad Tecnológica de Xicotepec de Juárez, Posgrado en Ingeniería Agroalimentaria. Av. Universidad Tecnológica No. 1000, Tierra Negra, 73080. Xicotepec de Juárez, Puebla, México.
2Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Laboratorio de Calidad de Cultivos para Uso Humano y Pecuario. Km 8 Carretera Tepatitlán-Lagos. C.P. 47600. Tepatitlán de Morelos, Jalisco. México.
3Universidad Autónoma Chapingo, Departamento de Ingeniería Agroindustrial. Carretera México-Texcoco, Km.38.5 Chapingo, C.P 56230, México.
4Fitoquímica, Colegio de Postgraduados. Carretera México-Texcoco, km 36.5, Montecillo, C.P. 56230, México.
5Facultad de Ciencias Agropecuarias, Universidad Autónoma del Estado de Morelos.
El fruto de zapote mamey (Pouteria sapota) tiene alto contenido de compuestos fenólicos solubles que no han sido caracterizados y algunos de estos compuestos son sustrato de enzimas relacionadas con pardeamiento de pulpa. Los objetivos fueron: i) estudiar las proantocianidinas en el fruto de mamey sapote, ii) determinar la actividad de la polifenol oxidasa y la peroxidasa, y iii) evaluar sus cambios durante el proceso de maduración del fruto. Los métodos de análisis fueron: butanol/HCl, DMAC (4 - (dimetilamino) cinamaldehído), vainillina y cromatografía líquida de alta resolución. La actividad enzimática se determinó por métodos de espectrofotometría. El contenido de proantocianidinas (PAs) mostro una reducción al avanzar la maduración del fruto. Con el método DMAC la reducción fue de 2.8 veces al pasar de la etapa de preclimaterio (CS) a la madurez hortícola (HM); con el método de vainillina la reducción fue de 1.6 veces desde CS a HM. En madurez hortícola, los contenidos de PAs fueron 124,8 mg equivalentes de catequina/100 g de peso fresco y de 322,4 mg equivalentes de proantocianidina B2/100 g de peso fresco por los métodos DMAC y vainillina, respectivamente. Las proantocianidinas monoméricas (catequina, epicatequina y epicatechin 3-galato) no cambiaron (p>0.05) durante el proceso de maduración. La actividad de la peroxidasa incrementó al final de la etapa de maduración y se asoció con pardeamiento de pulpa. El fruto de zapote mamey es una fuente importante de proantocianidinas oligoméricas.
Palabras clave: Pouteria sapota; frutos tropicales; taninos condensados; actividad enzimática
The fruit of mamey sapote (Pouteria sapota) has high content of soluble phenolic compounds that have not been characterized and some of these compounds are the substrate of enzymes related with flesh browning fruit. The objectives were: i) to study the proanthocyanidins in mamey sapote fruit, ii) to determine the activity of the polyphenol oxidase and peroxidase, and iii) to evaluate their changes during the ripening process. The proanthocyanidins were quantified by butanol/HCl, DMAC (4 - (dimethylamino) cinnamaldehyde) and vanillin methods. The characterization was done by HPLC. Enzymatic activity was determined by spectrophotometry methods. The proanthocyanidin (PAs) content showed a reduction with fruit ripeness progress. With DMAC method the reduction was of 2.8 times from preclimacteric stage (CS) to horticultural maturity (HM); the content with vanillin method was reduced 1.6 times from CS to HM. At HM, PAs content was of 124.8 mg equivalent of catechin/100 fresh weight and of 322.4 mg equivalent of proanthocyanidin B2/100 g fresh weight, for DMAC and vanillin methods, respectively. The monomeric PAs (catechin, epicatechin and epicatechin-3 gallate) did not change (p>0.05) during the ripening process. The enzymatic activity of peroxidase increases at the end of ripening process and was related with flesh browning. The mamey sapote is an important source of oligomeric proanthocyanidins.
Key words: Pouteria sapota; tropical fruit; condensed tannins; enzymatic activity
Introducción
Pouteria sapota (Jacq. H. E. Moore & Stearn) es una especie tropical que produce un fruto de pulpa dulce, suave y ligeramente fibrosa, de color anaranjado rojizo debido a la presencia de carotenoides (Alia-Tejacal et al., 2005a; Zou et al., 2012). En México, el fruto de P. sapota se denomina zapote mamey y su área cultivada es de cerca de 1336 ha (SIAP, 2016); el consumo se realiza principalmente en fresco o en forma de licuados, helados o postres.
P. sapota pertenece a los frutos tipo climatéricos. El proceso de maduración de los frutos climatéricos consta de cuatro etapas (preclimaterio, incremento de climaterio, pico climatérico y postclimaterio), definidas de acuerdo con su tasa de respiración y producción de etileno, con cambios en la composición química y textura de la pulpa durante todo el proceso de maduración (Watada et al., 1984; Torres-Rodríguez et al., 2011).
La pulpa de este fruto contiene grandes cantidades de fenoles solubles totales (TSP), los que disminuyen con la maduración (Torres-Rodríguez et al., 2011). En la fracción de TSP se han identificado flavanoles del tipo catequina, epicatequina, galocatequina y catequin 3-O galato, además de los ácidos gálico (Torres-Rodríguez et al., 2011; Ma et al., 2004), siríngico, p-hidroxibenzoico y p-cumarico (Yahia et al., 2011).
No existen reportes publicados sobre proantocianidinas (PAs) en P. sapota, aunque en el fruto maduro se puede detectar una ligera astringencia. Esta astringencia podría estar asociada con la presencia de PAs, que son oligómeros o polímeros de poli hidroxi flavan 3-ols, con unidades de epicatequina (procianidinas) o epi galocatequina (prodelfinidinas) (Schofield et al., 2001). Su estructura polifenólica y particular grado de polimerización le confiere a las PAs actividades biológicas benéficas a la salud humana (Silva et al., 2009; Hellström & Mattila, 2008). El consumo de PAs de alto peso molecular se ha asociado con la reducción de los diferentes tipos de colesterol (Zou et al., 2012) y con menor daño al tejido vascular por aterosclerosis (Gorinstein et al., 2011). Además, estudios con animales han permitido calificar a las PAs como compuestos prometedores para prevenir el desarrollo de enfermedades degenerativas del sistema nervioso (Lee et al., 2010; Wang et al., 2012).
Por otro lado, la polifenol oxidasa (PPO) y la peroxidasa (POD) son dos de las principales enzimas relacionadas con el pardeamiento de la fruta (Luo and Xie, 2012). No se encontraron informes publicados sobre la relación de la actividad de estas enzimas y el pardeamiento de la pulpa que se puede observar en el fruto maduro o muy maduro de zapote mamey. Dado que no hay informes sobre el análisis de PAs en zapote mamey, solo pocos reportes sobre la actividad enzimática de PPO y POD durante la maduración de este fruto, y dadas las importantes actividades biológicas atribuidas a las PAs, los objetivos de este estudio fueron: i) estudiar las proantocianidinas (PAs) en el fruto de mamey sapote, ii) determinar la actividad de la polifenol oxidasa (PPO) y la peroxidasa (POD), y evaluar sus cambios durante el proceso de maduración.
Materiales y Métodos
Material vegetal
Se obtuvieron 200 frutos de zapote mamey de un huerto ubicado en Tuxtla Chico, Chiapas, México (14° 56’ 20” N; 92° 10’ 05” W). Los frutos se encontraban en madurez fisiológica al momento del corte, lo que se aseguró mediante el índice de cosecha, a través de la presencia de una tonalidad rosa-naranja en la pulpa, que se verificó haciendo una incisión cerca del ápice del fruto. El transporte de los frutos al sitio experimental en Texcoco, México (19 ° 29 ‹23 «N, 98 ° 53′37» W), se llevó a cabo por tierra, utilizando cajas de plástico. Dentro de las 20 h posteriores a la cosecha, los frutos se almacenaron a 12 ° C, que es una temperatura que puede prolongar la vida postcosecha del zapote mamey sin causar daños por frío (Alia-Tejacal et al., 2005b).
Firmeza del fruto
Cada tercer día, se tomaron tres frutos de forma aleatoria de la cámara de almacenamiento para evaluar la firmeza de su pulpa (FF) que se midió con un analizador de textura (Stable Micro Systems, TA-XT2i, UK). Al fruto se le removió la cáscara en dos puntos de su región ecuatorial, con un elemento cónico de 2.6 cm de base redondeada y en un ángulo de 75°. Se tomaron las lecturas bajo una rutina en la que la pulpa del fruto se deformó hasta 4 mm a una velocidad de 3 mm s−1. La firmeza de la pulpa (FF) se expresó en newtons (N). Posteriormente, se tomó una muestra de pulpa y se colocó en nitrógeno líquido para luego almacenarse a -20 ° C para las evaluaciones subsecuentes de compuestos fenólicos y actividad enzimática.
Extracción de compuestos fenólicos (proantocianidinas)
Una muestra de 15 g de pulpa congelada se molió en una licuadora doméstica (Man LMU 9013, México) equipada con un recipiente de volumen reducido. Se pesó 1 g de la muestra homogeneizada y se mezcló con 20 mL de solvente (acetona:agua:ácido acético, 75.0:24.5:0.5 v/v/v) en un matraz Erlenmeyer (Prior et al., 2010). La mezcla se colocó en un baño de ultrasonido (Branson, Model 2510, USA) por 30 min, posteriormente se colocó en un agitador horizontal (Gyratory shaker, model G10, USA) por una hora. La muestra se centrifugó (Universal 32, Hettich Zentrifugen, Germany) a 2200 x g por 10 min a 20 °C, y el sobrenadante fue recuperado (filtrado con papel Whatman No. 1) y ajustado a un volumen de 20 mL con el solvente de extracción. Este extracto se dividió en dos volúmenes iguales; uno se concentró en un rotaevaporador (Heidolph, Laborata 4010, Germany) a 40 °C hasta 2 mL y se ajustó con agua destilada a un volumen de 10 mL para luego realizar tres extracciones líquido-líquido con 15 mL de acetato de etilo en cada caso, con recuperación de la fase orgánica. Las fases orgánicas colectadas se juntaron y se concentraron a sequedad en un rotaevaporador. El residuo se re-suspendió en 2 mL de methanol grado HPLC y se utilizó para los análisis de compuestos fenólicos por HPLC-DAD. El otro volumen de 10 mL se usó para la cuantificación de compuestos fenólicos por diversos métodos.
Cuantificación de compuestos fenólicos solubles totales por el método de Folin- Ciocalteu
Se usó el método colorimétrico de Folin-Ciocalteu (Singleton & Rossi, 1965) y el ácido gálico (Sigma, MN) para elaborar la curva patrón y poder expresar la concentración de fenoles solubles totales en mg equivalentes de ácido gálico (GAE) por 100 g de peso fresco (FW).
Proantocianidinas mediante el método de butanol/HCl
Se utilizó el método de Porter et al. (1986) con un volumen de 500 μL de extracto que se colocó en tubos de vidrió con tapón de baquelita. El método de butanol/HCl es confirmativo de la presencia de taninos condensados o proantocianidinas (PAs), al presentarse un color rojo intenso cuando la muestra es calentada, debido a la oxidación de las leucoantocianidinas (Schofiel et al., 2001). Para correr el ensayo, 3 mL de una solución concentrada de butanol/ HCl (95:5 v/v) (JT Baker S.A. de C.V., México) se mezclaron con 100 μL de reactivo férrico (sulfato férrico de amonio al 2 % en HCl 2 N). Los tubos se cerraron y se colocaron en baño de agua a 92 °C por 60 min. Posteriormente, se leyó la absorbancia de las muestras a 550 nm en un espectrofotometro (Perkin Elmer, Lambda 25, USA) el cual se ajustó a cero de absorbancia con un blanco preparado con todos los reactivos, pero sustituyendo el extracto por solvente de extracción. Harinas de sorgo (Dykes & Rooney, 2006) y de cálices de jamaica se usaron como controles positivo y negativo, respectivamente en la prueba. En ambos casos la extracción de PAs se realizó de la misma forma que en el caso de la pulpa del zapote mamey. Debido a que no existe en el mercado un estándar químico de taninos condensados adecuado para zapote mamey, los resultados se expresan como valores de absorbancia.
Método de DMAC (4 - (dimetilamino cinamaldheído)
El método colorimétrico DMAC (Wallace & Giusti, 2010) se utilizó para lo cual se colocaron 2380 μL de metanol grado HPLC en tubos de ensayo que contenían una alícuota de 20 μL de extracto y 100 μL del reactivo DMAC preparado al 2 % en ácido sulfúrico al 6 N en metanol. Se utilizó metanol grado HPLC como blanco. Se elaboró una curva estándar con catequina (Sigma, MN) solubilizada en el mismo solvente usado para la extracción de PAs. La concentración de PAs se expresó en mg equivalentes de catequina (CE) por 100 g de peso fresco (FW).
Método de vainillina
Se utilizó el método propuesto por Sun et al. (1998). Un volumen de 2500 μL de vainillina al 1 % se colocó en tubos de vidrio con 1000 μL de extracto. Posteriormente, se agregaron 2500 μL de HCl al 8 % y se agitaron en vórtex por 20 s para luego centrifugarlos a 2200 x g por 10 min. La reacción se dejó estabilizar por 10 min en oscuridad. Se preparó una curva estándar de proantocianidina B2 (Fluka, MN) solubilizada en el solvente utilizado en la extracción de PAs. La concentración de PAs fue expresada como mg equivalentes de proantocianidina B2 (PB2E) por 100 g de peso fresco (FW).
Análisis de proantocianidinas por HPLC-DAD
Se utilizó un cromatógrafo de líquidos (HPLC; PerkinElmer Series 200, USA) con un detector de UV con arreglo de diodos, controlados por una computadora mediante el programa TotalChrom™. Para el análisis de la fracción de acetato de etilo se empleó una columna analítica Phenomenex Luna C18 (250 x 4.6 mm, 5 mm), bajo el protocolo descrito por Cabrera et al. (2003). Las fases móviles fueron: ácido acético al 0.1 % en agua (A) y metanol (B) con una velocidad de flujo de 1 mL min-1. La composición de la fase móvil inició con 100 % de A por 1 min, que incrementó linealmente a 63 % de B en 27 min, regresando a las condiciones iniciales en 5 min. La detección se realizó a 280 nm para catequinas y a 360 nm para flavanoles. La temperatura de la columna se mantuvo en 25 °C. Se usó un volumen de inyección de 10 μL. Las muestras se filtraron a través de membranas de nylon de 0.45 μm (Millipore™) antes de inyectarse al equipo. Todos los solventes fueron grado HPLC. Se prepararon curvas estándar de ácido gálico, catequina, epicatequina, galocatequina y epigalocatequina 3-galato (Sigma-Aldrich, MN) en concentraciones entre 5 a 20 ppm. Las curvas se corrieron a una longitud de onda de 280 nm y presentaron valores de R2 mayores de 0.997. La identidad de los picos se efectuó mediante la comparación de los tiempos de retención y espectros de UV con estándares comerciales.
Actividad enzimática
Una muestra de 40 g de pulpa de zapote mamey se mezcló con 50 mL de acetona helada (15 °C). La mezcla se homogenizó en una licuadora doméstica por un minuto y se filtró con bomba de vacío para separar la fase sólida que se denominó polvo de acetona. Este procedimiento se repitió hasta que el polvo tomó un color blanco. Finalmente, el polvo de acetona se dejó secar a temperatura ambiente y se almacenó a 20 °C para su posterior evaluación. Los métodos de Lamikanra (1995) y Flurkey & Jen (1978) fueron aplicados para evaluar las actividades enzimáticas de la polifenol oxidasa (PPO; EC. 1.14.18.1) y la peroxidasa (POD; EC. 1.11.1.7). Para ambas enzimas, 0.2 g del polvo de acetona se mezclaron con 5 mL de Tris-HCl (TH) 100 mM de pH 7.1 que contenía polivinil pilirridona al 1 %. La muestra se homogenizó con un equipo Ultra Turrax T25 (IKA Labortechnik, Staufen, Germany) por 30 s y se centrifugó (Sorvall centrifuge RC-5B, GMI, USA) por 20 min a 10,000 x g y a 4°C. Para evaluar la actividad enzimática de la PPO, se corrió un ensayo con 2 mL del sobrenadante que se mezcló con 3 mL de catecol 60 mM disuelto en TH. El cambio en la absorbancia se evaluó a 420 nm en un espectrofotómetro Genesys 10 (Thermo Fisher Scientific Remel Inc., USA) empleando TH como blanco y celdas de cuarzo. En el caso de la POD, 0.05 mL del sobrenadante se mezclaron con 2.6 mL de TH, 0.25 mL de guayacol 0.1 M, y 0.1 mL de peróxido de hidrógeno al 0.25 %. El cambio de absorbancia se midió a 470 nm por 3 min. Los ensayos se condujeron a 20 °C y la actividad enzimática fue reportada como U g1, donde una unidad enzimática (U) se definió como 1 μmol de benzoquinona formada por min para la PPO o 1 μmol de tetraguayacol min1 para la POD.
Además de la actividad enzimática, se midió el color de la pulpa fresca del zapote mamey en cada fecha de muestreo de los frutos almacenados a 12 °C con el fin de detectar oscurecimiento enzimático. El equipo usado fue un colorímetro MiniScan XE Plus (Hunter-Lab, model 45/0-L) en la escala CieLab con el que se obtuvieron los parámetros de color L*, a* y b*. Se analizaron tres frutos por cada fecha de muestreo.
Análisis estadístico
Se utilizó un diseño completamente al azar para realizar un análisis de varianza y pruebas rutinarias de comparación de medias (Tukey, ≤ 0.05), con los datos de firmeza de fruto y compuestos fenólicos, con el fin de identificar diferencias entre los dos estados de madurez de los frutos (pre-climaterio y madurez hortícola). La unidad experimental constó de tres frutos que fueron tomados de manera aleatoria en cada fecha de muestreo, durante el almacenamiento. Con los datos de las diferentes variables analizadas se realizaron pruebas de correlación de Pearson. Para los análisis estadísticos se utilizó el paquete estadístico SAS (SAS, 2002).
Resultados y Discusión
Compuestos fenólicos solubles totales y proantocianidinas durante la maduración del fruto
La maduración del fruto de zapote mamey almacenado a 12 ̊ C fue monitoreada como una función de la firmeza de la pulpa. La primera etapa dentro del proceso de maduración (estado 1) tuvo una duración de 15 días, y se caracterizó por presentar valores de firmeza entre 49.3 y 39.6 N. El estado 1 es equivalente a la fase de preclimaterio mencionada por Watada et al. (1984). La segunda etapa (estado 2), tuvo una duración de seis días; en esta etapa, la firmeza del fruto decreció drásticamente a valores de 2.7-1.2 N entre los días 15 y 16 (Figura 1). Aunque la tasa respiratoria del fruto no se midió en este estudio, Torres-Rodríguez et al. (2011) señalan que la fuerte caída de la firmeza del fruto coincide con el pico climatérico, en el cual se alcanza la más alta tasa respiratoria. En la etapa 2 el fruto se encontraba en madurez hortícola, de acuerdo con lo descrito por Watada et al. (1984). El perfil de firmeza del fruto fue similar a lo descrito por Alia-Tejacal et al. (2002) para fruto almacenado a 15 °C. El contenido de compuestos fenólicos solubles totales (TSP) varió desde 2,195.5 hasta 1,017.6 mg GAE 100 g-1 de peso fresco (FW) respectivamente, entre los días 1 y 15 de almacenamiento (estado 1) (Figura 1). Al alcanzarse 16 días de almacenamiento (DS) los TSP cayeron a 395.3 mg GAE 100 g-1 FW. Este cambio equivale a una reducción de 2.1 veces, en relación al contenido al inicio del almacenamiento, que es inferior a la reportada por Alia-Tejacal et al. (2002) en frutos de zapote mamey almacenados a temperatura ambiente (20 °C y 50-60 % de humedad relativa) que fue de 3.2 veces.

Figura 1 Firmeza de la pulpa y compuestos fenólicos solubles totales (TSP) de fruto de zapote mamey durante su maduración a 12 °C. Las barras representan la desviación estándar de la media de tres frutos.
Los valores promedio de los TSP en la etapa de preclimaterio (estado 1) y madurez hortícola (estado 2) fueron similares a los encontrados por Saucedo-Veloz et al. (2001) quienes reportaron 1.53 % para frutos en estado 1 y 0.21 % para el estado 2, pero fueron a su vez menores que los valores de 1653 y 646 mg GAE kg-1 FW informados por Alia-Tejacal et al. (2005a) para los mismos estados de maduración del fruto. En este sentido, se ha reportado que los TSP en el fruto de zapote mamey son afectados por la temperatura de almacenamiento (Alia-Tejacal et al., 2002), el grado de madurez (Saucedo-Veloz et al., 2001), origen geográfico del fruto (Torres-Rodríguez et al., 2011; Ma et al., 2004), y el proceso de extracción de estos compuestos, así como el tipo de solvente empleado (Yahia et al., 2011).
El zapote mamey es un fruto que presenta valores de sólidos solubles totales de entre 20 y 30 °Brix. La acumulación de azúcares en el fruto ocurre en las dos primeras semanas después de ser cosechado (Torres-Rodríguez et al., 2011) así que, los TSP cuantificados por el método de Folin-Ciocalteu podrían tener una alta interferencia por azúcares, que pueden tener reacción en el ensayo (Singleton et al., 1999). En tejido vegetal con elevado contenido de azúcares reductores, conviene removerlos, antes de correr el ensayo de Folin-Ciocalteu (Stratil et al., 2007).
Con la aplicación del método de butanol/HCl en el extracto de acetona del fruto de zapote mamey se pudo comprobar la presencia de proantocianidinas polímericas o taninos condensados en el fruto, y cuyo patrón durante el proceso de maduración fue similar al mostrado por los TSP (Figura 2).
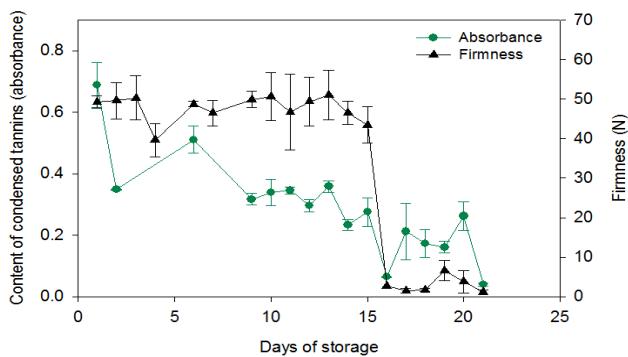
Figura 2 Firmeza de la pulpa y contenido de taninos condensados (absorbancia) en fruto de zapote mamey durante su maduración a 12 °C. Las barras representan la desviación estándar de la media de tres frutos.
Los frutos inmaduros presentan comúnmente elevadas cantidades de taninos condensados, pues constituye un mecanismo de las plantas para salvaguardar la preservación de la especie. El contenido de estos compuestos fenólicos decrece con la madurez del fruto. Sin embargo, algunos frutos mantienen elevadas cantidades de algún tipo de taninos condensados cuando el fruto alcanza su madurez de consumo hortícola, los que contribuyen a su sabor particular.
El comportamiento de las PAs cuantificadas por los métodos de vainillina y DMAC mostró el mismo patrón que los TSP, cuando los frutos pasaron del estado de pre-climaterio (estado 1) a madurez hortícola (estado 2) durante su maduración. Sin embargo, los valores de PAs fueron más bajos y en general, menos variables que los TSP, particularmente en el periodo comprendido entre el día 1 y 15 de almacenamiento. Los valores de PAs por el método de vainillina fueron más altos y más variables que los obtenidos con el método DMAC (Figura 3).

Figura 3 Contenido de proantocianidinas con los métodos de vainillina (izquierda) y DMAC (derecha) en fruto de zapote mamey durante su maduración a 12 °C. Las barras representan la desviación estándar de la media de tres frutos.
Las diferencias en el contenido de PAs entre los dos métodos podrían deberse a la predominancia de diferentes tipos de PAs en cada etapa de maduración y a la afinidad particular de cada método por un tipo específico de PAs. El método DMAC es más específico para monómeros de flavan-3-ols, y reacciona solamente con unidades terminales, por lo que no discrimina entre monómeros, dímeros o trímeros (Hummer & Schreier, 2008). La catequina y epicatequina reaccionan fácilmente con el reactivo del método DMAC en comparación a cómo lo hacen las PAs oligoméricas (Li et al., 1996), las que tienen mucho mayor afinidad por el reactivo del método de vainillina, especialmente aquellas con grupos hidroxilo m-orientados. (Hageman et al., 1997).
Ninguno de estos dos métodos es específico para taninos condensados (proantocianidinas poliméricas), dado que cualquier monómero de flavanol reacciona en el ensayo (Dykes & Rooney, 2006). Los valores de PAs obtenidos con el método DMAC son similares a los reportados para manzana “Red Delicious” (162 ± 10 mg 100 g-1 de fruta fresca) y uva roja (54 ± 4.2 mg 100 g-1 de fruta fresca) (Hellström & Mattila, 2008). De acuerdo con los valores de PAs obtenidos con el método de vainillina, el fruto de zapote mamey contiene más PAs que los frutos antes mencionados. Además, los valores de PAs encontrados en zapote mamey son similares a los reportados en el fruto de persimonio, que varían desde 61.2 hasta 91.5 mg equivalentes de catequina por gramo de peso seco (DW) con el método DMAC, y desde 3.15 hasta 4.03 mg equivalentes de catequina por gramo de DW, con el método de vainillina (Zou et al., 2012). Cabe destacar que, en zapote mamey el contenido de PAs determinado con el método de la vainillina es mucho mayor que con el método DMAC, en la etapa de maduración 2. Este patrón es contrario a lo que se ha informado para persimonio. Estos resultados sugieren que el zapote mamey podría representar una fuente rica de PAs oligoméricas, las cuales se asocian con diversos beneficios para la salud (Gorinstein et al., 2011; Zou et al., 2012), y que no son comunes en la mayoría de los frutos, ya que aún en el persimonio las que predominan son las PAs monoméricas.
En la Tabla 1 se resumen los resultados promedio sobre materia seca, firmeza de fruto y compuestos fenólicos para los dos estados de maduración del fruto estudiados. La materia seca de la pulpa del zapote mamey se incrementa ligeramente con la maduración del fruto. En el estado 1, el fruto de zapote mamey presentó altos valores de TSP y PAs, pero en madurez hortícola (estado 2), estos valores decrecieron de forma significativa. Como se mencionó en párrafos anteriores, del estado 1 al 2, los TSP se redujeron 2.1 veces; el contenido de PAs determinado por DMAC fue reducido 2.8 veces, mientras que las PAs obtenidas con el método de vainillina fueron reducidas 1.6 veces. Considerando la especificidad de los métodos de DMAC y vainillina hacia un tipo particular de PAs, estos resultados significan que en madurez hortícola (estado 2), en el fruto de zapote mamey predominan PAs oligoméricas. Sin embargo, es necesario realizar nuevos estudios para determinar la estructura química de estos compuestos, y más aún, evaluar sus actividades biológicas.
Tabla 1 Materia seca, firmeza de pulpa y contenido de compuestos fenólicos en fruto de zapote mamey durante su maduración a 12 ± 1 °C.
| Proanthocyanidins (PAs) | ||||||
|---|---|---|---|---|---|---|
| Ripening stages | % Dry matter | Firmness (N) | TSP¶ | DMAC§ | Vanillin‡ | |
| Preclimacteric stage | ||||||
| Stage 1 (1-15 days) | 26.4±5.1 | 47.8 a | 1298.0 a | 223.5 a | 486.0 a | |
| horticultural maturity | ||||||
| Stage 2 (16-21 days) | 30.4±7.2 | 2.9 b | 622.5 b | 79.9 b | 307.1 b | |
| 3.1 | 386.9 | 58.9 | 108.9 | |||
¶: TSP= fenoles solubles totales obtenidos con el método de Folin-Ciocalteau (mg GAE 100 g-1 FM). §: expresados en mg CE 100 g-1 peso fresco (FW). ‡: expresados en mg PB2E 100 g-1 FW. HSD: diferencia significativa honesta.
Análisis de proantocianidinas por HPLC-DAD
En la fracción de etil acetato (EAF) los compuestos fenólicos identificados fueron: ácido gálico (GA), catequina (CAT), epicatequina (EPC), y epicatequina 3-galato (EPCG). Los contenidos de estos compuestos fenólicos (GA, CAT, EPC y EPCG) no fueron estadísticamente diferentes (p<0.05) entre los estados de preclimaterio (estado 1) y la madurez hortícola (estado 2) (Tabla 2). Sin embargo, un compuesto de baja polaridad y por tanto con un elevado tiempo de retención, se observó en proporción elevada con relación a los compuestos fenólicos identificados. Este compuesto, denominado como P6, mostró un incremento gradual a través del proceso de maduración, con valores en el estado 2 que fueron casi el doble de lo observado en el estado 1 (Tabla 2). El compuesto (P6) fue tentativamente identificado como un dímero de epicatequina/catequina, de acuerdo con su espectro de UV y su tiempo de retención (26.5 min). Previamente, Yahia et al. (2011), mediante la técnica de espectroscopía de masas, identificaron un dímero de epicatequina en el fruto maduro de zapote mamey, el cual podría corresponder al compuesto P6 observado en el presente estudio.
Tabla 2 Contenido de compuestos fenólicos en dos estados de madurez de fruto de zapote mamey, analizados por HPLC-DAD.
| Ripening stages | GA† | CAT | EPGC | EPC | P6 |
|---|---|---|---|---|---|
| Preclimacteric stage | |||||
| Stage 1 (1 -15 days) | 4.37 a | 4.26 a | 0.72 a | 3.00 a | 26.90 a |
| Horticultural maturity | |||||
| Stage 2 (16 - 21 days) | 7.75 a | 5.45 a | 0.58 a | 5.14 a | 49.92 b |
| HSD | 2.61 | 3.35 | 0.67 | 4.00 | 16.17 |
†:GA: acido gálico, CAT: catequina, EPGC: epicatequin 3-galato, EPC: epicatequina, P6: Pico con un tiempo de retención de 26.5 min; dato expresado en µg g-1 tejido fresco (FW); HSD: diferencia significativa honesta.
En ninguna de las muestras analizadas se presentó galocatequina, compuesto fenólico observado en grandes cantidades en la pulpa de zapote mamey cultivar Magaña por Ma et al. (2004). La falta de información sobre el cultivar o el genotipo utilizado en la mayoría de los estudios sobre el fruto de sapote mamey dificulta la comparación de resultados.
Debe notarse qué, con excepción del GA, los compuestos CAT, EPC y EPGC, cuantificados por HPLC, son Pas monoméricas, determinadas con el método DMAC. El hecho de que las PAs totales cuantificadas con el método DMAC decrecieran de manera significativa durante la transición del estado 1 al 2, podría sugerir que otras PAs no cuantificadas en el presente trabajo podrían ser las responsables de los cambios observados.
Actividad enzimática
La actividad enzimática de la PPO mostró un incremento continuo durante el almacenamiento y maduración del fruto, y cambió de 61.6 (±27.2) U g1 en estado preclimatérico (estado 1) a 182.2 (±59.4) U g1 en madurez hortícola (estado 2). En el caso de la POD, la actividad permaneció en bajos niveles durante el estado 1, pero con un notable incremento durante el estado 2, al cambiar de 633.6 (±183.9) U g1 en estado de preclimaterio a 7235 (±1139.3) U g1 en madurez hortícola (Figura 4). La PPO cataliza la conversión de fenoles a o-difenoles a través de la hidroxilación y conversión de o-hidroxifenoles a o-quinonas por medio de la oxidación, lo que resulta en oscurecimiento del tejido vegetal (Aydemir, 2004). La POD es otra enzima oxido-reductasa involucrada en el pardeamiento de tejido vegetal, ya que también oxida difenoles como sustrato (Mdluli, 2005), y podría actuar sinérgicamente con la PPO debido a la formación de peróxido de hidrógeno durante la actividad oxidativa de la PPO (Luo & Xie, 2012).
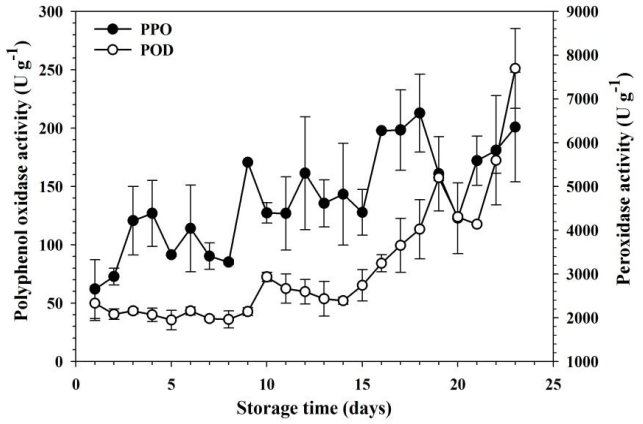
Figura 4 Variación de la actividad de las enzimas polifenoloxidasa (PPO) y peroxidasa (POD) durante el proceso de maduración de fruto de zapote mamey almacenado a 12 °C. Las barras representan la desviación estándar de la media de tres frutos.
De los parámetros de color, medidos durante el proceso de maduración de los frutos de zapote mamey almacenados, únicamente la luminosidad mostró cambios. Esta variable mostró una reducción a partir del día 15 de almacenamiento (datos no mostrados), que coincide con el incremento de la actividad de la POD.
Conclusiones
El grado de madurez del zapote mamey basado en la firmeza de la pulpa del fruto está relacionado con el contenido y el tipo de proantocianidinas. De acuerdo con los resultados obtenidos por los métodos analíticos de vainillina y DMAC, el zapote mamey es una fuente importante de proantocianidinas, con predominio del tipo oligomérico. De las enzimas analizadas durante el proceso de maduración, la polifenol oxidasa incrementó su actividad gradualmente, mientras que la peroxidasa detonó su actividad con la caída de la firmeza del fruto. Se observó una correlación inversa significativa (r = -0.4385) entre el contenido de fenoles solubles totales y la actividad de la polifenol oxidasa, pero la correlación con la peroxidasa no fue significativa.
REFERENCIAS
Alia-Tejacal, I., Colinas-León, M. T., Martínez-Damián, M. T. and Soto-Hernández, R. hM. (2005a). Análisis preliminar de carotenoides y compueste os fenólicos en frutos de zapote mamey (Pouteria sapota (Jacq.) H.E. Moore & Stearn). Revista Chapingo Serie Horticultura, 8: 225-231. https://doi.org/10.5154/r.rchsh.2004.04.025 [ Links ]
Alia-Tejacal, I., Colinas-León, M. T., Martínez-Damián, M. T. and Soto-Hernández, R. M. (2005b). Daños por frío en zapote mamey (Pouteria sapota (Jacq.) H. E. Moore and stearn). II. Cambios en fenoles totales y actividad enzimática. Revista Fitotecnia Mexicana, 28: 25-32. [ Links ]
Alia-Tejacal, I., Colinas-León, M. T., Martínez-Damián, M. T. and Soto-Hernández, R. M. (2002). Factores fisiológicos, bioquímicos y de calidad en frutos de zapote mamey (Pouteria sapota Jacq. H.E. Moore & Stearn) durante poscosecha. Revista Chapingo Serie Horticultura , 8: 263-281. https://s3.amazonaws.com/academia.edu.documents/33308482/cd350f9cdb9a0ddabd70af5219f84e87.pdf?response-content-disposition=inline%3B%20filename%3DFACTORES_FISIOLOGICOS_BIOQUIMICOS_Y_DE_C.pdf&X-Amz-Algorithm=AWS4-HMAC-SHA256&X-Amz-Credential=AKIAIWOWYYGZ2Y53UL3A%2F20190625%2Fus-east-1%2Fs3%2Faws4_ request&X-Amz-Date=20190625T172419Z&X-Amz-Expires=3600&X-Amz-SignedHeaders=host&X-Amz-Signature=f93769f2684ea2086ff91375527d66d6cdfc56b9ef237ed6c849594b45ded097 [ Links ]
Aydemir, T. (2004). Partial purification and characterization of polyphenol oxidase from artichoque (Cynara scolymus L.) heads. Food Chemistry 87: 59-67. https://doi.org/10.1016/j.foodchem.2003.10.017 [ Links ]
Cabrera, C., Giménez, R. and López, M. C. (2003). Determination of tea components with antioxidant activity. Journal of Agricultural and Food Chemistry , 51: 4427-4435. https://doi.org/10.1021/jf0300801 [ Links ]
Dykes, L. & Rooney, L. W. (2006). Sorghum and millet phenols and antioxidants. Journal of Cereal Science, 44: 236-251. https://doi.org/10.1016/j.jcs.2006.06.007 [ Links ]
Flurkey, W. H. & Jen, J. J. (1978). Peroxidase and polyphenol oxidase activities in developing peaches. Journal of. Food Science, 43: 1826-1828. https://doi.org/10.1111/j.1365-2621.1978.tb07424.x [ Links ]
Gorinstein, S., Leontowicz, H., Leontowicz, M., Jesion, I., Namiesnik, J., Drzewiecki, J., Park, Y. S., Ham, S. K., Giordani, E. and Trakhtenberg, S. (2011). Influence of two cultivars of persimmon on atherosclerosis indices in rats fed cholesterol-containing diets: Investigation in vitro and in vivo. Nutrition, 27: 838-846. https://doi.org/10.1016/j.nut.2010.08.015 [ Links ]
Hageman, A. E., Zhao, Y. and Johnson, S. (1997) Methods for determination of condensed and hydrolysable tannins. In: Antinutrients and Phytochemicals in Foods, ed. by Fereidoon S. American Chemical Society. Washington DC, pp. 170-81. https://doi.org/10.1021/bk-1997-0662.ch012 [ Links ]
Hellström, J. K. & Mattila, P. H. (2008). HPLC determinations of extractable and un-extractable proanthocyanidins in plant material. Journal of Agricultural and Food Chemistry , 56: 7617-7624. https://doi.org/10.1021/jf801336s [ Links ]
Hummer, W. & Schreier, P. (2008). Analysis of proanthocyanidins. Molecular Nutrition Food Research, 52: 1381-1398. https://doi.org/10.1002/mnfr.200700463 [ Links ]
Lamikanra, O. (1995). Enzymatic browning of Muscadine grape products. In: Enzymatic Browning and its Prevention. Lee, C. L. and J. R. Whitaker, eds., ACS Symposium Series, American Chemical Society, Washington D.C. pp. 166-177. [ Links ]
Lee, A. Y., Chon, E. J. and Yokozawa, T. (2010). Oligomeric proanthocyanidins improve memory and enhance phosphorylation of vascular endothelial growth factor receptor-2 in senescence-accelerated mouse prone/8. British Journal of Nutrition , 103:479-489. https://doi.org/10.1017/S0007114509992005 [ Links ]
Li Y. G., Tanner G. and Larkin P. (1996). The DMACA-HCl protocol and the threshold proanthocyanidin content for bloat safety in forage legumes. Journal of Science Food and Agriculture, 70: 89-101. https://doi.org/10.1002/(SICI)1097-0010(199601)70:1<89::AID-JSFA470>3.0.CO;2-N [ Links ]
Luo, Y. W. & Xie, W. H. (2012). Influence of polyphenol oxidase, peroxidase and organic acids on the in vitro iron bioavailability in faba bean flour. CyTA Journal of Food, 10: 123-127. https://doi.org/10.1080/19476337.2011.597513 [ Links ]
Ma, J., Yang, H., Basile, M. J. and Kennelly, E. J. (2004). Analysis of polyphenolic antioxidants from fruit of three: Pouteria species by selected ion monitoring liquid chromatography-mass spectrometry. Journal of Agricultural and Food Chemistry , 52: 5873-5878. https://doi.org/10.1021/jf049950k [ Links ]
Mdluli, K. M. (2005). Partial purification and characterization of polyphenol oxidase and peroxidase from marula fruit (Scle-rocarya birrea subsp. Caffra). Food Chemistry , 92: 311-323. https://doi.org/10.1016/j.foodchem.2004.07.026 [ Links ]
Porter, L., Hrstich, J. L. N. and Chan, B. G. (1986). The conversion of procyanidins and prodelphinidins to cyanidin and delphinidin. Phytochemistry, 1: 223-230. https://doi.org/10.1016/S0031-9422(00)94533-3 [ Links ]
Prior, R. L., Fan, E., Ji, H., Howell, A., Nio, C., Payne, M. J. and Reed, J. (2010). Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders. Journal of the Science of Food and Agriculture, 90(9): 1473-1478.https://doi.org/10.1002/jsfa.3966 [ Links ]
Saucedo-Veloz, C., Martínez-Morales, A., Chávez-Franco, S. H. and Soto-Hernández, R. M. (2001). Maduración de frutos de zapote mamey (Pouteria sapota (Jaq) H.E. Moore & Stearn). Revista Fitotecnia Mexicana , 24: 231-234. https://www.redalyc.org/pdf/610/61024213.pdf [ Links ]
SAS. Institute Inc. (2002).SAS/STAT® User’s Guide, Version 9.0, SAS Institute Inc. Cary, NC. [ Links ]
Schofield, P., Mbugna, D. M. and Pell, A. N. (2001). Analysis of condensed tannins: a review. Animal Feed Science and Technology, 91: 21-40. https://doi.org/10.1016/S0377-8401(01)00228-0 [ Links ]
SIAP (Servicio de Información y Estadística Agroalimentaria y Pesquera). (2016). Producción agrícola ciclo perenes. Mamey. http://www.siap.gob.mx/ [Last checked February 2016]. [ Links ]
Silva, C. A. M., Simeoni, L. A. and Silveira, D. (2009). Genus Pouteria: Chemistry and biological activity. Brazilian Journal of Pharmacology. 19: 501-509. http://dx.doi.org/10.1590/S0102-695X2009000300025 [ Links ]
Singleton, V. L., Orthofer, R. and Lamuela-Raventos, R. M. (1999). Analysis of total phenols and other oxidation sub-strates and antioxidants by means of Folin-Ciocalteu reagent. Methods in Enzymology, 299: 152-178. https://doi.org/10.1016/S0076-6879(99)99017-1 [ Links ]
Singleton, V. L. & Rossi, J. A. (1965). Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology Viticulture 16: 144-58. https://www.ajevonline.org/content/16/3/144.short [ Links ]
Stratil, P., Klejdus, B. and Kuban, V. (2007). Determination of phenolic compounds and their antioxidant activity in fruits and cereals. Talanta, 71: 1741-1751. https://doi.org/10.1016/j.talanta.2006.08.012 [ Links ]
Torres-Rodríguez, A., Salinas-Moreno, Y., Valle-Guadarrama, S. and Alia-Tejacal, I. (2011). Soluble phenols and antioxidant activity in mamey sapote (Pouteria sapota) fruits in postharvest. Food Research International, 44: 1956-1961. https://doi.org/10.1016/j.foodres.2011.04.045 [ Links ]
Sun, B., Ricardo-Da-Silva, J. M. and Spranger, I. (1998). Critical factors of vainillin assay for catechins and proanthocyani-dins. Journal of Agricultural and Food Chemistry , 46: 4267-4274. https://doi.org/10.1021/jf980366j [ Links ]
Wang, J., Ho, L., Blount, J., Janle, E. M., Gong, B., Pan, Y., Nagana, G. G. A., Raftery, D., Arrieta-Cruz, I., Sharma, V., Coo-per, B., Lobo, J., Simon, J. E., Zhang, C., Cheng, A., Qian, X., Ono, K., Teplow. D. B., Pavlides, C., Dixon, R. A. and Pasinetti, G. M. (2012). Brain-targeted proanthocyanidins metabolites for Alzheimer disease treatment. Journal of Neurocience, 32: 5144-5150. https://doi.org/10.1523/JNEUROSCI.6437-11.2012 [ Links ]
Wallace, T. C. & Giusti, M. M. (2010). Evaluation of parameters that affect the 4-dimethylaminocinnamaldehyde assay for flavanols and proanthocyanidins. Journal of Food Science, 75: C619-C625. https://doi.org/10.1111/j.1750-3841.2010.01734.x [ Links ]
Watada, A. E., Herner, R. C., Kader, A. A., Roman, R. J. and Staby, G. L. (1984). Terminology for the description of devel-opmental stages of horticultural crops. HortScience 19: 20-21. [ Links ]
Yahia, E. M., Gutiérrez-Orozco, F. and Arvizu-de León, C. (2011). Phytochemical and antioxidant haracterization of mamey (Pouteria sapota Jacq. H.E. Moore & Stearn) fruit. Food Research International , 44: 2175-2181. https://doi. org/10.1016/j.foodres.2010.11.029 [ Links ]
Zou, B., Li, C. M., Chen, J. Y., Dong, X. Q., Zhang, Y. and Du, J. (2012). High molecular weight persimmon tannin is a potent hypolipidemic in high-cholesterol diet fed rats. Food Research International , 48: 970-977. https://doi. org/10.1016/j.foodres.2012.05.024 [ Links ]
1Como citar este artículo: Torres-Rodríguez, A., Salinas-Moreno, Y., Valle-Guadarrama, S., Soto-Hernández, R. M., Alia-Tejacal, I. (2019). Proanthocyanidins and enzymatic activity in mamey sapote (Pouteria sapota) fruit during ripening. Revista Bio Ciencias 6 e565. doi: https://doi.org/10.15741/revbio.06.e565
Recibido: 18 de Septiembre de 2018; Aprobado: 05 de Mayo de 2019











 texto en
texto en 


