Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista bio ciencias
versão On-line ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub 02-Out-2020
https://doi.org/10.15741/revbio.06.e509
Artículos Originales
Evaluación del crecimiento y composición bromatológica del rotífero Brachionus plicatilis alimentado con diferentes microalgas nativas del Golfo de California
1Posgrado en Ciencias Biológico Agropecuarias, Universidad Autónoma de Nayarit, México.
2Universidad Autónoma de Baja California Sur, Carretera al Sur Km 5.5., Apartado Postal 19-,B, C.P. 23080, La Paz, Baja California Sur, México.
En la acuicultura, la producción de Brachionus plicatilis implica el abasto continuo de microalgas con requerimientos específicos de control de variables de cultivo, por ello se busca proponer nuevas cepas de microalgas nativas para alimentación de Brachionus plicatilis que cubran sus requerimientos nutricionales y estén adaptadas a condiciones ambientales locales. En este estudio se aislaron e identificaron especies de microalgas provenientes de la Bahía de La Paz, B.C.S. y estero de Ahome, Sinaloa, México. Tres Chaetoceros sp. (clave interna LPU-2, LPU-3, LPU-4), Synechococcus sp. (clave interna LPU-10) y Dicrateria sp. (clave interna LPU-8), además de Isochyrisis galbana (control) de las cuales se evalúo su crecimiento, su composición bromatológica y su efecto en el crecimiento y composición en el rotífero B. plicatilis.
La evaluación en rotíferos se realizó en unidades de 17 L, a 22°C por 7 días. Los rotíferos fueron alimentados diariamente, obteniendo las mayores densidades de 48rot. mL.-1 con Chaetoceros sp. LPU-2 y con la dieta control (I. galbana). La composición bromatológica de los rotíferos se vio modificada por las microalgas consumidas, encontrando las mayores concentraciones de lípidos y proteínas con la dieta con las microalgas Chaetoceros sp. LPU-2, Dicrateria sp. LPU-8 e I. galbana. Por lo anterior, se recomienda la microalga Chaetoceros sp. LPU-2 para su cultivo y alimentación de Brachionus plicatilis.
Palabras clave: Microalgas endémicas; Brachionus plicatilis; composición; alimento vivo
In aquaculture, producing the rotifer Brachionus plicatilis involves a continuous input of microalgae with specific requirements of culture variables. Thus, attempts are made to find new native microalgae strains that meet the nutritional needs of B. plicatilis and are adapted to the local environmental conditions. In our study we isolated and identified microalgae from Bahia de La Paz, B.C.S. and the Ahome estuary, Sinaloa, Mexico. Growth and bromatological composition of three Chaetoceros sp. (key number LPU-2, LPU-3, and LPU-4), Synechococcus sp. (key number LPU-10) and Dicrateria sp. (key number LPU-8) were evaluated, as well as their effect on growth and composition of the rotifer B. plicatilis. The microalga Isochyrisis galbana was used as control.
Rotifers were assessed in 17 L units at 22 °C during 7 days. These organisms were fed on a daily basis and reached the highest densities (48 rot. mL.-1) with Chaetoceros sp. LPU-2 and the control diet (I. galbana). The bromatological composition of rotifers was modified according to the microalga ingested, the highest lipid and protein concentrations were found with the following diets: Chaetoceros sp. LPU-2, Dicrateria sp. LPU-8, and I. galbana. Hence, the microalga Chaetoceros sp. LPU-2 is suggested for culture to feed Brachionus plicatilis.
Key words: Endemic microalgae; Brachionus plicatilis; composition; live feeds
Introducción
Los rotíferos pertenecen al micro-zooplancton que han sido ampliamente usados como fuente esencial de alimento en la producción de larvas de peces de agua dulce y marinos por sus características únicas (Odo et al., 2015). De las 2000 especies de rotíferos descritas, la mayoría pertenecen a agua dulce y la menor proporción son marinos (Lubzens & Zmora, 2003). De las dos principales especies de rotíferos marinos, el Brachionus plicatilis es el más usado en maricultura como alimento de diversos peces y crustáceos (Rehberg-Haas et al., 2015), variando su aporte nutricional de acuerdo al alimento consumido. Adicionalmente, es una especie con alta facilidad para la trasferencia de nutrientes (aminoácidos esenciales y ácidos grasos de cadena larga) al organismo que se alimenta con este y es fácil de digerir, por todo esto es de las especies más usadas en larvicultura (Zhou et al., 2009).
La producción masiva de rotíferos en laboratorios comerciales demanda altas cantidades de alimento vivo (microalgas) de alto valor nutrimental y con características fisiológicas que permitan su aprovechamiento por B. plicatilis. No obstante, una de las desventajas de la producción masiva de microalgas son los altos costos de producción que conlleva el abasto de las especies de microalgas tradicionales: Isochrysis galbana, Nannochloropsis oculata, Tetraselmis suecica, Dunaliella salina, Pavlova lutheri, Chaetoceros muelleri y Thalassiosira pseudonana (Wikfors & Ohno, 2001). El cultivo de las anteriores especies requieren de control de parámetros de cultivo muy específicos como: luz (120-170 µmol fotón m-2 s-1), salinidad (32-36 UPS), temperatura (19-23°C) entre otros. Es por ello, que se buscan alternativas para reducir los costos de producción mediante el uso de nuevas especies de microalgas nativas cuyos parámetros de cultivo se ajusten a los ambientes del área de trabajo y especialmente cepas aisladas de ambientes tropicales o sub-tropicales expuestas a altos niveles de radiación solar, que han mostrado alta síntesis de antioxidantes y alta habilidad para la transformación de luz solar a lípidos (Lim et al., 2012). Un aspecto relevante al proponer nuevas especies de microalgas para alimento vivo de rotíferos, es que las células presenten características: tamaño adecuado, digestibilidad, presenten hábitos planctónicos y fácil cultivo. Adicionalmente, la composición bioquímica deben presentar una alta concentración y buena composición de proteínas (aminoácidos esenciales), carbohidratos y lípidos (ácidos grasos omega-3). De los anteriores nutrientes, los más importantes por la dificultad de sintetizar es el ácido eicosapentaenoic (EPA; 20:5n − 3) y docosahexaenoic (DHA; 22:6n − 3), cuya fuente está dada por las microalgas (Tacon & Metian, 2013).
Muchas especies de microalgas han sido utilizadas para la alimentación de Brachionus plicatilis, sin embargo es necesario tomar en cuenta que la alimentación de este rotífero es diversa en su ambiente y únicamente está limitada por el tamaño de su corona y boca, por lo que no hay especies específicas de microalgas ya que además de microalgas, estos suelen consumir bacterias o flóculos de bacterias que suelen generarse en los cultivos (Hino et al., 1997).
Derivado del aumento de las actividades acuícolas y la necesidad de fuentes alternativas de proteínas y lípidos para la alimentación de larvas y otros organismos, es necesario proponer nuevas especies que sustituyan a las tradicionales Chaetoceros spp. e Isochrysis galbana principalmente, esto implica aislar, caracterizar y evaluar las cepas de microalgas para su uso como alimento vivo. En este estudio se consideró como zona de muestreo para la obtención de cepas de microalgas, una región de alta importancia acuícola de la cual se obtuvieron 4 cepas de microalgas marinas adaptadas a las condiciones tropicales, que fueron caracterizadas parcialmente y evaluado su uso por su aporte nutricional para el rotífero Brachionus plicatilis, que permita sustituir las microalgas tradicionales y minimizar sus costos de producción.
Material y métodos
Aislamiento y purificación de microalgas
Fueron colectadas muestras de agua en La Playa Las Salinas (26° 4’13.58”N, 109°23’58.67”O), al Noroeste del municipio de Ahome en Sinaloa, y en la Bahía de La Paz (24°16’7.66”N, 110°19’29.53”O) México, a un metro de profundidad y de la columna de agua, ya que lo que se pretendía era obtener especies planctónicas. Las muestra de agua que contenían las microalgas fueron trasportadas al Laboratorio Experimental de Acuacultura Unidad Pichillingue.
Localizado en el kilómetro 17 de la carretera a Pichillingue en La Paz Baja California Sur; posteriormente las muestras se tamizaron con un filtro WHATMAN® (1 µm), después se realizó un lavado con agua marina estéril para disminuir la carga bacteriana que pudieran contener, una vez teniendo la muestra se resembraron en tubos de ensaye con agua marina estéril y medio F/2 (Guillard, 1973) como fuente de nutrientes. Las cepas se aislaron mediante el desarrollo de diferentes métodos, como diluciones seriadas y siembra en placa empleando medio en agar marino (DB-2216). Una vez obtenidas cepas unialgales se procedió a la aplicación de baños por 24 h con una solución a partir de antibiótico (Gentamicina 240 mg 3 mL-1), a concentraciones de 10 µL de antibiótico en 300 µL de cultivo, realizando posteriormente siembras estriadas en placa en medio agar marino para verificar la ausencia de bacterias. Para poder identificar las microalgas aisladas se tomaron mediciones y fotografías con ayuda de un microscopio Nikon (Optiphot-2) con cámara (Sight Ds-L1) e identificaron los géneros siguiendo las claves descritas en Tomas (1997) y O’sullivan & Reynolds (2004) obteniendo tres géneros de microalgas y una de cianobacterias procedentes de la boca del estero la Chicura, Ahome Sinaloa, y otra especie de microalga de Bahía de La Paz B.C.S. Posteriormente las cepas fueron cultivadas en condiciones controlada de iluminación constante (33.7 a µmol fotón m-2 s-1), aireación continua, y temperatura promedio de 22 ± 2°C., las microalgas fueron medidas e identificadas morfológicamente como: Chaetoceros sp.(clave interna de laboratorio LPU-1), Chaetoceros sp. (clave interna LPU-3), Synechococcus sp. (clave interna LPU-10) y Dicrateria sp. (clave interna LPU-8).
Una vez identificadas las microalgas, se cultivaron en medio F/2 (Guillard, 1973) hasta con 17 L C/U, la curva de crecimiento se estimó en este volumen mediante conteos diarios con la ayuda de una cámara Neubauer. Los cultivos se mantuvieron de manera semicontinua con una tasa de dilución del 25 % por día, utilizando el volumen de cosecha para alimentación diaria de los tratamientos experimentales con B. plicatilis.
Evaluación de la dieta en Brachionus plicatilis
La evaluación del alimento vivo en B. plicatilis se realizó en garrafones de propileno de 19 L. Se inició a una concentración de 6.3 ± 0.4 rot mL-1, evaluando diariamente el alimento residual y concentración de los rotíferos antes de su alimentación con ayuda de un hematocitómetro y con una cámara Reuter respectivamente. La concentración de alimento para B. plicatilis fue la misma en todos los tratamientos, manteniendo una concentración algal constante de 80 000-100 000 células mL-1. Se utilizó la microalga Isochrysis galbana (T-ISO) como alimento control debido a que es una de las especies de mayor uso en alimentación de B. plicatilis, y que forma parte del cepario del laboratorio de microalgas de la UABCS. Los cultivos se mantuvieron por triplicado durante siete días, posteriormente se cosecharon en su totalidad, tanto el cultivo de las microalgas como el cultivo de los rotíferos, para esto se utilizó un tamiz de luz de malla de 40 µm para el caso de los rotíferos y mediante centrifugación a 4000 rpm por 30 min (IEC, modelo GP8R) para las microalgas, finalmente en ambos casos se realizó un lavado con una solución de formiato de amonio al 5 % para reducir las sales. Una vez obtenido el concentrado de microalgas y rotíferos, las muestras fueron congeladas a -40 °C y se liofilizaron por 48 h (Virtis Co, mod 12525) para su posterior análisis bromatológico.
La composición bromatológica en microalgas y rotíferos fue determinada por triplicado siguiendo técnicas espectrofotométricas (Beckman modelo DU® 640). El contenido de proteínas fue determinado con el método de Lowry et al. (1952), se utilizó albumina (99 % de pureza) de leche para realizar la curva de calibración. Para la determinación de carbohidratos se siguió el método de White (1987) y se utilizó glucosa anhidrica (99 % de pureza) para la curva de calibración. La terminación de lípidos totales se realizó mediante el método de Bligh & Dyer (1959) y se utilizó tripalmina (99 % de pureza) para la elaboración de la curva de calibración. Para la determinación de cenizas se utilizó el método de calcinación a 480ºC por 24 horas con la mufla marca Thermolyne y por diferencia de pesos se terminó el contenido de cenizas.
Análisis estadístico
Los datos de los porcentajes obtenidos en los constituyentes bromatológicos: proteínas, carbohidratos y lípidos en microalgas, y rotíferos alimentados con las diferentes dietas, fueron transformados a valores angulares (ángulo = arco seno) para acercar los datos a la distribución normal. Para determinar diferencias significativas en los constituyentes bromatológicos, se realizaron pruebas de análisis de varianza de una vía (ANOVA), posteriormente se realizó una prueba Tukey que permitiera establecer las comparaciones estadísticas entre los tratamientos. Para estos análisis estadísticos se utilizó el programa STADISTICA 7.
Resultados y Discusión
El clima en donde se aislaron las microalgas locales en la bahía de La Paz y Sinaloa es cambiante pues llega a presentarse temperaturas en el agua de 21-31°C a lo largo del año (Castro et al., 2000), por lo que dichos cambios requieren que las microalgas se adapten y/o produzcan más productos bioquímicos para asegurar su supervivencia (Duong et al., 2015). En la Figura 1 se observa el crecimiento poblacional de las especies de microalgas de reciente aislamiento, mostrando que son capaces de adaptase al cultivo en laboratorio para su producción masiva. Aunque en este trabajo los cultivos de las microalgas no se realizaron al exterior, de acuerdo a trabajos previos (Pacheco-Vega et al., 2015), se ha visto que especies de microalgas de ambientes tropicales de origen endémico, generalmente cuentan con esta plasticidad a variaciones de factores externos de cultivo, siendo favorable para la producción masiva de cultivos microalgales.

Figura 1 Crecimiento de las microalgas bajo condiciones controladas de laboratorio. A) Synechococcus sp. (LPU-10), B) Dicrateria sp. (LPU-8), C) Chaetoceros sp. (LPU-2), D) Chaetoceros sp. (LPU-3), E) Chaetoceros sp. (LPU-4) and F) Isochrysis galbana. Los resultados representan la media ± SDs.
Cada especie de microalga tiene un característico patrón de crecimiento estándar (Huesemann et al., 2016) por lo que los resultados mostrados en este estudio evidencian esas diferencias por pertenecer a especies diferentes. El crecimiento poblacional en las diferentes especies además de mostrar las fases poblacionales y su duración, mostraron las densidades máximas alcanzadas, siendo en Synechococcus sp. y Dicrateria sp. donde se registraron las mayores densidades celulares 50 240 000 células mL-1 y 10 231 250 células mL-1 respectivamente.
Aunque la mayoría de las cepas microalgales pueda crecer de manera satisfactoria en condiciones de laboratorio, cada una de ellas puede presentar diferentes condiciones óptimas de crecimiento, por lo que con una sola condición de cultivo para todas ellas no se asegura que presenten un crecimiento satisfactorio en todos los cultivos, debido a lo ya mencionado y a que algunas especies pueden presentar fluctuaciones en los requerimientos de luz, temperatura, nutrientes y otras condiciones del agua (Huesemann et al., 2016). En la Figura 1-A se observa que la cianobacteria Synechococcus sp. alcanza mayor densidad celular que las microalgas, esto debido a que generalmente las cianobacterias suelen presentar una mayor tasa de crecimiento que las microalgas (Sánchez-Alejandro & Sánchez-Saavedra 2015), para la cual Rosales-Loaiza et al., (2008) reportan densidades de hasta 406.13 X 106 ± 21.74 a temperatura de 27 °C, mientras que en este trabajo se reporta una densidad máxima de 56.54 x 106, atribuyéndose esta diferencia a las condiciones de cultivo, principalmente a que la temperatura del agua registrada en el cuerpo de agua donde se extrajo, ya que era de 26.5 °C y en este estudio se evaluó en el laboratorio a 23°C. Adicionalmente, se ha demostrado que el crecimiento de las microalgas se ve influenciado por la presencia de diferentes nutrientes orgánicos y si estos llegaran a modificarse, habría una variación en la composición bromatológica de las microalgas (Prieto et al., 2005). Hay que mencionar que tanto Synechococcus sp. y Dicrateria sp. al ser células de menor tamaño, se reproducen a mayor velocidad que las células o en este caso de las microalgas del genero Chaetoceros sp; que alcanzaron su etapa exponenciales en el segundo día y con densidades de 5 x106 cél mL-1, lo que coincide con lo reportado por Rosales-Loaiza et al. (2012) en un cultivo semi-continuo de Chaetoceros sp. que obtuvieron una densidad máxima de 6.1 x106 células mL-1 con semejanza en las etapas de crecimiento poblacional a lo aquí reportado.
Los resultados de crecimiento poblacional del rotífero Brachionus plicatilis mostraron que las mejores (p>0.05) dietas para la alimentación fueron con Chaetoceros sp. (LPU-2) con concentraciones similares a la dieta control (Figura 2) y seguido de Cheatoceros sp. (LPU-3). Las dietas menos favorables fueron con Chaetoceros sp. (LPU-4 ), Chaetoceros sp.(LPU-4), Synechococcus sp. (LPU-10) y Dicrateria sp. (LPU-8) (Figura 2).

Figura 2 Crecimiento poblacional de rotíferos B. plicatilis alimentados con diferentes dietas de microalgas. Los resultados representan la media ± SDs.
Al elegir un alimento se deben considerar las necesidades de la especie a alimentar, en este caso B. plicatilis tiene requerimientos nutricionales generales de proteínas, lípidos y carbohidratos de tamaño de apropiado de la microalga. Abou-Shanab et al., (2016) menciona que los integrantes del género Brachionus como filtrador puede ser selectivo con las partículas ingeridas. Adicionalmente, Hotos (2002) muestra la capacidad para la selectividad de alimento en B. plicatilis al ser alimentado con varias mezclas de microalgas, encontrando una preferencias de por la microalga Asteromonas gracilis, con tamaños de partículas de 20-25 µm. En este trabajo la microalga con clave LPU-2 con la que se obtuvo mejor crecimiento poblacional el rotífero B. plicatilis, presentó un tamaño de 5.1 - 5.7 µm, siendo menor a lo reportando por Hotos (2002). Sin embargo, en nuestro trabajo además del tamaño de las células, podemos observar la similitud de algunos constituyentes bromatológicos que se asemejan a los encontrados en I. galbana y fue por esto que se obtuvieran resultados semejantes con esta dieta control, por lo que además del tamaño del alimento, resulta relevante la composición bromatológica del mismo.
Composición bromatológica de microalgas y rotiferos
Las microalgas utilizadas para alimento acuícola deben tener una adecuada composición química, tamaño, aceptabilidad y digestibilidad para ser consideradas de buena calidad alimenticia, paralelamente las diferentes especies deben tener facilidad de manejo bajo condiciones de cultivo. La composición bromatológica de las microalgas evaluadas fue diferente (p>0.05), variando sus constituyentes en función del genero de microalga (Figura 3). Dentro de los constituyentes bromatológicos, el contenido de proteínas en microalgas fueron las que representaron la mayor proporción, siendo en la Chaetoceros sp. (LPU-2) estadísticamente similar a I. galbana, con un promedio de 31.7 % y 31.8 % respectivamente. Estos porcentajes son cercanos a los reportados por Jamali et al. (2015) con concentraciones de proteína de 39.8 % en Chaetoceros muelleri y de 30.3 % en I. galbana, pudiendo tener variaciones de estos constituyentes en función de las condiciones y edad del cultivo. Las concentraciones de esos constituyentes favorecieron el crecimiento poblacional del rotífero B. plicatilis.
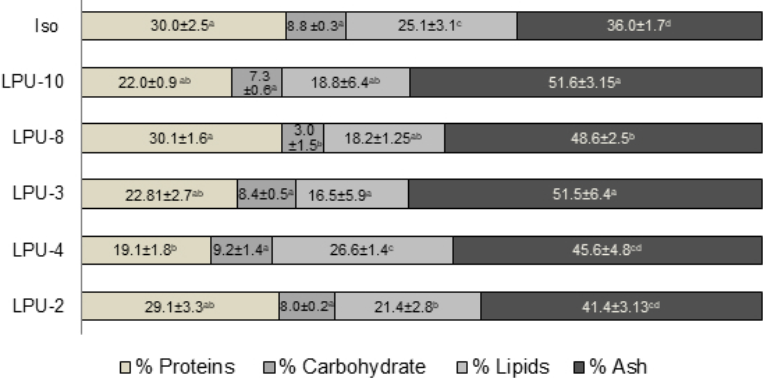
Figura 3 Composición bromatológica de diferentes microalgas: Isochyrisis galbana (Iso), Synechococcus sp. (LPU-10), Dicrateria sp. (LPU-8), Chaetoceros sp. (LPU-2), Chaetoceros sp. (LPU-4), Chaetoceros sp. (LPU-3). Letras diferentes en los renglones representan diferencias significativas (prueba de Tukey). Los resultados representan la media ± SDs.
La concentración de carbohidratos en las microalgas mostró similitud entre la microalga control (I. galbana) y la microalga Chaetoceros sp.-LPU-2, sin embargo la mayor concentración de carbohidratos se obtuvo en la cianobacterias Synechococcus sp. (LPU-10) con un promedio de 35 %, esto coincide con lo reportado por Brown et al., (1997) quien menciona que en microalgas las clorofitas son ricas en carbohidratos. En la alimentación de los rotíferos, es importante la composición de estos constituyentes alimenticios (microalgas) y especialmente la proporción proteína:carbohidratos, ya que se ha encontrado que entre mayor sea esta (alto contenido de proteína y bajo porcentaje de carbohidratos), se logra extender el periodo de vida en el rotífero Brachionus manjavacas (Snell, 2014), incrementándose las reproducciones en rotíferos. En los resultados aquí obtenidos, las mayores proporciones proteínas:carbohidratos se presentaron en las dietas con Chaetocetos sp. (LPU-2) e I. galbana (control), razón por lo cual se le atribuye las más altas poblaciones de B. plicatilis con estas dietas.
El contenido de cenizas de microalgas varió entre especies, estos resultados reafirman que las Chaetoceros spp. (LPU-2, LPU-3 y LPU-4) al ser diatomeas, resentan mayor cantidad de cenizas debido a su esqueleto de sílice que presentan este género, coincidiendo con lo reportado por Martínez-Córdova et al. (2012), quienes reportan para la microalga Chaetoceros muelleri concentraciones de cenizas entre un 34 hasta un 46 %, mientras que en este trabajo se obtuvieron para este mismo género concentraciones de 34 a 42.3 %.
Los lípidos tienen función específica en el desarrollo de los rotíferos, deficiencias de estos puede ocasionar problemas en los procesos reproductivos, disminución de visión, anemia y mortalidad durante su cultivo, principalmente derivado de disminución de las funciones de fosfolípidos en el sistema nervioso central y en el cerebro (Glencross, 2009). Por estas razones, se busca que tanto el alimento suministrado como los rotíferos cultivados en laboratorio, además del contenido de proteínas contengan alta concentración de lípidos. En resumen, este contenido lipídico, proteínas y carbohidratos en B. plicatilis está influenciado directamente por el alimento consumido (Cabrera et al., 2005). Esto coincide con los resultados obtenidos en este estudio, en donde se muestra que la máxima cantidad de lípidos registrada en B. plicatilis fue de 26 %, usando como alimento la diatomea Chaetoceros sp. (LPU-3) que también es una de las diatomeas que mayor cantidad de lípidos presentó (Figura 4). Estos resultados son muy próximos a los reportados por Campaña-Torres et al. (2012) con B. rotundiformis con un 21 % de lípidos alimentados con Nannochloropsis oculata. Por otra parte, resultados obtenidos por Melo Costa et al. (2009) con una dieta de Chaetoceros calcitrans para B. plicatilis mostraron un crecimiento poblacional similar a los reportados en este trabajo (día 7 de cultivo). Esto se le atribuye a que la micoalga Chaetoceros sp. (LPU-2) presenta similutudes a C. calcitrans en contenido de proteínas y lípidos, ya que un alimento algal con bajo contenido de lípidos impediría un aumento en la densidad poblacional de los rotíferos debido a la disminución de su tasa eclosión, siendo constituyentes esenciales en funciones estructurales de las celula, transporte de nutrientes, entre otras funciones.
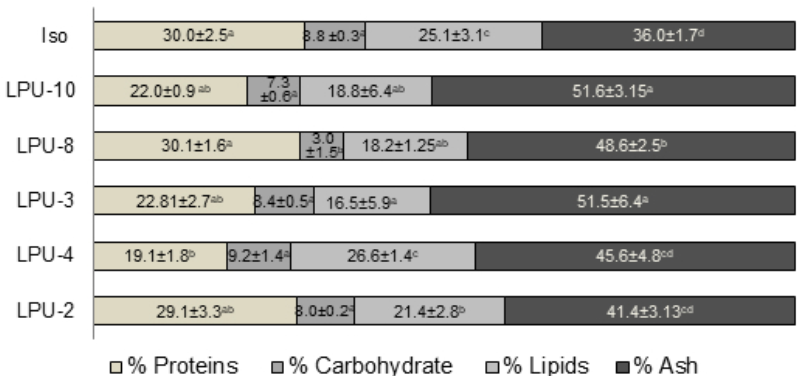
Figura 4 Composición bromatológica en rotiferos B. plicatilis alimentados por 8 días con diferentes microalgas: Isochyrisis galbana (Iso), Synechococcus sp. (LPU-10), Dicrateria sp. (LPU-8), Chaetoceros sp. (LPU-2), Chaetoceros sp. (LPU-4), Chaetoceros sp. (LPU-3). Letras diferentes en los renglones representan diferencias significativas (prueba de Tukey). Los resultados representan la media ± SDs.
Conclusiones
Las microalgas y una cianobacteria aislada de Ahome Sin. y la Bahía de La Paz, BCS., e identificadas como: Synechococcus sp. (LPU-10), Dicrateria sp. (LPU-8), Chaetoceros sp. (LPU-2), Chaetoceros sp. (LPU-4) y Chaetoceros sp. (LPU-3) presentan facilidad de manejo y cultivo en laboratorio. Adicionalmente, la composición de B. plicatilis puede variar de la misma forma al ser alimentadas con estas diferentes microalgas, de las cuales la microalga Chaetoceros sp. (LPU-2) es la que además de presentar un mayor contenido de proteína, logra un crecimiento poblacional de 48 rotíferos mL-1 de B. plicatilis en 7 días de cultivo, similar a la dieta control con Isochrysis galbana. Por lo anterior, se recomienda la microalga Chaetoceros sp. (LPU-2) para su cultivo y alimentación de Brachionus plicatilis.
REFERENCIAS
Abou-Shanab, R. A., Singh, M., Rivera-Cruz, A., Power, G., Bagby-Moon, T. and Das, K. (2016). Effect of Brachionus rubens on the growth characteristics of various species of microalgae. Electronic Journal of Biotechnology, 19(4): 68-74 https://doi.org/10.1016/j.ejbt.2016.06.005 [ Links ]
Bligh, E. G. and Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Canadian journal of biochemistry and physiology, 37(8), 911-917. [ Links ]
Brown, M. R., Jeffrey, S. W. J., Volkman, K. and Dunstan, G. (1997). Nutritional properties of microalgae for mariculture. Aquaculture 151(1-4): 315-331. https://doi.org/10.1016/S0044-8486(96)01501-3 [ Links ]
Cabrera, T., Hee Bae, J., Sungchul, C. and Sung Bumm, H. (2005). Effects of microalgae and salinity on the growth of three types of the rotifer Brachionus plicatilis. Ficheries Science and Tecnology, 8(2): 70-75. https://doi.org/10.5657/fas.2005.8.2.070 [ Links ]
Campaña-Torres, A., Martínez-Córdova, L. R., Martínez-Porchas, M., López-Elías, J. A. and Porchas-Cornejo, M. A. (2012). Productive response of Nannochloropsis oculata, cultured in different media and their efficiency as food for the rotifer Brachionus rotundiformis. International Journal of Experimental Botany, 81: 45-50. http://www.scielo.org.ar/img/revistas/phyton/v81n1/html/v81n1a07.htm [ Links ]
Castro, R., Mascarenhas, A. S., Durazo, R. and Collins, C. A. (2000). Variación estacional de la temperatura y salinidad en la entrada del Golfo de California, México. Ciencias Marinas, 26(4): 561-583 https://www.redalyc.org/html/480/48002602/ [ Links ]
Duong, V. T., Thomas-Hall, S. R. and Schenk, P. M. (2015). Growth and lipid accumulation of microalgae from fluctuating brackish and sea water locations in South East Queensland-Australia. Frontiers in plant science, 6 (May), 359. https://doi.org/10.3389/fpls.2015.00359 [ Links ]
Glencross, B. D. (2009). Exploring the nutritional demand for essential fatty acids by aquaculture species. Review Aquaculture , 1: 71-124. https://onlinelibrary.wiley.com/doi/pdf/10.1111/j.1753-5131.2009.01006.x [ Links ]
Guillard, R. (1973). Methods for microflagellates and nannoplankton. Handbook of phycological methods. Culture methods and growth measurements, Cambridge University Press, Cambridge 69-85. [ Links ]
Hino, A., Aoki, S. and Ushiro, M. (1997). Nitrogen-flow in the rotifer Brachionus rotundiformis and its significance in mass cultures. Hydrobiologia, 358(1-3): 77-82. https://doi.org/10.1023/A:1003128305910 [ Links ]
Hotos, G. H. (2002). Selectivity of the rotifer Brachionus plicatilis fed mixtures of algal species with various cell volumes and cell densities. Aquaculture Research , Vol, 33 12, 949-957. https://doi.org/10.1046/j.1365-2109.2002.00746.x [ Links ]
Huesemann, M., Crowe, B., Waller, P., Chavis, A., Hobbs, S., Edmundson, S. and Wigmosta, M. (2016). A validated model to predict microalgae growth in outdoor pond cultures subjected to fluctuating light intensities and water temperatures. Algal Research, 13: 195-206. https://doi.org/10.1016/j.algal.2015.11.008 [ Links ]
Jamali, H., Ahmadifard, N. and Abdollahi, D. (2015). Evaluation of growth, survival and body composition of larval white shrimp (Litopenaeus vannamei) fed the combination of three types of algae. International Aquatic Research, 7(2): 115-122. https://doi.org/10.1007/s40071-015-0095-9 [ Links ]
Lim, D. K., Garg, S., Timmins, M., Zhang, E. S., Thomas-Hall, S. R., Schuhmann, H. and Schenk, P. M. (2012). Isolation and evaluation of oil-producing microalgae from subtropical coastal and brackish waters. Artículo de investigación, 7(7): e40751. https://doi.org/10.1371/journal.pone.0040751 [ Links ]
Lowry, O. H., Rosebrough, N. J., Farr, A. L. and Randall, R. J. (1951). Protein measurement with the Folin phenol reagent. Journal of biological chemistry, 193(1): 265-275. https://www.cabdirect.org/cabdirect/abstract/19511404458 [ Links ]
Lubzens, E. & Zmora, O. (2003). Production and nutritional value of rotifers. In: Stottrup, J. G., L. A. McEvoy (Eds.), Live Feeds in Marine Aquaculture. Blackwell Scientific Publications Ltd, Oxford, pp. 17-64. https://books.google.com.mx/books?hl=es&lr=&id=nZodkTLNOPsC&oi=fnd&pg=PA17&dq=Production+and+nutritional+value+of+rotifers.+In:+Stottrup,+J.+G.,+L.+A.+McEvoy+(Eds.),+Live+Feeds+in+Marine+Aquaculture &ots=TirJHwdkiP&sig=lKCG9Uca4akGlSzeVEmIstH1ZXk#v=onepage&q=Production%20and%20nutritional%20value%20of%20rotifers.%20In%3A%20Stottrup%2C%20J.%20G.%2C%20L.%20A.%20McEvoy%20(Eds.)%2C%20Live%20Feeds%20in%20Marine%20Aquaculture&f=false [ Links ]
Martínez-Córdova, L. R., Campana-Torres, A., Martínez-Porchas, M., López-Elias, J. A. and García-Sifuentes, C. O. (2012). Effect of alternative mediums on production and proximate composition of the microalgae Chaetoceros muelleri as food in culture of the copepod Acartia sp. Latin American Journal of Aquatic Research, 40(1): 169-76. http://www.org/10.3856/vol40-issue1-fulltext-16 [ Links ]
Melo Costa, W., de Albuquerque, J. C. C., Figueiredo, M. B., Cavalcanti, A. M. A., da Silva, G. A. D. B., Gálvez, A. O. and de Oliveira, I. B. (2009). Cultivo de rotífero Brachionus plicatilis (müller, 1786) com diferentes espécies de microalgas e dieta formulada. Arquivos de Ciências do Mar, 42(2): 68-73. http://www.periodicos.ufc.br/index.php/arquivosdecienciadomar/article/viewFile/6027/4243 [ Links ]
Odo, G. E., Agwu, J. E., Iyaji, F. O., Madu, J. C., Ossai, N. I. and Allison, L. N. (2015). Mass production of rotifer (Branchionus calyciflorus) for aquaculture in south-eastern Nigeria. International Journal of Fisheries and Aquaculture , 7(9), 151-159. https://doi.org/10.5897/IJFA15.0497 [ Links ]
O’sullivan, P. E. & Reynolds. (2004). The Lakes Handbook. C.S. (Edited). Volume 1 limnology and limnetic ecology. Blackwell Science Ltd. 710 pp. [ Links ]
Pacheco-Vega, J. M., Cadena-Roa, M. A., Ascencio, F., Rangel-Dávalos, C. and Rojas-Contreras, M. (2015). Evaluación del potencial de microalgas endémicas para el cultivo de Artemia franciscana. Latin American Journal of Aquatic Research , 43(1): 23-32. http://dx.doi.org/10.3856/vol43-issue1-fulltext-3 [ Links ]
Prieto, M. J., Mogollon, M. J., Castro, A. L. and Sierra, L. A. (2005). Efecto del medio y condiciones de cultivo en la productividad de tres diatomeas marinas con potencial acuícola. Revista MVZ Córdoba, 10(1): 544-554 http://www.redalyc.org/html/693/69310104/ [ Links ]
Rehberg-Haas, S., Meyer, S. Lippemeier, S. and Schulz, C. (2015). A comparison among different Pavlova sp. products for cultivation of Brachionus plicatilis. Aquaculture , 435: 424-30. https://doi.org/10.1016/j.aquaculture.2014.10.029 [ Links ]
Rosales-Loaiza, N., Guevara, M., Lodeiros, C. and Morales, E. (2008). Crecimiento y producción de metabolitos de la cianobacteria marina Synechococcus sp. (Chroococcales) en función de la irradiancia. Revista de Biología Tropical, 56(2): 421-429. http://www.scielo.sa.cr/pdf/rbt/v56n2/art01v56n2.pdf [ Links ]
Rosales-Loaiza, N., Zambrano, H., Guevara, M., Lodeiros, C. and Morales, E. (2012). Productividad de las microalgas marinas Chaetoceros sp. LAEP-35 y Chroomonas sp. MOF-03 en cultivos semicontinuos de interés en acuicultura. Ciencia, 20(2): 90-97 https://www.researchgate.net/profile/Nestor_Rosales_Loaiza2/publication/292996852_Productividad_de_las_microalgas_marinas_Chetoceros_sp_LAEP-35_y_Chroomonas_sp_MOF-03_en_cultivos_semicontinuos_de_interes_en_acuicultura/links/56b53f6008ae5ad360578e79/Productividad-de-las-microalgas-marinas-Chetoceros-sp-LAEP-35-y-Chroomonas-sp-MOF-03-en-cultivos-semicontinuos-de-interes-en-acuicultura.pdf [ Links ]
Sánchez-Alejandro, F. & Sánchez-Saavedra, M. P. (2015). Characterization of the growth, biochemical composition, and nutrient utilization of the cyanobacterium Geitlerinema lemmermannii. Journal of applied phycology, 27(3): 1177-1184. https://doi.org/10.1007/s10811-014-0416-1 [ Links ]
Snell, T. W. (2014). Rotifers as models for the biology of aging. International review of hydrobiology, 99(1-2): 84-95. https://www.ncbi.nlm.nih.gov/pubmed/24791148 [ Links ]
Tacon, A. G. J. & Metian, M. (2013). Fish matters: importance of aquatic foods in human nutrition and global food supply.n Reviews in Fisheries Science, 21(1): pp. 22-38. https:doi.org/10.1080/10641262.2012.753405 [ Links ]
Tomas, C. (1997). Identifying marine phytoplankton. San Diego, California: Academic Press. Primera edición. 858 pp. [ Links ]
White, J. (1987). Biochemical composition and energy content of six species. of phytoplankton used in mariculture of bivalves. Aquaculture , 60(3-4): 231-241. https://doi.org/10.1016/0044-8486(87)90290-0 [ Links ]
Wikfors, G. & Ohno, M. (2001). Impact algae research in Aquaculture . Journal of phycology, 37(6): 968-974. https://doi.org/10.1046/j.1529-8817.2001.01136.x [ Links ]
Zhou, W., Tang, X., Qiao, X., Wang, Y., Wang, R. and Feng, L. (2009). Ingestion of Brachionus plicatilis under different microalgae conditions. Chinese Journal of Oceanology and Limnology, 27(3): 473-79. https://link.springer.com/content/pdf/10.1007%2Fs00343-009-9208-x.pdf [ Links ]
1Como citar este artículo: Contreras-Sillero, M. E., Pacheco-Vega J. M. * , Cadena-Roa, M. A., Contreras-Chavarría, J. A., Rangel-Dávalos, C., Valdez-González, F. J., González-Hermoso, J. P. (2019). Evaluation of growth and bromatological composition of the rotifer Brachionus plicatilis fed different native microalgae from the Gulf of California. Revista Bio Ciencias 6, e509. doi: https://doi.org/10.15741/revbio.06.e509
Recibido: 09 de Mayo de 2018; Aprobado: 10 de Diciembre de 2018











 texto em
texto em 



