Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista bio ciencias
versión On-line ISSN 2007-3380
Revista bio ciencias vol.6 Tepic ene. 2019 Epub 02-Oct-2020
https://doi.org/10.15741/revbio.06.e425
Artículos originales
Selenio y vanadio en la germinación y el crecimiento de plántulas de chile (Capsicum annuum L.) y rábano (Raphanus sativus L.)
1 CONACYT-Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco, Biotecnología Vegetal. Camino Arenero, Núm. 1227, Col. El Bajío, C.P. 45019. Zapopan, Jalisco. México.
2 Universidad del Papaloapan, Instituto de Biotecnología. Circuito Central, Núm. 200, Col. Parque Industrial, C.P. 68301. Tuxtepec, Oaxaca. México.
3 Universidad Politécnica de Sinaloa, Ingeniería en Biotecnología. Carretera Municipal Libre Mazatlán Higueras km 3, Col. Genaro Estrada C.P. 82199. Mazatlán, Sinaloa. México.
El objetivo de este trabajo fue evaluar el efecto del vanadio (V) y el selenio (Se), como selenito (Na2SeO3) y selenato (Na2SeO4), en la germinación y crecimiento inicial de chile serrano y rábano. Las semillas y las plántulas se incubaron bajo condiciones controladas de luz y temperatura. Las concentraciones evaluadas fueron 2.5, 5 y 10 μM de V; 1.25, 2.5 y 5 μM de Na2SeO3 y Na2SeO4; y agua destilada como control. En general, el Se incrementó el porcentaje de germinación de chile serrano, pero no tuvo efecto en rábano. De manera similar, el V no tuvo efecto en la germinación de ninguna de las dos especies. La adición de selenito incrementó la altura de las plántulas, duplicó la longitud y número de raíces, así como favoreció el peso seco de las plántulas de chile serrano. En rábano, el tratamiento con selenito aumentó la altura de las plántulas y la dosis más alta (5 μM) estimuló el crecimiento de las raíces. El selenato mejoró la longitud y número de raíces, y el peso seco de las plántulas de chile serrano; mientras que en rábano incrementó la altura de la plántula y en la dosis más baja (1.25 μM) aumentó el peso seco. El V tuvo un efecto similar al selenato, mejorando el crecimiento de la raíz de chile serrano y la parte aérea en rábano, obteniendo los mejores resultados en la altura y el peso seco de las plántulas con la dosis más baja evaluada (2.5 μM).
Palabras clave: selenito; selenato; vanadato de amonio; elementos benéficos
The aim of this work was to evaluate the effects of vanadium (V) and selenium (Se), as selenite (Na2SeO3) and selenate (Na2SeO4), on the germination and initial growth of pepper and radish. The seeds and seedlings were incubated under controlled conditions of light and temperature, and the concentrations evaluated were 2.5, 5 and 10 μM V, 1.25, 2.5 and 5 μM Na2SeO3 and Na2SeO4, and distilled water in the control. In general, Se increased the germination percentage of pepper, but it had no effect on radish germination. Similarly, V had no effect on germination in either of the two species at the concentrations evaluated in this work. The selenite addition enhanced the seedling height, doubled the length and number of roots, and increased the dry weight of the pepper seedlings. In radish, selenite enhanced the seedling height, and the highest dose (5 μM) stimulated root growth. Selenate only improved the length and number of roots and the dry weight of the pepper seedlings, whereas in radish it enhanced seedling height, and the lowest dose (1.25 μM) increased the dry weight. V had a similar effect to that of selenate, improving the growth of the pepper root and the aerial part of radish. The best results for seedling height and dry weight were obtained at the lowest dose evaluated (2.5 μM).
Keywords: selenite; selenate; ammonium vanadate; beneficial elements
Introducción
El selenio (Se) es un elemento esencial para los animales y humanos, debido a que una dieta suplementada con Se, particularmente compuestos orgánicos de Se, aumenta la defensa antioxidante, lo que puede reducir la susceptibilidad a enfermedades como el cáncer y otros trastornos relacionados con el estrés oxidativo (Yasin et al., 2015; Schiavon et al., 2016; Mimmo et al., 2017). Además, el Se actúa como cofactor de enzimas involucradas en muchas rutas bioquímicas en plantas y animales (Ahmad et al., 2016); siendo los alimentos a base de plantas una fuente importante de Se para los humanos. Por otro lado, el Se no es considerado un elemento esencial para las plantas, pero si un elemento benéfico, especialmente por inducir en dosis bajas tolerancia a diferentes factores ambientales que generan estrés oxidativo, entre los que destacan: tolerancia al arsénico en arroz (Chauhan et al., 2017; Singh et al., 2018), a cadmio y plomo en canola (Wu et al., 2016), a estrés salino en tomate (Mozafariyan et al., 2016) y déficit hídrico en maíz (Nawaz et al., 2016). El Se disminuye los efectos adversos del estrés oxidativo induciendo diferentes componentes del sistema antioxidante enzimático y no enzimático de las plantas, así como la actividad de GSHperoxidasas, incrementos en los niveles de ácido ascórbico, glutatión, tioles no proteicos y compuestos fenólicos (Srivastava et al., 2009; Chauhan et al., 2017; Singh et al., 2018). Recientemente, el Se es utilizado como fertilizante para aumentar su contenido en la parte comestible de las plantas, lo que también es conocido como biofortificación, en cultivos como zanahoria y lechuga (Smolen et al., 2016) maíz (Nawaz et al., 2016) y rábano (Schiavon et al., 2016), lo que implica la producción de cultivos con mayores beneficios para la salud. También se ha reportado que la aplicación de Se incrementa el rendimiento y calidad del grano de maíz (Nawaz et al., 2016), mejora los niveles de compuestos nutracéuticos (glucorafanina) en raíces de rábano (Schiavon et al., 2016) y en fresa incrementa el contenido de flavonoides y compuestos polifenólicos (Mimmo et al., 2017).
En el suelo, el Se existe en cuatro estados de oxidación: selenito (SeO3 2-, Se4+), selenato (SeO4 2-, Se6+), Se elemental (Se0) y seleniuro (Se2-) (Krystyna, 2002). Las plantas pueden absorber el Se en forma de SeO3 2- o SeO4 2-; estos son los compuestos inorgánicos más comunes presentes en la solución del suelo, el agua y en la mayoría de los alimentos (do Nascimento da Silva et al., 2017).
A diferencia del Se, el vanadio (V) ha sido menos estudiado en plantas, aunque también es considerado un elemento benéfico (Trejo-Téllez et al., 2016). Sin embargo, para otros organismos vivos como las algas verdes, se ha identificado al V como un micronutriente (Nalewajko et al., 1995). Este elemento forma parte de varias metaloenzimas como nitrogenasas (en Azotobacter chroococcum) y haloperoxidasas. En humanos, los complejos de V ejercen una gran variedad de actividades biológicas como insulinomiméticas, antitumorales y también actúan como inhibidores de enzimas (Habala et al., 2015).
El V en el suelo es generalmente poco móvil y tiene varios estados catiónicos, incluyendo V2+, V3+, V4+ y V5+, esta última forma se caracteriza por ser un oxidante fuerte (Matsugo et al., 2015). La forma predominante en el suelo es V4+, la cual es menos móvil y tóxica que la forma pentavalente (V5+) (Tian et al., 2015). En plantas se ha reportado que pequeñas cantidades de V estimulan la producción de biomasa, mientras que niveles altos de este elemento inhiben el crecimiento y causan cambios morfológicos en hojas y raíz de Ipomoea aquatica (Chen et al., 2016). De forma contraria, en albahaca (Ocimum basilicum) se encontró que el peso seco de la raíz incrementó al aumentar la dosis de V (Akoumianaki-Ioannidou et al., 2016). En pepino se ha observado que el V puede tener un efecto antagónico en la absorción de metales pesados tóxicos como plomo y cadmio, y un efecto sinérgico en la absorción de nutrientes esenciales para las plantas (Charles & Onyema, 2016).
Por otro lado, cultivos como el chile verde, que incluye jalapeño, pimiento morrón, poblano, serrano, chilaca entre otros, representan una de las hortalizas con mayor valor económico en México (SIAP, 2017). Además de su valor comercial como fruto, el chile es importante por su contenido de moléculas bioactivas como capsaicinoides, provitamina A, vitamina C y folato, las cuales tienen una influencia positiva en la salud humana (Guzmán & Bosland, 2017). En otros cultivos como el rábano (Raphanus sativus L.), la raíz es el principal órgano de consumo, aunque las hojas, semillas y flores también pueden ser consumidas; esta especie es rica en potasio, zinc, glucosinolatos, antioxidantes como vitaminas C y B, flavonoides y antocianinas (Schiavon et al., 2016).
Considerando los usos potenciales de los elementos benéficos en la producción agrícola, el objetivo de este trabajo fue evaluar el efecto del V y los dos estados de oxidación del Se (Na2SeO3 y Na2SeO4) más comúnmente absorbidos por las plantas, en la germinación y el crecimiento inicial de plántulas de chile serrano y rábano.
Material y métodos
Se usaron semillas comerciales de chile serrano (Capsicum annuum L. cv. Chiltepec) y rábano (Raphanus sativus L. cv. Champion), seleccionando las semillas homogéneas sin daños aparentes.
Establecimiento del experimento
Se utilizaron recipientes transparentes de polipropileno con tapa (500 mL), en la base del recipiente se colocó una capa de papel filtro, posteriormente se agregó 8 mL de cada tratamiento y se colocaron 20 semillas de chile serrano o rábano. Los tratamientos consistieron en 1.25, 2.5 y 5 μM de Se en forma de Na2SeO3 y Na2SeO4; 2.5, 5 y 10 μM V (NH4VO3) y el testigo fue agua destilada (0 μM). Las fuentes de Se y V fueron grado reactivo (Sigma-Aldrich; Saint Louis, MO, USA).
Los recipientes con las semillas se colocaron en un cuarto de cultivo a 25 ± 2°C , con un fotoperiodo de 16 h luz, 8 h oscuridad. La luz fue suministrada con lámparas fluorescentes de luz blanca (32 μmol s-1 m-2). Se establecieron dos experimentos independientes con tres repeticiones cada uno (n=6), cada repetición consistió de un recipiente con 20 semillas. Se empleó un diseño experimental completamente al azar con 10 tratamientos.
Variables evaluadas
Germinación
Para el caso del chile serrano, se monitoreó cada tercer día durante 17 días después del establecimiento del experimento; mientras que, para el rábano, se realizó un registro diario de la germinación, hasta seis días después de la aplicación de los tratamientos. En ambos casos, se consideró una semilla germinada cuando la radícula alcanzó 2 mm de longitud. Esta variable se expresó en porcentaje.
Crecimiento
Se determinó la altura de las plántulas y la longitud de la raíz con una regla graduada. El número de raíces se registró cuando se observaron diferencias entre tratamientos. El peso seco de las plántulas (en grupos de 4 plántulas/tratamiento) se obtuvo después del secado del tejido a 72 °C durante 48 h. Estas variables se determinaron 15 y 24 días después del inicio de los tratamientos en plántulas de rábano y chile serrano, respectivamente.
Resultados y discusión
Germinación
El Se, en forma de selenito (Na2SeO3) o de selenato (Na2SeO4), incrementó el porcentaje de germinación de chile serrano (Figura 1). El máximo porcentaje de germinación se encontró en el tratamiento con 2.5 μM de selenito o selenato (Figura 1D). Estos resultados difieren de los reportados por Frias et al. (2009) quienes encontraron que el selenito disminuye la tasa de germinación de Lupinus angustifolius, pero los mismos tratamientos (2, 4, 6 y 8 mg L-1) con selenato fueron estadísticamente igual al testigo (0 mg L-1). En contraste, en el presente estudio con la aplicación de dosis bajas de Se (menores a 1 mg L-1), no se obtuvieron diferencias entre las formas iónicas evaluadas; al contrario, se encontraron tasas de germinación superiores al testigo con 2.5 μM (≈ 0.4 mg L-1) de selenito o selenato. Por otro lado, la germinación fue similar entre el testigo y las diferentes concentraciones de V (Figuras 1C y 1D).

Figura 1 Porcentaje de germinación de semillas de chile serrano expuestas a diferentes concentraciones de Na2SeO3 (A, D), Na2SeO4 (B, D) y NH4VO3 (C, D). Los datos presentados en la subfigura D representan la comparación entre tratamientos del último día de registro de datos (día 17). Medias con letras diferentes indican diferencias significativas de acuerdo a la prueba de Duncan (p < 0.05), ± desviación estándar.
Las semillas de rábano fueron de rápida germinación, 24 h después del establecimiento del experimento, sin observarse diferencias entre los diferentes tratamientos evaluados con Se o V (Figura 2). Müller & Engelbrecht (2017) tampoco encontraron efectos significativos en la germinación de semillas de Medicago polymorpha y Trifolium subterraneum con la aplicación de diferentes concentraciones de selenato (0.25 a 4.0 mg L-1 ≈ 1.3 a 21 μM). De forma similar, la aplicación de vanadato (0.1 μM) no tuvo influencia en la germinación, crecimiento y metabolismo (azúcares, proteínas, pigmentos fotosintéticos, fotosíntesis y respiración) en centeno y trigo (Kasai et al., 1999). Cabe mencionar que la dosis empleada por estos investigadores es baja, comparada con las concentraciones empleadas en el presente trabajo (1.25, 2.5 y 5.0 μM).

Figura 2 Porcentaje de germinación de semillas de rábano expuestas a diferentes concentraciones de Na2SeO3 (A), Na2SeO4 (B) y NH4VO3 (C). Las diferencias estadísticas entre tratamientos no son significativas (p > 0.05).
Por el contrario, Ahmed (2010) encontró que la germinación de semillas de lechuga, tomate y rábano disminuye conforme incrementa la concentración de Se (10 a 200 mg L-1 Na2SeO4). Lo que indica que hay varios aspectos que deben ser considerados al momento de usar elementos benéficos como el Se y V en la agricultura. Entre ellos que, al no ser esenciales para las plantas, altas concentraciones pueden inhibir la germinación y el crecimiento; pero dosis bajas, como las usadas en este trabajo, pueden incrementar el porcentaje de semillas germinadas como en el chile serrano (Figuras 1A, 1B, 1C y 1D) o no tener ningún efecto en la germinación, como en el caso del rábano (Figuras 1C y 2).
Estos resultados resaltan otro aspecto importante, que el efecto de los elementos benéficos es dependiente de la especie. Por lo que es necesario determinar para cada especie la forma iónica del elemento benéfico y el intervalo de concentraciones adecuadas para potenciar las características deseadas en el cultivo.
Crecimiento de plántulas
El crecimiento de la parte aérea de las plantas de chile serrano fue estimulado diferencialmente dependiendo de la forma iónica del Se, siendo mayor cuando se aplicó en forma de selenito, con resultados similares en las tres dosis evaluadas. Mientras que las plántulas crecidas con selenato o vanadato tuvieron una altura similar al testigo (Figura 3A). La longitud de la raíz fue mayor en todos los tratamientos evaluados de Se y V, observándose casi el doble del crecimiento comparado con las plantas testigo (Figura 3B). Esta estimulación en el crecimiento de la raíz también ha sido reportada en Brassica oleracea, ya que bajas concentraciones de V (1 mg L-1 como VOSO4) favorecieron la elongación de la radícula, mientras que concentraciones superiores a 3 mg L-1 causaron síntomas severos de toxicidad e inhibición del crecimiento de la raíz (Kaplan et al., 1990). Adicionalmente, la aplicación de Se o V favoreció la formación de raíces, obteniéndose mayor número de raíces comparado con el testigo; aunque no se observaron diferencias entre las dos fuentes de Se y el V (Figura 3C). Estos resultados concuerdan con lo reportado por Vachirapatama et al. (2011), donde se observó mayor número de raíces laterales en plantas de B. campestris ssp. chinensis (mostaza verde china) crecidas con 20 y 40 mg L-1 de V. Este crecimiento de las raíces en las plántulas de chile serrano favorecerá su establecimiento en campo.

Figura 3 Altura de plántula (A), longitud de raíz (B), número de raíces (C) y peso seco (D) de plántulas de chile serrano después de 24 días del establecimiento del experimento. Medias con letras diferentes indican diferencias significativas de acuerdo a la prueba de Duncan (p < 0.05), ± desviación estándar.
La biomasa seca en las plántulas de chile tratadas con 1.25 μM de selenito incrementó 47 % y fue disminuyendo conforme aumentó la concentración hasta 5 μM, el cual es estadísticamente similar al testigo y al tratamiento con la misma concentración en forma de selenato (Figura 3D). De manera similar, en Oryza sativa L. ssp. japonica, la adición de dosis bajas de Se (2 y 6 mg L-1) en Na2SeO3 promueve el crecimiento e incrementa el contenido de pigmentos fotosintéticos, así como la expresión de proteínas relacionadas con el metabolismo primario y la fotosíntesis; indicando que el efecto benéfico del Se en el crecimiento puede ser atribuido a la regulación positiva en el metabolismo de carbohidratos y proteínas en la raíz y al incremento de la eficiencia fotosintética en la parte aérea (Wang et al., 2012). Los valores de peso seco de las plántulas tratadas con V fueron estadísticamente similares a los registrados en los tratamientos con selenato y a las dos concentraciones más bajas de selenito, pero superior al testigo, y se debe principalmente al desarrollo de las raíces. Nuestros resultados contrastan con lo reportado en B. campestris ssp. chinensis, debido a que no observaron cambios en el crecimiento de plantas expuestas a dosis bajas de V (1 y 10 mg L-1), mientras que dosis superiores a 20 mg L-1 (≈ 170 μM) disminuyen drásticamente el peso seco de hojas, tallo y raíz (Vachirapatama et al., 2011). En este estudio se encontró que concentraciones similares de V (10 μM ≈ 1.2 mg L-1) incrementaron 38 % el peso seco de las plántulas de chile serrano. Akoumianaki-ioannidou et al. (2015) reportaron que el V favorece la absorción de algunos elementos esenciales como el Fe, el cual está involucrado en la biosíntesis de clorofila y es constituyente de enzimas que participan en la cadena de transporte de electrones fotosintético, mejorando el crecimiento.
Aunque no se detectaron diferencias significativas en el porcentaje de germinación de semillas en rábano (Figura 2); si se encontraron efectos positivos en el crecimiento de las plántulas con la aplicación de elementos benéficos. La altura de las plántulas fue similar en los tratamientos con selenito, selenato o vanadato, pero en todos los casos fue superior al testigo (Figura 4A). Las plántulas más altas fueron las tratadas con 2.5 μM V, aunque los valores fueron estadísticamente similares al resto de los tratamientos con V, selenato y las concentraciones más altas de selenito. El crecimiento de la raíz principal sólo fue estimulado con la adición de 5 μM de selenito, comparado con el testigo (Figura 4B). No se observaron diferencias en el número de raíces entre tratamientos (datos no mostrados). Sólo las concentraciones más bajas evaluadas del Se en forma de selenato y el V favorecieron la acumulación de biomasa seca de plántulas, el resto de los tratamientos fueron similares al testigo (Figura 4C). Tanto el Se como el V mostraron la tendencia de reducir el peso seco conforme incrementa su concentración en la solución nutritiva. Resultados semejantes fueron reportados en B. campestris ssp. chinensis, donde altas concentraciones de V (1, 10, 20, 40 y 80 mg L-1) tuvieron un efecto negativo en la acumulación de biomasa seca, siendo menor que en el testigo (Vachirapatama et al., 2011). En este trabajo encontramos que concentraciones menores a 1 mg L-1 (1.25 μM ≈ 0.30 mg L-1) estimularon el crecimiento (en peso seco) de las plántulas de rábano, observándose una disminución en el peso seco con el incremento en la concentración de V hasta ser estadísticamente igual al testigo (Figura 4).
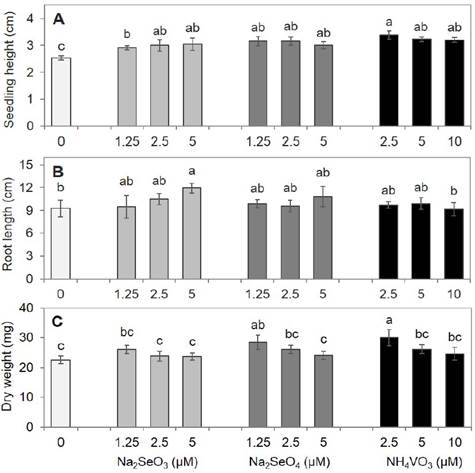
Figura 4 Altura de plántula (A), longitud de raíz (B) y peso seco (C) de plántulas de rábano después de 15 días del establecimiento del experimento. Medias con letras diferentes indican diferencias significativas de acuerdo a la prueba de Duncan (p < 0.05), ± desviación estándar.
En este trabajo se observaron efectos contrastantes del Se y V en la germinación y el crecimiento de las plantas de chile serrano y rábano. El Se incrementó la tasa de germinación en chile serrano, pero no tuvo efecto en rábano. En cambio, el V no tuvo influencia en la germinación de ninguna de las dos especies (Figuras 1 y 2). Un efecto similar se observó en las variables de crecimiento, donde él Se y V tuvieron mayor efecto en chile serrano, favoreciendo su crecimiento. Lo que indica que el efecto benéfico de estos elementos también está en función de la especie. Este efecto dependiente de la especie también ha sido reportado por Arscott & Goldman (2012) en brotes de brócoli, frijol mungo y cebolla con diferentes fechas de cosecha (cosecha 1: 3 d para brócoli y frijol mungo, 5 d para cebolla; y en la cosecha 2: 5 y 7 d, respectivamente) donde las semillas fueron tratadas con diferentes dosis de selenato (0, 127, 635, 1270 y 12700 μM), sin observar diferencias estadísticas en la primera fecha de cosecha, en las tres especies evaluadas. Mientras que, en la segunda fecha de cosecha, en el brócoli se observó una reducción del 45 % en su producción de biomasa con dosis de 635 a 12700 μM. En el frijol mungo no hubo diferencias estadísticas entre tratamientos y en cebolla sólo se encontró un efecto negativo con la concentración más alta (Arscott & Goldman, 2012). Por lo que, las diferencias anatómicas entre dicotiledóneas (brócoli y frijol mungo) y monocotiledóneas (cebolla) podrían influir en la capacidad de absorción y metabolismo del Se. De forma similar, el Se (como Na2SeO4) incrementó la altura de plántula y la acumulación de biomasa seca de M. polymorpha; mientras que las mismas concentraciones redujeron la altura y el peso seco de plántulas de T. subterraneum (Müller & Engelbrecht, 2017). Esta respuesta diferencial a la aplicación de Se y V entre especies indica que tienen diferentes habilidades para absorber y acumular estos elementos en sus tejidos, modificando su crecimiento y desarrollo.
Conclusión
El Se y V afectaron diferencialmente el proceso de germinación y crecimiento de plántulas de chile serrano y rábano. Mientras que el Se incrementó el porcentaje de germinación de chile serrano, el V no tuvo efecto en la geminación de ninguna de las dos especies. Aunque ambos elementos favorecieron el crecimiento de las plántulas de las dos especies evaluadas, se confirma que dosis bajas de Se o V tienen efectos positivos ya sea en germinación, crecimiento o en ambos procesos del ciclo de vida de las plantas. Sin embargo, en el caso del Se no se encontraron diferencias entre la aplicación de selenito (Na2SeO3) o selenato (Na2SeO4) en la germinación, pero si en el crecimiento inicial de plántulas de chile serrano y rábano. Por lo que, los efectos benéficos de estos elementos químicos pueden ser aprovechados en la agricultura, teniendo en cuenta que su uso está en función de la concentración, la fuente, el tipo de cultivo, la forma de aplicación, la duración y la etapa de crecimiento.
También es importante considerar que se requiere generar conocimiento sobre el efecto de estos elementos en otras etapas del cultivo, en la calidad de los frutos, así como su papel para contrarrestar el estrés en plantas y su efecto en la salud humana, como resultado de la biofortificación de cultivos.
References
Ahmed, H. Kh. (2010). Differences between some plants in selenium accumulation from supplementation soils with selenium. Agriculture and Biology Journal of North America, 1: 1050-1056. https://doi.org/10.5251/abjna.2010.1.5.1050.1056 [ Links ]
Ahmad, P., Allah, E. A., Hashem, A., Sarwat, M. and Gucel, S. (2016). Exogenous application of selenium mitigates cadmium toxicity in Brassica juncea L. (Czern & Cross) by up-regulating antioxidative system and secondary metabolites. Journal of Plant Growth Regulation, 35(4): 936-950. https://doi.org/10.1007/s00344-016-9592-3 [ Links ]
Akoumianaki-Ioannidou, A., Barouchas, P. E., Kiramariou, A., Ilia, E. and Moustakas, N. K. (2015). Effect of vanadium on dry matter and nutrient concentration in pennyroyal (Mentha pulegium L.). BulletinUASVM Horticulture, 72(2): 295-298. https://doi.org/10.15835/buasvmcn-hort:11348 [ Links ]
Akoumianaki-Ioannidou, A., Barouchas, P. E., Ilia, E., Kyramariou, A. and Moustakas, N. K. (2016). Effect of vanadium on dry matter and nutrient concentration in sweet basil (Ocimum basilicum L.). Australian Journal of Crop Science, 10: 199-206. https://www.researchgate.net/publication/301204639_Effect_of_vanadium_on_dry_matter_and_nutrient_concentration_in_sweet_basil_Ocimum_basilicum_L [ Links ]
Arscott, S. and Goldman, I. (2012). Biomass effects and selenium accumulation in sprouts of three vegetable species grown in selenium-enriched conditions. HortScience, 47(4): 497-502. https://doi.org/10.21273/HORTSCI.47.4.497 [ Links ]
Charles, I. O. and Onyema, M. O. (2016). Vanadium inhibition capacity on nutrients and heavy metal uptake by Cucumis sativus. Journal of American Science, 12(10): 63-66. https://doi.org/10.7537/marsjas121016.09 [ Links ]
Chauhan, R., Awasthi, S., Tripathi, P., Mishra, S., Dwivedi, S., Niranjan, A., Mallick, S., Tripathi, P., Pande, V. and Tripathi, R.D. (2017). Selenite modulates the level of phenolics and nutrient element to alleviate the toxicity of arsenite in rice (Oryza sativa L.). Ecotoxicology and Environmental Safety, 138: 47-55. https://doi.org/10.1016/j.ecoenv.2016.11.015 [ Links ]
Chen, T., Li, T. Q. and Yang, J. Y. (2016). Damage suffered by swamp morning glory (Ipomoea aquatica Forsk) exposed to vanadium (V). Environmental Toxicology and Chemistry, 35: 695-701. https://doi.org/10.1002/etc.3226 [ Links ]
do Nascimento da Silva, E., Aureli, F., D’Amato, M., Raggi, A., Cadore, S., and Cubadda, F. (2017). Selenium bioaccessibility and speciation in selenium-enriched lettuce: investigation of the selenocompounds liberated after in vitro simulated human digestion using two-dimensional HPLC-ICP-MS. Journal of Agricultural and Food Chemistry, 65: 3031−3038. https://doi.org/10.1021/acs.jafc.7b01188 [ Links ]
Frias, J., Piotr, G., Cristina, M. V., Radoslaw, P., Enrique, B., Begon, J., Krzysztof, G. and Concepcion, V. V. (2009). Influence of germination with different selenium solutions on nutritional value and cytotoxicity of lupin seeds. Journal of Agricultural and Food Chemistry, 57: 1319-1325. https://doi.org/10.1021/jf8028368 [ Links ]
Guzmán, I. and Bosland, P. W. (2017). Sensory properties of chile pepper heat and its importance to food quality and cultural preference. Appetite, 117: 186-190. https://doi.org/10.1016/j.appet.2017.06.026 [ Links ]
Habala, L., Bartel, C., Giester, G., Jakupec, M. A., Keppler, B. K., and Rompel, A. (2015). Complexes of N-hydroxyethyl-N-benzimidazolylmethylethylenediaminediacetic acid with group 12 metals and vanadium-synthesis, structure and bioactivity of the vanadium complex. Journal of Inorganic Biochemistry, 147: 147-152. https://doi.org/10.1016/j.jinorgbio.2015.04.004 [ Links ]
Kaplan, D. I., Sajwan, K. S., Adriano, D. C. and Gettier, S. (1990). Phytoavailability and toxicity of beryllium and vanadium. Water, Air, and Soil Pollution, 53: 203-212. https://doi.org/10.1007/BF00170737 [ Links ]
Kasai, M., Yamazaki, J., Kikuchi, M., Iwaya, M. and Sawada, S. (1999). Concentration of vanadium in soil water and its effect on growth and metabolism of rye and wheat plants. Communications in Soil Science and Plant Analysis, 30: 971-982, https://doi.org/10.1080/00103629909370261 [ Links ]
Krystyna, P. (2002). Determination of selenium species in environmental samples. Microchimica Acta, 140: 55-62. https://doi.org/10.1007/s00604-001-0899-8 [ Links ]
Matsugo, S., Kanamori, K., Sugiyama, H., Misu, H. and Takamura, T. (2015). Physiological roles of peroxido-vanadium complexes: Leitmotif as their signal transduction pathway. Journal of Inorganic Biochemistry, 147: 93-98. https://doi.org/10.1016/j.jinorgbio.2015.02.008 [ Links ]
Mimmo, T., Tiziani, R., Valentinuzzi, F., Lucini, L., Nicoletto, C., Sambo, P., Scampicchio, M., Pii, Y. and Cesco, S. (2017). Selenium biofortification in Fragaria × ananassa: implications on strawberry fruits quality, content of bioactive health beneficial compounds and metabolomic profile. Frontiers in Plant Science, 8: 1887. https://doi.org/10.3389/fpls.2017.01887 [ Links ]
Mozafariyan, M., Kamelmanesh, M. M. and Hawrylak-Nowak, B. (2016). Ameliorative effect of selenium on tomato plants grown under salinity stress, Archives of Agronomy and Soil Science, 62: 1368-1380. https://doi.org/10.1080/03650340.2016.1149816 [ Links ]
Müller, F. L. and Engelbrecht, W. L. (2017). Selenium addition affects early seedling growth of Medicago polymorpha and Trifolium subterraneum, but not seed germination: a preliminary study. South African Journal of Plant and Soil, 35: 1-3. https://doi.org/10.1080/02571862.2017.1324048 [ Links ]
Nalewajko, C., Lee, K. and Jack, T.R. (1995). Effects of vanadium on freshwater phytoplankton photosynthesis. Water, Air, and Soil Pollution, 81: 93-105. https://doi.org/10.1007/BF00477258 [ Links ]
Nawaz, F., Naeem, M., Ashraf, M. Y., Tahir, M. N., Zulfiqar, B., Salahuddin, M., Shabbir, R. N. and Aslam, M. (2016). Selenium supplementation affects physiological and biochemical processes to improve fodder yield and quality of maize (Zea mays L.) under water deficit conditions. Frontiers in Plant Science, 7: 1438. https://doi.org/10.3389/fpls.2016.01438 [ Links ]
Schiavon, M., Berto, C., Malagoli, M., Trentin, A., Sambo, P., Dall’Acqua, S. and Pilon-Smits, E. A. H. (2016). Selenium biofortification in radish enhances nutritional quality via accumulation of methyl-selenocysteine and promotion of transcripts and metabolites related to glucosinolates, phenolics, and amino acids. Frontiers in Plant Science, 7: 1371. https://doi.org/10.3389/fpls.2016.01371 [ Links ]
SIAP. (Servicio de Información Agroalimentaria y Pesquera). (2017). Atlas Agroalimentario 2017. Primera Edición 2017. https://www.gob.mx/siap/prensa/atlas-agroalimentario-2017 . [Last Ckecked December 01st 2017]. [ Links ]
Singh, R., Upadhyay, A. K. and Singh, D. P. (2018). Regulation of oxidative stress and mineral nutrient status by selenium in arsenic treated crop plant Oryza sativa. Ecotoxicology and Environmental Safety, 148: 105-113. https://doi.org/10.1016/j.ecoenv.2017.10.008 [ Links ]
Smolen, S., Skoczylas, L., Ledwozyw-Smolen, I., Rakoczy, R., Kopec, A., Piatkowska, E., Biezanowska-Kopec, R., Koronowicz, A. and Kapusta-Duch, J. (2016). Biofortification of carrot (Daucus carota L.) with iodine and selenium in a field experiment. Frontiers in Plant Science, 7: 730. https://doi.org/10.3389/fpls.2016.00730 [ Links ]
Srivastava, M., Ma, L. Q., Rathinasabapathi, B. and Srivastava, P. (2009). Effects of selenium on arsenic uptake in arsenic hyperaccumulator Pteris vittata L. Bioresource Technology, 100: 1115-1121. https://doi.org/10.1016/j.biortech.2008.08.026 [ Links ]
Tian, L. Y., Yang, J. Y. and Huang, J. H. (2015). Uptake and speciation of vanadium in the rhizosphere soils of rape (Brassica juncea L.). Environmental Science and Pollution Research, 22: 9215-23. https://doi.org/10.1007/s11356-014-4031-0 [ Links ]
Trejo-Téllez, L. I., Gómez-Merino, F.C. and Álcantar-González, E. (2016). Elementos benéficos: potencialidades y limitantes. In: Nutrición de Cultivos. Álcantar-González, E., Trejo-Téllez, L. I. and Gómez-Merino, F. C. ed. 59-101 pp. Texcoco, México. Colegio de Postgraduados. [ Links ]
Vachirapatama, N., Jirakiattikul, Y., Dicinoski, G., Townsend, A. T. and Haddad, P. R. (2011). Effect of vanadium on plant growth and its accumulation in plant tissues. Songklanakarin Journal of Science and Technology, 33: 255-261. http://rdo.psu.ac.th/sjstweb/journal/33-3/0125-3395-33-3-255-261.pdf [ Links ]
Wang, Y.D., Wang, X., Wong, Y.S. (2012). Proteomics analysis reveals multiple regulatory mechanisms in response to selenium in rice. Journal of Proteomics, 1849-1866. https://doi.org/10.1016/j.jprot.2011.12.030 [ Links ]
Wu, Z., Yin, X., Gary, B. S., Lin, Z., Liu, Y., Li, M. and Yuan, L. (2016). Indications of selenium protection against cadmium and lead toxicity in oilseed rape (Brassica napus L.). Frontiers in Plant Science, 7: 1875. https://doi.org/10.3389/fpls.2016.01875 [ Links ]
Yasin, M., El-Mehdawi, A. F., Pilon-Smits, E. A. H. and Faisal, M. (2015). Selenium-fortified wheat: potential of microbes for biofortification of selenium and other essential nutrients. International Journal of Phytoremediation, 17: 777-786. https://doi.org/10.1080/15226514.2014.987372 [ Links ]
Recibido: 20 de Diciembre de 2017; Aprobado: 18 de Abril de 2018











 texto en
texto en 



