Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista bio ciencias
versión On-line ISSN 2007-3380
Revista bio ciencias vol.6 Tepic ene. 2019 Epub 02-Oct-2020
https://doi.org/10.15741/revbio.06.e404
Artículos originales
Evaluación zootécnica de larvas de Penaeus vannamei alimentadas con microalgas endémicas y un probiótico del Golfo de California
1 Universidad Autónoma de Baja California Sur (UABCS), Unidad Pichilingue. Apartado Postal 19-B. C.P. 23080, La Paz, Baja California Sur, México.
2 Instituto Tecnológico de La Paz, Boulevard Forjadores de Baja California Sur No.4720 Apdo. Postal 43-B, C.P. 23080, La Paz, B.C.S., México.
3 Universidad Autónoma de Nayarit, Escuela Nacional de Ingeniería Pesquera, Bahía de Matanchén Km 12, Carretera a los Cocos, C.P. 63740, San Blas, Nayarit; México.
Se evaluaron tres cepas de microalgas marinas (Schizochytrium sp., Navicula sp. y Grammatophora sp.) y una mezcla de tres bacterias probióticas (Lactobacillus spp.) para alimentar larvas de camarón blanco (Penaeus vannamei). Estas especies fueron cultivadas al exterior sin control de temperatura y de luz. Chaetoceros muelleri se cultivó con técnicas estándar y se utilizó como control. Las larvas de Penaeus vanammei se cultivaron a densidades de 175 nauplios L-1 en unidades experimentales de 70 L. La concentración de microalgas se mantuvo entre 70,000 y 125,000 células mL-1 y el probiótico a 114 x 103 UFC mL-1. Las larvas de camarón se cultivaron en nauplios estadio V y se mantuvieron hasta Mysis I. Al final del experimento, se evaluó la composición bromatológica y su desempeño en larvas. Las mejores supervivencias se observaron en ensayos realizados con Chaetoceros muelleri como control (61.6 %), la mezcla de Grammatophora sp. y Schizochytrium sp. con probióticos (58.3 %) y la mezcla de Grammatophora sp. y Schizochytrium sp. (55.8 %). Se observó una mortalidad cercana al 100 % con alimentación monoalgal de Navicula sp. Estos resultados sugieren que Grammatophora sp. + Schizochytrium sp. cultivadas al exterior pueden ser empleadas para alimentar larvas de camarón.
Palabras clave: Penaeus vannamei; Lactobacillus; cultivo de larvas; composición bromatológica
Three marine microalgae strains (Schizochytrium sp., Navicula sp., and Grammatophora sp.) and a mix of three probiotic bacteria (Lactobacillus spp.) were evaluated to feed white-shrimp larvae (Penaeus vannamei). These species were cultured outdoors without temperature or light control. Chaetoceros muelleri was cultured with standard techniques and used as control. Penaeus vanammei larvae were cultured at densities of 175 nauplii L-1 in 70 L experimental units. Microalgae concentration was maintained between 70,000 and 125,000 cells mL-1 and probiotic at 114 x 103 UFC mL-1. Shrimp larvae were cultured in nauplius stage V and maintained up to Mysis I. The bromatological composition and its performance in larvae were assessed at the end of the experiment. The best survivals were observed in trials with the control Chaetoceros muelleri (61.6 %), the mixture of Grammatophora sp. and Schizochytrium sp. plus probiotics (58.3 %) and the mixture of Grammatophora sp. and Schizochytrium sp. (55.8 %). A mortality close to 100 % was observed with Navicula sp. monoalgal fed. These results suggest that Grammatophora sp. + Schizochytrium sp. cultured outdoors can be used to feed shrimp larvae.
Keywords: Penaeus vannamei; Lactobacillus; larvae culture; bromatological composition
Introducción
La utilización de microalgas en el alimento de larvas de camarón durante las primeras etapas de vida es una actividad frecuente en los criaderos de cultivo. Esto se debe a que, como alimento vivo, son una fuente de nutrientes de alta calidad por la variedad de aminoácidos y ácidos grasos esenciales que contienen, los cuales son parte fundamental para el desarrollo y crecimiento de los camarones (Pedroza-Islas, 2002). Para suministrarlas en los criaderos de camarón instalados en áreas tropicales y subtropicales, se siguen varias estrategias, que es posible incluirlas como una sola especie (monoalgal) o mediante la mezcla de varias especies. Desafortunadamente, estas estrategias de alimentación se ven limitadas por el número reducido de especies que se pueden incorporar a los cultivos de camarón, los cuales se mantienen a temperaturas de 26-31 °C, mientras que las especies de microalgas requieren condiciones controladas de temperatura en un rango de 22-26 °C, lo que conlleva a problemas de shock térmico. Adicionalmente, el uso de estas especies de origen desconocido en muchos de los casos provoca impactos ecológicos en estos ambientes y mayores gastos de producción, ya que en varias ocasiones son especies no nativas de la región (Gozlan, 2010).
En la actualidad, la acuacultura está obligada a cumplir con una serie de retos para lograr desarrollarse como una actividad económicamente redituable y sustentable. Dentro de estos retos destaca el lograr la producción de productos provenientes del cultivo sin la explotación de los recursos naturales tales como la tierra o el agua (Crab et al., 2012). En este sentido, existen algunas microalgas capaces de promover el crecimiento bacteriano en cultivos discontinuos, los cuales mejoran los productos de metabolitos beneficiosos para el desarrollo de las larvas de camarón. En los últimos años, este proceso ha generado un creciente interés por el uso de bacterias probióticas en los sistemas de cultivo del camarón (Leal et al., 2010).
Por otro lado, cuando las bacterias y microalgas se cultivan en conjunto, se hacen más digeribles por larvas y pequeños organismos marinos, y estimula su crecimiento y supervivencia. Las bacterias participan activamente en el proceso de digestión de las microalgas suministradas debido a la producción de enzimas externas al sistema digestivo de las larvas (Riquelme & Avendano-Herrera, 2003). De acuerdo con Natrah et al., (2013), las microalgas actúan como cápsulas que incorporan bacterias beneficiosas al sistema digestivo de las larvas. Además, contribuyen a la alimentación de las larvas con componentes nutricionales y compuestos que inhiben el crecimiento de microorganismos patógenos, ya sea mediante mecanismos de exclusión o competitivos o bien, mediante la producción de sustancias bactericidas. Otro de los beneficios de los cultivos mixtos de microalgas y bacterias es la promoción del crecimiento de las mismas microalgas en el medio de cultivo (De-Bashan & Bashan, 2010). Aunque cabe resaltar que, en este tipo de procesos, la fisiología del tracto digestivo de los camarones se puede ver modificada por la presencia de las microalgas y las bacterias.
Se ha evaluado la actividad enzimática digestiva, la movilización y el almacenamiento de energía de reserva para la determinación cualitativa y cuantitativa de proteínas, lípidos y carbohidratos (Arcos-Ortega et al., 2015). Sin embargo, la industria de la acuacultura debe hacer énfasis en investigaciones que identifiquen nuevas especies de microalgas y bacterias marinas que mantengan un rendimiento eficiente del cultivo con características que beneficien la calidad nutricional y en especial sobre los procesos digestivos y mejoramiento de la calidad del agua en los cultivos (Crab et al., 2012; Simões et al., 2002). Este tipo de investigaciones pueden impactar de manera positiva en los cultivos de camarón, en especial en la mejora en la etapa de crecimiento. En este sentido se ha visto que, para el cultivo del camarón, la relación bacterias-microalgas como BFT (biofloc) incorporadas al cultivo presenta un proceso dinámico debido a las variables ambientales que impactan en éste, desencadenando la generación de metabolitos que benefician el buen estado de los camarones (Jagadeesan et al., 2015; Natrah et al., 2013). Por ejemplo, las bacterias del género Bacillus pueden mejorar la digestibilidad de nutrientes en larvas de camarón (Aguirre-Guzmán et al., 2012; Ziaei-Nejad et al., 2006). El rango de temperaturas del medio en el que habitan las bacterias y microalgas es una variable que puede influir en la interacción microalgas-bacterias-camarones. Aunque no es posible generalizar el efecto de la temperatura sobre las especies mutualistas, sí es posible predecir si las cepas de bacterias y algas aisladas de ambientes similares mostrarán una interacción positiva, lo que permitirá generar sistemas de cultivo equilibrados y controlados, sobre todo en el control de la calidad del agua (Zhou et al., 2009).
Actualmente, el número de especies de microalgas utilizadas comúnmente en acuacultura es limitado. Si se diversifica la variedad de microalgas a utilizar en esta actividad, se podrán fortalecer las áreas de producción de alimento vivo, generar mejoras en la calidad nutricional y disminuir afectaciones biológicas de los propios sistemas de cultivo (Crab et al., 2012). Con la inclusión de nuevas especies de microalgas se espera la optimización de sistemas intensivos de cultivo, la promoción de prácticas sustentables, tanto en el desarrollo de los camarones como en la calidad del agua de los cultivos, lo cual permitirá la disminución de los costos de producción.
En este trabajo se evaluó el efecto de incluir cuatro nuevas cepas de microalgas y bacterias probióticas en dietas de camarón cultivado en un ambiente subtropical (Bahía de La Paz, B.C.S.; México). Varias dietas de camarón fueron analizadas con distintos métodos de inclusión: monoalgal, microalgas mixtas y microalgas mezcladas con bacterias probióticas de cepas de laboratorio (obtenidas del tracto digestivo de P. vannamei adulto), con un contenido de Lactobacillus sp. (claves:TD23, TD219 y R42C). Con el propósito de evaluar la capacidad de las larvas de camarón para digerir los compuestos nutricionales contenidos en las microalgas, se evaluaron los cambios en la composición proximal de P. vannamei con distintas estrategias de alimentación con microalgas y la adición de bacterias probióticas.
Material y Métodos
Cultivo de microalgas y bacterias probióticas
Las microalgas evaluadas en este estudio fueron recolectadas en la Bahía de La Paz, Baja California Sur, México. Las microalgas fueron aisladas y preservadas en el depósito de cepas de la Universidad Autónoma de Baja California Sur (UABCS). Los medios de cultivo fueron enriquecidos en medios de cultivo F/2 (Guillard, 1975). El cultivo de las cepas se mantuvo en tubos de ensaye y matraces en condiciones controladas e inoculando en volúmenes progresivos. Los cultivos en matraz (≥ 1 L), garrafones y tanques de policarbonato cilíndricos y translúcidos (300 L) se mantuvieron al aire libre sin luz artificial ni control de temperatura. Los tanques 300 L se mantuvieron en cultivos semicontinuos (30 % del volumen se cosechó diariamente y se completó el nivel de los tanques con agua de mar enriquecida y esterilizada). El rendimiento obtenido de cultivo se utilizó para alimentar a las larvas de camarón. Los tratamientos experimentales se compararon con Chaetoceros muelleri, utilizado como control de alimentación; éste se mantuvo a una temperatura de 21 ± 1˚C con luz continua (2,500 lux) con lámparas de luz de día y aireación constante.
Las cepas de bacterias evaluadas fueron proporcionadas por el depósito de Ciencia y Tecnología de Alimentos (BCSSU) de la UABCS. Las cepas presentaron características de morfología bacilar y no esporulante, catalasa-negativa y gram-positiva. Las bacterias probióticas se reactivaron y cultivaron en caldo MRS con una temperatura de 34 °C. Los cultivos se realizaron en un volumen de 1 L y se centrifugaron a 3,500 rpm durante 30 min; se descartó el sobrenadante y se recuperaron las bacterias para ser resuspendidas en 500 mL de agua de mar esterilizada. Después de preparar el medio, eran añadidas a los tanques de cultivo (80 mL a cada tanque con una densidad de 1x 108 UFC mL L-1).
Condiciones experimentales para Penaeus vannamei
Se utilizaron nauplios de Penaeus vannamei (estadios 4-5) proporcionados por el criadero Granjas Marinas de Sinaloa, S. A. de C. V. GRANMAR, localizado en Baja California Sur, México. Los nauplios se mantuvieron en un garrafón de polietileno de 15 L con una corriente de aire constante y se acondicionaron a un rango de temperatura de 27-28 °C durante 3 h. Después de mezclar manualmente el contenido del tanque, se realizó un conteo volumétrico de las larvas para estimar en número de nauplios mL-1 considerando 10 muestreos de 10 mL cada una. Después del conteo, los nauplios se distribuyeron en las unidades experimentales instaladas.
Tabla 1 Tratamientos y descripción de dietas para larvas de P. vannamei en condiciones de cultivo.
| Trial | Description |
|---|---|
| A. | Chaetocerosmuelleri (control) |
| B. | Grammatophora sp. (LPU-7) |
| C. | Schizochytrium sp. (LPU-1) |
| D. | Navicula sp. (LPU-6) |
| E. | Grammatophora sp.+ Schizochytrium sp. |
| F. | Grammatophora sp.+Schizochytrium sp.+Probiotic |
| G. | Navicula sp.+ Schizochytrium sp. |
| H. | Navicula sp.+ Schizochytrium sp.+ Probiotic |
El experimento se realizó en un área de cultivo aislada en la cual se mantuvo la temperatura a 30 ± 1 °C, utilizando calentadores ambientales eléctricos. El sistema de cultivo consistió en 24 unidades de tanques de fibra de vidrio de fondo plano con una capacidad de 120 L c/u, colocados en un arreglo de 2 hileras. Todas las unidades experimentales eran suministradas con agua de mar filtrada (1 μm), además se añadió una solución de hipoclorito de sodio comercial a 35 ppt. La solución se neutralizó después de 24 horas con tiosulfato de sodio. La aeración fue continua mediante difusores de acuario. El fotoperiodo fue de 12-12 horas y sin recambios de agua. Se realizaron siete ensayos con un control de acuerdo con la siguiente descripción:
Todos los tratamientos se realizaron por triplicado (24 tanques). El cultivo se comenzó a partir del estadio Zoea I hasta Mysis I. Las larvas de camarón se distribuyeron en cada uno de los tratamientos a una densidad de 170 Nauplios L-1 (11,900 organismos por tanque experimental). Todas las unidades experimentales se cubrieron con una lámina de polietileno para evitar la contaminación entre cada uno de los tratamientos. Diariamente se registró la temperatura, el pH, el oxígeno disuelto y la salinidad con el equipo Hanna HI9828.
El régimen de alimentación consistió en la adición de microalgas y dietas mixtas de microalgas y probióticos (ensayos de alimentación de A-H). Las microalgas presentaron una densidad celular de 80,000 a 120,000 células mL-1 en los cultivos larvales, además se añadieron tres cepas de bacterias probióticas a proporciones iguales (1:1:1) y se sembraron a una densidad final de 114x103 UFC mL-1. Para la evaluación del efecto de las dietas en los parámetros zootécnicos de larvas de Penaeus vannamei, se llevó a cabo un seguimiento de la supervivencia y el tamaño de etapas de Zoea I a Mysis I. Considerando todas las unidades experimentales, la supervivencia de los organismos se estimó con base en el porcentaje de organismos vivos registrados en cada etapa; el tamaño se determinó con base en la longitud de 50 organismos al inicio del experimento y 20 al final. La identificación de cada una de las primeras etapas del desarrollo de P. vannamei se realizó con base en las características morfológicas (Kitani, 1986). La longitud total se midió con un estereoscopio con un micrómetro manual (Reichert).
Para evaluar el efecto sobre la composición de la larva, se colectó una muestra de éstas en estadio Zoea I mediante el uso de un tamiz de 30 μm de luz de malla al iniciar el experimento, el resto de las larvas se recolectó al finalizarlo. Las larvas se lavaron con agua destilada y se colocaron en tubos Falcon con 55 mL de capacidad, se liofilizaron y almacenaron a -40 °C hasta la realización de los análisis bromatológicos, los cuales consistieron en cenizas, proteínas (Bradford, 1976), carbohidratos totales (Whyte, 1987) y lípidos totales (Bligh & Dyer, 1959) éste último también se realizó en las microalgas.
Para determinar la presencia de probióticos de Lactobacillus sp. en los tanques experimentales, se tomaron muestras de 2 mL de muestra. La muestra se diseminó (20 μL) en cajas Pretri preparadas con un medio de cultivo MRS, posteriormente se incubaron durante 24 h a una temperatura constante de 34 °C. Después de la incubación se realizó el recuento de colonias. Las muestras se recolectaron al iniciar y al finalizar el experimento.
Análisis estadístico
Se realizaron pruebas de normalidad y homogeneidad de la varianza de los datos previo a la realización de los análisis estadísticos. El porcentaje de supervivencia, el contenido de proteínas, lípidos y carbohidratos para microalgas y larvas, se transformaron en arco seno; posteriormente se realizó un análisis de varianza de una vía para cada caso. Para la evaluación de las dietas sobre el crecimiento de Zoea I y Mysis I se realizó un análisis de varianza de una vía para todos los ensayos. Para los casos donde se encontraron diferencias estadísticas significativas se realizó el análisis de la prueba a posteriori de Tukey. Para los análisis estadísticos se utilizó el software STATISTICA 7.0 para Windows (Statsoft, USA; α=0.05).
Resultados y Discusión
Desarrollo de P. vannamei en cultivo
La densidad celular de las microalgas varió entre las cepas. Los cultivos no axénicos se mantuvieron en condiciones semi-continuas a partir del día 4 de cultivo (Figura 1). Se observaron fases de retraso en todas las curvas, este comportamiento se hace evidente en las diferentes tasas de crecimiento de cada especie de microalgas al ser comparadas con el experimento control (C. muelleri), el cual se encontraba en condiciones de luz y temperatura definidas. Se observó que a partir del día, 4 la densidad celular fue afectada en el 30 % de los cultivos, donde se encontraron las concentraciones más altas fue en C. muelleri. El potencial de crecimiento y concentración de biomasa en Grammatophora sp., Schizochytrium sp. y Navicula sp., se observó en los cultivos semicontinuos. La concentración máxima se detectó hasta el día 9 en el experimento control, el cultivo masivo al exterior de microalgas ofrece la ventaja de generar un alimento vivo a bajo costo. De manera adicional, el uso de microalgas endémicas en la producción de larvas de camarón disminuye los riesgos ambientales que ocurren si se introducen especies ajenas a la región donde se localizó el cultivo. En este sentido, el uso de este tipo de investigaciones permite reforzar varios de los retos propuestos en la actualidad para generar una acuacultura económicamente sustentable; ya que por un lado se lleva a cabo una integración de los sistemas de cultivo ya existentes (microalgas y larvas de camarón), y por el otro, presenta una alternativa de alimentación con calidad nutricional rica en lípidos (Crab et al., 2012).
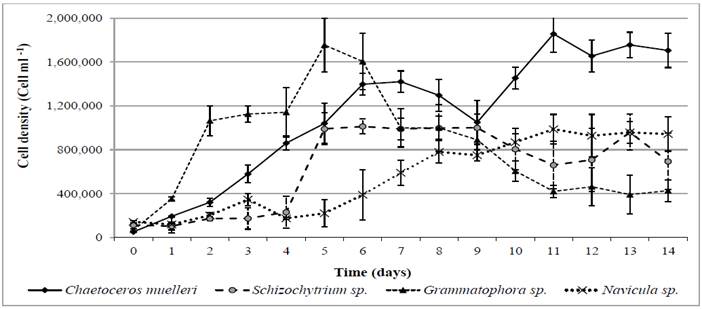
Figura 1 Incremento de densidad celular en cultivos masivos de cuatro especies de microalgas bajo condiciones semicontroladas (Chaetoceros muelleri) y cultivadas al exterior (Grammatophora sp., Schizochytrium sp. y Navicula sp.).
En cuanto a los valores de supervivencia obtenidos en las etapas de Nauplio a Mysis I alimentadas con distintas especies de microalgas (A, B, E y F), probióticos y algas mixtas, éstos mostraron diferencias significativas (p<0.05) entre los tratamientos. Los tratamientos en los que se observó mayor supervivencia fueron los tratamientos donde las larvas se mantuvieron con la mezcla de microalgas de Grammatophora sp. + Schizochytrium sp. (Gr + Sk), Grammatophora sp. + Schizochytrium sp. + Probiótico (Gr + Sk + Prob) y Chaetoceros muelleri (control). El tratamiento donde se alimentaron las larvas con Navicula sp. presentó una mortalidad cercana del 100 % (Figura 2). En publicaciones anteriores, se ha reportado una buena composición bromatológica al alimentar a los organismos con dietas que incluyen estas microalgas (Navicula sp.), inclusive se ha considerado para la formulación de gránulos para alimentar peces como la especie Spaurus aurata (Reyes-Becerril et al., 2013; Pacheco-Vega et al., 2015a). La composición bromatológica de Navicula sp. La reportó Curbelo et al. (2004) y debido a su buena composición, propusieron un alimento vivo para larvas de camarón que incluía una combinación de esta cepa con Artemia salina. En este trabajo las células de Navicula sp. se depositaron en el fondo formando una película que dificultó su consumo por las larvas, esto debido a que los camarones tienen un comportamiento planctónico en sus primeros estadios no se alimentan de microalgas sedimentadas. En este trabajo las larvas del tratamiento que contenía Navícula sp. no fueron consumidas por la razón antes mencionada.

Figura 2 Supervivencia larval de Zoea I de Penaeus vannamei alimentadas con Chaetoceros muelleri (A), Grammatophora sp. (B), Grammatophora sp.+ Schizochytrium sp. (C), Grammatophora sp.+ Schizochytrium sp. + probiotico (D), Navicula sp. (E), Schizochytrium sp. (F), Navicula sp. + Schizochytrium sp. (G), Navicula sp. + Schizochytrium sp. + probiotico (H).
El tamaño de las larvas mostró diferencias entre los tratamientos, en el tratamiento control fue donde se alcanzó la mayor talla (3.0 mm) y presentó una diferencia significativa (p<0.05) comparada con el resto de los tratamientos (Figura 3). Cabe señalar que tanto el tratamiento control como los que incluyen el tratamiento con Grammatophora sp., Grammatophora sp. + Schizochytrium sp., y Grammatophora sp. + probióticos, alcanzó la etapa de Mysis I en el día 9, mientras que los tratamientos con Schizochytrium sp., en combinación con Navicula sp. y con los probióticos, se alcanzó la misma etapa hasta el día 11. Con base en este resultado, es posible que los tamaños alcanzados hayan tenido influencia de los factores tales como la calidad del agua y las características intrínsecas de los géneros y especies de cepas de las algas seleccionadas.

Figura 3 Tallas de Penaeus vannamei en estadio larval Misis I alimentadas con Chaetoceros muelleri (A), Grammatophora sp. (B), Grammatophora sp.+ Schizochytrium sp. (C), Grammatophora sp.+ Schizochytrium sp.+ Probiótico (D), Navicula sp. (E), Schizochytrium sp. (F), Navicula sp. + Schizochytrium sp. (G), Navicula sp. + Schizochytrium sp. + Probiótico (H).
En los últimos años se ha reportado que además de los componentes bromatológicos, se conocen alrededor de 10,000 metabolitos secundarios (Fusetani, 2000) que son específicas de un taxón (géneros y especies) de microalgas y pueden influir en los organismos alimentados con estos (Roy & Pal, 2015; Van Durme et al., 2013). Cabe resaltar que los tratamientos en combinación de Grammatophora sp. y Schizochytrium sp. utilizados para alimentar las larvas de P. vannamei, presentaron alta supervivencia. Las dietas que contienen dos especies de microalgas tienen mejor resultado en la supervivencia, esto se refleja subsecuentemente en beneficios en la supervivencia de las larvas debido al suministro de diversas microalgas con diferente valor nutrimental, en contraste a los resultados observados en dietas con una sola microalga (Jamali et al., 2015). Por otro lado, se observó que es factible el cultivo al exterior de las especies de microalgas estudiadas en este trabajo, sin importar la temperatura o el control de la luz. En este sentido, la calidad del agua se mantuvo homogénea entre todos los tratamientos y en rangos aceptables para las condiciones de cultivo (Boyd & Tucker, 1998). La supervivencia, el crecimiento y el tiempo transcurrido para la metamorfosis en las larvas, se atribuyen a la composición bioquímica de las microalgas, dado que los nutrientes de las células pueden variar (proteínas, lípidos y carbohidratos).
Composición bromatológica en larvas de camarón
Las características físicas de la membrana de las microalgas están directamente relacionadas con la actividad de los carbohidratos altamente digestivos. Específicamente los tratamientos en los que se encontraba Schizochytrium sp., ya que presentan paredes celulares flexibles y digeribles con un alto contenido de polisacáridos (Darley et al., 1973). En este trabajo las características físicas y químicas de los alimentos (microalgas) presentaron un efecto directo sobre la digestión y absorción de nutrientes por las larvas de camarón (Tabla 2).
Tabla 2 Composición bromatológica (cenizas, proteínas, carbohidratos y lípidos) presentes en larvas de Penaeus vannamei alimentadas con diferentes especies de microalgas. Se incluyen los valores promedio y desviación estándar.
| Treatment (diet) | Proteins (%) | Lipids (%) | Carbohydrates (%) | Ashes(%) |
|---|---|---|---|---|
| A | 55.97 ± 1.81 | 20.45 ± 2.13 | 3.12 ± 0.92 | 19.33 ± 2.96 |
| B | 66.90 ± 4.24 | 16.17 ± 3.41 | 1.76 ± 0.04 | 17.67 ± 3.34 |
| C | 55.78 ± 4.36 | 15.73 ± 1.71 | 4.56± 0.96 | 20.09 ± 20.09 |
| D | 58.17 ± 1.42 | 17.05 ± 1.82 | 2.91 ± 0.25 | 17.34 ± 1.33 |
| E | - | 19.24 ± 0.84 | - | - |
| F | 63.26 ± 6.26 | - | 4.57 ± 0.64 | 17.02 ± 0.51 |
| G | 55.74 ± 2.88 | 12.51 ± 2.21 | 3.68 ± 0.23 | 18.82 ± 1.66 |
| H | 57.65 ± 2.42 | 21.00 ± 3.64 | 6.56 ± 0.77 | 19.09 ± 1.28 |
Donde: Chaetoceros muelleri (A), Grammatophora sp. (B), Grammatophora sp.+ Schizochytrium sp. (C), Grammatophora sp.+ Schizochytrium sp. + Probiótico (D), Navicula sp. (E), Schizochytrium sp. (F), Navicula sp. + Schizochytrium sp. (G), Navicula sp. + Schizochytrium sp. + Probiótico (H).
El porcentaje de proteína total en el estadio Zoea I se reportó en un rango de 55.7-66.9 %, en donde los valores más bajos se presentaron en las dietas con Navicula sp. + Schizochytrium sp. + Probiótico; el contenido más alto fue en Grammatophora sp.
Los requerimientos de proteína para el desarrollo del camarón son de gran importancia en términos de nutrición. En este experimento, se detectó un alto contenido de proteína cruda en los análisis bromatológicos en microalgas. Estos resultados indican una combinación favorable, ya que es posible que no sólo sea un alto contenido proteico, sino que además ésta sea fácil de digerir por las larvas de P. vannamei. Adicionalmente, Pacheco-Vega et al., (2015a) mencionan que estas especies de microalgas presentan concentraciones bajas de proteínas; si se pretende analizar el contenido proteico por sí solo, este valor no es relevante, pero al combinar las distintas fuentes de proteína (ya sean de origen vegetal o animal) o por la presencia de bacterias (Ziaei-Nejad et al., 2006), se sustenta el contenido de proteína cruda. Existen otros factores que influyen el proceso de digestión de los alimentos en las larvas, por un lado, los factores exógenos, como son la temperatura, el tránsito de los alimentos, el pH de las larvas y oxígeno disuelto, y por otro los factores endógenos, tales como el tamaño de la larva y la ubicación de los órganos digestivos, los cuales complementan la información para realizar un análisis exhaustivo del aprovechamiento del alimento en las larvas (McGaw & Curtis, 2013). Por ejemplo, al conocer los factores endógenos, nos permitirá conocer el desarrollo del tracto digestivo de la larva de camarón hasta convertirse en un camarón adulto. Sainz-Hernández & Córdoba, (2009) mencionan que los hábitos alimenticios de los camarones en estado larvario se basan en el consumo de microalgas, al llegar a su estadio juvenil estos hábitos se modifican, ya que empiezan a desarrollar enzimas digestivas como tripsina y quimotripsina (enzimas proteolíticas), lo cual se debe al consumo de animales pequeños, con lo cual se incrementa su consumo de proteína en la dieta.
En el caso de los parámetros de la calidad de agua (oxígeno disuelto, temperatura y salinidad), estos se mantuvieron dentro del rango óptimo para el cultivo de camarón, por lo que no se tuvo afectación de estas variables en los resultados aquí obtenidos. Es deseable que se conserve la calidad de agua para el desarrollo de una acuacultura sustentable en donde se pretende evitar la afectación del medio ambiente (Crab et al., 2012).
El contenido total de lípidos observado en los resultados es menor en larvas alimentadas con Navicula sp. + Schizochytrium sp. Las concentraciones más altas fueron en la dieta control con C. muelleri y en el trabamiento con Navicula sp. + Schizochytrium sp. + el probiótico. De acuerdo con Pacheco-Vega et al. (2015b), las diatomeas Grammatophora sp., proporcionan una serie de ácidos grasos poliinsaturados, los cuales pueden favorecer la digestibilidad de los lípidos.
El contenido de carbohidratos se presentó en un rango de 1.76 a 6.75 %. El valor más bajo se obtuvo en el estadio de Mysis I con el tratamiento de Grammatophora sp. y el porcentaje más alto en larvas alimentadas con Schizochytrium sp. Los resultados obtenidos describen que esta especie de microalga contiene un alto contenido de carbohidratos, sin embargo, no se presentó evidencia que éstos hayan podido ser digeridos por las larvas de P. vannamei. Lo anterior es atribuible a los camarones, como ya se ha comentado en el párrafo anterior, que presentan una adaptación enzimática de la etapa tardía Zoea, provocada por el cambio de hábitos alimenticios (Sainz-Hernández & Cordova, 2009) y aunque no se tenga evidencia de que los carbohidratos representan una necesidad alimentaria básica para los camarones (Jamali et al., 2015), es posible que el contenido de carbohidratos en larvas haya variado por la presencia de las microalgas, ya que estas contienen carbohidratos en las membranas celulares (Sørensen et al., 2016).
El aporte nutricional suministrado por las microalgas y la presencia de bacterias probióticas en los cultivos de larva de camarón mejoran la actividad de los carbohidratos, ya que, al momento de romper las membranas celulares de las microalgas, quedan disponibles sus componentes en calidad de sustratos, lo que permite llevar a cabo la digestión de proteínas y lípidos intracelulares. En este estudio, es posible que, al igual que para lípidos, haya sido posible la digestión de carbohidratos por la estimulación de bacterias probióticas presentes en el ambiente del cultivo. Hay que recordar, que estas bacterias son del género Bacillus, las cuales contribuyen con enzimas exógenas para mejorar la digestión de los nutrientes (Ziaei-Nejad et al., 2006). Conforme se desarrolla el tracto digestivo de los camarones desde larvas hasta juveniles, los camarones son capaces de procesar alimentos con un mayor contenido de proteína, es posible que el alimento mixto (microalgas y/o bacterias probióticas ácido lácticas) promuevan la digestión de los nutrientes en la dieta. En este trabajo el alimento mixto de especies nativas balanceó el rendimiento del crecimiento y redujo los costos de producción, al compararlo con C. muelleri, especie no nativa de la región.
Conclusión
Los resultados de este trabajo sugieren que el cultivo al exterior de larvas del camarón P. vannamei alimentadas con alimento mixto de Grammatophora sp. y Schizochytrium sp., nativas del Golfo de California, y la mezcla de bacterias probióticas del género Lactobacillus spp. (Clave: TD23, TD219 y R42C) aisladas del tracto digestivo de P. vannamei adulto, presentan un alto potencial de cultivo de las larvas. La combinación de estos alimentos mixtos estimula a las enzimas digestivas de los camarones, lo cual permite un aprovechamiento óptimo de los alimentos. Adicionalmente, el utilizar especies nativas es amigable con el ambiente.
Referencias
Aguirre-Guzmán, G., Lara-Flores, M., Sánchez-Martínez, J. G., Campa-Córdova, AI. and Luna-González, A. (2012). The use of probiotics in aquatic organisms: A review. African Journal of microbiology research, 6(23): 4845-4857. http://www.academicjournals.org/app/webroot/article/article1380730221_Aguirre-Guzman%20et%20al.pdf [ Links ]
Arcos Ortega, F., Sánchez León-Hng, S.J., Rodríguez Jaramillo, C., Burgos Aveces, M. A., Giffard Mena, I. and García Esequiel, Z. (2015). Biochemical and histochemical changes associated with gonad development of the Cortez Geoduck, Panopea globosa (Dall 1898), from the Gulf of California, Mexico. J. of Shellfish Research, 34(1):71-80. [ Links ]
Bradford, M.M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1-2): 248-254. https://doi.org/10.1016/0003-2697(76)90527-3 [ Links ]
Bligh, E. G. & Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Canadian journal of biochemistry and physiology, 37: 911-917. https://doi.org/10.1139/y59-099 [ Links ]
Boyd, C. E. & Tucker, C. S. (1998). Pond Aquaculture Water Quality Management. Kluwer Academic Publishers, USA. [ Links ]
Curbelo, R., Leal, S., Núñez, N., Quintana, P., Benguela, I., Muñóz, D. and Almaguer, Y. (2004). Cultivo de la microalga bentónica Navicula sp. para la alimentación de las primeras postlarvas de camarón blanco. Revista de Investigaciones Marinas, 25(2):143-150. https://biblat.unam.mx/es/revista/revista-de-investigaciones-marinas/articulo/cultivo-de-la-microalga-bentonica-Navicula-sp-para-la-alimentacion-de-las-primeras-postlarvas-de-camaron-blanco [ Links ]
Crab, R., Defoirdt, T., Bossier, P. and Verstraet, W. (2012). Biofloc technology in aquaculture: beneficial effects and future challenges. Aquaculture (356-357): 351-356. https://doi.org/10.1016/j.aquaculture.2012.04.046 [ Links ]
Darley, W.M., Porter, D. and Fuller, M. S. (1973). Cell wall composition and synthesis via Golgi-directed scale formation in the marine eucaryote, Schizochytrium aggregatum, with a note on Thraustochytrium sp. Archiv für Mikrobiologie, 90(2): 89-106. https://doi.org/10.1007/BF00414512 [ Links ]
De-Bashan, L. E, & Bashan, Y. (2010). Immobilized microalgae for removing pollutants: review of practical aspects. Bioresource Technol, 101(6): 1611-1627. https://doi.org/10.1016/j.biortech.2009.09.043 [ Links ]
Fusetani, N. (2000). Drugs from the sea. Karger, Basel, Japon. [ Links ]
Gozlan, R. E. (2010). The cost of non-native aquatic species introductions in Spain: fact or fiction? Aquatic Invasions, 5(3): 231-238. https://doi.org/10.3391/ai.2010.5.3.02 [ Links ]
Guillard, R. (1975). Culture of phytoplankton for feeding marine invertebrates. In: Culture of marine invertebrate animals. 29-66 pp. [ Links ]
Humason, G. L. (1979). Animal Tissue Techniques. Fourth edition. San Francisco, USA. W.H. Freeman and Company. [ Links ]
Jagadeesan, K., Kannan, D. and Shettun, N. (2015). Influence of diatom with different densities on survival rate of pre and post larval stages of Litopenaeus vannamei. Revista Internacional de Investigación en Ciencias del Mar, 4(2): 15-19. [ Links ]
Jamali, H., Ahmadifard, N. and Abdollahi, D. (2015). Evaluation of growth, survival and body composition of larval white shrimp (Litopenaeus vannamei) fed the combination of three types of algae. International Aquatic Research, 7(2): 115-122. https://doi.org/10.1007/s40071-015-0095-9 [ Links ]
Leal, S., Miranda, A., Curbelo, R. and Hernández, J. (2010). Las diatomeas bentónicas como fuente de alimento en el cultivo larvario de camarón y otros organismos acuáticos. En: CruzSuarez, L.E., Ricque-Marie, D., Tapia-Salazar, M., Nieto-López, M.G., Villarreal-Cavazos, D. A., Gamboa-Delgado, J. (Eds), Avances en Nutrición Acuícola X - Memorias del X Simposio Internacional de Nutrición Acuícola, 8-10 de Noviembre, San Nicolás de los Garza, N. L., México. ISBN 978-607- 433-546-0. Universidad Autónoma de Nuevo León, Monterrey, México, pp. 598-619. [ Links ]
Kitani, H. (1986). Larval development of the white shrimp Penaeus vannamei Boone reared in the laboratory and the statistical observation of its naupliar stages. Bulletin of the Japanese Society for the Science of Fish, 52:1131-1139. [ Links ]
McGaw, I. J. & Curtis, D. L. (2013). A review of gastric processing in decapod crustaceans. Journal of Comparative Physiology B, 183(4): 443-465. https://doi.org/10.1007/s00360-012-0730-3 [ Links ]
Natrah, F. M., Bossier, P., Sorgeloos, P., Yusoff, F. M. and Defoirdt, T. (2013). Significance of microalgal-bacterial interactions for aquaculture. Reviews in Aquaculture, 6(1): 48-61. https://doi.org/10.1111/raq.12024 [ Links ]
Pacheco-Vega, J. M., Cadena-Roa, M. A., Ascencio, F., Rangel-Dávalos and C., Rojas-Contreras, M. (2015a). Assessment of endemic microalgae as potential food for Artemia franciscana cultura. Latin American Journal of Aquatic Research, 43(1): 23-32. https://doi.org/10.3856/vol43-issue1-fulltext-3 [ Links ]
Pacheco-Vega, J. M., Sánchez-Saavedra, M. P., Cadena-Roa, M. A. and Tovar-Ramírez, D., (2015b). Lipid digestibility and performance index of LitoPenaeus vannamei fed with Chaetoceros muelleri cultured in two different enriched media. Journal of Applied Phycology, 28(4): 2379-2385. https://doi.org/10.1007/s10811-015-0750-y [ Links ]
Pedroza-Islas, R. (2002). Alimentos Microencapsulados: Particularidades de los procesos para la microencapsulación de alimentos para larvas de especies acuícolas. En: Cruz-Suárez, L. E., Ricque-Marie, D.,Tapia-Salazar, M., Gaxiola-Cortés, M. G., Simoes, N. (Eds.). Avances en Nutrición Acuícola VI. Memorias del VI Simposium Internacional de Nutrición Acuícola. September 3-6, 2002. Cancún, Quintana Roo, México. 438-447. [ Links ]
Reyes-Becerril, M., Guardiola, F., Rojas, M., Ascencio-Valle, F. and Esteban, M.A. (2013). Dietary administration of microalgae Navicula sp. affects immune status and gene expression of gilthead sea bream (Sparus aurata). Fish Shellfish Immun, 35(3): 883-889. Doi: org/10.1016/j.fsi.2013.06.026 [ Links ]
Riquelme, C.E. and Avendano-Herrera, R.E. (2003). Interacción bacteria-microalga en el ambiente marino y uso potencial en acuicultura. Rev. Chil. Hist. Nat., (76):4:725-736. DOI: org/10.4067/S0716-078X2003000400014 [ Links ]
Roy, S.S. and Pal, R. (2015). Microalgae in aquaculture: a review with special references to nutritional value and fish dietetics. In: Proceedings of the Zoological Society, Vol. 68, No. 1, 1-8. Springer India.DOI:10.1007/s12595-013-0089-9 [ Links ]
Sainz-Hernández, J. C. & Cordova-Mureta, J. H. (2009). Activity of trypsin in Litopenaeus vannamei. Aquaculture. 290(3-4): 190-195. https://doi.org/10.1016/j.aquaculture.2009.02.034 [ Links ]
Simões, N., Jones, D., Soto-Rodríguez, S., Roque, A. and Gómez-Gil, B. (2002). Las Bacterias en el Inicio de la Alimentación Exógena en Larvas de Camarones Peneidos: Efectos de la Calidad del Agua, Tasas de Ingestión y Rutas de Colonización del Tracto Digestivo. En: Memorias VI. Simposium Internacional de Nutrición Acuícola. Cancún, Q. Roo, México. [ Links ]
Sørensen, N., Daugbjerg, N., Richardson, K., Nørregaard, R. D., Espersen, L., Møhl, M. and Nielsen, T., (2016). Succession of picophytoplankton during the spring bloom 2012in Disko Bay (West Greenland)-an unexpectedly low abundance of green algae. Polar Biol. Doi: 10.1007/s00300-016-1952-8 [ Links ]
Whyte, J.N.C. (1987). Biochemical composition and energy content of six species of phytoplankton used in mariculture of bivalves. Aquaculture. 60: 231-241. Doi: org/10.1016/0044-8486(87)90290-0 [ Links ]
Ziaei-Nejad, S., Rezaei, M.H., Takami, G.A., Lovett, D.L., Mirvaghefi, A.R. and Shakouri, M. (2006). The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture, 252(2): 516-524. Doi: org/10.1016/j.aquaculture.2005.07.021 [ Links ]
Zhou, X., Wang, Y. and Li, W. (2009). Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality, survival rate and digestive enzyme activities. Aquaculture. 287: 349-353. Doi: https://doi.org/10.1016/j.aquaculture.2008.10.046 [ Links ]
Recibido: 22 de Noviembre de 2017; Aprobado: 03 de Julio de 2018











 texto en
texto en 


