Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub Oct 02, 2020
https://doi.org/10.15741/revbio.06.e541
Artículos originales
Efecto de cepas de Bacillus solas y en interacción con hongos fitopatógenos sobre el crecimiento vegetal y calidad del fruto de jitomate
1 Doctorate in Sciences, Centro de Investigación en Alimentación y Desarrollo, A.C. (CIAD), Campus Cuauhtémoc. Cd. Cuauhtémoc, Av. Río Conchos S/N. Parque Industrial, C.P. 31570, Chihuahua, México.
2 Professor-Researcher, Centro de Investigación en Alimentación y Desarrollo, A.C. (CIAD), Campus Cuauhtémoc. Cd. Cuauhtémoc, Av. Río Conchos S/N. Parque Industrial, C.P. 31570, Chihuahua, México.
3 Universidad de Ciencias y Artes de Chiapas (UNICACH), Facultad de Ingenierías, Unidad Académica Villacorzo. Villacorzo, Km 3.0, Carretera Villacorzo-Ejido Monterrey, C.P. 29000, Chiapas, México.
4 Universidad Autónoma de Nayarit (UAN), Unidad Académica de Agricultura. Km. 9.0 Carretera Tepic-Compostela, C.P. 63155, Xalisco, Nayarit, México.
Una alternativa para promover la calidad del fruto de jitomate (Solanum lycopersicon L.) y aminorar los efectos indirectos de hongos fitopatógenos causantes de enfermedades de raíz y cuello puede ser el uso de bacterias antagonistas del género Bacillus. El objetivo del estudio fue determinar el efecto de tres cepas de Bacillus solas y en interacción con tres hongos fitopatógenos en la promoción del crecimiento de plantas de jitomate cv. Merlice y calidad del fruto. Para este propósito, se inocularon plántulas con tres especies de Bacillus (B. amyloliquefaciens, B. methylotrophicus y B. subtilis subsp. inaquosorum), y después con tres hongos fitopatógenos del jitomate (Alternaria solani, Fusarium oxysporum y Phytophthora infestans). Al final del ciclo de producción, se determinaron, la altura y peso de las plantas; longitud y peso de raíces; y clorofila en hojas y el rendimiento. Los frutos cosechados se caracterizaron por color, peso, tamaño, espesor del mesocarpio, sólidos solubles totales, acidez titulable, composición bromatológica, firmeza, y número y peso de semillas. La inoculación con las tres cepas de Bacillus resultó en los valores más altos en la mayoría de las variables evaluadas. B. amyloliquefaciens incrementó significativamente la altura de la planta, longitud de raíz y el rendimiento en un 30 %, mientras que el fitopatógeno F. oxysporum redujo el rendimiento 30 %. Bacillus subtilis mostró efectos positivos en el diámetro y firmeza del fruto, contenido de proteínas y longitud de raíz. Las tres cepas de Bacillus promovieron el crecimiento de las plantas y el rendimiento y mejoraron algunos parámetros de calidad del fruto.
Palabras clave: Agentes de control biológico; bacterias antagonistas; promoción del crecimiento; enfermedades radiculares; rendimiento
An alternative to promote the quality of tomato fruits (Solanum lycopersicon L.) and reduce the indirect effects of phytopathogenic fungi that cause root and crown diseases, might be the use of antagonistic bacteria of the Bacillus genus. The aim of the study was to determine the effect, of three Bacillus strains alone and together in interaction with phytopathogenic fungi on the plant growth promotion of tomato cv. Merlice and fruit quality. For this purpose, seedlings were inoculated with three Bacillus species (B. amyloliquefaciens, B. methylotrophicus and B. subtilis subsp. inaquosorum) and then with three phytopathogenic fungi of tomato (Alternaria solani, Fusarium oxysporum and Phytophthora infestans). At the end of the production cycle, the height and weight of plants, the length and weight of roots, chlorophyll in leaves, and the fruit yield, was determined. The fruits harvested were characterized for color, weight, size, mesocarp thickness, total soluble solids, titratable acidity, bromatological analysis, firmness, and number and weight of seeds. Bacillus inoculation with the three strains resulted in higher values among the variables evaluated. Bacillus amyloliquefaciens significantly increased plant height and root length and yield by 30 %, whereas the phytopathogen F. oxysporum significantly decreased yield in 30 %. Bacillus subtilis strain showed positive effects on fruit diameter and firmness, protein content and root length. The three Bacillus strains promoted the growth of tomato plants, yield and improved some of their fruit quality parameters.
Keywords: Biological control agents; antagonistic bacteria; growth promotion; root diseases; yield
Introducción
El jitomate (Solanum lycopersicon L.; Solanales: Solanaceae) es uno de los cultivos hortícolas de gran importancia a nivel mundial, debido a su elevado consumo tanto en producto fresco como procesado, con una superficie sembrada de aproximadamente 5 millones de hectáreas y una producción de más de 177 millones de toneladas en 2016. En el mismo año, México contribuyó con más de 4 millones de toneladas (2.3 %) cosechadas en un área de más de 90,000 ha (FAO, 2016). Este cultivo, como muchos otros, es susceptible al ataque de una gran diversidad de hongos fitopatógenos. Dichos microorganismos pueden causar pérdidas económicas hasta del 100 % en tomate (Martínez-Ruiz et al., 2016). Algunos de estos hongos son causantes de enfermedades de raíz y cuello, que obstruyen los haces vasculares de la planta, evitando el flujo normal de agua y nutrientes, lo cual se refleja en síntomas como defoliación, marchitez, clorosis foliares, reducción del crecimiento, baja producción de frutos, entre otros efectos negativos (Shafique et al., 2016). Dentro de los hongos patógenos más importantes del jitomate se encuentran Fusarium oxysporum f. sp. lycopersici, Alternaria solani y Phytophthora infestans (El_Komy et al., 2015). Los fungicidas químicos son los más comúnmente usados para el control de estos fitopatógenos con resultados satisfactorios; sin embargo, el uso excesivo de estas sustancias puede inducir el desarrollo de resistencia por parte de los patógenos, eliminación de microorganismos no blancos, contaminación de suelos agrícolas y cuerpos de agua, y otros efectos negativos (Al-Rahmah et al., 2013; Shafique et al., 2016). Una alternativa para el control de estos patógenos, puede ser el uso de bacterias antagonistas del género Bacillus, reconocidas como excelentes agentes de control biológico, mejoradores de la calidad de suelos agrícolas y promotores del crecimiento vegetal, entre otros atributos (Cabra-Cendales et al., 2017). Sin embargo, varias cepas de Bacillus han sido evaluadas principalmente in vitro, de manera individual y en pocos estudios se han considerado los efectos de la aplicación de estos sobre la composición bromatológica de los frutos y su potencial para aminorar el daño indirecto en frutos causado por microorganismos fitopatógenos in situ (Esitken et al., 2010; Ju et al., 2014; El-Komy et al., 2015). Derivado de lo anterior, el objetivo del estudio fue determinar el efecto de tres cepas de Bacillus solas y en interacción con tres hongos fitopatógenos sobre el crecimiento de plantas de jitomate y calidad del fruto.
Material y Métodos
Material vegetal y microbiano
Las cepas microbianas fueron proporcionadas por el cepario del Centro de Investigación en Alimentación y Desarrollo (CIAD), Sede Chihuahua, Campus Cuauhtémoc, y la Universidad Michoacana de San Nicolás de Hidalgo, Michoacán, México. Se usaron tres cepas bacterianas del género Bacillus [B. amyloliquefaciens (Ba); B. methylotrophicus (Bm) y B. subtilis subsp. Inaquosorum (Bs)]. La patogenicidad de los fitopatógenos y los efectos antagonistas de Bacillus spp., se confirmaron en estudios previos (Rios-Velasco et al., 2016; Ruiz-Cisneros et al., 2017) y tres hongos fitopatógenos aislados de cultivos de jitomate, en México [Alternaria solani (As), Fusarium oxysporum (Fo) y Phytophthora infestans (Pi)].
Las semillas de jitomate (Solanum lycopersicon L. cv. Merlice), fueron provistos por la compañía DeRuiter™ (Monsanto Holland), mientras que los agentes polinizantes Bombus terrestris L. (Hymenoptera: Apidae), fueron adquiridos con Koppert México, S.A. de C.V. (El Marqués, Querétaro, México).
Establecimiento y manejo del cultivo de jitomate
El experimento se realizó en un invernadero (tipo túnel de 20 × 8 × 5 m, sin calefacción) en Cuauhtémoc, Chihuahua, México, localizado a 28°26›51»N; 106°49›43»O y 2,020 msnm. Las semillas de jitomate se germinaron en charolas de 200 cavidades hasta el estado de 2-3 hojas verdaderas. Posteriormente, se trasplantaron en bolsas de plástico negro con capacidad de 5 L con una mezcla de sustrato esterilizado (121 ºC, 15 psi, 1 h) compuesto de suelo franco, vermiculita (Termolita, S.A. de C.V., Santa Catarina, Nuevo León, México) y peat moss (Lambert Peat Moss Inc.-Turbines Lambert Inc., Quebec, Canadá) en una proporción de 1:1:1. La fertilización se realizó cada 30 días después del trasplante (dpt) [250 mL de Urea (6 g/L) (Ferti-urea, Productora de Fertilizantes del Noroeste, S.A. de C.V., Cd. Obregón, Sonora, México) y Triple 19 (2 g/L) (Poly-Feed, grado invernadero, fertilizante sólido soluble NPK 19-19-19, Haifa México, S.A. de C.V., México) y 10 mL de medio Murashige y Skoog (4.4 g/L) (Sigma-Aldrich, México)], durante el ciclo de producción 2016. La polinización fue llevada a cabo por una colmena de abejorros B. terrestris.
Inoculación del sustrato con los microorganismos
Las cepas de Bacillus se crecieron en caldo LB (Sigma-Aldrich, St. Louis, MO, EUA) a 28 °C, en agitación constante (180 rpm) por 2 d. Para su incremento, los hongos se inocularon en un caldo nutritivo (BD Bioxon, Becton Dickinson de México, S.A. de C.V., Cuautitlán Izcalli, Estado de México, México), excepto P. infestans que se creció en un caldo de verduras V8 (jugo V8, Campbell´s™) adicionado con carbonato de calcio (3 g/L), a 28 °C, en agitación constante (180 rpm) por 5 d.
Los patógenos y antagonistas se aplicaron individualmente al sustrato de 150 macetas, a los 8 dpt, de acuerdo con las concentraciones mostradas en la Tabla 1. Se aplicaron 30 mL (4.5-6.0×1010 UFC) de la suspensión de la bacteria antagonista y 20 mL (2.6-7.8×107 conidias) de la suspensión del fitopatógeno. Se usaron 10 plantas para cada microorganismo (antagonista o fitopatógeno), donde cada planta fue una unidad experimental (T2-T7, Tabla 1) y 90 plantas para las pruebas de interacción entre antagonistas y patógenos (T8-T16, Tabla 1). Adicionalmente, se usaron 10 plantas sin inóculo, como testigos (T1, Tabla 1).
Tabla 1 Tratamientos y concentración (CFU o conidias/mL) de las inoculaciones en plantas de jitomate con cepas de Bacillus y hongos fitopatógenos.
| Treatment | Antagonists (CFU/mL) |
Phytopathogens (conidia/mL) |
||
|---|---|---|---|---|
| Code | Antagonistic bacteria | Phytopathogenic fungi | ||
| T1 | Control | - | - | - |
| T2 | Bacillus amyloliquefaciens (Ba) | - | 1.8×109 | - |
| T3 | B. methylotrophicus (Bm) | - | 2.0×109 | - |
| T4 | B. subtilis subsp. Inaquosorum (Bs) | - | 1.5×109 | - |
| T5 | - | Fusarium oxysporum (Fo) | - | 1.3×106 |
| T6 | - | Alternaria solani (As) | - | 3.9×106 |
| T7 | - | Phytophthora infestans (Pi) | - | 2.6×106 |
| T8 | Ba | Fo | 1.8×109 | 1.3×106 |
| T9 | Ba | As | 1.8×109 | 3.9×106 |
| T10 | Ba | Pi | 1.8×109 | 2.6×106 |
| T11 | Bm | Fo | 2.0×109 | 1.3×106 |
| T12 | Bm | As | 2.0×109 | 3.9×106 |
| T13 | Bm | Pi | 2.0×109 | 2.6×106 |
| T14 | Bs | Fo | 1.5×109 | 1.3×106 |
| T15 | Bs | As | 1.5×109 | 3.9×106 |
| T16 | Bs | Pi | 1.5×109 | 2.6×106 |
UFC= Unidades formadoras de colonias.
Los tratamientos de interacción (antagonistas vs patógenos), consistieron en la aplicación el patógeno correspondiente a los 18 dpt (10 d después de la aplicación de las cepas de Bacillus). La población de antagonistas se mantuvo mediante tres aplicaciones del inóculo a intervalos de 20 d, después de la primera inoculación. Cabe resaltar que los fitopatógenos se inocularon en una ocasión. Las plantas se mantuvieron bajo condiciones de invernadero y se evaluaron durante el ciclo de producción (abril a octubre 2016).
Mediciones agronómicas
Al final del ciclo de producción, las plantas se evaluaron para altura y peso de la parte aérea, longitud y peso de raíz y diámetro de tallo. La clorofila (unidades SPAD) se estimó cuatro veces (cada 20 dpt) en 10 hojas al azar por planta, de cada tratamiento, usando un medidor de clorofila Spad 502DL Plus (Konica Minolta Brand, Spectrum Technologies, Inc., Aurora Illinois, EUA). También se registró el número de frutos producidos por planta y con base en esto, se calculó el rendimiento, considerando todos los frutos cosechados a través del tiempo durante el periodo de evaluación.
Los jitomates se cosecharon en el punto rojo, de acuerdo a las especificaciones del Departamento de Agricultura de Estados Unidos de América (USDA, 2015) y se almacenaron por 3 d a 4 °C hasta su análisis. Los frutos fueron evaluados para peso, diámetro polar y ecuatorial, color, número y peso de semillas, sólidos solubles totales (SST; °Brix), acidez titulable (% ácido cítrico), firmeza y espesor del mesocarpio. Los diámetros polar y ecuatorial se midieron usando un medidor de diámetro (Cranston Machinery Co., Oak Grove, Oregon, EUA). El color [L* (luminosidad de negro a blanco), a* (va de rojo a verde) y b* (va de azul a amarillo)]. se midió en cuatro puntos equidistantes en el eje ecuatorial de cada fruto, usando un colorímetro Minolta CR300. El número de semillas se determinó en 10 frutos al azar de cada tratamiento. Los sólidos solubles totales (SST, °Brix) se determinaron, usando un refractómetro digital de mesa PAL-1 (Atago Co. Ltd., Tokyo Japón). Para la acidez titulable, se homogeneizaron 10 g de pulpa (a partir de 20 frutos tomados al azar de cada tratamiento) con 250 mL de agua destilada estéril y 50 mL de la solución obtenida se titularon con NaOH al 0.1 N, usando fenolftaleína al 0.5 % como indicador de color. La acidez titulable se expresó como porcentaje de ácido cítrico (NMX-F-102-S-1978). Para la firmeza de los frutos, se evaluaron 50 jitomates tomados al azar de cada tratamiento y se determinó mediante una prueba de punción usando un analizador de textura Ta XTPlus (Texture Analyzer, Surrey, RU), iniciando a 30 cm/min, a una distancia de 15 cm en dos puntos opuestos a lo largo del plano ecuatorial y se registró la fuerza máxima (N). El espesor del mesocarpio se determinó en cuatro secciones de 10 frutos al azar de cada tratamiento, usando un Vernier digital (Knova 0-150 mm).
Análisis bromatológico
Se obtuvo una muestra compuesta de 250 g a partir de 20 frutos tomados al azar de cada tratamiento. Las muestras se colocaron en bolsas Ziploc™ y se almacenaron a -80 °C hasta su análisis. Subsecuentemente, las muestras se homogeneizaron usando una licuadora LB10 (Waring Laboratory, Torrington, CT, USA) y se obtuvieron sub-muestras de puré (de 1 a 10 g, dependiendo de la determinación). Estas se sometieron a mediciones de humedad, cenizas, proteínas (N × 6.25), grasas y fibra total, de acuerdo a los métodos oficiales (925.10, 923.03, 991.20 y 920.35) de la Association of Official Analytical Chemistry (AOAC, 2002).
Análisis estadístico
El experimento consistió de 16 tratamientos (Tabla 1). Los ensayos se realizaron con 10 plantas de jitomate por tratamiento, considerando a cada planta como una unidad experimental, usando un diseño completamente al azar. Los datos se analizaron usando el software Statistical Analysis System versión 9.0 (SAS, 2002) para balancear el análisis de varianza (ANOVA), y las medias se separaron mediante la prueba de Tukey (p=0.05). Las mediciones en frutos, se determinaron por triplicado y los datos obtenidos se sometieron a un ANOVA y una prueba de separación de medias por Tukey (p=0.05).
Resultados y Discusión
Promoción de crecimiento vegetal y rendimiento de la planta
Las tres cepas de Bacillus mostraron efectos positivos en al menos una de las variables agronómicas evaluadas (Figuras 1 y 2). El peso fresco y seco de las plantas varió de 104 a 246.6 g y de 29.7 a 47.9 g, respectivamente. Las plantas inoculadas con B. subtilis obtuvieron los valores más altos, causando el efecto más notable en dichas variables de respuesta, comparadas con las plantas testigo (Figura 1). La misma cepa promovió la mayor longitud de raíz (45 cm) y altura (1.45 m; Figura 1). También las plantas tratadas con B. amyloliquefaciens, mostraron un estímulo significativo en altura (1.42 m; Figura 1). Los tres fitopatógenos redujeron hasta en un 25 % la altura de la planta con relación a las del testigo (Figura 1). Además, las plantas tratadas con A. solani y P. infestans resultaron en los valores más bajos para longitud de raíz, con 29 y 30 cm, respectivamente, comparativamente a los testigos (35 cm), pero inferiores a las tratadas con las cepas de Bacillus (Figura 1).

Figura 1 Variables de crecimiento (altura, pesos fresco y seco) estimadas en Lycopersicon esculentum L. cv. Merlice, inoculados con cepas de Bacillus solas y en interacción con hongos fitopatógenos: a) plantas; b) raíces. Los datos se presentan como medias ± error estándar.

Figura 2 Efectos en variables agronómicas (diámetro de tallo, clorofila (unidades SPAD), y frutos/planta) de plantas de jitomate inoculadas con cepas de Bacillus solas y en interacción con hongos fitopatógenos. Los datos se presentan como medias ± error estándar.
Asimismo, las plantas tratadas con las cepas de Bacillus mostraron los valores más altos en diámetro de tallo, clorofila en hojas y rendimiento, comparadas con aquellas inoculadas con los fitopatógenos solos y en interacción (Bacillus spp. vs fitopatógenos; Figura 2). Bacillus amyloliquefaciens promovió el mayor rendimiento de frutos (63,000 kg Ha-1), seguido por B. subtilis (52,000 kg Ha-1; Figura 2). En el resto de los tratamientos los rendimientos fueron variables (Figura 2).
Los efectos positivos, resultado de la inoculación de cepas de Bacillus pueden deberse a sus múltiples atributos como excelentes colonizadores de raíces, mejoradores del crecimiento de raíz, promotores del rendimiento del cultivo, inductores de resistencia al estrés abiótico, entre otros (Beneduzi et al., 2012). Por su parte, las raíces producen exudados que estimulan el crecimiento de los agentes de control biológico en una manera de sinergismo (Widnyana & Javandira, 2016; Yuan et al., 2015).
En nuestro estudio, algunas variables agronómicas tales como el crecimiento vegetal, la clorofila en hojas, el rendimiento (número y diámetro de frutos), masa radicular y diámetro de tallo fueron incrementadas por las cepas de Bacillus. Bacillus amyloliquefaciens promovió el mayor rendimiento y tamaño de frutos, comparado con aquellos obtenidos de las plantas testigo. Mena-Violante & Olalde-Portugal (2007) reportaron un incrementó en el rendimiento por planta y el peso de los frutos en 25 % y 18 %, respectivamente, al aplicar la cepa B. subtilis BEB-13bs. Gül et al. (2008) y Myresiotis et al. (2014) demostraron que la aplicación de B. amyloliquefaciens en plantas de jitomate, incrementaron el rendimiento en 8-9 %. Efectos similares por Bacillus en el rendimiento han sido reportados en otros cultivos (Esitken et al., 2010). Esto podría atribuirse a la capacidad de algunas cepas de Bacillus para producir hormonas tales como auxinas, citocininas y giberelinas, las cuales promueven el crecimiento de las raíces y el desarrollo de frutos. También pueden solubilizar fosfatos inorgánicos y mineralizar los fosfatos orgánicos, entre otros nutrientes, favoreciendo el crecimiento de las plantas (Esitken et al., 2010). Además de su capacidad para producir biosurfactinas (lipopéptidos), responsables de incrementar la movilidad de Bacillus para una rápida colonización radicular (Lugtenberg & Kamilova, 2009; Ahemad & Kibret, 2014).
Los fitopatógenos redujeron en gran medida las variables agronómicas evaluadas, así como los parámetros de calidad del fruto. Las plantas inoculadas con A. solani y P. infestans mostraron un efecto negativo en las variables agronómicas, principalmente en altura de la planta, longitud de raíz, diámetro de tallo, rendimiento y el número y tamaño de frutos. El rendimiento en plantas tratadas con fitopatógenos, fue 31 % menor que en los testigos, variando de 33,000 a 39,000 kg Ha-1. Las plantas tratadas con F. oxysporum mostraron el rendimiento más bajo (Figura 2). Esto puede atribuirse a la deficiente asimilación nutrimental de las plantas enfermas causado por las micotoxinas (ácido fusárico), y enzimas (cutinasas y esterasas) producidas por los fitopatógenos (Beneduzi et al., 2012).
Por otra parte, el rendimiento en plantas tratadas con las cepas de Bacillus y subsecuentemente con los fitopatógenos, fue menor que el observado con las cepas de Bacillus solas y los testigos. Sin embargo, se redujeron los síntomas de la enfermedad causada por los fitopatógenos e incluso se promovió el crecimiento vegetal en algunos tratamientos (Figura 1). Esto pudo deberse a que algunas cepas de Bacillus son altamente competitivas y capaces de colonizar la rizosfera formando una capa protectora en las raíces produciendo compuestos fungicidas, que actúa como una barrera natural contra los fitopatógenos (Widnyana & Javandira, 2016).
Calidad del fruto
Los datos obtenidos para los diámetros polar y ecuatorial de frutos, se muestran en la Figura 3. El tamaño de los frutos de plantas inoculadas con las cepas de Bacillus, fue mayor (21 %) que en el resto de los tratamientos. Los frutos más grandes fueron producidos por plantas inoculadas con B. subtilis (>55 mm de diámetro). En contraste, las plantas inoculadas con los patógenos, produjeron frutos de menor tamaño. Los frutos de plantas tratadas con B. subtilis, tuvieron el mayor espesor de mesocarpio, mientras que aquellos de plantas inoculadas con los patógenos, fueron más delgados. El mesocarpio más delgado se observó en frutos de plantas tratadas con A. solani (Figura 3).
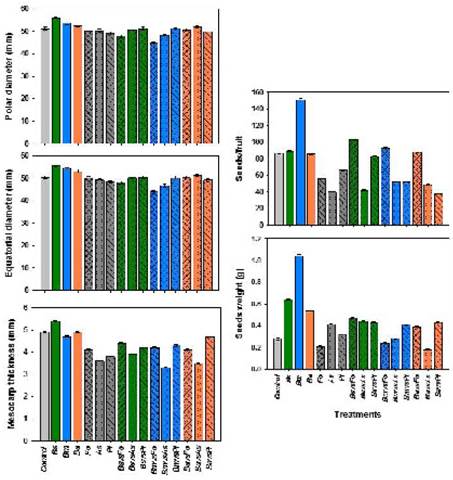
Figura 3 Efectos en las variables agronómicas (diámetros polar y ecuatorial, número de semillas/fruto, peso de semillas y espesor de mesocarpio) de frutos de jitomate obtenidos de plantas inoculadas con cepas de Bacillus solas y en interacción con hongos fitopatógenos. Los datos se presentan como medias ± error estándar.
El número de semillas por fruto fluctuó de 38 a 151 (Figura 3). El mayor número se obtuvo del tratamiento con B. methylotrophicus. El peso de semillas por fruto fluctuó de 0.18 a 1.04 g. El mayor peso se obtuvo en los frutos de plantas tratadas con las cepas de Bacillus, en particular con B. methylotrophicus, mientras que los más bajos se observaron en las plantas inoculadas con F. oxysporum y de la interacción B. amyloliquefaciens vs A. solani. Al respecto, Tewksbury et al. (2008) mencionan que los patógenos pueden reducir el número y tamaño de las semillas en los frutos, o incluso, obtener semillas vacías, presumiblemente como consecuencia de una deficiencia en la asimilación de los nutrientes causada por la enfermedad.
En general, los SST y la acidez titulable no mostraron una tendencia clara, aunque los SST fueron mayores en los frutos de plantas tratadas con los patógenos A. solani y P. infestans. Esto puede deberse a una mayor velocidad de hidrólisis de carbohidratos, lo cual puede tener implicaciones en el mercado del jitomate fresco (Tigist et al., 2013). La acidez titulable fue mayor en frutos de plantas tratadas con las tres cepas de Bacillus, que los testigos (Tabla 2). Donde los valores más altos se observaron en frutos de plantas tratadas con B. amyloliquefaciens (0.48 % ácido cítrico), mientras que los valores más bajos se observaron en frutos de plantas tratadas con F. oxysporum (0.24 % ácido cítrico; Tabla 2).
Tabla 2 Sólidos solubles totales (SST, °Brix), acidez titulable (% ácido cítrico), firmeza y parámetros de color L*, a* y b* por el sistema CIELAB de frutos de jitomate cosechados de plantas inoculadas con cepas de Bacillus solas y en interacción con hongos fitopatógenos.
| Treatment | TSS (°Brix) | % citric acid | Firmness (N) | L* | a* | b* |
|---|---|---|---|---|---|---|
| Control | 4.40 ± 0.11ab | 0.34 ± 0.02ab | 37.4 ± 1.4bcdef | 49.2 ± 1.2abc | 14.4 ± 0.9ab | 19.2 ± 0.9ab |
| Antagonists alone | ||||||
| B. subtilis subsp. inaquosorum | 4.43 ± 0.53ab | 0.43 ± 0.03ab | 59.2 ± 1.0a | 48.5 ± 0.3abc | 13.8 ± 1.2abc | 19.5 ± 0.7ab |
| B. methylotrophicus | 3.78 ± 0.18b | 0.42 ± 0.09ab | 26.1 ± 0.6ef | 49.3 ± 1.1abc | 16.0 ± 0.6a | 21.6 ± 0.8ab |
| B. amyloliquefaciens | 3.95 ± 0.25ab | 0.48 ± 0.01a | 43.2 ± 1.2abcde | 53.4± 0.5a | 14.4 ± 0.6ab | 19.9 ± 1.5ab |
| Phytopathogens alone | ||||||
| F. oxysporum | 4.34 ± 0.34ab | 0.24 ± 0.03b | 23.3 ± 1.2f | 48.9 ± 0.8abc | 14.6 ± 0.7ab | 20.2 ± 1.3ab |
| A. solani | 4.77 ± 0.34a | 0.39 ± 0.04ab | 36.2 ± 1.5cdef | 50.7 ± 0.7abc | 15.0 ± 0.9ab | 22.5 ± 1.0a |
| P. infestans | 4.52 ± 0.28ab | 0.32 ± 0.03ab | 51.6 ± 1.4abc | 49.1 ± 0.2abc | 14.5 ± 0.5ab | 21.1 ± 1.5ab |
| Antagonists vs phytopathogens | ||||||
| B. subtilis vs F. oxysporum | 4.16 ± 0.22ab | 0.33 ± 0.05ab | 34.5 ± 0.8cdef | 50.1 ± 0.5abc | 13.9 ± 1.2abc | 23.6 ± 1.0a |
| B. subtilis vs A. solani | 4.68 ± 0.23ab | 0.39 ± 0.18ab | 41.7 ± 1.3abcdef | 49.6± 1.9abc | 16.3 ± 0.4a | 19.5 ± 0.3ab |
| B. subtilis vs P. infestans | 3.96 ± 0.25ab | 0.33 ± 0.05ab | 55.4 ± 1.1ab | 50.5 ± 0.8abc | 14.8 ± 0.6ab | 21.0 ± 0.4ab |
| B. methylotrophicus vs F. oxysporum | 4.34 ± 0.24ab | 0.27 ± 0.09ab | 52.1 ± 1.4abc | 51.5 ± 1.5abc | 12.1 ± 1.4bcd | 22.8 ± 1.0a |
| B. methylotrophicus vs A. solani | 4.18 ± 0.11ab | 0.36 ± 0.05ab | 32.0 ± 0.6def | 41.8 ± 1.0bc | 9.9 ± 1.5d | 18.5 ± 1.6ab |
| B. methylotrophicus vs P. infestans | 4.07 ± 0.49ab | 0.35 ± 0.03ab | 46.7 ± 1.7abcd | 40.3 ± 0.7b | 10.7 ± 1.3cd | 15.5 ± 1.9b |
| B. amyloliquefaciens vs F. oxysporum | 3.79 ± 0.22b | 0.40 ± 0.05ab | 52.7 ± 1.1abc | 48.9 ± 1.1abc | 14.7 ± 0.5ab | 21.1 ± 1.4ab |
| B. amyloliquefaciens vs A. solani | 4.69 ± 0.10ab | 0.32 ± 0.12ab | 33.6 ± 1.4cdef | 49.3 ± 1.1abc | 13.9 ± 1.0abc | 19.8 ± 1.3ab |
| B. amyloliquefaciens vs P. infestans | 3.83 ± 0.13ab | 0.38 ± 0.13ab | 58.6 ± 0.9a | 50.2 ± 2.0abc | 13.3 ± 0.9abcd | 20.9 ± 0.3ab |
Medias con la misma literal entre columnas, son estadísticamente iguales de acuerdo con la prueba de Tukey (p=0.05). ± Error estándar.
La firmeza de los frutos fluctuó de 23.3 a 59.2 N sin mostrar una tendencia clara. Los frutos de plantas tratadas con B. subtilis, mostraron los valores más altos, resultando en un incremento en la firmeza en 1.6 veces comparado con los frutos testigo. Los frutos más blandos se obtuvieron de plantas tratadas con F. oxysporum (Tabla 2). Resultados similares fueron obtenidos por Mena-Violante & Olalde-Portugal (2007) en plantas de tomate inoculadas con B. subtilis. De acuerdo con estos autores, los frutos más firmes son más resistentes al ataque de microorganismos patógenos, lo cual mejora su vida de anaquel. Este efecto puede ser atribuido a cambios en la producción de fitohormonas, principalmente etileno, el cual es responsable de la expresión de genes de la maduración en las plantas. El color de los frutos no se vio afectado por los microorganismos evaluados (Tabla 2), lo cual es consistente con la literatura existente. Este es el atributo de calidad más estrechamente relacionado con la apariencia, contenido de azúcar, acidez, pH, textura, sabor y jugosidad (Araujo et al., 2014).
Composición bromatológica de frutos
El contenido de humedad en frutos de plantas tratadas con las cepas de Bacillus fluctuó de 95.5 a 96.8 %. Las plantas tratadas con B. methylotrophicus produjeron frutos con el menor contenido de agua (Tabla 3). Sin embargo, el contenido de humedad en frutos de plantas tratadas con las cepas de Bacillus y en interacción con los fitopatógenos fue superior al 98 %. Esto puede atribuirse al estrés hídrico inducido en las plantas, por la enfermedad causada por dichos patógenos, lo cual podría inhibir la transpiración normal de las plantas y sus frutos (Yadeta & Thomma, 2013).
Tabla 3 Análisis bromatológico de jitomates cosechados de plantas inoculadas con cepas de Bacillus solas y en interacción con hongos fitopatógenos.
| Treatment | Bromatological composition | ||||
|---|---|---|---|---|---|
| Moisture (%) | Ashes (%) | Proteins(%) | Fats (Lipids) (%) | Fiber (%) | |
| Control | 96.8 ± 0.13cde | 0.09 ± 0.01b | 0.35 ± 0.09cd | 0.08 ± 0.01bcd | 1.18 ± 0.01a |
| Antagonistic microorganisms | |||||
| B. subtilis subsp. inaquosorum | 95.7 ± 0.20de | 0.41 ± 0.06a | 0.93 ± 0.04a | 0.02 ± 0.04d | 1.19 ± 0.03ª |
| B. methylotrophicus | 95.5 ± 0.18e | 0.43 ± 0.01a | 0.68 ± 0.07abc | 0.18 ± 0.03a | 1.16 ± 0.03ª |
| B. amyloliquefaciens | 96.8 ± 0.71cde | 0.41 ± 0.07a | 0.92 ± 0.11a | 0.08 ± 0.02abcd | 1.14 ± 0.03ª |
| Phytopathogenic microorganisms | |||||
| F. oxysporum | 97.1 ± 0.33bcd | 0.38 ± 0.06a | 0.70 ± 0.15ab | 0.15 ± 0.04abc | 1.58 ± 0.05a |
| A. solani | 97.7 ± 0.05abc | 0.08 ± 0.01b | 0.33 ± 0.02d | 0.04 ± 0.01d | 1.76 ± 0.02ª |
| P. infestans | 97.4 ± 0.25abc | 0.10 ± 0.03b | 0.72 ± 0.06ab | 0.06 ± 0.01cd | 1.29 ± 0.04ª |
| Antagonists vs phytopathogens | |||||
| B. subtilis vs F. oxysporum | 98.3 ± 0.07ab | 0.03 ± 0.04b | 0.51 ± 0.04bcd | 0.03 ± 0.04d | 1.32 ± 0.54a |
| B. subtilis vs A. solani | 98.5 ± 0.06a | 0.02 ± 0.04b | 0.44 ± 0.04bcd | 0.08 ± 0.02bcd | 1.40 ± 0.23ª |
| B. subtilis vs P. infestans | 98.6 ± 0.10a | 0.03 ± 0.05b | 0.42 ± 0.04bcd | 0.03 ± 0.01d | 1.47 ± 0.20ª |
| B. methylotrophicus vs F. oxysporum | 98.7 ± 0.05a | 0.04 ± 0.01b | 0.40 ± 0.04bcd | 0.04 ± 0.01d | 1.32 ± 0.54a |
| B. methylotrophicus vs A. solani | 98.5 ± 0.09a | 0.04 ± 0.05b | 0.47 ± 0.04bcd | 0.10 ± 0.01abcd | 1.24 ± 0.10a |
| B. methylotrophicus vs P. infestans | 98.5 ± 0.03a | 0.03 ± 0.02b | 0.44 ± 0.04bcd | 0.08 ± 0.01abcd | 1.27 ± 0.39ª |
| B. amyloliquefaciens vs F. oxysporum | 98.5 ± 0.03a | 0.03 ± 0.02b | 0.51 ± 0.02bcd | 0.05 ± 0.70d | 1.44 ± 0.13ª |
| B. amyloliquefaciens vs A. solani | 98.6 ± 0.09a | 0.02 ± 0.01b | 0.46 ± 0.08bcd | 0.17 ± 0.04a | 1.48 ± 0.72ª |
| B. amyloliquefaciens vs P. infestans | 98.5 ± 0.1a | 0.08 ± 0.04b | 0.45 ± 0.06bcd | 0.06 ± 0.02cd | 1.54 ± 0.98ª |
Medias con la misma literal entre columnas, son estadísticamente iguales de acuerdo con la prueba de Tukey (p=0.05). ± Error estándar.
El contenido de cenizas fue mayor en frutos de plantas tratadas con cepas de Bacillus en un 95 %, que aquellos obtenidos de los tratamientos de interacción (Bacillus vs fitopatógenos) y de las plantas testigo (Tabla 3).
El contenido de proteínas fluctuó de 0.33 a 0.93 % (Tabla 3), donde se observó que los jitomates de plantas tratadas con las cepas de Bacillus, contenían más proteína (0.68-0.93 %), que aquellos obtenidos de las plantas testigo. Los frutos de plantas tratadas con patógenos tuvieron un alto contenido de proteínas, excepto con el tratamiento de A. solani, resultando en los valores más bajos (Tabla 3). Mientras que el contenido de grasas (lípidos) fluctuó de 0.02 a 0.18 % sin una tendencia clara (Tabla 3), donde el valor más alto fue observado en jitomates de plantas tratadas con B. methylotrophicus. La composición bromatológica de los frutos analizados, fue similar a lo reportado en la literatura (Guil-Guerrero & Rebolloso-Fuentes, 2009; Pinela et al., 2012). Pinela et al. (2012), reportaron altos niveles de humedad, fluctuando de 90.6 a 93.7 %, el contenido de cenizas fluctuó entre 0.54 y 0.74, un contenido bajo de grasas fluctuando de 0.03 a 0.17 en cultivares de jitomate. Adicionalmente, Hernández-Suárez et al. (2007) mencionan que muchos factores como el cultivar y las prácticas culturales, pueden influir en la composición bromatológica de los frutos de jitomate, principalmente en la concentración de minerales (cenizas), proteína y contenido de grasa. Por lo tanto, la capacidad de las cepas de Bacillus para fijar el nitrógeno, solubilizar minerales como el fósforo y producir hormonas que regulen el crecimiento vegetal, puede estar involucrada en el incremento del contenido de proteínas y cenizas en los frutos (Sivasakthi et al., 2014). Por otra parte, la eficacia de las bacterias antagonistas evaluadas bajo condiciones de invernadero, sin calefacción pudieron verse afectadas por la temperatura, humedad interna y concentraciones de los microorganismos antagonistas y fitopatógenos (Inam-ul-Haq et al., 2009).
Conclusión
Las cepas de Bacillus evaluadas en este estudio promovieron el rendimiento y tamaño de frutos en jitomates bajo condiciones de invernadero, con mayor énfasis en las variables como altura de la planta, clorofila en hojas, rendimiento, masa radicular, diámetro de tallo, tamaño y calidad de frutos. Por lo tanto, las cepas B. amyloliquefaciens y B. subtilis subsp. inaquosorum pueden ser una alternativa sustentable para usarse para incrementar el rendimiento y tamaño de los frutos en jitomate.
Agradecimientos
La autora María Fernanda Ruiz Cisneros agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT-México) por la beca proporcionada durante sus estudios de Doctorado.
REFERENCIAS
AOAC. (Association of Official Analytical Chemistry). (2002). Official methods of analysis. Association of Official Agricultural Chemists. 17a Ed. Washington, D.C., USA. [ Links ]
Ahemad, M. & Kibret, M. (2014). Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective. Journal of King Saud University - Science, 26(1): 1-20. https://doi.org/10.1016/j.jksus.2013.05.001 [ Links ]
Al-Rahmah, A. N., Mostafa, A. A., Abdel-Megeed, A., Yakout, S. M. and Hussein, S. A. (2013). Fungicidal activities of certain methanolic plant extracts against tomato phytopathogenic fungi. African Journal of Microbiology Research, 7(6): 517-524. https://doi.org/10.5897/AJMR12.1902 [ Links ]
Araujo, J. C., Silva, P. P., Telhado, S. F., Sakai, R. H., Spoto, M. H. and Melo, P. C. (2014). Physico-chemical and sensory parameters of tomato cultivars grown in organic systems. Horticultura Brasileira, 32(2): 205-209. http://dx.doi.org/10.1590/S0102-05362014000200015 [ Links ]
Beneduzi, A., Ambrosini, A. and Passaglia, L. M. (2012). Plant growth-promoting rhizobacteria (PGPR): their potential as antagonists and biocontrol agents. Genetics and Molecular Biology, 35(4): 1044-1051. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3571425/pdf/gmb-35-1044.pdf [ Links ]
Cabra-Cendales, T., Rodríguez-González, C. A., Villota-Cuásquer, C. P., Tapasco-Alzate, O. A. and Hernández-Rodríguez, A. (2017). Bacillus effect on the germination and growth of tomato seedlings (Solanum lycopersicum L). Acta Biológica Colombiana, 22(1): 37-44. http://dx.doi.org/10.15446/abc.v22n1.57375 [ Links ]
El_Komy, M. H., Saleh, A. A., Eranthodi, A. and Molan, Y. Y. (2015). Characterization of novel Trichoderma asperellum isolates to select effective biocontrol agents against tomato Fusarium wilt. The Plant Pathology Journal, 31(1): 50-60. https://doi.org/10.5423/PPJ.OA.09.2014.0087 [ Links ]
Esitken, A., Yildiz, H. E., Ercisli, S., Donmez, M. F., Turan, M. and Gunes, A. (2010). Effects of plant growth promoting bacteria (PGPB) on yield, growth and nutrient contents of organically grown strawberry. Scientia Horticulturae, 124: 62-66. https://doi.org/10.1016/j.scienta.2009.12.012 [ Links ]
FAO. (Organization de las Naciones Unidas) Food and Agriculture Organization of the United Nations. FAOSTAT. (2016). Producción de jitomate a nivel mundial. http://www.fao.org/faostat/es/#data/QC/visualize Last Checked August 2018. [ Links ]
Guil-Guerrero, J. L. & Rebolloso-Fuentes, M. M. (2009). Nutrient composition and antioxidant activity of eight tomato (Lycopersicon esculentum) varieties. Journal of Food Composition and Analysis, 22: 123-129. https://doi.org/10.1016/j.jfca.2008.10.012 [ Links ]
Gül, A., Kidoglu, F. and Tüzel, Y. (2008). Effects of nutrition and Bacillus amyloliquefaciens on tomato (Solanum lycopersicum, L.) growing in perlite. Spanish Journal of Agricultural Research, 6(3): 422-429. https://doi.org/10.5424/sjar/2008063.335 [ Links ]
Hernández-Suárez, M. H., Rodríguez, E. R. and Romero, C. D. (2007). Mineral and trace element concentrations in cultivars of tomatoes. Food Chemistry, 104(2): 489-499. https://doi.org/10.1016/j.foodchem.2006.11.072 [ Links ]
Inam-ul-Haq, M., Javed, N., Khan, M. A., Jaskani, M. J., Khan, M. M., Khan, H. U., Irshad, G. and Gowen, S. R. (2009). Role of temperature, moisture and Trichoderma species on the survival of Fusarium oxysporum ciceri in the rainfed areas of Pakistan. Pakistan Journal of Botany, 41(4): 1965-1974. http://www.pakbs.org/pjbot/PDFs/41(4)/PJB41(4)1965.pdf [ Links ]
Ju, R., Zhao, Y., Li, J., Jiang, H., Liu, P., Yang, T., Bao, Z., Zhou, B., Zhou, X. and Liu, X. (2014). Identification and evaluation of a potential biocontrol agent, Bacillus subtilis, against Fusarium sp. in apple seedlings. Annals of Microbiology, 64(1): 377-383. https://doi.org/10.1007/s13213-013-0672-3 [ Links ]
Lugtenberg, B. & Kamilova, F. (2009). Plant-growth-promoting rhizobacteria. Annual Review of Microbiology, 63: 541-556. https://doi.org/10.1146/annurev.micro.62.081307.161918 [ Links ]
Martínez-Ruiz, F. E., Cervantes-Díaz, L., Aíl-Catzím, C. E., Hernández-Montiel, L. G., Sánchez, C. L. D. T., and Rueda-Puente, E. O. (2016). Hongos fitopatógenos asociados al tomate (Solanum Lycopersicum L.) en la zona árida del noroeste de México: la importancia de su diagnóstico. European Scientific Journal, ESJ, 12(18): 232-256. http://dx.doi.org/10.19044/esj.2016.v12n18p232 [ Links ]
Mena-Violante, H. G. & Olalde-Portugal, V. (2007). Alteration of tomato fruit quality by root inoculation with plant growth-promoting rhizobacteria (PGPR): Bacillus subtilis BEB-13bs. Scientia Horticulturae, 113(1): 103-106. https://doi.org/10.1016/j.scienta.2007.01.031 [ Links ]
Myresiotis, C. K., Vryzas, Z. and Papadopoulou-Mourkidou, E. (2014). Enhanced root uptake of acibenzolar-S-methyl (ASM) by tomato plants inoculated with selected Bacillus plant growth-promoting rhizobacteria (PGPR). Applied Soil Ecology, 77: 26-33. https://doi.org/10.1016/j.apsoil.2014.01.005 [ Links ]
NMX-F-102-S-1978. (Norma Mexicana). Determinación de la acidez titulable en productos elaborados a partir de frutas y hortalizas. Norma mexicana. Dirección general de normas. https://www.colpos.mx/bancodenormas/nmexicanas/NMX-F-102-S-1978.PDF [ Links ]
Pinela, J., Barros, L., Carvalho, A.M. and Ferreira, I. C. (2012). Nutritional composition and antioxidant activity of four tomato (Lycopersicon esculentum L.) farmer’ varieties in Northeastern Portugal homegardens. Food and Chemical Toxicology, 50: 829-834. https://doi.org/10.1016/j.fct.2011.11.045 [ Links ]
Rios-Velasco, C., Caro-Cisneros, J. M., Berlanga-Reyes, D. I., Ruiz-Cisneros, M. F., Ornelas-Paz, J. J., Salas-Marina, M. A., Villalobos-Pérez, E. and Guerrero-Prieto, V. M. (2016). Identification and antagonistic activity in vitro of Bacillus spp. and Trichoderma spp. isolates against common phytopathogenic fungi. Revista Mexicana de Fitopatología, 34(1): 84-99 http://dx.doi.org/10.18781/R.MEX.FIT.1507-1 [ Links ]
Ruiz-Cisneros, M. F., Rios-Velasco, C., Berlanga-Reyes, D. I., Ornelas-Paz, J. J., Acosta-Muñiz, C. H., Romo-Chacón, A., Zamudio-Flores, P. B., Pérez-Corral, D. A., Salas-Marina, M. Á., Ibarra-Rendón, J. E. and Fernández-Pavía, S. P. (2017). Incidence and causal agents of root diseases and its antagonists in apple orchards of Chihuahua, México. Revista Mexicana de Fitopatología, 35(3): 437-462. http://dx.doi.org/10.18781/R.MEX.FIT.1704-3 [ Links ]
SAS, (Statistical Analysis System). (2002). SAS User’s Guide. Version 9.0. SAS Institute, Cary, NC. [ Links ]
Shafique, H. A., Sultana, V., Ehteshamul-Haque, S. and Athar, M. (2016). Management of soil-borne diseases of organic vegetables. Journal of Plant Protection Research, 56(3): 221-230. https://doi.org/10.1515/jppr-2016-0043 [ Links ]
Sivasakthi, S., Usharani, G. and Saranraj, P. (2014). Biocontrol potentiality of plant growth promoting bacteria (PGPR)-Pseudomonas fluorescens and Bacillus subtilis: A review. African Journal of Agricultural Research, 9(16): 1265-1277. https://doi.org/10.5897/AJAR2013.7914 [ Links ]
Tewksbury, J. J., Reagan, K. M., Machnicki, N. J., Carlo, T. A., Haak, D. C., Peñaloza, A. L. C. and Levey, D. J. (2008). Evolutionary ecology of pungency in wild chilies. Proceedings of the National Academy of Sciences, 105(33): 11808-11811. https://doi.org/10.1073/pnas.0802691105 [ Links ]
Tigist, M., Workneh, T. S. and Woldetsadik, K. (2013). Effects of variety on the quality of tomato stored under ambient conditions. Journal of Food Science and Technology, 50(3): 477-486. https://doi.org/10.1007/s13197-011-0378-0 [ Links ]
USDA (United States Department of Agriculture). (2015). Tomatoes: Shipping point and market inspection instructions. https://www.ams.usda.gov/sites/default/files/media/Tomato_Inspection_Instructions%5B1%5D.pdf [ Links ]
Widnyana, I. K. & Javandira, C. (2016). Activities Pseudomonas spp. and Bacillus sp. to stimulate germination and seedling growth of tomato plants. Agriculture and Agricultural Science Procedia, 9: 419-423. https://doi.org/10.1016/j.aaspro.2016.02.158 [ Links ]
Yadeta, K. A. & Thomma, B. P. (2013). The xylem as battleground for plant hosts and vascular wilt pathogens. Frontiers in Plant Science, 4(97): 1-12. https://doi.org/10.3389/fpls.2013.00097 [ Links ]
Yuan, J., Zhang, N., Huang, Q., Raza, W., Li, R., Vivanco, J. M. and Shen, Q. (2015). Organic acids from root exudates of banana help root colonization of PGPR strain Bacillus amyloliquefaciens NJN-6. Scientific Reports, 5: 13438. https://doi.org/10.1038/srep13438 [ Links ]
Recibido: 10 de Julio de 2018; Aprobado: 01 de Octubre de 2018











 text in
text in 


