Introducción
Los murciélagos son el segundo orden de mamíferos más diverso en el mundo con más de 1,400 especies (Burgin et al. 2018 y American Society of Mammalogists 2020). Este orden se compone de seis familias con distribución exclusivamente neotropical: Phyllostomidae, Mormoopidae, Noctilionidae, Thyropteridae, Natalidae y Furipteridae (Clare et al. 2011). En México se pueden encontrar las primeras cinco familias distribuidas a lo largo de las vertientes del Golfo, el Pacífico y la Península de Yucatán (Medellín et al. 2008). Habitan principalmente en matorrales xerófilos y selvas bajas, medianas y altas (Ortega y Arita 1998). Entre las características generales de los murciélagos neotropicales se destaca que son de hábitos nocturnos, tienen sistema de ecolocalización, pesan entre 5 y 65 g (Tirira 1998), y algunas especies, como las que integran las familias Mormoopidae y Natalidae, son cavernícolas estrictos (Rodríguez-Durán 2009). Los murciélagos cavernícolas neotropicales tienen gran impacto en los ecosistemas, donde proveen servicios ecosistémicos como dispersores de semillas, controladores de plagas y polinizadores de flores (Kunz et al. 2011). Por otra parte, la comunidad de murciélagos cavernícolas es de gran interés para la investigación ecológica, ya que estas especies tienen características de simpatría y coexistencia a lo largo de su distribución, condiciones importantes para analizar y entender la estructura y composición de las comunidades.
Los estudios sobre la diversidad de murciélagos se han centrado en definir los factores que determinan la estructura y composición de sus comunidades (Moreno y Halffter 2000; Kalko y Handley 2001; Stevens et al. 2004; Stoner 2005; Stevens y Amarilla-Stevens 2012). Uno de los principales ejes de análisis consiste en tratar de explicar la coexistencia de especies en escenarios de simpatría con base en la competencia (Arlettaz 1999; Ashrafi et al. 2011; Salsamendi et al. 2012; Emrich et al. 2014), donde se postula que la coexistencia se logra al evitar la competencia mediante la diferenciación del nicho realizado (Hutchinson 1959; MacArthur y Levins 1967).
El nicho realizado se ha diferenciado entre especies del orden Chiroptera en gran medida por la especialización de sus dietas en el eje trófico, donde podemos identificar diferentes gremios alimenticios (i. e., artropodívoros, frugívoros, nectarívoros, hematófagos y carnívoros; Denzinger y Hans-Ulrich 2013). Esta diferenciación del nicho trófico se manifiesta en la especialización de las estructuras alares, cuya variabilidad en forma y tamaño proporciona diferentes capacidades de vuelo entre especies (Norberg y Rayner 1987; Norberg et al. 1993; Mancina et al. 2012). Las variaciones en la estructura alar y el desempeño de vuelo están relacionadas con la especialización del alimento, lo que hace evidente la relación entre la morfología alar de las especies que pertenecen a diferentes nichos tróficos (Norberg et al. 1993; Norberg y Norberg 2012; Marinello y Bernard 2014; Furey y Racey 2016). Se ha observado que murciélagos con alas pequeñas y redondeadas generalmente son del gremio artropodívoro; aquellos con alas pequeñas y puntiagudas por lo general se asocian con el gremio nectarívoro, y las alas grandes y redondeadas a menudo corresponden a murciélagos frugívoros (Norberg y Rayner 1987; Norberg y Norberg 2012). Por otra parte, la masa y tamaño corporal de los murciélagos tiene un gran efecto en el desempeño de vuelo y selección de dieta. Murciélagos de talla grande y mayor peso se asocian a la selección de presas grandes, así como, a desempeños de vuelo poco maniobrables y ágiles (Barclay y Brigham 1991), y murciélagos con talla pequeña y masa corporal menor se asocian a selección de presas pequeñas y desempeños de vuelo ágiles y maniobrables (Aldridge y Rautenbach 1987; O’Neill y Taylor 1989).
Aunque la diferenciación morfológica alar entre especies que pertenecen a diferentes gremios alimenticios está bien establecida (Norberg y Rayner 1987; Moreno et al. 2006; Carvalho et al. 2013; Marinello y Bernard 2014), esta no se ha estudiado entre las especies que tienen tallas similares y comparten el mismo gremio alimenticio, como en el caso de las especies insectívoras de la comunidad de murciélagos cavernícolas neotropicales que pertenecen a las familias Mormoopidae y Natalidae. Podría suceder que, entre especies que comparten gremio alimenticio existan pocas o muy sutiles diferencias en la selección de alimento, y que debido a esto, no puedan ser relacionadas con la morfología alar. Sin embargo, es posible que la diferenciación en la selección de alimento entre especies que comparten un gremio alimenticio sea suficientemente distinta para ser relacionada con la morfología alar entre estas especies.
Por otra parte, las diferencias en la morfología alar proporcionan diferentes desempeños de vuelo (Swartz et al. 2003; Kalko et al. 2008; Mancina et al. 2012) y esta diferenciación separa las aerósferas de forraje entre las especies, ya que el espacio aéreo es un gradiente de complejidad estructural donde la morfología alar y el desempeño de vuelo de cada especie se ponen a prueba (Kalko y Handley 2001; Kalko et al. 2008; Carvalho et al. 2013). Sin embargo, este tipo de estudios aún son escasos para las especies neotropicales, y todavía más en especies neotropicales cavernícolas. Probablemente esto se deba a la dificultad para observar a estos individuos durante el vuelo en estas aerósferas estructuralmente complejas (Carvalho et al. 2013; Marinello y Bernard 2014). Una solución es emplear la ecomorfología, una herramienta de análisis con la que se puede inferir el desempeño de vuelo de las especies sin tener que observar a los individuos durante el vuelo (Norberg y Rayner 1987; Norberg et al. 1993; Norberg 2002).
La ecomorfología investiga la relación causal que existe entre los diferentes diseños estructurales de los individuos con el comportamiento y desempeño que tienen estos para explotar su hábitat (Norton 1995). Esta ciencia estipula que de manera multifactorial la forma y tamaño de las estructuras anatómicas determinan el desempeño funcional del organismo (Swartz 1991). Sin embargo, también toma en cuenta que las interacciones ecológicas del individuo localmente pueden alterar su desempeño funcional, dependiendo de las características del hábitat, recursos disponibles y condiciones. El análisis ecomorfológico puede considerar estructuras particulares de un organismo, así como, una caracterización completa o exhaustiva de todo un sistema estructural anatómico que expliquen las funciones ecológicas del individuo (Swartz et al. 2003). Por lo tanto, en el caso de los murciélagos, analizar el tamaño y la forma de las alas permite describir la capacidad de vuelo (agilidad y maniobrabilidad) de cada especie (Norberg y Rayner 1987; Norberg et al. 1993; Mancina et al. 2012). La agilidad consiste en la velocidad a la que puede iniciarse un giro o cambio de dirección, mientras que la maniobrabilidad se define como el espacio en el que se puede dar un giro a una velocidad específica (Norberg y Rayner 1987). Para medir la agilidad y maniobrabilidad es necesario tomar en cuenta la teoría de giro en vuelo (Norberg y Norberg 1971) que menciona, que un individuo debe de mantener en equilibrio tres fuerzas para realizar un giro, la fuerza de inercia provocada por el peso del animal en movimiento, el empuje del individuo provocado por la velocidad en la que realiza el giro y la fuerza lateral que contrarresta las dos fuerzas anteriores mediante el batido de las alas. El tamaño y la forma alar del murciélago delimita la cantidad de fuerza lateral que puede desarrollar, características como baja carga alar provocan que el murciélago genere la mayor fuerza lateral permitiendo estabilizar el giro. Por otra parte, se considera que un individuo ágil y maniobrable presenta, área alar grande, envergadura pequeña y relación de aspecto bajo, que le permiten al individuo contrarrestar la fuerza lateral de giro, girar en espacios pequeños y mayor resistencia al viento en la punta del ala, respectivamente (Norberg y Rayner 1987). Por lo tanto, es posible medir la agilidad y maniobrabilidad de los murciélagos comparando los valores de carga alar, relación de aspecto e índice de punta entre individuos.
La maniobrabilidad y agilidad están íntimamente relacionadas con la actividad de forraje de dos formas: el desempeño de vuelo delimita la aerósfera en la que un murciélago puede volar para obtener su alimento y condiciona su éxito al conseguir el alimento (Kalko y Handley 2001; Kalko et al. 2008; Mancina et al. 2012). Por lo tanto, al describir la agilidad y la maniobrabilidad y correlacionarlas con la dieta de cada especie, se pueden inferir de forma teórica las aerósferas que utilizan (Swartz et al. 2003; Kalko et al. 2008; Mancina et al. 2012). Las aérosferas de forraje que describen Kalko et al. (1996) se describen a través de la complejidad estructural aérea mediante la observación y captura de especies. Ellos mencionan que los espacios aéreos que utilizan los murciélagos para forrajear tienen dos características principales: espacios aéreos despejados y espacios aéreos desordenados, estos últimos hacen referencia al sotobosque y el borde de la vegetación.
Describir ensambles de especies por características de vuelo, zona de forraje y tipo de dieta nos permite definir cómo se establecen las comunidades a escala local, al entender los mecanismos de segregación espacial y trófica entre especies que pertenecen a diferentes gremios alimenticios (Marinello y Bernard 2014), y entre especies que pertenecen al mismo gremio alimenticio; por ejemplo, entre las especies de las familias Mormoopidae y Natalidae.
El objetivo de este trabajo es definir y proponer los ensambles de especies que integran una comunidad de murciélagos cavernícolas neotropicales con base en el desempeño de vuelo, la zona de forraje y el gremio alimenticio. Como hipótesis esperamos que existan diferentes ensambles dentro de la comunidad de murciélagos cavernícolas que se diferencien por sus desempeños de vuelo y dieta. Especies que dependen de vuelo activo para conseguir alimento como las especies artropodívoras, tendrán mayor desempeño de agilidad y maniobrabilidad durante el vuelo y explotarán aerósferas complejas. En contraparte, especies que no dependen del vuelo activo para conseguir alimento como las especies hematófagas o nectarívoras, tendrán desempeños de vuelo menos ágiles y maniobrables y explotarán aerósferas despejadas. Por último, esperaríamos que especies que comparten gremio alimenticio como los artropodívoros, tengan diferentes desempeños de vuelo debido a las preferencias en dieta y por lo tanto exploten distintas zonas de forraje.
Materiales y Métodos
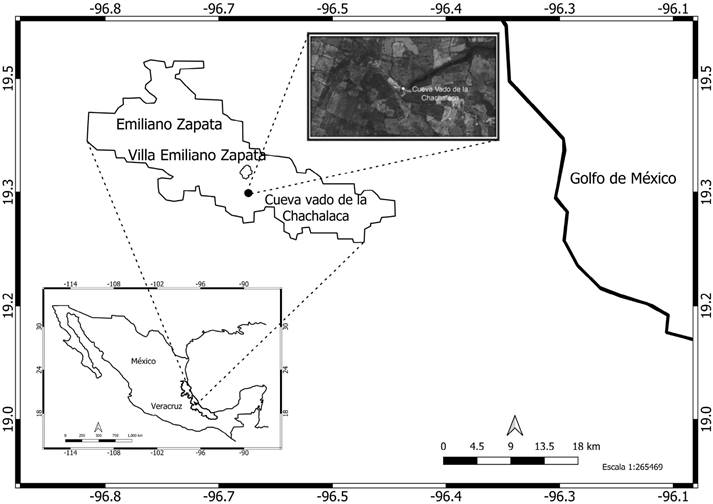
Área de estudio. Se estudió la comunidad de murciélagos de la cueva “El Vado de la Chachalaca” (19° 21’ 12.09” N; -96° 39’ 30.27” W, 449 msnm), localizada cerca de la población Villa de Emiliano Zapata, en el municipio de Emiliano Zapata, Veracruz, México (Figura 1). El tipo de vegetación original de la zona es el bosque tropical caducifolio (Rzedowski 2006); sin embargo, actualmente es un mosaico de vegetación compuesto por fragmentos de bosque secundario, relictos de bosque tropical caducifolio y áreas de actividad ganadera y agrícola. La vegetación circundante a la cueva corresponde principalmente a relictos de bosque tropical caducifolio (Figura 1). La temperatura y la precipitación anual promedio en la zona es de 25.2 °C y 2,779 mm, respectivamente. Las lluvias se registran de junio a septiembre con un período prolongado de secas en los meses restantes.
Captura de murciélagos y nota nomenclatural. Se realizaron colectas de una noche por mes durante un período de un año, desde el mes de marzo del 2016 a marzo del 2017. Para la captura de murciélagos se utilizaron trampas de arpa colocadas en la entrada de la cueva. Se estableció un tiempo de captura de tres horas a partir del ocaso. Durante la colecta, se contaron e identificaron todos los murciélagos capturados. La identificación se realizó mediante la clave de Medellín et al. (2008) para el uso de P. mesoamericanus seguimos a Pavan y Marroig (2016, 2017).
Gremios alimenticios. La descripción de la dieta de Mormoops megalophylla y Pteronotus mesoamericanus se realizó por análisis de contenidos estomacales. Se sacrificaron 15 hembras y 15 machos adultos de cada especie. A estos individuos se les extrajo el contenido estomacal e intestinal, los cuales fueron trasportados al laboratorio inmersos en una capa de hielo. En el laboratorio se analizaron los contenidos estomacales de M. megalophylla y P. mesoamericanus por separado. Los insectos presentes en el contenido estomacal se identificaron hasta el nivel de orden mediante los métodos de Whitaker et al. (1996, 2003).
Para definir la dieta de Natalus mexicanus se emplearon las identificaciones de insectos del contenido estomacal de 30 individuos adultos colectados por el grupo de investigación de marzo del 2003 a marzo del 2005. Los contenidos estomacales fueron extraídos y analizados en el laboratorio mediante el método antes descrito. Los individuos y contenidos estomacales pertenecen a una población de N. mexicanus localizada en el Estado de Colima, México (Torres-Flores y López Wilchis 2018).
Diphylla ecaudata y Desmodus rotundus se categorizaron en cuanto a su dieta como murciélagos hematófagos de aves y mamíferos, respectivamente, con base en información publicada por Ruschi (1951), Goodwin y Greenhall (1961), Estefano et al. (2015) e Ito et al. (2016). A Glossophaga soricina se le definió como una especie con dieta nectarívora según los datos de Sánchez y Álvarez (2000).
Para determinar los grupos de especies con mayor similitud entre sus dietas de acuerdo con la descripción de la dieta obtenida para cada especie, se realizó un análisis de similitud Bray-Curtis con el programa Past 3 (Hammer y Harper 2006).
Morfometría alar . Para calcular el área alar del antebrazo y la punta alar, así como el área total del ala (Gager et al. 2016), se realizó lo siguiente. Los individuos fueron inmovilizados de forma mecánica sobre una hoja de papel milimétrico donde se dibujó el contorno del ala. Posteriormente, se recortó cada porción alar en la hoja de papel y se calculó el área con base en el método para determinar áreas de polígonos irregulares de Jonckhere et al. (2004). Cada porción de papel milimétrico se pesó con una báscula electrónica digital (SCALE modelo 100g/0.01g); además, se pesó un área definida de 10 cm2 de la misma hoja de papel milimétrico. Por último, los valores de peso obtenidos en la báscula se usaron en la siguiente ecuación para calcular cada área AP = Pa x Am/Pam. Donde: AP es el área de la porción, Pa es el peso del área alar recortada, Am es el área conocida (10 cm2) y Pam es el peso del área conocida.
De igual manera, se midió la longitud del quinto dedo del ala derecha con un vernier, se pesó al individuo con una báscula electrónica (SCALE modelo 100g/0.01g) y con un escalímetro se midió la envergadura alar. Con los datos antes mencionados y las áreas de cada porción alar, se calculó la relación de aspecto, carga alar e índice de punta, siguiendo las ecuaciones propuestas por Moreno et al. (2006) y Gager et al. (2016) .
Con los datos obtenidos se realizaron comparaciones estadísticas con pruebas de hipótesis de t de Student con las variables de relación de aspecto y carga alar entre la comunidad aquí analizada y dos comunidades más, la primera de ellas compuesta de especies estrictamente cavernícolas (Torres-Flores y López-Wilchis 2018) y las segunda con especies principalmente insectívoras, pero no estrictamente cavernícolas (Furey y Racey 2016). Con estas comparaciones pretendemos identificar si es posible caracterizar la comunidad de murciélagos cavernícolas con respecto a sus características alares. Por otra parte, al considerar la hipótesis de que las especies son más ágiles y tienen mejor maniobrabilidad cuando presentan valores bajos en relación de aspecto y carga alar (Norberg y Rayner 1987), se decidió hacer una escala para cuantificar y clasificar los valores como bajos, medios y altos en función de estas variables. El intervalo estadístico de carga alar y la relación de aspecto de todas las especies encontradas en este estudio se dividieron en tres categorías. Con respecto a la carga alar, se consideró un valor alto cuando era mayor o igual al percentil 75 de la distribución, x ≥ 8.931 (Mg/S/Nm-2); un valor medio corresponde a la media estadística, 5.265 < x < 8.931 (Mg/S/Nm-2); y un valor bajo corresponde a valores iguales o menores al percentil 25, x ≤ 5.265 (Mg/S/Nm-2). Para la relación de aspecto se siguió la misma metodología, los valores, de alto a bajo, fueron los siguientes: A ≥ 6.496, 5.189 < A < 6.496 y A ≤ 5.189. Con base en este mismo criterio, se asignaron los valores altos, medios y bajos de relación de aspecto y carga alar entre los grupos de especies resultantes en el análisis de similitud por tipo de dieta y de forma inversamente proporcional, asignamos las categorías de agilidad y maniobrabilidad (baja, media y alta) para cada grupo.
Ensambles. Se realizó una ordenación multivariada mediante el método de análisis de correspondencia canónico (CCA, canonical correspondence analysis) con el programa Past 3 (Hammer y Harper 2006). Las variables categóricas fueron el tipo de dieta y las características alares de envergadura, índice de punta, carga alar y relación de aspecto. Con respecto a los datos de dieta se realizó lo siguiente. Para las especies M. megalophylla, N. mexicanus y P. mesoamericanus se usaron datos cuantitativos que representan partes de insectos en el contenido estomacal. Sin embargo, los datos cualitativos de dieta obtenidos por bibliografía para las especies D. rotundus, D. ecaudata y G. soricina fueron transformados a datos cuantitativos de la siguiente manera. A cada individuo se le asignó un valor aleatorio entre 1 y 10 dentro de su gremio alimenticio, sangre de mamíferos para D. rotundus, sangre de aves para D. ecudata y néctar para G. soricina. El valor obtenido por individuo fuera de su gremio alimenticio fue igual a 0.1. Por último, para normalizar los datos de partes de insectos y los valores atribuidos a los gremios hematófagos y nectarívoros, se transformaron los datos a escala logarítmica natural y se sumaron tres unidades para evitar números negativos, estos datos son los que se usaron para el análisis CCA. Los grupos resultantes del CCA son los ensambles que se proponen en esta investigación. Estos ensambles fueron nombrados de la siguiente forma: 1) nombre de la comunidad a la que pertenecen “murciélagos neotropicales cavernícolas”, 2) nombre del gremio alimenticio al que pertenecen (i. e., “artropodívoros”) y 3) aerósfera en la que desarrollan la actividad de forraje, (i. e., “sotobosque”).
Para el sacrificio de los murciélagos se emplearon las recomendaciones de Sikes et al. (2016) y se tomaron en cuenta los lineamientos éticos de la División de Ciencias Biológicas y de la Salud de la Universidad Autónoma Metropolitana-Iztapalapa (Anónimo 2010). Los permisos federales que avalan esta colecta son SGPA/DGVS Nos. 09131/14, 05853/13 y CC 08450/92.
Resultados
Se analizaron un total de 109 individuos que representan seis especies residentes permanentes en la cueva: Diphylla ecaudata (n = 9), Desmodus rotundus (n = 5), Glossophaga soricina (n = 5), Mormoops megalophylla (n = 30), Natalus mexicanus (n = 30) y Pteronotus mesoamericanus (n = 30). La proporción de gremios en la comunidad analizada es de 82.6 % de especies artropodívoras, 12.8 % de especies hematófagas y 4.6 % de especies nectarívoras. Las características alares para cada especie se observan en la Tabla 1.
Tabla 1 Características alares por especies, valores promedio y error estándar.
| Especie | Envergadura (S/m) | Área alar total (S/m2) | Relación de aspecto (A) | Carga alar (Mg/S/Nm-2) | índice de punta (I) | N |
|---|---|---|---|---|---|---|
| Dyphylla ecaudata | 0.373 ± 0.003 | 0.0010 ± 0.00004 | 5.927 ± 0.250 | 17.189 ± 0.511 | 0.7011 ± 0.031 | 9 |
| Desmodus rotundus | 0.365 ± 0.006 | 0.0011 ± 0.00006 | 6.210 ± 0.146 | 19.380 ± 1.001 | 0.784 ± 0.129 | 5 |
| Glossophaga soricina | 0.248 ± 0.005 | 0.0005 ± 0.00002 | 6.530 ± 0.224 | 11.968 ± 0.951 | 0.756 ± 0.275 | 5 |
| Mormoops megalophylla | 0.325 ± 0.003 | 0.0010 ± 0.00002 | 5.677 ± 0.209 | 7.438 ± 0.256 | 0.453 ± 0.035 | 30 |
| Natalus mexicanus | 0.263 ± 0.002 | 0.0006 ± 0.00002 | 5.998 ± 0.216 | 4.330 ± 0.185 | 0.203 ± 0.014 | 30 |
| Pteronotus mesoamericanus | 0.351 ± 0.002 | 0.0011 ± 0.00003 | 5.784 ± 0.193 | 7.146 ± 0.251 | 0.164 ± 0.008 | 30 |
Con respecto al tipo de dieta de los murciélagos presentes en la comunidad, detectamos cuatro grupos bien definidos (Figura 2) por el método de Bray Curtis (Bray y Curtis 1957), los cuales fueron discriminados principalmente por gremio alimenticio, como era de esperarse, diferenciando a los hematófagos (D. rotundus y D. ecaudata), nectarívoros (G. soricina) y artropodívoros (N. mexicanus, M. megalophylla y P. mesoamericanus). Sin embargo, en el gremio artropodívoro encontramos dos grupos definidos. El primer grupo lo componen únicamente individuos de N. mexicanus (Figura 2), el cual se denominó “Murciélagos con dieta de artrópodos no voladores”, ya que su principal fuente de alimento son opiliones, aunque también consumen insectos voladores como lepidópteros (Tabla 2). El segundo grupo, compuesto por M. megalophylla y P. mesoamericanus, se denominó “Murciélagos con dieta de artrópodos voladores”, ya que la principal fuente de alimento son lepidópteros, dípteros, tricópteros y hemípteros (Tabla 2). Los resultados de los contenidos estomacales analizados y la clasificación de alimento por especie se observa en la Tabla 2.
Tabla 2 Dieta por especie. Para especies insectívoras, los números representan la cantidad de partes de insectos encontradas. Los círculos indican el orden de mayor a menor cantidad de partes de insectos encontradas; los cuatro círculos son el orden más consumido. NP = no presente y P = presente.
| Dyphylla ecaudata | Desmodus rotundus | Glossophaga soricina | Mormoops megalophylla | Natalus mexicanus | Pteronotus mesoamericanus | |
|---|---|---|---|---|---|---|
| Lepidoptera | NP | NP | NP | 1515 °°°° | 940 °°° | 869 °°°° |
| Coleoptera | NP | NP | NP | 369 °°° | 580 | 281 °°° |
| Trichoptera | NP | NP | NP | 142 ° | NP | 187°° |
| Diptera | NP | NP | NP | 151 °° | 630 °° | 111 |
| Hemiptera | NP | NP | NP | 103 | NP | 127 ° |
| Ephemeroptera | NP | NP | NP | 26 | NP | 118 |
| Hymenoptera | NP | NP | NP | 6 | 30 ° | 12 |
| Aranae | NP | NP | NP | NP | 970 °°°° | NP |
| Sangre mamíferos | NP | P | NP | NP | NP | NP |
| Sangre aves | P | NP | NP | NP | NP | NP |
| Néctar | NP | NP | P | NP | NP | NP |
Sobre la caracterización morfométrica alar de la comunidad de murciélagos cavernícolas neotropicales encontramos que, al comparar las características de relación de aspecto y carga alar promedios de la comunidad analizada en este estudio respecto a una comunidad de murciélagos cavernícolas ubicada en el estado de Colima al oeste de México (Torres-Flores y López Wilchis 2018), no se encontraron diferencias significativas en los promedios de relación de aspecto ( = 5.88 A; t11 = −2.002; p = 0.071), y carga alar ( = 8.06 Mg/S/Nm−2; t11 = −1.990; p = 0.072). Cabe destacar que ambas comunidades son de murciélagos cavernícolas neotropicales; sin embargo, la composición de especies es diferente. Torres-Flores y López Wilchis (2018) reportan la presencia de P. davyi, P. personatus y Macrotus waterhousii, así como, la ausencia de D. rotundus y D. ecaudata. Por otra parte, observamos que no existen diferencias significativas para ambas variables relación de aspecto (t7 = -2.21; p = 0.077) y carga alar (t7 = -0.766; p = 0.477) al comparar nuestros datos con una comunidad dominada por organismos artropodívoros no estrictamente cavernícolas (Furey y Racey 2016). Con base en estas observaciones, podría decirse que las especies que integran la comunidad de murciélagos cavernícolas neotropicales tienen alas con forma y tamaño similar, probablemente dominadas por características alares de individuos artropodívoros. Las alas de las especies presentes en la comunidad de murciélagos cavernícolas neotropicales presentan valores promedio de relación de aspecto y carga alar de 5.99 ± 0.21 A y 7.28 ± 0.90 Mg/S/Nm-2, respectivamente.
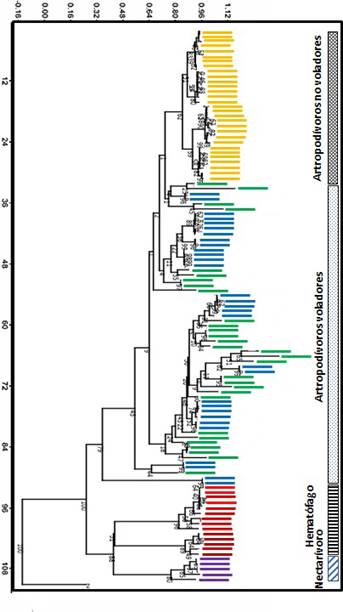
Figura 2 Agrupamiento de individuos por tipo de alimento mediante el método de Bray-Curtis. Código de colores: Amarillo N. mexicanus, verde M. megalophylla, azul P. mesoamericanus, rojo claro D. ecaudata, rojo intenso D. rotundus y Morado G. soricina.
Respecto al desempeño de vuelo de los cuatro grupos resultantes por selección de alimento en la comunidad se encontró lo siguiente. El primer grupo lo conforman individuos de las especies D. rotundus y D. ecaudata. Estas especies tienen el desempeño más bajo de agilidad y maniobrabilidad, ya que los promedios en relación de aspecto y carga alar de estas especies son los más altos entre todas las especies analizadas (Tabla 3). El segundo grupo está compuesto por individuos de N. mexicanus, que representan la especie con el mejor desempeño en maniobrabilidad y agilidad, al tener los valores más bajos en promedio de relación de aspecto y carga alar (Tabla 3). El tercer grupo lo componen individuos de las especies P. mesoamericanus y M. megalophylla, el promedio obtenido para los valores de relación de aspecto y carga alar (Tabla 3) representan un desempeño de agilidad y maniobrabilidad media de vuelo en comparación con los otros grupos. El último grupo lo conforman individuos de G. soricina, estos individuos comparten valores altos de carga alar con el grupo uno (11.968 Mg/S/Nm-2) y valores medios de relación de aspecto con el grupo tres (6.530 A), debido a esto los categorizamos como murciélagos con agilidad y maniobrabilidad media-baja (Tabla 3).
Tabla 3 Promedio y error estándar de las características alares por grupo.
| Grupo | Especie | Envergadura | Área alar total | Relación de aspecto | Carga alar | Índice de punta | Agilidad y maniobrabilidad |
|---|---|---|---|---|---|---|---|
| 1 | D. rotundus y D. ecaudata | 0.370 ± 0.003 | 0.001 ± 0.00004 | 6.027 ± 0.169 | 17.971 ± 0.546 | 0.730±0.048 | Baja |
| 2 | N. mexicanus | 0.263 ± 0.001 | 0.001 ± 0.00002 | 5.736 ± 0.216 | 4.378 ± 0.185 | 0.392±0.030 | Alta |
| 3 | M. megalophylla y P. mesoamericanus | 0.340 ± 0.003 | 0.001 ± 0.00001 | 5.628 ± 0.141 | 6.989 ± 0.179 | 0.546±0.054 | Media |
| 4 | G. soricina | 0.248 ± 0.005 | 0.001 ± 0.00002 | 6.530 ± 0.224 | 11.968 ± 0.951 | 0.756 ± 0.275 | Media-Baja |
Con el CCA se forman cuatro grupos definidos (Figura 3). Los primeros dos ejes del análisis explican el 99.89 % de la variación total. El eje 1 está definido por diferentes variables, dentro de tipo de alimento lo definen, aranae, hemiptera e hymenoptera y dentro de variables morfometricas los definen, carga alar, relación de aspecto e índice de punta. El eje 2 está definido por las variables de dieta, hemiptera, aranae y ephemeroptera y por la variable morfométrica envergadura. Existe concordancia entre el tipo de dieta de los individuos con respecto a las características alares. Los individuos hematófagos (D. rotundus y D. ecaudata) están asociados principalmente con una alta carga alar (Figura 3). Por el contrario, los individuos artropodívoros con predilección por artrópodos no voladores (N. mexicanus) son mayormente asociados con una baja carga alar (Figura 3). Los murciélagos que tienen mayor área total alar (M. megalophylla y P. mesoamericanus) se asocian con dietas artropodívoras con predilección por el consumo de lepidópteros, dípteros, tricópteros y hemípteros (Figura 3). Por último, los individuos con alta carga alar y media relación de aspecto se asocian con individuos nectarívoros (G. soricina; Figura 3). También se observan los cuatro grupos que representan los ensambles que se proponen en este trabajo, los cuales componen a la comunidad de murciélagos cavernícolas neotropicales (Figura 3).
Discusión
Composición de especies. Se han registrado aproximadamente 20 especies de murciélagos neotropicales en el área de estudio pertenecientes a familias Phyllostomidae, Natalidae y Mormoopidae (Moreno et al. 2006). Seis de estas especies son residentes permanentes en la cueva que se estudió. La diferencia entre el número de especies encontradas en la cueva respecto al total de especies registradas en el área se debe a que no todos los murciélagos del área son estrictamente cavernícolas. De las especies cavernícolas reportadas para esta zona por Moreno et al. (2006) no se registraron en la cueva a P. personatus y P. davyi. Una posible explicación es que hay más cavernas en la zona que albergan murciélagos donde se pueden refugiar estas especies. Por lo tanto, las seis especies que registramos representan una fracción de la comunidad de murciélagos cavernícolas presentes en el área de estudio.
La proporción de gremios alimenticios encontrada en este estudio difiere con lo reportado por García et al. (2015) para una comunidad de murciélagos neotropicales cavernícolas en Venezuela. Ellos reportan 16.6 % de artropodívoros, 16.6 % de hematófagos y 66.0 % de frugívoros. Por otra parte, en una comunidad de murciélagos cavernícolas neotropicales que se localiza en el estado de Colima, México, se reportó una proporción de gremios de 71.0 % de artropodívoros, 14.2 % nectarívoros y 14.2 % frugívoros (Torres-Flores y López-Wilchis 2018), que también difiere a lo encontrado en este estudio. Sin embargo, es importante destacar que el gremio artropodívoro es el predominante en la comunidad de murciélagos cavernícolas, y es representado principalmente por las especies de las familias Mormoopidae y Natalidae a lo largo de la región neotropical en México y en algunas zonas de Centroamérica (García et al. 2015; Torres-Flores y López-Wilchis 2018; Rodríguez-Durán 2020).
Características de vuelo de las especies neotropicales cavernícolas. Según los datos reportados por Norberg y Rayner (1987), el intervalo de dispersión estadístico de relación de aspecto y de carga alar en murciélagos abarca de 5.4 A a 11.1 A y de 4.1 Mg/S/Nm-2 a 35.7 Mg/S/Nm-2, respectivamente. Al comparar los promedios de relación de aspecto y carga alar obtenidos en la comunidad de murciélagos cavernícolas aquí analizada (Tabla 1) contra el intervalo de dispersión obtenido por Norberg y Rayner (1987), se observa que la comunidad de murciélagos cavernícolas neotropicales se ubica por debajo de la media en cada una de las variables. Se sabe que los valores bajos de relación de aspecto y carga alar generan mayor agilidad y maniobrabilidad en el vuelo y que se relacionan con vuelos en zonas estructuralmente complejas (Norberg y Rayner 1987; Norberg 2002; Mancina et al. 2012; Marinello y Bernard 2014). Por lo tanto, podemo decir que, las características alares que encontramos en las especies que componen la comunidad de murciélagos neotropicales cavernícolas en general son alas redondeadas y con baja carga alar, que favorecen un forraje activo durante el vuelo y su desarrollo en aerósferas estructuralmente complejas (Norberg y Norberg 2012), posiblemente estas características podrían estar determinadas en su mayoría por las características alares de las especies insectívoras, que como ya habíamos mencionado son el gremio predominante.
Definición de ensambles por características de vuelo, dieta y zona de forraje. En las características alares del cuarto grupo integrado por individuos de la especie G. soricina (Figura 3), se observa que tienen carga alar alta, lo que indica que necesitan bastante fuerza de sustentación para mantener el vuelo. Esto condiciona el vuelo a velocidades bajas, ya que, al disminuir la velocidad, se pierde fuerza de sustentación (Mancina et al. 2012). Por otra parte, presentan alta relación de aspecto, lo que indica que no pueden hacer cambios de dirección dentro de espacios reducidos (Findley et al. 1972), pues al intentarlo tendrían que disminuir la velocidad y, por lo tanto, perder la sustentación de vuelo. Además, debido a los valores de relación de aspecto e índice de punta que presentan, pueden volar con rapidez con poco desgaste energético, gracias a que tienen un menor arrastre del viento (Hedenströ y Johansson 2015).
Con base en las características alares antes mencionadas, se considera que este grupo de individuos tiene agilidad y maniobrabilidad media-baja en comparación con los otros grupos (Tabla 3; Figura 3). Teóricamente, los individuos de G. soricina debería evitar vuelos en aerósferas estructuralmente complejas que requieran giros o maniobras frecuentes y repentinas, por ejemplo, al interior del sotobosque. Sin embargo, esta especie se ha encontrado de forma natural en aerósferas estructuralmente complejas. Kalko et al. (2008) clasifican a G. soricina como un murciélago que vuela principalmente en espacios estrechos haciendo referencia a la aerósfera dentro del sotobosque. Por otra parte, Carvalho et al. (2013) lo describen como un murciélago que vuela principalmente alrededor del dosel. Tomando en cuenta el desempeño de vuelo que presenta esta especie, se podría decir que los espacios aéreos despejados le son más favorables, aunque tienen la facultad de desarrollar su vuelo en el interior del sotobosque, así como alrededor del dosel.
Con respecto a la dieta de G. soricinaSánchez y Álvarez (2000) mencionan que cerca del 80 % de su dieta se compone del néctar producido por Mastichodendron sp., Cordia alliodora, Ceiba pentandra, Crescentia alata, Pseudobombax ellipticum, Ipomoea sp., Mucuna sp., Combretum farinosum, Agave sp. y Stenocereus sp., plantas que forman parte de dos estratos arbóreos: el sotobosque y el dosel. Por lo anterior, se puede deducir que el desempeño de vuelo de esta especie se favorece en aerósferas estructuralmente no complejas, aunque acostumbra volar entre estos dos estratos arbóreos, uno de ellos complejo, para conseguir su alimento (Norberg et al. 1993; Marinello y Bernard 2014). Por último, se ha reportado que G. sorcina puede introducir en su dieta algunos insectos como lepidopteros, dipteros y coleopteros cuando escasea la producción de néctar, efecto que sucede principalmente en ecosistemas estacionales (Howell 1974; Clare et al. 2011). Esta conducta alterna entre nectarívoro y artropodívoro en la dieta de G. soricina puede explicar que ocupe de forma alterna las aeróferas de sotobosque y dosel, concordando con su desempeño de vuelo y características alares.
Tomando en consideración las características de vuelo, zona de forraje y dieta de este grupo, representado por G. soricina, se propone el ensamble denominado “Murciélagos neotropicales cavernícolas nectarívoros de vuelo facultativo” (Figura 3). Algunas especies que podrían agregarse a este ensamble, y que no encontramos en la comunidad que se analizó, son aquellas que pertenecen a la subfamilia Glossophaginae y el género Leptonycteris.
El grupo uno integra las características alares y de desempeño de vuelo de los individuos de Desmodus rotundus y Diphylla ecaudata. Este grupo tiene el valor más alto de carga alar y el segundo valor más alto en relación de aspecto de entre todos los demás grupos (Tabla 3; Figura 3), lo que indica que necesitan mucha fuerza de sustentación para sostener el vuelo y, además, no pueden girar a alta velocidad ni en espacios reducidos. Sin embargo, estas especies son las que tienen menos arrastre del viento, lo que les permite volar distancias más grandes en áreas despejadas (Hedenströ y Johansson 2015). Tomando en cuenta estas características, son las especies menos ágiles y maniobrables en comparación con el resto de las especies de la comunidad. Estas especies teóricamente deberían de volar en aerósferas con poca complejidad estructural, espacios que están relacionados con la periferia del dosel y senderos despejados a través de la vegetación. Sin embargo, Kalko et al. (2008) y Carvalho et al. (2013) coinciden en que D. rotundus vuela dentro del sotobosque, lo que no es compatible con la inferencia teórica del desempeño de vuelo que nosotros describimos. Por otra parte, Carvalho et al. (2013) registraron que D. ecaudata vuela a la altura del dosel, lo que concuerda con lo que se describe en este estudio. A pesar de que las características alares de estos murciélagos, en teoría, favorecen el vuelo en aerósfereas estructuralmente no complejas según los datos de este estudio, estas especies suelen volar dentro del espacio aéreo del sotobosque. Una posible explicación a esta contradicción es que estas especies vuelan en el espacio aéreo del sotobosque por resguardo o protección de depredadores (Sánchez-Hernández et al. 2006). Otro aspecto a considerar es que las capacidades de vuelo de ambas especies no están altamente relacionadas con la actividad de forraje, ya que consumen su alimento posados en su presa.
Con respecto a la dieta de estas especies, D. ecaudata tiene un tipo de alimentación especialista, consume principalmente sangre fresca proveniente de aves (Uieda 1996; Ito et al. 2016). Cuando hay escasez de este alimento, se pueden alimentar ocasionalmente de sangre fresca de mamíferos como porcinos, ovinos, equinos e incluso de humanos (Ruschi 1951; Ito et al. 2016). Por otra parte, D. rotundus no es especialista en su dieta y se puede alimentar de sangre de reptiles, mamíferos y aves (Goodwin y Greenhall 1961; Estefano et al. 2015). Por lo tanto, en la actualidad, los recursos alimenticios de estas especies están principalmente confinados a corrales o encierros (Estefano et al. 2015), y las conductas de vuelo están más relacionadas con el desplazamiento hacia estos encierros y no para el forraje activo durante el vuelo. Por lo anterior, se sugiere que las características alares que presentan son más favorables para desplazarse distancias grandes con poco desgaste energético (Sánchez- Hernández et al. 2006) en lugares semiabiertos, y así llegar a presas silvestres o a los encierros donde están las principales fuentes de alimento.
Tomando en consideración las características de vuelo, zona de forraje y dieta de este grupo, el cual es representado por las características de los individuos de D. rotundus y D. ecaudata, se propone el ensamble “Murciélagos neotropicales cavernícolas hematófagos de áreas semiabiertas” (Figura 3). Se optó por el término semiabierto porque a pesar de que este grupo de individuos es el más apto para volar en lugares abiertos con poca complejidad estructural, aún pertenecen a la comunidad de murciélagos cavernícolas neotropicales que, como ya se habíamos mencionado, son especies que se desarrollan en sotobosque, dosel y subdosel. La única especie que podría incluirse en este ensamble es D. youngi.
El grupo tres que integra las características alares y desempeño de vuelo de los individuos de M. megalophylla y P. mesoamericanus presenta carga alar media y relación de aspecto alto en comparación con las demás especies de la comunidad (Tabla 3). La relación de aspecto alta no les permite hacer cambios de dirección dentro de espacios pequeños a velocidades altas. Sin embargo, sí pueden realizar giros en espacios reducidos, ya que los valores medios de carga alar les permiten disminuir la velocidad sin perder sustentación, de tal forma que logran hacer giros al reducir su velocidad (Mancina et al. 2012). Por otra parte, en comparación con los dos primeros grupos definidos en esta investigación, estos son individuos que no pueden recorrer grandes distancias, ya que tienen mayor arrastre con el viento, lo que generaría mayor desgaste energético (Hedenströ y Johansson 2015). Esta misma condición hace que tengan menor velocidad de vuelo en comparación con los dos grupos antes descritos (Hopkins et al. 2003). Este grupo de individuos se clasificó con maniobrabilidad y agilidad media. En teoría, deberían evitar lugares que demanden alta agilidad y maniobrabilidad (Marinello y Bernard 2014). Sin embargo, pueden disminuir su velocidad y girar en espacios pequeños lo que les permite volar en aerósferas medianamente complejas. Según los datos de este trabajo, se podría inferir que las zonas de vuelo de estos individuos están relacionadas con bordes de vegetación, lugares semiabiertos e, inclusive, el interior del sotobosque. Esto concuerda con lo reportado por Kalko et al. (2008) y Queiroz de Oliveira et al. (2015) quienes registraron que P. mesoamericanus vuela alrededor e interior del sotobosque. También coincide con lo reportado para M. megalophylla que se encuentra principalmente volando por encima de arroyos y cuerpos de agua ubicados entre la vegetación (Rezsutek y Cameron 1993).
Con respecto a la dieta, los resultados indican que P. mesoamericanus consume principalmente lepidópteros, coleópteros y dípteros (Tabla 2). Esta composición de alimento se ha observado a lo largo de la distribución de P. mesoamericanus (Emrich et al. 2014; Salinas-Ramos et al. 2015). Por otra parte, también se observó que M. megalophylla presenta una dieta muy similar a la de P. mesoamericanus, al alimentarse principalmente de lepidópteros, coleópteros y dípteros (Tabla 2). Esta composición concuerda con lo reportado por Rezutek y Cameron (1999) y Boada et al. (2003), con la diferencia de que ellos reportan el orden dermóptera, que no se identificó en este estudio. Sin embargo, se encontró que M. megalophylla también se puede alimentar de hemípteros, himenópteros y efemerópteros (Tabla 2).
Se observó que entre M. megalophylla y P. mesoamericanus existe una amplia sobreposición de nicho trófico. En la revisión bibliográfica no se encontró este patrón descrito para estas dos especies; sin embargo, se ha reportado sobreposicion de nicho trófico entre M. blainvillei y P. quadridens, especies filogenéticamente emparentadas con M. megalophylla y P. mesoamericanus, respectivamente (Rolfe y Kurta 2012; Rolfe et al. 2014), además de que la composición de alimento que ellos reportan es muy similar con lo encontrado en nuestros resultados. Se puede decir que entre M. megalophylla y P. mesoamericanus muy probablemente no exista diferenciación de nicho trófico. Los principales componentes de la dieta de M. megalophylla y P. mesoamericanus se encuentran en áreas de pastizales, sotobosque y áreas cercanas a cuerpos de agua (MacSwiney et al. 2009). Por lo tanto, el requerimiento alimenticio de ambas especies se ubica dentro y alrededor del sotobosque, donde su desempeño de vuelo es óptimo.
Tomando en consideración las características de vuelo, zona de forraje y dieta de este grupo, representado por las características de P. mesoamericanus y M. megalophylla, proponemos el ensamble denominado “Murciélagos neotropicales cavernícolas artropodívoros de vuelo facultativo” (Figura 3). Se optó por el término “facultativo” porque estas especies pueden volar entre aerósferas complejas, como el sotobosque, y areósferas semidespejadas, como el dosel o los senderos. La facultad de volar entre el sotobosque y el dosel para conseguir el alimento podría permitir la sobreposición de su nicho trófico al disminuir la competencia entre ambas especies de forma espacial; mientras que una puede realizar su actividad de forraje en el dosel, la otra lo realiza en el sotobosque o viceversa. Este fenómeno ya se ha reportado para otras especies de murciélagos del género Myotis (Krüger et al. 2014). Algunas especies que podrían pertenecer a este ensamble por sus requerimientos alimenticios y características alares son P. davyi, P. gymnonotus, P. personatus, P. quadridens y M. blainvilli.
El grupo dos, formado por las características alares y desempeño de vuelo de los individuos que representan a la especie N. mexicanus, tiene carga alar media y relación de aspecto bajo (Tabla 3). Esta especie necesita la menor fuerza de sustentación en comparación con las especies anteriores. La baja carga alar le permite reducir la velocidad sin perder sustentación durante el vuelo, y la relación de aspecto medio le permite hacer giros o variaciones de dirección en espacios pequeños sin tener que reducir la velocidad (Mancina et al. 2012). Estas características permiten considerar a N. mexicanus como un murciélago muy ágil y maniobrable en comparación con las demás especies de esta comunidad. Sin embargo, es la especie que genera el mayor arrastre de viento, lo que le impide volar distancias grandes, así como a velocidades altas (Hedenströ y Johansson 2015). Las características alares de esta especie sugieren que puede volar en lugares donde se requieran cambios de dirección, giros y alteraciones de velocidad frecuentes, características relacionadas con aerósferas estructuralmente complejas; por ejemplo, al interior del sotobosque (Kalko y Handley 2001; Kalko et al. 2008).
Con respecto a la dieta de N. mexicanus, según los datos, el 32 % de lo que consume son organismos del orden Araneae (Tabla 2). Es posible que también utilice lepidópteros como segunda fuente de alimento, que representa 30 % de la dieta, y dípteros, coleópteros e himenópteros, que en conjunto representan cerca del 38 % restante de su dieta (Tabla 3). Esto discrepa de lo encontrado por Torres-Flores y López Wilchis (2018), quienes reportan que el 70 % de la dieta de N. mexicanus se compone de organismos del género Araneae, y el 30 % restante son lepidópteros y dípteros. Sin embargo, es evidente que la principal fuente de alimento son los organismos del orden Opiliones.
El área de forraje de N. mexicanus está delimitada por la localización de su principal fuente de alimento: los opiliónidos, que se localizan generalmente entre rocas, hojas, ramas y suelo dentro del sotobosque (Acosta et al. 2007). Podría decirse que tanto las características alares del murciélago como la distribución de su principal alimento delimitan la zona de forraje de N. mexicanus al interior del sotobosque de forma exclusiva.
Tomando en consideración las características de vuelo, zona de forraje y dieta de este grupo, el cual es representado por las características de los individuos de N. mexicanus, se propone el ensamble denominado “Murciélagos neotropicales cavernícolas artropodívoros de sotobosque” (Figura 3). Dentro del listado de características alares de Norberg y Rayner (1987) no existe otro murciélago neotropical con estas características; sin embargo, pueden integrar este ensamble otras especies de la familia Natalidae que se distribuyen en el centro y sur de América como Natalus major, N. primus, N. stramineus, N. tumidirostris y N. brevimanus.
Mediante la descripción de estos ensamblajes es posible decir que la coexistencia entre las especies de las familias Natalidae y Mormoopidae está mayormente relacionada con la diferenciación de la zona de forraje más que con la diferenciación de nicho trófico (Figura 3). Estas especies podrían disminuir la competencia al realizar las actividades de forraje en dos aerósferas distintas. N. mexicanus comparte recursos alimenticios con P. mesoamericanus y M. megalophylla. Sin embargo, N. mexicanus realiza sus actividades de forraje principalmente en aerósferas complejas como el sotobosque, mientas que P. mesoamericanus y M. megalophylla pueden buscar su alimento tanto en el sotobosque como en zonas semidespejadas o a la altura del dosel. Diferenciar el área de forraje puede disminuir la competencia a escala local y permitir la coexistencia entre estas familias.
La comunidad de murciélagos cavernícolas neotropicales se puede caracterizar por tener valores de relación de aspecto y carga alar bajos, los cuales hacen que estas especies tengan capacidades para volar en aerósferas que demandan alta maniobrabilidad y agilidad de vuelo, en comparación con otras especies del orden Chiroptera. Estas características parecen estar relacionadas con murciélagos con hábitos artropodívoros más que con la composición de especies de la comunidad, esto puede ser debido a que el gremio predominante en la comunidad es el gremio artropodívoro.
Correlacionar las características alares, composición alimenticia y zona de forraje permite definir de forma óptima ensambles dentro de una comunidad de murciélagos. Además, con respecto a nuestra hipótesis, se encontró que especies que comparten un gremio alimenticio aún tienen diferencias en la composición de alimento, las cuales se manifiestan en las estructuras alares, generando diferentes desempeños de vuelo, y por lo tanto entre estas especies se pueden observar diferencias en las aerósferas de forraje. Dentro de la comunidad de murciélagos neotropicales cavernícolas se lograron definir cuatro ensambles que distinguen las aerósferas que emplean los murciélagos para la actividad de forraje en tres zonas diferentes dentro y alrededor del sotobosque. La primera corresponde al interior del sotobosque, la segunda se compone de murciélagos que pueden volar de forma facultativa entre el sotobosque y lugares semiabiertos y, por último, murciélagos que vuelan en lugares semiabiertos, ya sea alrededor del dosel o en senderos. Existen otras especies que pueden pertenecer a estos ensambles o existir ensambles que no se pudieron identificar debido a la cantidad de especies que se analizan en este trabajo. Sin embargo, se abre la puerta a nuevas investigaciones para identificar nuevos ensambles o identificar otras especies dentro de los ensambles aquí propuestos.
Por último, se logró reconocer la diferenciación que existe en las zonas de forraje entre las especies que representan a las familias Mormoopidae y Natalidae, que podría ser el mecanismo que utilizan estas especies para disminuir la competencia que produce la superposición de nicho trófico a escala local.











 nova página do texto(beta)
nova página do texto(beta)