Introducción
El acelerado crecimiento demográfico durante este siglo ha dado como resultado la expansión y generación de nuevas zonas urbanas, que a su vez han modificado y fragmentado los paisajes naturales (Noss 1994; Aguilar et al. 2000). Dicha problemática ocasiona una extinción local o regional de especies (Kirkpatrick y Jarne 2000) y, en algunos casos, ha obligado a que las poblaciones animales que dependen de áreas conservadas se desplacen y concentren en los relictos de vegetación que aún permanecen intactos (Laurance y Yensen 1991; Tilman et al. 1994). La zona costera noroccidental de la Península de Yucatán es un ejemplo de estas áreas bien conservadas donde, en los últimos años, se han obtenido nuevos registros. Tal es el caso de especies como Tayassu pecari, Sarcoramphus papa, Crax rubra, Penelope purpurascens, entre otras, que se creían extirpadas o sin evidencia documentada de su presencia en ecosistemas costeros (Hidalgo-Mihart y Contreras-Moreno 2012; Hidalgo-Mihart et al. 2012; Hernández-Pérez et al. 2014). Es probable que la eliminación de las selvas de la península de Yucatán haya restringido la distribución de muchas especies hacia la costa, donde aún existen áreas aisladas de vegetación nativa en buen estado de conservación (Hernández-Pérez et al. 2014).
La zona costera del noroccidente de la Península de Yucatán se caracteriza por la presencia de gran diversidad de ecosistemas como, los manglares, dunas costeras, marismas, lagunas costeras, pastizales, sabanas, selvas medianas y petenes (Durán et al. 2010). Todos ellos fungen como hábitats críticos para una gran diversidad de especies mastofaunísticas de la región. Dicha zona está conformada por una serie de áreas protegidas decretadas a lo largo de la costa, lo que la convirte en un corredor biológico de suma importancia para conservar la biodiversidad en México (Acosta-Lugo et al. 2010). En el ámbito internacional, el Fondo Mundial para la Naturaleza (WWF, por sus siglas en Inglés) considera esta región como prioritaria y la denomina "Manglares de los Petenes" (Acosta-Lugo et al. 2010). De igual forma, en el ámbito nacional la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) la ha enlistado como zona prioritaria "Anillo de Cenotes". Asimismo, se trata de un Área de Importancia para la Conservación de las aves (AICA; Acosta-Lugo et al. 2010).
Uno de los ecosistemas únicos de la zona costera de la Península de Yucatán (solo compartidos con la Península de Florida en EE.UU y con la Isla de Cuba) son los petenes (Trejo-Torres et al. 1993). Los petenes se consideran pequeñas "islas" de vegetación arbórea, principalmente de selva mediana perennifolia, subperennifolia y de manglar, inmersas en medio de amplias zonas inundables de tipo pantanoso conocidas como "marismas" donde predominan los pastizales o mangles enanos. Por lo general, en el centro de cada petén afloran manantiales de agua dulce (Barrera 1982; Rico-Gray 1982). De distribución restringida y con característica de frágiles debido a que pueden alterarse con pequeños cambios en los flujos hídricos, los petenes son uno de los ecosistemas menos conocidos y estudiados biológicamente (Vince et al. 1989; Acosta-Lugo et al. 2010 a). Los pocos estudios sobre la mastofauna general asociada a estos ecosistemas provienen de la Península de Florida en EE.UU. Los cuales demuestran que se trata de un ecosistema biodiverso, en el cual hay más de 30 especies de mamíferos, principalmente roedores y murciélagos (Vince et al. 1989; Oak Hammock Marsh 2012). En México, solo se ha realizado un par de estudios sobre murciélagos en estos hábitats (León y Montiel 2006; Montiel et al. 2006). El complicado acceso a los petenes y la baja observación a causa de lo intrincado de la vegetación, son factores que dificultan la realización de estudios sobre la ecología de la mastofauna en este tipo de hábitat.
Los petenes se hallan inmersos en selvas de manglares, concentran gran cobertura vegetal, mantienen fuentes permanentes de agua dulce y, aunado a su intrincado acceso, podrían estar siendo utilizados como refugio por diversas especies de mamíferos que habitan el sur de México. Por ello, es de suma importancia contar con información sobre la diversidad de mamíferos asociados a los petenes, así como conocer su estado de conservación y sus patrones de actividad, a fin de entender la dinámica y la estructura de dicho ecosistema, y establecer acciones para conservarlo. Los objetivos de este trabajo fueron conocer la diversidad, abundancia relativa y patrones de actividad de los mamíferos de talla mediana y grande asociados a los petenes de la costa noroeste de la Península de Yucatán, utilizando la técnica de fototrampeo.
Materiales y métodos
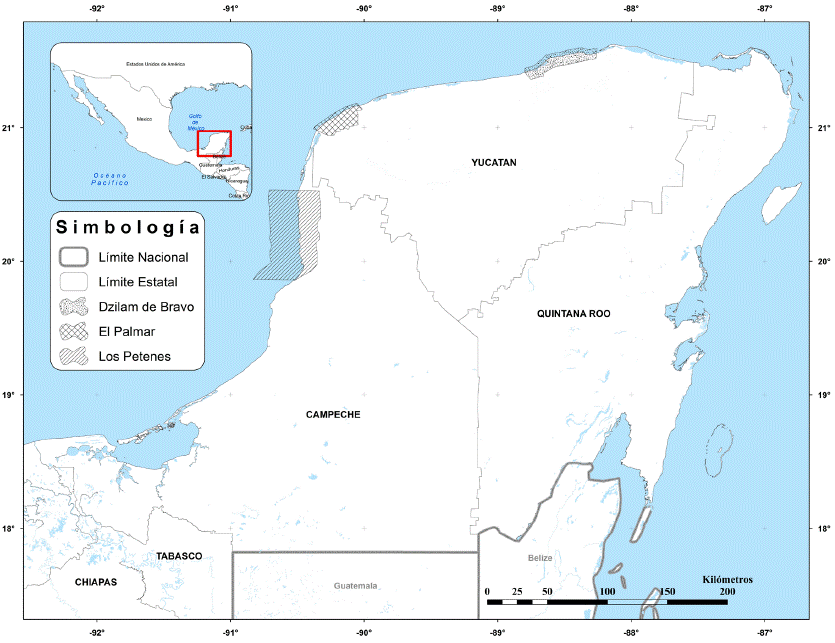
Área de estudio. La investigación se realizó en ocho petenes de tres áreas naturales protegidas (ANP), localizadas en la costa noroeste de la Península de Yucatán: La Reserva de la Biosfera Los Petenes (RBLP), en el Estado de Campeche, y las Reservas Estatales El Palmar (REEP) y Dzilam (RED), en Yucatán (Figura 1). El clima predominante varía entre cálido subhúmedo con lluvias en verano (Aw), y semiseco y seco cálido (BS'hw; García 1988). La temperatura media anual oscila entre 26.1 a 27.9 ºC y la precipitación media anual varía de 600 a 1,272.8 mm (García 1988; Seduma 2006; Chablé-Santos 2009). Los suelos predominantes en los petenes son el gleysol mólico, el solonchak órtico y el regosól calcárico (Tun-Dzul et al. 2006). El sistema hidrográfico es alimentado por la surgencia del manto freático a manera de manantial, que brota dentro de un medio palustre (Trejo-Torres et al. 1993).
Los elementos arbóreos predominantes en los petenes son zapote (Manilkara zapota), chechem negro (Metopium brownei) y mangle blanco (Laguncularia racemosa). Estas especies miden aproximadas entre 15 a 25 m. También hay abundante presencia de especies arbustivas, como el hulub (Bravaisia berlandieriana), palmas de huano (Sabal yapa) y helechos (Acrostichum aureum; Acosta-Lugo et al. 2010b).
Fototrampeo. Se llevaron a cabo dos periodos de fototrampeo. El primero, del 31 de agosto al 18 de octubre, durante la época de lluvias de 2013; se instaló 14 trampas-cámara. El segundo se realizó en la época de secas, del 13 diciembre de 2013 al 11 de junio de 2014; se instaló seis trampas-cámara. Se utilizaron equipos de la marca Reconyx(r) PC800 Professional (www.reconyx.com) que toman imágenes de alta calidad, no poseen flash o luz blanca que podría interferir en el comportamiento de algunas especies, y además poseen el retraso de disparo más corto que cualquier otro equipo similar (0.2 s).
Las estaciones de fototrampeo fueron instaladas, de manera no sistematizada, en árboles que fructificaban y en lugares con indicios de fauna (huellas, rascaderos, frutos comidos) cercanos a cuerpos de agua. En cada estación, se instaló una trampa-cámara sujeta a un árbol a una altura no mayor a 0.5 m del suelo; siempre se buscó colocarlas en lugares planos para obtener mejores fotografías. Las cámaras fueron programadas para tomar series de tres fotografías por detección de evento y estuvieron activas durante las 24 h del día. Cada estación de fototrampeo fue referenciada con un GPS marca Garmin(r) modelo 62s y revisada una vez al mes para constatar que el funcionamiento de la cámara y las baterías fueran los adecuados, y a su vez para almacenar la información capturada y vaciar su memoria.
Se obtuvo el esfuerzo de muestreo multiplicando el número total de cámaras trampa empleadas por el total de días de muestreo (Medellín et al. 2006; Lira-Torres y Briones-Salas 2012). Para obtener el índice de abundancia relativa por especie (IAR), se utilizó la formula sugerida por Lira-Torres y Briones-Salas (2012): IAR = C/EM*1000 trampas-noche, donde C = Capturas o eventos independientes fotografiados, EM = Esfuerzo de Muestreo (núm. de cámaras trampa por días de monitoreo) y 1000 días-trampa = (unidad estándar).
Para evitar sobre estimaciones, se consideró en los análisis solo registros independientes. Un registro independiente fue considerado como una sola fotografía de la especie cada 24 h. En caso que en la fotografía se distinguiera más de un individuo, o de que en subsecuentes fotografías se pudiera distinguir a diferentes individuos, entonces cada uno de estos fue considerado como un registro independiente.
Patrones de actividad. Se determinó el patrón de actividad de aquellas especies que presentaron al menos 10 registros independientes. Los fotografías fueron ordenadas por intervalos de una hora y se agruparon en tres unidades: a) diurnos, cuando en las fotografías se observaba luz solar; b) nocturnos, cuando no se observaba luz solar; c) crepusculares, cuando las fotografías se obtuvieron al amanecer (6:00-8:00 h) o al atardecer (18:00-20:00 h; Monroy-Vilchis et al. 2011; Lira-Torres y Briones-Salas 2012).
Resultados
Esfuerzo y Diversidad. El esfuerzo de muestreo en conjunto para ambas temporadas (lluvia y seca) fue de 3,284 trampas noche. Se obtuvo un total de 700 registros independientes de 16 especies de mamíferos, pertenecientes a seis Ordenes, 12 Familias y 15 géneros. Carnívora fue el Orden mejor representado, con cuatro Familias y seis especies registradas (Tabla 1).
Tabla 1 TFI: Total de fotografías independientes; IARt: Índice de abundancia relativa total. NOM-059: Clasificación del estado de conservación de acuerdo a la norma mexicana, P = en peligro, A = amenazada y Pr = protección especial. UICN: Estado de conservación de acuerdo a la lista roja de especies amenazadas de la Unión Internacional para la Conservación de la Naturaleza, EN = en peligro, VU = vulnerable y NT = casi amenazado. Llva = Lluvias.
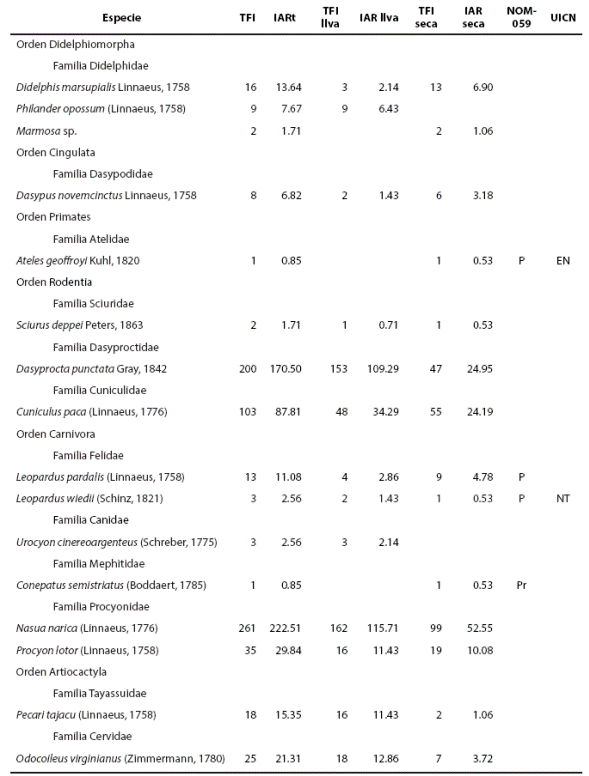
Durante la temporada de lluvias, el esfuerzo de muestreo fue de 1,400 trampas noche. Se obtuvo 437 registros independientes. Se registraron 13 especies, correspondientes a cinco Ordenes, 10 Familias y 12 géneros. En la temporada seca, el esfuerzo de muestreo fue de 1,884 trampas noche. Se obtuvo 263 registros independientes de 14 especies pertenecientes a seis Ordenes, 11 Familias y 13 géneros (Tabla 1).
Abundancia relativa. Las especies más abundantes para ambos periodos fueron Nasua narica (IAR = 222.5, n = 261), Dasyprocta punctata (IAR = 170.5, n = 200), Cuniculus paca (IAR = 87.8, n = 103) y Procyon lotor (IAR = 29.8, n = 35). En cambio, las menos abundantes fueron Ateles geoffroyi y Conepatus semistriatus (IAR = 0.8, n = 1; Tabla 1; Fig. 2).
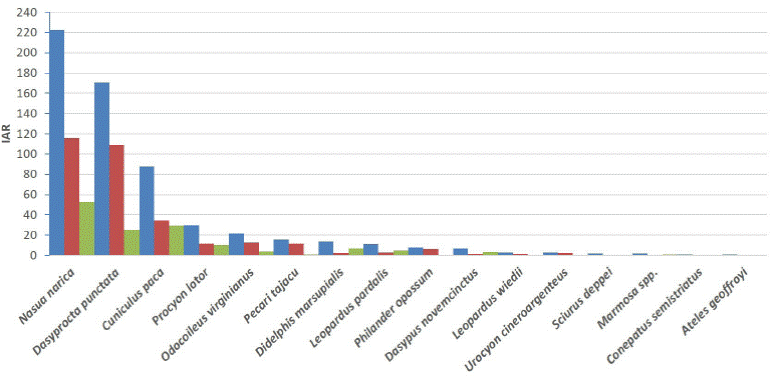
Figura 2 Índices de abundancia relativa (IAR) de las especies de mamíferos de talla mediana y grande registradas en petenes de la costa noroeste de la Península de Yucatán. En azul se muestra el IAR total para ambas temporadas, en rojo el IAR para la temporada de lluvias y en verde para la temporada de seca.
En la temporada de lluvias, las especies más abundantes fueron N. narica (IAR = 115.71, n = 162), D. punctata (IAR = 109.29, n =153) y C. paca (IAR = 34.29, n= 48). En contraste, las menos abundantes fueron Leopardus wiedii, Dasypus novemcinctus (IAR = 1.43, n = 2) y Sciurus deppei (IAR = 0.71, n = 1). En la temporada seca las especies más abundantes fueron, N. narica (IAR = 52.55, n = 99), C. paca (IAR = 29.19, n = 55) y Dasyprocta punctata (IAR = 24.95, n =47). Por el contrario, las menos abundantes fueron L. wiedii, C. semistriatus y S. deppei (IAR = 0.53, n = 1; Tabla 1; Fig. 2).
Patrones de actividad. Se determinó el patrón de actividad para 10 de las 16 especies registradas. Se obtuvo cuatro patrones: Diurno/Nocturno/Crepuscular (24 h), Crepuscular/Nocturno, Crepuscular/Diurno y Nocturno. 30 % de las especies se registraron como Crepusculares/Nocturnas, mientras que 20 % dedicaron tiempo a sus actividades durante la noche (Nocturnas), y 20 % se muestran con actividad Crepuscular/Diurna. Por su parte, el restante 30 % no mostró tendencia hacia algún patrón u horario en particular, es decir fueron activas tanto de día como de noche (Diurno/Nocturno/Crepuscular; Tabla 2; Fig. 3).
Tabla 2 Patrones de actividad de las especies de mamíferos medianos y grandes registrados en petenes de la costa noroeste de la Península de Yucatán, México. NRI: Número de registros independientes: Horario = H; Picos de actividad = PiA; Patrón de actividad = PaA.
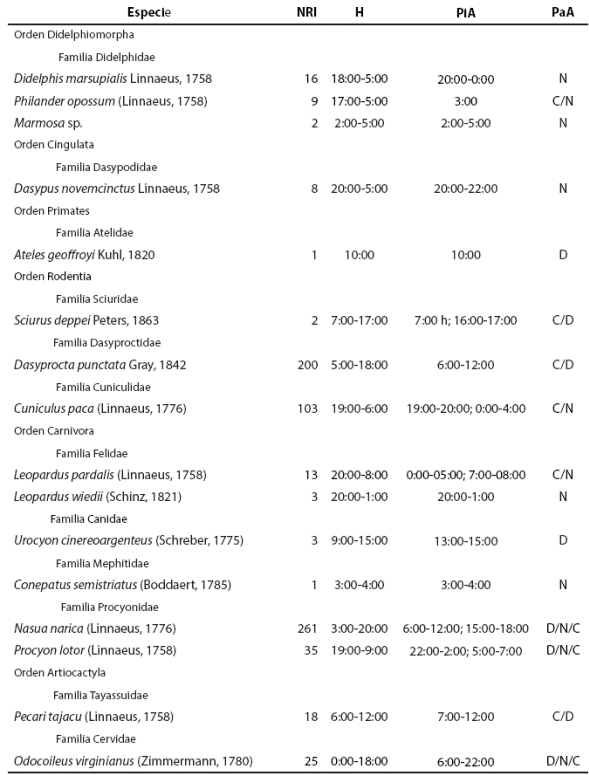
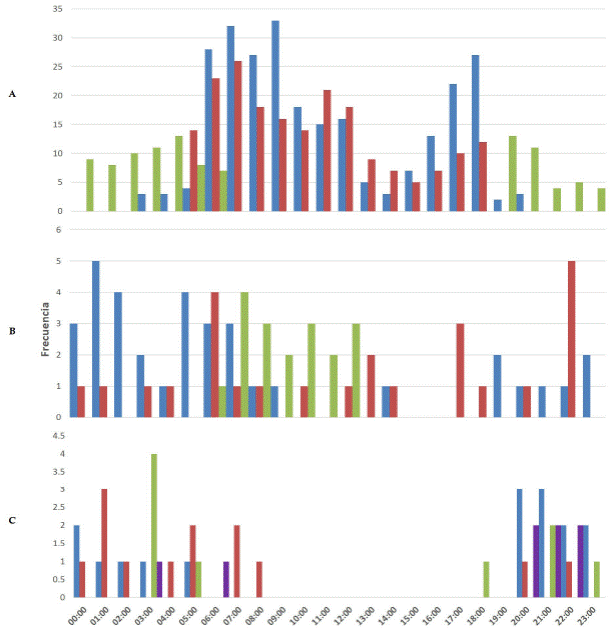
Figura 3 Patrones de actividad de los mamíferos medianos y grandes más abundantes en los petenes de la Península de Yucatán. A: en azul Nasua narica (n = 261), en rojo Dasyprocta punctata (n = 200), en verde Cuniculus paca (n = 103); B: en azul Procyon lotor (n = 35), en rojo Odocoileus virginianus (n = 25), en verde Pecari tajacu (n = 18); C: en azul Didelphis marsupialis (n = 16), en rojo Leopardus pardalis (n = 13), en verde Philander opossum (n = 9), en purpura: Dasypus novemcinctus (n = 8).
Estado de conservación. 25 % de las especies registradas se encuentran en alguna categoría de riesgo, de acuerdo a la NOM-059 (SEMARNAT 2010). 12.5 %, dentro de alguna categoría de riesgo en el entorno internacional, de acuerdo con las listas de la Unión Internacional para la Conservación de la Naturaleza (UICN, Red List 2014; Tabla 1).
Discusión
Diversidad de especies. El presente trabajo registró 16 especies de mamíferos medianos y grandes, equivalente a 50 % y 61.5 % de los registrados en la eco-región Petenes-Celestún-Palmar (EPCP) y la Reserva Estatal Dzilam (RED). Tomando en cuenta que en la EPCP se han documentado 43 especies de mamíferos, de las cuales 32 son terrestres de talla mediana y grande (CONANP 2002; CONANP 2006; Acosta-Lugo et al. 2010), mientras que la RED presenta 26 especies de mamíferos medianos y grandes de las 57 especies registradas (Sosa-Escalante 1994; Hernández-Betancourt et al. 1996). Sin embargo, los programas de manejo de las ANP que conforman la EPCP y la RED enlistan especies que podrían no estar presentes o que actualmente no se tiene conocimiento de su ocurrencia en la costa noroeste de la península de Yucatán. Tal es el caso del mono aullador de manto (Alouatta palliata), el tapir (Tapirus bairdii) y el hormiguero pigmeo (Cyclopes didactylus). De no confirmarse su presencia, el porcentaje de especies que hacen uso de los petenes incrementaría.
Si bien es cierto que el método de fototrampeo es idóneo para el estudio de especies difíciles de observar, debido a su conducta elusiva y baja abundancia (Chávez et al. 2013), es posible que en este estudio no se hayan registrado especies como el cacomixtle (Bassariscus sumichrasti), la martucha (Potos flavus) y el viejo de monte (Eira barbara), debido a sus hábitos arborícolas. Las tres especies mencionadas podrían estar frecuentando los petenes en búsqueda de alimento, debido a que dichas islas de vegetación proveen una diversidad de árboles como zapote (Manilkara zapota), anona (Annona glabra) y ficus (Ficus spp.), entre otros. En época de fructificación podrían proveer de alimento a estas especies, entre otras que, a pesar de ser carnívoras basan una parte de su dieta en el consumo de frutos (Kays 1999; Navas-Vargas et al. 2012; Soley 2012).
El ensamblaje de mamíferos terrestres de talla mediana y grande registrado en este estudio abarca una cantidad considerable de especies que habitan también en la selva subcaducifolia (Pérez-Irineo y Santos-Moreno 2012). Asimismo, hay una alta diversidad comparada con cafetales y selvas medianas de las cañadas de la Selva Lacandona en Chiapas, donde solamente se registraron 12 especies de mamíferos medianos y grandes (Cruz-Lara et al. 2004). Sin embargo, algunas especies comunes en esos hábitats, como el jaguar (Panthera onca), el coyote (Canis latrans) y el pecarí de labios blancos (Tayassu pecari), no fueron detectadas en nuestro estudio. En cuanto al coyote, es conocido que ha expandido su distribución a áreas tropicales de México y Centroamérica, siendo una especie que hace uso de áreas abiertas para localizar a sus presas (Young 1951; Hidalgo-Mihart et al. 2006). Por su parte, el pecarí de labios blancos tiene requerimientos de espacio muy grandes (más de 100 km2 por grupo para Campeche; Reyna-Hurtado et al. 2009). Por ello, es probable que el área cubierta por los petenes sea insuficiente para esta especie. Debido a lo anterior, ambas especies pueden no estar usando alguno de estos tipos de hábitat. No obstante, es bien conocida la plasticidad del jaguar para emplear diversos tipos de hábitat. Tal es el caso de los registros de la especie en los marismas del estado de Nayarit (Rodrigo Núñez, Comm. pers. 2014). Por lo anterior, no se descarta su presencia en el hábitat de petenes.
Otra posibilidad que no se descarta es que estas tres especies vivan en abundancias relativas muy bajas y para detectarlas sea necesario un muestreo mucho mayor que el presente.
Abundancia relativa. El tejón (N. narica), el sereque (D. punctata) y el tepezcuintle (C. paca) fueron las especies que registraron la mayor abundancia en la zona. Por lo tanto, su presencia en los petenes puede estar influida por la disponibilidad de alimento (Manilkara zapota, Metopium brownei, Annona glabra y Ficus sp.), por la elevada humedad y por lo intrincado de la vegetación. Lo anterior concuerda con lo mencionado por Lira-Torres y Briones-Salas (2012). Asimismo, distintos estudios indican que estas especies son muy comunes en los bosques tropicales de México (Faller-Menéndez et al. 2005; Alfaro-Espinosa et al. 2006; Pérez-Irineo y Santos-Moreno 2012), así como en Brasil (Norris et al. 2012) y Ecuador (Zapata-Ríos et al. 2002). Probablemente dominan en estos bosques debido a su adaptabilidad o plasticidad de hábitos alimentarios (Pérez-Irineo y Moreno-Santos 2012).
Los carnívoros presentan una elevada riqueza y abundancia en los petenes. Se registraron seis especies. Entre ellas, destaca la presencia de félidos que se encuentran en protección en el ámbito nacional (NOM-059; SEMARNAT 2010), como el ocelote (L. pardalis) y el margay (L. wiedii). La presencia de carnívoros como los félidos podría estar ligada a la elevada abundancia de presas, como los marsupiales y roedores (Konecny 1989), grupos bien representados durante el muestreo (marsupiales: Didelphis marsupialis, Philander opossum y Marmosa sp.; roedores: C. paca, Dasyprocta punctata y S. deppei).
El único primate registrado para este tipo de hábitat fue el mono araña (Ateles geoffroyi), especie poco común de observar en la zona, de acuerdo con los comentarios de los pobladores. Se lograron dos registros en el presente estudio: el primero, un registro visual en la REEP correspondiente a una hembra con su cría (el dato no fue usado para analizar la abundancia), el segundo, en la RED, correspondiente a una fotocaptura de un ejemplar en el suelo del bosque. La observación de primates en el suelo normalmente indica una alteración en el hábitat, principalmente debido a la fragmentación, que hace que éstos bajen al suelo para desplazarse a otros fragmentos a fin de alimentarse (Pozo-Montuy y Serio-Silva 2006). Dichos desplazamientos aumentan las probabilidades de que sean atacados por perros, coyotes, o que contraigan enfermedades de otros animales silvestres o domésticos (Gilbert 1994; Stoner 1996; Santa-Cruz et al. 2000). Este riesgo inminente puede ocasionar su desaparición y, por lo tanto, es de prioridad implementar estudios sobre el efecto de la fragmentación y monitoreo para la conservación de sus poblaciones en la costa norte de la Península.
En cuanto a la abundancia estacional, no hubo variaciones, debido a que N. narica, D. punctata y C. paca fueron las especies más abundantes en ambas temporadas, y concuerdan con lo obtenido por Lira-Torres y Briones-Salas (2012), quienes indican que C. paca y D. mexicana, a pesar de ser especies solitarias son también las más abundantes en los bosques tropicales. Respecto de N. narica, su abundancia relativa posiblemente se relaciona con que sea una especie gregaria que forma grupos numerosos (Valenzuela 2005b). No obstante, en la temporada de secas se registró la presencia de C. semistriatus, Marmosa spp. y Ateles geoffroyi, especies que no fueron registradas en la temporada de lluvias. Lo anterior podría deberse a que muchas especies tienden a incrementar sus áreas de actividad en búsqueda de alimento durante la época seca (Reyna-Hurtado et al. 2009).
Patrones de Actividad. El presente estudio registró que N. narica, P. lotor y O. virginianus tienen un patrón de actividad Diurno/Nocturno/Crepuscular, mientras que D. punctata y P. tajacu tuvieron un patrón Crepuscular/Diurno y que P. opossum, C. paca y L. pardalis mostraron un patrón Crepuscular/Nocturno. Por su parte, D. marsupialis y Dasypus novemcinctus solo fueron registrados en la noche. Van Schaik y Griffiths (1996) mencionan que el tamaño corporal de las especies se relaciona con el patrón de actividad de cada una de ellas, de manera que aquellas con peso mayor a 10 kg forrajean más tiempo a causa de sus requerimientos energéticos. Por lo tanto, deberían ser especies activas las 24 h. Por el contrario, aquellas especies con peso menor a 10 kg deben ser nocturnas, debido a que se evaden de los depredadores. Sin embargo, algunos estudios (Monroy-Vilchis et al. 2011; Lira-Torres y Briones-Salas 2012), incluido el presente, contradicen esta afirmación, pues si bien especies de talla grande como O. virginianus fueron activas durante las 24 h, también se registraron especies con peso menor a 10 kg activas durante todo el día. Tal es el caso de N. narica y P. lotor. En consecuencia, es probable que existan factores externos (temperatura, humedad, disponibilidad de recursos, sexo, edad, estatus reproductivo, baja abundancia de depredadores etc.) que estén influyendo sobre el patrón de actividad de cada especie (Monroy-Vilchis et al. 2011; Valenzuela 2005).
Los dos felinos registrados (L. pardalis y L. wiedii) tuvieron un patrón de actividad nocturno. En L. pardalis se observó un pico de actividad entre las 01:00 y 05:00 h, en cambio, L. wiedii, aunque con solo tres registros independientes, se mostró más activo entre las 20:00 y 01:00 h. Asimismo, las especies P. opossum y C. paca presentaron actividad durante la fase crepuscular-nocturna, con picos de actividad entre 21:00 y las 04:00 h. Lo anterior concuerda con otros estudios realizados con estas especies (Monroy-Vilchis et al. 2011). La coincidencia entre los patrones de actividad de las especies mencionadas podría indicar que la actividad de dichos felinos está influida por la presencia de sus presas (Cassia Bianchi et al. 2011).
La zorrita gris (Urocyon cinereoargenteus) fue registrada en tres ocasiones. Mostró una actividad entre las 09:00 y 15:00 h, contrastante a lo encontrado por Reid (1997), quien describe a la especie como de hábitos principalmente nocturnos; sin embargo, semejante a lo observado por Reyna-Hurtado (datos sin publicar) en la Reserva de la Biosfera de Calakmul, donde las zorritas grises son muy activas a la hora de mayor calor. La aparente incongruencia puede deberse al pequeño número de fotocapturas, o bien a la influencia estacional ligada a la disponibilidad de recursos alimentarios, tal como lo indican González et al. (1992).
Por otra parte, especies como Pecari tajacu y Dasyprocta punctata registraron un patrón de actividad crepuscular-diurno, de acuerdo con lo reportado en otras partes de México y Sudamérica (Emmons y Feer 1990; Tobler et al. 2009; Lira-Torres y Briones-Salas 2012). Ateles geoffroyi y C. semistriatus fueron registrados una sola vez. No obstante, las tendencias observadas indican que se trata de especies de hábitos diurnos y nocturnos, respectivamente, tal como lo indica Reid (1997).
Implicación para la conservación de los mamíferos en petenes. Este es el primer estudio realizado en México donde se registran los mamíferos medianos y grandes con ocurrencia en las comunidades vegetales conocidas como petenes. A pesar de ser un hábitat raramente estudiado, su buen estado de conservación y difícil acceso ha dado como resultado que el número de mamíferos medianos y grandes que se asocian a éste sea diverso. Con la información obtenida sobre su abundancia y patrones de actividad, se podrán delinear estrategias para su conservación, así como para el mantenimiento de estos hábitats tan diversos y poco estudiados en México.
A pesar de que el estudio se realizó en áreas protegidas, se observó la presencia de cazadores en el área, lo que implica un aprovechamiento de la fauna. En un estudio paralelo, se registraron las principales especies, de las cuales se extrae la mayor biomasa para consumo local en las comunidades adyacentes a las ANP (Reyna-Hurtado et al. 2013). Entre las especies más buscadas por los pobladores en los petenes, se encuentran el tejón, el sereque y tepezcuintle, también registradas en el presente estudio. La cacería de subsistencia está permitida para los campesinos con la finalidad de que obtengan la proteína animal que requieren (Naranjo et al. 2004). Sin embargo, esta cacería no se encuentra regulada por ninguna dependencia. Es fundamental la realización de una evaluación del estado de conservación de las especies con mayor aprovechamiento por las comunidades, con la finalidad de estimar tasas de extracción adecuadas para así asegurar la permanencia de las especies a largo plazo (Lira-Torres et al. 2012).
Agradecimientos
Los autores agradecen a la Dirección de la Reserva de la Biosfera Los Petenes (Campeche), en especial a C. Romero y L. Sosa, por otorgar los permisos para acceder a la reserva, así como a la Secretaria de Desarrollo Urbano y Medio Ambiente (SEDUMA; Yucatán), en especial a E. Batllori y L. Méndez, por permitirnos acceder a las Reservas Estatales El Palmar, y Dzilam. A G. Hernández, J. y B. Campos, por su asistencia en campo; al proyecto "Conservación de poblaciones de pecarí de labios blancos (Tayassu pecari) en áreas protegidas", apoyado por el Programa de Conservación de Especies en Riesgo (PROCER) de la CONANP, también a R. Manríquez, P. Oropeza y E. Rendón por su amabilidad y responsabilidad en la Conservación de la Biodiversidad Mexicana; A J. Cú, T. Chi y a dos revisores anónimos, por las sugerencias a este manuscrito; por ultimo, al Colegio de la Frontera Sur, por el apoyo logístico.











 nueva página del texto (beta)
nueva página del texto (beta)