Introducción
El estudio de la dinámica del oxígeno disuelto para evaluar la producción primaria (PP) y el metabolismo comunitario (definido como el balance entre la producción y la respiración) constituyó un parteaguas en la comprensión de los flujos de materia y energía de los ecosistemas (Odum, 1956).
El desarrollo de otras técnicas como la incorporación de 14C también impulsó y enriqueció los estudios de PP. Sin embargo con este método la interpretación es compleja por la refijación de parte del 14C respirado y por la excreción de carbono marcado (Marra, 2002), además de las subestimaciones variables de las tasas, que se ubican entre la fotosíntesis bruta y la neta (Bender, Orchardo, Dickson, Barber, & Lindley, 1999) entre otras complejidades.
Aún así, el uso extendido del 14C limitó los estudios de balance metabólico usando la dinámica del oxígeno, a pesar de que estos últimos permiten evaluar la autotrofía o heterotrofía a escala comunitaria-ecosistémica. Esto implicó asimismo una disminución de las estimaciones de respiración comunitaria durante décadas (Smith & Kemp, 1995; Behrenfeld & Falkowski, 1997.
En contraste, recientemente se ha señalado la relevancia de los sistemas acuáticos continentales en el ciclo planetario del carbono (Duarte & Prairie, 2005; Cole et al., 2007), dado que presentan, por ejemplo, tasas más altas de exportación de carbono hacia los sedimentos que los sistemas oceánicos (Tranvik et al., 2009).
Este tipo de información es hoy crucial para enfrentar los desafíos del cambio ambiental (p. ej. cambios en los patrones de precipitación, en los umbrales de eutrofización, en el funcionamiento de los sistemas como sumideros o fuentes de carbono) a escalas de regional a planetaria (Guimarais-Bermejo, Merino-Ibarra, Valdespino-Castillo, Castillo-Sandoval & Ramírez-Zierold, 2018).
Asimismo, continúa abierta la pregunta sobre si los sistemas acuáticos continentales funcionan, en su conjunto, como netamente autotróficos o como netamente heterotróficos (Cole et al., 2007; Tranvik et al., 2009). Más aún, se ha resaltado que esto se debe en gran medida a la escasez de datos de sistemas tropicales (St. Louis, Kelly, Duchemin, Rudd & Rosenberg, 2000; Tranvik et al., 2009).
La comparación entre sistemas acuáticos tropicales y templados es también una prioridad para probar hipótesis generales en la Teoría ecológica y en la Limnología. Por ejemplo, se ha hipotetizado que el ciclaje de los nutrientes debería ser mayor en sistemas tropicales que en templados (Boulton et al., 2008); si este comportamiento es generalizado o no -y si tiene un impacto sobre el balance metabólico de los ecosistemas- son preguntas que, si no se enfocan con indicadores integrales del funcionamiento de los ecosistemas, requerirán de un esfuerzo experimental muy intenso para evaluar cada uno de los procesos involucrados.
Estudio del metabolismo de los ecosistemas acuáticos
Por todo ello, se ha formado una importante corriente de autores que respaldan nuevamente el estudio del metabolismo de los ecosistemas acuáticos (Staehr et al., 2010) ─incluyendo lagos (Solomon et al., 2013), estuarios e incluso arrecifes coralinos─ mediante el seguimiento de la evolución del oxígeno, debido a que es un método sencillo, útil y confiable que tiene la ventaja de permitir la evaluación de la respiración y, por tanto, de evaluar por separado las producciones bruta y neta (McKinnon, Logan, Castine & Duggan, 2013), contribuyendo eficazmente al entendimiento de los flujos de carbono. Este renovado interés se debe asimismo a la necesidad de estudiar con una misma estrategia los sistemas acuáticos tropicales frente al horizonte del cambio global (Staehr et al. 2012; Solomon et al., 2013), ya que la multiplicidad de métodos y estrategias utilizados es una fuente importante de variación de los resultados, lo que dificulta su integración e interpretación (Cloern, Foster & Klekner, 2014).
La escasez (St. Louis, Kelly, Duchemin, Rudd & Rosenberg, 2000; Tranvik et al., 2009) y heterogeneidad de la información disponible sobre sistemas tropicales se hacen patentes en la Tabla 1, derivado de una extensa revisión de la literatura. La forma en que se reportan los resultados revela la heterogeneidad con que se han hecho los escasos estudios, lo que dificulta tanto la comparación como el escalamiento de la información. Es particularmente notorio el escasísimo número de trabajos en los que se reportan la respiración y el balance metabólico (P:R en la Tabla 1), incluyendo la mayoría de ellos exclusivamente la producción primaria. Adicionalmente, muchos estudios reportan las tasas metabólicas solamente en unidades volumétricas (sección inferior de la Tabla 1), lo que implica que no consideraron la variabilidad vertical ni la integración en este eje. Similarmente, muchos estudios reportan las tasas horarias, sin la necesaria integración temporal sobre el ciclo diurno completo. Como se discute en detalle más adelante, ambos aspectos son cruciales para permitir la comparación entre sistemas, así como la integración y escalamiento regional de la información.
Tabla 1 Producción primaria bruta (PB), producción primaria neta (PN) y respiración comunitaria (R) en sistemas acuáticos continentales tropicales. En la parte superior se muestran estudios que reportan estas tasas integradas por área/fotoperiodo (gC m-2 día-1), mientras que en la inferior aquellos que reportan las tasas volumétricas y/o horarias con sus respectivas unidades.
| Sistema | Estado trófico* | Profundidad | PP Bruta ( PB ) | PP Neta ( PN ) | Respiración ( R ) | P:R | Unidades | Referencia |
|---|---|---|---|---|---|---|---|---|
| tasas integradas por área | gC m-2 día-1 | |||||||
| Alchichica, México | Oligotrófico | P | 2.9 | 0.84 | 2.029 | 4.39 | Oseguera et al. 2015 | |
| Chapala, México | Oligo-mesotrófico | S | 0.27 | Lind et al. 1992 | ||||
| Shahidullah, Bangladesh | Mesotrófico | 4.2 | 3.7 | 1.15 | Khondker y Kabir 1995 | |||
| Valle de Bravo, México | Eutrófico | P | Valdespino-Castillo et al. 2014 | |||||
| Zona trofogénica | 2.1 | 0.49 | 3.9 | 0.54 | ||||
| Todo el sistema | 2.1 | -1.1 | 6.1 | 0.34 | ||||
| Quebrada Seca, Venezuela | Hipertrófico | 1.8 − 3.5 | González et al. 2003 | |||||
| La Mariposa, Venezuela | Hipertrófico | 0.9 − 2.6 | ||||||
| Pao Cachinche, Venezuela | Hipertrófico | 2.5 − 6.8 | ||||||
| Hipertrófico | 1.0 -6.8 | 0.5 - 3.9 | 0.3 - 5.2 | González et al. 2004 | ||||
| Lago Xolotlán, Nicaragua | Hipertrófico | 4.6 − 6.8 | Erikson et al. 1998, 1999 | |||||
| Río Ganges, India | 0.9 − 1.02 | Natarajan 1989 | ||||||
| Chang Jiang, Yangtze, China | 1.15 − 3.61 | Liang et al. 1988 | ||||||
| Lago Lanao, Filipinas | 2.6 | 1.7 | Lewis 1974 | |||||
| Tres pozas tropicales, India | Vijayaraghavan 1971 | |||||||
| Poza Othakadai | 1.5 − 15.8 | |||||||
| Estanque Teppakulam | 2.0 − 8.0 | |||||||
| Poza Yanamalai | 1.05 − 5.4 | |||||||
| Oloiden, Kenia | 1.58 − 4.54 | Allanson 1990 | ||||||
| Bosomtwe, Ghana | 4.73 | 0.38 | 4.34 | 1.1 | Awortwi 2010 | |||
| ( PB ) | ( PN ) | ( R ) | Unidades | |||||
| tasas volumétricas | ||||||||
| Río Jharahi, India | 0.04 - 0.42 | 0.02 - 0.31 | 0.02 - 0.11 | mgC l-1h-1 | Pratap y Khatibullah 2014 | |||
| Chapala, México | Oligo-mesotrófico | S | 0.067 | gC m-3 día-1 | Dávalos-Lind y Lind 2001 | |||
| Parque Norte, Colombia | Eutrófico | 62 - 791 | 0 - 1074 | mgC m-3 h-1 | Ramírez y Alcaráz 2002 | |||
| Los Tunjos, Colombia | 10 | mgC m-3 h-1 | Gaviria 1991 | |||||
| Embalse Chisacá, Colombia | 90 | mgC m-3 h-1 | Gaviria 1991 | |||||
| Embalse La Regadera, Colombia | 112 | mgC m-3 h-1 | Gaviria 1991 | |||||
| F. José de Caldas, Colombia | 119 | mgC m-3 h-2 | Arboleda y Ramírez 2002 | |||||
| Tequesquitengo, México | P | 0.079 | 0.041 | mgC h-1 | Hernández Becerril y Tapia Peña 1987 | |||
*Datos ordenados por estado trófico (reportado) y por tasas integradas (por área, por día al principio de la tabla); y volumétricas, en la parte inferior. P=profundo; S=somero
La escasez y heterogeneidad de los estudios en los sistemas acuáticos tropicales contrasta con la urgencia para enfrentar las preguntas abiertas, y determinar si su capacidad para exportar carbono hacia los sedimentos o hacia la atmósfera está cambiando debido al aumento de la temperatura atmosférica o a otras consecuencias del cambio global. Al respecto, uno de los pocos estudios de largo plazo en sistemas tropicales mexicanos muestra un balance metabólico que tiende hacia la heterotrofía neta (P:R <1), con una respiración alta y mayor que en muchos sistemas templados (Guimarais-Bermejo, Merino-Ibarra, Valdespino-Castillo, Castillo-Sandoval & Ramírez-Zierold, 2018), cuestionando lo propuesto en este sentido a nivel global (Duarte & Prairie 2005; Cole et al., 2007).
Evaluación del metabolismo acuático mediante la evolución del oxígeno
Por lo antes expuesto, suscribimos el exhorto a multiplicar las evaluaciones del metabolismo acuático mediante la evolución del oxígeno (Staehr et al., 2010; Solomon et al., 2013; Cloern, Foster & Klekner, 2014) para contribuir eficazmente al entendimiento de los flujos de carbono. Por nuestra parte, consideramos adicionalmente que, de entre las opciones para evaluar la dinámica del oxígeno (Staehr et al., 2012), el método de las incubaciones en botellas claras y oscuras tiene ventajas importantes, que lo hacen muy conveniente para el estudio sistemático de los sistemas acuáticos continentales tropicales, como son: 1) que es un método de alta precisión que se puede llevar a cabo con una infraestructura modesta, 2) que es recomendable su aplicación en sistemas con estado trófico avanzado (Zhang, Berberian & Wanninkhof, 2002) que es el método más funcional en sistemas con influencia del viento, en los cuales la difusión de oxígeno atmosférico afecta considerablemente las mediciones en aguas abiertas (Nöel et al., 2010; Valdespino-Castillo, Merino-Ibarra, Jiménez-Contreras, Castillo & Ramírez-Zierold, 2014).
Para favorecer el uso extendido, efectivo y comparable de esta estrategia en los sistemas acuáticos tropicales, en la Figura 1 hemos integrado las consideraciones conceptuales y técnicas que percibimos relevantes y de utilidad para su implementación en distintos sistemas y para la obtención de información comparable y de buena calidad, las cuales discutimos en detalle a continuación.
El primer paso para la implementación exitosa de un estudio de balance metabólico es la consideración de las características limnológicas del sistema, en particular las relacionadas con su distribución de oxígeno disuelto (Figura 1, Tabla 1) para diseñar la estrategia de incubación. Otras de las definiciones y precauciones indispensables tienen que ver con los aspectos críticos del método de incubaciones en botellas claras y oscuras, que -si no se atienden- pueden implicar desventajas en su uso: a) es una técnica que requiere entrenamiento previo de los operadores, por lo que éste es un componente clave de su implementación exitosa. En particular, es crucial que se domine la técnica de colecta de agua sin alteración alguna de la concentración de oxígeno. b) Se conoce que la multiplicación de los microbios sobre las paredes de las botellas puede causar sobrestimación de la respiración (Lee & Fuhrman, 1991). Este efecto puede minimizarse utilizando botellas de baja rugosidad (cristal) y evitando que sean muy pequeñas, siendo 60 ml el volumen mínimo recomendado. c) En sistemas oligotróficos se requiere realizar incubaciones largas (en escala ~diurna) para registrar variaciones significativas de oxígeno (Figura 1).
Debido a que las tasas metabólicas varían con la temperatura y la luz, es conveniente realizar las incubaciones in situ. Sin embargo, si se prefiere aprovechar las ventajas que ofrecen las incubaciones en el laboratorio (Azevedo, Duarte & Bordalo, 2006) debe tenerse presente que es necesario emular lo más posible el hábitat natural al hacerlo (Figura 1). En cualquier caso, es muy importante utilizar múltiples réplicas, así como evitar la entrada de herbívoros durante la colecta del agua, y lograr un control riguroso de la interacción con la atmósfera de las muestras colectadas para evitar errores por difusión de oxígeno (Valdespino-Castillo, Merino-Ibarra, Jiménez-Contreras, Castillo & Ramírez-Zierold, 2014).
Al respecto, cabe recordar que en otros métodos, como la estimación de la fugacidad de CO2, se requiere un control del intercambio de gases similarmente riguroso. Más aún, el cálculo de los flujos de carbono a partir de la alcalinidad total, el carbono inorgánico disuelto y el pH, requiere determinaciones de muy alta precisión y consideración de las particularidades fisicoquímicas del sistema, que tienen mucho peso en estos equilibrios. Así, la serie de consideraciones y precauciones necesarias para aplicar estos métodos es aún más extensa y crítica (Dickson & Goyet, 1994) que en el caso de la dinámica del oxígeno.
Para el análisis de la dinámica del oxígeno (sea usando botellas o sensores) es necesario y conveniente integrar las tasas instantáneas (por volumen, por hora) a tasas por área y por día, que permiten comparar la información entre sistemas (Behrenfeld & Falkowski, 1997) (ver Figura 1). Para ello, es muy importante realizar mediciones nocturnas de la respiración comunitaria in situ, (que están entre las mediciones que menos se han realizado) para evitar el uso de estimaciones indirectas, como la de la “respiración en la oscuridad” (en inglés dark respiration, que es una fracción de la fotorrespiración, (Geider & Osborne, 1989), que en la realidad pueden tener variaciones importantes entre distintos sistemas y condiciones.
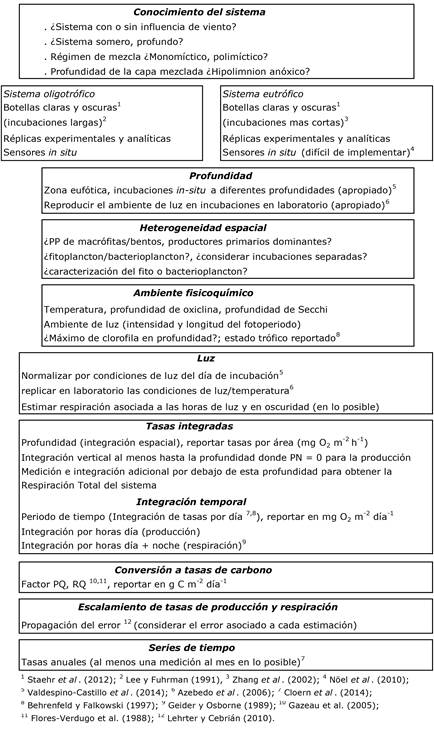
Figura 1 Secuencia metodológica-conceptual hacia la construcción de un inventario de flujos de carbono tropicales usando la dinámica del oxígeno como estrategia.
Se presentan de forma secuencial las consideraciones conceptuales y técnicas a seguirse para obtener datos que permitan la comparación entre sistemas, así como su escalamiento espacial y temporal.
Para la obtención de tasas integradas representativas, resaltamos aquí también la importancia de que la distribución vertical de las incubaciones in situ sea definida a partir de las características de cada sistema, ya que el metabolismo es función tanto de la penetración de la luz en la columna de agua (por su efecto en la PP), como de la respiración comunitaria presente.
La integración vertical debe realizarse al menos hasta el punto de compensación, donde las tasas de producción y respiración se igualan (es decir, donde la producción neta, PN= 0). Este cálculo confiere al método un límite operativo y conceptual para la evaluación de la capa de producción (trofogénica), que no es homogénea verticalmente, por lo que deben incluirse en ella varios niveles de incubación.
Cuando interesa obtener el balance metabólico del sistema completo, es importante también realizar estimaciones de la respiración aeróbica por debajo de la capa trofogénica y hasta el fondo del sistema (Guimarais-Bermejo, Merino-Ibarra, Valdespino-Castillo, Castillo-Sandoval & Ramírez-Zierold, 2018), en la medida en que la presencia de oxígeno disuelto las haga posibles. Sin embargo, en sistemas estratificados eutróficos, si el suministro físico de oxígeno (principalmente por difusión y mezcla vertical) no es suficiente, el sistema puede permanecer anóxico en el hipolimnion. En estas condiciones la respiración es anoxigénica y ya no puede resolverse con los métodos propuestos. En esta zona la química redox está dominada por los microorganismos presentes, algunos con capacidades para obtener energía sin usar el oxígeno (por ejemplo, reduciendo el nitrato).
En la integración espacial es asimismo importante establecer el valor potencial del bentos en el balance metabólico a nivel ecosistémico (que implica la interacción con el sedimento). En particular en sistemas someros, el estudio de la dinámica del oxígeno puede nutrirse de los principios generales anteriormente expuestos pero puede requerir de estrategias metodológicas más complejas, como campanas de micro y mesocosmos.
Por último, otro aspecto importante a considerar en los estudios que requieren de un escalamiento (desde las tasas instantáneas hacia la escala ecosistémica y hacia tasas anuales), es que es necesario calcular la propagación del error estadístico acumulado en las integraciones y cálculos (Lehrter & Cebrián, 2010; Valdespino-Castillo, Merino-Ibarra, Jiménez-Contreras, Castillo & Ramírez-Zierold, 2014).
Conclusiones
En resumen, hemos señalado aquí que los estudios sobre metabolismo comunitario-ecosistémico (el balance entre fotosíntesis y respiración) representan una estrategia muy útil para estimar la magnitud de estos flujos en los sistemas acuáticos tropicales y para evaluar su papel como sumideros o fuentes de carbono; para lograr esto los datos obtenidos deben ser comparables y haberse obtenido tomando en cuenta diversos aspectos conceptuales y técnicos (propuestos en la secuencia metodológica de la Figura 1).
Al mismo tiempo, la evaluación de la información existente para los sistemas tropicales revela cuan escasos han sido este tipo de estudios hasta ahora, y evidencia la urgente necesidad de aportar información sobre los balances metabólicos y la exportación de carbono en los sistemas acuáticos continentales tropicales para poder incluirlos en los balances de carbono de mayor escala (inventarios generales o regionales) y aportar elementos para enfrentar el cambio global.
Finalmente nos parece pertinente cerrar esta propuesta con dos notas mirando, una hacia el pasado y otra hacia el futuro de los estudios relacionados con la producción primaria y el metabolismo.
Mirando hacia atrás, es procedente reconocer aquí que, aunque la estimación de la biomasa fitoplanctónica mediante la concentración de clorofila-a ha sido un indicador útil del estado trófico de los ecosistemas, no debe ser considerado directamente como una medida de PP (bruta o neta) y mucho menos, del metabolismo comunitario. Esta errónea equiparación ha ocurrido frecuentemente en estudios de producción primaria (Harris, 1986), y puede implicar errores significativos en la interpretación de resultados (Felip & Catalán, 2000).
Es importante tener presente que las tasas de producción y respiración son flujos metabólicos y por ello tienen un componente temporal y una dirección (son vectores); en contraste, la estimación de la biomasa es una medida estática. Adicionalmente, la clorofila-a es un estimador limitado de la biomasa fitoplanctónica, debido a las grandes variaciones inter-específicas: la relación biovolumen:clorofila depende de la estructura y forma de vida de las especies predominantes (Felip & Catalan, 2000), así como de variaciones intra-específicas (e.g., cambios en el contenido de pigmento por foto-aclimatación; Longhurst & Harrison, 1989).
Mirando hacia el futuro de los estudios metabólicos y de producción, es particularmente interesante visualizar que actualmente estamos en los albores de comprender la relevancia de la incorporación de carbono a la biomasa a través de metabolismos distintos a la fotosíntesis oxigénica (fotosíntesis anoxigénica o diversas vías de quimiosíntesis). Para entonces, es deseable que el uso de la dinámica del oxígeno para evaluar el metabolismo ecosistémico sea una herramienta ampliamente utilizada en los ecosistemas acuáticos tropicales.











 texto en
texto en 



