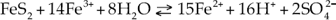Introducción
Un gran número de ríos en el mundo presenta contaminación metálica derivada de los procesos de oxidación de sulfuros resultantes de actividades mineras (Battagia-Brunet et al., 2012; García-Moyano, González-Toril, Aguilera, & Amils, 2012; Klein, Tischler, Muhling, & Schlomann, 2013), como es el caso del río Spree en Alemania, en el cual se calculó que durante 2015 se descargaron 130 000 toneladas de sulfato (Sonntag, 2007). Los drenajes ácidos de mina (AMD del inglés, acid mine drainage) contienen concentraciones de sulfato desde gramos hasta cientos de gramos por litro (Nordstrom, Alpers, Ptacek, & Blowes, 2000; Blowes, Ptacek, Jambor, & Weisener, 2003). Los minerales responsables de la generación de los AMD son los sulfuros de hierro (pirita, FeS2 y la pirrotita, Fe1-XS) y, en menor medida, calcopirita, marcasita, esfalerita, etcétera, los cuales son estables e insolubles en ausencia de agua y oxígeno atmosférico (González-Toril, Llobet-Brossa, Casamayor, Amann, & Amils, 2003; Johnson, 2003; Árcega-Cabrera, Castillo-Blum, & Armienta, 2010). La gestión eficaz de los AMD y la corrección de los impactos que producen sólo es posible si se conocen los procesos que influyen en la liberación y transporte de los elementos potencialmente tóxicos, en particular de los denominados metales pesados (Armienta, Talavera, Morton, & Barrera, 2003; Árcega-Cabrera et al., 2010; Inocencio-Flores, Velázquez-Machuca, Pimentel-Equihua, Montañez-Soto, & Venegas-González, 2013).
Dada la posibilidad de acceso de los AMD a sistemas hidrológicos superficiales o a sistemas acuíferos subterráneos que sean utilizados para el consumo humano o industrial, en los últimos años se ha invertido tiempo y dinero en la investigación centrada en técnicas correctoras y preventivas de los AMD (Gallert & Winter, 2002). Su formación ha sido ampliamente reconocida como uno de los grandes problemas ambientales en muchas regiones mineras (Cohen-Ronald, 2006; Johnson, 2003; Hallberg, 2010; García-Moyano et al., 2012). Por lo tanto, existen normativas europeas (European Union’s Water Framework Directive) que regulan la cantidad de sulfato en las aguas.
La necesidad de prevenir la formación de AMD ha provocado el desarrollo de investigaciones sobre los mecanismos de oxidación y su prevención (Nordstrom et al., 2000; Johnson & Hallberg, 2003, 2005; Hallberg, 2010). La información generada sobre el tema es poca debido a que la oxidación de los sulfuros es compleja y sus efectos pueden variar de manera enorme entre distintos lugares y condiciones (Klein et al., 2013).
En el ámbito internacional, entre las entidades preocupadas por el control de los AMD se tiene a las siguientes:
International Network for Acid Prevention (INAP): agrupación de empresas de minería comprometida con el control de los AMD.
Mine Environment Neutral Drainage Program (MEND): organismo fundado por el gobierno canadiense, con el objetivo de desarrollar tecnologías para reducir los efectos de los AMD.
Acid Drainage Technology Initiative (ADTI): grupo de EUA que incluye representantes de empresas, estado, gobiernos federales y universidades.
Partnership for Acid Drainage Remediation (PADRE): comisión europea de la International Mine Water Association (IMWA), destinada al estudio de mejores prácticas en la remediación de los AMD de minas en activo y abandonadas en Europa.
Mecanismo de oxidación y disolución de iones potencialmente tóxicos
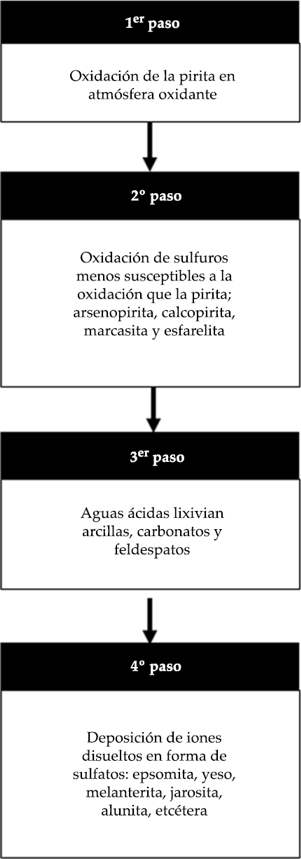
Una aproximación al mecanismo de degradación de la calidad del agua por introducción de metales pesados disueltos procedentes de actividades mineras sigue los pasos del esquema de la figura 1.
Los sulfatos formados en la cuarta etapa se vuelven a disolver cuando el drenaje ácido deja de funcionar o se producen otros aportes de aguas más puras, que quedan contaminadas en poco tiempo. El resultado final es que los cuerpos de agua se acidifican y presentan altas concentraciones de sulfatos, cationes alcalinos y elementos potencialmente tóxicos, como los denominados metales pesados.
La pirita se oxida a sulfatos, siendo esta reacción catalizada por actividad bacteriana, generando acidez y liberando hierro en forma iónica (Hallberg, 2010). Una vez que este fenómeno se ha iniciado es muy difícil controlarlo sin un coste elevado (Cruz & Monroy, 2006), por lo que se requiere de técnicas predictivas eficientes para poder proponer medidas de prevención y control.
Existen dos mecanismos de oxidación (Nan-cucheo & Barrie-Johnson, 2011):
1. Reacción directa del oxígeno con la pirita para dar lugar a iones sulfato y acidez. Se trata de un mecanismo inorgánico, donde el agente oxidante es el oxígeno. Este mecanismo se corresponde con la reacción
2. Sustitución del oxígeno por el ion férrico, actuando como oxidante (2). Se trata de otro mecanismo inorgánico:
Para que esta reacción tenga lugar es necesaria una reacción previa (3), donde el ion ferroso se oxida in situ (Singer & Stumm, 1970):
Otros minerales sulfuros son oxidados de forma similar a la pirita, dando lugar a metales y sulfatos en disolución; los AMD contienen diversos metales, por ejemplo Cu, Fe, Zn, Al, Pb, As, Cd, etcétera, en concentraciones tóxicas. En el AMD (pH = 3.0) de mina de cobre se pueden registrar las siguientes concentraciones: Co (9.00 mg/l); Cu (45.50 mg/l); Fe (435.00 mg/l); Mn (7.21 mg/l); Ni (3.80 mg/l); Pb (7.50 mg/l); Zn (7.00 mg/l), y sulfato (3 360.00 mg/l) (Sahinkaya & Yucesoy, 2010; Sahinkaya, Dursun, Ozkaya, & Kaksonen, 2013).
Factores abióticos y bióticos involucrados en la oxidación
La producción de acidez se ve muy favorecida por la finura de grano de la pirita y se ve influenciada, entre otros factores, por la temperatura, velocidad de penetración del oxígeno, humedad o las características hidrogeológicas del lugar (Stumm & Morgan, 1981).
La oxidación del Fe es un mecanismo dependiente del pH y Eh. La actividad microbiana aumenta la velocidad de formación de AMD y puede ser responsable de la mayor parte del AMD generado, principalmente por poblaciones de bacterias quimiolitotróficas acidófilas o neutrofilas, cuyos mecanismos de actuación son diferentes (Bonnefoy & Holmes, 2012; Dopson & Johnson, 2012; Klein et al., 2013; Ilbert & Bonnefoy, 2013). Las principales bacterias oxidantes de Fe en la formación de los AMD son las acidófilas del género Thiobacillus y las neutrófilas Gallionela ferrugineala y Leptothrix sp. (Hedrich et al., 2011; Klein et al., 2013), aunque pueden contribuir también otros grupos, como el Leptospirillum sp., que llevan el pH a valores menores de cuatro, donde ya puede intervenir Thiobacillus (Baker & Banfield, 2003; Johnson & Hallberg, 2003; Schippers et al., 2010; Korehi, Bloethe, & Schippers, 2014; Joshi 2014; Jones et al., 2015). El principal nutriente de estas bacterias autótrofas es el CO2 (Stumm & Morgan, 1981). También es un importante nutriente el fósforo que se encuentra en trazas en los AMD (Banks, Younger, Amesen, Iversen, & Banks, 1997). El fosfato precipita como fosfatos de Fe o es adsorbido a minerales férricos (Stumm & Morgan, 1981). Otro nutriente importante es el nitrógeno presente en los nitratos que habitualmente se encuentran en los AMD como consecuencia del uso de explosivos de N en las actividades mineras (Banks et al., 1997). Otra fuente importante de N es el amonio, cuya falta puede provocar la reducción de la actividad bacteriana (Tuovinen, Panda, & Tsuchiya, 1979).
Mientras que la oxidación del ion ferroso es termodinámicamente favorable, su cinética es muy lenta cuando los valores de pH son menores que cuatro. Sin embargo, las bacterias oxidantes Thiobacillus ferrooxidans utilizan la energía y pueden aumentar de forma significativa su tasa de oxidación (IPAT-UNESCO, 2000). Las bacterias que actúan como catalizadores aceleran esta reacción de 4 a 50 veces, con el consiguiente aumento de la acidez de las aguas (Johnson & Hallberg, 2003).
Por tanto, existen diversos procedimientos de naturaleza física, química y biológica para inhibir o reducir la acidez de los AMD. Esta revisión está centrada en las técnicas que actúan sobre los microorganismos oxidantes del Fe inhibiendo su actividad (técnicas preventivas), a través del empleo de bacterias, detergentes aniónicos, conservantes biológicos o vegetación, y en aquellas estrategias centradas en el empleo de microorganismos que reducen la acidez de los AMD (técnicas de remediación), en particular a través del uso de microbios transformadores de azufre y de metales, y la creación de humedales.
Prevención: inhibición microbiana de los AMD
Tal y como afirmaron Johnson y Hallberg en su revisión bibliográfica, es considerablemente más rentable tratar el residuo y prevenir las condiciones que causan el deterioro que tratar las aguas ya degradadas (Johnson & Hallberg, 2005). La naturaleza del problema de acidez depende del origen del residuo minero y su grado de meteorización, y esto debe tenerse en cuenta para determinar el método adecuado para el postratamiento. El uso final deseado del área que ocupan los residuos mineros potencialmente generadores de AMD es también un factor crucial para la elección de las acciones de prevención. Los microorganismos influyen en la movilidad de los metales en el residuo de mina de muchas maneras. Algunos microorganismos causan una movilización del metal, mientras que otros contribuyen a que la disponibilidad del metal sea limitada (Solano, 2005; Hallberg, 2010). La influencia de los microorganismos en la movilidad del metal depende de cuál de estos procesos domina.
Los métodos centrados en la adición de sustancias para inhibir la formación de AMD pueden influir directamente sobre los microorganismos oxidantes o intervenir sobre toda la comunidad microbiana. En este último caso se encuentran ventajas, porque estas sustancias pueden mejorar la calidad de las aguas drenadas. Sin embargo, en la mayoría de los casos, para que los efectos sean permanentes, la aplicación de las sustancias inhibidoras tiene que ser repetida. Los experimentos realizados no han sido suficientemente prolongados como para determinar si los efectos del tratamiento sobre los microorganismos son permanentes. Sin embargo, algunos estudios indican que los efectos permanecen tras la degradación del inhibidor (Bernardes de Souza &Mansur, 2011). Se debe prestar especial atención a que los productos químicos antibacterianos utilizados sean compuestos que respeten el medio ambiente y no generen otros daños ambientales.
Los mecanismos de control de los mecanismos de liberación de iones de metales tóxicos pueden deberse a:
Bacterias libres que constituyen partículas suspendidas móviles que pueden tener una capacidad de absorción del metal más elevada que las del ambiente circundante.
Crecimiento de las bacterias, que se lleva a cabo en biopelículas formadas en las superficies de los minerales, lo cual los protege de la solubilización y, en consecuencia, reduce el transporte de los metales.
Además de estos mecanismos, Nancucheo y Barrie-Johnson indicaron que los microorganismos producen agentes complejantes y otros metabolitos que pueden transformar los metales tóxicos en formas más o menos solubles, afectando el grado de solubilidad y movilidad (Nancucheo & Barrie Johnson, 2011, 2014).
Desde el punto de vista microbiano, las posibles influencias de los microorganismos en el estado químico (especiación) y, en consecuencia, en la movilidad del metal, son numerosas y complejas, abarcando desde procesos directos, como la transformación del metal y la fijación intracelular, a influencias más indirectas a través de la producción de sustancias que hacen que el metal sea más o menos móvil a través de la complejación. Tales procesos pueden ocurrir en el ambiente que prevalece en los residuos mineros con alta concentración de metales y pueden ser determinantes para la magnitud del impacto ambiental de los residuos de mina (Bernardes de Souza & Mansur, 2011). Estas interacciones entre metales y microorganismos pueden perturbarse por la presencia de otros compuestos, como minerales arcillosos, aniones inorgánicos, cationes competentes, materia orgánica complejante, etcétera. Los metales pueden llegar a estar hidratados, quelados o adsorbidos por estos compuestos, lo cual puede hacer que el metal esté menos disponible para la interacción microbiana.
Los microorganismos participan en el ciclo del carbono y por lo tanto influyen en la cantidad y carácter de la materia orgánica, y en la cantidad y tipo de agentes quelantes orgánicos capaces de unirse a los metales. En general, el tamaño del compuesto de coordinación entre el metal y el ligante orgánico determina si el complejo es móvil o inmóvil en el ambiente. La degradación microbiana puede de este modo cambiar los compuestos metal-orgánicos inmóviles a móviles y/o a formas de metal solubles en agua o viceversa. Sin embargo, la coordinación de los iones metálicos con la materia orgánica disminuye su grado de degradación (Renella, Landi, & Nannipieri, 2004).
Estas técnicas bactericidas son efectivas para el control de la contaminación del agua durante las fases de laboreo y de preparación de las escombreras, considerándose tecnologías más económicas al minimizar el tratamiento posterior del agua y sus costes asociados (Ohimain, Andriesse, & Van Mensvoort, 2004). Ohimain et al. señalan la persistencia del cambio que producen estas técnicas en la microbiología de las escombreras una vez desaparecido el bactericida, permitiendo así la estabilidad de la escombrera restaurada (Ohimain et al., 2004).
Dentro de estas técnicas microbianas existen hoy en día cuatro líneas de investigación fundamentales: la inhibición bacteriana biológica (Johnson, Rolfe, Hallberg, & Iversen, 2001; Yang et al., 2008); el empleo de detergentes aniónicos (Li, Qi, & Liu, 2009; Urbanová et al., 2011); el uso de sustancias orgánicas conservantes (Bhatnagar & Singh, 1991), y la aplicación de vegetación (Johnson & Hallberg, 2005), siendo el empleo de medidas microbiológicas mucho menos dañina para el medio ambiente, siempre que no implique la adición de agentes artificiales.
a) Inhibición bacteriana biológica
En la mina de Richmond, en el norte de California, se han realizado estudios con 16 especies distintas de microorganismos, identificando a los taxones procarióticos como los mejores inhibidores de la humificación en condiciones de pH 1, y temperaturas oscilantes entre 30 y 50 ºC (Johnson et al., 2001).
Asimismo, se ha observado una marcada inhibición en la degradación del citrato por la Klebsiella oxytoca cuando metales como Al, Cd, Co, Cu y Zn se enlazan con un anión orgánico (Renella et al., 2004).
Por otro lado, existen bacterias del género Caulobacter que inhiben la formación de ácido en desechos piríticos. Análisis de laboratorio han permitido calcular la reducción en costes de neutralización y almacenamiento de lodos ácidos gracias a ellas (Yang et al., 2008).
b) Inhibición bacteriana por medio del uso de detergentes aniónicos
La inhibición de las bacterias oxidantes del Fe (Thiobacillus ferrooxidans) se puede conseguir con diversas sustancias, como los surfactantes aniónicos, que han demostrado lograr la inhibición de modo económico y ambientalmente seguro (Li et al., 2009).
El lauril sulfato sódico (SLS, por sus siglas en inglés sodium laureth sulfate) es bastante efectivo en la limitación de la población bacteriana (Li et al., 2009). Muestras que contienen SLS en concentraciones ascendentes de 5 a 25 ppm muestran un descenso proporcional del cultivo bacteriano hasta detenerlo para 30 ppm. De esta forma, el SLS en concentraciones de 30 ppm y superiores provocará que la acidez y la concentración de hierro sean fuertemente reducidas (Li et al., 2009). En concentraciones bajas, el SLS actúa alterando las propiedades semipermeables de la membrana citoplasmática de la bacteria, permitiendo así la entrada de hidrogeniones en la celda, lo que da lugar a disfunciones en el metabolismo y a una reducción en la velocidad de oxidación del hierro. Las concentraciones elevadas de SLS dañarán de tal modo la membrana que matarán a las bacterias (Urbanová et al., 2011). El SLS se administra con riego por aspersión en soluciones diluidas sobre las escombreras de forma que queden saturados los 30 cm superficiales, donde se produce fundamentalmente la oxidación. Con el paso del tiempo y las precipitaciones, el producto irá profundizando. El SLS se ha mostrado ineficaz en algunas ocasiones, por lo general en zonas con elevadas precipitaciones y baja capacidad de adsorción de los materiales piríticos (Li et al., 2009).
La adición de pequeñas cantidades de surfactantes aniónicos desde el inicio de formación de las escombreras impide la proliferación de bacterias ferrooxidantes. De esta manera, las raíces de la vegetación, que requieren oxígeno, comenzarán a desarrollarse de manera adecuada, formándose un ambiente reductor que impedirá ya desde el inicio la degradación ácida de los materiales presentes en la escombrera (Ohimain et al., 2004).
c) Inhibición bacteriana por medio del uso de conservantes biológicos
Se trata de una técnica que utiliza sustancias orgánicas conservantes tóxicas para Thiobacillus ferrooxidans. No producen otro tipo de impacto ambiental y se mantienen perfectamente fijadas a los materiales de la escombrera.
Unas de las sustancias más investigadas y ensayadas por su eficiencia son el benzoato sódico (SBZ por su nombre en inglés, sodium benzoate) y el sorbato potásico (PSB del inglés, potassium sorbate) (Bhatnagar & Singh, 1991). Cuando las muestras contienen unas concentraciones de inhibidor de hasta 30 ppm, se produce un descenso en la población bacteriana debido a la inhibición parcial, mientras que para concentraciones de 40 ppm y mayores, el SBZ y PSB reducen altamente los parámetros a controlar (Singh, Bhatnagar, & Sinha, 1990). Estas sustancias pueden reaccionar con aguas ácidas, precipitando sales orgánicas (sorbatos y benzoatos), que de ser redisueltas liberarán ácido benzoico y sórbico, también identificados como eficaces inhibidores de T. ferrooxidans (Bhatnagar & Singh, 1991). El PSB se ha mostrado como el inhibidor más eficaz, pero es también el más caro, mientras que el SBZ y el SLS presentan efectividad análoga, siendo el SBZ más barato.
d) Inhibición bacteriana por medio de la aplicación de vegetación
Los suelos de áreas descubiertas afectadas por la minería de arranque de carbón exhiben por lo general bajos pH y altas concentraciones de metales (Johnson & Hallberg, 2005). Las áreas con vegetación presentan pH elevados y tendrán mayores niveles de macronutrientes. Johnson y Hallberg detectaron que la diversidad de las familias de hongos en suelos con actividad minera es inferior, en comparación con áreas no explotadas (Johnson & Hallberg, 2005). La aplicación de vegetación sobre escombreras disminuye la producción de ácido a través de los siguientes fenómenos (Johnson & Hallberg, 2005):
La raíz compite por el oxígeno y la humedad con bacterias productoras de ácido.
El establecimiento de poblaciones de bacterias y hongos conlleva al consumo adicional de oxígeno y a la formación de ácidos orgánicos, que pueden inhibir las T. ferrooxidans.
Los niveles de dióxido de carbono en la escombrera aumentarán debido a la respiración de la raíz y la población bacteriana heterótrofa, creándose así un microambiente desfavorable para el desarrollo de las T. ferrooxidans.
La vegetación estabiliza la cubierta, protegiéndola del viento, la erosión e infiltración de agua.
Se usan dos enfoques generales en la revegetación de escombreras con niveles tóxicos de metales pesados (Johnson & Hallberg, 2005):
Un enfoque incluye la siembra de genotipos más o menos tolerantes al metal en el residuo.
El segundo enfoque es la adición de lodos de aguas residuales, composta o residuos similares a la superficie de las escombreras para facilitar la vegetación.
El establecimiento de la cubierta vegetal puede facilitarse usando plantas tolerantes al metal, empleando una capa de cubierta especial donde las plantas se siembran, adicionando fertilizantes, inoculando micorrizas y/o aplicando plantas en simbiosis con bacterias fijadoras del nitrógeno. De este modo se posibilita el crecimiento de plantas en los residuos, a pesar de su bajo contenido en materia orgánica y nutrientes, como nitrógeno y fósforo.
La elección de la vegetación es de particular importancia y se realiza considerando el lugar, las condiciones climáticas y los genotipos tolerantes a altas concentraciones del metal (Trumm, 2010). El éxito de la recuperación vendrá indicado por el aumento de la producción del suelo, a través de la acumulación continua de materia orgánica medida sobre la base de la acumulación de detritos, los contenidos en carbono y nitrógeno orgánico, y la proliferación de raíces. Todas estas características están fuertemente influenciadas por la actividad microbiana (Trumm, 2010).
La microflora del suelo es de gran importancia para el establecimiento de vegetación saludable. Los vertederos de minas presentan a menudo bajos contenidos en nutrientes clave, como nitrógeno y fósforo, por lo que es esencial determinar el protagonismo de los microorganismos simbióticos (hongos micorrizas y bacterias fijadoras del nitrógeno) para mejorar el nivel de nutrientes de las plantas usadas para colonizar los residuos de mina (Visser, Straker, & Turchenek, 2010). La inoculación de micorrizas, combinada con arcilla expansiva y fertilizantes de nitrógeno y fósforo, obtuvo un óptimo desarrollo de plantas en una escombrera de una antigua mina de zinc (Pierzynski, Lambert, Hetrick, Sweeney, & Erickson, 2002).
Hay indicios de que las bacterias simbióticas fijadoras del nitrógeno pueden jugar un papel importante en la formación del suelo en los vertederos de minas (Chabbi & Rumpel, 2004). Las escombreras de una mina de uranio en Colorado fueron cubiertas de 15 a 20 cm de arena arcillosa, fertilizada principalmente con Indian ricegrass (Oryzopsis hymenoides), que se desarrolla en lugares donde ocurre la fijación del nitrógeno (Wullstein, 1980). La fijación del nitrógeno observada en este estudio evitó la necesidad de aplicar nitrógeno. La estabilización de las cubiertas arenosas es otra ventaja conseguida por la aplicación de pastos.
El correcto desarrollo del ciclo del nitrógeno en los ecosistemas de los ambientes de mina es necesario para la revegetación y la estabilidad a largo plazo (Reuben, Worwood, Carrigan, & Sorensen, 2011). Considérese que los residuos de mina no están siempre asociados con la falta de nitrógeno. Sorensen y Fresquez encontraron en áreas de vertederos de carbón en Nuevo México que el nitrógeno orgánico fósil asociado con el lodo y el carbón puede conducir a altos valores de nitrógeno total, amonio, nitrato y nitrito (Sorensen & Fresquez, 1991). Otro aspecto importante del ciclo del nitrógeno es la generación de acidez a través de la nitrificación, que puede dificultar la recuperación. Sin embargo, la desnitrificación consume protones y aumenta el pH.
Se ha demostrado que la adición de fangos residuales en lugar de fertilizantes inorgánicos tiene mejores resultados en el establecimiento y mantenimiento de la vegetación. Además, la vegetación en los residuos de mina contaminados por metales pesados puede servir en ocasiones de pasto para animales, lo que generaría un problema mayor debido a la asimilación de los metales por parte del ganado y su correspondiente dispersión a otros grupos de la biosfera, provocando efectos tóxicos, incluso para el ser humano (Malik, 2004; Ahluwalia & Goyal, 2007).
El establecimiento de vegetación en áreas minadas puede influir de modo negativo en la movilidad del metal, pues los ácidos orgánicos producidos por la actividad microbiana o por las emanaciones orgánicas de plantas en la rizosfera cambian ampliamente la movilidad de los metales pesados (Schwab, Splichal, & Banks, 2006). En un estudio de campo en Kansas, centrado en la influencia de cuatro ácidos orgánicos principales muy comunes en ese suelo, como ácido fórmico, succínico, acético y láctico, se analizó la movilidad de metales pesados en residuos de mina y suelo no contaminado en condiciones de saturación. Los resultados no fueron concluyentes debido a la dificultad que conllevó su interpretación, porque todos los ácidos estaban presentes en todos los experimentos, incluso si no habían sido añadidos, y se encontraron dificultades para separar los efectos provocados por los ácidos orgánicos y los del pH. De todos modos, la adición de ácidos orgánicos indujo un aumento en la actividad microbiana y una mejora de la inmovilización microbiana del zinc, lo cual fue diferente a lo esperado (Schwab et al., 2006).
Aunque el objetivo inmediato de la recuperación es establecer una cubierta vegetal para prevenir la erosión del suelo, como objetivo a largo plazo están la estabilidad y el desarrollo del ecosistema del suelo. Por lo tanto, es crucial que la recuperación asegure una sucesión en el ecosistema para presentar condiciones tan estables como las del ambiente no perturbado.
Biorremediación: reducción de la acidez de los AMD
Como la prevención no siempre es posible, los AMD ya generados deben ser tratados. Existen numerosas revisiones bibliográficas sobre este tema (Klein et al., 2013; Sánchez-Andrea, Sanz, Bijmans, & Stams, 2014). Entre las técnicas microbianas encaminadas a reducir la acidez generada por las actividades mineras se encuentra el uso de microbios transformadores de azufre (Johnson & Hallberg 2005; Koschorreck, 2008; Muyzer & Stams, 2008; Barton & Fauque, 2009; Sheoran, Sheoran, & Choudhary, 2010; Klein et al., 2013); microbios transformadores de metales (Ehrlich, 2001; Wall & Krumholz, 2006), y uso de humedales (Younger, 2000; Batty & Younger, 2002; Weber, Werker, Gehder, Senger, & Legge, 2010; Guo & Cutrigh, 2015; Guo, Cutrigh, & Duirk, 2015).
a) Biorremediación por medio del uso de microbios transformadores de azufre
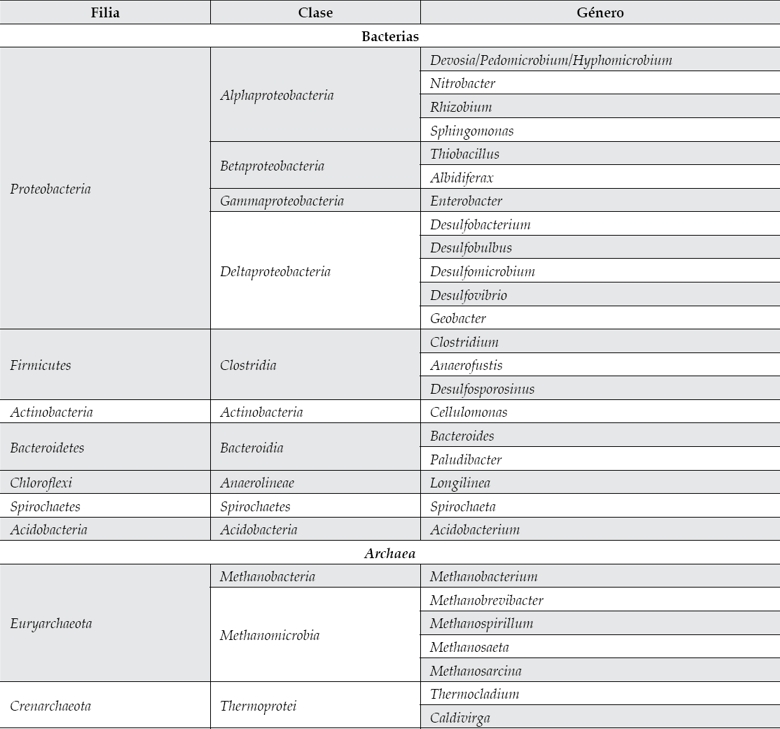
Los microorganismos procariotas capaces de reducir la concentración de azufre son fundamentalmente bacteria y archaea, y constituyen un grupo de más de 40 géneros (Klein et al., 2013), cuya actividad depende de su capacidad para oxidar sustancias orgánicas y transformarlas por completo en CO2 (Sánchez-Andrea et al., 2014). Una selección de los microrganismos más empleados en la remediación de los AMD (Klein et al., 2013; Sánchez-Andrea et al., 2014) se encuentra en el cuadro 1.
Cuadro 1 Géneros empleados para reducir el azufre en los AMD. Fuentes: Klein et al., 2013; Sánchez-Andrea et al., 2014.
El proceso de reducción bacteriana de sulfatos ha sido utilizado principalmente en reactores biológicos a escala piloto (Tabak, Scharp, Burckle, Kawahara, & Govind, 2003; Newcombe & Brennan, 2010; Bekmezci, Ucar, Kaksonen, & Sahinkaya, 2011; Kumar, McCullough, & Lund, 2011; Sánchez-Andrea et al., 2014). En una de estas investigaciones se desarrolló un sistema para tratar agua contaminada por metales de una mina de carbón y un vertedero de residuos fundidos en Pensilvania, usando composta de champiñón como una fuente de carbono orgánico para la reducción bacteriana de sulfato (Newcombe & Brennan, 2010). La composta de champiñón contenía caliza, que añadía alcalinidad al sistema. Las concentraciones de Fe, Zn, Mn, Ni y Cd se vieron disminuidas en más del 95% debido a la precipitación de los metales dentro de los reactores. El pH en uno de los sistemas aumentó desde 3.7 en el afluente hasta 6.9 en el vertido. Los efectos beneficiosos del tratamiento pueden ser por una precipitación del metal, dependiendo del pH en el reactor (Newcombe & Brennan, 2010).
En el campo, el sulfuro de hidrógeno (gas tóxico) se pierde en la atmósfera como resultado de la reducción de sulfato que se produce cuando la acumulación de materia orgánica (hojas, césped y otros compuestos orgánicos) se acumula en los lagos ácidos de mina. La sucesión natural microbiana es acelerada por la adición de materia orgánica, de preferencia con un contenido bajo de nitrógeno y fósforo (Kumar et al., 2011). El sulfuro de hidrógeno se emite a la atmósfera a pH próximos a 6 y 7, y por lo tanto se elimina acidez del sistema.
Kumar et al. concluyeron que la ventaja de este método como medida de recuperación de lagos de minas ácidos radica en que el pH se eleva, y la acidez y el azufre se pierden sin crear un problema de lodos químicos (Kumar et al., 2011). Otra ventaja es que los residuos orgánicos pueden servir como material crudo para el proceso, eliminando por lo tanto otro problema de residuos. Sin embargo, estas investigaciones fueron hechas en laboratorio, sin comprobarse su efectividad en el campo.
Debe mencionarse que para algunos tipos de residuos de mina, la reducción de sulfato con la adición de compuestos orgánicos debe evitarse, ya que puede causar un problema de contaminación mayor. Por ejemplo, en algunas minas de uranio, el radio soluble es eliminado como un coprecipitado con bario mediante la adición de cloruro de bario y colas de efluentes ricas en sulfato. Estudios de laboratorio probaron que la adición de un sustrato de carbono exógeno provoca que la reducción de sulfato disuelva el sulfato de radio y bario (Fedorak et al., 1986).
No se conoce ninguna bacteria que forme azufre elemental directamente mediante la reducción del sulfato, así que para esto se necesita un cultivo mixto, que conste de bacterias reductoras de sulfato que conviertan el sulfato en sulfuro y unas bacterias oxidantes del sulfuro que transformen el sulfuro en azufre elemental. Sin embargo, Tabak et al. desarrollaron un proceso biológico para la eliminación de sulfato del efluente de una mina abandonada usando melaza como fuente de carbono orgánico en un reactor de lecho fijo anaeróbico con flujo ascendente (Tabak et al., 2003). Las bacterias reductoras de sulfato que viven simbióticamente con bacterias de azufre fotosintéticas cooperaron para convertir el sulfato vía sulfuro en azufre elemental.
b) Biorremediación por medio del uso de microbios transformadores de metales
Algunos procesos de oxidación, como la oxidación del hierro ferroso y manganeso manganoso, pueden llevar a la precipitación de los mismos. Los productos de la oxidación pueden estar acumulados en la superficie de la célula microbiana o estar precipitados sin relación con las células (Ehrlich, 2001). Los procesos de reducción darían lugar también a la precipitación, como la reducción del selénico o selenioso a selenio metálico. Sin embargo, la precipitación estará restringida a la tolerancia al metal del organismo activo involucrado en el proceso (Ehrlich, 2001). En un estudio previo, bacterias pertenecientes al género Clostridium, actuando junto con la Desulfovibrio, proporcionaron una disminución de las concentraciones de selenio, uranio, molibdeno y sulfato, mediante la conversión de sulfato a hidrógeno sulfuro, que después reaccionó con iones de uranilo y molibdato para formar precipitados insolubles. El selenio fue rebajado de 1.6 mg.l-1 a menos de 0.5 mg.l-1, probablemente por la reducción microbiana del selénico y selenioso solubles a selenio metálico insoluble (Wall & Krumholz, 2006).
c) Biorremediación por medio de la creación de humedales
Los humedales, tanto los naturales como los creados artificialmente, podrían ser adecuados para el tratamiento de los AMD. Este método ha recibido mucha atención, pues es relativamente barato. La consideración primordial al diseñar un humedal es la de proporcionar un sistema biológico que sea autogenerador y que también tenga la habilidad de amortiguar amplias fluctuaciones de la calidad del agua, condiciones climáticas y flujo (Johnson & Hallberg, 2005). Los humedales son por lo general sistemas de tratamiento de agua residual de bajo mantenimiento, incluyendo en éste la eliminación periódica y adición de caliza y biomasa, dragado, aumento del sedimento y control de plagas, como insectos.
Los sistemas de tratamiento por humedales artificiales, que se basan en los mismos procesos físicos, químicos y biológicos que tienen lugar en los humedales naturales, se clasifican en los siguientes dos tipos principales y se ilustran en la figura 2 (Johnson & Hallberg, 2005):

Fuente: http://www.ideassonline.org/.
Figura 2 a) Sistema de flujo libre; b) sistema de flujo subsuperficial.
Sistemas de flujo libre (FWS, por sus siglas en inglés free water surface): el nivel de agua está sobre la superficie del terreno (la superficie de agua está expuesta a la atmósfera) y el agua fluye a una baja velocidad a través de la vegetación del pantano en cuencas superficiales o canales.
Sistemas de flujo subsuperficial (SFS, por sus siglas en inglés sub-surface flow sytem): similares a los FWS, pero el agua fluye a través del sustrato, estando el nivel de agua por debajo de la superficie del terreno. Aunque requieren menos área son más difíciles de mantener. Tienen la ventaja de no producir olores ni mosquitos, pero los procesos en su interior son anaerobios.
Se llevan a cabo diversos procesos biológicos para mejorar la calidad del agua en los humedales: oxidación bacteriana; fijación del metal por parte de plantas y microorganismos; precipitación del metal, como sulfuros; adsorción por fases sólidas (Pulford, 1991). No está claro cuál de estos procesos es el más importante para tratar los AMD y puede diferir entre ubicaciones. Algunos enfoques en los humedales buscan dirigir los procesos microbianos, por ejemplo, promoviendo la reducción del sulfato. Dicha reducción de sulfato es favorecida por los bajos Eh y pH, condiciones anaerobias que predominan de forma típica en los humedales, excepto dentro de una capa de poca profundidad, donde el ambiente es aerobio. La bacteria que reduce sulfato usa la energía creada por la reducción de sulfato en tales ambientes, y por lo general es resistente y capaz de adaptarse a amplias variaciones del pH y temperatura; sin embargo, no tolera periodos largos de condiciones aerobias. Si las condiciones vuelven a ser aerobias (debido a fluctuaciones de nivel de agua u otros factores), las reacciones se revertirán y los humedales se convertirán en una fuente de sulfatos y metales. Aunque la actividad bacteriana está significativamente reducida en los casos donde el pH es menor de cinco, la bacteria puede controlar su microambiente regulando el pH a través de la reducción del sulfato (Pulford, 1991).
Para promover la reducción del sulfato en los humedales, a menudo se añade un sustrato orgánico para proporcionar una fuente de carbono para las bacterias reductoras de sulfato. Como ya se indicó, la composta de champiñón ha sido utilizado con este propósito; por una parte, por ser una fuente de carbono, pero por otra, por contener caliza que neutraliza la acidez (Newcombe & Brennan, 2010).
Cuando se diseña un humedal para hacer estas funciones, el área de tratamiento, la profundidad del agua, el número de celdas, la forma de la celda, la velocidad del flujo y el sustrato tienen que ser considerados y optimados para evitar la infiltración de agua al subsuelo (Johnson & Hallberg, 2005). En cuanto a los sistemas FWS, varios aspectos físicos son importantes cuando se diseña un humedal, como las concentraciones de metales pesados en este caso, tanto de entrada como de salida, pues determinan el tiempo de retención necesario y, en consecuencia, la superficie requerida para el humedal; de especial relevancia es la relación entre anchura y largura. Asimismo, hay que tener en cuenta la carga hidráulica, el área específica, y la profundidad y pendiente del fondo.
Recientemente se han obtenido resultados satisfactorios en fitoextracción con el empleo de cañas en pantanos (Guo et al., 2015; Guo & Cutright, 2015). Ambos trabajos consisten en la comparación del efecto de diferentes variables en la generación de placas de Fe y su fitoextracción. Guo y Cutright determinaron que el ácido cítrico es un buen elemento quelante para incrementar la absorción de metales por parte de las plantas, al contrario que las bacterias oxidizantes de Fe y los heterótrofos acidofílicos (Guo & Cutright, 2015). Guo et al. confirmaron la idoneidad del ácido cítrico para la aplicación, determinando una mayor absorción de metales con la mayor edad de la planta (Guo et al., 2015).
Dentro de la creación de humedales, se podría incorporar una de las nuevas líneas que se está desarrollando profundamente en los últimos años: el uso de microalgas (Gupta, Shrivastava, & Neeraj, 2001; Mehta & Gaur, 2005; Aguilera, Manrubia, Gomez, Rodriguez, & Amils, 2006; Aguilera, Souza-Egipsy, Gomez, & Amils, 2007; Aguilera et al., 2010; Munoz & Guieysse, 2006; Das et al., 2009; Souza-Egipsy, Altamirano, Amils, & Aguilera, 2011; Orandi, Lewis, & Moheimani, 2012; Orandi & Lewis, 2013). Las microalgas desarrolladas en AMD se caracterizan por sobrevivir en aguas con alto contenido de metales, baja concentración de nutrientes y bajo pH, y algunas de estas especies resistentes tienen la capacidad de extraer ciertos metales pesados de los AMD (Aguilera, Souza-Egipsy, Martin-Uriz, & Amils, 2008; Natarajan, 2008). Sin embargo, se requieren más investigaciones en este campo, pues la influencia de las condiciones ambientales influye en el desarrollo de tales algas (Orandi et al., 2012; Orandi & Lewis, 2013).
Conclusiones y líneas futuras de investigación
El tratamiento o prevención de los AMD es un proceso crucial a tener en cuenta en los planes de diseño, operación y cierre de las minas, pues su generación puede tener graves consecuencias medioambientales, en especial si llegan a sistemas fluviales o a acuíferos subterráneos por los que tienen acceso directo a seres vivos.
La generación de AMD se ve favorecida por la presencia de bacterias ferrooxidantes Thiobacillus ferrooxidans, que catalizan la oxidación de minerales sulfurados, como la pirita. Pero del mismo modo que hay bacterias que aceleran el proceso, también se puede recurrir a bacterias para anularlo por completo o ralentizarlo, siendo esto la base de las técnicas preventivas y de remediación, respectivamente.
En los últimos años se han desarrollado tratamientos biotecnológicos amigables con el medio ambiente; pero muchos de ellos sólo se han llevado a cabo a pequeña escala en laboratorio debido a que su implementación resulta cara en exceso, si se le compara con otras técnicas que se están empleando en la actualidad, basadas sobre todo en métodos físicos (Pozo, Puente, Lagüela, & Veiga, 2014).
Se requiere una mayor investigación en las bacterias presentes en las comunidades microbianas de los AMD que muestran un ratio de oxidación mayor que los Thiobacillus ferrooxidans, pues podrían ser interesantes para alcanzar la remediación. Como ya lo indicaron Klein et al., estas bacterias deberían ser aisladas y estudiadas de manera que fuera posible identificar las condiciones óptimas de desarrollo de las mismas (Klein et al. 2013). Además, es necesario considerar las combinaciones de diferentes estrategias microbiológicas y estudiarlas en futuras investigaciones, así como la combinación con diferentes técnicas físicas, con el objetivo de aumentar la inhibición y remediación de los AMD.
El estudio de la influencia de los diversos parámetros que caracterizan el agua, como pH y Eh, deben ser estudiados a profundidad, así como la influencia que generan los procesos microbianos para la oxidación del Fe en la disponibilidad de los elementos traza necesarios para el desarrollo celular.











 text new page (beta)
text new page (beta)