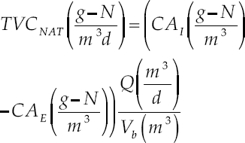Introducción
La acuicultura tiene en el agua su recurso natural más importante. Su uso es consuntivo, es decir, el agua sólo sirve como hábitat para los organismos acuícolas, pero no se consume. No obstante el modelo de producción que se utilice, la producción acuícola depende directamente de la calidad y cantidad del agua.
Al paso del agua por los estanques acuícolas se modifica su calidad por los residuos de los peces -disueltos y suspendidos- que se componen de heces fecales, alimento balanceado no consumido y biomasa muerta de bacterias (Timmons, Ebeling & Piedrahita, 2009). Estos residuos se componen primariamente de materia orgánica que al diluirse en el agua forman especies nitrogenadas, como el nitrógeno amoniacal total (N-NH4-N-NH3), especie altamente tóxica para los peces.
La concentración de contaminantes aumenta en el agua cuando no se tiene un flujo adecuado en los estanques acuícolas. En cualquier modelo de producción, la circulación del agua sirve como transporte de los contaminantes hacia cuerpos de agua cercanos o trenes de tratamiento de agua residual, según el modelo de producción utilizado.
En modelos de producción abiertos, cuando el agua entra a los estanques y se descarga directamente a los cuerpos de agua aledaños, la concentración de contaminantes se mantiene en intervalos adecuados, siempre que se abastezca de agua limpia. El efluente de los estanques lleva consigo concentraciones altas de contaminantes que impactan a los cuerpos de agua receptores y en los modelos sustentables tiene como receptor un tren de tratamiento que permite la remoción de los contaminantes del agua para luego conducirla, ya sea a cuerpos de agua cercanos o al mismo estanque.
Los modelos sustentables en la acuicultura se clasifican en: 1) sistemas de recirculación acuícola (SRA); 2) biofloc, y 3) acuaponia. Los tres modelos tienen en común remover los contaminantes del efluente para permitir la vida acuática. Sus diferencias estriban en las formas y dispositivos usados para realizar las operaciones unitarias de un tren de tratamiento de agua. Estos modelos tienen como función ahorrar agua, disminuir el impacto en el ambiente, aumentar la producción acuícola y reducir el uso de espacios, entre otras ventajas (Timmons et al., 2009).
Los sistemas de recirculación acuícola se han venido desarrollando desde hace más de treinta años, principalmente en los países en desarrollo, con el objeto de disminuir la cantidad de agua utilizada en las unidades de producción acuícola y mejorar el control de enfermedades, el crecimiento y, en general, la eficiencia del cultivo. No obstante los beneficios descritos, los sistemas de recirculación acuícola (SRA) tienen la limitante de requerir un consumo energético (Timmons, Ebeling, Summerfelt, Wheaton, & Vinci, 2002).
En general, los SRA se componen de cinco principales etapas (procesos y operaciones) que permiten sostener la calidad de agua necesaria para la vida acuática: circulación de agua, remoción de sólidos, biofiltración, oxigenación y eliminación de gases. Otros componentes complementarios son eliminación de color, filtración y desinfección.
La etapa de biofiltración se puede entender, en su sentido más amplio, como cualquier técnica de filtración que involucra organismos biológicos (vivos) para eliminar impurezas del agua. El nitrógeno es un nutriente esencial para todos los organismos vivientes que se encuentra en proteínas, ácidos nucleicos, nucleótidos y pigmentos. En el ambiente acuícola, el nitrógeno es un componente residual derivado del cultivo de los peces que tiene varias fuentes principales: urea, ácido úrico, aminoácidos excretados por los peces, detritos orgánicos de organismos muertos, alimento no consumido y heces fecales. En particular, los peces excretan varios desechos nitrogenados a través de la difusión en las agallas, orina y heces fecales (Konikoff, 1975).
La descomposición de estas especies nitrogenadas en los SRA es particularmente importante debido a la toxicidad del nitrógeno amoniacal total (NAT = N-NH4 + + N-NH3). El proceso de remoción de amonio por filtración biológica es llamado nitrificación y consiste en una oxidación sucesiva del amonio a nitritos y finalmente a nitratos. Los pasos de este proceso, normalmente, se llevan a cabo uno detrás del otro en un ambiente aerobio mediado por dos grupos de bacterias autótrofas quimiosintetizadoras. Las bacterias oxidantes del NAT incluyen géneros como Nitrosomonas, Nitrosococcus, Nitrospira, Nitrosolobus y Nitrosovibrio. Aquellas oxidantes de nitritos comprenden géneros como Nitrobacter, Nitrococcus y Nitrospina (Timmons et al., 2009). Estos organismos se fijan a medios filtrantes formando una biopelícula.
La nitrificación se ve afectada por diversas variables y su comportamiento entre ellas (Lekang, 2013). Uno de los factores limitantes es la concentración de oxígeno disuelto en el agua. Este puede afectar directamente el proceso. Una concentración igual o mayor a 2 mg/l puede resultar en una tasa de nitrificación adecuada. Las bacterias que intervienen tienen una alta sensibilidad a la temperatura. Valores entre 10 y 15 ºC en el agua requieren reactores con largos tiempos de retención para permitir el crecimiento de bacterias nitrificantes. El pH y la alcalinidad tienen un impacto importante en la eficiencia de conversión de NAT a nitritos y estos a nitratos. Cuando se tienen valores de pH menores que cuatro se inhibe el proceso. La alcalinidad, entonces, tiene dos funciones: mantener niveles de pH por arriba del valor neutro, y para contrarrestar concentración de iones hidrógeno en el agua mediante un sistema buffer donde se implica a los carbonatos y bicarbonatos.
La concentración de materia orgánica disuelta en el agua es uno de los factores críticos que afectan la operación de la nitrificación. Las bacterias heterótrofas -encargadas de remover la materia orgánica- tienen una tasa de crecimiento máxima cinco veces mayor que las bacterias nitrificantes, por lo que las bacterias heterótrofas tienen mayor éxito al competir por el espacio y el oxígeno disuelto en la biopelícula; en consecuencia, pueden llegar a inhibir la nitrificación (Lekang, 2013).
Para remover las especies nitrogenadas se han propuesto diferentes tecnologías de filtración biológica; sin embargo, un biofiltro ideal es aquel que remueve 100% del amonio y los nitritos, es de bajo costo, no es presurizado, no requiere de mantenimiento para su operación y no retiene sólidos. Desafortunadamente no existe un biofiltro que cumpla todas estas características. Todo biofiltro tiene ventajas y desventajas en las diferentes áreas de aplicación.
Los SRA que se aplican en grandes escalas comerciales tienden a utilizar biofiltros granulares, como lechos expandidos, fluidizados y de perdigones flotantes; no obstante, hay diferentes tipos de biofiltros que son utilizados, como biofiltros sumergidos, percoladores, biocilindros, biofiltros de perdigones flotantes, etcétera (Timmons et al., 2009).
El objeto de este trabajo es evaluar la eficiencia del proceso de remoción de nitrógeno en biofiltros acuícolas de biomasa fija en zonas de grandes altitudes y temperaturas del agua bajas. Para evaluar el desempeño de los biofiltros (eficiencia de remoción), Drennan et al. (2006) proponen correlacionar la concentración de nitrógeno amoniacal total (NAT) en el influente del biofiltro y la tasa volumétrica de remoción de nitrógeno amoniacal (TVCNAT ):
Donde TVCNAT = tasa volumétrica de remoción de nitrógeno amoniacal; CAI = concentración de nitrógeno amoniacal en el influente del biofiltro; CAE = concentración de nitrógeno amoniacal en el efluente del biofiltro; Q = caudal que pasa a través del biofiltro, y Vb = volumen de empaque en el biofiltro.
Zhu y Chen (1999) reportan tasas en reactores de lechos fluidizados de 374 g NAT/m3·d; sin embargo, en trabajos subsecuentes reportan tasas de 312 y 291 g NAT/m3·d para el mismo filtro (Zhu & Chen, 2001). Para filtros de arena fluidizado, Ling y Chen (2005) lograron tasas de 956 g NAT/m3·d y 4 917 g NAT/m3·d, con una razón (C/N) de 1.0 y 2.0, respectivamente. Cabe subrayar que todos los estudios previos se hicieron bajo condiciones de laboratorio y con cultivos monoespecíficos.
Estudios a escala piloto reportan tasas volumétricas de conversión de nitrógeno amoniacal total para filtros de perdigones y fluidizados de arena de 127 y 117 g NAT/m3·d, respectivamente (Pfeiffer & Malone, 2006). A nivel comercial, Guerdat, Losordo, Classena, Osborneb y Delonga (2010) reportan tasas de 704 g NAT/m3·d para un filtro de lecho fluidizado, 267 g NAT/ m3·d para un biorreactor de poco espacio y 586 g NAT/m3·d para un filtro de perdigones.
Los valores de las TVCNAT se ven afectados por factores ambientales, como temperatura, concentración de oxígeno, pH y cargas de nitrógeno y carbono, así como por el manejo que se le da al biofiltro (Suhr & Pedersen, 2010). Entre mayor sea la concentración de contaminantes, mayor será la remoción de NAT. Sin embargo, la eficiencia de remoción de NAT no depende de la TVCNAT , pues entre más estable es el comportamiento entre el flujo de agua y el empaque del biofiltro mayor es la eficiencia (Pfeiffer & Wills, 2011; Suhr & Pedersen, 2010).
La tasa de conversión de NAT por lo general se relaciona con el volumen de empaque utilizado en el biofiltro. Se utiliza el volumen por la dificultad de estimar el área efectiva de empaque. Cuando es posible determinar el área se pueden reportar los valores en función de ésta. Pedersen, Oostervelda y Pedersen (2015) reportan valores de tasa métrica de conversión de nitrógeno amoniacal total (TMCNAT ) de 0.2 y 0.14 g NAT/m2·d para biofiltros de lechos suspendidos y lechos de biomasa fija, respectivamente.
Metodología
Se llevó a cabo un experimento de 62 días en un biofiltro percolador-columna de arena inserto en un sistema de recirculación acuícola (SRA) para la producción de trucha arcoíris (Oncorhynchus mykiss), que se encuentra ubicado en el Centro Interamericano del Agua, a 2 660 msnm, en la meseta central de México. Este sistema consiste en un estanque acuícola circular con remoción de sólidos al centro del mismo y un biofiltro percolador-columna de arena denominado UFiPA. Se utilizó un caudal de 2.1 l/s (181.44 m3/d). Diariamente se purgaron 100 litros de agua con residuos sólidos del estanque, mismos que se repusieron con agua de lluvia cosechada.
Se introdujeron 418 organismos con una longitud de 19 cm y peso de 287 g. Se inició con una biomasa de 119.96 kg a una densidad de 13.3 kg/m3. Se alimentaron diariamente con dieta balanceada de la marca El Pedregal; la ración y el tamaño del gránulo se determinaron con base en las recomendaciones del fabricante.
Se utilizó agua cosechada de lluvia (cuadro 1). Se agregó sal, cal y bicarbonato de sodio para adecuarla a las condiciones fisicoquímicas que permitieran un crecimiento adecuado de los organismos.
El agua empleada fue suficiente para llenar una vez el prototipo y para reponer el agua debido a pérdidas por evaporación, drenado de lodos, toma de muestras, operación del tren de tratamiento y probables fugas. De acuerdo con investigaciones anteriores (García-Pulido, Gallego-Alarcón, Díaz-Delgado, Fall, & Burrola-Aguilar, 2011), este volumen es estimado en 2.0% del total del sistema.
El origen de las especies nitrogenadas (NAT) en el agua de lluvia fue, como lo mencionan Evans, Coombes y Dunstan (2006), la contaminación del techo del laboratorio por aves, insectos o pequeños mamíferos que defecan o mueren en la superficie que colecta el agua. Para descartar el problema se eliminó el agua derivada de las primeras lluvias de la temporada (Lee, Lau, Kayhanian, & Stenstrom, 2004). Sin embargo, aun así se tuvo una concentración de nitrógeno amoniacal total en el agua pluvial de 0.92 mg N-NAT/L, la cual se disminuyó al pasar por el tren de tratamiento del SRA.
Maduración del sistema
La maduración de un biofiltro se entiende como el momento en el cual se logra la máxima capacidad del mismo. Según varios autores, ésta se logra cuando la concentración de NAT en el efluente se estabiliza por debajo de 0.7 mg/l (Timmons et al., 2009; Colt, Lamoureux, Patterson, & Rogers, 2006; Sandu, Boardman, Watten, & Brazil, 2002; Menasveta et al., 2001; Zhu & Chen, 2001). Este proceso se obtiene cuando el empaque se ha poblado por una comunidad de bacterias especializadas en la oxidación de los nutrientes disueltos en el agua. Se consideró maduro el biofiltro una vez sembrados cien organismos de la especie Oncorhynchus mykiss (trucha arcoíris), peces y cuando la concentración de nitrógeno amoniacal total en el efluente del estanque fue constante por debajo de 0.2 mg NAT/l.
Monitoreo del tren de tratamiento
El monitoreo del sistema se llevó a cabo en la entrada y salida del biofiltro (figura 1). Para determinar la TVCNAT se analizó la concentración de nitrógeno amoniacal total (NAT) en laboratorio, y oxígeno disuelto (OD), temperatura y pH in situ. La determinación de los parámetros medidos in situ se realizó diariamente entre las 7:00 y las 8:00 horas para evaluar las condiciones más críticas de los mismos.

Figura 1 Esquema del (a) Sistema de recirculación acuícola (unidades en metros) y del (b) biofiltro percolador-columna de arena. A, B, C puntos de muestreo en el biofiltro; D y E puntos de muestreo en el estanque.
De manera paralela, para determinar la eficiencia de remoción se llevó a cabo en los mismos puntos de muestreo el monitoreo de nitritos (N-NO2), nitratos (N-NO3), demanda química de oxígeno (DQO), sólidos suspendidos totales (SST) y alcalinidad.
La determinación del NAT se realizó dos veces por semana, considerando una estrategia de muestreo aleatorio estratificado para lograr estimaciones más precisas (con menor varianza) para toda la población (Lohr, 2000). Como estratos fueron considerados los intervalos de la biomasa. Con un tamaño de muestra de 67 individuos se obtuvo una precisión de 12.5%, con un nivel de confianza (1-α) de 95%.
Modelación de la tasa volumétrica de conversión del nitrógeno amoniacal total
Con base en los datos de NAT adquiridos se determinó la tasa volumétrica de conversión de nitrógeno amoniacal total. La tasa se estimó diariamente con base en la ecuación (1) (Guerdat, Losordo, Classena, Osborneb, & Delonga, 2010; Malone & Pfeiffer, 2006; Drennan et al., 2006). Debido a que las concentraciones de NAT fueron bajas, la TVCNAT se modeló mediante una regresión lineal (Malone & Pfeiffer, 2006).
Resultados y discusión
Maduración del biofiltro
El tiempo de maduración fue de 37 días, momento en el cual la concentración de NAT en el estanque se estabilizó y resultó menor a 0.2 mg de NAT/l (Colt et al., 2006). Cuando el sistema se consideró maduro, se sembró el resto de los organismos para llegar a la biomasa inicial de estudio.
La figura 2 muestra el comportamiento del NAT a la salida del biofiltro en función del tiempo. Se dio un incremento de la concentración de nitrógeno amoniacal total hasta el día 22; después, ésta cae a valores menores a 0.2 mg NAT/l, lo que indicó que se tenía una población aceptable de bacterias en el biofiltro que oxidan los compuestos nitrogenados.

Figura 2 Comportamiento del nitrógeno amoniacal total en el tiempo de maduración del biofiltro. Limites óptimos, de tolerancia y letales tomados de García-Pulido et al. (2011).
El lapso utilizado para madurar los biofiltros varía de 7 a 60 días. Depende de varios factores, los principales son la temperatura del agua y la concentración de nutrientes en la misma. Esta última se logró con la introducción de truchas al estanque, que aportaron en promedio 1.10 ± 0.60 mg NAT/l al influente del biofiltro. La temperatura media del agua en el estudio fue de 17.09 ± 1.27 ºC. Tales valores llevaron al biofiltro a madurar en 5.2 semanas, dentro del intervalo reportado (Colt et al., 2006; Sandu et al., 2002; Menasveta et al., 2001; Zhu & Chen, 2001).
Desarrollo de la trucha arcoíris
La biomasa alcanzada fue de 180.42 kg, con un peso promedio de 472.31 ± 66.78 g, una densidad de 28.73 kg/m3 (61 org/m3), un incremento diario en el peso de 4.23 g/d, con una tasa específica de crecimiento (TEC) de 0.74% peso/d. El consumo total de alimento fue de 157.07 kg, con un porcentaje de ración diaria de alimento balanceado (45% de proteína y 16% de lípidos) de 1.13 ± 0.23%, con un factor de conversión alimenticia (FCA) de 1.37.
Con base en la TEC, el crecimiento estuvo en niveles aceptables, pero bajos. Los intervalos reportados se encuentran entre 0.82 y 2.03% peso/d (Safari & Mehraban, 2014; Dalsgaard, Larsen, & Pedersen, 2015; Papoutsoglou et al., 2013; Larsen, Skov, & Jokumsen, 2012; McKenzie et al., 2012; Karakatsouli et al., 2008; Papoutsoglou, Karakatsouli, & Chiras, 2005). Sin embargo, los trabajos reportados con valores altos de la TEC se hicieron bajo condiciones de laboratorio, con un manejo controlado de los factores que influyen en el crecimiento.
La mortalidad de 1.84 ± 1.93% se mantuvo por debajo de lo reportado por Blanco (1995) para la fase de engorda de la trucha arcoíris. De acuerdo con este autor, un cultivo de flujo abierto (tecnología tradicional) tiene mortalidades del orden de 2% en esta fase.
Eficiencia de remoción del biofiltro
Cuando la cantidad de materia orgánica, representada por la DQO, es baja (menor que 50 mg/l), los biofiltros se especializan en la remoción de especies nitrogenadas. En este comportamiento, si bien existe remoción de materia orgánica, no es significativa (Eding, Kamstra, Verreth, Huismana, & Klapwijkc, 2006). Las cargas de materia orgánica que entraban al biofiltro eran, en promedio, de 49.27 ± 0.33 mg/l; la remoción de DQO en el percolador fue de 11.14 ± 0.67%. Aun en este porcentaje de remoción, la materia orgánica no representaba un peligro para los peces (García-Pulido et al., 2011).
La característica anterior, normal en una producción acuícola (García-Pulido et al., 2011), llevó a diseñar el percolador en el tren de tratamiento como un biofiltro para remover las especies nitrogenadas disueltas en el agua, primordialmente el nitrógeno amoniacal total. Este ion es el principal factor limitante para la vida acuática y, en consecuencia, en la producción trutícola es indispensable conocer y controlar su concentración en el agua, pues aun a niveles muy bajos (< 1.0 mg/l) puede llegar a ser tóxico. Timmons y Ebeling (2010) mencionan que en concentraciones mayores a 1.0 mg/l es letal para la trucha arcoíris.
La eficiencia del biofiltro con base en la remoción de especies nitrogenadas fue 77.22 ± 0.5%, 26.46 ± 0.58% para NAT y N-NO2, respectivamente (figura 3). Dos factores que contribuyeron a contar con una remoción menor que 80% de nitrógeno amoniacal total fueron el pH y la alcalinidad. Aunque estos parámetros se mantuvieron en intervalos de tolerancia y óptimos (pH 6.98 ± 0.07 y alcalinidad 65.14 ± 0.69 mg/l como CaCO3), Bonvendeur (1989) indica que el pH a un valor de 8 permite 100% de la nitrificación en un biofiltro. En función de la disminución de éste, el valor de remoción de compuestos nitrogenados desciende. Valores de pH menores a 7 inhiben el proceso de nitrificación (Boyd & Craig, 2012).
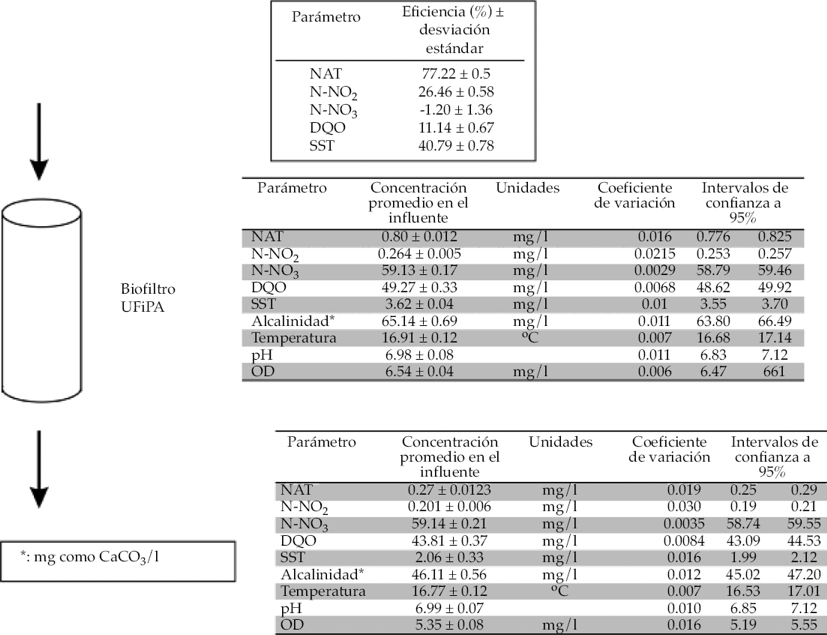
Figura 3 Eficiencia remoción de nutrientes del biofiltro, concentraciones en el influente y el efluente del mismo.
La alcalinidad es un parámetro determinante para que el proceso de nitrificación se lleve a cabo en condiciones adecuadas (Boyd, 1990). Los carbonatos representados por la alcalinidad son coadyuvantes para la producción de biomasa de bacterias nitrificantes (Timmons & Ebeling, 2010). La concentración de alcalinidad en el influente del biofiltro fue de 65.14 ± 0.69 mg/l como CaCO3. Una buena nitrificación se logra con alcalinidad mayor a 100 mg/l como CaCO3; sin embargo, a 50 mg/l como CaCO3 este proceso se lleva a cabo con eficiencia aceptable (mayor que 60%); pero en concentraciones menores que 25 mg/l como CaCO3 puede ser letal para la biopelícula del percolador (Timmons & Ebeling, 2010; Loyless & Malone, 1997).
Aun con el impacto de estos factores, las concentraciones de los parámetros limitantes en el efluente del biofiltro fueron aceptables para permitir la vida de la trucha arcoíris (cuadro 3).
El biofiltro consiste en dos operaciones unitarias que se llevan a cabo mediante el percolador y la columna de arena. En el primero se efectúa el proceso de biofiltración, en la columna de arena también se realiza la biofiltración y a la vez se remueven sólidos originados en el estanque y en el percolador. Los SST fueron removidos en 40.79 ± 0.78%. Aunque se puede considerar como una remoción baja, el intervalo de trabajo de este filtro para los sólidos entre la concentración de entrada y salida fue de 1.56 mg/l.
La columna de arena se diseñó con características similares a un filtro lento de arena. Tuvo como objetivo depurar el agua mediante la sedimentación, filtración mecánica y biológica. Una de las funciones básicas de la filtración lenta es que lleve a cabo los procesos de nitrificación y oxidación de la materia orgánica. El tiempo de retención hidráulica (TRH) fue de 30 minutos, que con base en un filtro de arena lento para potabilización fue muy rápido. El TRH está en función de la carga de materia orgánica y nutrientes (Metcalf & Eddy, 2013). Las cargas de nutrientes y materia orgánica con las que se contó en el agua residual acuícola permiten reducir los tiempos de retención hidráulica para los filtros lentos de arena y aún así conservar sus funciones. No obstante, las concentraciones de materia orgánica, sólidos y compuestos nitrogenados se mantuvieron en niveles óptimos para el cultivo.
Tasa volumétrica de conversión de nitrógeno amoniacal total
Se modeló la tasa volumétrica de conversión de nitrógeno amoniacal total (TVCNAT ), que se define como el incremento diario de NAT convertido a nitrito (N-NO2) por unidad de volumen (Timmons et al., 2009). El biofiltro se analizó en tres etapas: 1) biofiltro UFiPA, 2) percolador y 3) columna de arena.
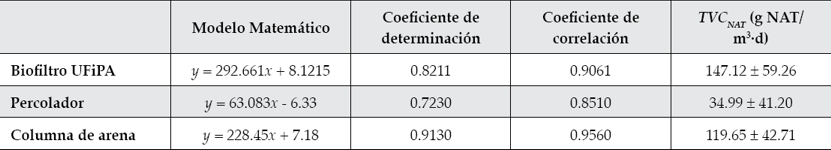
El biofiltro UFiPA presentó una dependencia lineal (R 2 = 0.8211; R = 0.9061) entre la concentración de NAT en el influente del reactor y su conversión a nitritos. De manera particular, tanto el percolador como la columna de arena presentaron también un comportamiento lineal. Con una fuerte dependencia R 2 = 0.913, R = 0.956 y R 2 = 0.723, R = 0.851, para el filtro de arena y el percolador, respectivamente (figura 4). La dependencia lineal entre la concentración de nitrógeno amoniacal total a bajas concentraciones y la TVCNAT ha sido concurrente en estudios previos en que se evaluó el desempeño de biofiltros (Guerdat et al., 2010; Zhu & Chen, 1999).

Figura 4 Efecto de la concentración de nitrógeno amoniacal en el influente y la tasa volumétrica de conversión de nitrógeno amoniacal total (TVCNAT ) en: (a) el biofiltro UFiPA, (b) la columna de arena y (c) el percolador.
Las tasas resultantes (cuadro 2) fueron menores a las reportadas en estudios realizados bajo condiciones de laboratorio. En el estudio de Liu, Che y Zhang (2013) utilizaron un biofiltro de perdigones secuencial donde llegaron a valores de 400 g de NAT/m3·d. Wu, Bao y Liu (2008) utilizaron un biofiltro de perdigones y obtuvieron tasas de 172 g de NAT/m3·d con concentraciones de NAT en el influente entre 2 y 3 g/m3. Zhu y Chen (1999) reportan tasas en reactores de lechos fluidizados de 374 g NAT/ m3·d. Para el mismo biofiltro, en trabajos subsecuentes, reportan tasas de 312 y 291 g NAT/ m3·d (Zhu & Chen, 2001). En filtros de arena fluidizado, Ling y Chen (2005) lograron tasas de 956 g NAT/m3·d y 4 917 g NAT/m3·d, con una razón (C/N) de 1.0 y 2.0, respectivamente.
Cuadro 2 Modelos matemáticos de la TVCNAT . Donde x = concentración de NAT en el influente en g/m3; y = TVCNAT en g de NAT/m3 d.
Estudios realizados a escala piloto reportan TVCNAT para filtros de perdigones y filtros fluidizados de arena de 127 y 117 g NAT/m3·d, respectivamente (Pfeiffer & Malone, 2006). A nivel comercial, Guerdat et al. (2010) reportan tasas de 704 g NAT/m3·d para un filtro de lecho fluidizado, 267 g NAT/m3·d para un birreactor de poco espacio y 586 g NAT/m3·d para un filtro de perdigones. Pedersen, Oostervelda y Pedersen (2015) evaluaron filtros de lechos suspendidos con tasas de 140 g de NAT/m3·d, con una eficiencia de remoción de NAT entre 49 y 59%.
Los valores reportados para las TVCNAT (117-4 917 g de NAT/m3·d) depende principalmente del tipo de biofiltro y de la concentración de NAT en el influente del mismo (Pfeiffer & Wills, 2011). En este estudio, se encontraron valores bajos en las tasas con respecto a los estudios realizados bajo condiciones de laboratorio. Sin embargo, el comportamiento de las TVCNAT fue similar al reportado en la producción de salmones y tilapia (Pedersen et al., 2015; Pfeiffer & Malone, 2006). La etapa de producción es un tercer factor que influye en los valores de las tasas. Se estima que para la engorda de peces son aceptables valores entre 140 y 300 g de NAT/m3·d (Malone & Beecher, 2000).
Las TVCNAT con valores altos son reportadas para filtros de medio móvil (filtros de perdigones, lechos suspendidos, lechos fluidizados). Los filtros de medio fijo (percoladores, biodiscos, columnas de arena) pueden llegar a tener valores 150% más bajos (Shur & Pedersen, 2010).
Aun con los valores de las TVCNAT obtenidos en este estudio, la eficiencia de remoción de NAT en el biofiltro fue alta: mayor a 70%, lo que indica que esta última es independiente de las TVCNAT (Pedersen et al., 2015; Liu et al., 2013). El biofiltro, percolador-columna de arena, reflejó una combinación exitosa en la remoción de NAT. Cuando se evaluó el desempeño de cada operación, los valores de las TVCNAT y el porcentaje de remoción de NAT resultaron bajos para el percolador, no así para la columna de arena.
La columna de arena tuvo un desempeño adecuado por sí sola, sin embargo, no es posible separarla. En el percolador se llevan a cabo procesos como la oxidación de materia orgánica y da inicio la nitrificación. Cuando llega el agua residual a la columna, ésta remueve con mayor facilidad los compuestos nitrogenados y la materia orgánica.
Conclusión
El biofiltro UFiPA, combinación de percolador-columna de arena, tuvo un desarrollo especializado en la remoción de compuestos nitrogenados. Tiene una eficiencia de remoción de NAT mayor que 70%, con valores bajos de TVCNAT . (147.12 ± 59.26 g NAT/m3·d). Este biofiltro mantuvo los parámetros limitantes disueltos en el agua por debajo del nivel tóxico para la producción sustentable de trucha arcoíris.











 nova página do texto(beta)
nova página do texto(beta)