Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Tecnología y ciencias del agua
On-line version ISSN 2007-2422
Tecnol. cienc. agua vol.6 n.3 Jiutepec May./Jun. 2015
Artículos técnicos
Cinética de consumo de nutrientes y crecimiento de un bloom de microalgas en un fotobiorreactor High Rate Algae Pond (HRAP)
Kinetics of Nutrient Uptake and Growth of a Bloom of Microalgae in a High Rate Algae Pond (HRAP) Photobioreactor
Sara Haro* y José Antonio Perales
Universidad de Cádiz, España
*Autor de correspondencia
Dirección institucional de los autores
M.G.I.A. Sara Haro
Centro Andaluz de Ciencia y Tecnología Marina
Campus Universitario de Puerto Real
Departamento Tecnologías del Medio Ambiente
11510 Puerto Real, España
Teléfono: +34 6 8731 4580
sara.haro@uca.es
Dr. José Antonio Perales.
Centro Andaluz de Ciencia y Tecnología Marina
Campus Universitario de Puerto Real
11510 Puerto Real, España
Teléfono: +34 95601 6747
ORCID ID: 0000-0001-6647-539X
joseantonio.perales@uca.es
Recibido: 22/01/2014.
Aceptado: 21/01/2015.
Resumen
En el presente trabajo se cultivó un bloom de microalgas en un fotobiorreactor piloto tipo high rate algae pond (HRAP),con un volumen de 450 l. Éste se operó en discontinuo, con un medio sintético y bajo condiciones ambientales de luz y temperatura. El objetivo era utilizar un modelo cinético que predijera las velocidades de crecimiento de biomasa, consumo de nitrógeno y fósforo, y la evolución del contenido de estos dos nutrientes en la biomasa. Los resultados parecen indicar que el contenido en nitrógeno y fósforo se redujo en más de un 80% en el agua residual sintética y que efectivamente el modelo resultó útil para predecir el consumo de nutrientes por las microalgas, lo que junto con los datos experimentales del contenido en nutrientes de la biomasa indicó la existencia de otros procesos que compiten con las microalgas en la eliminación de los nutrientes del fotobiorreactor.
Palabras clave: High rate algae pond, microalgas, nitrógeno, fósforo.
Abstract
In the present work, a bloom of microalgae was cultured in a pilotscale high rate algae pond (HRAP) photobioreactor with a volume of 450 l. This was performed in batch with synthetic media under natural light and temperature conditions. The objective was to predict the kinetics of biomass growth, nitrogen and phosphorus removal, and the evolution of the biomass content in these nutrients. The results show a reduction in nitrogen and phosphorus contents of over 80% with synthetic wastewater and that the model was useful to predict nutrient uptake by microalgae which, along with experimental data related to nutrient contents of biomass, indicates the existence of other processes that compete with microalgae in the removal of nutrients in a photobioreactor.
Keywords: High rate algae pond, microalgae, nitrogen, phosphorus.
Introducción
Uno de los problemas actuales de las masas de aguas naturales es la eutrofización. La eutrofización se define como "el aumento de nutrientes en el agua, especialmente de los compuestos de nitrógeno o de fósforo, que provoca un crecimiento acelerado de algas y especies vegetales superiores, con el resultado de trastornos no deseados en el equilibrio entre organismos presentes en el agua y en la calidad del agua a la que afecta" (Directiva 91/271/CE). Los principales nutrientes que conducen a la eutrofización de las aguas naturales son las formas de nitrógeno y fósforo (N orgánico, P orgánico, NH4+, NO2-, NO3- y PO43-) presentes en los efluentes secundarios de las plantas de tratamiento de las aguas residuales (Ruiz-Marin, Mendoza-Espinosa, & Stephenson, 2010).
Con el fin de minimizar este problema, la legislación europea establece una serie de requisitos para los vertidos procedentes de las instalaciones de tratamiento de aguas residuales urbanas realizados en zonas sensibles cuyas aguas sean eutróficas o tengan tendencia a serlo en un futuro próximo (Directiva 91/271/CE). Los valores límites más restrictivos establecidos para fósforo y nitrógeno total son de 1 y 10 mg 1-1, respectivamente (Directiva 98/15/CE).
Las estaciones convencionales de tratamiento de aguas residuales están diseñadas para eliminar de manera eficiente la materia orgánica y los sólidos en suspensión, pero no para eliminar el contenido en nitrógeno y fósforo total (Abdel-Raouf, Al-Homaidan, & Ibraeheem, 2012). Por lo tanto, para cumplir con los niveles establecidos por la legislación vigente en las zonas sensibles, se están incorporando nuevas tecnologías a los diagramas de flujos de las estaciones depuradoras de aguas residuales (EDAR) (Arbib, 2012). El cultivo de microalgas se propone como un tratamiento terciario eficaz para eliminar el nitrógeno y el fósforo presentes en las aguas residuales (Oswald & Gotaas, 1957). Los mecanismos empleados por las microalgas para la eliminación de nutrientes pueden deberse a proceso bióticos, relacionados con la asimilación de nutrientes, o a procesos abióticos asociados con stripping del amonio y precipitación del fósforo a valores de pH elevados. Entre las ventajas del uso de microalgas destacan el abaratamiento de los costos; la eliminación simultánea del nitrógeno y fósforo sin necesidad de adicionar una fuente externa de carbono; la obtención de un efluente oxigenado, beneficiando así el medio receptor, y la posibilidad de su implantación aguas abajo de la estación depuradora sin necesidad de remodelar la planta de tratamiento. Además, esta vía también puede ser explotada para la producción de biomasa con un alto valor como materia prima en la fabricación de biocombustibles de tercera generación, al igual que para la biofijación de dióxido de carbono y su retirada de la atmósfera (Arbib, 2012).
Los sistemas de cultivo de algas en suspensión se clasifican por lo general en sistemas abiertos y cerrados (Tredici, 2004). Los sistemas de cultivo abierto, que se han venido empleando desde los años de 1950, se pueden clasificar en aguas superficiales naturales, como estanques, lagunas y lagos, y estanques artificiales. Dentro de estos últimos, los denominados "raceway ponds" o "High Rate Algae Ponds (HRAP)" son los más empleados. Por otra parte, los sistemas cerrados son reactores transparentes, de plástico o vidrio, y se clasifican en placa plana, fotobiorreactores tubulares y sistemas de bolsas (Cai, Park, & Li, 2012). Los fotobiorreactores HRAP son estanques abiertos, poco profundos (15-30 cm de nivel de agua), en los que las algas y los nutrientes son impulsados por unas paletas rotatorias que giran alrededor de un eje horizontal. Estos sistemas se caracterizan por ser baratos, fáciles de construir y operar (Arbib, 2012; Cai et al., 2012).
Con respecto a la eliminación del nitrógeno y fósforo del agua residual, lo importante no es la velocidad a la que crecen las microalgas sino la velocidad a las que las microalgas consumen el nitrógeno y fósforo, ya que no todos los nutrientes consumidos por las microalgas son empleados para crecer. Las microalgas tienden a consumir nitrógeno y fósforo en exceso, proceso conocido como "luxury uptake" (Powell, Shilton, Chisti, & Pratt, 2008).
El "Phototreatment model (PhBT)" es un modelo cinético que combina los procesos de crecimiento de la biomasa y asimilación de nutrientes y como consecuencia permite predecir la evolución del contenido de nutrientes en la biomasa en experimentos en discontinuo. Los experimentos llevados a cabo para desarrollar el PhBT se realizaron a pequeña escala (utilizando frascos Pyrex de borosilicato de dos litros como fotobiorreactores), y en condiciones controladas de luz y temperatura en el laboratorio. Debido al pequeño tamaño de los fotobiorreactores, las microalgas no se cosecharon, por lo que no se comprobó de modo experimental si la cantidad de nitrógeno y fósforo presente en las microalgas coincidía con las cantidades estimadas por el modelo PhBT (Ruiz et al., 2012a).
En el presente trabajo se pretende reproducir el procedimiento cinético establecido por el PhBT, usando un fotobiorreactor piloto tipo HRAP, operando en discontinuo bajo condiciones ambientales de luz y temperatura para predecir las velocidades de crecimiento, el consumo de nutrientes, y el contenido de nitrógeno y fósforo presente en la biomasa.
Material y métodos
Microorganismos y medio de cultivo
Para este experimento se utilizó un bloom de microalgas, cuya especie dominante era Coelastrum sp., obtenido de los fotobiorreactores HRAP presentes en la planta piloto de la EDAR "El Torno", situada en Chiclana de la Frontera, Cádiz (36° 25' 38.15" N, 6° 9' 23.9" O), España. Para el cultivo de las microalgas se empleó medio COMBO (Kilham, Kreeger, Lynn, Goulden, & Herrera, 1998).
Fotobiorreactor
Para el desarrollo del experimento se empleó un fotobiorreactor piloto tipo HRAP. Se utilizó un HRAP de fibra de vidrio, con un volumen de 450 1, operando con una lámina de agua de aproximadamente 30 cm, y una superficie total de 1.93 m2 (2 525 mm de longitud, 750 mm de anchura y 450 mm de profundidad) (figura 1). Lo que supone una relación superficie-volumen (S/V) de 3.62 m-1. El cultivo se mezcla mecánicamente con cuatro paletas que giran en torno a un eje horizontal movidos por un motor a una velocidad óptima entre 5 y 7 rpm (Dodd, 1986).

La rueda de paletas está asentada sobre una depresión en el fondo del fotobiorreactor que sirve para reducir el flujo de retorno. Además, las paredes del HRAP están curvadas excéntricamente en sus extremos más alejados de la rueda de paletas para acelerar el flujo (Arbib et al., 2012).
Diseño experimental
El HRAP se puso a funcionar en las instalaciones habilitadas en el exterior del Centro Andaluz de Ciencia y Tecnología Marinas (Cacytmar).
El fotobiorreactor se inoculó con el bloom de microalgas hasta obtener una concentración inicial de entre 0.05 y 0.07 g SS 1-1.
El experimento se mantuvo en discontinuo hasta alcanzarse el estado estacionario; esto es, cuando la concentración de biomasa algal se mantuvo constante durante tres días consecutivos.
Procedimiento analítico
Se tomaron muestras todos los días y de manera aproximada a la misma hora. Los análisis realizados fueron concentración y composición de biomasa, concentración de nutrientes, y como parámetros de control se determinaron pH, intensidad lumínica y temperatura.
La biomasa en peso seco se determinó en forma de sólidos en suspensión mediante el método normalizado de los sólidos en suspensión secados en estufa de 103 a 105 °C (APHA-2540 D), para ello se emplearon filtros de fibra de vidrio (GF/F CAT núm. 1825-047, WhatmanTM).Ésta también se determinó de forma indirecta por densidad óptica a 680 nm.
Cada vez que la concentración de biomasa en el fotobiorreactor se veía incrementada en más de 0.1 g SS 1-1, se centrifugaba un volumen de cultivo adecuado para obtener la cantidad de biomasa necesaria para realizar, previo secado por liofilización, su análisis elemental de carbono, nitrógeno, hidrógeno, azufre (analizador CHNS Leco® 932) y fósforo (digestor microondas modelo Speed Wave de Berghof y espectrómetro de emisión atómica de plasma IRIS Intrepid de Thermo Elemental). Cada uno de los elementos analizados se determinó por triplicado; en el caso del fósforo, por duplicado.
La concentración de nitrógeno y fósforo total se determinó mediante el método de oxidación propuesto por Köthe y Bitsch (1992). Para la oxidación previa de la muestra se añadió una microcuchara de reactivo OXISOLV® (Merck KGaA, Darmstadt, Alemania) a 10 ml de muestra; se incubó a 105 °C durante 60 minutos y se dejó enfriar a temperatura ambiente. Posteriormente se prosiguió con el análisis del nitrógeno y del fósforo en forma de nitratos (N-NO3-) y fosfatos (P-PO43-) mediante los métodos colorimétricos de Müller y Weidemann (1995), y APHA 4500-P-E, respectivamente.
La concentración de nitrógeno en forma de nitratos (N-NO3-), amonio (N-NH4+) y nitritos (N-NO2-) se midieron al inicio y final del experimento, conforme a los métodos colorimétricos de Müller y Weidemann (1995), APHA 4500-NH3 D y APHA 4500-NO2 B, respectivamente. La concentración de fósforo en forma de fosfatos (P-PO43-) se midió de modo colorimétrico de acuerdo con el método normalizado APHA 4500-P-E.
El valor de pH se midió de forma electroquímica (pH-metro GLP 32, CRISON®). De manera puntual se tomaron datos de pH cada minuto durante 24 horas mediante una sonda de pH conectada a un data-logger de adquisición de datos, para poder estudiar cómo varía el pH en relación con el ciclo día-noche en función de la fotosíntesis.
También se tomaron datos de la radiación fotosintéticamente activa (PAR) y de la temperatura tanto externa como interna del fotobiorreactor cada cinco minutos; la adquisición de los datos se llevó a cabo mediante un data-logger.
Análisis estadístico
El análisis de los datos experimentales de evolución temporal de las concentraciones de biomasa, nitrógeno y fósforo se realizó conforme al modelo cinético PhBT (Ruiz et al., 2012a), basado a su vez en los modelos de crecimiento de biomasa microalgal y consumo de nutrientes en aguas residuales, propuesto por Verhulst (Verhulst, 1838) y Romero (Quiroga, Perales, Romero, & Sales, 1999), respectivamente. Para hacer el modelo se emplearon técnicas de regresión no lineal mediante la minimización del cuadrado de los residuos empleando la herramienta Solver de Microsoft Excel 2007.
Nomenclaturas
X: concentración de microalgas en un instante t.
X0: concentración inicial de microalgas.
Xm: concentración máxima de microalgas que el sistema alcanzaría en batch.
µ(X): máxima tasa de crecimiento específico.
t: tiempo.
PVD: productividad volumétrica del fotobiorreactor operando en discontinuo.
PVC: productividad volumétrica del fotobiorreactor operando en continuo.
Pα: productividad superficial del fotobiorreactor operando en continuo.
Θ: tiempo de retención hidráulico (TRH) al que opera el fotobiorreactor.
hHRAP: profundidad de la lámina de agua del fotobiorreactor.
S: concentración de substrato soluble en un instante t.
S0: concentración de substrato inicial (nutrientes en el medio de cultivo).
Snα: concentración de substrato no asimilable.
X0/Y0: concentración de nutrientes en el inóculo.
St0: concentración total inicial de substrato (S0 + X0/Yo).
µ(S): máxima tasa específica de captación de nutrientes: µN (máxima tasa específica de captación de nitrógeno) y µP (máxima tasa específica de captación de fósforo).
1/Y: composición de la biomasa en un instante dado.
SP: contenido en nitrógeno o fósforo particulado en un instante t.
SPo: concentración inicial de substrato particulado.
ΔY: procesos de acumulación o pérdida de reservas en la biomasa.
SµX: concentración de sustrato obtenida de sustituir la µx (cuadro 1) en la ecuación (6).
SµS: concentración de sustrato obtenida de sustituir la µS (cuadro 2) en la ecuación (6).
Resultados y discusión
Luz y temperatura
La radiación solar y la temperatura se monitorearon a lo largo de todo el experimento, obteniéndose una radiación solar media de 562.87 ± 145.94 µmol m-2 d-1 (p = 95%, n = 107), y una temperatura media en el interior y exterior del HRAP de 20 ± 0.71 °C y de 21 ± 0.99 °C (p = 95%, n = 107), respectivamente.
pH
El pH al inicio del experimento fue de 8.2 y fue aumentando hasta que aproximadamente a las 72 h de experimento se estabilizó en torno a un pH medio de 10.27 ± 0.08 (p = 95%, n = 24), pH superior al obtenido por Arbib et al. (2012) para este mismo fotobiorreactor HRAP (pH = 9.32 ± 0.30), pero utilizando agua residual en lugar de medio sintético, o al valor de 8.5 obtenido por Ketheesan y Nirmalakhandan (2012), cultivando Scenedesmus sp., en medio basal Bold's en un raceway de 23 l con iluminación artificial en laboratorio. Estas diferencias pueden deberse a la hora a la que se realizó la medición del pH.
El valor de pH registrado es muy dependiente de la hora a la que se hace la medición. En nuestro caso, el pH se medía todos los días aproximadamente a la misma hora (9:00-11:00), pero el pH evoluciona a lo largo del día, como han indicado algunos autores (Ketheesan & Nirmalakhandan, 2012; Putt, Singh, Chinnasamy, & Das, 2011). Para comprobar dicha evolución, se realizó un registro completo del pH durante 24 horas (figura 2).

En la figura 2 se observa perfectamente como el pH aumenta durante el día, alcanza su pH máximo en la puesta de sol y disminuye de modo gradual durante la noche. Estas variaciones de pH se deben a los procesos biológicos de fotosíntesis (consumo de CO2) y respiración (generación de CO2) llevados a cabo por las microalgas (Margalef, 1983).
Crecimiento de biomasa
En la figura 3 se muestra el crecimiento del bloom de microalgas a lo largo de todo el experimento. Las microalgas crecen conforme a las fases de crecimiento microbiano en cultivos en discontinuo: fase de latencia, fase exponencial, fase estacionaria y fase de declive (Prescott, Harley, & Klein, 2004). En la figura 3 se observan con claridad las fases de crecimiento exponencial y estacionaria, mientras que las fases de latencia y declive no son apreciables. La fase de latencia probablemente no se aprecie debido a la similitud con las condiciones ambientales bajo las que se obtuvo el inóculo y la fase de declive debido a que el experimento se dio por finalizado cuando se alcanzó la fase estacionaria, aproximadamente a las 300 h de haberse iniciado el experimento.
La cinética de crecimiento de la biomasa se ha analizado de acuerdo con el modelo de Verhulst (Verhulst, 1838) y sus parámetros cinéticos aparecen recogidos en el cuadro 1. De acuerdo con este modelo, el crecimiento microbiano puede ser expresado como una curva sinusoidal, como describe la ecuación (1), donde X sería la concentración de microalgas en un instante t; X0, la concentración inicial de microalgas; Xm, la concentración máxima de microalgas que el sistema alcanzaría en batch; µ, la máxima tasa de crecimiento específico, y t es el tiempo:

Por otra parte, con el fin de comparar los resultados obtenidos con otros experimentos, también se ha calculado la productividad volumétrica (cuadro 1), que se define como la biomasa producida por volumen de reactor y unidad de tiempo, es decir, nos muestra la capacidad que tiene un reactor de producir biomasa bajo condiciones de operación específicas. Este parámetro puede ser calculado a partir de la ecuación (2) (Ruiz et al., 2012a) utilizando los parámetros cinéticos del modelo de Verhulst (cuadro 1).

El modelo cinético de Verhulst se ajusta bien a los datos experimentales (figura 3), siendo el coeficiente de determinación (R2) de 0.946 (cuadro 1). Además, el valor de Xo medido experimentalmente en el laboratorio coincide con el predicho por el modelo de Verhulst, siendo ambos de 0.072 y 0.073 g SS 1-1, respectivamente, lo que también corrobora el buen ajuste al modelo cinético de Verhulst. La Xm es de 0.284 g SS L-1, prácticamente igual a la obtenida por Arbib et al. (2013), que fue de unos 0.300 g SS 1-1. La similitud entre ambos puede deberse al hecho de que en los dos experimentos se utilizó el mismo fotobiorreactor, aunque Arbib et al. (2013) emplearon agua residual pretratada y un monocultivo de Scenedesmus obliquus. La máxima tasa de crecimiento específico obtenida ha sido de 0.442 d-1, unas cuatro veces superior a la obtenida por Radmann, Reinehr y Costa (2007), quienes obtuvieron una μ de 0.038—0.138 d-1 para Spirulina platensis cultivada en medio Zarrouk, en un raceway con un volumen de seis litros a una concentración de 0.15 g l-1 y en condiciones controladas de luz y temperatura. En cuanto a la productividad volumétrica (0.025 g SS l-1 d-1), ésta sí es comparable a los 0.028—0.046 g l-1 d -1 obtenidos por Radmann et al. (2007), pero inferior a la obtenida por Ketheesan y Nirmalakhandan (2012), que fue de 0.085 g l-1 d-1 para Scenedesmus sp. cultivada en medio basal Bold's en un raceway de 23 litros con iluminación artificial en el laboratorio, probablemente porque estos autores airearon el reactor con aire enriquecido con CO2 (1%).
Por otro lado, a partir de los parámetros cinéticos de crecimiento obtenidos en el experimento en discontinuo, se ha predicho el valor máximo de concentración de biomasa (ecuación (3)), y las productividades volumétrica (ecuación (4)) y superficial (ecuación (5)) del fotobiorreactor operando en continuo (Ruiz et al., 2012b):



Donde Θ es el tiempo de retención hidráulico (TRH) al que opera el fotobiorreactor y hHARP es la profundidad de la lámina de agua del fotobiorreactor. Considerando que la máxima productividad en continuo se alcanza para un TRH de 2/μ (Ruiz et al., 2012b).
El valor de concentración de biomasa (ecuación (3)) y máxima productividad volumétrica (ecuación (4)), operando en continuo a un TRH de 4.54 d (2/μ) serían de 0.142 y 0.031 g SS l-1 d-1, respectivamente. El TRH óptimo al que se tiene la máxima producción de biomasa es aproximadamente la mitad al obtenido por Arbib et al. (2012) para este mismo fotobiorreactor HRAP, pero utilizando agua residual en vez de medio sintético. Son muchos los autores que consideran que el TRH óptimo al que se produce la máxima producción de biomasa se encuentra entre los 8 y 10 d (De—Godos, Blanco, García—Encina, Becares, & Muñoz, 2009; García et al., 2006). El hecho de que nuestro TRH óptimo al que se produce la máxima producción de biomasa sea inferior se debe al elevado valor de μ (cuadro 1), como consecuencia del uso de medio sintético como forma de cultivo.
El caudal al que debería ser alimentado el fotobiorreactor para obtener la máxima producción de biomasa funcionando en continuo es de 99 l d-1 y la concentración de biomasa en el efluente sería de 141.75mg l-1. Esta concentración de biomasa en el efluente es también aproximadamente la mitad a los 250-300mg l-1 que Tredeci (2004) determinó como concentración de biomasa típica para el efluente de un fotobiorreactor HRAP. Pero se debe tener en cuenta que esta producción de biomasa es para raceway a escala industrial, en los que el efecto sombreado creado por las paredes del fotobiorreactor es mínimo y, en nuestro caso, se trata de un raceway piloto donde el efecto de sombreado en los canales debido a su estrechez tiene como consecuencia una disminución de productividad, lo que pone en evidencia el problema de escalado que presentan los reactores tipo HRAP, al igual que han indicado otros autores (Ketheesan & Nirmalakhandan, 2011).
La productividad superficial estimada es de 9.4 g m-2 d-1 (ecuación (5)), aproximadamente un 30% más baja de la productividad superficial típica para un HRAP, que es de 12-13 g m-2 d-1 (Tredeci, 2004). De-Godos et al. (2009) operaron dos HRAP para tratar purines diluidos a un TRH de 10 d, el doble al estimado para este experimento, y obtuvieron una productividad superficial de 21 a 28 g m-2 d-1. García et al. (2006) obtuvieron una productividad superficial media mensual de 12.7 g m-2 d-1 para un HRAP operando a un TRH de 10 d y 14.8 g m-2 d-1 para otro HRAP, pero operando a un TRH de 8 d, mientras que Arbib et al. (2012) obtuvieron una productividad superficial de 8.26 ± 1.43 g m-2 d-1, operando a un TRH de 8 d el mismo fotobiorreactor HRAP que el utilizado para este experimento, resultando que sí se encuentra en la misma línea que los estimados en el presente estudio, lo cual corrobora que la baja productividad se debe a aspectos relacionados con la escala del fotobiorreactor.
En este estudio también se estimó la eficacia fotosintética del sistema operando en discontinuo, que fue de 0.650%, y la que habría tenido si hubiese operado en continuo a un TRH de 4.5 d, esto es, sólo un 0.845%. Ésta se estimó a partir de la radiación PAR media medida, partiendo de que la energía solar en el intervalo de 400 a 700 nm es de un 48% de la energía solar total (Zhu, Long y Ort, 2008) y que el poder calorífico superior medio de las microalgas es de 20 MJ K-1 (Illman, Scragg, & Shales, 2000). La eficiencia fotosintética típica de un HRAP es de 1.3 a 2.4% (Park, Craggs, & Shilton, 2010), superior a la obtenida en este estudio, lo que puede deberse, de nuevo, al efecto sombreado creado por las paredes del fotobiorreactor.
Eliminación de nutrientes
El consumo de nitrógeno y fósforo por las microalgas se ha analizado de acuerdo con el modelo cinético de Romero de consumo de substratos por microorganismos en reactores en discontinuo (Quiroga et al., 1999). De acuerdo con este modelo, Ruiz et al. (2012a) desarrollaron un modelo para predecir la captación denutrientes por microalgas en un fotobiorreactor operando en discontinuo, modelo PhBT, en el que la captación de nutrientes puede expresarsea partir de la ecuación (6), donde So es la concentración de substrato inicial (nutrientes enel medio de cultivo); Snα la concentración de substrato no asimilable; Sto es la concentración total inicial de substrato (nutrientes en el mediode cultivo (So) y nutrientes en el inóculo (Xo/Yo) (ecuación (7)); µ es la máxima tasa específica decaptación de nutrientes, y t es el tiempo:


Para el cálculo de los parámetros cinéticos So, Snα y µ se ha partido del valor conocido de Sto, que se puede estimar a partir de la ecuación (7) con los datos experimentales obtenidos del análisis elemental de la biomasa empleada como inóculo (1/Yo = 0.062 mg N mg SS-1 y 0.009 mg P mg SS-1) y el valor de la concentración inicial de biomasa obtenido de la modelización cinética del crecimiento, Xo = 73 mg l-1 (cuadro 1).
La capacidad de eliminación de nitrógeno y fósforo por el bloom de microalgas se muestran en las figuras 4 y 5, y sus parámetros cinéticos aparecen recogidos en el cuadro 2.
Eliminación del nitrógeno total
El modelo cinético se ajusta bien a los datos experimentales (figura 4), siendo el coeficiente de determinación R2 de 0.934 (cuadro 2). Además, la So medida de forma experimental en el laboratorio se aproxima bastante con la predicha por el modelo, siendo ambas de 16.392 y 14.101 mg NT L-1. La concentración de Snα, que es el contenido de nitrógeno total soluble que tiene el efluente a la salida del fotobiorreactor, es de 2.615 mg NT 1-1, habiéndose reducido la concentración de nitrógeno total en un 81.5% a la salida del efluente y siendo aproximadamente un 75% inferior al límite más restrictivo de vertido de 10 mg NT 1-1 que establece la Directiva 98/15/CE para aguas residuales urbanas. La µN es de 0.359 d-1, inferior a los 1.4-2.5 d-1 obtenidos por Ruiz et al. (2012a), pero hay que tener en cuenta que Ruiz et al. (2012a) cultivaron Chlorella vulgaris en diferentes medios de cultivos en frascos Pyrex de borosilicato de dos litros, y en condiciones controladas de luz y temperatura en el laboratorio.
Eliminación del fósforo total
El modelo cinético se ajusta bien a los datos experimentales (figura 5) y coeficiente de determinación R2 de 0.982 (cuadro 2); además, la So medida de forma experimental en el laboratorio es muy parecida a la predicha por el modelo, siendo ambas de 2.122 y 1.914 mg PT l-1, respectivamente. La concentración de Snα es de 0.046 mg PT l-1, reduciéndose la concentración de fósforo prácticamente en su totalidad a la salida del efluente y siendo inferior al valor más restrictivo de concentración en vertido de 1 mg PT l-1 que establece la Directiva 98/15/CE. La µp es de 1.313 d-1, mayor a la µN (cuadro 2) obtenida para el nitrógeno, lo cual significa que la velocidad específica de consumo de fósforo por las microalgas es mayor. La µp, al igual que en el caso del nitrógeno, es muy inferior a los 2-8.7 d-1 obtenidos por Ruiz et al. (2012a).
Composición de la biomasa
Evolución del nitrógeno en la biomasa
Según el modelo PhBT (Ruiz et al., 2012a), el valor de µ del modelo de crecimiento de biomasa y de consumo de nutrientes son el mismo parámetro; pero en nuestro caso, al compararlos se observa cómo no coinciden, ya que la µ del modelo de crecimiento de biomasa es de 0.441 d-1 (cuadro 1) y la de consumo de nitrógeno es de 0.359 d-1 (cuadro 2).
En la figura 6 se ha representado la evolución de los nutrientes predicha por la ecuación (6) y usando los valores de So y Snα recogidos en el cuadro 2, pero empleando en un caso el valor de µ obtenido de la modelización de la biomasa (µx) y en otro el valor fruto de la modelización del consumo de nitrógeno (µN).
En la figura 6 se observa cómo parece ser que las microalgas consumen nitrógeno (línea negra) a una velocidad superior a la que realmente está descendiendo la concentración de nitrógeno en el medio (línea gris). Pero esto no es posible, pudiéndose deber a que la concentración de nitrógeno en la biomasa (1/YN) varía con el tiempo (ecuación (8)):

En la figura 8 se puede observar cómo, en efecto, los valores experimentales de contenido en nitrógeno de la biomasa no son constantes en el tiempo.
En el presente trabajo se ha desarrollado una ecuación que justifique los procesos de acumulación o pérdida de nutrientes en la biomasa a lo largo del proceso de fotobiodepuración. Para ello se parte de la ecuación (9), en la que se expresa el valor de la composición de la biomasa en un instante dado (1/Y) como:

Donde X es la concentración de la biomasa en un instante t y SP es el contenido en nitrógeno o fósforo particulado en un instante t. El contenido en nitrógeno o fósforo particulado puede expresarse como SP = SPo + (So-S), donde SPo es la concentración inicial de substrato particulado; So es la concentración inicial de substrato soluble, y S es la concentración de substrato soluble en un instante t. Por lo tanto, sustituyendo en la ecuación (9) obtenemos:

El problema es que el valor de S no es el mismo si empleamos la velocidad específica de crecimiento derivada de la modelización de la biomasa (µX) que si empleamos el valor derivado del consumo de substrato (µN o µP), y es precisamente esa diferencia la que define los procesos de acumulación o pérdida de reservas en la biomasa durante el proceso (ΔY) (ecuación (11)):

Donde:

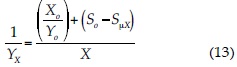
Reordenando términos, obtenemos que:

Sustituyendo la ecuación (6) en la ecuación (14) y reordenando términos, tenemos la ecuación (15), donde A = So-Snα y B = -X0/Y0:

En la figura 7 puede verse cómo los datos que predice el modelo (ecuación (10)) no coinciden con los datos experimentales de composición de la biomasa, siendo el contenido experimental de nitrógeno en la biomasa menor al esperado, lo que puede deberse a que no todo el nitrógeno eliminado en el agua residual es consumido por las microalgas, sino que existen otros procesos que también participan en la eliminación del nitrógeno.
Para cuantificar la cantidad de nitrógeno que no ha sido consumido por las microalgas y que ha sido eliminada del medio, se determinará el valor de µN necesaria para que se dé un buen ajuste de los datos experimentales de composición (cuadro 3; figura 8).
Según estos, el consumo del nitrógeno soluble en el medio debería haber sido el representado en la figura 9 (línea negra), por lo que parece ser que existe otro proceso complementario al consumo biológico de nitrógeno por las microalgas que también participa en la eliminación del nitrógeno del medio. Estos procesos complementarios podrían ser bióticos, como la desnitrificación, o abióticos, como el stripping. El stripping es un proceso abiótico en el que a temperatura ambiente y pH constante superiores a 8, como sería nuestro caso, el NH4+ se transforma en amoniaco gaseoso (NH3) y se libera a la atmósfera (Margalef, 1983). Pero esta hipótesis queda descartada, pues la forma mayoritaria de nitrógeno en el medio era NO3-, siendo la concentración inicial de NO3- y NH4+ en el medio de 17.4 y 0.625mg l-1, respectivamente. La desnitrificación es la transformación biológica del nitrato en gas nitrógeno (N2), óxido nítrico (NO) y óxido nitroso (N2O). Todos estos compuestos son gaseosos y se liberan normalmente a la atmósfera. Pero éstas son transformaciones que se producen en condiciones anóxicas (Margalef, 1983) y, en nuestro caso, el sistema es oxidante en extremo, dada la elevada actividad fotosintética en el mismo. Descartadas estas dos opciones, queda otro proceso biológico, menos conocido, aunque no por ello menos importante, como es el hecho de que los cultivos de algas son fuentes de emisión de CH4 y N2O. De manera reciente, autores como Harter et al. (2013), o Ferrón, Ho, Johnson y Huntley (2012) han cuantificado los flujos de N2O desde el agua al aire. Ferrón et al. (2012), cultivando Staurosira sp. en un raceway de 64 000 litros expuestos a luz solar y a la atmósfera, determinaron que para raceway fertilizados durante todo el periodo de cultivo, como es nuestro caso, el flujo de N2O del agua a la atmósfera sería de 342.86 µmoles m-2 d-1, y Harter et al. (2013), cultivando Dunaliella salina en un reactor de 42 litros, suministrándole gas de combustión en condiciones controladas de luz y temperatura, determinaron que este flujo era de 2 711 µg N l-1 d-1.
En la figura 10 se presenta la evolución del nitrógeno en el medio debido a los procesos complementarios, obtenido por diferencia de las dos curvas anteriores (figura 9). Se puede concluir que del total del nitrógeno eliminado, un 43.5% ha sido consumido por las microalgas, mientras que el 56.5% restante fue eliminado por procesos complementarios; posiblemente parte de este nitrógeno se emitió a la atmósfera en forma de N2O. Si suponemos que todo el nitrógeno que no ha sido consumido por las microalgas se ha emitido a la atmósfera en forma de N2O, se obtiene que este flujo ha sido de 5 200.16 µmol N2O m-2 d-1, que es 15 veces superior a lo obtenido por Ferrón et al. (2012), o lo que es lo mismo, 485.35 µg N 1-1 d-1, que es cinco veces inferior a lo que obtuvo Harter et al. (2013).

Evolución del fósforo en la biomasa
En el caso del fósforo, la µ del modelo de crecimiento de biomasa y la de consumo de fósforo tampoco coinciden, siendo ambas de 0.44 d-1 (cuadro 1) y de 1.31 d-1 (cuadro 2), respectivamente.
En la figura 11 se representa la evolución del fósforo predicha a partir de la µ del modelo de consumo de nutrientes y del crecimiento de biomasa (ecuación (6)), y a diferencia del nitrógeno, puede observarse cómo la biomasa consume fósforo (µx) más lentamente de lo que realmente lo hace el sistema (µP). El hecho de que ambas curvas no coincidan es posible que se deba al efecto combinado de dos procesos: uno biológico, conocido como "luxury uptake", esto es, que las microalgas tienden a consumir más nutrientes del que necesitan para crecer acumulándolos en forma de reserva (Ruiz et al., 2012a); pero también puede ser que participen procesos abióticos, como la precipitación de fosfatos, dado el pH alcanzado en los reactores.
En la figura 12, al igual que para el nitrógeno, también puede verse cómo los valores experimentales de contenido en fósforo de la biomasa varían con el tiempo (ecuación (8). En esta figura también se han representado los valores de 1/YP predichos por la pérdida de fósforo en la biomasa a partir de la ecuación (10), y se observa cómo los datos que predice el modelo se ajustan a los datos experimentales de composición de la biomasa, con excepción del valor máximo observado de alrededor de 1.9% al cabo de 22 h. Este resultado podría indicar que la rápida eliminación observada para el fósforo en las primeras 70 h (figura 5) podría deberse a un proceso de precipitación, lo cual haría que la composición en fósforo del material particulado del reactor (1.9%) sea muy superior al valor máximo típico en microalgas, que no suele superar el 1%. De manera posterior, este fósforo extracelular se iría asimilando por parte de las microalgas, para finalmente formar parte del material celular en una importante proporción en los estadios finales del crecimiento en batch, coincidiendo los valores experimentales con los predichos por el modelo. Esta hipótesis debería ser confirmada mediante la comparación de estos resultados con los obtenidos del análisis elemental de fósforo a la biomasa, previo lavado de la misma con una disolución ligeramente ácida, para discernir entre las dos formas de fósforo en la biomasa.
Conclusiones
El cultivo de un bloom de microalgas en un fotobiorreactor piloto tipo HRAP permite reducir en más de un 80% las concentraciones de nitrógeno y fósforo presentes en el medio sintético, lo que apunta a que se trata de una tecnología con elevada potencialidad como tratamiento terciario para la eliminación de nutrientes en estaciones depuradoras de aguas residuales. El modelo cinético PhBT es una herramienta útil para predecir la cinética de crecimiento de la biomasa, y de consumo de nitrógeno y fósforo en fotobiorreactores operando en discontinuo. Se ha podido comprobar de forma experimental que el modelo PhBT además predice con bastante aproximación la evolución de la composición de la biomasa en términos de contenido en nitrógeno y fósforo, lo cual puede resultar muy útil a la hora de identificar otros procesos que compiten con los biológicos en la eliminación de nutrientes en los fotobiorreactores. Por último, el conocimiento de la evolución de la riqueza de nitrógeno y fósforo en la biomasa es un aspecto clave a la hora de establecer estrategias de operación orientadas hacia la minimización en la producción de biomasa algal, manteniendo una elevada velocidad de consumo de nutrientes.
Referencias
Abdel-Raouf, N., Al-Homaidan, A. A., & Ibraheem, I. B. M. (2012). Microalgae and Wastewater Treatment. Saudi Journal of Biological Science, 19, 2012, 257-275. [ Links ]
APHA-AWWA-WEF (1992). Standard Methods for the Examinations of Water and Wastewater (18th ed.). Washington, DC: American Public Health Association AWWA, Water Environment Federation. [ Links ]
Arbib, Z. (2012). Fotobiodepuración de aguas residuales urbanas: análisis comparativo de fotobiorreactores a escala piloto. Tesis doctoral. Cádiz: Universidad de Cádiz, Departamento Tecnología del Medio Ambiente. [ Links ]
Arbib, Z., Ruiz, J., Álvarez, P., Garrido, C., Barragán, J., & Perales, J. A. (2012). Long Term Outdoor Operation of a Tubular Airlift Pilot Photo Bioreactor and a High Rate Algal Pond as Tertiary Treatment of Urban Wastewater. Ecological Engineering, 52, 143-153. [ Links ]
Arbib, Z., Ruiz, J., Álvarez, P., Garrido, C., Barragán, J., & Perales, J. A. (2013). Effect of pH Control by Means of Flue Gas Addition on Three Different Photo Bioreactors Treating Urban Wastewater Operating in Continuous Mode Long-Term. Bioresource Technology, 57, 226-235. [ Links ]
Cai, T., Park, S., & Li, Y. (2012). Nutrient Recovery from Wastewater Streams by Microalgae: Status and Prospects. Renewable and Sustainable Energy Reviews, 19, 360-369. [ Links ]
De-Godos, I., Blanco, S., García-Encina, P. A., Becares, E., & Muñoz, R. (2009). Long-Term Operation of High Rate Algal Ponds for the Bioremediation of Piggery Wastewaters at High Loading Rates. Bioresource Technology, 100, 4332-4339. [ Links ]
Directiva del Consejo 91/271/CEE del 21 de mayo de 1991 sobre el tratamiento de las aguas residuales urbanas. Diario Oficial de las Comunidades Europeas (30 de mayo de 1991), 50(135), 40-52. [ Links ]
Directiva 98/15/CE de la comisión del 27 de febrero de 1998 por la que se modifica la Directiva 91/271/CEE del Consejo en relación con determinados requisitos establecidos en su anexo I. Diario Oficial de las Comunidades Europeas (7 de marzo de 1998), 50(67), 29-30. [ Links ]
Dodd, J. C. (1986). Elements of Pond Design and Construction (pp. 265-284). In A. Richmond (Ed.). Handbook of Microalgal Mass Cultures. Boca Raton, USA: CRC Press, Inc. [ Links ]
Ferrón, S., Ho, D. T., Johnson, Z. I., & Huntley, M. E. (2012). Air-Water Fluxes of N2O and CH4 during Microalgae (Staurosira sp.) Cultivation in an Open Raceway Pond. Environmental Science & Technology, 46, 10842-10848. [ Links ]
García, J., Green, B. F., Lundquist, T., Mujeriego, R., Hernández-Mariné, M. & Oswald, W. J. (2006). Long Term Diurnal Variations in Contaminant Removal in High Rate Ponds Treating Urban Wastewater. Bioresource Technology, 97, 1709-1715. [ Links ]
Harter, T., Bossier, P., Verreth, J., Bodé, S., Van Der Ha, D., Debeer A., Boon, N., Boeckx, P., Vyverman, W., & Nevejan, N. (2013). Carbon and Nitrogen Mass Balance during Flue Gas Treatment with Dunaliella salina Cultures. J. Appl. Phycol., 25, 359-368. [ Links ]
Illman, A. M., Scragg, A. H., & Shales, S. W. (2000). Increase in Chlorella strains Calorific Values when Grown in Low Nitrogen Medium. Enzyme and Microbial Technology, 27, 631-635. [ Links ]
Ketheesan, B., & Nirmalakhandan N. (2012). Feasibility of Microalgal Cultivation in a pilot-Scale Airlift-Driven Raceway Reactor. Bioresource Technology, 108, 196-202. [ Links ]
Ketheesan, B., & Nirmalakhandan, N. (2011). Development of a New Airlift-Driven Raceway Reactor for Algal Cultivation. Applied Energy, 88, 3370-3376. [ Links ]
Kilham, S. S., Kreeger, D. A., Lynn, S. G., Goulden, Y. C. E., & Herrera, L. (1998). COMBO: Adefined Freshwater Culture Medium for Algae and Zooplankton. Hydrobiología, 377, 147-159. [ Links ]
Köthe, J., & Bitsch, R. (1992). Oxysolv® Plus Microwave A New Way for Sample Preparation. Fresenius' Journal of Analytical Chemistry, 343(9-10), 717-718. [ Links ]
Margalef, R. (1983). Limnología. Barcelona: Ediciones Omega. [ Links ]
Müller, R., & Weidemann, F. (1995). Die Bestimmung des Nitrats in Wasser. Jahrbuchfür Wasserchemie und Wasserreinigungs-technik. Verlag Chemie, Renibek, 12, 247-271. [ Links ]
Oswald, W. J., Gotaas, H. B. (1957). Photosynthesis in Sewage Treatment. Transactions American Society Civil Engineers, 122, 73-105. [ Links ]
Park, J. B. K., Craggs, R. J., & Shilton, A. N. (2010). Wastewater Treatment High Rate Algal Ponds for Biofuel Production. Bioresource Technology, 102, 35-42. [ Links ]
Prescott, L. M, Harley, J. P., & Klein, D. A. (2004). Microbiología (119-120 pp; 5ª ed.). C. Gamazo & I. Lasa (Trad.). Madrid: McGraw-Hill Interamericana de España. [ Links ]
Powell, N., Shilton, A., Chisti, Y., & Pratt, S. (2008). Towards a Luxury Uptake Process Via Microalgae-Defining the Polyphosphate Dynamics. Water Research, 43, 4207-4213. [ Links ]
Putt, R., Singh M., Chinnasamy, S., & Das, K. C. (2011). An Efficient System for Carbonation of High-Rate Algae Pond Water to Enhance CO2 Mass Transfer. Bioresource Technology, 102, 3240-3245. [ Links ]
Quiroga, J. M., Perales, J. A., Romero, L. I., & Sales, D. (1999). Biodegradation Kinetics of Surfactants in Seawater. Chemosphere, 39, 1957-1969. [ Links ]
Radmann, E. M., Reinehr, C. O., & Costa, J. A. V. (2007). Optimization of the Repeated Batch Cultivation of Microalga Spirulina platensis in Open Raceway Ponds. Aquaculture, 265, 118-126. [ Links ]
Ruiz-Marin, A., Mendoza-Espinosa, L. G., & Stephenson, T. (2010). Growth and Nutrient Removal in Free and Immobilized Green Algae in Batch and Semi-Continuous Cultures Treating Real Wastewater. Bioresource Technology. 101, pp. 58-64. [ Links ]
Ruiz, J., Arbib, Z., Álvarez, P., Garrido, C., Barragán, J., & Perales, J. A. (2012a). Photobiotreatment model (PhBT): A Kinetic Model for Microalgae Biomass Growth and Nutrient Removal in Wastewater. Environmental Technology, iFirst, 1-13.
Ruiz, J., Álvarez, P., Arbib, Z., Garrido, C., Barragán, J., & Perales, J. (2012b). Performance of a Flat Panel Reactor in the Continuous Culture of Microalgae in Urban Wastewater: Prediction from a Batch Experiment. Bioresource Technology, 127, 456-463. [ Links ]
Tredeci, M. R. (2004). Mass Production of Microalgae: Photobioreactors (178-214 pp.). In A. Richmond (Ed.). Handbook of Microalgae Culture: Biotechnology and Applied Phycology. Oxford: Blackwell Publishing. [ Links ]
Verhulst, P. F. (1838). Notice sur la loique la population suit dans son accroissement. Correspondances Mathematiques et Physiques, 10, 113-121. [ Links ]
Zhu, X. G., Long, S. P., & Ort, D. R. (April, 2008). What is the Maximum Efficiency with which Photosynthesis Can Convert Solar Energy into Biomass? Current Opinion in Biotechnology, 19(2), 153-159. [ Links ]














