Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología y ciencias del agua
versión On-line ISSN 2007-2422
Tecnol. cienc. agua vol.6 no.2 Jiutepec mar./abr. 2015
Artículos técnicos
Superficie de respuesta aplicada al tratamiento de aguas residuales acoplando DSA y fotocatálisis
Response surface applied to the treatment of wastewater with the coupling of DSA and photocatalysis
Eloy Isarain-Chávez*, Saray Ramírez-Martínez, María Maldonado-Vega, Juliette Lambert, Juan M. Peralta-Hernández
Centro de Innovación Aplicada en Tecnologías Competitivas, México
*Autor de correspondencia
Ulises Morales-Ortiz
Universidad Autónoma Metropolitana-Iztapalapa, México
Dirección institucional de los autores
Dr. Eloy Isarain Chávez
Ing. Saray Ramírez Martínez
Dra. María Maldonado Vega
Dra. Juliette Lambert
Dr. Juan M. Peralta Hernández
Centro de Innovación Aplicada en Tecnologías
Competitivas (CIATEC)
Departamento de Investigación Ambiental
Omega-201, Fraccionamiento Industrial Delta
37545 León, Guanajuato, México
Teléfono: +52 (477) 7100 011, extensión 1508
isarain_chavez@yahoo.com.mx
vega.maldonado.m@gmail.com
jlambert@ciatec.mx
jperalta@ciatec.mx
M.C. Ulises Morales-Ortiz
Universidad Autónoma Metropolitana-Iztapalapa
Departamento de Química
Av. San Rafael Atlixco núm. 186
09340 México, D.F., México
Teléfono: +52 (55) 5804 4671, extensión 15
ulis@xanum.uam.mx
Recibido: 06/02/13
Aceptado: 11/09/14
Resumen
Este estudio empleó el análisis de superficie de respuesta basado en un diseño compuesto central para evaluar una celda electrolítica de flujo tipo filtro prensa, acoplada a un concentrador parabólico compuesto solar, los cuales se usaron para llevar a cabo el tratamiento de 20 l de agua residual doméstica de 742 a 756 mg l-1 en demanda química de oxígeno, y de 248 a 253 mg l-1 en carbono orgánico total. Los ánodos usados en la celda electrolítica fueron de IrPbO, IrSnO y RuPbO, recubiertos mediante la técnica de los cloruros metálicos sobre placas de Ti y activados por descomposición térmica. El concentrador parabólico compuesto solar posee un área de 1 m2, la cual fue expuesta por cuatro horas por día, recibiendo una radiación promedio de 889 Watts m-2. La degradación de los contaminantes se vio favorecida con la adición de TiO2 a concentraciones de 100 a 150 mg l-1, con efectos poco significativos al cambiar la concentración de 0.02 a 0.06 M de Na2SO4 del electrolito soporte. Los ensayos de la degradación fueron seguidos por el análisis del carbono orgánico total, con porcentajes de degradación de 5 a 30% al final del tratamiento, al aplicar intensidades de corriente de 10 a 30 A, con consumos energéticos desde 6 hasta 74 kW m-3.
Palabras clave: ánodos dimensionalmente estables, aguas residuales domésticas, concentrador parabólico compuesto, fotocatálisis, oxidación anódica, óxido de titanio.
Abstract
This study describes a response surface analysis based on a central composite design to evaluate a filter-press electrolytic flow cell coupled with a compound parabolic solar concentrator. This was used to treat 20 l of domestic wastewater with a chemical oxygen demand of 742 to 756 mg l-1 and total organic carbon of 248 a 253 mg l-1. The anodes used in the electrolytic cell were IrPbO, IrSnO and RuPbO. They were coated with metallic chlorides on Ti plates and were activated with thermal decomposition. The area of the compound parabolic solar concentrator was 1 m2 and was exposed for 4 hours per day, receiving an average radiation of 889 watts m-2. The addition of TiO2 in concentrations of 100 to 150 mg l-1 contributed to the degradation of the pollutants, and the effects from changing the concentration of the electrolyte support from 0.02 to 0.06 M of Na2SO4 were not very significant. Tests of the degradation were followed by an analysis of total organic carbon, with degradation percentages between 5 and 30% at the end of treatment when applying currents of 10 to 30 A, with an energetic consumption from 6 to 74 kW m-3.
Keywords: Dimensional stable anodes, domestic wastewater, compound parabolic concentrator, photocatalysis, anodic oxidation, titanium oxide.
Introducción
El tratamiento de aguas residuales tiene dos propósitos: abatir o disminuir la contaminación de los cuerpos receptores de agua, o disminuir el consumo de agua mediante su reutilización. Hoy día existen tecnologías para el tratamiento de aguas residuales, las cuales dependen en gran medida del tipo de efluente, así como del grado de tratamiento requerido para su reutilización. En la mayoría de los casos se emplean tratamientos convencionales, los cuales incluyen diversas etapas de separación físicas, como cribado, desarenado, sedimentación, separación de grasas y aceites, seguidos de proceso con o sin aireación, para finalmente ser sometidas a etapas de desinfección, como cloración, ozonación o UV. En los últimos años se han desarrollado opciones que proyectan una alta viabilidad en su aplicación, como oxidación química (O3, O3/H2O2, H2O2/Fe+2), fotocatálisis (TiO2/UV, foto-Fenton), degradación fotoquímica (O3/UV, O3/H2O2), o bien la combinación de éstos (electro-Fenton; fotoelectro-Fenton, electrocoagulación/O3 (Fernandes, Pacheco, Ciríaco, & López, 2012; Lambert, Maldonado-Vega, Isarain-Chávez, & Peralta-Hernández, 2013; Isarain-Chávez, De la Rosa, Martínez-Huitle, & Peralta-Hernández, 2013; García, Isarain-Chávez, García-Segura, Brillas & Peralta-Hernández, 2013), al igual que la oxidación anódica (OA) o electro oxidación, las cuales pueden efectuar una oxidación parcial o total de los contaminantes (Isarain-Chávez, Peralta-Hernández, Guerra, & Morales-Ortiz, 2012; García, Isarain-Chávez, El-Ghenymy, Brillas, & Peralta-Hernández, 2014).
Estos procesos han sido útiles en etapas previas en la degradación de contaminantes resistentes a la biodegradación o como postratamiento antes de la descarga del efluente en los cuerpos receptores. Dichas tecnologías presentan ventajas, como el tamaño de los equipos y su versatilidad, ya que pueden operar a temperatura ambiente y presiones bajas, con una baja generación de lodos, así como una alta viabilidad a la degradación de diversos compuestos empleando electrodos recubiertos por metales en su forma oxidada (OA) (Zhou, Särkkä, & Sillanpää, 2011a; Isarain et al., 2012; Patel, Bandre, Saraf, & Ruparelia, 2013).
En la actualidad existe una gran variedad de ánodos dimensionalmente estables, como SnOx, RuOx, PbOx, IrOx, PtOx, PdOx, etcétera, depositados sobre titanio; estos electrodos se caracterizan por conseguir altas tasas de degradación o transformación de compuestos orgánicos debido al alto valor de sobrepotencial a la reacción de evolución de oxígeno, aunado a una alta estabilidad y conductividad (Szpyrkowicz, Kaul, Neti, & Satyanarayan, 2005; Makgae, Klink, & Crouch, 2008; Fierro et al., 2009; Profeti, Profeti, & Olivi, 2009; Papastefanakis, Mantzavinos, & Katsaounis, 2010; Zhou et al., 2011a; Isarain et al., 2012; Wu et al., 2012; Patel et al., 2013; Chu, Zhang, Liu, Qian, & Li, 2013).
El uso de ánodos dimensionalmente estables en el tratamiento de efluentes y procesos de remediación ha sido documentado por diversos autores en múltiples aplicaciones, desde la eliminación de colorantes con eficiencias de 50 a 90%, empleando electrodos de Ir-Sn, RhOx, MnO2-RuO2, Pt-Ir, PdO-Co3O4 (Szpyrkowicz, Juzzolino, & Kaul, 2001; León, Pomposo, Suárez, & Vega, 2009).
Zanbotto-Ramalho, Martínez-Huitle y Ribeiro-Da-Silva (2010) utilizaron electrodos de Ti/Ru0.23Ti0.66Sn0.11O2 en la eliminación de derivados del petróleo, como el fenol, benzeno, tolueno y xilenos, con degradaciones de 47 a 100%. Mientras que Feng y Li (2003), así como Makgae et al. (2008), utilizaron ánodos de Ti/IrO-PtO, Ti/Sb-Sn-RuO2, Ti/Sb-Sn-RuO2-Gd y Ti-b-PbO2, al igual que Ti/SnO2-RuO2-IrO2, en la eliminación del fenol con mineralizaciones de 50 a 100%. Estos resultados concuerdan con estudios reportados por Cong, Wu y Tan (2005), con abatimientos de 60% para el 2-clorofenol. El grupo de Chatzisymeon, Dimou, Mantzavinos y Katsaounis (2009) ha centrado su atención en el tratamiento de aguas residuales provenientes del proceso de obtención de aceite de oliva usando IrO2, mientras que otras investigaciones se enfocaron en la degradación de la tetraciclina con electrodos de RuO2-IrO2, alcanzando eliminaciones de 33% (Wu et al., 2012). Los estudios indican que durante el proceso de degradación se forman especies intermedias que en algunos casos son más difíciles de oxidar que la molécula original, como es el caso del ácido oxálico, el cual fue degradado empleando electrodos de IrO2-Ta2O5, conforme lo reportan Scialdone, Randazzo, Galia y Filardo (2003); años más tarde, Huang, Shih y Liu (2011) confirman el poder oxidante del Ti/RuO2 e IrO2 en la degradación de dicho ácido. Es de hacer mención que investigadores como Kim, Kim, Kim, Park y Lee (2005) se enfocaron en la dilucidación de los mecanismos de eliminación del nitrógeno y sus iones amonio, nitrito y nitrato, así como del cloro. Estos resultados serían confirmados por Lacasa, Llanos, Cañizares y Rodrigo (2012a), utilizando electrodos de IrO2 y RuO2; estos mismos autores también realizaron estudios concernientes a la eliminación de arsénico III (Lacasa, Cañizares, Rodrigo, & Fernández, 2012b). Otras de las aplicaciones en el uso de los DSA son los procesos de ósmosis inversa con ánodos de IrO2, RuO2 y Ta2O5 conforme a lo reportado por Zhou, Liu, Jiao, Wang y Tan (2011b).
La reacción de oxidación anódica queda expresada por la oxidación del agua a un potencial E° = 1.23V/SHE a 25 °C, como lo muestra la reacción (1). Mediante reacciones monoelectrónicas se genera como intermedio al radical hidroxilo adsorbido •OH(ads) (reacciones (2) y (3)) (Marselli, García-Gómez, Michaud, Rodrigo, & Comninellis, 2003; Scialdone, 2009; Chatzisymeon et al., 2009; Martínez-Huitle & Brillas, 2009; Zanbotto-Ramalho et al., 2010):

Este proceso inicia por la descarga del H2O en medio ácido sobre el ánodo metálico (M), generando un radical hidroxilo adsorbido M(•OH) (reacción (4)), dando origen a un superóxido (MO) por la reacción (5), generándose especies fisisorbidas M•OH) y quimisorbidas MO. En ausencia de materia orgánica, ambas especies propician la evolución de O2 (reacciones (6) y (7)) (Scialdone, 2009; Martínez-Huitle & Brillas, 2009; León et al., 2009; Fierro et al., 2009; Panizza & Cerisola, 2009; Zanbotto-Ramalho et al., 2010):

En presencia de materia orgánica (R), la especie quimisorbida genera especies parcialmente oxidadas RO (reacción (8)) (Scialdone, 2009; León et al., 2009; Fierro et al., 2009; Panizza & Cerisola, 2009; Martínez-Huitle & Brillas, 2009; Zanbotto-Ramalho et al., 2010):

Los ánodos no activos poseen una baja presencia de M(•OH) cuando la reacción (5) es más rápida que la reacción (4). En cambio, se da una combustión cuando existe una alta concentración de radicales •OH, al ser despreciable la velocidad de la reacción (4). La combustión electroquímica se lleva a cabo por hidroxilación o deshidrogenación (R o R'H) con las especies M(•OH), conforme a las reacciones (9) y (10):

El oxígeno disuelto en el medio reacciona con el radical orgánico R'•, generando así el radical peroxilo R'OO• (reacción (11)), tomando un átomo de hidrógeno de otro contaminante R"H (reacción (12)). De esta manera, los hidroperóxidos R'OOH rompen su estructura hasta CO2, iones inorgánicos y agua (Scialdone, 2009; Martínez-Huitle & Brillas, 2009; Panizza & Cerisola, 2009; Zanbotto-Ramalho et al., 2010):

El radical •OH también puede ser generado mediante reacciones fotocatalíticas, basadas en la absorción directa o indirecta de energía radiante por un fotocatalizador de banda ancha en la interfaz del sólido excitado y la solución donde se efectúan las reacciones de degradación de los compuestos orgánicos (Malato, Fernández-Ibáñez, Maldonado, Blanco, & Gernjak, 2009).
Esta energía radiante posee un valor promedio conocido como constante solar Fet = 1 367 Wm-2, cuya irradiancia total del espectro UV (280-400 nm) en la superficie terrestre es inferior a 103.9 Wm-2 (100% de transmisión en la atmósfera). De esta energía radiante, sólo de 5 a 7.6% está constituida por el total del espectro UV (Gueymard, 2004), la cual se puede dividir en cuatro regiones: UV-A (luz larga o negra λ = 400 - 315 nm, con una energía por fotón de 3.10 - 3.94 eV); UV-B (λ = 315 - 280 nm, 3.94 - 4.43 eV); UV-C (luz UV corta λ = 280 - 100 nm, 4.43 - 12.40 eV); y luz UV-V (luz ultravioleta de vacío λ = 200 - 10 nm, 6.20 - 124 eV), esta fracción es suficiente para que un fotón de 254 nm equivalga a 4.89 eV, cuya energía genera estados excitados, produciendo rupturas homolíticas y heterolíticas en moléculas, produciendo radicales •OH (Legrini, Oliveros, & Braun, 1993).
Por otra parte, uno de los fotocatalizadores más empleados en la fotocatálisis heterogénea es el TiO2, debido a que éste posee una alta actividad y estabilidad en medio acuoso, además está clasificado como un semiconductor tipo n, compuesto por anatasa, rutilo y brookita. La anatasa posee un ancho de banda de 3.20 eV, con una energía de Gibbs de formación de 883.3 kJmol-1, mientras que para el rutilo es 3.03 eV, con una energía de Gibbs de 889.4 kJmol-1 (Rodríguez, Candal, Solís, Estrada, & Blesa, 2005). La anatasa es termodinámicamente menos estable que el rutilo, pero este último posee mayor área superficial y alta densidad de centros activos, los cuales incrementan la adsorción y la catálisis (Malato et al., 2009; Hapeshi et al., 2010).
El proceso de fotocatálisis está determinado por la formación de un par hueco-electrón, por la absorción de un fotón de longitud de onda menor que hγ/Eg, donde Eg es la energía del bandgap, donde un electrón de la banda de valencia (bv) es promovido a la banda de conducción (bc), generándose un hueco (reacción (13)). Las especies fotogeneradas participan en las reacciones redox (hbv+ es fuertemente oxidante y ebc- es moderadamente reductor). Los huecos son capturados por el agua, dando origen a los radicales •OH conforme a las reacciones (14) y (15), que oxidan a los contaminantes en la superficie del catalizador (González & Braun, 1995; Malato et al., 2009; Chong, Jin, Chow, Christopher, & Saint, 2010):

Como se ha hecho mención, el TiO2 presenta ciertas ventajas, como una mayor actividad fotocatalítica, una superficie polar e hidrofílica, la cual le confiere una alta estabilidad química en solución acuosa, con una elevada resistencia a la fotocorrosión, siendo sólo disuelto en ácido sulfúrico o fluorhídrico concentrados. Algunas de las ventajas de la fotocatálisis es que evita la formación de compuestos halogenados, y limita la acción de microorganismos y bacterias, lo cual representa un proceso no selectivo usado en el tratamiento de mezclas complejas de contaminantes en medio acuoso. Además, el TiO2 es relativamente fácil de recuperar o inmovilizar, posee un bajo costo y no es tóxico, por lo que no requiere de manejo especial y no representa ningún riesgo para la salud humana o hacia el medio ambiente; esto se combina con la radiación solar como única fuente de energía (González & Braun, 1995; Malato et al., 2009; Hapeshi et al., 2010; Chong et al., 2010), lo cual convierte a la fotocatálisis en un proceso limpio.
Cabe mencionar que las reacciones antes descritas están fuertemente influenciadas por la transferencia de materia, la concentración del fotocatalizador, la concentración del oxígeno disuelto en el medio y la concentración del contaminante, el pH, así como de la intensidad de irradiación y, en menor medida, por la temperatura, ya sea para los sistemas fotocatalíticos y electroquímicos, siendo este último influenciado fuertemente por la intensidad de corriente y los materiales que constituyen a los electrodos (González & Braun, 1995; Martínez-Huitle & Brillas, 2009; Chong et al., 2010).
Los diseños estadísticos como herramientas proporcionan respuestas a problemas claramente identificados y específicos. Por ello se optó por la selección de un diseño compuesto central, cuyos factores fueron codificados conforme a la ecuación (16), eligiendo Xi como el valor real de la variable independiente i; xi0 es su valor en el punto central del intervalo; Δxi es la media de la diferencia entre su valor inferior y superior (Ramírez, Costa, & Madeira, 2005; Domínguez, González, Palo, & Sánchez-Martín, 2010; Almeida, García-Segura, Bocchia & Brillas, 2011; Zhang, Yang, Rong, Fu, & Gu, 2012):

Con este diseño es posible calcular el promedio y los efectos principales de cada factor, así como sus interacciones de 2 a 2, 3 a 3, hasta k factores. La respuesta asociada con el diseño para tres variables es representada por un modelo de polinomio lineal descrito por la ecuación (17):
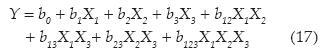
Donde Y es la respuesta experimental; Xi, el código (-1 o +1); bi, la estimación del efecto principal del factor i para la respuesta Y; y bij es la estimación de efecto de interacción entre el factor i y j para la respuesta Y (Hammami, Oturan, Bellakhal, Dachraoui, & Oturan, 2007; Zhang et al., 2012).
Este trabajo muestra una primera aproximación a la viabilidad del tratamiento de las aguas residuales domésticas usando la combinación de dos procesos simultáneos de oxidación avanzada, como la oxidación anódica con ánodos dimensionalmente estables y la fotocatálisis heterogénea con TiO2, basado en un diseño compuesto central, evaluando la eficiencia del proceso mediante el descenso del carbono orgánico total, eficiencia de degradación y costos energéticos. Es de mencionar que la literatura no reporta antecedentes sobre el uso de la combinación de ambas tecnologías en el tratamiento de aguas residuales domésticas.
Metodología
El sistema fue alimentado con 20 l de aguas residuales domésticas previamente filtradas con una malla de 0.5 mm para retener sólidos gruesos, adicionando TiO2 (Cabrera, Alfano, & Cassano, 1996) (Anatasa, dp = 30-90 nm; da = 700; Sg = 48 m2g-1) como fotocatalizador, usando tres diferentes concentraciones: 100, 150 y 200 mg l-1, y Na2SO4 como electrolito soporte a concentraciones de 0.03, 0.04 y 0.05 molar (todos los reactivos fueron suministrados por la casa Karal), aplicando intensidades de corriente de 10, 20 y 30 amperes; estas variables se evaluaron mediante un diseño compuesto central por el método de superficie de respuesta (MSR), con ensayos aleatorios para garantizar la validez estadística empleando el software Design-Expert 7.0. Las variables de respuestas fueron el carbono orgánico total, el consumo energético y la eficiencia de degradación.
El pH de las aguas fue monitoreado mediante un pH-metro Extech 407227 y la conductividad por un HACH (µScm-1 o mScm-1). La radiación solar fue seguida por un pirómetro Daystar Inc. DS-05A. Mientras que la DQO fue analizada conforme a la NMX-AA-030-SCFI-2001 y el porcentaje de degradación fue cuantificado por un analizador de carbono orgánico total (Shimadzu L-CSN), inyectando alícuotas de 50 µl previamente filtradas con PTFE Whatman de 0.45 µm. Los SST, SSD, SS, así como otros parámetros, fueron realizados conforme a los métodos estandarizados APHA-AWWA-WEF (1998).
Celda electroquímica
La celda electrolítica es multicompartimental, con placas externas de acero inoxidable e internos de polietileno de alta densidad de forma rectangular (195 x 41 mm), con un volumen total de 431.73 ml. Como ánodos se empleó al Ti/RuPbOx, Ti/IrPbOx, Ti/IrSnOx, los cuales fueron recubiertos por la técnica de los cloruros de los metales nobles involucrados y activados por descomposición térmica (Morales-Ortiz, Ávila-García, & Hugo-Lara, 2006; Profeti et al., 2009; Papastefanakis et al., 2010). Los cátodos fueron de Ti con una área de 79.95 cm2, con una relación ánodo/cátodo de 1:1. Los ensayos se realizaron en condiciones galvanostáticas a intensidad de corriente constante mediante un rectificador BK Precision Mod-1900 DC, 1-16 VDC/60 A, empleando una configuración eléctrica monopolar y un régimen de flujo flow-by con tiempos de electrólisis de 240 minutos.
Concentrador parabólico solar (CPC)
El fotorreactor tipo CPC es un sistema estático, constituido por cuatro soportes de aluminio, conformado por cinco tubos de vidrio borosilicato SCHOTT-Duran con espesor de 1.8 mm (índice de refracción de 1.51-1.54 a una λ = 380-750 nm), con una capacidad total de 15.2 l; el largo de los tubos es de 145 cm y un diámetro externo de 5 cm. El sistema cuenta con una serie de reflectores cóncavos, cuya distribución de la radiación solar es en torno a un foco; estos reflectores (0.4 mm de espesor) poseen un acabado espejo en aluminio anodizado (con reflectancia de 86% del cual 15% es difusa y el resto es directa en el espectro UV); el CPC cuenta con una razón de concentración de RC = 1, y está alineado con el eje este-oeste con una inclinación a 21° con orientación sur. Todas las conexiones son de teflón o plástico resistente a la radiación UV. El sistema es alimentado por una bomba magnética de diafragma Shurflo serie de oro 2088 a 12 volts (25 l min-1). La figura 1 muestra el montaje del sistema experimental de la celda electroquímica acoplada al concentrador parabólico solar.

Resultados y discusión
Caracterización de las aguas residuales
El cuadro 1 muestra la caracterización de las aguas residuales domésticas cuyos parámetros de sólidos sedimentables, pH, temperatura, fósforo, grasas y aceites cumplen con los límites máximos permisibles conforme a la Norma Oficial Mexicana NOM-001-SEMARNAT-1996 (Semarnat, 1996), para descargas en cuerpos receptores; sin embargo, la DBO5, SST, nitrógeno y cloruros, así como la DQO, que no está considerada en la norma, presentaron una alta concentración y sus efectos repercuten en el medio acuático si el efluente no es tratado de manera adecuada.
Diseño compuesto central
Los valores reales de los niveles fueron codificados en inferior (-1), intermedio (0) y superior (1), considerando seis puntos centrales y seis puntos axiales. La elección de la distancia α de los ensayos axiales al centro se estableció con la finalidad de obtener una varianza estable de la respuesta en los puntos de interés con una α = 1.68179, optándose por un diseño rotable, con un total de 20 ensayos; estos datos fueron generados empleando la ecuación (16) mediante el programa Design-Expert 7.0. Los niveles para la intensidad de corriente fueron de 3.18, 10, 20, 30 y 36.82 ampere; para el Na2SO4, la concentración fue de 0.02, 0.03, 0.04, 0.05 y 0.06 M, y para el TiO2 fue de 65.9, 100, 150, 200 y 234.1 mg l-1. Los ensayos sugeridos fueron ordenados en el cuadro 2, que muestra algunas de las variables de interés monitoreadas durante el tratamiento del agua residual doméstica.
Consumo energético de los procesos
Los datos obtenidos a partir del diseño de experimentos se muestran en el cuadro 2. Para todos los casos se tiene un ligero incremento en el pH, efecto que puede ser atribuido a la generación de OH- en la superficie del cátodo conforme a la reacción (18) (Isarain-Chávez, De la Rosa, Godínez, Brillas, & Peralta-Hernández, 2014). En el caso de la irradiación solar, fue un factor importante que no se pudo controlar, pues se registraron variaciones de 1 090 a 738 Wm-2 al inicio y final de los ensayos durante el trascurso de los días; estas variaciones afectaron las velocidades de reacción fotocatalíticas, las cuales fueron proporcionales al flujo radiante. En este mismo cuadro se aprecian los valores iniciales y finales del proceso, cuantificados en términos de COT, los cuales evidencian un bajo porcentaje de degradación:

Como se esperaba, existe un incremento en la conductividad al adicionar el Na2SO4, cuyo único fin fue disminuir la tensión de celda y el costo eléctrico, el cual está ligado con el consumo energético de los procesos (CEP), donde un aumento en la intensidad de corriente incrementa el voltaje de celda. Este CEP es definido como la cantidad de energía consumida durante el proceso de degradación a un tiempo t; el CEP es expresado en unidades de kWhm-3 y queda definido por la ecuación (19) (Isarain-Chávez et al., 2012):

Donde I es la intensidad de corriente (A); t, el tiempo de electrólisis (horas); V, el voltaje promedio de celda (V), y VS es el volumen del agua tratada (l).
Respuestas del diseño de experimentos
El cuadro 3 presenta los factores y las respuestas para el diseño rotable compuesto central usando la MSR, generando los perfiles gráficos donde se extraen los parámetros de diferencia en la concentración del carbono orgánico total (ΔCOT), eficiencia de degradación (η) y el consumo energético por unidad de masa de COT (CECOT); los dos primeros parámetros fueron evaluados por las ecuaciones (20) y (21):
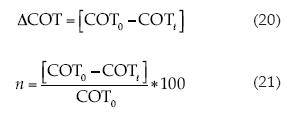
Donde COT0 es la concentración del carbono orgánico total inicial (mg l-1) y COTt es la concentración del carbono orgánico total al tiempo t (min). Mientras que el consumo energético por unidad de masa de COT (CEC0T) es expresado en kWh (gCOT)-1) a un tiempo t de electrólisis, expresado por la ecuación (22), donde Δ(COT)exp es el descenso del COT experimental (g m-3) (Isarain-Chávez et al., 2012):

En dicho cuadro se aprecia que los valores de ΔCOT van de 16 a 57 mg l-1 y se interpreta que la mayor eficiencia se consigue al aplicar una corriente de 30 y 36.8 ampere, así como la adición de 150 a 200 mg l-1 de TiO2, con 0.04, 0.05 molar de Na2SO4.
Las ecuaciones (23), (24) y (25) son los modelos matemáticos predictivos obtenidos en términos lineales con las interacciones de las tres variables independientes conforme a la ecuación (17), para el CECOT, el ΔCOT, y la η por oxidación anódica acoplada a la fotocatálisis en el tratamiento de 20 l de aguas residuales domésticas:

La figura 2a muestra una aceptable correlación entre la probabilidad normal de los residuales para el CECOT, donde los puntos cercanos a la diagonal indican el óptimo del modelo, la cual determina que la desviación entre estos valores es mínima (Ramírez et al., 2005; Almeida et al., 2011). En el caso de la figura 2b, los residuales se encuentran dentro de los límites (Domínguez et al., 2010).
Análisis de varianza ANOVA para el modelo lineal
En el cuadro 4 se muestra el análisis de varianza, el cual demuestra que el modelo lineal es significativo a partir del test (F modelo = 7.19), con un valor bajo de probabilidad de 0.0028, con modelos sugeridos con p < 0.05, los cuales fueron validados con ensayos independientes.
Superficies de respuesta
Efecto de la intensidad de corriente
En la figura 3 se observan los gráficos tridimensionales de superficie de respuesta para CECOT, ΔCOT y η, mostrando el efecto de la concentración del Na2SO4, del TiO2 y de la I. En el cuadro 3 se aprecian los ensayos a cinco diferentes intensidades de corriente: 10, 20 y 30 A, con un mínimo de 3.18 y un máximo de 36.82 ampere. Al aplicar la corriente de 3.18 A, se obtiene una baja eficiencia de degradación de 7% (ensayo 11), con un efecto poco significativo por parte del fotocatalizador y un consumo de 0.36 kWh COT-1. Mientras que a 36.8 A, se consigue 30% de degradación, manteniendo la misma concentración del fotocatalizador y del sulfato de sodio, con un consumo de 1.26 kWh COT-1, siendo éste superior al del ensayo 4 bajo las mismas condiciones de TiO2 y Na2SO4; esto demuestra que el radical •OH vía electroquímica fue la principal especie oxidante, también se tienen reacciones de competencia (ecuación (1)), la cual, a altas intensidades de corriente, consume electrones que provocan una disminución en la eficiencia del proceso global y un mayor consumo energético (figuras 3a y 3b).
Cabe hacer mención que el efluente presentó una alta concentración de cloruros (49.5 mg l-1), que en teoría puede llevar a la formación de especies que contribuyen al proceso oxidativo con bajo consumo energético (ensayos 4, 14 y 18), como lo muestra la reacción (26), donde la especie formada es hidrolizada a ión cloro y ácido hipocloroso (reacción (27)); esta última posee un menor poder oxidante (E° = 1.49 V vs. SHE) que el radical •OH (E° = 2.80 V vs. SHE) (De Laat, Le, & Legube, 2004; Kim et al., 2005; Isarain-Chávez et al., 2014):

Estas reacciones pueden ser afectadas a altas densidades de corriente donde un exceso de radicales •OH puede trasformar al ión Cl-, a otras especies menos oxidantes conforme a las reacciones (28), (29) y (30) (De Laat et al., 2004; Kim et al., 2005; Isarain-Chávez et al., 2014):

Otras de las especies a considerar es el nitrógeno amoniacal (19.6 mg l-1), los iones nitrito y nitrato; la primera especie teóricamente podría ser oxidada por seis electrones, con la inhibición de la reacción de evolución de oxígeno, siguiendo la reacción (31) (Kim et al., 2005; Michels, Kapalka, Abd-El-Latif, Baltruschat & Comninellis, 2010):

Mientras que en el cátodo podría reducir el ión nitrato (10.1 mg l-1) a nitrito vía dos electrones (reacción (32)), o bien el ión nitrato puede ser llevado hasta amonio vía ocho electrones conforme la reacción (33) (Kim et al., 2005; Michels et al., 2010), en el medio fotocatalítico podría llevarse a cabo la reacción inversa del ión nitrito, a ión nitrato, como se muestra en la reacción (34):
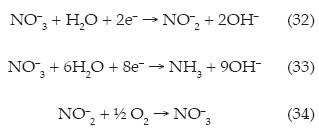
De acuerdo con los resultados mostrados, se tiene que a intensidades de corriente de 20 A, se alcanzan eficiencias de 23 hasta 30%, con consumos que van de 0.7 a 0.84 kWh COT-1, lo cual se traduce en un ahorro energético.
Efecto de la concentración del Na2SO4
Con la finalidad de evaluar la influencia del Na2SO4, se realizaron experimentos con cinco diferentes concentraciones, cuyos valores se muestran en el cuadro 3 y en la figura 3, resultando que a 0.02 y 0.04 M (ensayos 2, 7 y 12), la degradación fue significativamente mayor que a 0.06 M (ensayo 1), todas ellas con intensidades de corriente de 20 A y 150 mgl-1 de TiO2. Los ensayos 15 y 16 a concentraciones de 0.03 y 0.05 M de Na2SO4 y corrientes de 10 A y 100 mgl-1 de TiO2, con degradaciones de 18 y 15%, respectivamente. Estos resultados concuerdan con lo reportado en la literatura, donde un aumento en la concentración de Na2SO4 provoca un menor abatimiento del COT (figura 3c) debido a que el anión SO42- posee la constante de reacción de secuestro de radicales más alta que los otros iones, pese a su desaparición más rápida en las aguas, como se ha reportado (SO42- > NO-3 > Cl-). Este efecto también puede atribuirse a una alta intensidad en la corriente, que genera una elevada concentración de radicales •OH, la cual conduce a la formación de oxidantes débiles, como los iones S2O82-, conforme a la reacción (35) (Domínguez et al., 2010; García et al., 2014):

La disminución en los costos por kWh COT-1 para todos aquellos sistemas con alto contenido de Na2SO4 no compensa la baja eficiencia de degradación lograda al final de la electrólisis.
Efecto de la concentración del TiO2
Al igual que en los casos anteriores, se probaron cinco diferentes concentraciones de fotocatalizador, considerando dos valores extremos de 65.9 y 234 mgl-1 de TiO2, con eficiencias de 9 y 18% a 20 A, y 0.04 M de Na2SO4 (ensayos 6 y 17); en el primer caso ocurre una clara deficiencia por parte del fotocatalizador, cuya contribución es mínima; en contraparte, el exceso de TiO2 produce el efecto de apantallamiento o bien posiblemente una dimerización (ecuación (36)), generando un radical hidroperóxilo (ecuación (37)), el cual resulta menos reactivo con una baja contribución al proceso oxidativo (figuras 3e y 3f). Cabe destacar que estos sistemas tuvieron un alto consumo energético con 1.09 y 1.94 kWh COT-1:
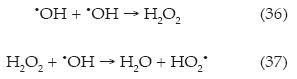
En el caso de las concentraciones de 100, 150 y 200 mgl-1 de TiO2 se consiguió una diferencia poco significativa (figura 3d), lo cual evidencia que la mayor contribución del proceso oxidativo se debe a la producción del radical •OH vía electroquímica. Otro de los aspectos a considerar fue la concentración de oxígeno disuelto en el medio, ya que si el oxígeno se agota, el proceso fotocatalítico se detiene (figura 1), por lo cual el oxígeno resulta ser el principal aceptor de electrones, generando al radical superóxido O2• (KO2 = 2 x 1010 M-1s-1), conforme a la ecuación (38), el cual posee un menor poder oxidante; sin embargo, puede llegar a degradar compuestos aromáticos sustituidos con una alta absorción en el intervalo UV:

Es de destacar que las aguas residuales domésticas con las que se realizaron todos los ensayos poseen cierta concentración de iones HCO3-, los cuales pueden disminuir la eficiencia del proceso, como se pone de manifiesto en la reacción (39):
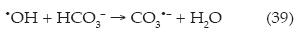
Optimización del proceso
A partir de los resultados anteriores, se seleccionó al sulfato de sodio como la variable a minimizar, para maximizar la eficiencia de degradación, manteniendo en el intervalo al consumo energético y al catalizador. De esta manera se determinaron las condiciones óptimas del proceso y cuyos límites son listados en el cuadro 5.
Experimentos óptimos y caracterización del agua residual
La solución obtenida por el sistema predice un ΔCOT de 54 mg l-1 y una eficiencia de degradación máxima de 26.8%, con un consumo mínimo de 1.30 kWh COT-1 y una deseabilidad de 0.768, aplicando una intensidad de corriente de 29.78 A, con concentraciones de 0.03 M de Na2SO4 y 200 mg l-1 de TiO2. Estas condiciones fueron ensayadas en el sistema consiguiendo una disminución en la DQO de 793.7 a 479.7 mg l-1, y en COT de 265.7 a 212.9 mg l-1, con un aumento del pH de 8.1 a 8.42 unidades. Pese a que se emplearon los parámetros óptimos, difícilmente se alcanzó un porcentaje superior a 19.8% en COT, con lo cual se demuestra que ambos procesos de oxidación avanzada bajo estas condiciones ensayadas no son suficientemente robustos como para tratar aguas residuales que no hayan sido sometidas a algún tratamiento previo.
Conclusiones
Los ensayos mostraron un aumento en la degradación, al incrementar la intensidad de corriente sobre los electrodos de DSA, decreciendo la tensión de celda al aumentar la concentración de Na2SO4, ya que el agua residual posee una baja conductividad; esto conlleva a un aumento en el costo de tratamiento por la adición de reactivos, siendo poco viable esta alternativa, por lo cual no es recomendable la oxidación anódica para estos efluentes, pese al alto poder oxidante de los materiales, ya que el alto consumo energético y el bajo porcentaje de degradación hacen poco atractiva esta tecnología. Este hecho quedó demostrado al pasar de los 30 a los 36 A, consiguiendo degradaciones poco significativas. Un aumento en la concentración del TiO2 incrementa la degradación, pero un exceso de fotocatalizador puede propiciar un efecto negativo de apantallamiento; de manera análoga, un incremento en la concentración de Na2SO4 favorece la generación del anión SO42-, el cual posee la constante de reacción de secuestro de radicales •OH muy alta, disminuyendo la eficiencia global del proceso. La combinación de TiO2 y DSA representa una alternativa en el pulido de las aguas en la eliminación de trazas de contaminantes, pero no así para efluentes con una alta concentración de sólidos suspendidos, color y DQO.
Agradecimientos
Los autores agradecen al Centro de Innovación Aplicada en Tecnologías Competitivas (Ciatec) por su apoyo a través del proyecto 000HD0072 para la realización del trabajo.
Referencias
APHA, AWWA, WEF (1998). Standard Methods for the Examination of Water and Wastewater, Method 9222D. 20th edition. American Public Health Association, American Water Works Association and Water Environment Federation. [ Links ]
Almeida, L. C., García-Segura, S., Bocchia, N., & Brillas, E. (March 14, 2011). Solar Photoelectro-Fenton Degradation of Paracetamol Using a Flow Plant with a Pt/air-Diffusion Cell Coupled with a Compound Parabolic Collector: Process Optimization by Response Surface Methodology. Applied Catalysis B: Environmental, 103(1-2), 21-30. [ Links ]
Cabrera, M. I., Alfano, O. M., & Cassano, A. E. (December, 1996). Absorption and Scattering Coefficients of Titanium Dioxide Particle Suspensions in Water. Journal Physical Chemistry, 100(51), 20043-20050. [ Links ]
Cong, Y., Wu, Z., & Tan, T. (May 22, 2005). Dechlorination by Combined Electrochemical Reduction and Oxidation. Journal of Zhejiang University Science, 6(6), 563-568. [ Links ]
Chatzisymeon, E., Dimou, A., Mantzavinos, D., & Katsaounis, A. (August 15, 2009). Electrochemical Oxidation of Model Compounds and Olive Mill Wastewater over DSA Electrodes: The Case of Ti/IrO2 Anode. Journal of Hazardous Materials, 167(1-3), 268-274. [ Links ]
Chong, M. N., Jin, B., Christopher-Chow, W. K., & Saint, C. (May, 2010). Recent Developments in Photocatalytic Water Treatment Technology: A Review. Water Research, 44(10), 2997-3027. [ Links ]
Chu, Y., Zhang, D., Liu, L., Qian, Y., & Li, L. (May 15, 2013). Electrochemical Degradation of M-cresol Using Porous Carbon-Nanotube-Containing Cathode and Ti/SnO2-Sb2O5-IrO2 Anode: Kinetics, Byproducts and Biodegradability. Journal of Hazardous Materials, 252-253, 306-312. [ Links ]
De Laat, L., Le, G. T., Legube, B. (May, 2004). A Comparative Study of the Effects of Chloride, Sulfate and Nitrate Ions on the Rates of Decomposition of H2O2, and Organic Compounds by Fe(II)/H2O2 and Fe(III)/H2O2. Chemosphere, 55(5), 715-723. [ Links ]
Domínguez, J. R., González, T., Palo, P., & Sánchez-Martín, J. (September 1, 2010). Anodic Oxidation of Ketoprofen on Boron-doped Diamond (BDD) Electrodes. Role of Operative Parameters. Chemical Engineering Journal, 162(3), 1012-1018. [ Links ]
Feng, Y. J., & Li, X. Y. (May 2003). Electro-Catalytic Oxidation of Phenol on Several Metal-Oxide Electrodes in Aqueous Solution. Water Research, 37(10), 2399-2407. [ Links ]
Fernandes, A., Pacheco, M. J., Ciríaco, L., & López, A. (January 15, 2012). Anodic Oxidation of a Biologically Treated Leachate on a Boron-doped Diamond Anode. Journal of Hazardous Materials, 199-200, 82-87. [ Links ]
Fierro, S., Ouattara, L., Herrera, C. E., Passas-Lagos, E., Baltruschat, H., & Comninellis, C. (February 28, 2009). Investigation of Formic Acid Oxidation on Ti/IrO2 Electrodes. Electrochimica Acta, 54(7), 2053-2061. [ Links ]
García, O., Isarain-Chávez, E., El-Ghenymy, A., Brillas, E., & Peralta-Hernández, J. M. (August 15, 2014). Degradation of 2, 4-D Herbicide in a Recirculation Flow Plant with a Pt/Air-Diffusion and a BDD/BDD Cell by Electrochemical Oxidation and Electro-Fenton Process. Journal of Electroanalytical Chemistry, 728, 1-9. [ Links ]
García, O., Isarain-Chávez, E., García-Segura, S., Brillas, E., & Peralta-Hernández, J. M. (December, 2013). Degradation of 2, 4-Dichlorophenoxyacetic Acid by Electro-Oxidation and Electro-Fenton/BDD Processes Using a Pre-pilot Plant. Electrocatalysis, 4(4), 224-234. [ Links ]
González, M. C., & Braun, A. M. (August, 1995). Photolysis of Aqueous Solutions of Nitrate and Nitrite. Res. Chem. lntermed, 21(8-9), 837-859. [ Links ]
Gueymard, C. A. (April, 2004). The Sun's Total and Spectral Irradiance for Solar Energy Applications and Solar Radiation Models. Solar Energy, 76(4), 423-453. [ Links ]
Hammami, S., Oturan, N., Bellakhal, N., Dachraoui, M., & Oturan, M. A. (November 15, 2007). Oxidative Degradation of Direct Orange 61 by Electro-Fenton Process Using a Carbon Felt Electrode: Application of the Experimental Design Methodology. Journal of Electroanalytical Chemistry, 610(1), 75-84. [ Links ]
Hapeshi, E., Achilleos, A., Vasquez, M. I., Michael, C., Xekoukoulotakis, N. P., Mantzavinos, D., & Kassinos, D. (March, 2010). Drugs Degrading Photocatalytically: Kinetics and Mechanisms of Ofloxacin and Atenolol Removal on Titania Suspensions. Water Research, 44(6), 1737-1746. [ Links ]
Huang, Y. H., Shih, Y. J., & Liu, C. H. (April 15, 2011). Oxalic Acid Mineralization by Electrochemical Oxidation Processes. Journal of Hazardous Materials, 188(1-3), 188-192. [ Links ]
Isarain-Chávez, E., De la Rosa, C., Godínez, L. A., Brillas, E., & Peralta-Hernández, J. M. (January 15, 2014). Comparative Study of Electrochemical Water Treatment Processes for a Tannery Wastewater Effluent. Journal of Electroanalytical Chemistry, 713, 62-69. [ Links ]
Isarain-Chávez, E., De la Rosa, C., Martínez-Huitle, C. A., & Peralta-Hernández, J. M. (March, 2013). On-Site Hydrogen Peroxide Production at Pilot Flow Plant: Application to Electro-Fenton Process. International Journal Electrochemical Science, 8, 3084-3094. [ Links ]
Isarain-Chávez, E., Peralta-Hernández J. M., Guerra, R., & Morales-Ortiz, U. (August, 2012). Caracterización de ánodos de PtPdOx y RuO2 usados en una celda electroquímica para la eliminación del cloruro de metiltionina en una solución sintética. Revista Académica de la FI-UADY, 16(2), 131-140. [ Links ]
Kim, K. W., Kim, Y. J., Kim, I. T., Park, G. I., & Lee, E. H. (August 10, 2005). The Electrolytic Decomposition Mechanism of Ammonia to Nitrogen at an IrO2 Anode. Electrochimica Acta, 50(22), 4356-4364. [ Links ]
Lacasa, E., Cañizares, P., Rodrigo, M. A., & Fernández, F. J. (February 15, 2012b). Electro-Oxidation of As(III) with Dimensionally-Stable and Conductive-Diamond Anodes. Journal of Hazardous Materials, 203-204, 22-28. [ Links ]
Lacasa, E., Llanos, J., Cañizares, P., & Rodrigo, M. A. (March, 2012a). Electrochemical Denitrificacion with Chlorides Using DSA and BDD Anodes. Chemical Engineering Journal, 184(1), 66-71. [ Links ]
Lambert, J., Maldonado-Vega M., Isarain-Chávez, E., & Peralta-Hernández, J. M. (July, 2013). Ozone and Electrocoagulation Processes for Treatment of Dye in Leather Industry Wastewater: A Comparative Study. International Journal of Emerging Technology and Advanced Engineering, 3(7), 1-9. [ Links ]
Legrini, O., Oliveros, E., & Braun, A. M. (January, 1993). Photochemical Processes for Water Treatment. Chem. Rev., 93(2), 671-698. [ Links ]
León, M. T., Pomposo, G. G., Suárez, G. J., & Vega, S. S. (2009). Treatment of Acid Orange 24 Solutions with Dimensionally Stable Anodes. Portugaliae Electrochimica Acta, 27(3), 227-236. [ Links ]
Makgae, M. E., Klink, M. J., & Crouch A. M. (December, 2008). Performance of Sol-Gel Titanium Mixed Metal Oxide Electrodes for Electro-catalytic Oxidation of Phenol. Applied Catalysis B: Environmental, 84(3-4), 659-666. [ Links ]
Malato, S., Fernández-Ibáñez, P., Maldonado, M. I., Blanco, J., & Gernjak, W. (September 15, 2009). Decontamination and Disinfection of Water by Solar Photocatalysis: Recent Overview and Trends. Catalysis Today, 147(1), 1-59. [ Links ]
Marselli, B., García-Gómez, J., Michaud, P. A., Rodrigo, M. A., & Comninellis, C. (February, 2003). Electrogeneration of Hydroxyl Radicals on Boron-doped Diamond Electrodes. Journal of the Electrochemical Society, 150(3), D79-D83. [ Links ]
Martínez-Huitle, C. A., & Brillas, E. (April 7, 2009). Decontamination of Wastewaters Containing Synthetic Organic Dyes by Electrochemical Methods: A General Review. Applied Catalysis B: Environmental, 87(3-4), 105-145. [ Links ]
Michels, N. L., Kapałka, A., Abd-El-Latif, A. A., Baltruschat, H., & Comninellis, C. (September, 2010). Enhanced Ammonia Oxidation on BDD Induced by Inhibition of Oxygen Evolution Reaction. Electrochemistry Communications, 12(9), 1199-1202. [ Links ]
Morales-Ortiz, U., Ávila-García, A., & Hugo-Lara, C. (April 14, 2006). Ruthenium Oxide Films for Selective Coatings. Solar Energy Materials & Solar Cell, 90(6), 832-840. [ Links ]
Panizza, M., & Cerisola, G. (April, 2009). Direct and Mediated Anodic Oxidation of Organic Pollutants. Chem. Rev., 109, 6541-6569. [ Links ]
Papastefanakis, N., Mantzavinos, D., & Katsaounis, A. (April, 2010). DSA Electrochemical Treatment of Olive Mill Wastewater on Ti/RuO2 Anode. Journal of Applied Electrochemistry, 40(4), 729-737. [ Links ]
Patel, P. S., Bandre, N., Saraf, A., & Ruparelia, J. P. (2013). Electro-Catalytic Materials (Electrode Materials). Electrochemical Wastewater Treatment. Procedia Engineering, 51, 430-435. [ Links ]
Profeti, L. P., Profeti, D., & Olivi, P. (March, 2009). Pt-RuO2 Electrodes Prepared by Thermal Decomposition of Polymeric Precursors as Catalysts for Direct Methanol Fuel Cell Applications. International Journal of Hydrogen Energy, 34(6), 2747-2757. [ Links ]
Ramírez, J. H., Costa, C. A., & Madeira, L. M. (October, 2005). Experimental Design to Optimize the Degradation of the Synthetic Dye Orange II Using Fenton's Reagent. Catalysis Today, 107-108(30), 68-76. [ Links ]
Rodríguez, J., Candal, R. J., Solís, J., Estrada, W., & Blesa, M. A. (2005). El fotocatalizador: síntesis, propiedades y limitaciones (pp. 129-145). En R. J. Candal (Ed.). Tecnologías solares para la desinfección y descontaminación del agua. San Martín, Argentina: UNSAM Edita, Universidad Nacional de San Martín. [ Links ]
Scialdone O. (November 1, 2009). Electrochemical Oxidation of Organic Pollutants in Water at Metal Oxide Electrodes: A simple Theoretical Model Including Direct and Indirect Oxidation Processes at the Anodic Surface. Electrochimica Acta, 54(26), 6140-6147. [ Links ]
Scialdone, O., Randazzo, S., Galia, A., & Filardo, G. (January, 2003). Electrochemical Oxidation of Organics at Metal Oxide Electrodes: The Incineration of Oxalic Acid at IrO2-Ta2O5 (DSA-O2) Anode. Electrochimica Acta, 54(4), 1210-1217. [ Links ]
Semarnat (1996). Norma Oficial Mexicana NOM-001-SEMARNAT-1996. Que establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. Diario Oficial de la Federación, 6 de enero de 1997. [ Links ]
Szpyrkowicz, L., Juzzolino C., & Kaul, S. N. (June, 2001). A Comparative Study on Oxidation of Disperse Dyes by Electrochemical Process, Ozone, Hypochlorite and Fenton Reagent. Water Research, 35(9), 2129-2136. [ Links ]
Szpyrkowicz, L., Kaul, S. N., Neti, R. N., & Satyanarayan, S. (April, 2005). Influence of Anode Material on Electrochemical Oxidation for the Treatment of Tannery Wastewater. Water Research, 39(8), 1601-1613. [ Links ]
Wu, J., Zhang, H., Oturan N., Wang, Y., Chen, L., & Oturan, M. A. (May 2012). Application of Response Surface Methodology to the Removal of the Antibiotic Tetracycline by Electrochemical Process Using Carbon-felt Cathode and DSA (Ti/RuO2-IrO2) Anode. Chemosphere, 87(6), 614-620. [ Links ]
Zanbotto-Ramalho, A. M., Martínez-Huitle, C. A., & Ribeiro Da Silva, D. (February, 2010). Application of Electrochemical Technology for Removing Petroleum Hydrocarbons from Produced Water Using a DSA-type Anode at Different Flow Rates. Fuel, 89(2), 531-534. [ Links ]
Zhang, C., Yang, L., Rong, F., Fu D., & Gu, Z. (March, 2012). Boron-Doped Diamond Anodic Oxidation of Ethidium Bromide: Process Optimization by Response Surface Methodology. Electrochimica Acta, 64(1), 100-109. [ Links ]
Zhou, M., Liu, L., Jiao, Y., Wang, Q., & Tan, Q. (August 15, 2011b). Treatment of High-Salinity Reverse Osmosis Concentrate by Electrochemical Oxidation on BDD and DSA Electrodes. Desalination, 277(1-3), 201-206. [ Links ]
Zhou, M., Särkkä, H., & Sillanpää, M. A. (April 29, 2011a). Comparative Experimental Study on Methyl Orange Degradation by Electrochemical Oxidation on BDD and MMO Electrodes. Separation and Purification Technology, 78(3), 290-297. [ Links ]














