La obesidad y el sobrepeso continúa aumentando en niños y adultos de todo el mundo, ambos son factores de riesgo de algunas enfermedades crónicas y cardio-vasculares que, a su vez son las principales causas de defunción a nivel mundial; hasta el momento no hay un tratamiento eficaz para revertir el aumento de esta epidemia (Organización Mundial de la Salud [OMS], 2022), por tanto, es necesario continuar investigando para dar una solución eficiente. Frecuentemente, el consumo de azúcares se asocia con una dieta no nutritiva y con la obesidad. Los ambientes obesogénicos se han incrementado y han favorecido el consumo de dietas altas en grasa y/o carbohidratos a cualquier hora del día, las cuales tienen un aporte energético elevado y un alto valor reforzante, que llevan al sobreconsumo de energía (Espitia-Bautista, et al., 2017; Evans & Anderson, 2017), y a una ingesta tipo compulsiva (Muñoz-Escobar et al., 2019). El consumo de azúcares añadidos a la dieta se encuentra por arriba del recomendado (5-10% de la ingesta calórica total) por la OMS (2015). La fuente principal de los azúcares añadidos está en las bebidas, entre ellas los refrescos, los jugos y el agua saborizada (Brisbois, Marsden, Anderson & Sievenpiper, 2014; Marriott, Olsho, Hadden, & Connor, 2010; Sánchez-Pimienta, Batis, Lutter & Rivera, 2016), su consumo entre las comidas principales contribuye con el desarrollo de la obesidad (Fiorentino, 2019), el aumento de los episodios entre comidas (snacks) y el tamaño de las porciones conducen al sobrepeso.
Investigaciones recientes en humanos y animales han asociado a la Oxt con la inhibición del consumo de alimentos palatables y ha surgido el interés por conocer el papel funcional que tiene la Oxt sobre el control de la conducta alimentaria y su posible uso terapéutico para el tratamiento de la hiperfagia y la obesidad (Burmester, Gibson, Butler, Bailey, & Terry, 2019; Iwasaki et al., 2019). El funcionamiento anómalo del sistema de Oxt está ligado a la obesidad en animales y en humanos, en modelos animales, se demostró que los ratones Oxtr-/- (con deficiencia funcional del receptor de Oxt) desarrollaron obesidad de inicio tardío (Camerino, 2009; Takayanagi et al., 2008). De forma semejante, los pacientes humanos con síndrome de Prader-Willi (quienes tienen un número reducido de neuronas de Oxt en el PVN), presentan hiperfagia y obesidad (Miller et al., 2017).
Aunque se reconoce la participación de la Oxt en el control de la ingesta de alimentos palatables, los neurocircuitos subyacentes que modulan estos efectos no se han determinado totalmente, con técnicas de inmunohistoquímica se demostró que la administración periférica de Oxt, o el acceso a soluciones altas en carbohidratos aumentan la expresión de la proteína c-Fos en neuronas del SON y del PVN (Hume, Sabatier & Menzies, 2017; Olszewski et al., 2010; Zhang & Cai, 2011), esto sugiere que, las neuronas de Oxt responden a los cambios metabólicos postpandriales producidos por la ingesta de carbohidratos, es decir, funcionan como sensores metabólicos (Song, Levin, Stevens & Sladek, 2014). Recientemente se demostró que la administración intraperitoneal (ip) de Oxt en ratones, redujo la ingesta de alimento a través de una vía aferente vagal que activa a las neuronas del PVN (Iwasaki et al., 2019), demostrando la existencia de un circuito oxitocinérgico de acoplamiento periférico-central.
La Oxt es una neurohormona que se sintetiza en el hipotálamo, principalmente en el PVN y en el SON, en estos núcleos la liberación de la Oxt ocurre local y distalmente a través de terminales axónicas que llegan al núcleo arqueado del hipotálamo (ARC), al área tegmental ventral (VTA), al núcleo del tracto solitario (NTS), y a la médula espinal. El receptor de Oxt está distribuido ampliamente en regiones cerebrales como el ARC, PVN, hipotálamo dorsomedial (DMH), hipotálamo ventromedial (VMH) e hipotálamo lateral (LH), regiones que han sido relacionadas con el control de la alimentación y el metabolismo (Romano et al., 2020; Rosen, de Vries, Goldman, Goldman & Forger, 2008).
En términos generales se considera que la Oxt reduce la ingesta de alimento y aumenta el gasto energético en animales saciados y en ayuno (Arletti et al, 1989; Noble, Billington, Kotz & Wang, 2014), mejora el metabolismo de la glucosa y disminuye el peso corporal y tejido adiposo en ratas obesas (Altirriba, Poher & Rohner-Jeanrenaud, 2015; Iwasa et al., 2019; Roberts et al., 2017), inhibe la ingesta de alimento en ratas macho y hembra (Liu et al., 2020). En contraste, el bloqueo farmacológico de los receptores de Oxt con antagonistas selectivos, aumenta la ingesta calórica y el peso corporal en ratones (Zhang & Cai, 2011).
Particularmente, la Oxt modula la ingesta selectiva de carbohidratos, la estimulación central del receptor de Oxt inhibe la ingesta de sacarosa y el bloqueo con antagonistas selectivos la aumenta (Mullis, Kay & Williams, 2013; Olszewski et al., 2010). Consistentemente los ratones knockout del receptor de Oxt (carecen del gen Oxt), beben más solución de sacarosa y sacarina que sus contrapartes wild-type (Amico, Vollmer, Cai, Miedlar & Rinaman, 2005; Sclafani, Rinaman, Vollmer, & Amico, 2007). De forma similar, clínicamente la administración intranasal de Oxt en mujeres, redujo la ingesta de bocadillos dulces después de realizar una tarea estresante (Burmester et al., 2019). Estos resultados sugieren que la Oxt modula selectivamente la ingesta de carbohidratos en animales y en humanos.
Las evidencias neurobiológicas del efecto anorexigénico de la Oxt son amplias, pero los mecanismos conductuales participantes han sido menos explorados, la caracterización de estos mecanismos puede contribuir para el desarrollo de un tratamiento farmacológico y conductual que sea eficaz contra la obesidad. Hoy en día, no hay un tratamiento farmacológico totalmente exitoso para combatir la obesidad, esto ha impacto debido al aumento de las comorbilidades relacionadas a ésta. Actualmente, la Oxt representa una alternativa con un alto potencial terapéutico para el tratamiento de la obesidad y algunos desórdenes de la conducta alimentaria, sin embargo, se requiere de más investigación. Por lo tanto, el objetivo de esta investigación fue evaluar el efecto del consumo intermitente de una solución de sacarosa, sobre la expresión de las neuronas del PVN y del SON que producen oxitocina y caracterizar la microestructura de la conducta de beber en ratas saciadas. Nuestras hipótesis de trabajo a probar fueron las siguientes, H1: Los sujetos experimentales incrementarán el consumo de la solución de sacarosa al 20% (a pesar de estar saciados), en un horario (ciclo de luz) fuera del periodo de alimentación natural (ciclo oscuro), H2: El acceso intermitente (1h) y restringido (5g) a la solución de sacarosa interrumpirá el estado de saciedad y demorará el proceso de satisfacción, H3: El acceso a la solución de sacarosa aumentará la actividad de la proteína c-Fos en las neuronas de Oxt de los núcleos del SON y del PVN.
Método
Sujetos
Se utilizaron 24 ratas macho Wistar con un peso aproximado de 200-230g que fueron proporcionadas por el bioterio de la Facultad de Estudios Superiores Iztacala (FESI). Los sujetos fueron colocados de manera aleatoria en cajas-habitación individuales equipadas con el sistema BioDAQ, bajo un ciclo invertido de luz-oscuridad de 12x12 h (inicio del ciclo de luz 11:00 a.m.), y temperatura del laboratorio a 22 ± 1°C. Los procedimientos llevados a cabo se realizaron conforme a la Norma Oficial Mexicana (NOM-062-ZOO-1999) con las especificaciones para la producción, cuidado y uso de animales de laboratorio y con el aval de la comisión de Ética de la FESI (CE/FESI/102020/1365).
Dieta
Todos los sujetos tuvieron acceso al alimento estándar de laboratorio para rata (Harlam laboratorios, USA), el cual contiene 18% de grasa, 58% de carbohidratos y 24% de proteínas (3.1 kcal/g), el agua y el alimento estándar de laboratorio estuvieron disponibles 23h. En la hora de registro, un grupo de ratas tuvo una hora de acceso libre a una solución de sacarosa al 20% (0.8 kcal/ml), un segundo grupo tuvo acceso restringido a 5g de la misma solución, y el grupo control tuvo acceso libre a agua natural.
Análisis microestructural de la conducta de beber
El análisis microestructural de la conducta de beber se realizó en cajas equipadas con el BioDAQ 2.2 System (Research Diet Inc), sistema que recopila con alta precisión los datos de la ingesta de alimento y de los líquidos (Boyle, Lorenzen, Compton, & Watts, 2012). Los bebederos fueron colocados en las tolvas de las cajas, y el sistema pesó segundo a segundo la botella de plástico (± 0.01 g). Así, cuando el peso de la botella permanece estable indica que el animal “no está bebiendo” y un peso inestable indica que el sujeto experimental “está bebiendo”. Por tanto, un episodio de beber se definió como el periodo de tiempo en el que el peso del bebedero estaba variando y que la cantidad mínima de consumo fuera de 0.02 g. El episodio de beber terminó cuando el peso de la tolva permaneció estable por más de 5 segundos, es decir, cada episodio estuvo separado por un intervalo mínimo de 5 segundos. Teniendo en cuenta estas definiciones, se evaluaron los siguientes parámetros de consumo: latencia para iniciar a beber (seg), frecuencia de los episodios (número de episodios), duración (min) de los episodios, tiempo entre episodios (TEE; tiempo total de consumo/frecuencia-1) y tasa local de consumo (kcal/seg).
Análisis Inmunohistoquímico
Los sujetos fueron anestesiados con una mezcla de ketamina/xilazina (112.5/22.5 mg/kg, ip) y perfundidos intracardiacamente primero con 200 ml de solución salina isotónica al 0.9% seguido de 200 ml de paraformaldehído al 4% en buffer fosfato (PBS 0.1 M, con un pH de 7.2). Al término de la perfusión, las ratas fueron decapitadas, removidos los cerebros y colocados en paraformaldehido al 4% durante 24 h. Una vez post-fijados, los cerebros fueron colocados en sacarosa al 30% durante 72 h. Posteriormente se obtuvieron cortes coronales de 40 μm de espesor con un criostato (Leika, Nussloch, Alemania) a -18°C. Los cortes fueron colectados en 4 series de la región anterior a la región posterior del núcleo paraventricular y del núcleo supraóptico con ayuda del Atlas estereotáxico de Paxinos y Watson (2013).
Los cortes cerebrales fueron incubados durante 72 h a 4ºC con un anticuerpo policlonal anti-oxitocina hecho en conejo (adquirido a Tocris Laboratorios, USA) diluido 1:3000 en Supermix (PBS, 0.25% gelatina natural y 0.5 tritón x-100). Finalizadas las 72 h, los tejidos fueron lavados 3 veces x 10 minutos con PBS e inmediatamente incubados con un anticuerpo secundario biotilinado (goat anti-rabbit IgG; adquirido a Vector Laboratories Inc.) en una dilución de 5:1000 en Supermix durante 2 h a temperatura ambiente. Al término, los tejidos fueron lavados nuevamente con PBS y colocados con el complejo avidina-biotina peróxidasa (Vectastain Elite ABC Kit, Vector Laboratories) durante 2 h a temperatura ambiente. Posteriormente, los tejidos fueron lavados 3 veces x 10 minutos con PBS. Para el revelado de oxitocina, los tejidos fueron colocados en buffer trizma (pH 7.2), a la cual se le agrego diaminobenzidina (DAB; Sigma Aldrich; 0.5 mg/ml) y peróxido de hidrógeno al 30% (35µl/100ml). Una vez corroborada la inmunoreactividad de oxitocina, los tejidos fueron lavados 3 veces x 10 minutos con PBS, colocados en portaobjetos y posteriormente fueron deshidratados gradualmente con alcohol al 70%, 96% y 100%, aclarados con xileno y cubiertos con Entellan (Merck).
Cuantificación de neuronas positivas a oxitocina en el PVN y en el SON
Con ayuda del Atlas estereotáxico para rata de Paxinos y Watson (2013) se localizó el PVN y el SON y se obtuvieron microfotografías digitales con una ampliación de 10x y 20x de los cortes cerebrales con ayudad de un microscopio óptico (Leica EC50 HD), el cual tiene una cámara digital conectada a una PC. Las imágenes fueron procesadas y analizadas con ayuda del software Image-Pro Plus 5.1. Se contaron las células positivas para Oxt de forma independiente en ambas regiones, tomando en cuenta el fondo de la imagen y el tamaño aproximado de las células positivas a Oxt.
Procedimiento
Antes de comenzar los experimentos, los animales tuvieron 7 días de habituación a las condiciones del bioterio (cajas-habitación, ciclo luz/oscuridad, temperatura). Posteriormente los sujetos fueron divididos aleatoriamente a uno de tres grupos y durante 10 días, todos los grupos tuvieron disponible el alimento estándar de laboratorio y agua por 23 horas. Al inicio del periodo de luz (11:00 a.m.) el alimento y el agua fueron retirados y se colocó el bebedero correspondiente a cada grupo:
Grupo Control (n=8), disponibilidad ad libitum de un bebedero con agua natural,
Grupo Restringido (restringido por cantidad, n=8), disponibilidad de un bebedero con 5 g de sacarosa al 20%,
Grupo con acceso Ad libitum (restringido en tiempo, pero no en cantidad, n=8), disponibilidad ad libitum por una hora de un bebedero con sacarosa.
Se registró el consumo (g) de agua y de la solución de sacarosa al 20%, y se llevó a cabo el análisis microestructural de la conducta de beber (1 h). Al finalizar el registro, se colocó nuevamente el alimento estándar de laboratorio y un bebedero con agua para todos los grupos. La solución de sacarosa fue preparada diariamente diez minutos antes del inicio del registro.
El décimo día después de realizar el registro conductual, los sujetos fueron sacrificados para llevar a cabo el análisis inmunohistoquímico de los cerebros. Además, fue extraído y pesado el tejido adiposo de la región mesentérica, gonadal y retroabdominal, siguiendo el método utilizado por Ravagnani et al. (2012).
Análisis estadístico
Los datos de esta investigación se expresan en términos de la media ± el error estándar de la media (SEM), la ingesta de alimento estándar, de agua y de las soluciones fue medida en gramos. Para el análisis del consumo de la solución de sacarosa por día se utilizó un ANOVA de dos factores con medidas repetidas en el factor tiempo, en el primer factor se consideró el tipo de bebida (dieta: agua, solución de sacarosa al 20% con acceso ad libitum o solución de sacarosa al 20% con acceso restringido) y en el segundo factor los días de acceso a la solución (día 1-10), en el caso de la ingesta de alimento estándar por día se usó un ANOVA de dos factores con medidas repetidas en el factor tiempo, en el primer factor se consideró el consumo de alimento en tres grupos de animales (agua, solución de sacarosa al 20% con acceso ad libitum o solución de sacarosa al 20% con acceso restringido) y en el segundo factor los días de acceso al alimento (día 1-10), en ambos casos un ANOVA significativo fue seguido de la prueba de comparación Tukey. Para estos análisis de medidas repetidas se utilizó la corrección de Greenhouse-Geisser para evitar la violación de la condición de esfericidad.
Para el análisis de la ingesta total de la solución al 20%, la ingesta del alimento estándar y consumo calórico total, se obtuvo el promedio de consumo de los diez días por sujeto y se realizó un análisis ANOVA ordinario de una vía. Para analizar los datos de los parámetros del análisis de la microestructura de beber (tasa local de alimentación, latencia, frecuencia, duración y tiempo entre episodios), se obtuvo el promedio de los diez días de cada parámetro por sujeto y se realizó el análisis con el ANOVA ordinario de una vía. El criterio para la significancia estadística fue de p < .05. Los datos fueron analizados con el paquete estadístico GraphPad Prism Version 8.0.1 (GraphPad Software, San Diego, CA, USA).
Resultados
Consumo de solución de sacarosa y alimento estándar
El análisis estadístico del consumo de sacarosa reveló diferencias significativas en la interacción [F(18, 189) = 3.612, p < .0001], en el factor tiempo [F(4.286, 90) = 4.729, p < .0013] y en el factor dieta [F(2,21) = 52.94, p < .001]. La prueba post hoc de Tukey indicó un aumento del consumo de la solución de sacarosa al 20% en el grupo Ad libitum (ver Figura 1A), con relación al grupo Control (día 4 y días 6 al 10) y al grupo Restringido (días 4, 6, 7, 9 y10). En tanto que, en el grupo con acceso Restringido se presentó un aumento de la solución de sacarosa con relación al grupo Control (días 2, 5-8, y 10). Estos resultados sugieren que el incremento del consumo de la solución de sacarosa dependió del tiempo de exposición a la solución, y de la dieta disponible (agua, solución de sacarosa disponible una hora, o 5g de solución disponible).
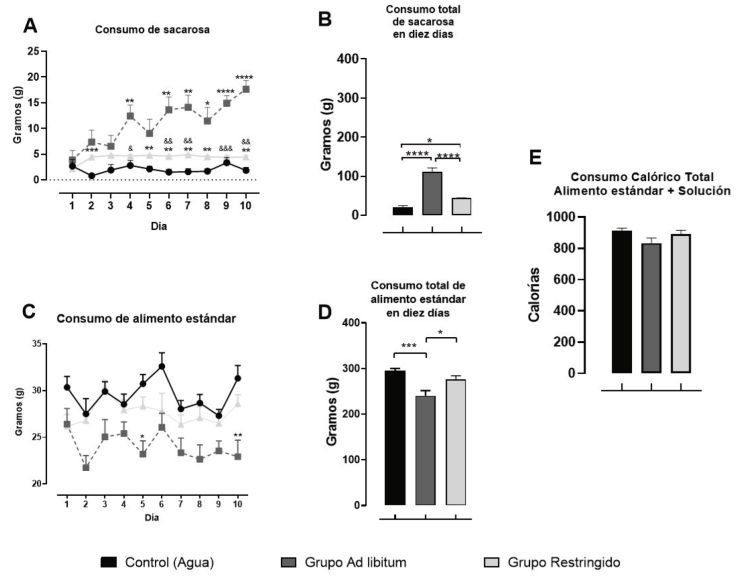
Figura 1 Consumo diario y total de la ingesta de una solución de sacarosa al 20% y de alimento estándar de laboratorio durante 10 días. A) Consumo diario de la solución de sacarosa, en la primera hora al inicio del periodo de luz, bajo dos condiciones de acceso: Grupo Ad libitum (restringido a 1h de acceso, sin restringir la cantidad de solución) y Grupo Restringido (restringido a 5g de la solución), B) Consumo total de la solución de los diez días de observación, C) Consumo diario (23 h) de alimento estándar de laboratorio, D) Consumo total de alimento estándar de laboratorio durante diez días y E) Suma del consumo calórico total de diez días de la ingesta de alimento estándar más la solución. Los resultados se representan en la media ± SEM; se usa (*) para marcar diferencias significativas en relación con Grupo Control y (&) para las diferencias con el Grupo Adlibitum: *p < .05, **p<.01, ***p<.001, ****p<.0001; & p < .05, && p<.01, &&& p<.001
El análisis del promedio de consumo de la solución de sacarosa durante los diez días de acceso (ver Figura 1B) con el ANOVA de una vía, indicó diferencias estadísticamente significativas [F(2, 21) = 52.94, p < .0001], la prueba de comparación Tukey indicó un aumento del consumo de la solución de sacarosa en el grupo Ad libitum en relación al grupo Control y en relación al grupo con acceso Restringido; el grupo con acceso Restringido también presentó un aumento del consumo en relación con el grupo Control.
El consumo de alimento estándar de laboratorio presentó diferencias estadísticamente significativas en el factor tiempo [F (3.25, 68.24) = 4.234, p < .0069] y en el factor dieta [F(2, 21) = 10.45, p < .0007], no encontrando diferencias en la interacción [F (18, 189) = 1.531, p > .083]. La prueba de Tukey indicó una reducción del consumo de alimento en el día 10 en el grupo Ad libitum en comparación con el grupo Control (ver Figura 1C). El promedio de diez días del consumo total de alimento estándar también presentó diferencias estadísticamente significativas [F(2, 21) = 10.45, p < .0007], la prueba de comparación Tukey indicó la reducción del consumo de alimento estándar en el grupo Ad libitum con relación a los grupos Control y Restringido (ver Figura 1D). En el consumo total de calorías de la dieta estándar y de la solución (ver Figura 1E), no se encontraron diferencias estadísticamente significativas [F(2, 21) = 2.58, p > .09].
Comparando el consumo de la solución dulce con el consumo de alimento estándar, se aprecia que el grupo Ad libitum bebió (g) proporcionalmente un tercio de la solución (111±10.32) en una hora de acceso diario, en relación con el consumo de alimento estándar (g) del grupo Control (294.9±5.17) durante 23 h de acceso (ver Figuras 1B y 1D), y más del doble de lo que bebió el grupo Restringido (43.57±0.97).
Peso y acumulación de tejido adiposo
El peso corporal y el tejido adiposo total (ver Figuras 2A y 2B) no presentaron diferencias estadísticamente significativas [F(2, 21) = 1.81, p > 0.19; F(2, 21) = 2.629, p > .095]. Pero el análisis por región indicó cambios estadísticamente significativos en la acumulación del tejido adiposo mesentérico [F(2, 21) = 6.67, p < .006], la prueba de Tukey mostró una reducción de este tejido en el grupo Restringido en comparación con los grupos Control y Ad libitum (ver Figura 2C).
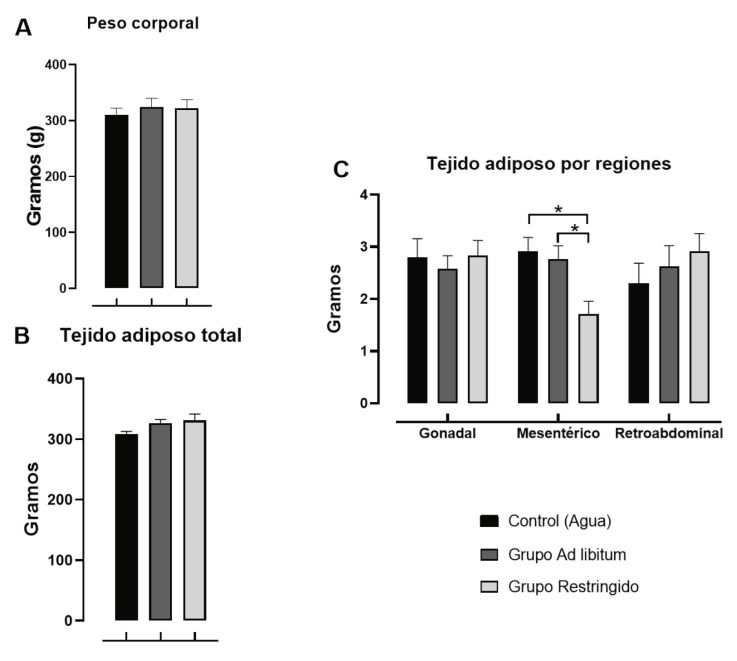
Figura 2 Presenta el peso corporal (A), la cantidad de tejido adiposo total (B), y la cantidad de tejido adiposo por regiones (C), en ratas con acceso Ad libitum o Restringido a una solución de sacarosa en la primera hora al inicio del periodo de luz por diez días. Los resultados se representan en la media ± SEM. *p < .05
Análisis microestructural de la conducta de beber
La microestructura de la conducta de beber presentó cambios debidos al consumo de la solución de sacarosa (ver Tabla 1). El análisis estadístico indicó diferencias significativas en la latencia [F(2, 21) = 9.54, p < .001], la prueba de Tukey reveló la disminución de la latencia en los grupos Ad libitum y Restringido con relación al grupo Control; esto sugiere que los sujetos que tienen disponible la solución de sacarosa inician a beber más tempranamente. En el parámetro de frecuencia no se encontraron diferencias estadísticamente significativas [F(2, 21) = 1.531, p < 0.23]. Respecto a la duración de los episodios de beber, el ANOVA reveló diferencias significativas [F(2, 21) = 6.459, p < .007], la prueba post hoc de Tukey demostró un incremento significativo de la duración de los episodios en el grupo Ad libitum con relación al grupo Control. En el tiempo entre episodios, también se encontraron diferencias significativas [F(2, 21) = 10.02, p < .0009], la prueba Tukey indicó la reducción del tiempo entre episodios en el grupo Restringido, en relación con los grupos Ad libitum y Control, es decir, bajo esta condición los sujetos acortan el tiempo que separa a un episodio de otro. También encontramos diferencias estadísticamente significativas [F(2, 21) = 12.38, p < .0003] en la tasa local de beber, la prueba de Tukey informó un incremento de consumo por unidad de tiempo en el grupo Ad libitum en relación con los grupos Control y Restringido, esto sugiere que los animales beben más rápido, consumen más solución por unidad de tiempo.
Tabla 1 Análisis microestructural de la conducta de beber
| Parámetro |
|
|
|
p |
|---|---|---|---|---|
| Latencia (min) | 3 ± 0.54 | 1.52 ± 0.37* | 0.62 ± .10*** | .001 |
| Frecuencia | 1.84 ± 0.47 | 2.42 ± 0.30 | 1.62 ± 0.5 | .23 |
| Duración (min/episodio) | 2.46 ± 0.65 | 4.97 ± 0.44** | 3.58 ± 0.30 | .007 |
| Tiempo entre episodios (min) | 28.4 ± 4.61 | 18.74 ± 3.7 | 6.22 ± 1.13***& | .0009 |
| Tasa local de beber (g/seg) | 0.12 ± 0.02 | 0.51 ± 0.09*** | 0.20 ± 0.01&& | .0003 |
Nota: Parámetros de la microestructura de beber en ratas saciadas en la primera hora al inicio del periodo de luz. Grupo Ad libitum con tiempo de acceso restringido a una hora pero con solución sacarosa ilimitada. Grupo Restringido, limitado a 5 g de una solución de sacarosa. Se usa (*) para marcar diferencias significativas en relación con Grupo Control y (&) para las diferencias con el Grupo Adlibitum: * p < .05, ** p<.01, *** p<.001, & p < .05, && p<.01
Análisis inmunohistoquímica Oxitocina
El análisis de inmunohistoquímica reveló cambios en los niveles de Oxt en el SON, las diferencias fueron estadísticamente significativas [F(2, 12) = 9.274, p < .0037], la prueba de Tukey indicó un incremento de los niveles de Oxt en el grupo Restringido en comparación con los grupos Control y Ad libitum (ver Figura 3A).
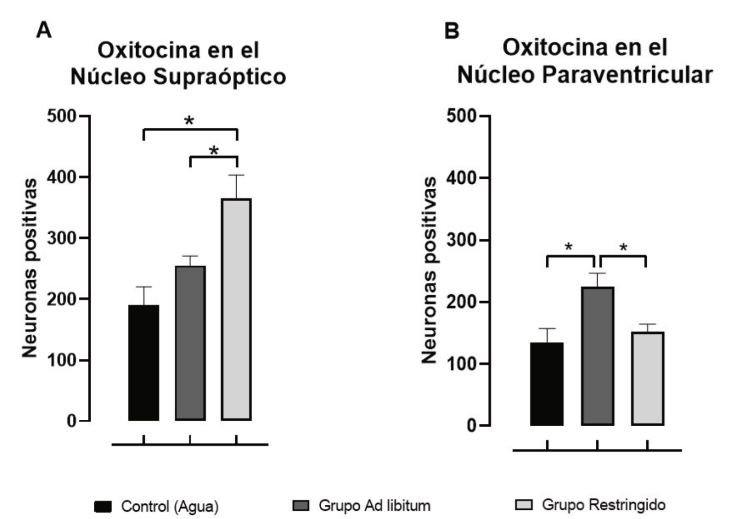
Figura 3 Cantidad de neuronas positivas a Oxitocina en el Núcleo Supraóptico (SON) y Núcleo Paraventricular Hipotalámico (PVN), después de diez días de acceso ad libitum o restringido a una solución de sacarosa al 20%. Los resultados se presentan en la media ± SEM. *p < .05
En el PVN también se presentaron diferencias estadísticamente significativas [F(2, 12) = 6.219, p < .014], la prueba de comparación de Tukey mostró un incremento de los niveles de Oxt en el grupo Ad libitum en relación con el grupo Control y el grupo Restringido (ver Figura 3B).
Se realizó la prueba de r de Pearson para determinar la correlación entre la cantidad de solución consumida y la inmunoreactividad de las neuronas de Oxt, la prueba estadística determinó que estas variables no se correlacionan (valores de p > .05), esto sugiere que la actividad de las neuronas de Oxt no depende de la cantidad de solución ingerida.
Discusión
El objetivo de esta investigación fue evaluar el efecto del consumo de una solución de sacarosa, sobre la expresión de las neuronas del PVN y del SON que producen oxitocina, y caracterizar la microestructura de la conducta de beber en ratas en un estado de saciedad. Los resultados demostraron que los sujetos del grupo Ad libitum incrementaron el consumo de la solución de sacarosa al 20%, y presentaron un efecto compensatorio sobre la ingesta de alimento estándar. En el grupo Restringido no hubo afectación del consumo de alimento estándar, y el consumo calórico total fue similar al observado en el grupo Control, esto sugiere que el consumo limitado de la solución llevó a un efecto compensatorio parcial sobre el alimento estándar. El análisis conductual mostró un patrón temporal diferente en ambos grupos, el grupo Ad libitum, se caracterizó por la reducción de la latencia para iniciar el primer episodio de beber, incremento de la duración de los episodios y aumento de la tasa local de alimentación. En tanto que, en el grupo Restringido, el patrón conductual se caracterizó por una reducción de la latencia y la disminución del tiempo entre episodios. La actividad de las neuronas de Oxt incrementó en ambos grupos experimentales, en el grupo Ad libitum aumentó en el PVN, en tanto que, en el grupo Restringido aumentó en el SON.
Nuestros resultados indican que las ratas consumieron la solución de sacarosa en la primera hora del ciclo de luz a pesar de estar saciadas. El consumo de la solución dulce se estableció a partir del cuarto día en ambos grupos, en el grupo Ad libitum el consumo empezó a incrementar a partir del cuarto día y hasta el final de las observaciones, en el día 10 se registró el consumo más alto (17.62±1.7). En el grupo Restringido el consumo de la solución se estabilizó partir del cuarto día, en parte esto se debió a que, los animales consumían los 5g de la solución que tenían disponible, la media más alta registrada fue de 4.86±0.123. En consistencia con nuestros resultados, investigaciones previas demostraron que las bebidas dulces favorecen el sobreconsumo, las soluciones altas en azúcar (16%) son las preferidas por los roedores en pruebas cortas (agudas), en tanto que, en los modelos crónicos se ha demostrado la preferencia por las bebidas bajas (4%) en azúcar (Eikelboom & Hewitt, 2016; Eikelboom, Hewitt, & Adams, 2022). Nuestros resultados sugieren que los grupos restringidos por cantidad y por tiempo de acceso a la solución de sacarosa, bebieron en exceso (g) en comparación con el consumo de agua (Control 2.026 ± 0.42 g), los animales del grupo Restringido bebieron el doble (4.35 ± 0.097 g) y los del grupo Ad libitum quintuplicaron (11.10 ± 1.032 g).
La disponibilidad de la bebida fue una de las variables que determinó el aumento del consumo, las ratas que tuvieron acceso ad libitum consumieron más que aquellas que tuvieron una cantidad limitada de la solución. Investigaciones pioneras (Blundell, 1986) dieron cuenta de la influencia que pueden tener las variables contextuales (e.g. disponibilidad y las características organolépticas de los alimentos) sobre la conducta alimentaria. Aunque los sujetos experimentales estaban saciados, la disponibilidad de la solución dulce facilitó el consumo sin una necesidad biológica a satisfacer (hambre o sed), en un ciclo (luz) en el que de forma natural los roedores comen poco. Esto sugiere que, la disponibilidad y el sabor de la bebida impulsaron el consumo, que fue mediado más por el valor intrínseco del alimento (control hedónico) que por señales de hambre o saciedad (control homeostático) (Chakravarthy, Balasubramani, Mandali, Jahanshahi & Moustafa, 2018). Al comparar la cantidad (g) de alimento estándar consumido por el grupo Control, con el consumo de la solución (g) por el grupo Ad libitum durante diez días, se observó que los animales consumen proporcionalmente un tercio de la solución (g), en relación con el consumo de alimento estándar de los sujetos Control, es decir, en un tiempo breve (1h diaria) bebieron una gran cantidad de la solución azucarada. Investigaciones previas demostraron que, el acceso intermitente a las bebidas dulces induce la ingestión de grandes cantidades en un tiempo breve, incluso en ausencia de hambre (Corwin & Babbs, 2012; Di Segni et al., 2014; Eikelboom & Hewitt, 2016; Hone-Blanchet & Fecteau, 2014; Suárez-Ortiz et al., 2018). Nuestros resultados contribuyen en el entendimiento de la influencia que tienen los ambientes obesogénicos y las características del alimento sobre el consumo de alimento en condiciones de saciedad. Las variables ambientales o contextuales intervienen en el consumo de alimento no solo en los animales, evidencias recientes sugieren que el aumento de la obesidad infantil se debe más a factores ambientales que a factores genéticos (Daniels, Schinasi, Auchincloss, Forrest & Diez Roux, 2021), la disponibilidad de alimentos entre las comidas principales, sus características organolépticas, y el sedentarismo son factores que están contribuyendo en la incidencia de la obesidad.
Las ratas del grupo Ad libitum disminuyeron el consumo de alimento estándar (g), para compensar el consumo calórico proveniente de la bebida, en investigaciones previas se ha visto este efecto en ratones resistentes a la obesidad y en ratas, estos animales reducen la ingesta de alimento estándar para mantener un consumo calórico constante (Soto et al., 2016; Eikelboom et al., 2022). En esta investigación, el consumo calórico total fue similar en los tres grupos, este se mantuvo constante durante diez días, esto sugiere que hubo una modulación homeostática para salvaguardar el peso corporal. Es necesario seguir investigando para determinar en qué momento o en qué condiciones se produce este efecto compensatorio y cuánto tiempo se mantiene, los resultados de las investigaciones al respecto aún son contradictorios, en algunas se encuentra la compensación y en otras no. En este sentido, es necesario determinar si este efecto compensatorio, tiene que ver con mecanismos homeostáticos o esta permeado por el aprendizaje del acceso temporal al alimento (horario fijo del acceso al alimento) y/o a la porción de alimento disponible, y cuestionar si los sujetos con restricción de tiempo y con una porción de alimento libre, hacen un ayuno voluntario del alimento estándar para después atracarse o si realmente hay un efecto compensatorio (homeostático); los animales con una cantidad de alimento limitado no presentaron un efecto compensatorio como tal, pues el consumo de alimento estándar siguió siendo similar al del grupo Control y además consumieron el alimento palatable disponible.
El acceso a la solución de sacarosa al 20% durante diez días no afectó la acumulación del peso corporal, resultados semejantes fueron encontrados por Eikelboom et al., (2022), y aunque nuestros resultados muestran que no hubo cambios en el tejido adiposo total, el análisis por región indicó la reducción del tejido adiposo mesentérico en el grupo Restringido, esto sugiere que la distribución del tejido puede estar cambiando para prevenir el aumento de peso o el desarrollo de procesos inflamatorios. Investigaciones previas demostraron que, la reducción del tamaño del tejido adiposo mesentérico puede ser consecuencia de una mayor actividad metabólica (Ludwing et al., 2013), se sugiere que los cambios en los estados inflamatorios y endocrinos debidos a la dieta se presentan primeramente en el tejido adiposo mesentérico más que en otros depósitos de tejido adiposo visceral (Wu et al., 2018), y puede mostrar una respuesta diferencial a las dietas a través de la modulación de los procesos metabólicos inflamatorios (Ludwing et al., 2013). El tejido adiposo retroperitoneal presenta mayor expresión de factores de transcripción que regulan la lipogénesis, mientras que la región mesentérica muestra mayor expresión de genes relacionados con la oxidación de ácidos grasos mitocondriales (Palou et al., 2009). Por otro lado, es probable que el solo consumo de la solución no induzca el aumento de peso debido a los efectos compensatorios (porciones consumidas y procesos metabólicos), sin embargo, el problema se agrava cuando se presenta la interacción con otras variables como, el estrés o la adición de dietas altas en grasa (variables que están presentes en los ambientes naturales humanos), y que exacerban el consumo de las bebidas dulces (Gharibeh et al., 2022), entonces el peso corporal aumenta y consecuentemente aumenta el riesgo de desarrollar obesidad.
El análisis de la microestructura de la conducta alimentaria demostró patrones temporales diferentes en los grupos Ad libitum y Restringido. En el caso del primero se encontró un adelanto del inicio del primer episodio de beber (reducción de la Latencia) y un incremento de la duración de los episodios, este patrón sugiere que la respuesta sensorial producida por el alimento está demorando el proceso de satisfacción (proceso que detiene la alimentación). Estos resultados son consistentes con investigaciones previas que indican que el consumo de azúcar aumenta el hambre y retrasa la satisfacción (DiNicolantonio et al., 2018). Además, como se mencionó antes, estos sujetos bebieron una gran cantidad de la solución en un tiempo breve (1h), este resultado es consistente con el incremento de la tasa local de beber, los animales del grupo Ad libitum bebieron a una velocidad mayor (ingirieron más alimento por unidad de tiempo). Esto sugiere que, la rapidez con que se consume el alimento está mediado por señales orosensoriales, los antecedentes indican que dietas palatables altas en energía o altas en grasa, inducen la ingestión de porciones más grandes de alimento a ritmos más rápidos por sus características orosensoriales (Melhorn et al., 2010; Treesukosol & Moran, 2014). Por tanto, el incremento de la ingesta de solución dulce en el grupo Ad libitum se explica conductualmente con la demora del proceso de satisfacción, producido por la estimulación orosensorial de la bebida.
Respecto al grupo Restringido, el análisis microestructural demostró el adelanto del primer episodio (fue el primer grupo en iniciar el consumo), y la reducción del tiempo entre episodios (episodios más cercanos). Nuestros resultados sugieren que las características temporales de los patrones de alimentación en animales saciados pueden ser afectados por la disponibilidad de alimento palatable en horarios de no consumo, el estado de saciedad en el que se encontraban los sujetos fue interrumpido por la disponibilidad de un alimento palatable. Investigaciones previas demostraron la presencia de conductas anticipatorias al acercarse la hora de acceso al alimento palatable (Muñoz-Escobar et al., 2019; Mendoza et al., 2005), los animales esperan con ansia el acceso al alimento; hay un deseo por el alimento. En esta investigación al dar el acceso a una cantidad limitada de la solución, los animales se precipitan al bebedero (hay un inicio temprano del consumo), y presentan episodios de beber más cercanos a pesar de estar saciados, esto sugiere la interrupción del estado de saciedad producido por el aumento del deseo por el alimento.
El análisis de inmunohistoquímica indicó un aumento de la expresión de Oxt en el SON y en el PVN. Estos resultados son consistentes con investigaciones que demostraron un aumento de la expresión c-Fos en neuronas del SON y del PVN al consumir soluciones dulces (Hume, et al., 2017; Olszewski et al., 2010; Zhang & Cai, 2011). Nuestros resultados indican que independientemente de la cantidad de solución consumida se incrementó la inmunoreactividad de las neuronas de Oxt en el SON y en el PVN, esto sugiere que la actividad de estas neuronas no dependió de la distensión gástrica. Esto es congruente con la demostración de que las neuronas de Oxt responden particularmente a los alimentos palatables con alto contenido de azúcar y no a los alimentos altos en grasa, o a la distensión gástrica (Hume, et al., 2017). Llama la atención que el grupo Restringido presentó mayor actividad de las neuronas de Oxt en el SON y que el grupo Ad libitum tuvo más actividad en el PVN, así mismo que haya mayor respuesta en el SON en relación con el PVN. Particularmente las neuronas del SON se activan rápida e intensamente por las señales asociadas a la ingesta de alimento (Hume et al., 2017; Johnstone, Fong & Leng, 2006). La mayor expresión de neuronas en el SON, se debe en parte a la mayor densidad de células de Oxt localizadas en el SON que en el PVN (Althammer & Grinevich, 2017). Nuestros resultados sugieren que las neuronas de Oxt del SON están implicadas en el proceso de satisfacción, pues se activan tan pronto como se inicia el consumo de alimento. En tanto que, el PVN se relaciona con el efecto supresor de la ingesta de alimento (Leibowitz & Alexander, 1998), esto sugiere que la actividad de Oxt en el PVN está relacionada con el término de la alimentación, nuestros resultados sugieren que probablemente estos núcleos tengan funciones diferentes, sin embargo, se requiere de mayor investigación para probar estas hipótesis.
Los resultados respecto a la activación de las neuronas de Oxt por distensión gástrica son controversiales (Hume et al., 2017; Mazda, Yamamoto, Fujimura & Fujimiya, 2003), nuestros resultados son consistentes con la activación de las neuronas de Oxt independientemente de la cantidad de solución ingerida, es posible que esta señal sea modulada por la participación de otros mecanismos. Se sabe que, la distención gástrica produce la liberación de serotonina (5-HT) de las células enterocromafines, activando los receptores 5-HT3 localizados en las terminales aferentes vagales, lo que conduce a la activación de las neuronas del NTS y la subsecuente activación de las neuronas del PVN y del SON (Mazda et al., 2003), regiones en las que la 5-HT media las respuestas de las neuronas de Oxt (Emiliano, Cruz, Pannoni & Fudge, 2003), además la 5-HT se ha relacionado con la modulación de la ingesta selectiva de carbohidratos y con el control de la conducta alimentaria (Leibowitz & Alexander, 1998). Nuestros resultados indican que no hubo correlación entre la cantidad de bebida ingerida y la actividad de las neuronas Oxt, es posible que las señales de distensión gástrica sean mediadas por receptores 5-HT y no por el receptor de Oxt, pero, se requiere continuar investigando para probar esto.
Algunas de las limitaciones de esta investigación son que el conteo de neuronas activas solo se cuantificó en el SON y el PVN, se tendrían que revisar otros núcleos relacionados con el circuito de la recompensa. Los registros se realizaron al inicio del periodo de luz, por lo que se sugiere indagar en otros periodos dentro del ciclo oscuro. El conteo se realizó el décimo día de acceso a la solución, por lo que podría realizarse en otros puntos de tiempo, antes y después. A futuro se espera indagar sobre otros sistemas de neurotransmisores que también se piensa están relacionados, por ejemplo, la 5-HT, la dopamina, el GABA y el glutamato.
Conclusión
El consumo de bebidas dulces entre las comidas interrumpió el estado de saciedad natural en el que estaban los animales. Los sujetos experimentales incrementaron el consumo de una solución de sacarosa al 20% en un ciclo en el que los roedores comen poco. El consumo de alimento de laboratorio disminuyó para compensar el consumo calórico, lo que aumenta el interés por conocer la participación de la Oxt y los mecanismos a través de los cuales actúa. La microestructura de la conducta alimentaria se caracterizó en el grupo Ad libitum, por la reducción de la latencia para iniciar el primer episodio de beber, incremento de la duración de los episodios y aumento de la tasa local de alimentación, esto sugiere que el incremento de la solución se debió a la demora del proceso de satisfacción. El grupo Restringido se presentó una reducción de la latencia y la disminución del tiempo entre episodios, esto alude a la interrupción del estado de saciedad. En ambos grupos se incrementó la actividad de las neuronas de Oxt pero en el grupo Ad libitum el nivel de Oxt aumentó en el PVN, en tanto que, en el grupo Restringido incrementó en el SON, probablemente las neuronas de Oxt responden a señales diferentes en cada núcleo, y que implican la participación de otros sistemas de neurotransmisores como la 5-HT. Nuestros resultados amplían el entendimiento de la influencia de las variables ambientales sobre el consumo de alimento, y cómo afecta el consumo de bebidas dulces entre comidas al patrón temporal de alimentación. Contribuyendo con la participación que tiene la oxitocina y su función en el desarrollo de la obesidad, y su potencial uso terapéutico para esta y otros trastornos de la conducta alimentaria.











 nueva página del texto (beta)
nueva página del texto (beta)


