Introducción
Los suelos del mundo tienen la capacidad de almacenar Carbono (1 500 Pg) en el primer metro de profundidad del suelo, tres veces más que la cantidad contenida en la vegetación terrestre (550 Pg) y el doble de lo existente en la atmósfera (750 Pg), por lo que desempeñan un papel clave en la mitigación del cambio climático (Veni et al., 2020). También, se estima que las existencias de Nitrógeno total (NT) del suelo varían entre 133 y 140 Pg en un mismo intervalo de profundidad (Batjes, 2014).
El Carbono (C) y el Nitrógeno (N) son indicadores importantes de la calidad de la materia orgánica del suelo debido a su capacidad de mejorar su estructura, la disponibilidad de nutrientes, la retención de agua y la actividad microbiana (Di Gerónimo et al., 2018). Específicamente, el C del suelo es un componente del ciclo global de dicho elemento; mientras que, la disponibilidad de N es la principal limitante en la productividad, ya que es un macronutriente que determina el crecimiento de la vegetación (Cerón y Aristizábal, 2012; Yuan y Chen, 2012).
El Nitrógeno forma parte de los residuos vegetales y animales depositados en el suelo, que pasan por un proceso de descomposición antes de estar disponible para las plantas, y sus existencias están sujetas a las condiciones ambientales y topográficas, prácticas de manejo y por el tipo de vegetación que define la calidad de la materia orgánica (Suárez et al., 2015; Cantú y Yáñez, 2018; Madrigal et al., 2019; Ayala-Montejo et al., 2020). En este sentido, uno de los índices empleados para determinar la calidad de la materia orgánica del suelo (MOS) es la relación C:N, indicador que refleja la velocidad de mineralización del Nitrógeno para la vegetación, relaciones altas indican que la MOS se descompone lentamente, ya que la reserva de Nitrógeno es inmovilizada por los microorganismos, por lo que no puede ser utilizado por las plantas; en cambio, relaciones entre 10 y 14 corresponden a una mineralización rápida que genera suficiente N para los microorganismos y para la vegetación (Gamarra et al., 2018).
Sin embargo, en las últimas décadas, se ha ejercido una mayor presión sobre los recursos forestales para satisfacer las necesidades humanas, lo cual ha provocado cambios en la ecología y biología del recurso suelo, que a su vez ha repercutido en la calidad de sus servicios ecosistémicos (producción de alimentos y biomasa, almacenamiento y filtración de agua, entre otros) (Murray y King, 2012; IPCC, 2014; Burbano-Orjuela, 2016).
Las prácticas de manejo forestal pueden afectar la estabilidad y el contenido de las reservas de Carbono y Nitrógeno del suelo, así como sus propiedades, derivado de las modificaciones en las condiciones ambientales, la estructura y composición de la vegetación (Zhou et al., 2015). Los cambios en las propiedades del suelo están influenciados por el grado de alteración del entorno del rodal, el cual se correlaciona con la intensidad y la corta de aprovechamiento (Jurgensen et al., 2012), lo que define principalmente la disponibilidad de nutrientes del suelo, la humedad y la temperatura edáficas, aportes de las capas de hojarasca, distribución de raíces y la comunidad microbiana (Slesak et al., 2011; Slesak, 2013; Wic et al., 2013; Mushinski et al., 2017). En particular, los aprovechamientos forestales con altas intensidades de corta modifican en gran medida la disponibilidad de la materia orgánica del suelo, ello incide sobre la productividad del sitio a lo largo del tiempo (Binkley y Fisher, 2013; Kurth et al., 2014; Achat et al., 2015).
Zhang et al. (2016) señalan que cualquier cambio de las propiedades edáficas afectará los niveles de Nitrógeno y Carbono. Las actividades relacionadas con el manejo forestal como trazos de caminos, tráfico de maquinaria pesada, tala, arrastre, apilamiento y carga, causan múltiples daños en el suelo, incluyendo incrementos de la densidad aparente, surgimiento de surcos, cambios en la dinámica del recurso hídrico en el suelo, aumento de la erosión y pérdida de nutrientes, y amenaza ante la presencia de infecciones fúngicas y cambios en el microclima, aspectos que, en general, alteran en gran medida los ciclos biogeoquímicos que se desarrollan en el suelo (Cambi et al., 2015; Islam et al., 2015, Luna-Robles et al., 2021).
En algunos estudios se ha demostrado que la respuesta del Nitrógeno en suelos bajo manejo forestal se considera como de dinámica alta, es decir, puede presentar pérdidas (Jones et al., 2011; Kellman et al., 2014), ganancias (Grand y Lavkulich, 2012) o ningún cambio, en función de la intensidad del aprovechamiento, tipo de vegetación y tipo de suelo. (Jerabkova et al., 2011; Scott et al., 2014). Nave et al. (2011) determinaron que después de 15 años de aplicación del tratamiento silvícola, las concentraciones totales de Carbono no presentan variaciones. Al respecto, Ruiz-Peinado et al. (2013) señalan que el Carbono se reduce considerablemente durante los primeros años (poscorta), con una tendencia de recuperación significativa en un período de 6 a 20 años después de la cosecha.
Según González-Rodríguez et al. (2019), la capa orgánica del suelo es una importante vía de nutrientes para los ecosistemas forestales, por lo que la ocurrencia de incendios forestales representa una amenaza potencial para el secuestro de Carbono por la biomasa y los recursos del suelo. Asimismo, Overby et al. (2002) citan que los incendios de alta severidad causan alta mortalidad en el estrato arbóreo, y las altas temperaturas (675 °C) consumen la mayor parte de la capa orgánica. Por otra parte, los incendios pueden ocasionar cambios en el ciclo de nutrientes y en la estructura del suelo (Wohlgemuth et al., 2006), por lo tanto, en el almacenamiento del carbono orgánico del suelo (COS) (North y Hurteau, 2011). Tales alteraciones se relacionan con la resiliencia de los ecosistemas ante los efectos de incendios forestales (Cadena-Zamudio et al., 2020).
Los suelos tipo Umbrisol se caracterizan por tener un alto contenido de materia orgánica dentro del primer metro de profundidad, y niveles de pH muy ácidos (<5.5), se distribuyen principalmente en áreas templadas o frías, muchos umbrisoles están cubiertos de vegetación natural o casi natural, y ocupan en todo el mundo alrededor de 100 millones de hectáreas (FAO, 2016). En México, estos suelos cubren menos de 3 % de la superficie del país, 2.91 % de la superficie del estado de Durango, y específicamente 3.3 % del municipio Pueblo Nuevo (INEGI, 2010; Inegi, 2017).
Con base en lo anterior, el objetivo fue determinar el reservorio de N y la relación C:N en dos profundidades de un Umbrisol, en tres rodales con cortas de regeneración como tratamientos de manejo silvícola (Matarrasa, Árboles Padre y Selección), y un área regenerada posincendio con una antigüedad de ocho años de intervención, además de un control denominado rodal de Referencia.
Materiales y Métodos
El estudio se llevó a cabo en bosques del ejido La Ciudad en el municipio Pueblo Nuevo, Durango, México. La vegetación está compuesta principalmente por Pinus duranguensis Martínez, P. cooperi C. E. Blanco, P. ayacahuite C. Ehrenb. ex Schltdl., Juniperus deppeana Steud. y Quercus sideroxila Bonpl. (González-Elizondo et al., 2012). La altitud media es de 2 583 m. El suelo dominante en la zona pertenece al tipo Umbrisol (Figura 1). La precipitación media anual es de 1 200 mm y la temperatura media anual de 18 ºC (INEGI, 2010).
Se evaluaron cinco rodales con distintas condiciones de manejo silvícola correspondientes a tres cortas de regeneración: Matarrasa, Árboles Padre y Selección, un área Posincendio regenerada en forma natural y un rodal denominado Referencia, considerado como tratamiento testigo o control, porque se asumió que representa el escenario original del suelo antes del manejo forestal y la ocurrencia del incendio (Cuadro 1). El tiempo promedio de los rodales después de ser intervenidos es de ochos años, lo mismo para el rodal Posincendio.
Cuadro 1 Descripción de los rodales y tratamientos silvícolas
| Rodal | Superficie (ha) | Descripción |
|---|---|---|
| Matarrasa (M) | 10.29 | Extracción total del arbolado, actualmente en
etapas de desarrollo entre brinzales y monte bravo. |
| Árboles Padre (AP) | 9 | Intensidad de corta del 80 %. Volumen inicial y posterior de 206.8 y 41.3 m3 ha-1. |
| Selección (S) | 20 | Intensidad de corta del 34 %. Volumen inicial y posterior de 223.8 y 147.4 m3 ha-1. |
| Posincendio (P-I) | 10 | Sin datos sobre la magnitud del incendio.
Recibió un pre-aclareo (año 2017) cuando tenía una densidad de 10 000 individuos ha-1. |
| Referencia (R) | 4.35 | Masa arbórea
más próxima a aplicarse corta de regeneración considerando que el turno forestal ronda los 60 años, volumen de 231 m3 ha-1. |
Muestreo del suelo
Con base en las características del suelo Umbrisol que incluyen un horizonte superficial profundo y contenidos altos de materia orgánica, en cada uno de los rodales se recolectaron ocho muestras compuestas de suelo (combinación de cuatro submuestras individuales, tomadas en el mismo rodal, para obtener aproximadamente 1 kg de suelo) a dos profundidades (cuatro de 0-20 cm y cuatro de 20-40 cm), para un total de 40 muestras (Cantú y Yáñez, 2018), las cuales se llevaron al laboratorio de suelos de la Facultad de Ciencias Forestales en la Universidad Autónoma de Nuevo León, donde se secaron al aire, se cribaron pasándolas por un tamiz con apertura de malla de 2 mm y se almacenaron para su posterior análisis químico.
Determinación del Nitrógeno total y Carbono orgánico del suelo (COS) (%)
El contenido de Nitrógeno total del suelo se determinó con el método Kjeldahl, con un equipo destilador-titulador Velp Scientifica modelo UDK159, con base en Mamani et al. (2020). El COS se determinó a partir del contenido de la materia orgánica con el método Walkley y Black modificado (Cantú y Yáñez, 2018), en el cual el suelo se oxida con una solución estandarizada de dicromato de potasio; con el índice de Van Bemmelen se estimó el Carbono orgánico asumiendo que la materia orgánica posee 58 % de Carbono.
Determinación de la reserva de Nitrógeno en el suelo
En el Cuadro 2 se presentan los valores de la densidad aparente (g cm-3) del suelo de los diferentes rodales analizados, determinada a partir del método gravimétrico (Luna et al., 2021). Para calcular la reserva de Nitrógeno en Mg ha-1 se utilizó la siguiente relación (Madrigal et al., 2019):
Donde:
CN = Cantidad de Nitrógeno en el suelo (Mg ha-1)
N.T. = Porcentaje de Nitrógeno total
DA = Densidad aparente (g cm-3)
P = Profundidad de muestreo (cm)
Determinación de la relación C:N
La relación C:N se calculó a partir de los porcentajes de Carbono y Nitrógeno de las muestras de suelo para ambos intervalos de profundidad. En este caso, el resultado de la división es directamente proporcional a la disponibilidad de Nitrógeno respecto a Carbono, tal relación proporciona una estimación del grado de descomposición de la materia orgánica del suelo (Kirkby et al., 2011; Castro et al., 2019); particularmente, proporciones altas indicarían una baja disponibilidad de Nitrógeno en el suelo (Cantú y Yáñez, 2018).
Donde:
C.O. = Carbono orgánico (%)
N.T. = Nitrógeno total (%)
Análisis estadístico
Para las variables Nitrógeno total (%), Carbono (%), relación C:N y reserva de Nitrógeno (Mg ha-1), se aplicaron pruebas de normalidad de Kolmogorov-Smirnov y la de homogeneidad de varianzas de Levene (Rubio y Berlanga, 2012).
Con el fin de identificar diferencias estadísticas significativas (P≤0.05), se aplicó la prueba de Kruskal-Wallis (KW) con corrección de Bonferroni asumiendo no normalidad (Berlanga y Rubio, 2012) para ambas profundidades de suelo. El análisis se hizo con el paquete estadístico SPSS versión 22 (International Business Machines, 2013).
Resultados
El contenido de N para la profundidad de 0-20 cm varió entre 0.28 y 0.46 %; los rodales de Árboles Padre y Selección fueron el de mayor y menor porcentaje, respectivamente. Para el segundo intervalo de profundidad (20-40 cm) fluctuó entre 0.11 y 0.27 %, los rodales de Referencia y Matarrasa, representaron las áreas de menor y más contenido (Cuadro 3).
Cuadro 3 Valoresmedios de las variables analizadas por intervalo de profundidad.
| Tratamiento | Intervalo de profundidad del suelo | |||||
|---|---|---|---|---|---|---|
| 0-20 cm | 20-40 cm | |||||
| NT (%) | CO (%) | C:N | NT (%) | CO (%) | C:N | |
| Matarrasa | 0.30 | 6.10 | 18.58 | 0.26 | 5.7 | 21.05 |
| (0.30-0.31) | (5.62-6.40) | (17.9-19.5) | (0.25-0.27) | (5-6.4) | (18.3-21.4) | |
| Árboles Padre | 0.46 | 8.58 | 18.8 | 0.18 | 2.63 | 14.5 |
| (0.44-0.47) | (8.25-9.11) | (17.6-20) | (0.17-0.18) | (2.25-3.18) | (13.1-16.9) | |
| Selección | 0.28 | 6.63 | 24.7 | 0.18 | 6.63 | 20.0 |
| (0.18-0.31) | (5.92-7.90) | (19.1-34.4) | (0.16-0.20) | (3.19-4.36) | (18.5-21.9) | |
| Posincendio | 0.43 | 7.92 | 18.3 | 0.25 | 4.52 | 19.0 |
| (0.36-0.45) | (7.40-8.50) | (17.1-20.1) | (0.17-0.28) | (3.58-5-30) | (15.9 a 20.4) | |
| Testigo | 0.31 | 6.57 | 21.4 | 0.11 | 2.91 | 28.3 |
| (0.30-0.32) | (6.07-7.36) | (20-22.9) | (0.09-0.12) | (2.72-3.20) | (24.8-31.5) | |
El Carbono orgánico para la primera profundidad de suelo (0-20 cm) osciló entre 6.10 y 8.58 % con el siguiente orden entre los rodales analizados: Árboles Padre > Posincendio > Selección > Referencia > Matarrasa. Para la profundidad de 20-40 cm, los registros de Carbono correspondieron al intervalo de 2.64 y 5.72 %, en el cual Árboles Padre y Matarrasa fueron las áreas con menor y mayor contenido de Carbono. El promedio de la relación C:N del suelo en ambas profundidades fue de 20.4. Los tratamientos Posincendio y Árboles Padre tuvieron la más baja relación C:N en ambas profundidades de suelo. El manejo silvícola mediante corta de Selección y el rodal de Referencia presentaron una alta relación C:N, respecto a los demás rodales analizados para la profundidad de 0-20 cm; mientras que para la profundidad 20-40 cm fueron los de Referencia y Matarrasa (Cuadro 3).
Particularmente, se determinó una disminución del Nitrógeno y Carbono conforme aumentó la profundidad del suelo en todos los rodales analizados (Figura 2).
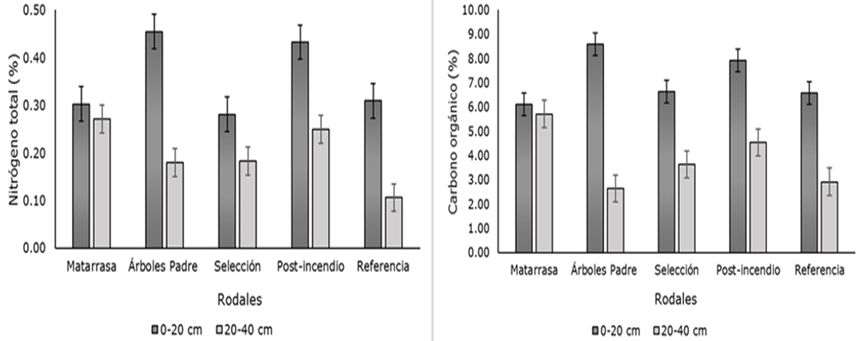
Figura 2 Valores medios del contenido de a) Nitrógeno total y b) Carbono orgánico por intervalo de profundidad.
Reservorio de Nitrógeno en el suelo
La reserva de Nitrógeno en el suelo Umbrisol para la profundidad 0-20 cm en los tratamientos silvícolas Matarrasa, Árboles Padre e Incendio forestal presentó incrementos en la reserva de N de 35.65 %, 84.48 % y 40.92 % respectivamente, en comparación con el rodal de Referencia (3.56 Mg ha-1), mientras que el tratamiento Selección registró la menor reserva de Nitrógeno en los primeros 20 cm (2.95 Mg ha-1).
Para la profundidad 20-40 cm, el Nitrógeno se redujo en todos los rodales, a excepción de el de Selección, el cual registró un ligero aumento respecto a la primera profundidad, sin embargo, los cuatro rodales mostraron valores por encima del rodal de Referencia (1.47 Mg ha-1) (Figura 3). Al considerar todo el perfil de 0-40 cm, la reserva de Nitrógeno presentó el siguiente orden descendente: Árboles Padre (9.63 Mg ha-1) > Matarrasa (8.99 Mg ha-1) > Posincendio (8.21 Mg ha-1) > Selección (5.95 Mg ha-1) > Referencia (5.03 Mg ha-1).
Los resultados de las variables Nitrógeno total (%), Carbono (%), relación C:N y reserva de Nitrógeno (Mg ha-1) evidenciaron diferencias estadísticas significativas para todas las variables (Cuadro 4).
Cuadro 4 Resultados de la prueba de Kruskal-Wallis para la comparación entre rodales para ambos intervalos de profundidad.
| Estadísticos prueba KW | Carbono | Nitrógeno | C:N | N (Mg h-1) |
|---|---|---|---|---|
| n (0-20 cm) | 20 | 20 | 20 | 20 |
| Grados de libertad | 4 | 4 | 4 | 4 |
| Chi cuadrada | 14.80 | 14.50 | 12.10 | 11.92 |
| Significancia | 0.005* | 0.006* | 0.018* | 0.030* |
| n (20-40 cm) | 20 | 20 | 20 | 20 |
| Grados de libertad | 4 | 4 | 4 | 4 |
| Chi cuadrada | 17.30 | 15.79 | 15.42 | 16.41 |
| Significancia | 0.002* | 0.002* | 0.003* | 0.002* |
* Representa diferencias significativas (P≤0.05).
Las comparaciones múltiples con la prueba post hoc de Kruskal-Wallis y corrección de Bonferroni, detectaron diferencias significativas para las variables en ambas profundidades. Para la de 0-20 cm, no hubo diferencias significativas en Nitrógeno total entre los rodales para el contenido de Carbono orgánico, únicamente los pares de Matarrasa-Árboles Padre obtuvieron diferencias, la variable C:N tuvo solo una comparación significativa (Posincendio-Selección) y la reserva de Nitrógeno registró diferencias entre Selección-Árboles Padre y Referencia-Árboles Padre.
Para el segundo intervalo de profundidad (20-40 cm), las comparaciones de pares de Matarrasa-Referencia y Referencia-Posincendio fueron significativas para el Nitrógeno total; para el Carbono orgánico, Matarrasa-Referencia y Matarrasa-Árboles Padre, la relación C:N con el par Referencia-Árboles Padre; y para la reserva de Nitrógeno, solo se presentaron diferencias entre Matarrasa-Referencia (Cuadro 5).
Cuadro 5 Prueba post hoc de Kruskal-Wallis con corrección de Bonferroni para las variables analizadas.
| Comparaciones por pareja | Nitrógeno total (%) | Carbono orgánico (%) | C:N | Reserva Nitrógeno (Mg ha-1) | ||||
|---|---|---|---|---|---|---|---|---|
| 0-20 cm | 20-40 cm | 0-20 cm | 20-40 cm | 0-20 cm | 20-40 cm | 0-20 cm | 20-40 cm | |
| Matarrasa-Selección | 1.000 | 1.000 | 1.000 | 0.727 | 1.000 | 1.000 | 0.422 | 0.486 |
| Matarrasa-Posincendio | 1.000 | 1.000 | 0.155 | 1.000 | 0.943 | 1.000 | 1.000 | 0.730 |
| Matarrasa-Referencia | 0.214 | 0.008* | 1.000 | 0.021* | 1.000 | 1.000 | 1.000 | 0.001* |
| Matarrasa-Árboles Padre | 0.111 | 0.728 | 0.009* | 0.003* | 1.000 | 0.102 | 1.000 | 0.486 |
| Selección-Referencia | 1.000 | 0.828 | 1.000 | 1.000 | 1.000 | 0.558 | 1.000 | 0.639 |
| Selección-Posincendio | 0.231 | 1.000 | 1.000 | 1.000 | 0.050* | 1.000 | 0.168 | 1.000 |
| Selección-Árboles Padre | 0.120 | 1.000 | 0.101 | 0.680 | 0.314 | 0.639 | 0.003* | 1.000 |
| Referencia-Árboles Padre | 0.250 | 1.000 | 0.131 | 1.000 | 0.486 | 0.002* | 0.023* | 0.639 |
| Referencia-Posincendio | 0.131 | 0.034* | 1.000 | 0.450 | 0.086 | 0.072 | 0.730 | 0.422 |
| Posincendio-Árboles Padre | 1.000 | 1.000 | 1.000 | 0.110 | 1.000 | 1.000 | 1.000 | 1.000 |
* Diferencias significativas con nivel de significancia de α=0.05.
Discusión
De acuerdo a la valoración de la NOM-021-RECNAT-2000 (Semarnat, 2002), los contenidos del Nitrógeno total (%) para el suelo son muy altos, atribuidos principalmente a las propiedades del Umbrisol que posee niveles de pH ácidos inferiores a 5.5 y altos contenidos de materia orgánica, con características muy recalcitrantes (resina, lignina y celulosa) (FAO, 2015), que en conjunto favorecen el establecimiento de hongos micorrícicos, los cuales en suelos forestales son más resistentes a pH ácidos que las bacterias nitrificadoras (Paul, 2015; Kamble y Bååth, 2016; Zhang et al., 2016). Además, son los encargados de llevar acabo los procesos de transformación de las proteínas de la materia orgánica a sustancias nitrificadas (Havlin et al., 1999).
Particularmente, los contenidos de Carbono orgánico y Nitrógeno total presentaron variabilidad entre los rodales sujetos a cortas de regeneración y el área regenerada Posincendio con el rodal de Referencia para ambas profundidades. Lo anterior coincide con Amundson et al. (2003), Thiffault et al. (2011), Achat et al. (2015) y Mushinski et al. (2017), quienes señalan que a posteriori de las cortas de regeneración e incendio, suelen presentarse y acelerarse diferentes transformaciones biogeoquímicas en el suelo, tales como la mineralización, humificación, desnitrificación, etc., y que pueden intervenir en existencias alteradas de Nitrógeno (ganancias o pérdidas). Según Steubing (2002), las cortas de regeneración e incendio modifican la cobertura del suelo y la estructura de la vegetación, porque intervienen sobre diversos factores abióticos como la humedad del suelo, viento, radiación, intercepción y temperatura, cuyo efecto combinado finalmente determina los balances de C, N y C:N del suelo.
Los hallazgos del presente estudio permiten inferir que después de ocho años de la intervención silvícola y ocurrencia del incendio forestal, la capacidad del reservorio de Nitrógeno del Umbrisol se incrementó en la profundidad 0-40 cm, lo que coincide con la respuesta del reservorio de Carbono para estos mismos rodales, el cual presentó un secuestro promedio de 149.89 Mg ha−1 posterior a las cortas e incendio forestal (Luna et al., 2022).
De acuerdo a lo anterior, las cortas de Matarrasa y Árboles Padre provocaron aumentos de 79 y 91 % en el reservorio de Nitrógeno respecto al rodal de Referencia. Tales tratamientos modificaron las condiciones bióticas y abióticas que definen la dinámica del Nitrógeno, por ejemplo, las tasas de incorporación de material orgánico al suelo (raíces, ramas, hojas) y la actividad de microrganismos sintetizadores de Nitrógeno. Así mismo, la apertura de los doseles favoreció el establecimiento de pastos y arbustos con tasas de descomposición más altas que la vegetación arbórea (Thiffault et al., 2011; Zehetgruber et al., 2017).
Lo anterior contrasta con lo citado en otros estudios sobre aprovechamientos forestales intensivos similares, en los que se han determinado concentraciones bajas de Nitrógeno en rodales después de una década de ser intervenidos (Achat et al., 2015; Foote et al., 2015; Mushinski et al., 2017).
La ocurrencia del incendio forestal influyó significativamente sobre el contenido de Nitrógeno total en los dos intervalos de profundidad del suelo. Se estimaron porcentajes superiores al de todos los rodales, a excepción de la segunda profundidad en el rodal con Matarrasa, resultados que concuerdan con lo registrado por Johnson y Curtis (2001) y de la Rosa et al. (2014), quienes documentan que un incendio forestal aumenta la cantidad y tasa de degradación de la MOS. Los autores agregan que el Nitrógeno total puede resultar en ganancias posteriores debido a la incorporación de residuos no quemados que incluyen el carbón vegetal, materia orgánica hidrófoba y el establecimiento de vegetación de rápido crecimiento posincendio, principalmente herbáceas y arbustivas.
Covington y Sackett (1992) y Certini (2005) señalan que en la parte superficial del suelo, el amonio es la principal forma inorgánica de Nitrógeno que se origina durante el incendio; después de semanas o meses, se forma el nitrato a partir del amonio; la nitrificación es inmediata si existen las bacterias nitrificadoras (Nitrosomonas y Nitrobacter), lo cual en el presente estudio es posible que ocurriese en menor grado debido al pH acido del Umbrisol que inhibió la actividad bacteriana, y con ello disminuyó la disponibilidad de nitrógeno, y en consecuencia, se pudo presentar una lixiviación de nitratos.
Para la profundidad del suelo de 20-40 cm, se determinó que la reserva de Nitrógeno disminuyó de manera considerable para todos los rodales; esto coincide con Madrigal et al. (2019), quienes en bosques de oyamel, pino y pino-aile cuantificaron decrementos conforme aumentó la profundidad, aspecto que se vincula principalmente con la disminución de la cantidad de materia orgánica, así como con procesos como la asimilación por parte de la vegetación en los primeros centímetros, la lixiviación y volatilización del Nitrógeno.
Según Porta et al. (2014), para indicar que la materia orgánica está en un estado dinámico (mineralización), la relación C:N debe corresponder a un intervalo de 10 a 14. Galicia et al. (2016) definen que en bosques de pino-encino, se consideran óptimas las relaciones C:N cuando varíen entre 24 y 47. Los valores del presente estudio están en una relación promedio de 20.4 para ambas profundidades, lo cual indica que la tasa de la mineralización para el Umbrisol está ligeramente por encima de las condiciones óptimas.
Conclusiones
Las cortas de regeneración y la ocurrencia del incendio forestal contribuyen, ocho años después de su aplicación, a incrementar el reservorio de Nitrógeno en el suelo en comparación con el rodal de Referencia, por lo que las prácticas forestales aplicadas favorecen a la sustentabilidad del Umbrisol. Particularmente, las cortas de Matarrasa y Árboles Padre registran diferencias con el rodal de Referencia; estos tratamientos silvícolas, por su característica propia del manejo, aumentan la incorporación de material orgánico al suelo (raíces, ramas, hojas), provocando incrementos de 79 a 91 % en el reservorio de N. La relación C:N promedio del suelo Umbrisol (20.4) está por abajo de los intervalos óptimos de C:N (24-47) para bosques de pino-encino.
Los resultados permitirán establecer criterios pre y posmanejo forestal, tales como la planeación de tratamientos complementarios de manejo silvícola con énfasis en aclareos, limpias, podas, quemas controladas, preparación del sitio, manejo de residuos de cortas, entre otras, para conservar y mejorar las variables del suelo: C, N y C:N.











 texto en
texto en 




