Introducción
Las “moscas sierra” de las coníferas (Hymenoptera: Diprionidae) son insectos que ocasionan defoliación en árboles de los géneros Pinus L., Juniperus L., Cupressus L., Abies Mill., Larix Mill. y Pseudotsuga Carrière en bosques de clima templado (Smith, 1988; 1993). Esta familia comprende dos subfamilias: Diprioninae y Monocteninae; la primera ataca Pinus, mientras que la segunda se ha citado asociada con Juniperus y Cupressus e incluye al género Monoctenus Dahlbom 1835, del cual se conocen doce especies: tres en Europa, cinco en Japón y cuatro de América del Norte (Taeger y Blank, 2008).
En México, hasta 1974, se tenía el registro de M. sadadus Smith en Durango y Veracruz (Smith, 1974). Posteriormente en 2007, en la Sierra de Álvarez en Armadillo de los Infante, San Luis Potosí (22°11´53´´ N; 100°37´03´´ O; 1 840 msnm) se registraron 20 ha de cedro blanco afectadas por Monoctenus sp., infestación que se incrementó a 200 ha en 2008. En 2010, se determinó que correspondía a una nueva especie identificada como M. sanchezi Smith (Smith et al., 2010).
En Ixcateopan de Cuauhtémoc, Guerrero (18°32´5.56´´ N; 99°47´15.6´´ O, 1 741 msnm) durante 2017 se detectó a Monoctenus sp., en 460 ha de cedro blanco (J. flaccida). Sin embargo, al comparar los adultos obtenidos en esa localidad con los de San Luis Potosí, se observaron diferencias morfológicas externas, al igual que con M. sadadus. Además, M. sanchezi y la especie en estudio difirieron también en la fenología.
De acuerdo con Smith et al. (2010), los adultos de M. sanchezi se presentan de junio hasta finales de julio y las larvas ocurren de julio a noviembre; mientras que los cocones, que construyen las larvas para puparse, se observan de noviembre a diciembre y la pupación ocurre en junio. En este estudio se presenta la fenología y la descripción de una nueva especie de Monoctenus procedente de Ixcateopan de Cuauhtémoc, Guerrero, México.
Materiales y Métodos
Área de estudio de la fenología y recolecta de material biológico
El monitoreo de la fenología se inició en enero de 2017 y se continuó hasta septiembre de 2019 en La Barranca, Ixcateopan de Cuauhtémoc, Guerrero (18°32´5.56´´ N; 99°47´15.6´´ O, 1 741 msnm), para determinar cuándo ocurren los diferentes estadios de desarrollo de Monoctenus en J. flaccida.
Se realizaron visitas quincenales en diez puntos dentro de La Barranca, en las que se consignó la presencia de adultos machos y hembras diferenciados por dimorfismo sexual (presencia de antenas bipectinadas en los machos); además, se revisó el follaje de los cedros para determinar la existencia de larvas y se removió el suelo para la búsqueda de cocones activos (presencia de larvas verdes y pupas) e inactivos (con orificios de emergencia de adultos de mosca sierra, dañados por parasitoides, entomopatógenos o roedores). Cabe mencionar que no se observaron huevecillos, ya que es difícil determinar su presencia en campo (González y Sánchez, 2018).
Se recolectaron larvas (8 de septiembre de 2017) en el follaje de los cedros blancos y cocones del suelo de árboles afectados (25 de enero de 2018 y 29 mayo de 2019). Ambos fueron confinados en botes de plástico de 4.0 L y trasladados en hieleras al Laboratorio de Sanidad Forestal y Agrícola del Campo Experimental Pabellón (Cepab), INIFAP, en Pabellón de Arteaga, Aguascalientes. Las larvas fueron alimentadas con follaje del hospedero natural. Los capullos obtenidos de la cría de larvas o recolectados del suelo, se colocaron dentro de frascos de plástico de 250 mL con tapa de organza y se introdujeron a una cámara Binder 720 KBW E5.1 con temperatura controlada de 26 ±2 ºC, con un fotoperiodo de 14:10 horas luz y oscuridad, respectivamente. Dos veces a la semana, los capullos se rociaron con agua mediante un aspersor manual de 1.0 L para evitar la deshidratación. La emergencia de los adultos o parasitoides se monitoreó tres veces por semana.
Adicionalmente, el 15 de agosto de 2019 se recolectaron larvas en Llano Grande, Xichú, Guanajuato (21°16´9.9´´ N; 100°03´13.0´´ O, 2 100 msnm), localidad donde se informó al enlace de Sanidad de la Comisión Nacional Forestal (Conafor) la presencia de moscas sierra afectando 150 ha de J. flaccida, desde noviembre de 2017.
Grupos de larvas, tanto de Ixcateopan de Cuauhtémoc como de Xichú, se sumergieron en agua caliente a 70 °C por tres minutos, y después se fijaron en alcohol al 70 % (González et al., 2014) para realizar la descripción morfológica y fotografiarlas con una cámara de celular a través del objetivo de un microscopio de disección Motic a una amplificación de 40X. Las características, para la diferenciación de los especímenes a nivel larvario se basó en las publicaciones de Ross (1955 , Yuasa (1922), Wong y Szlabey (1986) y González et al. (2014).
Para la identificación morfológica de los adultos emergidos en el Cepab, se consideraron las descripciones de los adultos de Monoctenus spp. de Smith et al. (2010) y la terminología de Goulet (1992). La lanceta del ovipositor de las hembras se extrajo después de un proceso de maceración en frío. El abdomen se separó del cuerpo y se introdujo a un tubo Eppendorf de 4 mL con KOH al 10 % por 24 h. Al término de la maceración, el abdomen se enjuagó con agua destilada, se deshidrató en alcohol al 70 % y se realizaron montajes temporales en glicerina. Con un microscopio compuesto Motic BA 200, se fotografiaron las estructuras y en forma complementaria se obtuvo una fotografía de la lanceta en un microscopio electrónico de barrido, SEM (EVO MA15, Zeiss). No se realizaron montajes de la genitalia de machos debido a que no hubo ejemplares para la extracción.
Un grupo de cinco larvas de Monoctenus sp. de Ixcateopan de Cuauhtémoc, Guerrero y dos larvas de M. sanchezi recolectadas en Armadillo de los Infante, San Luis Potosí conservadas en alcohol al 70% y seis adultos hembras de M. sanchezi de Armadillo de los Infante, San Luis Potosí con fecha de emergencia 19 de junio de 2012, y cinco hembras de Monoctenus sp. de Ixcateopan de Cuauhtémoc, Guerrero, con fecha de emergencia 8 de octubre de 2018, se enviaron al Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales (Cenid-Comef) en la ciudad de México para su identificación molecular.
Los ejemplares en alcohol al 70 % se lavaron tres veces con agua destilada estéril y se colocaron en tubos Eppendorf de 1.5 mL, se agregó nitrógeno líquido para su maceración y se adicionaron 500 μL de buffer de lisis. El tubo se dejó reposar a temperatura ambiente durante 30 minutos, para centrifugar por 1.0 min a 12 000 rpm; se recuperó el sobrenadante en un nuevo tubo, al cual se le adicionaron 300 μL de fenol:cloroformo 1:1, se colocó en el vortex durante un minuto y se centrifugó a 12 000 rpm durante 3 min. Se transfirió el sobrenadante a otro tubo y se agregaron 200 μL de fenol:cloroformo 1:1. El sobrenadante se pasó a un tubo nuevo y se adicionaron 300 μL isopropanol y 30 μL de acetato de amonio, se mezclaron ligeramente y se centrifugó durante 5 min a 12 000 rpm; el sobrenadante se decantó y la pastilla se lavó con 50 μL de etanol al 70 %. El precipitado se secó a temperatura ambiente y la pastilla se resuspendió en 50 μL de agua libre de nucleasas. La calidad del ADN se midió en un NanoDrop 2000 (Thermo Scientific). El producto se conservó a una temperatura de ± 4 °C.
Se utilizaron los primers universales LCO1490 (5´-GGTCAACAAATCATAAAGATATTGG-3´) y HCO2198 (5´TAAACTTCAGGGTGACCAAAAAATCA-3´) (Folmer et al., 1994) para la amplificación de regiones del ADN ribosomal, los cuales reconocen al gen Citocromo Oxidasa, Subunidad I (COI). Las reacciones de PCR se realizaron por medio de la adición de los reactivos: Buffer PCR (5x: 5.0 µL concentración: cantidad, respectivamente), MgCl2 (25mm: 0.75 µL), dNTP (10mm: 0.25 µL), Primer 1 (10 nmol: 1.0 µL), Primer 2 (10 nmol: 1.0 µL), DNA Taq polimerasa (5u µL-1: 0.5 µL), DNA blanco (20 ng µL-1: 3.0 µL) y 13.5 µL de agua grado PCR.
La amplificación se realizó en un termociclador T100 de la marca Biorad usando el siguiente programa: 1) desnaturalización inicial 1 ciclo de 3.0 min a 95 °C; 2) desnaturalización 1.0 min a 95 °C; 3) alineamiento 5 ciclos de 30 s a 51 °C; 4) extensión 1.0 min a 70 °C; 5) desnaturalización 1.0 min a 94 °C; 6) alineamiento 35 ciclos de 30 s a 51 °C; 7) extensión 1.0 min a 72 °C; 8) extensión final 1 ciclo de 5.0 min a 72 °C; y 9) Conservación a 4.0 °C. Los fragmentos amplificados se corrieron en geles de agarosa al 1 %, con 0.4 μL de bromuro de etidio y se visualizaron en un fotodocumentador Infinitity-ST5 Vilber Lourmat.
La banda de interés se cortó para su purificación con el kit WIZARD ® SV Gel and PCR Clean-Up System, siguiendo el protocolo del proveedor (Promega Corporation, 1999). Se adicionaron 50 µL de la solución 1 al gel de agarosa conservado en tubos Eppendorf, se disolvió a 65 °C. Se transfirió el mix del gel diluido a una minicolumna insertada en un tubo colector y se incubó a temperatura ambiente por 1.0 min; enseguida, se centrifugó a 14 000 rpm durante 1.0 min, y el sobrenadante del tubo colector se decantó. Posteriormente, se realizaron dos lavados con 700 µL de la solución 2 y se centrifugó a 14 000 rpm por 3.0 min y el sobrenadante del tubo colector, se decantó y se transfirió la minicolumna a un tubo Eppendorf estéril y se dejó secar a temperatura ambiente. Se adicionaron 50 µL de agua libre de nucleasas, se incubó a temperatura ambiente por 5.0 min y se centrifugó a 14 000 rpm durante 1.0 min; se desechó la minicolumna, el producto se conservó a 4 °C. Los productos de PCR purificados se enviaron a secuenciar a Macrogen Korea en Seúl, República de Corea.
Las secuencias se ensamblaron en el módulo SeqMan Pro del programa DNASTAR Lasergene Molecular Biology 16, cada ensamble se sometió a un análisis de homología BLAST (Basic Local Alignment Search Tool) contra la base de datos de nucleótidos del National Center of Biotechnology Information (https://blast.ncbi.nlm.nih.gov/Blast.cgi), además se analizaron en la base BOLD SYSTEMS.
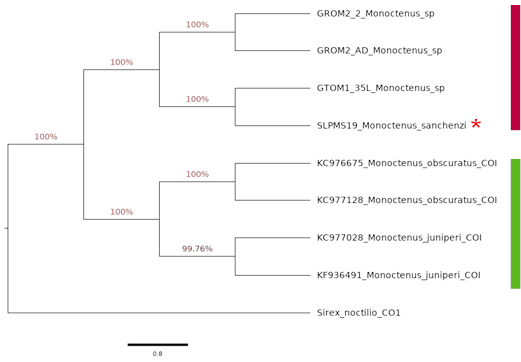
Se realizó un análisis filogenético para el género Monoctenus, en el cual se incluyeron los ensambles de la secuenciación de los ejemplares de las recolectas y las bases de datos de referencia resultado de la búsqueda en el Gen Bank. Las secuencias se alinearon con el método Clustal, con el programa CLUSTAL OMEGA 1.2.2 (Sievers y Higgins, 2014) y se hizo la búsqueda del mejor modelo de sustitución de nucleótidos con el programa ModelTest-NG (Darriba et al., 2019). La reconstrucción filogenética se efectuó con inferencia bayesiana mediante Markov Chains Monte Carlo (MCMC), implementado en el programa BEAST v1.10.4 (Suchard et al., 2018) con 1 000 000 de generaciones. Cabe mencionar que se utilizó como testigo fuera de grupo la secuencia HM114320 del GenBank correspondiente a Sirex noctilio Fabricius, 1793 (Hymenoptera: Siricidae).
Resultados y Discusión
Monoctenus cuauhtemoci n. sp. De Lira, 2021
Distribución. México, Ixcateopan de Cuauhtémoc, Guerrero; 18°3’26.06’’ N; 99°47’19.4’’ O, 2 136 msnm.
Hospedero. Cedro blanco Juniperus flaccida Schltdl. que crece en la sierra de Cuauhtémoc, Guerrero. Se regitraron 460 ha afectadas en 2017 y para el 2020 la afectación se incrementó a 4 320 ha.
Datos de la fenología y enemigos naturales están disponibles en De Lira-Ramos et al. (2019) y González et al. (2019).
Etimología. En honor al último emperador azteca, originario del municipio de Ixcateopan, donde se presentó el ataque de esta especie de Monoctenus, y la sierra donde se ubican las infestaciones es conocida como la sierra de Cuauhtémoc.
Material Tipo. Holotipo. Hembra montada en seco, etiquetada como México, Ixcateopan de Cuauhtémoc, Guerrero. “La Barranca” 18°3’26.06’’ N; 99°47’19.4’’ O, 2 136 msnm; Colector E. González, G. del 8 de octubre de 2018 (Figuras 1A a la 1D). Macho montado en seco, mismos datos (Figura 2). Depositados en la colección de Insectos Forestales del Cenid-Comef, INIFAP, Viveros de Coyoacán, Ciudad de México.

Fotografías tomadas a 2X (A, B y C) y 4X (D).
Figura 1 Hembra de Monoctenus cuauhtemoci n. sp. De Lira, 2021 que ataca Juniperus flaccida Schltdl. en Ixcateopan de Cuauhtémoc, Guerrero, México. Dorsal (A), ventral (B), lateral (C); cabeza (D).

Microfotografías tomadas a 10X (A y C) y 40X (B y D). Montaje en glicerina.
Figura 2 Lanceta del ovipositor de la hembra de Monoctenus cuauhtemoci n. sp. De Lira, 2021; lanceta completa (A) y acercamiento del ápice (B) y Monoctenus sanchezi; lanceta completa (C) y acercamiento del ápice (D).
Paratipos. Tres hembras con los mismos datos de recolecta. Depositados en la colección de insectos forestales del Cepab, dependiente del INIFAP. km 32.5 carr. Aguascalientes-Zacatecas, Pabellón de Arteaga, Aguascalientes, México.
Larvas. Colección de larvas de moscas sierra preservadas en alcohol 70 % con etiqueta GROM2. Centro de Formación Forestal (Cefofor) dependiente de la Conafor. Ciudad Guzmán, Jalisco, México; y colección de larvas de moscas sierra en alcohol 70 % con etiqueta GROM2 del Cepab, dependiente del INIFAP. km 32.5 carr. Aguascalientes-Zacatecas. Pabellón de Arteaga, Aguascalientes, México.
Descripción. Hembra, la mayor parte del cuerpo es de coloración negra; parte de la cabeza, así como los segmentos pro y mesotoráxicos de color naranja (Figura 1A ), antenas negras formadas por 15 antenómeros, del 2 a 9 presentan los ramis grandes, pero no llegan a dos veces la longitud de la base como en M. sadadus (Figura 1C). El escapo no más largo que ancho y el tercer segmento antenal más de dos veces el largo que el ancho. El área ocelar presenta una mancha negra que se une con dos manchas semicirculares que alcanzan la porción interna media y superior de las órbitas internas de los ojos compuestos, abarcando los sockets antenales (Figura 1D). A los costados externos de los sockets antenales presenta un área naranja que interrumpe la mancha a los costados de los sockets y en la porción inferior interna de los ojos compuestos, clípeo y labro. El prescutum, tégula y lóbulos medio y laterales del mesoescutum de coloración naranja, mesopleura negra. Patas negras con el ápice del fémur y base de la tibia más claros en las patas medias y posteriores (Figura 1B). En las patas delanteras, la tibia es café amarillento en su totalidad y el fémur presenta el tercio apical amarillento. Alas oscurecidas con pardo claro desde la base a la mitad del ala, resto hialinas; estigma y venas pardo oscuro. Abdomen en vista dorsal es negro brillante, mientras que en forma lateral solo el primer segmento presenta una porción clara que rodea el espiráculo (Figuras 1A y 1B).
En las lancetas del ovipositor de las hembras de M. cuauhtemoci n. sp. y M. sanchezi se observan diferencias (Figura 2A y 2C), ambas especies presentan nueve anillos y tienen los dientes basales en los dos primeros redondeados, pero los anillos 3-6 en M. sanchezi se observan curveados por la mayor preponderancia del diente basal, mientras que en M. cuauhtemoci n. sp. son más rectos. Los anillos 7-9 en la punta de la lanceta en ambos se presenta el diente basal en proyección hacia adelante y atrás, el número de dientes en el anillo 9 en M. cuauhtemoci n. sp. presenta cinco dientes bien definidos y en M. sanchezi no están marcados (Figuras 2B y 2D).
Machos (Figura 3) longitud de 8 mm, completamente obscuro. Cabeza negra con setas amarillas, labro, mandíbulas y palpos café obscuro. Antenas negras con 22 antenómeros, con ramis pequeños del segundo hasta el último antenómero. Las patas delanteras con la coxa, trocánter y fémur café oscuro, y con la tibia café amarillento. El segundo par de patas con la coxa, trocánter y fémur café oscuro y la tibia café oscuro en la parte media con la parte basal y anterior café amarillento. El tercer par de patas con la coxa, trocánter y fémur café oscuro, tibia y el primer tarsómero café claro en la parte anterior y café oscuro en la parte basal. Tégula café oscuro casi negro. Lóbulo medio y lateral del mesoscutelum es negro sin manchas.
Bajo condiciones de campo, los adultos se observaron del 18 de julio al 24 de agosto (Figura 4), disminuyeron su presencia hasta el 4 de septiembre, esto representa un mes más tarde de lo consignado para M. sanchezi en San Luis Potosí. En total, se observaron 187 hembras y solo dos machos, lo cual coincide con los datos de San Luis Potosí, donde se observó una baja presencia de machos. Con la disección de los cocones se determinó que el cambio de larvas a pupas ocurrió desde el 27 de abril, con la mayor presencia del 27 de julio al 10 de agosto, lo que coincide con la emergencia de adultos y con la disminución de las larvas verdes (diapáusicas) en los cocones, esto representa dos meses antes de lo registrado para M. sanchezi (Smith et al., 2010).
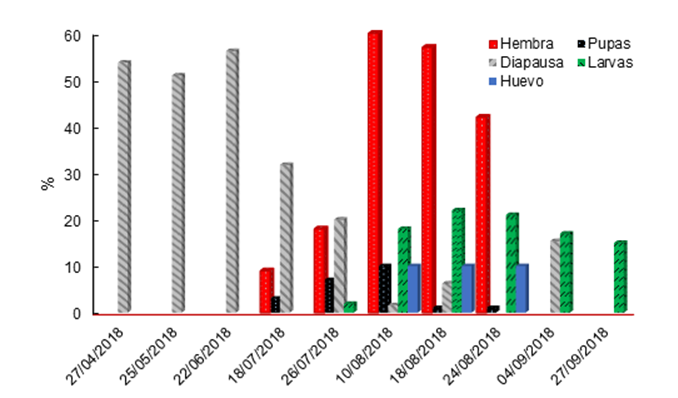
Figura 4 Fenología de Monoctenus cuauhtemoci n. sp. De Lira, 2021, en Ixcateopan de Cuauhtémoc, Guerrero, México. Ciclo 2018.
Las larvas se observaron después del 18 de julio, con la mayor densidad de población el 10 de agosto, y estuvieron presentes hasta el 24 de septiembre. La mortalidad de larvas, efecto del tratamiento de combate aplicado el 25 de agosto de 2018, se observó después del 4 de septiembre, que representa 10 días después de la aplicación. La formación de cocones se observó después de octubre, y dentro de ellos, las larvas permanecieron en diapausa (en los cocones en el suelo), con mayor proporción en noviembre y diciembre; en esta condición se mantuvieron hasta el 9 de abril de 2019. Lo anterior indica que las pupas se forman a partir de finales de abril, como se observó en 2018. Los datos permiten inferir que solo se hay una generación por año, al igual que en San Luis Potosí; aunque con diferencias en la época de aparición (Smith et al., 2010). La detección de huevecillos ocurrió en el mes de agosto, estadio de desarrollo difícil de observar a simple vista, ya que se requiere de entrenamiento para identificarlos.
De los factores que afectan a la población de cocones en el suelo, el más importante es la mortalidad ocasionada por parasitoides, seguido por la depredación por roedores, moscas parasitoides de las familias Bombyliidae y Tachinidae. De los hongos entomopatógenos, Beauveria bassiana (Bals.) Vuillemin fue el más prevaleciente, en comparación con Metarhizium anisopliae (Metsch.) Sorokin (Figura 5).

Figura 5 Factores de Mortalidad que afectan la población de Monoctenus cuauhtemoci n. sp. de Lira 2021, en Ixcateopan de Cuauhtémoc, Guerrero.
En la emergencia bajo condiciones controladas en el Cepab, los parasitoides más comunes (Figura 6) fueron los de la familia Mantispidae, seguidos de los Tachinidae con 85 y 28 individuos, respectivamente. Aunque solo se registró la emergencia de un espécimen de Exenterus sp. (Hymenoptera: Ichneumonidae); en campo es común observar los orificios de emergencia ocasionados por parasitoides de la familia Ichneumonidae (Ordaz et al., 2013). Esta es la primera vez que se cita a la familia Mantispidae (Insecta: Neuroptera) como parasitoide de moscas sierra en México; aunque la familia se ha documentado en la literatura como un parasitoide de himenópteros (Triplehorn y Johnson, 2005).
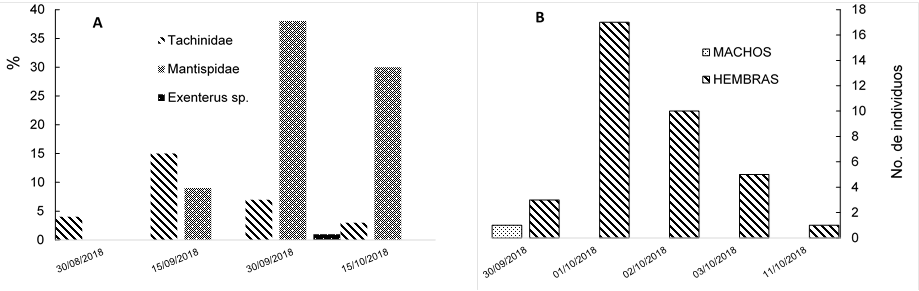
Figura 6 Factores de mortalidad que afectan la población de Monoctenus cuauhtemoci n. sp. De Lira 2021, (A) y emergencia de hembras de moscas sierra, Monoctenus cuauhtemoci n. sp., bajo condiciones controladas (B).
Las larvas del género Monoctenus son verde olivo, con cabeza café claro, con franjas oscuras longitudinales y se alimentan en forma solitaria. Además, la cabeza café clara presenta una mancha negra en la sutura de la corona; las antenas son de tres segmentos con el último de forma cónica; la mandíbula izquierda presenta más de tres dientes; las patas torácicas son café oscuro y presentan siete anulaciones en cada uno de los segmentos abdominales. En vista dorsal presentan una franja oscura longitudinal en la porción media del dorso con dos franjas claras a los costados y una oscura en forma subdorsal (Figura 7). La diferencia entre M. sanchezi y Monoctenus cuauhtemoci, de Ixcateopan se observa en el primer par de patas torácicas que en M. sanchezi presentan el trócanter completamente blanquecino; mientras que en Monoctenus cuauhtemoci, la porción basal es café oscuro y solo la apical blanquecina.

Fotos: Adriana R. Gijón.
Fotografías tomadas a 1X (A, B, D y E) y 2X (C y F).
Figura 7 Aspecto de larvas de Monoctenus sanchezi Smith (A, B y C) y Monoctenus cuauhtemoci n. sp. De Lira, 2021 (D, E y F). Dorsal (A y D), lateral (B y E) y acercamiento a patas torácicas (C y F).
Respecto a la identificación molecular, para el género Monoctenus existen en el GENBANK 34 secuencias correspondientes a COI, de las cuales 60 % corresponden a Monoctenus juniperi Linneaeus, 1758 y Monoctenus obscuratus Hartig, 1837, ambos presentes en Europa; mientras que, el resto sólo están determinados a género.
Los estudios moleculares mostraron que la banda del producto de PCR tanto para larvas, como adultos de Monoctenus fue de un peso de 740 pb del gen mitocondrial citocromo C Oxidasa Subunidad I.
Para este género se obtuvo un árbol con dos clados bien definidos (Figura 8). En el primero, se agrupan los ejemplares provenientes de los especímenes de las recolectas del presente estudio, mientras que el segundo corresponde a las secuencias de las bases registradas en el GENBANK para las especies de Europa. En el primer clado, se observa que M. sanchezi está muy relacionado con el ejemplar GTOM1_35 con un soporte de 100 %, el cual se identificó morfológicamente como M. sanchezi; y los ejemplares de Monoctenus procedentes de Ixcateopan de Cuauhtémoc, Guerrero tanto larvas (GROM2_2), como adultos (GROM2_AD) se ubican como una especie diferente.
Discusión
Se obtuvieron larvas de dos especies de Monocotenus: 1) Sierra de Álvarez en San Luis Potosí y 2) Sierra de Cuauhtémoc en Guerrero, ambas son muy parecidas, pero difieren en los trócanteres de las patas delanteras torácicas, que en M. sanchezi son completamente blanquecinos y en las larvas de Ixcateopan, el trócanter presenta la porción basal café oscuro y la apical blanquecina. A nivel de adultos, la maculación en la cara de M. sanchezi es muy ligera, solo abarca la zona de los ocelos y dos pequeñas manchas circulares cerca de la órbita interna de los ojos compuestos; en M. sadadus Smith y M. cuauhtemoci n. sp., la mancha es muy grande y cubre gran parte de la cara, aunque difieren en tamaño: en M. cuauhtemoci n. sp. las manchas debajo de los ocelos llegan a tocar las órbitas internas de los ojos compuestos y en M. sadadus son más pequeñas; también en M. cuauhtemoci n. sp. la mancha se interrumpe en los costados de los sockets antenales, lo que no ocurre en M. sadadus. Otra diferencia entre ellas es la longitud de los ramis en los antenómeros 2 a 9 que en M. sadadus es del doble de la base y en M. cuauhtemoci n. sp. son más cortos. Las diferencias morfológicas entre las poblaciones de Sierra de Álvarez, San Luis Potosí y Xichú, Guanajuato (identificadas como M. sanchezi) con respecto de la población de Sierra de Cuauhtémoc fueron corroboradas con los análisis moleculares y con las diferencias en la lanceta del ovipositor de la hembra basadas en la preponderancia del diente basal en los anillos 3 a 6 y en el número de dientes en el anillo nueve.
Conclusiones
Monoctenus cuauhtemoci n. sp. es una nueva especie detectada en la Sierra de Cuauhtémoc que difiere de M. sanchezi, principalmente, en la maculación de la cara y en la longitud de los ramis de los antenómeros. La población de Sierra de Cuauhtémoc es más agresiva que las poblaciones de Sierra de Álvarez, San Luis Potosí y Xichú, Guanajuato (identificadas como M. sanchezi) ya que se observan hasta 200 larvas por árbol, en comparación con 30 en las últimas localidades.











 texto en
texto en