Introducción
La Amazonía Colombiana es considerada una de las regiones con mayor biodiversidad y endemismo (Ter Steege et al., 2013). Esta diversidad de especies en los bosques tropicales húmedos es fundamental para su funcionamiento, resiliencia y capacidad de proporcionar bienes y servicios (Gómez et al., 2018). Sin embargo, la ganadería, los cultivos ilícitos y la tala ilegal han provocado su deforestación a un ritmo sin precedentes en Colombia, lo que afecta considerablemente la diversidad florística (Gómez et al., 2018, González-Orozco et al., 2020).
Los bosques de la Amazonía se caracterizan por su gran riqueza florística, faunística y por albergar una amplia variedad de productos forestales maderables y no maderables de inmensurable valor (González-Orozco et al., 2020). La información sobre la estructura y composición florística es una herramienta importante para la evaluación del potencial de un bosque y su definición de estrategias de manejo (Mena et al., 2020). Esto se obtiene a través de ciertos parámetros como la diversidad, frecuencia, densidad, dominancia, distribución diamétrica y espacial que muestran el desarrollo de los bosques (Dionisio et al., 2016).
En este contexto, es importante conocer estructuralmente el bosque para entender la relación natural de las especies nativas con las silvestres del género Theobroma. Actualmente, hay algunos estudios de biodiversidad que involucran diferentes taxones de Theobroma, entre ellos: Theobroma cacao L. “especie cultivada” (Sánchez et al., 2016); Theobroma grandiflorum (Wild. ex Spring) Schum (Peña y Alegre, 2017) y Theobroma subincanum Mart (Vela, 2019). No obstante, en regiones tropicales resulta escasa la información sobre las relaciones entre ellas (Gómez et al., 2018) con especies nativas de los bosques, en este caso los de las regiones de Caquetá y Putumayo.
El objetivo del presente trabajo consistió en evaluar la estructura, composición y diversidad de bosques asociados a especies silvestres de Theobroma en la Amazonía Colombiana.
Materiales y Métodos
Área de estudio
El estudio se realizó en el municipio Cartagena de Chairá departamento de Caquetá, donde se establecieron tres parcelas de muestreo en la zona del bajo Caguán; particularmente, en las veredas Palmichales, El Jordán y El Guamo. Dos parcelas más, se establecieron en el municipio Puerto Leguízamo, departamento de Putumayo en las veredas Las Vegas y La Cocha (Figura 1). Las zonas de estudio en el Caquetá y Putumayo presentan una altitud que varía entre 181 y 228 m. La vegetación corresponde a un bosque húmedo tropical (bh-T) (Holdridge, 2000), que conformaba un bosque natural secundario, sin entresaca subdivido en las categorías: bosque de mesón (El Jordán, El Guamo y La Cocha) y bosque de vega (Palmichales, Las Vegas).
En la región del Caquetá y Putumayo, la temperatura media anual oscila entre 24 y 26 °C. La precipitación anual promedio corresponde al intervalo de 3 300-3 600 mm; en un régimen monomodal, con un periodo de baja precipitación desde inicios de noviembre a mediados de febrero y un incremento de pluviosidad desde mediados de marzo, hasta finales de octubre. La humedad relativa en el área varía entre 78 y 87 % (González-Orozco et al., 2020).
Métodos de muestreo
Los sitios de muestreo se seleccionaron localizando especies del género Theobroma que se desarrollan en sus condiciones naturales. Esos especímenes se consideraron como eje central para el establecimiento de cinco parcelas circulares de 25.24 m de diámetro (500 m2), lo anterior con base en la metodología adaptada de Barreto et al. (2018). En los sitios de muestreo se inventariaron todos los individuos arbóreos con diámetro a la altura del pecho (DAP) superior a ≥ 10 cm, el cual se midió con cinta diamétrica Forestry Suppliers, y altura total (m) con un hipsómetro Suunto Pm-5.
Se colectaron muestras de ramas jóvenes, hojas, flores y frutos de las especies presentes (Avendaño-Arrazate et al., 2021). El material colectado se identificó en el Herbario del Museo de Historia Natural de Unidades con apoyo del Herbario Amazónico Colombiano (COAH), del Instituto de Investigaciones Amazónicas-SINCHI.
Composición y diversidad florística
A partir de información primaria se caracterizaron florísticamente las parcelas, con el fin de identificar la composición de las especies y analizar su estructura horizontal y vertical. Se cuantificó el número de individuos y se determinó a qué familia, género y especie pertenecían (Cano y Stevenson, 2009).
Estructura horizontal
La estructura horizontal se analizó mediante la abundancia, frecuencia y dominancia discriminadas en su valor absoluto y relativo (Mena et al., 2020). Con base en estas variables, se calculó el Índice de Valor de Importancia (IVI), dado por la suma de los parámetros expresados en porcentaje de la abundancia, frecuencia y dominancia relativa (Avendaño-Arrazate et al., 2021).
La diversidad florística se determinó mediante el índice de riqueza de Shannon (H´), el índice inverso de Simpson (1/D), por lo cual se debe interpretar la tendencia a la diversidad con valores mayores del índice; y el índice estructural de diversidad de Margalef. Para comparar la composición florística o similitud entre los fragmentos, se calculó el Índice de similitud de Jaccard (J) (Magurran, 1988).
Estructura vertical
Se realizó un análisis de la distribución de diámetro y altura, a partir de la distribución en clases diamétricas y altimétricas (Manzanilla et al., 2020). Posteriormente, se analizó la estratificación vertical que refleja la distribución de las copas en el perfil vertical respecto a los árboles de cacao nativo, con base en la metodología IUFRO (International Union of Forest Research Organizations); las especies presentes se distribuyeron en tres estratos: estrato superior, con un intervalo de altura total mayor o igual a 10 m; estrato medio, de 6 a 10 m; y estrato inferior, menor a 6 m de altura. Una vez que se consolidó la estratificación, con base en las fórmulas planteadas en el Cuadro 1, se calcularon los valores y la posición fitosociológica.
Cuadro 1 Indicadores fitosociológicos (Jerez et al., 2011).
| Indicador | Fórmula | Descripción |
|---|---|---|
| Valor fitosociológico |
|
VF = Valor
fitosociológico n = Número de individuos del subestrato N = Número total de individuos de todas las especies |
| Posición sociológica absoluta de la especie |
|
PSa = Posición sociológica absoluta de
la especie VF = Valor fitosociológico del subestrato N = No. de individuos de cada especie I = Inferior m = Medio s = Superior |
| Posición sociológica porcentual de la especie |
|
PS% = Posición sociológica porcentual
de la especie PSa = Posición sociológica absoluta de la especie ΣPSa = sumatoria total de los valores absolutos |
Resultados y Discusión
Composición florística
Estructura horizontal. En las cinco parcelas de muestreo establecidas en el Caquetá y Putumayo, se registraron 190 individuos, distribuidos en 35 familias, 85 géneros y 123 especies. Las familias con mayor número de taxones fueron Moraceae, Fabaceae, Myristicaceae, Malvaceae, Burseraceae, Lauraceae y Rubiaceae que en su conjunto agruparon 56 % del total de árboles inventariados (Cuadro 2).
Cuadro 2 Familias dominantes basadas en el Índice de Valor de Importancia (IVI), número de géneros, especies e individuos en parcelas de Caquetá y Putumayo, Amazonía Colombiana.
| Familia | Género | Especie | Individuos | IVI 300 % |
|---|---|---|---|---|
| Moraceae | 7 | 10 | 18 | 41.04 |
| Fabaceae | 6 | 13 | 17 | 37.31 |
| Myristicaceae | 5 | 9 | 25 | 34.23 |
| Malvaceae | 6 | 10 | 15 | 26.53 |
| Burseraceae | 5 | 9 | 14 | 24.67 |
| Lecythidaceae | 2 | 4 | 12 | 17.07 |
| Lauraceae | 6 | 9 | 9 | 13.47 |
| Rubiaceae | 7 | 8 | 10 | 12.40 |
| Urticaceae | 4 | 6 | 7 | 11.77 |
| Sapotaceae | 3 | 7 | 7 | 11.03 |
| Subtotal | 51 | 85 | 134 | 229.52 |
| Familias restantes | 35 | 38 | 56 | 70.48 |
| Total general | 85 | 123 | 190 | 300 |
Similar a lo registrado en la presente investigación, en estudios de la vegetación de paisajes en la Amazonía Colombiana se citan entre las familias con mayor cantidad de especies a Moraceae, Rubiaceae, Burseraceae, Fabaceae y Lauraceae (Cano y Stevenson, 2009; Meza y Armenteras, 2018). En bosques tropicales de la Amazonía Brasilera se observó que una de las familias con mayor valor de importancia es Fabaceae, la cual en muchos casos tiene el mayor número de especies, al igual que otras familias como Lauraceae, Sapotaceae y Lecythidaceae (Carim et al., 2013). En el caso de las parcelas de Caquetá y Putumayo, a Fabaceae fue la mejor representada con 13 especies y sobresalió con la mayor cantidad de géneros (6), además tuvo el segundo valor en importancia ecológica después de la familia Moraceae (Cuadro 2).
Al realizar un análisis del IVI familiar por parcela se observó que Fabaceae destacó entre las seis familias más importantes para las cinco parcelas en estudio y registró el IVI más alto en tres de ellas (P1-Palmichales, P3-El Guamo y P4-Las Vegas), el taxón con más especies perteneció al género Inga. En la evaluación de la composición arbórea de taxones asociados al cacao criollo en bosques secundarios de México, y de la zona amazónica de Brasil y Ecuador se ha consignado a Fabaceae como una de las familias botánicas con mayor número de especies (Roa et al., 2009; Veiga et al., 2015; Paredes et al., 2020; Avendaño-Arrazate et al., 2021; Imaña et al., 2021).
Iryanthera laevis Markgr, con ocho individuos; Brosimum cf. potabile Ducke, con 7 individuos; Eschweilera albiflora (DC.) Miers, con seis individuos; Iryanthera crassifolia A.C.Sm., con cinco individuos; Neea parviflora Poepp. & Endlicher, Theobroma glaucum H. Karst. y Parinari campestris Aubl., con 4 individuos cada una fueron las más representativas por su abundancia. Iryanthera laevis, Ficus trigona L.F, Brosimum cf. potabile, Theobroma subincanum Mart y Eschweilera albiflora presentaron el valor de importancia más alto (Cuadro 3).
Cuadro 3 Estructura horizontal de los principales fustales en parcelas de Caquetá y Putumayo, Amazonía Colombiana.
| Especie | AA | AR | FA | FR | DA | DR | IVI |
|---|---|---|---|---|---|---|---|
| Iryanthera laevis Markgr. | 8.00 | 4.21 | 4.00 | 2.50 | 0.47 | 5.89 | 12.60 |
| Ficus trigona L. F | 1.00 | 0.53 | 1.00 | 0.63 | 0.85 | 10.57 | 11.72 |
| Brosimum cf. potabile Ducke | 7.00 | 3.68 | 3.00 | 1.88 | 0.42 | 5.19 | 10.75 |
| Theobroma subincanum Mart. | 3.00 | 1.58 | 3.00 | 1.88 | 0.42 | 5.17 | 8.63 |
| Eschweilera albiflora (DC.) Miers | 6.00 | 3.16 | 3.00 | 1.88 | 0.28 | 3.47 | 8.51 |
| Inga cf. nobilis Willd. | 1.00 | 0.53 | 1.00 | 0.63 | 0.46 | 5.69 | 6.85 |
| Iryanthera crassifolia A.C.Sm. | 5.00 | 2.63 | 4.00 | 2.50 | 0.05 | 0.58 | 5.71 |
| Inga acreana Harms | 2.00 | 1.05 | 1.00 | 0.63 | 0.32 | 3.99 | 5.67 |
| Inga sp.6 | 1.00 | 0.53 | 1.00 | 0.63 | 0.33 | 4.15 | 5.31 |
| Trattinickia rhoifolia Willd. ex Spreng. | 1.00 | 0.53 | 1.00 | 0.63 | 0.32 | 4.03 | 5.19 |
| Neea parviflora Poepp. & Endlicher. | 4.00 | 2.11 | 3.00 | 1.88 | 0.08 | 0.95 | 4.93 |
| Theobroma glaucum H. Karst. | 4.00 | 2.11 | 3.00 | 1.88 | 0.06 | 0.78 | 4.76 |
| Pseudolmedia laevis (Ruiz & Pav.) J.F Macbr. | 2.00 | 1.05 | 2.00 | 1.25 | 0.18 | 2.20 | 4.50 |
| Astrocaryum standleyanum L.H.Bailey | 3.00 | 1.58 | 3.00 | 1.88 | 0.08 | 0.94 | 4.39 |
| Parinari campestris Aubl. | 4.00 | 2.11 | 2.00 | 1.25 | 0.08 | 1.00 | 4.36 |
| Protium sp.1 | 2.00 | 1.05 | 2.00 | 1.25 | 0.16 | 1.96 | 4.26 |
| Eschweilera coriacea (DC.) S.A. Mori | 2.00 | 1.05 | 2.00 | 1.25 | 0.15 | 1.87 | 4.17 |
| Euterpe precatoria Mart. | 3.00 | 1.58 | 2.00 | 1.25 | 0.08 | 0.96 | 3.79 |
| Bursera inversa Daly | 2.00 | 1.05 | 2.00 | 1.25 | 0.11 | 1.31 | 3.61 |
| Virola calophylla (Spruce) Warb. | 3.00 | 1.58 | 2.00 | 1.25 | 0.06 | 0.77 | 360 |
| Subtotal | 63 | 33.7 | 45 | 28.18 | 4.96 | 61.47 | 123.31 |
| Especies restantes | 126 | 67 | 115 | 72 | 3 | 39 | 177 |
| Total general | 190 | 100 | 160 | 100 | 8 | 100 |
AA = Abundancia absoluta; AR: = Porcentaje de individuos/Especie; DA = Dominancia absoluta; DR = Proporción de área basal/Especie; FA = Frecuencia absoluta; FR = frecuencia relativa; IVI = Índice Valor de Importancia de la especie.
Al comparar las especies entre parcelas, se observó una diferencia entre sitios de estudio, en donde las parcelas P1-Palmichlaes, P2-El Jordán y P3-El Guamo (Caquetá) compartieron las especies con mayor IVI a Brosimum cf. potabile e Iryanthera laevis, las cuales no fueron representativas para P4-Las Vegas y P5-La Cocha, dos sitios que forman parte de una región geográfica diferente (Putumayo). En las parcelas P3-El Guamo y P5-La Cocha se registraron entre las cinco especies con mayor IVI a Eschweilera albiflora.
Se identificaron tres especies de Theobroma: Theobroma subincanum Mart, Theobroma glaucum H. Karst y Theobroma obovatum Klotzch ex Bernoulli; cada una de ellas con tres, cuatro y un individuo, respectivamente; Theobroma subincanum y Theobroma glaucum fueron comunes entre las parcelas 1 y 5. Destacó Theobroma subincanum como una de las cinco especies con mayor índice de importancia (8.63) en las zonas de estudio. En una investigación de diversidad y distribución de parientes silvestres de cacao en Colombia, González-Orozco et al. (2020) indican que la variación de microambientes en el paisaje amazónico promueve la presencia de ciertos taxones de Theobroma, como las observadas en el presente trabajo; lo cual señalan se relaciona, en parte, con las condiciones hidrológicas en los ríos del Amazonas como fuertes impulsores de la distribución de Theobroma cacao silvestre.
Diversidad florística
El índice de diversidad de Shannon (H) para Palmichales fue de 3.38; El Jordán, 3.16; El Guamo, 3.58; Las Vegas, 3.4 y La Cocha, 3.51 (Cuadro 4). El análisis de equidad se evaluó mediante el inverso de Simpson (1/D), cuyos valores para Palmichales fue de 0.97, El Jordán 0.95, El Guamo 0.97, Las Vegas 0.96 y La Cocha 0.97. De acuerdo con los resultados hubo alta diversidad en todas las comunidades muestreadas producto del número elevado de especies. En cuanto al índice de Margaleff, en todas las parcelas se registraron valores superiores a 5, lo cual sugiere que son bosques de alta diversidad; sobresalieron los de El Guamo (9.72) y La Cocha (9.34).
Cuadro 4 Comparación de la diversidad alfa, riqueza de especies y diversidad entre las parcelas en Caquetá y Putumayo, Amazonía Colombiana.
| Palmichales | El Jordán | El Guamo | Las Vegas | La Cocha | |
|---|---|---|---|---|---|
| Especies | 30 | 27 | 38 | 30 | 35 |
| Individuos | 32 | 36 | 45 | 39 | 38 |
| Dominancia_D | 0.035 | 0.050 | 0.030 | 0.037 | 0.031 |
| Simpson_1-D | 0.964 | 0.949 | 0.969 | 0.962 | 0.968 |
| Shannon_ H' | 3.379 | 3.160 | 3.579 | 3.344 | 3.514 |
| Menhinick | 5.303 | 4.500 | 5.665 | 4.804 | 5.678 |
| Margalef | 8.368 | 7.255 | 9.720 | 7.916 | 9.347 |
| Equitatividad_J | 0.993 | 0.958 | 0.984 | 0.983 | 0.988 |
En bosque tropicales de la Amazonía, Lima et al. (2019) documentan el Índice de Diversidad de Shannon (H'=3.57) y de equidad (J=0.79), por lo que el bosque estudiado tiene una buena diversidad. De acuerdo con autores como Condé y Tonini (2013); Carim et al. (2013), los valores para la diversidad de Shannon son bajos comparados con registrados en bosque tropicales de otras regiones amazónicas como Roraima en Brasil. Lo anterior, se debe a la dominancia de determinadas especies y a una baja semejanza florística a nivel de género.
Prieto y Arias (2007) afirman que la alta diversidad florística de la Amazonía Colombiana se sustenta en la dominancia de pocos grupos taxonómicos que integran la mayor parte de la riqueza de especies, como se evidenció al analizar la dominancia de familias, lo cual mostró que 28.5 % de las familias representaron 69.1 % de la riqueza en especies.
En el bosque maduro se observaron altos índices de diversidad alfa, característica de la parte alta de la bio-región amazónica, donde se registra la mayor riqueza de especies arbóreas a nivel mundial.
El índice de similaridad de Jaccard indicó que las parcelas más parecidas fueron las de Palmichal y El Jordán, así como Palmichal y El Guamo. Mientras que la parcela La Cocha presentó mayor disimilitud con respecto a las demás (Cuadro 5).
Cuadro 5 Índice de Jaccard para las cinco parcelas establecidas en Caquetá y Putumayo, Amazonía Colombiana.
| Similitud | Índice de Jaccard |
|---|---|
| Palmichal y El Jordán | 0.140 |
| Palmichal y El Guamo | 0.133 |
| Palmichal y Las Vegas | 0.053 |
| Palmichal y La Cocha | 0.121 |
| El Jordán y El Guamo | 0.121 |
| El Jordán y Las Vegas | 0.018 |
| El Jordán y La Cocha | 0.107 |
| El Guamo y Las Vegas | 0.046 |
| El Guamo y La Cocha | 0.090 |
| Las Vegas y La Cocha | 0.016 |
Las parcelas que presentaron un mayor índice de Jaccard correspondieron a las parcelas que compartieron como zona geográfica El Cartagena de Chairá en Caquetá. Por otra parte, los índices más bajos se obtuvieron en Las Vegas y La Cocha; aunque forman parte de la misma zona geográfica (Putumayo) corresponden a dos tipos de bosque diferente: Bosque de Vega y Bosque de Mesón, respectivamente. De igual manera otro de los índices bajos se registró en El Jordán y las Vegas, dos parcelas que difieren tanto en ubicación geográfica como en tipo de bosque. Estos comportamientos se asocian a las condiciones agro-climatológicas y geológicas como el relieve, cambios de clima, suelos, entre otras; los cuales tienen influencia sobre el comportamiento de la vegetación, ya que inciden en el desarrollo de niveles altos de riqueza de especies y hábitats, asociado a estimaciones altas de biodiversidad para la región del bosque amazónico (Cárdenas, 2014; Andrade et al., 2017).
Estructura vertical
Distribución diamétrica. En las parcelas del Caquetá y Putumayo el histograma de distribución diamétrica evidenció que predominan individuos en las tres primeras clases diamétricas que representan 86 % del total. Se determinó que las especies con mayor clase diamétrica fueron Ficus trigona L.F, Inga cf. nobilis Willd, Trattinickia rhoifolia Willd. ex Spreng e Iryanthera laevis (Figura 2).
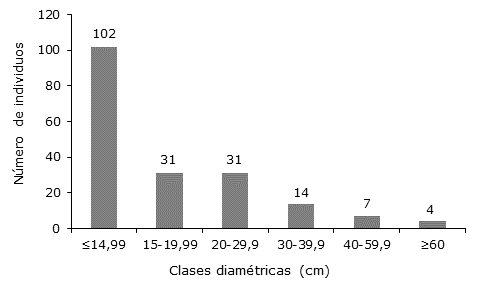
Figura 2 Clasificación diamétrica de individuos en parcelas de Caquetá y Putumayo, Amazonía Colombiana.
El comportamiento observado en la distribución diamétrica es similar al citado por Paredes et al. (2020) en bosques tropicales, en donde se observó que la estructura del bosque secundario estaba representada en gran cantidad por árboles de fuste pequeño y tendía a acumular especies de plantas leñosas de crecimiento rápido (especies pioneras). Las primeras clases diamétricas incluían la mayor cantidad de individuos, lo cual denota una dinámica de mortalidad y reclutamiento importantes para la regeneración dentro del bosque, ya que las especies presentes en las menores clases diamétricas son parte de un proceso de recambio de taxones que originan otros estadios sucesionales; y con ello se evidencia un equilibrio sostenido entre los individuos que mueren y los que crecen (Rodríguez y Brenes, 2009; Veiga et al., 2015).
Distribución altimétrica. En el Caquetá y Putumayo, los individuos se distribuyeron en seis clases altimétricas, 60 % de los individuos (115) se concentró en el estrato medio con alturas menores a 15 m (Figura 3).
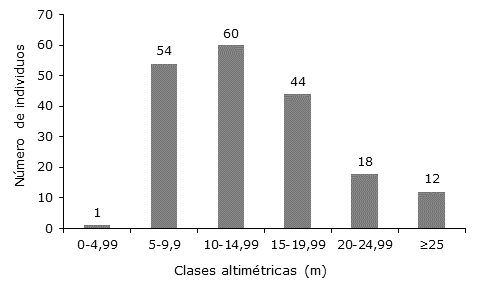
Figura 3 Clasificación altimétrica de individuos en parcelas en Caquetá y Putumayo, Amazonía Colombiana.
La distribución altimétrica coincide con el comportamiento para la región amazónica señalado por otros autores. Lima et al. (2019) indican que en un bosque umbrófilo denso de la amazonía oriental, 69 y 57 % de las especies se presentaron en el estrato medio, con alturas que variaron de 13.5 a 23.5 m. Dionisio et al. (2016) en un bosque denso del estado de Roraima registraron 70.29 % de individuos en el estrato medio; Condé y Tonini (2013) en un bosque del mismo estado obtuvieron porcentajes similares de alrededor de 71.3 % en el estrato medio. Andrade et al. (2017) en bosques de Rondonia citan que una distribución de individuos con alturas menores a 20 m es característica de bosques jóvenes y garantiza la continuidad de las especies dentro de la estructura del bosque.
Al evaluar la posición fitosociológica de las especies presentes en las parcelas del Caquetá y Putumayo sobresalieron como las más importantes: Iryanthera laevis (4.420), Brosimum cf. potabile (4.180), Eschweilera albiflora (3.523), Iryanthera crassifolia (2.867), Parinari campestris (1.794) y Theobroma glaucum (1.794) (Cuadro 6). La mayoría de los árboles de los taxones silvestres de Theobroma existentes en las parcelas de Caquetá y Putumayo de la Amazonía Colombiana, se ubicaron en el estrato superior con alturas entre 13 y 25 m
Cuadro 6 Posición fitosociológica de las principales especies en parcelas de Caquetá y Putumayo, Amazonía Colombiana.
| Especie | PS Inferior | PS Medio | PS Superior | PSA | PS % |
|---|---|---|---|---|---|
| Iryanthera laevis Markgr. | 0.000 | 0.516 | 4.232 | 4.747 | 4.420 |
| Brosimum cf. potabile Ducke | 0.000 | 0.258 | 4.22 | 4.489 | 4.180 |
| Eschweilera albiflora (DC.) Miers | 0.000 | 0.258 | 3.526 | 3.784 | 3.523 |
| Iryanthera crassifolia A.C.Sm. | 0.000 | 0.258 | 2.821 | 3.079 | 2.867 |
| Parinari campestris Aubl. | 0.000 | 0.516 | 1.411 | 1.926 | 1.794 |
| Theobroma glaucum H. Karst. | 0.000 | 0.516 | 1.411 | 1.926 | 1.794 |
| Neea parviflora Poepp. & Endlicher. | 0.037 | 0.258 | 1.411 | 1.705 | 1.588 |
| Euterpe precatoria Mart. | 0.000 | 0.258 | 1.411 | 1.668 | 1.553 |
| Lacistema nena J.F.Macbr. | 0.000 | 0.258 | 1.411 | 1.668 | 1.553 |
| Theobroma subincanum Mart. | 0.000 | 0.258 | 1.411 | 1.668 | 1.553 |
| Virola calophylla (Spruce) Warb. | 0.000 | 0.258 | 1.411 | 1.668 | 1.553 |
| Virola elongata (Benth.) Warb | 0.000 | 0.258 | 1.411 | 1.668 | 1.553 |
| Anaxagorea brevipes Benth. | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Bocageopsis multiflora (Mart.) R.E.Fr. | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Coussapoa orthoneura Standl. | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Dialium guianense (Aubl.) Sandwith | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Eschweilera coriacea (DC.) S.A. Mori | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Inga acreana Harms | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Inga japurensis T.D.Penn | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Maquira coriacea (H.Karst.) C.C Berg | 0.000 | 0.000 | 1.411 | 1.411 | 1.313 |
| Subtotal | 0.04 | 3.87 | 37.39 | 41.28 | 38.44 |
| Especies restantes | 0.22 | 8.77 | 57.11 | 66.10 | 61.58 |
| Total general | 0.26 | 12.64 | 94.49 | 107.39 | 100.01 |
Los índices fitosociológicos y de valor de importancia permitieron identificar cinco especies arbóreas sobresalientes: Iryanthera laevis, Brosimum cf. potabile, Eschweilera albiflora e Iryanthera crassifolia, las cuales representan un potencial para la conservación de materiales silvestres de cacao (Theobroma sp). De acuerdo con Avendaño-Arrazate et al. (2018), el cacao criollo es un recurso genético que se ha conservado durante muchos años en los ambientes totalmente aislados de poblaciones comerciales, en los que se desarrollan en convivencia con diferentes especies típicas de la selva, en este caso amazónica; de modo que estudios de la composición y estructura arbórea en condiciones naturales favorecerían la emisión de criterios sobre su hábitat y diversidad, y la identificación de taxones forestales asociados de importancia en su entorno; lo anterior coadyuvaría a la promoción de su conservación, así como a conocer especies arbóreas con potencial para implementarlas como sombra en sistemas productivos (Avendaño-Arrazate et al., 2021).
Conclusiones
En bosques asociados a Theobroma de la Amazonía Colombiana las familias de dosel más importantes son Moraceae, Fabaceae, Myristicaceae, Malvaceae y Burseraceae; destaca Iryanthera laevis con mayor importancia ecológica y posición fitosociológica.
Los valores de diversidad de Shannon varían entre 3.16 y 3.58; lo cual evidencia alto grado de diversidad que se relaciona con el índice de Jaccard que indica baja similitud entre parcelas, que se puede asociar a diferencias geográficas y de tipología del bosque.
Se identifican tres especies de Theobroma, de ellas sobresalen Theobroma subincanum por su importancia ecológica (IVI 8.63) y Theobroma glaucum por su posición fitosociológica (%PS 1.794).











 texto en
texto en