Introducción
Los Contaminantes orgánicos persistentes (COP) son compuestos particularmente tóxicos y estables, entre los que destacan: insecticidas, herbicidas, bifenilos policlorados (PCB), dioxinas y retardantes de llama (www.pops.int). Estos se caracterizan por su gran estabilidad química, lo que ha contribuido, en gran medida, a su dispersión en los ecosistemas del planeta. Debido a dicha estabilidad y baja solubilidad en agua, los PCB son muy difíciles de eliminar de las matrices del suelo. Su introducción fue mediante mezclas comerciales, la más común de ellas fue la serie de Aroclor (Producido por Monsanto Chemical Industry, Illinois) (Beyer y Biziuk, 2009; EPA, 2014). La cantidad de suelos contaminados por PCB en el mundo se desconoce. En Estados Unidos de América, 350 de los 1 290 sitios contaminados incluidos en el programa “Superfund” de la Agencia de Protección Ambiental (EPA, por sus siglas en inglés) están contaminados con PCB (27 %) (http://www3.epa.gov/). Por si fuera poco, dada su capacidad para bioacumularse, su estabilidad física e hidrofobicidad, los PCBs están presentes en toda la cadena alimentaria de la Tierra (Malisch y Kotz, 2014).
Es muy importante el uso de tecnologías de remediación eficientes para tratar de paliar el problema de los PCB. Una de ellas es la fitorremediación, la cual se basa en el uso de plantas para extraer, secuestrar o destoxificar contaminantes del suelo; su empleo reduce, significativamente, los costes de la descontaminación tradicional (Gomes et al., 2013), además de que contribuye a la lucha contra la erosión y ayuda a la restauración de espacios degradados (Dickinson et al., 2009). La efectividad de la fitorremediación puede incrementarse mediante la identificación de genes que participen en el metabolismo de los PCB. La cualidad de las plantas para degradar xenobióticos se descubrió en 1940, en relación con la descontaminación de plaguicidas (Sanderman, 1994): desde entonces, el desarrollo de la biología molecular ha contribuido a dilucidar en las plantas el metabolismo de algunos contaminantes (Eapen et al., 2007; Van Aken et al., 2009; Wang et al., 2012).
El proceso de degradación de contaminantes se puede resumir en tres etapas: transformación del compuesto, conjugación y compartimentación. En esta última existe una subclase de transportadores ABC, denominados multidrug resistance (MDR), que están implicados en la regulación de la afluencia y la salida celular de los xenobióticos (Rea, 2007; Xi et al., 2011). Sorprendentemente, se sabe muy poco sobre el papel de los MDR de las plantas en la resistencia a los xenobióticos, ya que hay pocos estudios sobre el particular (Conte y Lloyd, 2011). Los mecanismos que rigen esos procesos bioquímicos están finamente regulados por una gran cantidad de genes que codifican proteínas reguladoras. Los factores de transcripción tienen un papel central, y alteran la expresión de numerosos genes. Muchos de estos factores son coinducidos en respuesta a diferentes estreses, lo que sugiere la existencia de interacciones complejas (Yuan y Perry, 2011; Golldack et al., 2014). Campos (2011) analizó la posible implicación de la proteína Cold shock protein (CSP) en chopo Potri.004g172600 en la respuesta a contaminantes orgánicos. La familia CSP de las plantas tiene un dominio muy conservado, conocido como Cold shock domain (CSD), y presenta dos o más dedos de zinc Zinc Knuckle domain del tipo CCHC (CX2CX4HX4C) este motivo de unión al ADN le hace ser considerado un factor de transcripción, además dos sitios de reconocimiento de ARN (RRM) y cajas RGG repetidas.
Se han generado algunas variedades transgénicas para la fitorremediación de xenobióticos (Maestri y Marmiroli, 2011). Aunque, gran parte de la mejora genética se ha experimentado en plantas modelo de laboratorio como Nicotiana tabacum L. y Arabidopsis thaliana (L.) Heynh, que por su poca biomasa y corto tiempo de vida podrían no ser adecuadas para la remediación in situ. Por lo tanto, hay un interés particular en la mejora genética de árboles que mantengan un crecimiento rápido, sistemas radiculares extensos y abundante producción de biomasa, como los álamos y los sauces (Doty, 2015).
El género Populus comprende 40 especies arbóreas originarias de las zonas templadas y frías septentrionales. Tiene altas tasas de crecimiento (hasta 3 m año-1), así como un gran sistema radicular que asegura la absorción eficiente de agua subterránea (Isebrands y Richardson, 2015). La idoneidad del álamo no solo radica en sus características fisiológicas, Populus es hoy el mejor sistema modelo forestal disponible (genoma secuenciado). De este modo, el álamo es susceptible de emplearse como especie modelo para estudios de ecofisiología molecular, así como para asociaciones de gen-función en otros taxones (Brunner y Nilson, 2004).
El objetivo de este trabajo fue demostrar que las líneas transgénicas de A. thaliana que sobreexpresan PtCSP4 del álamo (Potri.004g172600) toleran la presencia de los PCB.
Materiales y Métodos
El estudio se llevó a cabo en el Laboratorio de Biotecnología Forestal del Centro de Biotecnología y Genómica de Plantas (CBGP), ubicado en el Parque Científico y Tecnológico, UPM Campus de Montegancedo, Ctra, M-40, km 38, 28223, Madrid, España.
Material vegetal
En los experimentos se utilizaron plantas in vitro de álamos (clon INRA 7171-B4) de Populus tremula × alba L., el cual se eligió por su excelente comportamiento in vitro y ex vitro, así como por su facilidad para ser transformado genéticamente, además de tener mucho vigor en campo. Para Arabidopsis thaliana se usó el ecotipo Columbia en la transformación genética. Las semillas se obtuvieron en el Arabidopsis Biological Resource Center de Ohio, USA. En la transformación de A. thaliana se utilizó la cepa C58C1 (pMP90) de Agrobacterium tumefaciens (Smith & Townsend, 1907) Conn, 1942, que contiene el plásmido pMP90 derivado de pTiC58. Esta cepa fue cedida por la Dra. Pamela Green (Michigan State University).
Tratamientos con Aroclor 1221 (PCB)
Para los tratamientos con este xenobiótico se evaluó, previamente, el crecimiento de los álamos in vitro en presencia de distintas concentraciones de Aroclor 1221 (mezcla de PCB comercializada por Sigma Aldrich) diluido en DMSO estéril: 0 (control), 50 y 200 mg L-1. Los experimentos se realizaron en condiciones in vitro; en cada tarro se utilizaron 20 mL de MS-fitoagar suplementado con DMSO (controles) o Aroclor 1221 diluido en el mismo volumen de DMSO, con álamos de un mes de emergencia que fueron trasplantados al medio contaminado. Tras determinar el efecto de los PCB sobre el crecimiento vegetativo, se obtuvo la biomasa foliar de 20 plantas con una báscula digital (KERN ® Mod. PCB2500-2), después de secarlas en un horno (ECOSHEL ® Mod. 9023AV) a 70 °C durante 24 h; además de la longitud radicular, la cual se midió con una regleta de acero inoxidable (MILLER ® de 6”).
Extracción de ADN genómico de P. tremula × P. alba
Para la extracción se utilizaron 100 mg de la planta completa in vitro tratada con Aroclor 1221 pulverizado en nitrógeno líquido. La extracción de ADN se hizo mediante el kit DNesay Plant Mini (Qiagen; Hilden, Germany) siguiendo las instrucciones del fabricante. El ADN se cuantificó con un espectrofotómetro NanoDrop ND-100 (NanoDrop Technologies; Wilmington, DE, USA), con una relación de 280/260 ≥ 1.8. Para visualizar el ADN se utilizaron geles de agarosa al 0.8 % (p/v), preparados con amortiguador TAE (Tris HCl 40 mM Sigma-Aldrich ®, pH 8.0., acetato sódico 20 mM Sigma-Aldrich®, EDTA 1 mM Sigma-Aldrich ®) suplementado con bromuro de etidio a 0.1 mg L-1 Sigma-Aldrich ®. Las muestras se mezclaron con buffer de carga (azul de bromofenol al 0.05 % (p/v) Sigma-Aldrich ® y glicerol 5 % (p/v) Sigma-Aldrich ®. El ADN se visualizó́ en un Molecular Imager Gel Doc XR System. Para la cuantificación virtual se usó́ el software Quantity One 4.6.5 de Bio Rad ® (California, USA).
Extracción y secuenciación de ADN plasmídico de E. Coli
El aislamiento de plásmidos se llevó a cabo con el kit QIAprep Spin Miniprep (Qiagen; Hilden, Germany). Para comprobar la calidad se cuantificó el ADN plasmídico con un espectrofotómetro NanoDrop ND-100 (NanoDrop Technologies; Wilmington, DE, USA), con una relación de 280/260 ≥ 1.8. El tamaño del inserto se comprobó con las enzimas de restricción NdeI y HpaI Takara Bio Inc ® (Shiga, Japón). Los fragmentos se visualizaron en geles de agarosa al 0.8 %. La secuenciación se realizó en el Centro Nacional de Investigaciones Oncológicas (CNIO) en Madrid, España, con un sistema ABI ® 3730 Applied Biosystems (Foster City, CA, USA).
Expresión heteróloga de PtCSP4 en A. thaliana
La secuencia codificante de PtCSP4 (Potri.004G172600.1) se amplificó por PCR a partir de ADN genómico; se introdujeron sitios aatb completos utilizando la enzima de alta fidelidad Long Range ADN Polimerasa Takara Bio Inc ® (Shiga, Japón). El fragmento obtenido (624 pb) se clonó mediante tecnología Gateway ® Invitrogen ® (Gaithersburg, MD, USA). Los oligonucleótidos para el clonaje se diseñaron a partir de las secuencias genómicas, a la temperatura de fusión de 60 °C. Para clonar el gen PtCSP se usaron oligonucleótidos forward 5´ attbAGAAGGAGAAAACGGCATGGGTGAGAGG 3´ y reverse 5´ attbCCTCACACTAAAATCAACGTCC 3´, los cuales se diseñaron en la zona más divergente del extremo 5’ de la región codificante del extremo amino-terminal. Los ciclos de amplificación consistieron en un paso inicial de 2 min a 50 °C, un paso de desnaturalización de 10 min a 95 °C y por 40 ciclos de amplificación de 15 seg a 95 °C y 1 min a 60 °C, para asegurar la presencia de un solo amplicón. El producto de PCR se clonó en el vector de expresión pDONR 221 Gateway ® (Invitrogen ® ), y posteriormente, para que el transgen quedase bajo el control del promotor 35S, se procedió a clonarlo en el vector binario PB2GW7 Gateway ® (Invitrogen ® ). Con la construcción resultante, se transformaron células de la cepa C58C1 (pMP90) de A. tumefaciens, que se utilizó para infiltrar plantas de Arabidopsis (Figura 1). Como control se transformaron plantas de Arabidopsis sin inserto.
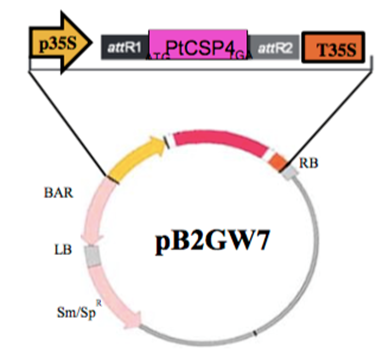
Figura 1 Clonaje de la región codificante de PtCSP4 en el vector pB2GW7. Diseño de clonaje para la expresión ectópica de PtCSP4 en Arabidopsis thaliana (L.) Heynh bajo el control del promotor CaMV35S. La zona comprendida entre las regiones LB y RB (T-ADN) incluye el gen BAR, que confiere resistencia al herbicida glufosinato de amonio.
Preparación de células y transformación con Agrobacterium
La preparación de células competentes y su transformación se realizó según el protocolo descrito por Hofgen y Willmitzer (1988), con algunas modificaciones. A partir de una colonia individualizada, se preparó un cultivo en 10 mL de medio LB con rifampicina (50 mg L-1) gentamicina (25 mg L-1) y kanamicina (50 mg L-1) Sigma-Aldrich ® . El cultivo se incubó a 28 °C y 200 rpm durante 16 h. Al día siguiente, 1 mL se inoculó en 100 mL del mismo medio (dilución 1:100), e incubó a 28 °C y 200 rpm hasta que alcanzó una OD600 ~ 0.8. Posteriormente, el cultivo se centrifugó a 5 000 rpm y 4 °C durante 5 min, se descartó el sobrenadante y se lavaron las células con 20 mL de NaCl 150 mM (estéril) frío. Se centrifugaron de nuevo las células a 4 °C y 5 000 rpm durante 5 min. Se resuspendieron en 2 mL de CaCl2 20 mM (estéril y frío).
Para la transformación de A. tumefaciens, se añadió 1 ng del plásmido pB2GW7 a 10 μL de células competentes (Agro 58C1). Se incubaron 5 min a 37 °C con agitación suave, después se mantuvieron en hielo durante 30 min. Posteriormente, se añadieron 500 μL de medio LB y se incubaron durante 3 h a 28 °C y 150 rpm en una incubadora TECNAL ® (Santo Domingo, República Dominicana). Tras una centrifugación de 1 min a baja velocidad (2 000 rpm), el pellet de células se resuspendió en 150 mL de medio LB y se plaqueó en LB-agar suplementado con rifampicina (50 mg L-1) y espectinomicina (100 mg L-1) Sigma-Aldrich ®. Las colonias fueron visibles tras incubarlas dos días a 28 °C.
Transformación genética de Arabidopsis thaliana
Se utilizaron plantas de A. thaliana de 3 semanas de edad, sembradas en alveolos de 5 × 5 cm (9 semillas/alveolo) con inflorescencias de unos 10 cm de largo. La transformación se llevó a cabo mediante el método de infiltración al vacío de Clough y Bent (1998), a partir de cultivos apropiados de A. tumefaciens. Se inocularon células recombinantes de la cepa C58C1 (pMP90), transformada con pB2GW7, en placas LB suplementadas con rifampicina (50 mg L-1) y espectinomicina (50 mg L-1) Sigma-Aldrich ®. Después de dos días en agitación (200 rpm) a 28 °C, se seleccionaron colonias individuales y se prepararon preinóculos en 3 mL de medio LB, con los mismos antibióticos que en el medio sólido. A partir de estos se inocularon 200 mL de medio LB con antibióticos, el cultivo se mantuvo en las mismas condiciones previas, hasta alcanzar una OD600 de 1.2. Las células se aislaron por centrifugación (15 min a 4 °C y 5 500 rpm en un rotor Beckman ® JA20 (Ft. Detrick, MD, USA) y se suspendieron en medio de infiltración (sales MS 1 × pH 5.7; sacarosa 5 % (p/v), MES 0.05 % (p/v) MERCK® (New Jersey, USA), bencilaminopurina (BAP) 0.044 µM Sigma-Aldrich ®, Silwet ® L-77 Lehle Seeds (Round Rock, TX, USA) a 0.02 % (v/v) que se agrega inmediatamente antes de infiltrar.
Las plantas de Arabidopsis se infiltraron durante 15 min al vacío. Se realizaron dos repeticiones. Después de secar las plantas con papel absorbente, se colocaron nuevamente en las cámaras de cultivo en condiciones controladas de crecimiento (temperatura 28 °C, fotoperíodo de 12 h de luz y 12 h de oscuridad). Una vez que se presentó la floración se colectaron las semillas de las líneas transformantes T0 (Se considera T0 a las plantas originadas por las semillas obtenidas luego de la transformación) y se germinaron para obtener la T1. El proceso anterior se repitió hasta obtener plantas T2 y T3. Las semillas T3 se sembraron en medio MS pH 5.7, suplementado con el herbicida fosfinotricina BASTA ® (10 µg mL-1). Después de dos semanas, se transfirieron las plantas vivas a una nueva placa con herbicida para descartar falsos positivos, donde se cultivaron durante otras dos semanas, después de lo cual las plantas sobrevivientes se transfirieron a una nueva placa con herbicida para descartar falsos positivos. El éxito de la transformación se verificó a través de amplificaciones qRT-PCR.
Extracción de ARN total de P. tremula x P. alba para validación por PCR en tiempo real
La extracción de ARN se llevó a cabo con 200 mg de tejido pulverizado (de planta in vitro completa). Para la extracción inicial, se utilizó el método de fenol-cloroformo (Ambion, 2008). Posteriormente, se purificó con el kit RNeasy Plus Mini (Qiagen; Hilden, Germany). Por último, se eluyó en 60 μL de agua estéril libre de ARNsa. Se cuantificó el ARN en un espectrofotómetro NanoDrop ND-100 (NanoDrop Technologies), con una relación de absorbancia de 260 nm/280 nm ≥ 2. Con esta metodología de extracción se obtuvieron 200 ng de ARN total. Para validar la calidad y cantidad del ARN se envió una alícuota al Centro Nacional de Investigaciones Oncológicas (CNIO) para practicarles una electroforesis por nanocapilaridades, con el equipo Bioanalizer 2100 (Agilent Technologies, Inc.; Santa Clara, CA, USA).
Antes de efectuar la síntesis de cADN, el ARN se trató con ADNsas, para evitar contaminación con ADN genómico en las muestras. Con este fin, se utilizó el kit Turbo ADN-Free ® (Ambion, Applied Biosystems; Austin, TX, USA). El cADN se sintetizó a partir de 1.5 µg de ARN en 30 µL de reacción del kit PrimeScript TM RT reagent (Perfect Real Time) Takara Bio, Inc®, (Otsu, Japan) en presencia de los cebadores Oligo dT y Random 6 mers Takara Bio, Inc®, (Otsu, Japan), en las cantidades recomendadas por el fabricante, con una incubación de 90 minutos a 37 °C.
PCR cuantitativas en tiempo real (qRT-PCR)
Las recientes PCR en tiempo real se llevaron a cabo en un termociclador ABI PRISM 7300 Applied Biosystems (Foster, CA, USA). Todas las reacciones se realizaron en un volumen final de 20 µL, con 10 µL de la mezcla SYBR™ Green 2x (Applied Biosystems), 0.2 µM de cada oligonucleótido, y 1 µL de cADN (apartado 3.7.2.). Para los genes de referencia, ARN ribosómico subunidad pequeña (18s) y polifenol oxidasa (PPO), se utilizó el cADN a una dilución 1:100. Los ciclos de amplificación fueron un paso inicial de 2 min a 50 °C, un paso de desnaturalización de 10 min a 95 °C y por 40 ciclos de amplificación de 15 seg a 95 °C y 1 min a 60 °C. Los datos se analizaron por medio del software 7300 Real-Time PCR System. Para el análisis de los niveles de expresión se hizo una cuantificación relativa del gen en estudio, por medio del método Ct (2-∆∆Ct) expuesto por Livak y Schmittgen (2001).
Resultados y Discusión
Crecimiento vegetativo en presencia de Aroclor 1221
Para elucidar los mecanismos que se activan al contacto con los PCB, se compararon plantas de álamo sin tratar (control), con plantas tratadas con Aroclor 1221. Previamente, se optimizaron las condiciones de tratamiento y se evaluó la sintomatología que resultó de la exposición a PCB. En los análisis se utilizaron álamos in vitro enraizados durante un mes, para evitar expresiones génicas asociadas a estadios muy juveniles y también para minimizar los posibles efectos de los transplantes. El cultivo in vitro de leñosas se considera generalmente muy difícil, si bien hay protocolos de regeneración más o menos eficaces para algunas especies. El híbrido elegido es particularmente viable y, de hecho, lidera la literatura sobre biotecnología forestal (Harfouche et al., 2011; Isebrands y Richardson, 2015).
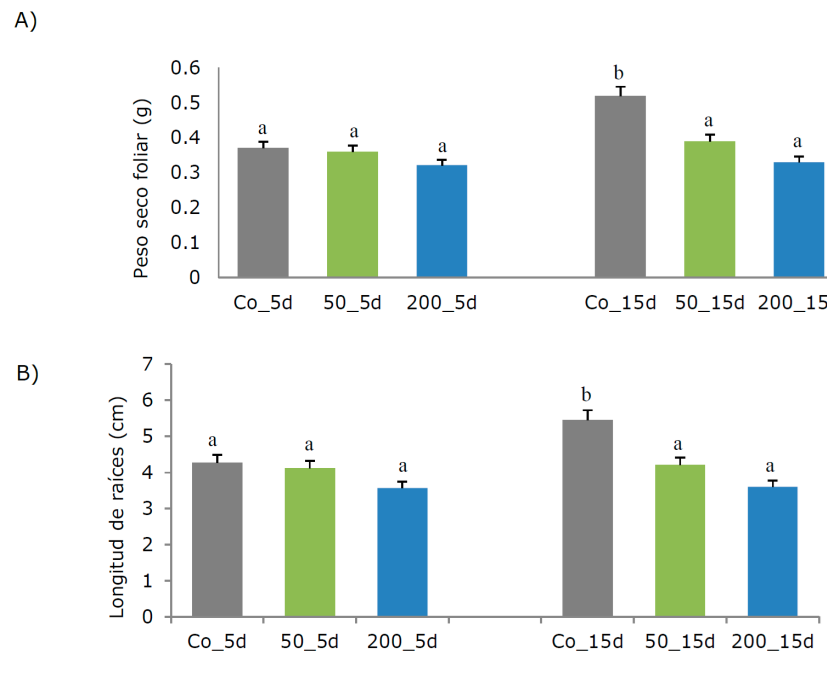
Las comparaciones entre plantas tratadas y las de control revelaron diferencias significativas en algunas variables cualitativas y cuantitativas. Si bien las plántulas in vitro exhibieron características de estrés a las concentraciones ensayadas, continuaron su crecimiento sin llegar a morir. El crecimiento de la planta en general y el sistema radical disminuyó conforme aumentaban la concentración de PCB y el tiempo de exposición. También, aparecieron síntomas de clorosis y necrosis foliar. Particularmente, la reducción de biomasa fue más pronunciada en la parte aérea que en las raíces. La longitud promedio de las raíces de las plantas control a los 5 días fue de 3.58 cm, presentó diferencias significativas respecto a las plantas tratadas (n=30, F= 4.0, p=0.68), cuya longitud promedio fue de 4.0 y 3.1 cm a 50 mg L-1 y 200 mg L-1 de PCB, respectivamente. A los 15 días se registró un tamaño de 2.54 cm a 50 mg L-1 y de 1.3 cm a 200 mg L-1. En 15 días a 200 mg L-1, el crecimiento de la longitud de las raíces fue 25 % con respecto al control (Figura 2A). El mismo patrón se advirtió en la evaluación del peso seco foliar (biomasa), en el que la cantidad de biomasa fue menor, debido a la disminución del crecimiento, y se consideró 30 % de diferencia de los tratamientos contra el control a los 15 días (Figura 2B). Estos efectos concuerdan con respuestas típicas de estrés celular (Proudfoot et al., 2002; Yang et al., 2012). En el presente estudio, los análisis de crecimiento y morfológicos sirvieron para valorar la respuesta del álamo a distintos niveles de PCB y seleccionar las condiciones experimentales óptimas para los tratamientos.
Comprobación de expresión heteróloga de PtCSP4
Los fragmentos obtenidos por PCR se analizaron mediante electroforesis, en los que se comprobó el tamaño del fragmento esperado en cada construcción del clonaje Gateway. Los resultados de la comprobación mediante electroforesis se muestran en la Figura 3. Juárez-Reyes, (2007) realizó un seguimiento secuencial de las construcciones de expresión por medio de geles.
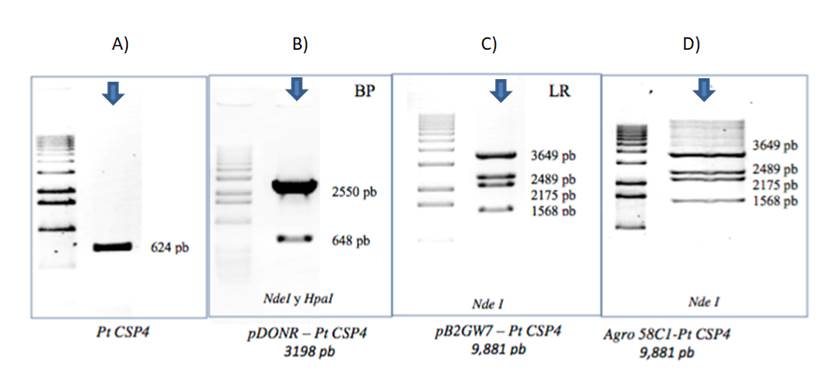
Figura 3 Comprobación del clonaje de PtCSP4 en geles de agarosa con enzimas de restricción. El producto de la clonación está marcado con flechas. Comprobaciones de cada clonaje, A) El fragmento PtCSP4 obtenido (624 pb). B) Reacción LR se clonó en el vector de expresión pDONR-PtCSP4 de 3198 pb con las enzimas de restricción NdeI y HpaI; C) el transgen se quedó bajo el control del promotor 35s en un vector binario PB2GW7-PtCSP4 que generó un fragmento de 9881 pb con ayuda de la enzima de restricción NdeI. D) construcción resultante, se transformaron células de la cepa C58C1 (pMP90) de Agrobacterium, que se utilizó para infiltrar plantas de Arabidopsis.
Nivel de expresión del transgen
Una vez que se tuvieron líneas transgénicas estables, se procedió a recolectar material de cada una de ellas para analizar la expresión del transgen. Se analizó un total de ocho líneas transgénicas independientes mediante qRT-PCR. La Figura 4 presenta datos promedio de tres réplicas técnicas. Se obtuvieron resultados análogos en dos réplicas biológicas. Las abundancias relativas del transcrito PtCSP4 demostraron ser bastante variables, como suele suceder en experimentos afines. Se utilizó la señal registrada por las plantas transformadas con el plásmido vacío, para relativizar la acumulación de transcrito en las líneas transgénicas.
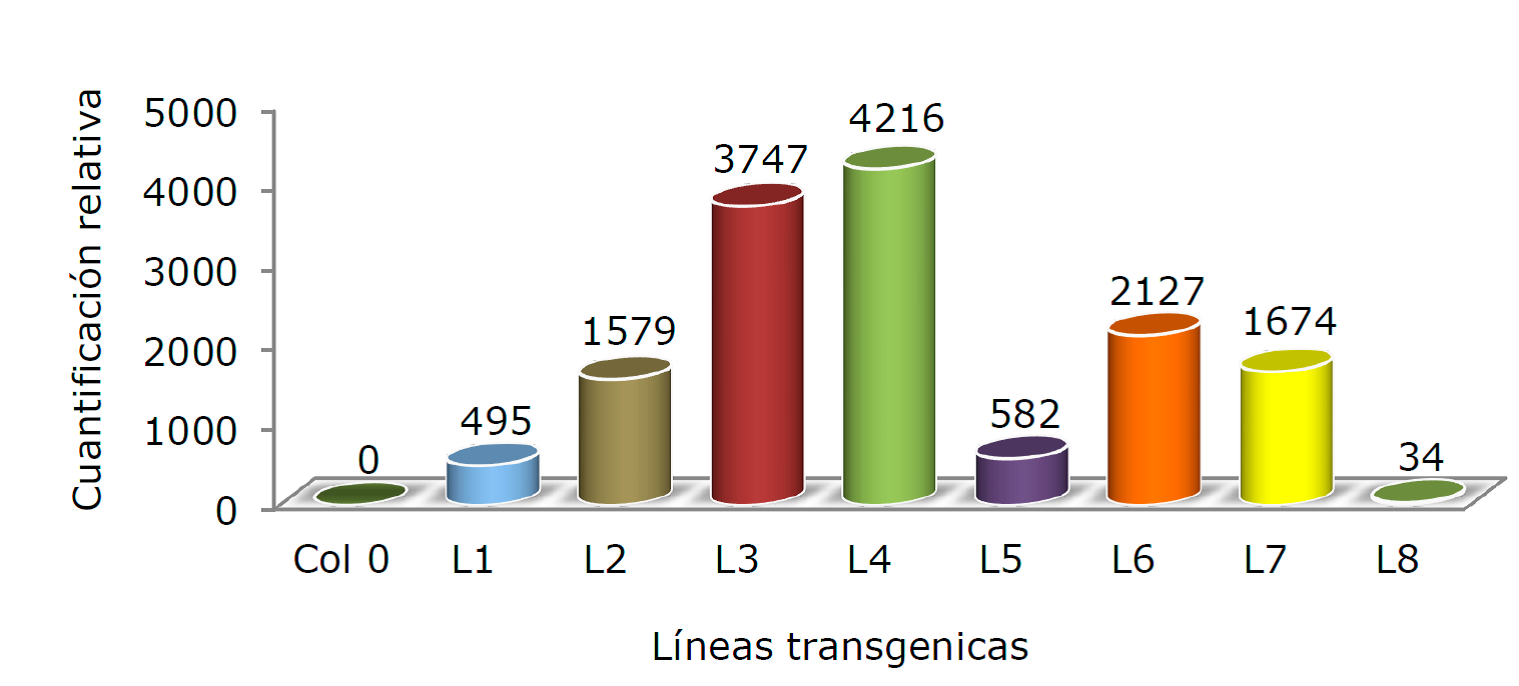
Figura 4 Expresión de PtCSP4 en plantas transgénicas de Arabidopsis. Niveles promedio de transcrito detectado en las plantas transgénicas mediante qRT-PCR. Se representa la media de tres réplicas técnicas independientes. Los valores numéricos se normalizaron a los niveles de un control interno (rARN 18S), y se les asignó un valor de 1 a las plantas Col0 (Control).
En la Figura 4 se observa que las líneas altas expresoras mostraron inducciones superiores a 3 500 veces (L3 y L4); las líneas con expresiones intermedias tuvieron valores entre 1 500 y 2 000 veces (L2, L6 y L7), y las bajas expresoras fueron inferiores a 500 veces (L1, L5 y L8). A partir de estos datos, se eligieron las líneas L1, L4 y L6 para las pruebas de tolerancia a contaminantes. Cabe resaltar que no se registró ninguna diferencia en el crecimiento y desarrollo de las plantas, como consecuencia de la sobreexpresión de PtCSP4.
Tolerancia de las líneas transgénicas a Aroclor 1221
Los ensayos de tolerancia a la presencia de PCB se llevaron a cabo con plantas germinadas y crecidas in vitro en condiciones controladas. Hasta el momento, no se había publicado ningún dato sobre la tolerancia de A. thaliana a Aroclor, por lo que antes de efectuar los ensayos, se decidió analizar la tolerancia natural de Arabidopsis a este compuesto.
Se evaluaron las mismas dosis utilizadas para álamo (50 a 200 mg L-1) y se comprobó que concentraciones de Aroclor a 200 mg L-1 provocaban mortalidad claramente apreciable. Sin embargo, en concentraciones inferiores a 100 mg L-1 no se registró una relación directa entre la presencia del compuesto y la sintomatología observada en las plántulas, razón por la cual se usaron 200 mg L-1 para los ensayos de tolerancia. Una vez optimizado el ensayo, las líneas transgénicas se sometieron al mismo tratamiento aplicado en plantas sin transformar. Para este ensayo, las placas se dividieron en cuatro cuadrantes, tres para líneas transgénicas y uno para el control. La inspección visual de los resultados indicó que las líneas que acumulan constitutivamente PtCSP4 tuvieron mayor tolerancia a la presencia de Aroclor a 200 mg L-1 en una concentración no letal, pero sí suficiente para crear un estrés sintomatológico en las plantas (Figura 5).
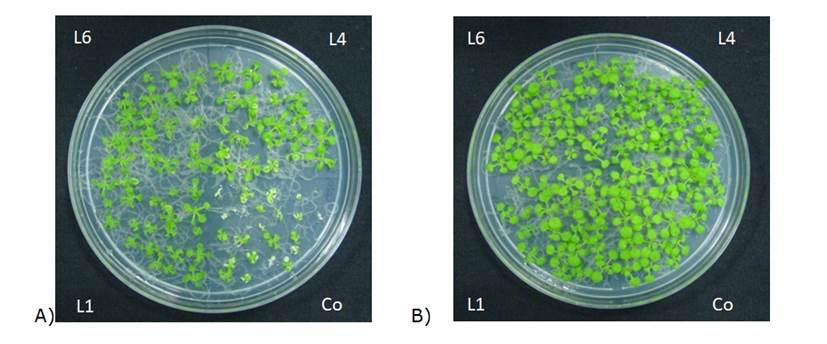
Figura 5 Líneas transgénicas con mayor tolerancia al contaminante. A) Tolerancia a 200 ppm de Aroclor 1221. B) Plantas control.
Al evaluar las plantas, diez días después de germinadas bajo el tratamiento con el contaminante, la supervivencia de las líneas transgénicas fue de 70 %, en contraste con 30 % de las plantas control. En las plantas transgénicas, el valor de peso fresco fue tres veces superior al de los controles, sin diferencias significativas entre líneas.
La eficacia de las plantas transgénicas para la fitorremediación de contaminantes orgánicos ha sido probada en diferentes especies (James y Strand, 2009). La sobreexpresión del gen de lacasa (LAC1) de algodón (Gossypium arboretum L.) en A. thaliana resulta en un aumento de la actividad secretora de lacasa, y en suelos mantiene una mejor resistencia a triclorofenol. Las plantas control presentaron clorosis severa, mientras que las plantas sobreexpresoras LAC1 mostraron menor daño y una mayor resistencia a una variedad de compuestos fenólicos. Los datos sugirieron que LAC1 fue secretada desde las plantas transgénicas para metabolizar el triclorofenol ex situ, lo que resultó en un ambiente menos tóxico (Wang et al., 2004).
En un estudio similar, la lacasa de Trametes versicolor (L.:Fr.) se expresó en tabaco, lo que dio como resultado la secreción de lacasa en la rizosfera y una mayor degradación de bisfenol A y pentaclorofenol (PCP) en cultivo hidropónico (Sonoki et al., 2005). Sin embargo, la degradación en suelos no se examinó. Wevar et al. (2005) desarrollaron tomates transgénicos (Lycopersicon esculentum Mill. cv. Pera) que sobre-expresan TPX1, una peroxidasa nativa, lo que genera una mayor actividad de la peroxidasa (Wevar et al., 2005). Un gen manganeso peroxidasa (Mano) se expresó en plantas de tabaco (Iimura et al., 2002). La actividad Mano en el medio que contenía esquejes transgénicos de raíz transgénicos fue 50 veces mayor, en comparación con los controles; lo que sugiere la secreción de la enzima MnP. Una incubación similar en presencia de PCP produjo una reducción de, aproximadamente, dos veces en la concentración PCP, si se comparan las líneas transgénicas con los controles.
El mismo grupo de investigación transformó a P. seiboldii × P. gradientata con MnP de Trametes versicolor. Varias líneas transgénicas tuvieron mayor actividad MnP que el control y contribuyeron a una eliminación más rápida de bisfenol A (Iimura et al., 2007). En trabajos posteriores, al aquí documentado, se realizarán pruebas de funcionalidad a las líneas transgénicas.
Expresión diferencial del gen PtCSP4
La expresión diferencial en plantas in vitro del clon P. tremula x alba a los 15 días a una concentración de 200 mg L-1 se comprobó mediante una validación por medio de qRT-PCR (Figura 6), la cual evidenció la respuesta de Aroclor 1221 en álamo. Chen et al., (2015) y Ariani et al., (2015), quienes realizaron la validación de resultados por qPCR en P. tomentosa y P. x canadensis, respectivamente, revelando la expresión empírica. Cabe señalar que este factor de transcripción nunca había sido asociado a estrés por xenobióticos.
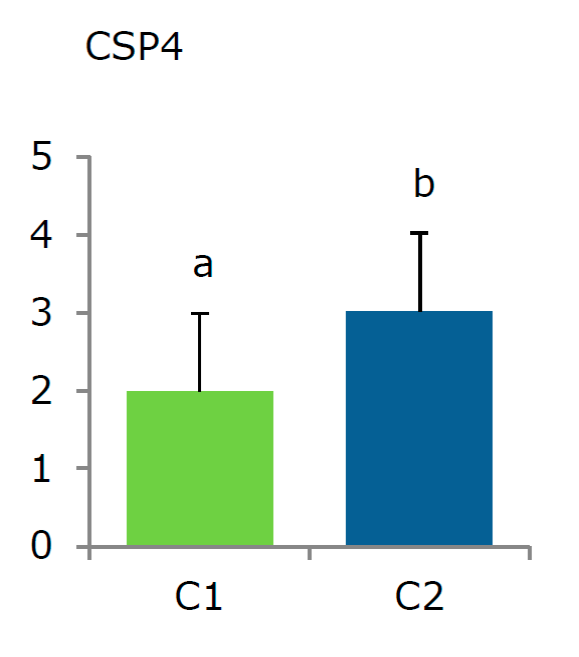
Figura 6 Análisis empírico de expresión diferencial mediante qRT-PCR del tiempo 15d, C1: 50 mg L-1 y C2:200 mg L-1. Los cambios en la expresión génica se estimaron respecto a un control (fold change). Se validó la expresión diferencial de cold shock (CSP4) Potri.004G172600.1 Las barras indican el error estándar del fold change promedio. Los valores se normalizaron según los niveles de MARN 18S y se asignó el nivel 1 al valor medido entre los controles.
Se intuye que la tolerancia en plantas in vitro del clon P. tremula x alba se debe a los niveles de expresión de PCSP4 y de una cascada de genes que participan en la defensa frente al estrés por PCB, o a estrés oxidativo. Sin embargo, es importante mencionar que, para tener una mayor precisión de la posible expresión génica, se requiere hacer un análisis transcriptómico y proteómico.
Conclusiones
No es sencillo conseguir plantas tolerantes a contaminantes. Varias proteínas CSP están relacionadas con estrés abiótico, y con procesos como el crecimiento, y la floración, pero nunca se han relacionado con el estrés por xenobióticos. Las plantas de Arabidopsis sobre-expresoras de PCSP4 de álamo presentan mayor tolerancia al estrés por PCB (Aroclor 1221). Lo anterior se comprueba por la menor severidad de los daños visibles en las plantas transgénicas, en comparación con las plantas control. Las líneas sobre-expresoras se comportan como si hubiesen sido sometidas a una aclimatación frente al estrés. Sin embargo, se requiere de una caracterización más profunda de sus funciones y comportamiento en campo, con fines de fitorremediación, tales como los análisis proteómicos y transcriptómicos.











 texto en
texto en