Introducción
Cedrela odorata L. (Meliaceae), especie conocida como cedro rojo, es una de las principales riquezas de los bosques mesoamericanos (Cortés, 2001). En la república mexicana se distribuye de forma natural en las vertientes del Golfo de México y del Pacífico (Pennington y Sarukhán, 2005); así como en Centro, Sudamérica y las islas del Caribe (Patiño, 1997). El interés en este taxon se debe a las cualidades de su madera: como la alta durabilidad, color, jaspeado y aroma (Mader et al., 2018); por lo que, se utiliza para la fabricación de muebles finos, instrumentos musicales, artesanías (Cintrón, 1990; Romo-Lozano et al., 2017), elaboración de cajas de tabaco (Rodríguez, 2011), además de tener usos medicinales y aportar servicios ambientales (Romo-Lozano et al., 2017). Por su relevancia económica se ha introducido en África, el sudeste asiático y al noreste de Australia (GBIF, 2018), ya que es la segunda especie arbórea tropical más comercializada del mundo, después de la caoba (Swietenia macrophylla King. [Meliaceae]) (Patiño, 1997), con un precio de exportación en Norteamérica de $958 a $977 USD por metro cúbico de madera aserrada (ITTO, 2019).
En consecuencia, el cedro rojo se ha sobreexplotado sin planes adecuados de manejo, lo que ha ocasionado el decremento y fragmentación de sus poblaciones naturales con la consiguiente restricción de flujo de genes entre las poblaciones (De la Torre, 2013), la pérdida de diversidad genética (Lesher-Gordillo et al., 2018) y de genotipos de alta productividad que son potencialmente resistentes a estrés biótico y abiótico (Cavers et al., 2003a). Además del daño antropogénico, presenta problemas de regeneración natural (Rodríguez, 2011); pérdida rápida de viabilidad de las semillas (García y Abdelnour, 2013); lento crecimiento, ya que tarda alrededor de 40 años en alcanzar la talla para su aprovechamiento maderable (Galván-Hernández et al., 2018); y el ataque de Hypsipyla grandella Zeller (barrenador de las meliáceas).
Este último constituye el principal factor que impide el establecimiento y productividad de plantaciones forestales comerciales de la especie (López-Ochoa et al., 2015; Santos et al., 2015). Al respecto, Marquetti (1990) señala la presencia de un híbrido natural, resultado del cruzamiento entre C. odorata y Cedrela cubensis Bisse, para el cual describe mayor heterosis, crecimiento y resistencia al barrenador respecto a sus progenitores. Sin embargo, C. cubensis se considera una sinonimia de C. odorata (The Plant List, 2013) y faltan pruebas que corroboren la existencia de esa afirmación.
Es importante resaltar que el comportamiento de las plantaciones está sujeto a la calidad del sitio de su establecimiento, pues los factores bióticos, abióticos y su interacción con el manejo, afectan su capacidad productiva; por lo tanto, a partir del lugar de plantación, los árboles alcanzarán rendimientos en volumen mayores en poco tiempo; mientras que en otros, será menor (Murillo-Brito et al., 2017).
Debido a lo anterior, C. odorata se incluye en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN) como especie vulnerable (IUCN, 2017), y en la lista de especies protegidas por la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre (CITES) (CITES, 2017). En México, está catalogada como Sujeta a Protección Especial en la Norma Oficial Mexicana 059-SEMARNAT 2010 (Semarnat, 2010); sin embargo, se ha planteado que no cumple con los estándares establecidos que justifiquen su permanencia en dicha disposición (Ruiz-Jiménez et al., 2018). Dada la actual situación problemática que enfrenta C. odorata, el objetivo de este trabajo es presentar los principales avances relacionados con la genética del cedro rojo para identificar oportunidades de desarrollo orientadas a su mejoramiento y conservación.
El genoma de Cedrela odorata
El cedro rojo pertenece a las meliáceas, grupo con un alto y variable número de cromosomas; por ejemplo, el 2n de especies de los géneros Soymida, Toona y Cipadessa es igual a 56, lo que sugiere un origen común y paleopoliploide (Styles y Vosa, 1971; Khosla y Styles, 1975). En comparación con otros taxa forestales como los géneros Picea y Pinus (2n=24) (Fuchs et al., 1995; Nkongolo, 1996; Pavy et al., 2008), algunos miembros de la familia Meliaceae poseen un número diploide más de dos veces mayor.
Styles y Vosa (1971) identificaron dos citotipos para C. odorata: 2n = 50 y 56, y sugieren que las poblaciones con menor número cromosómico se ubican en América Central y las Islas del Caribe, mientras que los de mayor número están en México y Sudamérica. No obstante, Khosla y Styles (1975) descartaron la relación de los citotipos con su origen geográfico y estimaron una longitud cromosómica de 2.0 a 5.0 µm y 60 µm para el tamaño total de la cromatina, lo que constituyó la primera referencia sobre la dimensión del genoma.
Se desconoce la secuencia del genoma nuclear del cedro rojo. La única meliácea caracterizada es Azadirachta indica A. Juss. (nim), cuyo tamaño es de 364 Mpb con poco más de 20 000 genes (Krishnan et al., 2012). Con esta referencia e información de taxones con filogenia cercana como Rutaceae (Citrus sinensis (L.) Osbeck, GenBank NC_023046-54), Malvaceae (Theobroma cacao L.; GenBank GCF_000208745), Brassicaceae (Arabidopsis thaliana (L.) Heynh.; GenBank NC_003070-76) o Vitaceae (Vitis vinifera L.; GenBank NC_012007-25) se esperaría que el tamaño del genoma de C. odorata sea de alrededor de 500 Mpb (Jaillon et al., 2007; Argout et al., 2011; Xu et al., 2013). Sin embargo, hay que considerar que A. indica tiene un número cromosómico 2n = 28; es decir, la mitad que el de cedro rojo y si se supone que su genoma es producto de una poliploidía (Khosla y Styles, 1975), entonces podría tener una dimensión dos veces mayor que la del nim.
Por otra parte, al describir el plastoma (genoma del cloroplasto) de C. odorata por medio de la plataforma de secuenciación Illumina, se determinó que su tamaño es de 158 558 pb (GenBank MG724915), en el que las regiones de copia sencilla larga (Long Single Copy, LSC) y corta (Short Single Copy, SSC) miden 86 390 pb y 18 380 pb, respectivamente; mientras que la región invertida (Inverted Region, IR) mide 26 894 pb. La lista de genes anotados, aquellos con funciones putativas identificadas, muestra un total de 112 genes diferentes de los cuales 78 codifican para proteínas, 30 para ARNt (ARN de transferencia) y 4 para ARNr (ARN ribosomal) (Mader et al., 2018). Del cloroplasto también se ha caracterizado la región intergénica rrn16-rrn23 con la que se construyó el vector pCBL5 que permite su transformación directa por recombinación homóloga. Este tipo de transformación reduce el riesgo de contaminación por polen de transgenes a individuos silvestres, debido a que los plastidios son heredados por vía materna. Lo anterior tiene el potencial de generar variedades transgénicas resistentes a plagas, como el barrenador de las meliáceas (López-Ochoa et al., 2015).
Con respecto al transcriptoma, mediante secuenciación de ARN de tejido foliar se identificaron 52 181 modelos de genes cuya longitud varía entre 200 pb y 37 635 pb (Finch et al., 2019), lo que aporta otra evidencia relacionada a que cedro rojo tiene más del doble de los 20 000 genes identificados en el genoma de A. indica (Krishnan et al., 2012). De esos genes putativos, entre 65 % y 70% presentan homología con aquellos caracterizados en genomas secuenciados de árboles como Populus trichocarpa Torr. & A. Gray ex Hook. y Quercus lobata Née. Esto representa el primer estudio de la especie por medio de tecnología de secuenciación de última generación (Finch et al., 2019).
Aportaciones de la biología molecular al estudio filogenético de cedro rojo
Las especies del género Cedrela son consideradas crípticas; es decir, la delimitación entre ellas es ambigua con base en rasgos morfológicos, de modo que la divergencia evolutiva del genoma no se manifiesta en el fenotipo (Cavers et al., 2013). Por lo tanto, los marcadores moleculares son una alternativa para resolver ese tipo de problemas, ya que permiten caracterizar la estructura poblacional, la diversidad genética, relaciones filogenéticas, rutas migratorias y los procesos de hibridación, entre otros (Alía et al., 2003).
Algunas de las principales aportaciones y avances obtenidos con la aplicación de herramientas moleculares en estudios evolutivos de Cedrela se abordan a continuación.
El análisis de variación de las regiones intergénicas (ITS) 18S-26S y trnS-trnG y algunos genes del cloroplasto (ejem.: psbB, psbT, psbN) ha concluido que la divergencia de los géneros Cedrela y Toona ocurrió hace 46.6 a 50.6 millones de años. Asimismo, durante el Mioceno, Centroamérica fue el punto de origen de la diversificación de Cedrela, lo que resultó en la aparición de dos linajes que migraron a Norte y Sudamérica (Muellner et al., 2010; Cavers et al., 2013; Koecke et al., 2013). También, se han reclasificado diversas especies del género: de ocho taxones a 17 y otras seis que aún no se aceptan (Cavers et al., 2013; Koecke et al., 2013; The Plant List, 2013).
En otro estudio, por medio de marcadores moleculares de cloroplasto se identificaron cinco haplotipos en Centroamérica, la zona de contacto entre los dos grandes linajes del norte y sur de América (Cavers et al., 2003b). Posteriormente, en el análisis se incluyeron poblaciones del Caribe y Sudamérica, en el cual mediante ITS y microsatélites nucleares y de cloroplasto se caracterizaron 22 haplotipos, lo que justificó la propuesta de reclasificación de algunos ecotipos, así como de nuevas especies de Cedrela (Cavers et al., 2013). Con dichos antecedentes, se confirma la ocurrencia de al menos tres divergencias evolutivas que concuerdan con la colonización de Mesoamérica por la flora sudamericana. Las primeras dos sucedieron antes y después de la formación del Istmo de Panamá, y la tercera, a finales del Pleistoceno.
Diversidad genética
La diversidad genética de C. odorata se ha evaluado en poblaciones de Centro y Sudamérica con el uso de marcadores moleculares de tipo RAPD, AFLP, microsatélites y secuencias de cloroplastos, con lo que se evidenció una mayor diversidad interpoblacional que dentro de las poblaciones, la cual se relaciona con la precipitación media anual y diferencia entre poblaciones de regiones secas (norte de la Península de Yucatán) de aquellas de zonas húmedas (Costa Rica) (Gillies et al., 1997; Cavers et al., 2003a, 2003b; Navarro et al., 2005; De la Torre et al., 2008).
La diversidad genética es fundamental para la evolución y conservación a largo plazo, así como para los programas de mejoramiento y manejo de los recursos genéticos (Jump et al., 2008). En particular, con los efectos del cambio climático resulta indispensable preservar el flujo génico y las variaciones en el material hereditario, ya que estas aumentan el potencial de adaptación a condiciones de estrés abiótico y biótico (Jiménez y Collada, 2000; Jump et al., 2008).
Impacto de la procedencia y genotipo en la susceptibilidad a Hypsipyla grandella
Como se ha mencionado, la principal limitante biótica de la productividad en las plantaciones comerciales de cedro rojo es el ataque del barrenador de las meliáceas. El lepidóptero ataca el brote principal de la planta, lo cual retrasa el crecimiento, produce bifurcaciones y proliferación de ramas bajas y codominantes, lo que merma considerablemente el valor comercial de la madera (Cornelius y Watt, 2003). De manera indirecta, ello provoca la tala ilegal de individuos fenotípicamente sobresalientes en poblaciones naturales y disminuye su disponibilidad para el aprovechamiento maderable sostenible (da Silva et al., 1999).
La variación en la susceptibilidad de C. odorata al ataque de H. grandella se relaciona con el origen geográfico de los genotipos; por ejemplo, se estima un intervalo entre 0.8 y 2.4 ataques por árbol y se sugiere que existen familias de crecimiento rápido y tolerantes al barrenador (Newton et al., 1999; Cornelius y Watt, 2003; Navarro et al., 2005). Asimismo, en un estudio que se realizó con clones producidos por injerto en Tezonapa Veracruz, México, la selección de genotipos de alta producción de volumen de madera representó una ganancia genética de 82 % por volumen, una disminución de 10.9 % en la incidencia de ataques y 6.3 % de mejoría en cuanto a la recuperación después del daño causado por el barrenador (Sampayo-Maldonado et al., 2019). La investigación evidencia parte de la variación genotípica de la especie, y demuestra que es posible el mejoramiento genético de estas características de resistencia al patógeno y elevar el potencial de producción en plantaciones económicamente viables. Sin embargo, aún falta identificar más rasgos genotípicos ligados a los caracteres fenotípicos de interés.
Mejoramiento genético convencional y asistido por biología molecular
El mejoramiento genético tiene como objetivo desarrollar variedades de alto valor económico, ecológico o social e implica procesos reiterados de actividades como selección, cruzamientos dirigidos y evaluaciones genéticas (White et al., 2007). Una de las principales estrategias del mejoramiento genético clásico consiste en la selección fenotípica de los mejores individuos maduros, seguida del establecimiento de ensayos de procedencias y progenies para estimar los componentes genéticos y ambientales (Zobel y Talbert, 1988). Sin embargo, los métodos tradicionales son limitantes por los largos ciclos reproductivos de la mayoría de las especies forestales, lo que representa varios años e incluso décadas para la obtención de resultados, en función de su biología (Figura 1) (Grattapaglia, 2017).
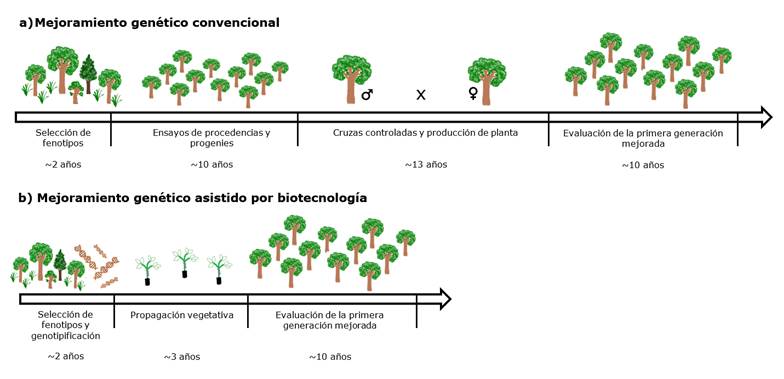
a) Mejoramiento genético convencional. El tiempo estimado para un ciclo completo es de 35 años, debido a que en C.odorata la madurez sexual ocurre cerca de los 12-15 años a los que se adicionan de tres a siete más para realizar la evaluación temprana de los rasgos fenotípicos de interés. b) Mejoramiento genético asistido por biotecnología. Con el uso de herramientas como el cultivo de tejidos y marcadores moleculares, se estima una reducción aproximada de 50 % de tiempo con respecto al mejoramiento genético convencional, ya que los rasgos genotípicos asociados al fenotipo de interés pueden evaluarse en plántulas (Elaboración propia).
Figura 1 Representación esquemática de las etapas de un programa de mejoramiento genético de Cedrela odorata L.
Además, en especies forestales este tipo de mejoramiento genético se basa, principalmente, en características de rasgos económicos para obtener mejor rendimiento en madera. La mayor parte de los estudios y, especialmente en especies tropicales no se basan en ideotipos específicos, que sean como una referencia al mejoramiento genético de estas, las cuales son importantes para la calidad y heterogeneidad de los materiales establecidos y que, de manera adicional, puedan considerarse como unidades productoras de germoplasma forestal (Dickmann y Gold, 1994; Solís-Guillen et al., 2017). Esta selección se dificulta aún más, cuando los caracteres de interés son complejos; por ejemplo, las propiedades de la madera, resistencia a plagas y enfermedades, así como la tolerancia al estrés abiótico (Nehra et al., 2005).
La biotecnología, en particular la biología molecular, ofrece oportunidades para genotipificar individuos superiores, realizar la selección asistida por marcadores (Marker Assisted Selection, MAS, por sus siglas en inglés), además de estudiar la organización del genoma y el funcionamiento de genes asociados a caracteres de importancia económica, entre otras. Una de las principales ventajas de las nuevas tecnologías consiste en reducir la duración de los ciclos de mejoramiento; por ejemplo, la MAS permitiría la selección temprana de caracteres que se expresan en la madurez (Grattapaglia, 2017); o bien, las predicciones con base en la genómica cuantitativa ahorrarían tiempo durante la etapa de evaluación (Figura 1) (Park et al., 2016), tal como se estima para la conífera Picea abies (L.) Karst, cuyo ciclo de mejoramiento convencional requiere más de 28 años y que es factible reducirlo a menos de 10 por medio de estas herramientas (Lenz et al., 2019).
En Latinoamérica, se han realizado diversos estudios orientados al mejoramiento genético tradicional de C. odorata. Así, en Costa Rica se evaluó el desempeño temprano y resistencia a H. grandella de 115 familias de 21 procedencias de México, Guatemala, Honduras, Costa Rica y Panamá en condiciones de asociación con cultivo de café (Navarro et al., 2004). Las variables de interés fueron altura, diámetro, resistencia y número de rebrotes: todas fueron altamente significativas a nivel de procedencia. Los coeficientes de heredabilidad obtenidos en sentido estricto (h 2 ) para las familias dentro de las procedencias fueron de 0.12 y 0.20 para diámetro y altura, respectivamente. Además, los árboles de cedro rojo asociados al cultivo de café presentaron mejor crecimiento en diámetro y altura, así como más resistencia al barrenador de las meliáceas y mayor producción de brotes (Navarro et al., 2004).
En México, el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) es una de las pocas instituciones dedicadas a la domesticación del cedro rojo. Los avances incluyen el establecimiento de dos ensayos de progenies en los que evaluaron un total de 210 familias de 26 procedencias del Golfo de México y sureste del país (Sánchez et al., 2003; Hernández-Máximo et al., 2016). En ambos experimentos, se estimó la heredabilidad individual de las principales variables cuantitativas de importancia económica: altura, diámetro a la altura del pecho (DAP) y volumen (Cuadro 1); asimismo, la correlación genética estimada para los caracteres estudiados fue alta (>0.90). Por lo tanto, se concluyó que las variables de crecimiento tienen un control genético de moderado a alto.
Cuadro 1 Heredabilidad estimada para las principales variables dasométricas en Cedrela odorata L. en ensayos de progenie establecidos en el campo experimental “El Palmar”, Tezonapa, Veracruz, México.
| Variable evaluada | Heredabilidad (h2i) en árboles de diferentes edades (años) al momento de la evaluación | Referencias | |||
|---|---|---|---|---|---|
| 3 | 5 | 7 | 11 | ||
| Altura (m) | 0.65 | Sánchez et al., 2003 | |||
| DAP (cm) | 0.38 | ||||
| Volumen (dm3) | 0.54 | ||||
| Índice de conicidad | 0.38 | ||||
| Altura (m) | 0.16 | 0.22 | 0.25 | 0.22 | Hernández-Máximo et al., 2016 |
| DAP (cm) | 0.16 | 0.21 | 0.27 | 0.27 | |
| Volumen (dm3) | 0.12 | 0.18 | 0.27 | 0.29 | |
h 2 i = Heredabilidad individual; DAP = Diámetro a la altura del pecho.
El proceso desde la selección de fenotipos para el establecimiento de los ensayos de progenie hasta la obtención de dichos parámetros genéticos requirió más de 20 años, a partir de los cuales se seleccionaron los 40 mejores individuos y se establecieron en un ensayo clonal en el que se calculó una ganancia genética de 82 % para el volumen, con base en una intensidad de selección de 10 % (Sampayo-Maldonado et al., 2019).
Conclusiones
A diferencia de otras especies forestales como aquellas de los géneros Populus, Pinus o Eucalyptus, los estudios genéticos sobre cedro rojo son incipientes. En ellos, algunas herramientas biotecnológicas han permitido determinar parte de sus características genéticas. Las investigaciones se han enfocado, principalmente, a poblaciones de la región comprendida entre Veracruz, México y el norte de Sudamérica, mismas que han evidenciado la estructura poblacional y su relación con las condiciones climáticas prevalecientes en su área de distribución, lo que sugiere que su acervo genético aún posee un importante potencial de adaptación.
No obstante, la fragmentación de sus poblaciones impide el flujo génico y la tala clandestina pone en riesgo este recurso, que a pesar de su valor en la región Neotropical, en México no se ha logrado que coadyuve al desarrollo económico de las comunidades rurales aledañas a su área de aprovechamiento. Por ello, es imprescindible llevar a cabo estudios intensivos y extensivos que conlleven a la caracterización del patrimonio genético de C.odorata a lo largo de su área de distribución en el país; así como investigaciones enfocadas a la fisiología de su respuesta al estrés biótico y abiótico y a la generación de tecnologías para su mejoramiento genético y aprovechamiento sostenible.
Con el apogeo de la era posgenómica y su relación con la bioquímica, biotecnología, biología molecular, bioinformática, bioestadística, entre otras, se ha revolucionado la forma de estudiar la interacción genotipo-ambiente y se dispone de nuevas alternativas para el mejoramiento y conservación de las especies forestales, lo que no implica el reemplazo de las técnicas convencionales, sino su complementación para hacer más eficientes dichos procesos y proteger la diversidad genética.











 texto em
texto em 


